酵素反応速度論⓪定常状態近似
はじめに
生化学の講義でみんな (?) 苦しむ Michaelis-Menten 式.あれの導出に「定常状態近似」ってありましたよね.酵素反応だとほぼ自明に思えるけど,酵素反応以外の化学反応でも使用することがあり,条件によっては近似していいのか必ずしも明らかではなかったり.今回は簡単な反応式について定常状態近似を導入できる前提を示したのち,定常状態近似を用いた場合と用いなかった場合の速度式を示し,Excel でそれぞれの反応を描いてみます.
単純な反応における定常状態近似の有無
定常状態近似の意義と成り立つ条件
基質 $${S}$$ が生成物 $${P}$$ に変換される反応
$${S \rightarrow P}$$
が活性中間体 $${S^*}$$ を経る下記の素反応群からなるとする.
$${S \xrightleftharpoons[k_{-1}]{k_1} S^* \xrightarrow{k_2} P}$$
理論的には,活性中間体を含むすべての化合物の濃度をオンタイムで把握できれば,素反応の速度定数を含むすべての反応速度に関わるパラメータを精密に算出できるが,活性中間体濃度のオンタイムモニターなどは明らかに現実的でない.そこで,定常状態近似により $${S^*}$$ の濃度を消去した速度式の導出を行うことがある.この時に用いる近似が定常状態近似 (SSA: Steady State Approximation) である.
$${S^*}$$ について次の二つの条件が満たされるとき,定常状態を仮定してよい.
活性中間体の蓄積が起こらない ($${r_{S^*}=0}$$)
活性中間体の濃度が基質や生成物に比べて十分に小さい ($${[S^*] \ll [S], [P]}$$)
定常状態近似による速度式の導出
$${S \xrightleftharpoons[k_{-1}]{k_1} S^* \xrightarrow{k_2} P}$$
について各素反応の速度式は次のようになる.
$${r_1=k_1[S]}$$
$${r_{-1}=k_{-1}[S^*]}$$
$${r_2=k_2[S^*]}$$
また,各化合物についての反応速度式は次のようになる.
$${r_S=-r_1+r_{-1}}$$
$${r_{S^*}=r_1-r_{-1}-r_2}$$
$${r_P=r_2}$$
定常状態近似より
$${r_{S^*}=0}$$
$${\therefore r_1=r_{-1}+r_2}$$
これに各素反応の速度式を代入して
$${k_1[S]=k_{-1}[S^*]+k_{2}[S^*]}$$
$${\therefore [S^*]= \cfrac{k_1[S]}{k_{-1}+k_2}}$$
よって求める反応速度は
$${r=r_P=r_2}$$
$${=k_2[S^*]}$$
$${=\cfrac{k_1k_2[S]}{k_{-1}+k_2}}$$
定常状態を仮定したときの化合物濃度の推移 in Excel
$${[S^*]}$$ は無視できるものとし,反応時間を $${\tau}$$ ごとに区切ったとき,時刻 $${t}$$ における化合物 $${S, T}$$ の濃度は
前節より
$${[S]_{t+ \tau}=[S]_t-r_t \times \tau}$$
$${[P]_{t+ \tau}=[P]_t+r_t \times \tau}$$
$${r_t=\cfrac{k_1k_2[S]_t}{k_{-1}+k_2}}$$
したがって今仮に
$${k_1=1, k_{-1}=10, k_2=10, [S]_0=40, [P]_0=0}$$
としたとき,$${[S]_t, [P]_t}$$ は下図のようになる.
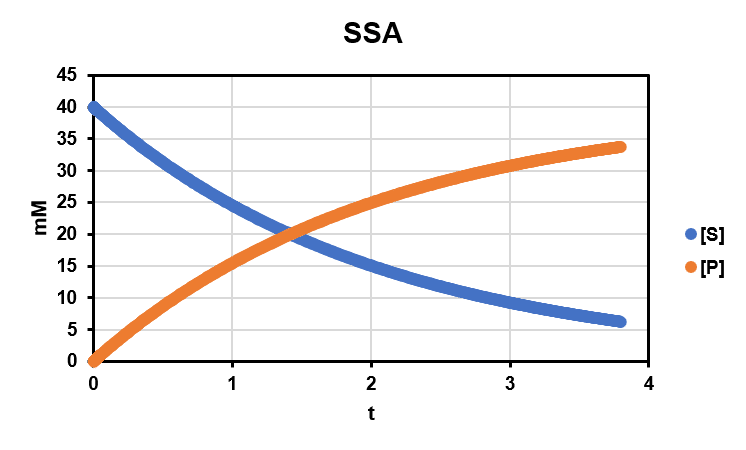
これが妥当かどうか確認するには定常状態を仮定しない場合と比較して確認すればよい.Excel を用いれば割と簡単に比較できる.
定常状態を仮定しないときの化合物濃度の推移 in Excel
反応時間を $${\tau}$$ ごとに区切ったとき,時刻 $${t+ \tau}$$ における化合物 $${X}$$ の濃度 $${[X]_{t+ \tau}}$$ を
$${[X]_{t+ \tau}=[X]_t+r_{X, t} \times \tau}$$
として $${[S], [S^*], [P]}$$ を計算する.
前々節より
$${r_S=-r_1+r_{-1}}$$
$${r_{S^*}=r_1-r_{-1}-r_2}$$
$${r_P=r_2}$$
かつ
$${r_1=k_1[S]}$$
$${r_{-1}=k_{-1}[S^*]}$$
$${r_2=k_2[S^*]}$$
であるから,
前節と同様に $${k_1=1, k_{-1}=10, k_2=10, [S]_0=40, [P]_0=0}$$
としたとき,$${[S]_t, [S^*]_t, [P]_t}$$ は下図右のようになる.
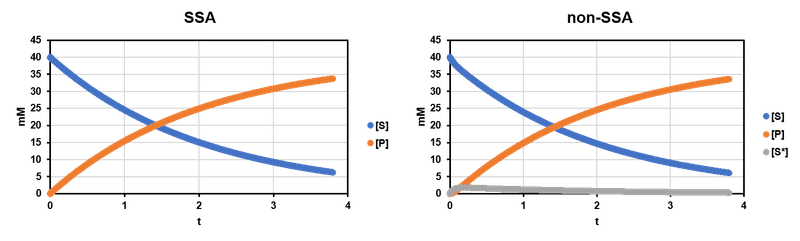
Fig. 2 を見比べるとわかる通り,$${[S], [P]}$$ についてはほとんど同様であり,$${[S^*]\approx0}$$ であることも見て取れる.
こうなったのは $${S^*}$$ の蓄積がほとんどないように素反応定数の値を設定したからである.
$${r_{S^*}=k_1[S]-k_{-1}[S^*]-k_2[S^*]}$$ だから
$${k_1}$$ を小さく,$${k_{-1}, k_2}$$ を大きくすれば $${r_{S^*}}$$ をかなり小さくできる.
今回はそれを踏まえて $${k_1=1, k_{-1}=10, k_2=10}$$ とした.
実際に $${k_1}$$ を大きく,$${k_{-1}, k_2}$$ を小さくすると定常状態近似は成り立たなくなる.例えば $${k_1=10, k_{-1}=1, k_2=1, [S]_0=40, [P]_0=0}$$
とすると,定常状態を仮定する場合 (SSA) としない場合 (non-SSA) の各化合物の濃度推移は下図のようになる.

Fig. 3 の左右を見比べればわかる通り,$${S^*}$$ が無視できない量存在し,結果として $${[S], [P]}$$ とも明らかに推移が異なっている.
おわりに
試験管で実施する酵素反応では,系に加える基質は酵素と比して大過剰なのがふつうである.したがって定常状態近似はほぼ自明に思える.しかし,それ以外の反応や生体内での連続した化学反応ネットワークを考える場合,定常状態近似を用いてよいか検証を要することがある.今回はかなり簡単な例で定常状態近似の妥当性を見てみた.意外とちゃんと差が見えておもしろかった.
この記事が気に入ったらサポートをしてみませんか?
