
バイオインフォマティクスの資格を取るためにメモしまくる件について 構造化学編(タンパク質の立体構造 タンパク質立体構造の形成と分子グラフィックス表現)
立体構造と化学結合
立体構造と化学結合
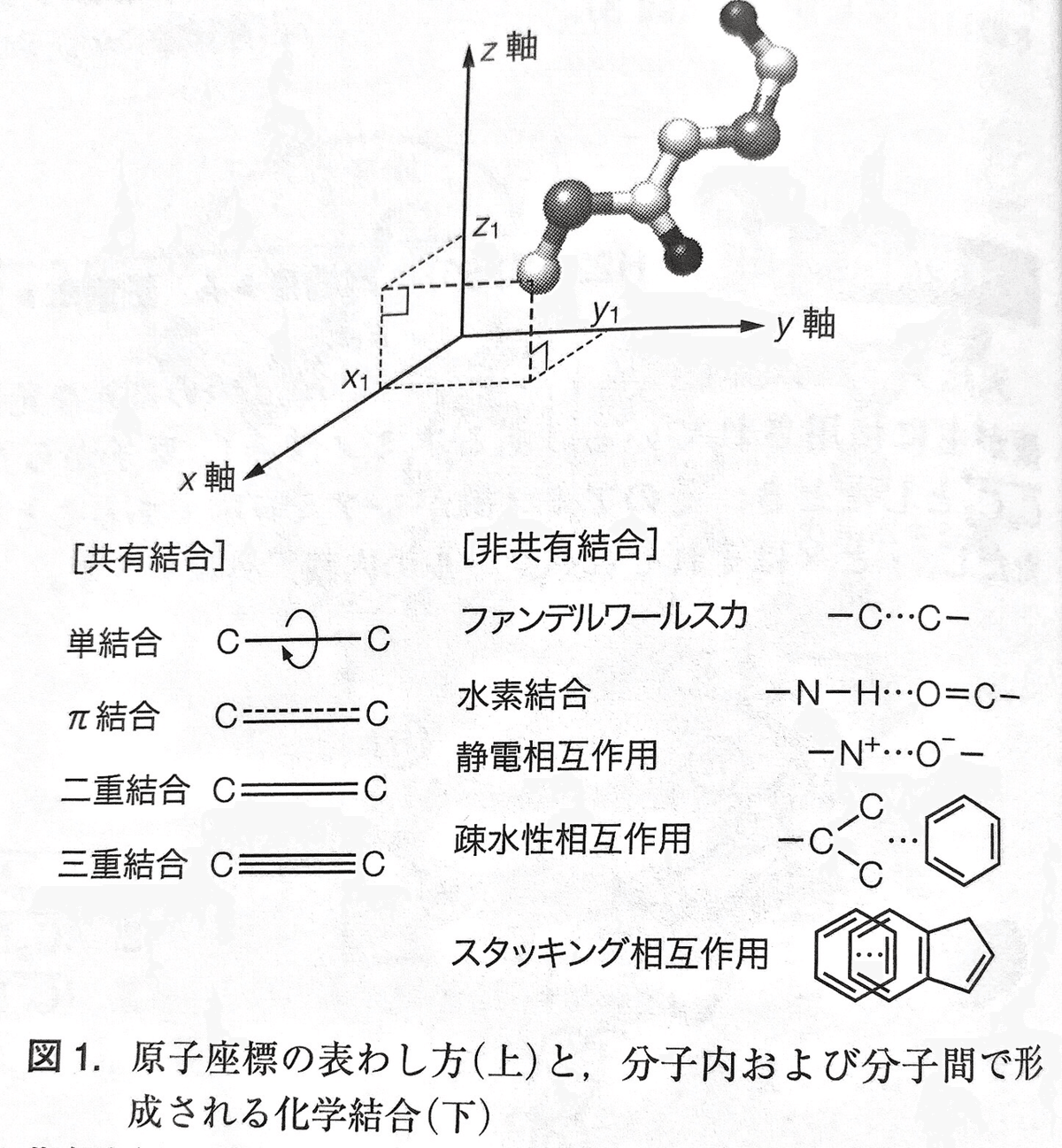
分子の立体構造は、分子を構成するそれぞれの原子の三次元座標(x, y, z)で表現。
長さの単位は Å (オングストローム;SI基本単位では1Å =0.1 nm = 10°m である)
炭素間の単結合の長さは 1.54 Å。
アミノ酸内部およびアミノ酸間(ペプチド結合)では、原子は非常に強い共有結合で結ばれている。
共有結合のうち単結合は自由に回転できるが、二重結合、π結合、三重結合などは自由に回転できない。
単結合の回転により生じる分子の構造の変化を立体配座(コンフォメーション)とよび、タンパク質はコンフォメーション変化により一定の構造にフォールドする(折りたたまれる)。
その際、
ファンデルワールス力(電荷をもたない原子間に働く微弱な引力)
水素結合(N-H...O=Cなどの、極性をもった原子に結合した水素を介した結合)
静電相互作用(正/負の電荷をもった原子間の引力または斥力)
疎水性相互作用(Val, Leu, Ile, Phe, Met などの炭化水素側鎖のように水に溶けにくい原子間に働く見かけの引力)などの非共有結合が分子内で形成される。
核酸では平面状の形をした塩基が重なりあうときに生じるスタッキング相互作用が構造の形成に重要。
立体構造を観察するために、分子グラフィックスソフトウェアを用いる。PyMOLやChimera 。
棒球(ボール&スティック)モデルは、タンパク質の詳細な構造を表現することができ、空間充填モデルは、タンパク質表面の凹凸の観察に適している。
リボンモデルは、ヘリックスとβストランドを模式的ならせん構造と矢印構造で表現する
ことで、主鎖のつながり方やタンパク質の全体構造(フォールド)を視覚的に理解しやすい。
フォールドとは、アミノ酸側鎖の部分は無視してN末端からC末端まで向かう主鎖の流れで表わしたタンパク質立体構造の概形であり、タンパク質を構成する二次構造とそれらの連結のパターンを指す。
タンパク質立体構造は、それらのアミノ酸配列よりも進化的な保存性が高いことが知られていて、アミノ酸配列の類似性が20%以下とかなり低い場合でも、フォールドはよく保存されている。


この記事が気に入ったらサポートをしてみませんか?
