週末有機化学演習 第3回
大学学部~院生向けの有機化学に関する問題を更新していきます。
休日の時間つぶしにどうぞ。
演習問題の解答は次回の演習の後半に載せています。
例) 第一回演習問題の解答→第二回演習の後半
今回のジャンルは『有機化学 基礎』です。
問A
問1
カルボカチオン、特にアルキルカチオンはWagner-Meerwein転位やヒドリド移動、アリール移動等の転位によってより安定なカルボカチオンへと変化します。さて、ではFig.1 のA,Bに示すようなカルボカチオンの転位は合理的といえるでしょうか?A,Bそれぞれについて起きる転位か起きない転位かを述べ、そう判断した理由も説明してください。

問2
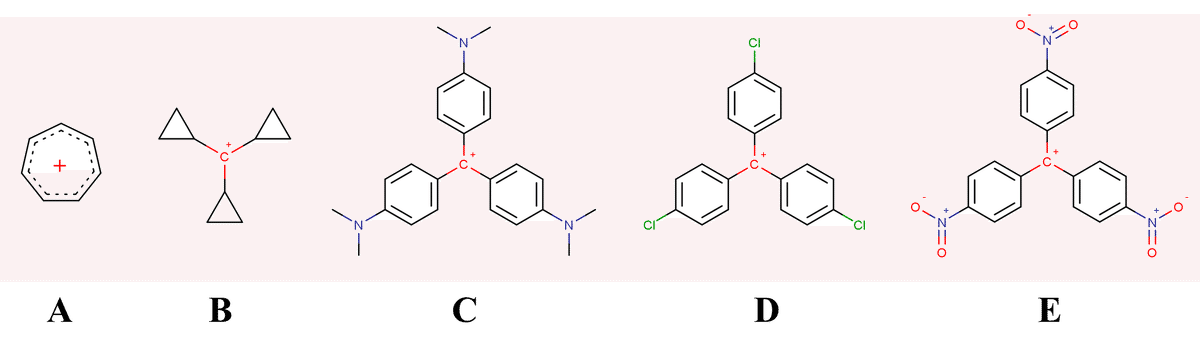
Fig.2 に示すA~Dのカルボカチオンについて、pKR+ (R+は下付き文字)の値が高い順に並べてください。
[ヒント]
pKR+値とは、あるカルボカチオンR+と水が反応しアルコールROHを与える平衡反応において、平衡時にR+の半分が水と反応し系内のR+とROH濃度が丁度等しくなるような媒質のpHに相当する値です。すなわち、pKR+値が大きいほどそのカルボカチオンの安定性も大きいといえ、この問題はA~Dのカルボカチオンを安定性が高い順に並べよと言い換えることができます。
問3
Fig.3 に示すアズレニウムカチオンBはフェニルカチオンAよりも安定であることが知られています。しかしながら、アズレニウムカチオンBとCを比較すると、Cの安定性は同じアズレニウムカチオンであるBと比べて低いことが知られています。アズレニウムカチオンBとCの安定性の違いは何に起因すると考えられるでしょうか。考察し説明してください。

問4
分子内に二つのカルボカチオンを持つカルボジカチオンは互いの静電反発により一般的にとても不安定です。しかしながらFig.4に示すカルボジカチオンはカチオンが隣接しているにもかかわらずとても安定であることが知られています。このカルボジカチオンが高い安定性を示す理由について、①フルオレニル部位の芳香族性 ②超共役 という二つの観点から考察し、説明してください。

問5
Fig.5に示すようなメチルカチオンよりもアルキル置換カルボカチオンの方が生成しやすく、また一級カルボカチオン、二級カルボカチオンと比較して三級カルボカチオンは一般的にとても生成しやすいです。三級カルボカチオンが生成しやすい理由について①電子的な要因 ②立体的な要因 の二つの観点から考察し説明してください。

問6
アルケンに対するハロゲンの付加、特に臭素分子の付加反応はアンチ選択的であることが知られています。

問6-1
アルケンに対する臭素付加がアンチ選択的に進行する理由を説明してください。
問6-2
Fig.7 に示すような化合物に対する臭素付加ではアンチ選択性が低下し4割近くシン体が生成します。このアンチ選択性の低下の原因について考察し説明してください。

問B
問1
SN1反応が部分ラセミ化で進行する理由を説明してください。
問2
多くの有機化学の教科書において、SN1反応は炭素-脱離基結合のヘテロリシスによりカルボカチオンが生成し、そこへ求核剤が攻撃することで反応が完遂する、だから反応速度が基質濃度のみに依存する一次式なのだと説明しています。しかしながら、冷静に考えればいくらSN1反応が進行するためにはカルボカチオン中間体が安定化される条件が必要とは言え、ヘテロリシス前の中性状態とヘテロリシス後の電荷分離状態を比べたら後者の方が高いエネルギーを持っていると考えるのが自然であり、この反応(ヘテロリシス) の進行には相当な活性化エネルギーが必要と考えられます。ではSN1反応におけるこの活性化エネルギーを基質はどこから得ているのでしょうか。考察し説明してください。
問3
Fig.8に示すA,B,Cの化合物の酢酸溶媒中における加溶媒分解を考えます。この加溶媒分解における反応速度の順序はどうなるでようか。A,B,Cを反応速度が速いと考えられる順に並べ、その順序になる理由を述べてください。

問題は以上です。お疲れ様でした。
第二回演習の解答例
問A
問1

Fig.9 に示すニトロ化試薬による芳香族ニトロ化の活性種はNO2+で表されるニトロニウムイオンになります。つまり二トロニウムイオンに対し芳香環が求核攻撃するわけですね。なので各試薬を二トロニウムイオンと対応するアニオンの形に直したときに、アニオン部位の電子求引性が強いほどにトロニウムイオンがより電気陽性になり芳香族ニトロ化における反応性が高くなると考えられます。その点で各試薬を二トロニウムイオン-アニオンの形で表してみるとFig.10 のようになります。

ここまでくれば後はアニオン部位の電子求引性を比較すればOKですね。OH-になる硝酸は一番小さくなりそうなことはすぐわかると思います。硝酸アセチルのアセチル部は電子求引性がBF4-とHSO4-よりも低そうだと考えるのも難しくないでしょう。BF4-とHSO4-についてはどちらも対応する酸が強酸であり悩むかもしれませんが、混酸の場合はH2Oが必ず関与してきますからNO2+のカチオン性が緩和されてそうだなと思えればBF4-の方がNO2+のカチオン性が高そうだと想像できます。以上のことからニトロ化能の強さはFig. のように考えることができます。
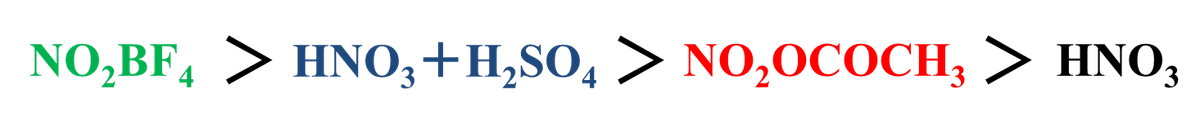
問2
誤りを含むものは選択肢4と5です。
選択肢4
亜硝酸自体は希薄な気層もしくは溶液でのみ存在できる不安定な物質です。亜硝酸塩や亜硝酸アルキルなどは比較的安定なものが多いですが、もともとの亜硝酸は濃厚溶液で扱えるようなものではありません。
選択肢5
誤っているのは最後の一文です。電子不足アルケンに求核的な作用を持っている物質を入れたら重禁剤になるどころかむしろ重合開始剤として振る舞ってしまいます。なので重禁剤として水や塩基は不適当です。
問3
誤りを含む選択肢は3です。前半部分は問題無いですが後半の記述が誤っています。アミンの乾燥に中性か塩基性寄りの乾燥剤である酸化バリウム、水素化カルシウムはむしろ適当です。そうでなくても、アミンと錯体を形成しやすい銅塩(無水硫酸銅(II) )が適当?と勘繰ることができればこの選択肢が誤りだろうと気づけると思います。
問B
問1-1
HWE反応は有名反応なので、勉強したことがある方ならなんなり答えられる問題でしょう。初見であっても問題文の情報から以下のような流れを想像することはできます。

問1-2
続く反応機構も問題文に書いてある情報をもとにありえそうな経路をいろいろ考えてみると以下のような流れが適当になります。

メタ的な話をしてしまうと、HWE反応の反応機構は大学の有機化学系講義の試験でも問われることが多いものなので覚えておくといいでしょうね。アルドール的な反応とWittig的な反応のコンボだということを覚えておくだけでもいいでしょう。
問1-3
この問題ですが、そもそもerythro型構造とthreo型構造ってなんだよって方は難しかったかもしれませんね。といっても、有機化学系の院生なら知っておいてほしいワードです。erythroとthreoは2個の隣接する不斉炭素を有するジアステレオマー化合物の相対配置を表わすもので、その化合物をFisher投影式でみたときに同じ基が同じ側にあるものをerythro、異なるものをthreoとします(より厳密な定義がありますがここでは触れません)。それを踏まえて中間体Yのerythro型構造とthreo型構造を破線-くさび形表記で書いてみるとFig.14 のようになります。

中間体Yでいうと水素原子が互いに同じ側にあるのがerythro、互いに逆側にあるのがthreoとなっていることが分かりますね。
問1-4
問題文では熱力学的に安定なのはerythroとthreoのどちらかと問われています。なので単純にFig.14に示す二つの構造どっちが安定そうかを考えればいいわけですね。これは単純に置換基の立体障害で考えればよいでしょう。アルキル基(R) が同じ側にあるerythro型よりも異なる側にあるthreo型の方が置換基同士の立体反発が小さく有利であるためthreo型の方が熱力学的に安定である。といえます。
問1-5
ここまでたどり着くことができればHWE反応がE選択的な理由はおのずと見えてくるでしょう。問1-2で考察した反応機構と問1-3,1-4での情報を整理すると、HWE反応の選択性はFig.15のような関係になることが見えてきます。

中間体Yにおいてerythro型から四面体中間体が形成されれば生成物はZ配置、threo型から形成されれば生成物はE配置となります。そして中間体Yはthreo型が熱力学的に安定です。さらに、ヒントにある情報『中間体Yの形成は可逆的』を踏まえると、仮にerythro型の中間体Yができたとしても、平衡によりより安定なthreo型に変化できると考えられます。以上より、HWE反応がE選択的である理由を以下のようにまとめることができます。
[HWE反応がE選択的である理由]
HWE反応では、ホスホネート試薬のアニオン体がアルデヒドに付加した際にerythro型とthreo型の中間体を与える。erythro型から反応が進んだ場合はZ配置オレフィンを、threo型から進んだ場合はE配置オレフィンを与えるが、立体障害において有利であり熱力学的に安定なthreo体の形成と反応が優先されるために、生成物のオレフィンはE選択的になる。
問1-6
一般的なHWE反応がE選択的なのはthreo型中間体を経由して進行するためであり、それはthreo型が熱力学的にerythro型よりも安定であるからということでした。なのでZ選択的に進行させるにはerythro型中間体を経由させればいいということが分かります。そのためにはどうするか、いたって単純に考えてみましょう。熱力学的支配の生成物としてEオレフィンが得られるなら、反応系を速度論的支配にしてしまえば逆にZオレフィンが得られるのでは?という発想はどうでしょう。実は安直なようで的を射ている発想です。中間体Yがthreo型経由で反応が進行するのは、中間体Yの形成が可逆的であるために仮にerythro型ができても熱力学的に安定なthreo型にどんどん変化してしまうためです。だったらこの一種の平衡をなくしてしまえばいいのです。リン酸エステル部の反応性を高くし、平衡の速度よりも早く四面体中間体が形成されるようにしてしまえば、速度論的生成物であるerythro型四面体中間体が優先で形成されますのでZ配置オレフィンが得られるでしょう。リン酸エステル部の反応性を高くするにはどうするかということですが、四面体中間体の形成は酸素アニオンによる求核攻撃なわけですから、リン酸エステル部に電子求引基を付けるというのがオーソドックスでしょう。
以上をまとめると、Z選択的なHWE反応を進行させるためにはリン酸エステル部に電子求引基を付けることによって酸素アニオンによる攻撃の受けやすさを高め、熱力学的に安定なthreo型中間体が形成される前にerythro型四面体中間体を形成できるようにすればよい。そうすれば速度論的な生成物であるZオレフィンが得られる。となります。
実際このような発想のもとZ選択的HWE反応がいくつか開発されており、Still法や安藤法が代表的です。
※あえて詳細に述べていませんが、本反応において速度論的な生成物はZオレフィンだよといわれてピンときてますでしょうか。ピンとこない方はWittig反応のE,Z選択性を調べてみればわかりやすい日本語の記事が出てくると思います。というよりウィキにも書いてあります。HWE反応もWittig反応も大体同じ理由で中間体のthreo-erythro選択性が発現します。要は中間体Y自体はthreo型が安定ですが、中間体Y形成時の遷移状態はC=OとP=Oがanti-periplanarの状態、すなわちerythro型のものが安定となっているのです。
この記事が気に入ったらサポートをしてみませんか?
