
Co-Localization 2 1.画像撮影
1.画像撮影
本章(1.画像撮影)では、適切な画像を取得するために検討すべき項目とその理由について解説します。検討すべき項目とは、染色条件・光学条件・撮影条件の3つに大別されます。染色条件とは、蛍光色素の種類・蛍光タンパクおよび抗原の位置・遺伝子の発現方法の3つのことです。光学条件とは、顕微鏡・対物レンズの種類・分光方法の3つのことです。撮影条件とは、露光時間・空間分解能・レーザパワーの3つのことです。これらの項目を最適化し、シグナルノイズ(SN)が良く、歪みがない画像を得ることによって、共局在の正確な定量が可能となります。
染色条件
染色条件には、下記3つの検討すべき項目があります。
・蛍光色素の種類
・蛍光タンパク・抗原の位置
・遺伝子の発現方法
「蛍光色素の種類」
蛍光色素の輝度・安定性・蛍光波長の3つの特性が画像のSNを決定します。蛍光色素とは、Green fluorescent protein (GFP), Red fluorescent protein (RFP)といった蛍光タンパク質やFluorescein, Alexa Fluor® 555といった蛍光有機小分子のことです。画像のSNは、定量の正確度や精度を決定するため、色素選びは重要です。
輝度(brightness)とは、文字通り、蛍光分子の明るさのことで、モル吸光係数と量子収率の積で表されます。明るい色素はシグナルが高く、暗い色素はシグナルが低くなります。明るい色素ほどSNは向上します。励起光を強くすることで、暗い色素でも明るく撮影(長時間露光)することでSNを高めることも可能ですが、光退色・自家蛍光といった問題(後述)が生じるため、SNがあまり改善しません。
安定性(stability)とは、退色(消光)に対する耐性のことで、励起光照射に対する蛍光分子の構造安定性で表されます。安定性が低い蛍光分子ほど、励起光照射に対する耐性が無く、すぐに退色(消光)します。このため、共局在の時間変化をタイムラプスで定量したいときに、安定性が低い色素では正確に定量できません。蛍光がすぐに退色し、標的分子が存在しないことになってしまうからです。
蛍光波長(wave-length)とは、蛍光分子が放出する光の波長のことです。蛍光波長を気にする理由は2つあります。各色の蛍光画像中には、自家蛍光が存在することと相手分子の蛍光がもれこんでくるという2点を考慮しなければいけないからです。自家蛍光とは、NADPHやコラーゲンといった細胞内の内在分子によって生じてしまう非特異的な蛍光(ノイズ)のことです。目的の蛍光(シグナル)と区別がつかないためにSNが低下する原因となります。自家蛍光はあらゆる波長帯に存在します。自身の試料では、どの波長帯の自家蛍光が強いのかを調べ、その波長帯を避けるのか賢明です。そして、もう1つの問題点、相手分子の蛍光のもれこみとは、2色の蛍光色素を撮影する際に、一方の色素の蛍光が他方の蛍光を検出するチャンネルへ混ざり込んでしまうことです。もれこみの蛍光もノイズとなり、本来の蛍光(シグナル)と区別がつかないためにSNが低下する原因となります。もれこみを避けるために、2色の蛍光波長ができるだけ離れるように、色素のペアを選択するのが賢明です。
上記の輝度・安定性・蛍光波長といった性能は、pH、温度、イオン濃度といった周囲の環境に影響を受けます(環境効果)。環境は、ゴルジ体、ミトコンドリアといった細胞内小器官ごとで、異なります (ex. pH 細胞質 7.2-7.4、ゴルジ体 6.0-6.7、リソソーム <5.5)。また、環境効果の程度は、蛍光色素ごとで異なります (ex. pKa GFP 6.0、Sirius <3.0)。具体例を挙げると、細胞質(pH 7.4)に局在していたGFP分子がゴルジ体 (pH 6.0)へと移行しただけで明るさはおよそ半分に減少します。それに対し、Siriusでは局在移行による明るさの減少はほとんど起きません。そのため、定量する分子の局在を考慮して、蛍光色素を適切に選択する必要があります。
「蛍光タンパク・抗原の位置」
蛍光タンパク・抗原の位置を適切に選択しなければ、標的分子が本来とは異なる領域に局在してしまいます。局在への影響の要因は3つに大別されます。蛍光・抗体染色の両方に共通する要因、蛍光染色で問題になる要因、抗体染色で問題になる要因の3つです。標的分子が本来の局在をとらないと、定量自体が無意味なものになります。そのため、文献検索や染色実験以外の実験手法も駆使して、標的分子の正しい局在をしっかり把握しておく必要があります。
蛍光・抗体染色の両方に共通する要因として、Tagが局在シグナル配列をマスクしてしまい、標的分子の正常な局在を阻害することが挙げられます。Tagとは蛍光Tag (ex. GFP, RFP)および抗原Tag (ex. Flag, Myc)のことです。例として、小胞体保留シグナル配列をC末端に持つ、小胞体局在タンパクのさらにC末端側に、GFPを付加した結果、小胞体への局在が見られなくなったということがあります。このため、Tagを付加する場合、標的分子のアミノ酸配列といった情報から、どの位置 (N・C末端、内部)に付加すれば局在への影響を最小限に留められるかを検討する必要があります。さらに付加した後も、局在に影響を与えていないかどうかをしっかりと確認する必要があります。
蛍光染色で問題になる要因として、蛍光Tag (ex. GFP)の付加によって、標的分子が異常な立体構造をとる (unfolding)ことが挙げられます。蛍光Tagはアミノ酸数で>200残基を超える比較的大きな分子です (ex. GFP 238 a.a.)。このため、蛍光Tagの挿入により正常なタンパクの折り畳みがおこなわれず、局在化シグナル配列の遮蔽・疎水性領域の露出・分解系への輸送促進が起こります。局在化シグナル配列の遮蔽によって、標的分子が本来の局在をとることができなくなります。疎水性領域の露出によって、自身や他の分子の疎水性領域との間で結合してしまい、凝集 (aggregation)の原因となります。分解系への輸送促進によって、不良品とみなされた分子はユビキチン・プロテアソーム系に局在するようになります。上記のような問題を避けるために、蛍光Tagを付加する場合には、付加する位置や局在への影響を入念に検討する必要があります。
抗体染色で問題になる要因として、抗体による阻害効果と抗原のマスキング現象という2つが挙げられます。抗体による阻害効果とは、抗原と結合した抗体が近傍のタンパクを遮蔽し、もう一方の抗体の反応が阻害されることです。抗原のマスキング現象とは、抗体の標的分子が別の分子と複合体を形成して抗原部位が遮蔽される現象のことです。この2つの要因が、定量したい2つの分子で起きると問題となります。本来は共局在をしているはずなのに、していないように見えるからです。これら2つの要因の影響を避けるためには、抗原部位が異なる抗体を検討する、抗原Tagの位置を変えてみるといったことを検討すべきです。
抗体染色の別の問題として、抗体の非特異的な反応によって、標的分子があたかも別の場所に局在するように見えるといった問題があります。非特異的な反応とは、抗体が本来の抗原以外の別の分子に結合してしまうことです。別の分子に結合した抗体によって、標的分子が本来は存在しない場所に局在するように見えるといったことが起こります。これを防ぐためには、BSAといったブロッキング剤で非特異的反応を防ぐこと、別の抗原を標的とする抗体を試すことで非特異的反応かどうかチェックすることが大事です。
「遺伝子の発現方法」
遺伝子の発現方法を適切に選択しなければ、画像のSNの低下に繋がります。画像のSNは標的分子の発現量に影響を受け、その発現量は発現方法によって決まってくるからです。発現方法とは、遺伝子の細胞内への導入方法や発現プロモーターを何にするのか?といったことです。発現量が少ないとシグナル(S)が低下し、多いとノイズ(N)が上昇し、いずれもSNが低下する方向に作用するからです。標的分子の局在に影響を与えず、画像のSNも高くなるように発現量を調節する必要があります。
発現方法の選択とは、遺伝子の導入方法と発現プローモーターの種類という、発現量を左右するパラメータを決めることです。遺伝子の導入方法は、細胞あたりの遺伝子のコピー数を、プロモーターの種類は、コピーあたりの転写量を決定します。遺伝子のコピー数は内在性の遺伝子であればコピー数は1-3程度ですが、カチオン性脂質によるリポフェクションやウイルスによるインフェクションでは、100を超えるコピー数も可能です。転写量は、プローモーターの種類によって変わってきます。内在性のプロモーターとサイトメガロウイルス由来のCMVといった強力なプロモーターでは転写量が大きく異なります。コピー数も転写量も多いほど、標的分子の発現量は増加します。
発現量が少なすぎても多すぎても、画像のSNの低下に繋がります。発現量が少ないと、画像が暗くなり、シグナル(S)が低下します。分子数が少なすぎて、細胞あたりの蛍光強度(蛍光色素の数と輝度の積)が低下するからです。自家蛍光由来のノイズは必ず存在するため、蛍光分子数が減少すると、画像のSNは低下します。一方、発現量が多すぎると、標的分子は異常な局在を示し、ノイズ(N)が上昇します。分子数が多すぎて、結合相手の取り合いが生じたり、フォールディングが正常におこなわれなくなるという2つの問題が生じるからです。1つ目の問題の、結合相手の取り合いに敗れた分子は、正常な局在を取れずに他の領域へと流出することになります。例えば、細胞膜と直接結合する分子と複合体を形成して、間接的に細胞膜に局在している分子は、複合体を形成できなければ細胞膜にとどまることができず、細胞質といった細胞膜以外の領域へと流出します。2つ目の問題の、フォールディングが異常な分子は「蛍光タンパク・抗原の位置」で述べたように、局在化シグナル配列の遮蔽・疎水性領域の露出・分解系への輸送促進といった問題が生じてきます。つまり、発現量が多すぎると、正常と異常な局在とが混ざった蛍光パターンとなり、SNが低下することになります。
理想的な定量は、内在性と同程度の発現量でおこなうことです。標的分子の局在を乱す可能性が低いからです。発現量が低く、蛍光が暗い場合にのみ発現量を増やすことを検討すべきです。この際、一般的なリポフェクションでは発現量が多くなりすぎるので注意が必要です。プロモータを変えて転写量を下げたり、インフェクションで感染ウイルス量を少なくし、コピー数を下げるといった工夫が必要です。いずれにしても、発現量を増やした場合、内在性の標的分子と局在が変わっていないことを確認することが大事です。
光学条件
光学系には、下記3つの検討すべき項目があります。
・顕微鏡の種類
・対物レンズの種類
・分光
「顕微鏡の種類」
顕微鏡の種類によって、蛍光画像の空間分解能は大きく変わってきます。空間分解能は共局在の定量の正確度を決定する重要な要素です。空間分解能が低いと、本来は2つの分子が「離れ」た場所に存在しているにもかかわらず「同じ」場所に存在していると誤って判定されてしまうためです。逆に空間分解能が高いと、別の場所に「離れ」て存在している2つの分子を「離れ」ていると正しく判定できます。蛍光顕微鏡は空間分解能によって3種類に分けることができます。分解能が低いものから順に、一般的な顕微鏡 (wide-field)、共焦点顕微鏡 (confocal)、超解像顕微鏡 (super-resolution)の3つです。蛍光画像の空間分解能の定義の一つとして、2つの輝点を区別することができる最小の距離(レイリーの分解能)があります。一般的な顕微鏡では、レイリーの分解能は、δ = 0.61 * (λ / N.A.) と定義されます。λは蛍光の波長、N.A.は開口数のことです。緑色の蛍光 (λ = 550 nm)、100倍の対物レンズ (ex. N.A. = 1.40)の場合、分解能は最大240 nm程度となります。それに対し、共焦点顕微鏡では一般的な顕微鏡よりも分解能は向上しています。照射する励起光と検出する蛍光の2つの光の広がりを抑えているためです(共焦点の2乗特性)。共焦点での分解能は、λ = 550 nm, N.A. = 1.40では、150 nm程度となります(XY方向のみ、Z方向は除く)。超解像顕微鏡には、STED, STORM/PALM, SIMといった、解像原理が異なる顕微鏡が複数あります。分解能は、それぞれで異なりますが、20 - 120 nm程度です。これら3種の顕微鏡の中から、研究目的にふさわしい顕微鏡を選択することが重要です。2色の分子の局在を「どれくらい」の空間分解能で主張できるかは、選択した顕微鏡で決まってくるからです。
(引用A)
「対物レンズの種類」
対物レンズの開口数 (N.A.)と収差補正という2つの性能が、共局在の定量に影響します。N.A.は上記(顕微鏡の種類)ですでに解説しているのでここでは割愛します。収差とは、蛍光のボケや歪みのことで、共局在定量の正確度に影響します。収差のうち、共局在の定量で注目するのは、「色収差」と「像面湾曲収差」です。「色収差」とは、光の波長(色)ごとに屈折率が異なることで生じる現象です。色のにじみ(軸上色収差)と画像の周辺部での像の大きさの違い(倍率色収差)とがあります(下図)。「像面湾曲収差」とは、画像の中心部と周辺部で像の大きさが異なることです。「像面湾曲収差」も波長依存性があるため、倍率色収差のように画像の周辺部で像の大きさの違いとなって現れます。「色収差」の補正はAchromat(2色)やApochromat(3色)と、「像面湾曲収差」の補正はPlanと呼ばれ、対物レンズにそれぞれ、Ach、Apo、Planと表記されます。たとえば、PlanApoと表記されている対物レンズは、3色の色収差と像面湾曲収差を補正できることを意味しています。共局在を正確に定量するために、PlanApoといった収差補正されているレンズを選ぶべきです。しかしながら、対物レンズによる収差の補正は完全ではありません。そのため、蛍光ビーズの画像といった基準となる画像によって、取得した蛍光画像を調整する必要があります(2章、画像処理参照)
(引用B)

「分光」
分光する、つまり特定の波長の光を取り出すときに問題となるのが、蛍光のもれこみです。蛍光のもれこみとは、たとえば、赤色の蛍光画像を取得するときに緑色の蛍光が混ざってくるということです。蛍光画像の撮影では、蛍光フィルター・回折格子・プリズムのいずれかを使って分光しています。蛍光フィルターは、特定の波長の蛍光だけを透過するフィルターを使って分光しています。回折格子は、光の回折・干渉現象が、波長ごとに異なる反応を示すことを利用して分光しています。プリズムは、光の屈折現象が、波長ごとに異なる反応を示すことを利用して分光しています。
上記3つの分光方法はすべて、特定の波長でしきい値をひき、しきい値以下の波長を捨て、以上の波長を回収しています。つまりAll or None方式で分光しています。しかしながら、蛍光色素は特定の波長の光だけを放出しているわけではなく、波長の幅を持った光を放出しています。たとえばGFPの蛍光波長のピークは511 nmですが、赤い波長(e.x. 575 nm)でもピークの約10%の蛍光を放出しています。つまり、GFPの蛍光の中には緑だけではなく赤色の成分も含んでいます。2色の蛍光分子を含んだ画像を分光するときには、相手の蛍光分子のもれこみを注意すべきです。

もれこみが特に問題となる状況は2つあります。1つは、短波長(e.x. 緑)の色素の発現量が長波長(e.x. 赤)の色素に比べて極端に多い状況です。長波長(e.x. 赤)の画像で、もれこみの蛍光(ノイズ)が支配的となり、あたかも共局在しているように見えてしまうからです。もう1つは、2色の画像を同時に検出する状況です(同時励起・同時検出)。GFPは488 nmの光で最も強く励起され、強い蛍光を放出します。逆に赤色を励起する543 nmの光では、GFPは弱い蛍光しか放出できません。このため、同時励起・同時検出では、赤色の蛍光画像に緑色の蛍光のもれこみも多くなってしまいます。
蛍光のもれこみを防ぐ方法は4つあります。1つ目は、もれこみが少ない、より長波長側の光を回収することです。ただし、この方法では、ノイズが減ると同時にシグナルも減ってしまい画像が暗くなります。2つ目は、蛍光波長が離れた色素のペアを選ぶことです。たとえば、緑と赤のペアではなく、緑と近赤外のペアにするといったことです。3つ目は、2つの蛍光色素のうち、短波長の色素の量が長波長の色素の量を超過しないことです。標的分子の発現量を抑えたり、染色効率を下げるといった工夫が必要です。4つ目は、2色の画像の取得を同時励起・同時検出ではなく、別個励起・別個検出にすべきです。しかしながら、このような細心の注意を払っても、もれこみが問題となる場合があります。その場合は、もれこみ成分を取り除く画像処理が必要となります(2章、画像処理参照)。
(引用C)
撮影条件
撮影条件によって、画像のSN・空間分解能・蛍光退色(ブリーチング)率の3つが決まってきます。3つともすでに述べたように、共局在の定量を正確におこなう上で重要な要素です。画像のSNは、空間分解能とトレード・オフの関係があります。また、画像のSNは、蛍光退色(ブリーチング)率ともトレード・オフの関係があります。トレード・オフとは、一方を追求すれば他方を犠牲にせざるを得ないという状態・関係のことです。つまり、画像のSNを向上させようとすると、空間分解能あるいは蛍光退色(ブリーチング)率が低下するということです。逆に、空間分解能あるいは蛍光退色(ブリーチング)率を改善しようとすると、画像のSNが低下します。
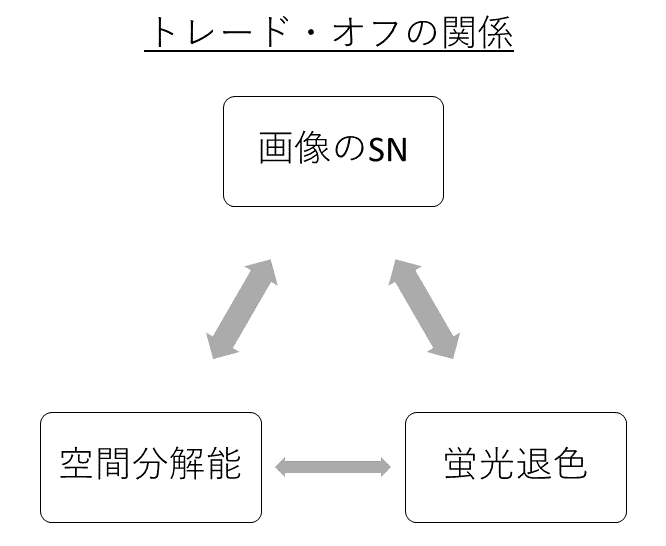
研究目的に合った、画像のSN・空間分解能・蛍光退色(ブリーチング)率を満たす画像を得るためには、撮影条件(パラメータ)を調整する必要があります。パラメータとは、「露光時間」、「励起光強度」、「空間解像度」のことです。「露光時間」とは、検出器が蛍光を集める時間のことです。長いほど明るい蛍光画像が得られます。「露光時間」は、画像のSNと蛍光退色(ブリーチング)率に影響します。長時間検出し明るい画像を取得すれば、画像のSNは向上しますが、蛍光退色(ブリーチング)も起こりやすくなります。逆に、短時間しか検出せず、暗い画像ならば、蛍光退色(ブリーチング)は防げますが、画像のSNは低下します。「励起光強度」とは、キセノンランプやLEDレーザーといった励起光源の光の強さのことです。「励起光強度」も、「露光時間」同様、画像のSNと蛍光退色(ブリーチング)率に影響します。「励起光強度」を上げると、明るい画像が得られ、SNが向上しますが、蛍光退色も起きやすくなります。逆に、「励起光強度」を下げれば、画像のSNが低下しますが、蛍光退色は防げます。「空間解像度」とは、画像の1ピクセルが何 μm × 何 μmであるのかということです。CMOSやCCDといったカメラ検出系ではビニングサイズ、共焦点のレーザースキャニング検出系ではピクセルサイズのことです。「空間解像度」は、画像のSNと空間分解能に影響します。「空間解像度」を上げると、空間分解能は向上しますが、ピクセルあたりの蛍光量は減少するため、画像のSNは低下します。逆に、「空間解像度」を下げると、空間分解能は低下しますが、ピクセルあたりの蛍光量は増加するため、画像のSNは向上します。これら3つのパラメータを最適にするためには、試行錯誤が必要不可欠となります。上記で述べた3つのパラメータと画像のSN・空間分解能・蛍光退色(ブリーチング)率の関係をしっかり理解しながら、自身の研究目的に合った最適な画像の取得を目指しましょう。
参考文献・サイト
(引用A)
https://www.olympus-lifescience.com/ja/support/learn/03/045/
https://www.olympus-lifescience.com/ja/support/learn/06/023/
http://microscopy.or.jp/jsm/wp-content/uploads/publication/kenbikyo/47_4/pdf/47-4-238.pdf
http://www.microscope.jp/knowledge/01-4.html
https://life-science-project.com/788/
http://www.lensya.co.jp/010/wforum.cgi?mode=allread&no=6464&page=630
http://d.hatena.ne.jp/Ctenophora/20061001
https://lne.st/2014/12/01/imaging/
(引用B)
https://life-science-project.com/897/
https://www.nikon-image.com/enjoy/phototech/capturenx2/guide14_1.html
https://www.newglass.jp/mag//TITL/maghtml/21-pdf/+21-p191.pdf
https://cweb.canon.jp/eos/special/dlo/factor/index02.html
http://www.nikon-instruments.jp/jpn/learn-know/microscope-abc/learn-more-microscope/about-aberration#Anchor_7
(引用C)
https://www.shimadzu.co.jp/products/opt/guide/14.html
https://www.shimadzu.co.jp/products/opt/guide/02.html
https://www.fpbase.org/protein/egfp/
https://deepgreen.dpb.carnegiescience.edu/cell%20imaging%20site%20/html/dual%20fp%20imaging.html
この記事が気に入ったらサポートをしてみませんか?
