腎疾患の直接的細胞死pathway
ChatGPT-4による結論の趣旨説明
調節された細胞死がAKIおよびCKDの病態に関与する可能性があることを示していますが、さまざまな調節壊死経路を標的とする研究の結果に矛盾があり、現在の理解にはギャップが存在します。非侵襲的バイオマーカーの特定や、治療法開発における最適な介入や対象患者集団の特定が重要であることを示唆しています。さらに、pan-cell death inhibitorが成功の確率を高める可能性があるものの、安全性への懸念も増加することが指摘されています。最終的に、調節壊死の治療的調節の有望性は、臨床試験を通じて確認されることが必要。介入のタイミングは重要であり、調節壊死の主な方法が時間とともに進化し、予防または治療に関連するさまざまな分子または細胞標的があります。臨床試料中のネクロトーシス、フェロトーシス、またはピロトーシスの進行中の分子または組織学的マーカーの特定により、リアルタイムのモニタリングが可能になり、介入のタイミングやタイプの調整、および患者の治療への反応の評価が可能になります。さまざまな形態の細胞死間の相互作用の可能性を考慮すると、2つまたは3つの経路に作用するパン細胞死阻害剤が成功の確率を高めるかもしれません。ただし、このようなアプローチにより、安全性への懸念が悪化する可能性があります。
Sanz, Ana B., Maria Dolores Sanchez-Niño, Adrian M. Ramos, and Alberto Ortiz. “Regulated Cell Death Pathways in Kidney Disease.” Nature Reviews Nephrology, March 23, 2023. https://doi.org/10.1038/s41581-023-00694-0.
要約
腎実質細胞の死と不適応な細胞の増殖または動員との間の不均衡に起因する細胞数の障害は、腎臓病の病因に寄与しています。急性腎不全は、腎臓上皮細胞の急性的な消失によって引き起こされることがある。慢性腎臓病では、腎上皮細胞の喪失が糸球体硬化と尿細管萎縮を引き起こし、間質性炎症と線維化は白血球と筋線維芽細胞の過剰から生じる。また、後天性嚢胞性疾患や腎臓がんなどは、それぞれ嚢胞壁や悪性細胞が過剰になることが特徴である。
細胞死は不要な細胞を除去する作用があるが、不釣り合いな反応は腎臓細胞の有害な喪失を引き起こす可能性がある。実際、アポトーシスやネクローシスなど、制御された細胞死の経路は、様々な腎臓病の病因における中心的な出来事として浮上しており、治療的介入が可能である可能性がある。ferroptosis, necroptosis , pyroptosisなどの制御されたネクローシスの様式は、直接的に、あるいは免疫細胞の動員や炎症反応の刺激を通じて、腎臓に障害をもたらす可能性がある。重要なことは、制御された細胞死の異なる様式間には、共通の引き金、分子成分、保護機構など、何層もの相互関係が存在することである。
Translated with DeepL
キーポイント
アポトーシスまたはNecroptosisによる制御された細胞死は、急性および慢性腎臓病における実質的な細胞喪失に寄与し、炎症、線維化、免疫反応をも調節する可能性がある。
アポトーシスを調節する治療戦略は、調節されたNecroptosisを阻害または促進する可能性がある。
一般に、腎臓病の前臨床モデルにおいて、ferroptosisやNecroptosisを標的とすることが治療上有益であることを裏付ける利用可能な証拠がある。しかし、pyroptosisを標的とすることの影響はあまり明らかでない。
制御された壊死の多様な形態は、相互に関連し、分子経路や細胞防御機構を共有し、同じ腎臓病で共存し、異なる細胞種や同じ細胞種に同期的または連続的に影響を及ぼす可能性がある。
調節された壊死は、損傷関連分子パターンを放出し、組織損傷を増幅させる炎症反応(壊死性炎症または免疫原性細胞死)を誘発する可能性がある。
いくつかの有望な前臨床データにもかかわらず、ヒトの腎臓病を予防または治療するために制御された壊死を対象とした臨床試験は行われていない。
Bing
Ferroptosis is a new type of programmed cell death that was discovered in recent years and is usually accompanied by a large amount of iron accumulation and lipid peroxidation during the cell death process. It is genetically and biochemically distinct from other forms of regulated cell death such as apoptosis1. Oxytosis/ferroptosis is initiated by the failure of the glutathione-dependent antioxidant defense system1. Ferroptosis plays an important regulatory role in the occurrence and development of many diseases, such as tumors, neurological diseases, acute kidney injury, ischemia/reperfusion, etc.2
Necroptosis is a newly discovered pathway of regulated necrosis that requires the proteins RIPK3 and MLKL and is induced by death receptors, interferons, toll-like receptors, intracellular RNA and DNA sensors, and probably other mediators1. Necroptosis is a programmed form of necrosis, or inflammatory cell death2. It is an effective means of caspase-independent cell death and can play an important role in limiting the time in which pathogenic stimuli can inhabit the cell3.
Receptor-interacting protein kinase 3 (RIPK3) is a protein that plays a role in programmed cell death1. RIPK3 is a member of the receptor-interacting protein (RIP) family of serine-threonine kinases and has a unique C-terminal domain that distinguishes it from other RIP family members2. RIPK3 is a component of the tumor necrosis factor (TNF) receptor I signaling complex and induces apoptosis by weakly activating NFκB transcription factor and caspase 82.
Mixed lineage kinase domain-like protein (MLKL) is a pseudokinase that plays a key role in necroptosis1. MLKL is a substrate of receptor-interacting protein kinase 3 (RIPK3) and is phosphorylated by RIPK3 during necroptosis1. MLKL oligomerizes and translocates to the plasma membrane where it forms pores that cause cell death1.

アポトーシスを起こしている細胞は、細胞表面の分子(‘eat me’ signals:「私を食べて」シグナル)を表示し、細胞膜が破れて炎症性物質が放出される前に、隣接する細胞によって速やかに飲み込まれ(エフェロサイトーシス)、クリアランスされることを促進します11。
さらに、アポトーシス細胞の細胞膜にあるパンネキシン1チャネルのカスパーゼによる開口は、AMP、GMP、クレアチン、スペルミジン、グリセロール-3-リン酸、ATP、フマル酸、コハク酸、その他隣接細胞での炎症を抑制する化合物からなるアポトーシス代謝物の分泌を促進します12。
さらに、アポトーシス自体は、食細胞の代謝の変化と関連しており、好気性解糖への切り替えや、溶質担体ファミリー(SLC)トランスポーターを通じて乳酸などの解糖副産物を放出し、隣接細胞における抗炎症反応を促進する13。
このように、アポトーシスとエフェロサイトーシスのプロセスは、全体として、隣接する細胞の「癒し」を促進する複雑なプログラムに関連している。
b, 対照的に、制御されたネクロシスは、例えば、初期のエンフルメントの欠如、炎症性分子の生成(例えば、パイロプトーシスにおけるIL-1β)、制御されたネクロシス形態ごとに特有の孔形成タンパク質による小さな損傷関連分子パターン(DAMP)の放出などを通じて、自然免疫および適応免疫応答を複数のステップで巻き込むことがある。これらの作用の最終的な共通経路は、NINJ1の関与による細胞膜の破壊であり、より大きなDAMPsの放出を可能にする。 www.DeepL.com/Translator(無料版)で翻訳しました。
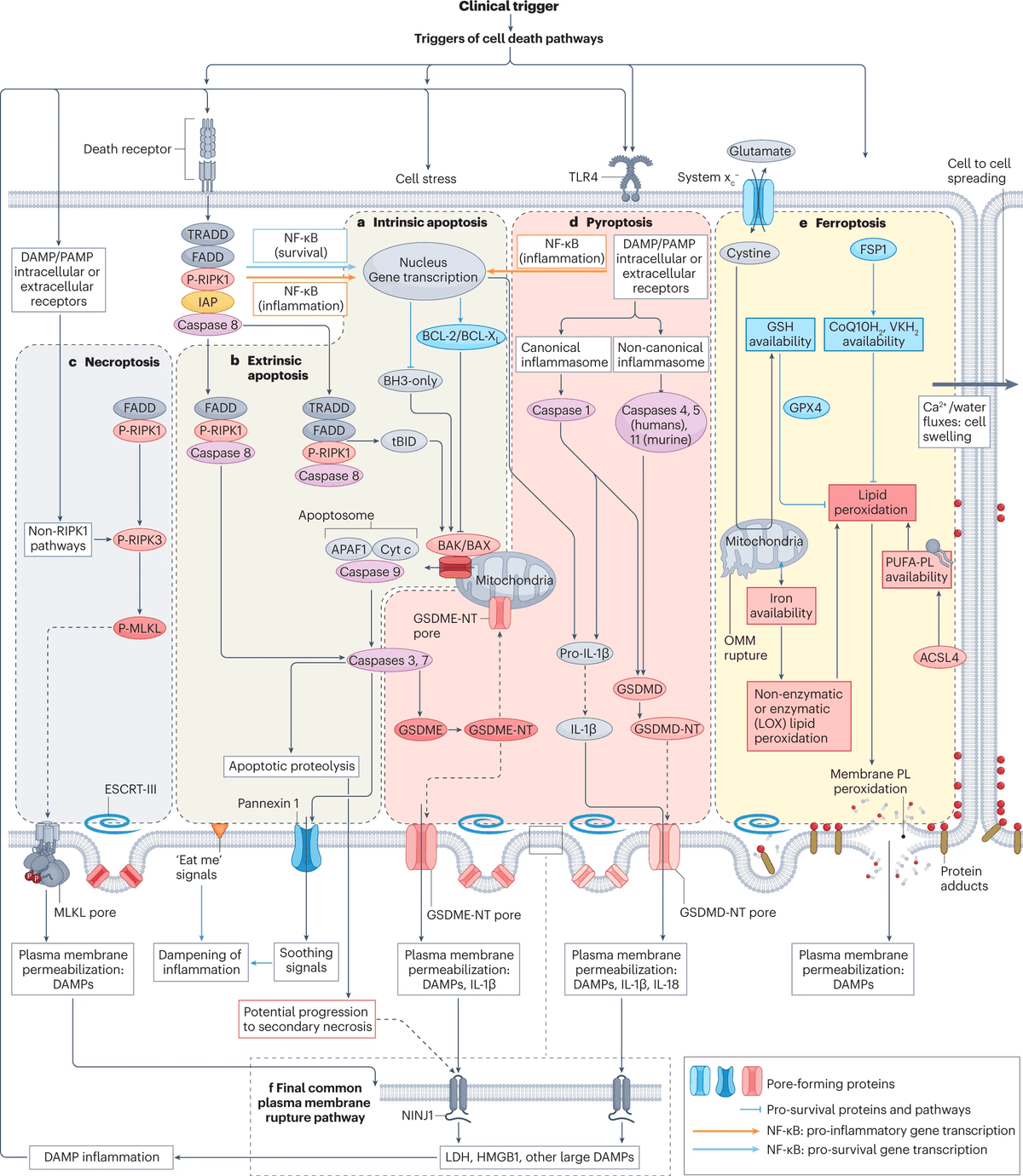
a. In the intrinsic pathway:内因性経路において、ストレス要因や生存シグナルの欠如により、生存を促すBCL-2ファミリータンパク質とアポトーシスを促すBH3-onlyタンパク質のバランスが崩れ、BAK/BAX依存性のミトコンドリア外膜透過が促進される。この結果、シトクロムcなどのアポトーシス促進性ミトコンドリアタンパク質が遊離してAPAF1やプロカスパーゼ9を含むアポトソームという多重タンパク質構造の形成に至る。この一連の現象により、カスパーゼ9(イニシエーターカスパーゼ)が活性化され、その後、カスパーゼ3やカスパーゼ7などの実行型カスパーゼを活性化し、細胞構造の解体に決定的な寄与をする。
b, In the intrinsic pathway:外在型アポトーシス経路では、腫瘍壊死因子受容体(TNFR)スーパーファミリーのデスレセプターの活性化がイニシエーターカスパーゼ8の活性化につながり、それが実行型カスパーゼを活性化し、さらにBH3のみのタンパク質BIDをミトコンドリアアポトーシス経路を活性化するTBIDに処理するかもしれません。しかし、TNFによるTNFRの活性化には、多タンパク質複合体への特定のタンパク質のリクルートによって、別の結果も存在する。アポトーシス阻害剤(IAP)タンパク質の存在は、NF-κBを活性化して抗アポトーシスタンパク質の転写を増加させるが、NF-κBは炎症反応を誘発することもある。IAPが存在しない場合、カスパーゼ8が活性化される。カスパーゼ8の阻害はネクロプトーシスを誘発する可能性がある(下記参照)。アポトーシス細胞は、その表面に "eat-me "シグナルを発現し、隣接する細胞による迅速な飲み込み(efferocytosis)を促進する。さらに、抗炎症性分子(鎮静シグナル)を分泌する。しかし、アポトーシスが広範囲に及んだり、アポトーシス細胞のクリアランスが低下すると、NINJ1が関与して細胞膜が透過し、損傷関連分子パターン(DAMPs)が放出される二次ネクロシスとなることがある。
c, Necroptosis. ネクロプトーシスの中心的な特徴は、リン酸化による受容体相互作用セリン・スレオニン・プロテインキナーゼ3(RIPK3)の活性化とそれに続く混合系キナーゼドメイン様タンパク質(MLKL)のリン酸化にある。リン酸化されたMLKLはオリゴマー化し、細胞膜を破壊する孔を形成し、細胞内容物の放出を可能にする。正規のRIPK3の活性化は、RIPホモ型相互作用モチーフを含むタンパク質RIPK1、TIRドメイン含有アダプター分子1(TICAM1)またはZ-DNA結合タンパク質1(ZBP1)との相互作用によって媒介されている。RIPK3とRIPK1の結合はTNFRの活性化に反応して起こり、RIPK3とTICAM1の結合はToll様受容体(TLR)の活性化によって誘導され、ZBP1への結合はウイルス感染の結果としてのZ-RNAの存在に反応して起こる。非正規のRIPK3の活性化は、細胞膜のNa+/H+交換体1の活性化と細胞内pHの上昇に応答して起こる(示さず)。
d.Pyroptosis. パイロプトーシスは、ガスダーミンを酵素で処理してアミノ末端(NT)断片にし、それがオリゴマー化して細胞膜孔を形成し、細胞内コンテンツやDAMPsを放出することが重要な特徴である。最もよく知られたモデルは、マクロファージにおいてNLRP3(カノニカル)インフラマソームがカスパーゼ1の活性化を介し、プロIL-1βをIL-1β、プロIL-18をIL-18、ガスダミンD(GSDMD)をGSDMD-NTに処理するものです。しかし、他の細胞系では他のインフラマソームや酵素がガスデルミンを処理する可能性があり、IL-1βの遺伝子発現が低い細胞種ではIL-1βはパイロプトシスの主要成分ではない可能性がある。さらに、ガスデルミンはミトコンドリアを透過させ、カスパーゼ3がガスデルミンE(GSDME)を、カスパーゼ8がGSDMDを切断する可能性とともに、アポトーシスとの関連性を示す。
e, Ferroptosis フェロプトーシスの中心的な事象は、鉄依存的に起こる細胞膜リン脂質(PL)の過酸化である。フェロプトーシスに対する細胞の感受性は、鉄の利用可能性(ミトコンドリアが鉄を貯蔵する役割を果たすかもしれないことに注意)、酵素的(例えば、リポキシゲナーゼ(LOX)により媒介される)または非酵素的脂質過酸化に対する能力、および脂質過酸化に対する細胞防御の存在に依存し、これにはシステムxc-シスチン/グルタミン酸アンチポーターによるシスティンの侵入によって維持されている十分なグルタチオン(GSH)貯蔵も含まれています。グルタチオンペルオキシダーゼ4(GPX4)という酵素は、その抗酸化作用のためにGSHを必要とします。さらに、ビタミンK(VK)とコエンザイムQ10(CoQ10;ユビキノンとしても知られる)を還元状態に保つフェロプトーシス抑制タンパク質1(FSP1)なども抗酸化システムに含まれます(それぞれVKH2、CoQ10H2)。フェロプソスの主な結果は、図中の赤い点で示される膜PLの過酸化であり、膜タンパク質付加物や膜破裂をもたらす。フェロプソシスは、腎臓の尿細管で報告されているように、体積シフトとカルシウムフラックスを伴う過程を経て、あるきっかけで細胞から細胞へと波状に広がっていく。
f, 異なる細胞死様式間で共通する特徴として、修復装置、輸送に必要なエンドソームソーティング複合体III (ESCRT-III) の膜修復能力、大きなDAMPsとタンパク質を放出する細胞膜断片化の最終段階でNINJ1の必要性を挙げている。しかし、フェロプトーシス中の細胞膜破断には、NINJ1は必要ない。注目すべきは、図中のすべての分子経路は経路間の相互関係を強調するために同じ細胞で表現されているが、すべての細胞種が、すべての形態の制御された細胞死を進行させるのに必要な細胞内機構や微小環境を備えているわけではないという点である。パイロプトーシスについては、IL-1βの転写、プロセッシング、放出の増加は主にマクロファージで特徴づけられているが、上皮細胞はこのインターロイキンを放出する能力がより限定的である。
ACSL, long-chain fatty acid–CoA ligase 4; OMM, outer mitochondrial membrane; PAMP, pathogen-associated molecular pattern; PUFA, polyunsaturated fatty acid; PUFA-PL, PUFA-containing phospholipids.


b,制御された壊死の最初の波が抑制されない場合、炎症を誘発する損傷関連分子パターン(DAMPs)の放出とネクロプトーシスなどの炎症サイトカイン媒介制御壊死の第2の波が発生することが考えられる。このシナリオでは、サイトカインまたはネクロプトーシス阻害剤を1回予防投与しても、フェロプトーシスによって引き起こされる細胞死の最初の波を防ぐことができないため、AKIを防ぐことはできない。しかし、ネクロプトーシスやその他の炎症に関連した細胞死は、例えば、傷害が発生した後に治療を開始することで治療が可能になる場合がある。このシナリオは、AKIと診断された後に治療が行われる、通常の臨床状況を表している。細胞死の進行によりDAMPsが継続的に放出されるため、治療は数日間にわたって維持されることが予想される。治療が成功すれば、AKIを予防することはできないが、炎症に関連した細胞死の増幅ループを阻害することにより、回復を促進することができる。細胞死がまだ続いているのか、もしそうなら、腎臓の細胞死の主な活動様式は何なのかを評価するためには、制御された壊死のバイオマーカーが必要である。
c, AKIの進行段階では、アポトーシス細胞死が、過剰な筋線維芽細胞や白血球、過剰な尿細管細胞を取り除く働きをする。この概念は、葉酸の過剰摂取によって誘発されたAKIモデルマウスにおける観察96,103,104と、ヒトAKIの回復期における形態的アポトーシスの記述105に基づいている。この前臨床モデルの初期段階におけるフェロプトーシスの役割と、長期的な転帰に対するネクロプトーシスの寄与については、いくつかの研究で検証されている117,143。しかし、この概念的な表現をヒトのAKIの形態に適用するためには、さらなる研究と臨床試験が必要である。 www.DeepL.com/Translator(無料版)で翻訳しました。
