
芳香族化合物の化学(3)「芳香族化合物の分子軌道」
有機化学の中でも芳香族化合物は構造,反応に特徴があります。
ここでは大学レベルの「芳香族化合物の化学」について解説していきます。
今回のテーマは「芳香族化合物の分子軌道」です。
【ベンゼンの分子軌道】
全ての炭素はsp2混成軌道を有し,C(sp2)-C(sp2)結合によりσ結合,p軌道によりπ結合を形成する。このπ結合が共鳴安定化により,ベンゼン環の上下に電子雲を形成する。

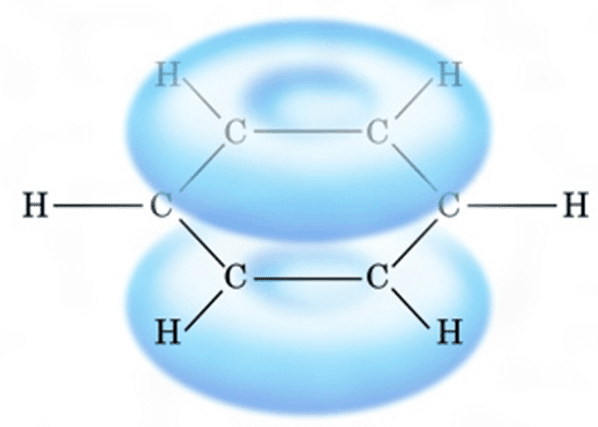
【ベンゼンのπ分子軌道】
ベンゼンの分子軌道はΦ1~Φ6があり,縮退により4つのエネルギー準位を有する。
これらの分子軌道はHückel近似により軌道エネルギーを算出することができる。

Hückel近似
π結合による分子内共役を有する化合物のπ結合にのみ適用される。
① すべての重なり積分は0とする。
② 隣接しない原子間の全ての共鳴積分は0とする。
③ 残り全ての共鳴積分は等しいβとする。
(例)1,3-butadieneの場合,エネルギー準位をE,クーロン積分をα,共鳴積分をβとする。炭素をそれぞれ1~4とすると,π結合は1-2間,2-3間,3-4間で形成されるので永年行列式は以下のようになる。

ベンゼンの軌道エネルギーの計算
Hückel近似に基づき,ベンゼンの永年行列式をたてると次のようになる。

これについて両辺をβで割り,(α-E)/β=xとし,行列式を展開すると,次のようになる。

これをEについて解くと次のようになる。

即ち,ベンゼンのエネルギー準位は次の6つが与えられ,その一部は縮退(同じエネルギー準位を持つ)するので,4つのエネルギー準位が存在する。

【参考図書】
ボルハルトショアー現代有機化学(下)
「芳香族化合物の化学」をまとめたpdf(power pointスライド)も作成しております。
ご希望の方がおられましたらコメントをよろしくお願いします。
この記事が気に入ったらサポートをしてみませんか?
