NOD2欠損はクローン病における分泌型IgA複合体の逆行性輸送を増加させる
ネイチャーコミュニケーションズ
ネイチャー・パブリッシング・グループ
NOD2欠損はクローン病における分泌型IgA複合体の逆行性輸送を増加させる
Nicolas Rochereau, Xavier Roblin, [...], and Stéphane Paul
論文情報追加
関連データ
補足資料
データ利用許諾書
要旨
腸管小胞体は、分泌性IgA(SIgA)-病原体複合体を腸管関連リンパ組織へ移行させる主要な経路である。SIgA/コメンサル複合体の取り込みは、粘膜における適応免疫のプライミングに重要である。本研究は、クローン病(CD)におけるSIgA逆行性免疫複合体輸送の影響を探ることを目的としている。その結果、NOD2変異を有するCD患者では、NOD2変異のないCD患者および健常人と比較して、SIgA輸送が有意に増加していることを報告した。NOD2は、逆行性輸送に関与する受容体であるDectin-1およびSiglec-5の発現を低下させることにより、ヒトおよびマウスのM細胞を介したIgA輸送に影響を及ぼしていることが明らかとなった。これらの知見は、NOD2が腸内細菌叢に対する粘膜応答を制御するメカニズムを明らかにし、CD腸管炎症および腸内細菌異常症に関与していることを示唆するものである。
主題用語 抗体、慢性炎症、粘膜免疫学、クローン病
はじめに
宿主免疫系が病原体と常在菌を識別する能力は、粘膜の恒常性を維持するために必須である1,2。腸管における粘膜恒常性維持機構の重要性は、機能的あるいは遺伝的な欠陥が存在する場合に強調される。このような、細かくバランスのとれた免疫反応を維持できない例として、クローン病(CD)のような慢性腸炎の発症が挙げられます。CDは特発性の慢性局所性腸炎で、回腸末端部に最も多く発症しますが、口から肛門までの消化管のどの部位にも発症する可能性があります。CDは、特定の遺伝的背景を持つ個体において、粘膜バリア機能障害とともに常在菌の自己認識の破綻の結果として生じると考えられています3-5。欧米の集団において、CDと最も強く関連する遺伝的危険因子は、細胞内微生物に対する免疫防御に重要な細胞内パターン認識受容体であるNOD2である6-8。NOD2は、腸管バリア機能を制御し、経細胞的な透過性と細菌の移動を制限することが知られています9,10。NOD2のCD関連変異(Leu1007fsinsC, Gly908Arg, Arg702Trp)10は、タンパク質のLRR領域内に位置し、ムラミルジペプチド(MDP)に応答してNF-κBの活性化が失われるものである。しかし、NOD2の不活性化がなぜ慢性大腸炎を引き起こすのか、その理由はまだほとんど推測の域を出ていません。
分泌型IgA(SIgA)は、ヒトや他の多くの哺乳類の粘膜表面に最も多く存在する免疫グロブリンである。SIgAは、腸内病原体と常在菌を識別することにより、腸管上皮を保護することができる11-16。腸管免疫系が腸内病原体を認識すると、高親和性でT細胞依存性の病原体特異的IgAが産生され、腸管内腔に「トランスシトーズ」される。SIgAは、M細胞の頂膜に付着し、パイエル板(PP)に存在する樹状細胞(DC)への抗原(Ags)の取り込みと運搬を促進するという特徴も有している。IgAオプソニン化微生物が侵入する感染症などの病態下では、これらの免疫複合体は、ヒトCD103 + DCによるTNF、IL-1β、IL-23などの炎症性サイトカインの産生を増幅させる17。この逆行性輸送はreverse transcytosisと呼ばれ、上皮性M細胞によって媒介されている18-21。SIgA2のCα1ドメインとそれに付随するシアル酸(Sia)残基のグリコシル化は、M細胞上のSIgA取り込みの受容体として同定されたDectin-1とSiglec-5と同様に、IgAの逆トランスサイトーシスに関与している19。しかし、SIgAがM細胞上を逆輸送される制御とその経路については、まだ解明されていない。
腸管透過性の亢進は、長年にわたりCDの病因の一つとして認識されてきた。多くの臨床研究、疫学研究、動物モデル研究により、IBDを誘発または悪化させる可能性のある様々な常在菌および潜在的病原性腸内細菌の影響が評価されています22,23。ある集団ベースのコホート研究において、サルモネラ胃腸炎のエピソードが検査機関登録に通知された個人では、IBDのリスクが増加することが示されました24。この知見は、急性腸炎を引き起こす病原体は、おそらく初期の腸炎や腸内細菌叢の変化を引き起こし、結腸原性微生物の形成を促進することによって、後に CD を発症する素因となり得るという概念を提唱するものであった。我々は、CD患者で観察される粘膜炎症は、IgA-病原体複合体が内腔からM細胞を通じてPP免疫細胞へ輸送される量が増加するためではないかと仮定した。実際、細菌-IgA複合体は、逆トランスサイトーシス後、CD11c+ DCに取り込まれ、炎症反応を誘導することができる18,19。さらに、IgAを多く含む腸内細菌を選択すると、ヒトでは腸内細菌の多様性が低下し25 、無菌マウスでは大腸炎に対する劇的な感受性が付与される12,26。最も早期に観察可能なCD病変は、M細胞が豊富で27、PPがより多く存在し、IgA2が優勢な濾胞関連上皮 (FAE) に発生することが報告されている28。CDに関連するNOD2変異は主に回腸区画に病変を発生させやすいことから29、腸内細菌叢と粘膜自然免疫の間のシグナル伝達相互作用を変化させることで疾患感受性が高まることが示唆される。そこで我々は、NOD2がIgAの逆行性輸送を制御していることが、NOD2変異患者で観察される調節異常を説明する可能性があると考えた。
我々は、NOD2遺伝子変異を有するCD患者から採取したヒトPP生検において、IgAの輸送が増加していることを観察した。我々は、NOD2がヒトおよびマウスのM細胞を介したIgA輸送において、このプロセスで共受容体として働くことが既に同定されているM細胞上のDectin-1とSiglec-5の発現を減少させることにより制御効果を持つことを証明する。この結果は、NOD2を介した腸内細菌に対する自然免疫反応の制御機構が、CD患者に見られる粘膜炎症の開始や持続に関与していることを明らかにするものである。
研究成果
NOD2変異は、CD患者においてSIgAレトロ輸送を増加させる
我々はまず、SIgAの輸送が病気の結果として変化しているかどうかを調べ、次にNOD2変異を持つ、あるいは持たないCD患者から採取したサンプルに分析を絞り込んでいった。この問題に取り組むため、まず健常者(n = 8)またはCD患者(n = 20)の回腸末端のPP生検からNOD2遺伝子型を決定し、SIgA陽性細胞数を定量化した。NOD2フレームシフト多型を発現するCD患者(n = 10)では、健常者(n = 8)および野生型(WT)NOD2を発現するCD患者(n = 10)に比べ、PPあたりのSIgA陽性細胞の平均増加率は2.8倍であった。抗IgA抗体と抗分泌成分(SC)抗体による最初の共焦点化(図1b)により、IgAは内部(間質液)からではなく内腔から濃縮されていることが確認された(SIgAの内腔からPPへの逆輸入)。すべての検査生検でIgA+/SC+の共焦点化が観察された(健常者n = 8; NOD2フレームシフト多型を持つCD患者n = 10; WT NOD2を持つCD患者n = 10)。2番目の共局在化IgA2+/DC-SIGN+(図1b)は、SIgA+細胞の数が、M細胞を介したSIgAの逆行性輸送とそのDCへの取り込みに由来していることを示している。SIgAの逆行性輸送の増加は、PPを欠く腸のセグメントでは観察されなかった(図1a, b)。SIgA+細胞の数の弱い違いは、NOD2多型R702W(n = 4)、FS1007insC(n = 3)またはR702W/G908R(n = 3)の患者において測定された(図1a)。これらのデータを総合すると、NOD2遺伝子の変異を単独で示すCD患者のサブセットにおいて、PPに関連するSIgAが増加していることが示される。
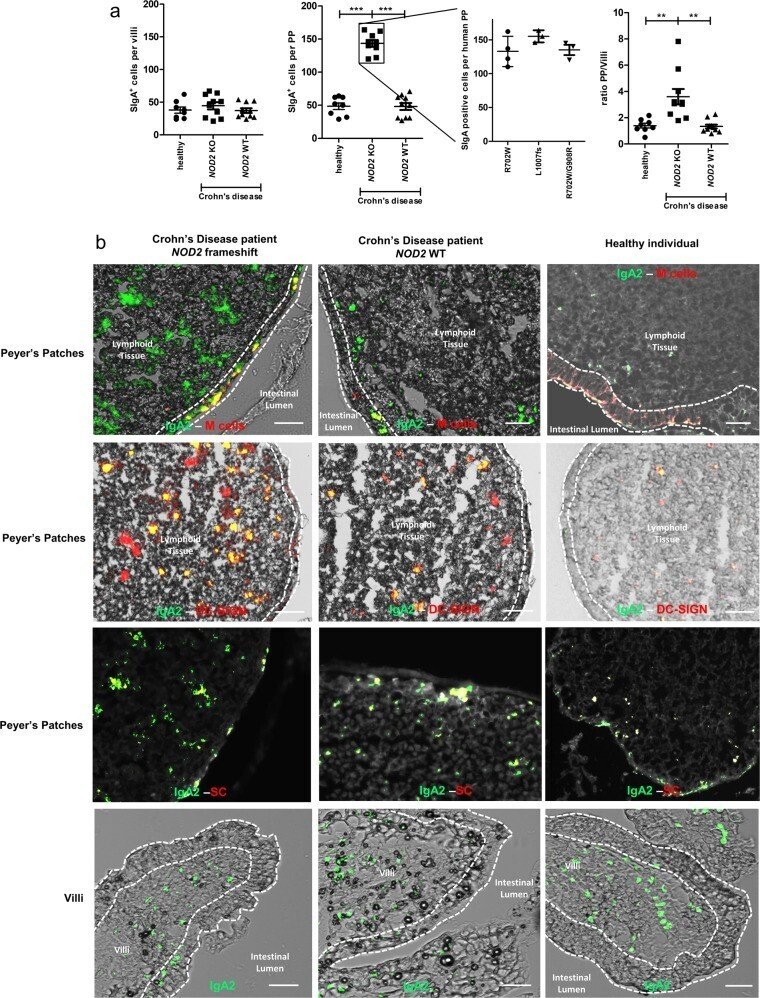
図1.
図1.
NOD2変異は、CD患者においてSIgA逆転写を増加させる。
NOD2欠損マウスではIgAの逆輸送が増加する
NOD2がない場合、PPはFAEのCD4+ T細胞とM細胞のレベルが高く、Th1(IFN-γ、TNF-α、IL-12)およびTh2(IL-4)サイトカインのレベルが増加している。これらの免疫変化は、副細胞の透過性の増加や酵母/細菌のトランスロケーションと関連している30,31。そこで我々は、定常状態では、NOD2遺伝子変異を有するCD患者で観察される調節異常がSIgAの逆トランスサイトーシスを促進し、最終的に細菌-SIgA複合体の過剰な取り込みを引き起こすのではないかと考えた32。
そこで、NOD2ノックアウト(KO)マウスにおいて、NOD2発現欠損がSIgAの輸送に影響を与えるかどうかを検討した。蛍光標識したSIgAの輸送をNOD2ノックアウトマウスとWTマウスの間で比較し、PPを含む結紮腸管ループに投与した後の抗体分子の運命を検討した。NOD2多型の患者から得られたヒト腸管生検で観察されたように、NOD2 KOマウス(112.4 ± 14.5)のSIgA輸送はWTマウス(49.4 ± 7.6)と比較して内腔からPPへの平均2.3倍の増加で有意差があった。このIgA輸送の有意な増加は、MDP-PAM処理後の有意な減少とともに、NOD2がトランスサイトーシスのプロセスに関与していることを示している(図2a)。最後に、結紮型腸管ループモデルを用いて、陰性対照であるBSAや無関係なマウスIgGのレトロトランスサイトーシスは観察されなかったことから、この効果はSIgA依存的であることが示唆された(図2a)。
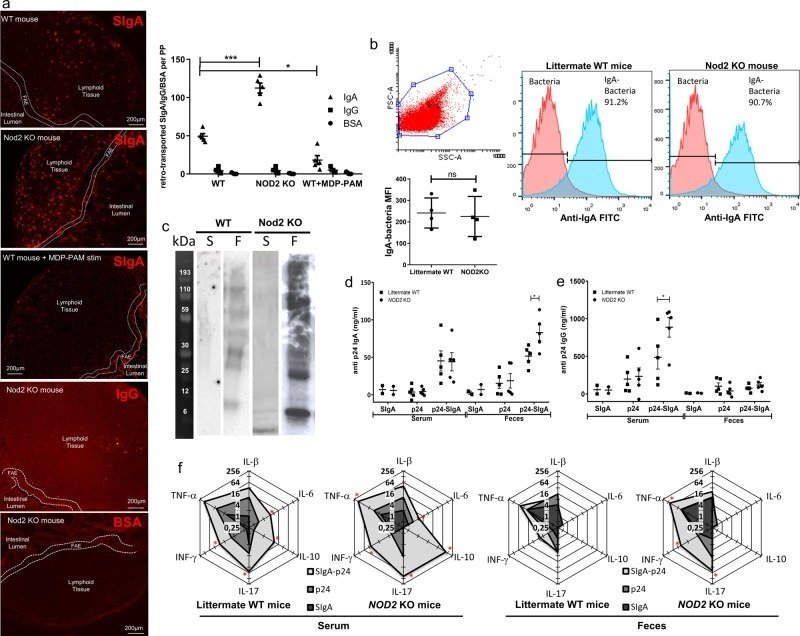
図2
図2
NOD2欠損によるマウスのIgA逆行性輸送の増加。
HIV p24とSIgAを同腹のWTマウスに経口投与すると、ウイルス抗原に対する強固な免疫応答が生じる。この実験では、SIgAがHIV p24抗原をそのままPPsの腸管M細胞に運ぶデリバリーシステムとして機能している20。そこで我々は、NOD2 KOマウスで観察されたSIgAの逆輸送の増加により、同腹のWTマウスと比較して、経口免疫後のp24特異的反応性が改善されるのではないかと推測している。まず、先に述べたように33 (図2c) 、IgAの結合能は、ラットメイトマウスでもNOD2 KOマウスでも同じ微生物叢パターンに結合することが確認された。また、フローサイトメトリーによるIgA+菌の定量化でも確認した(図2b)。経口免疫は全身および粘膜反応を誘導することがよく知られているため、最後の免疫の1週間後に血清および糞便の両方の試料で抗原特異的反応を測定した。NOD2 KOマウスでは、全身p24特異的IgGおよび糞便IgA力価が、同腹のWTマウスと比較して有意に増加した(図2d, e)。同量のp24の経口投与だけでは、KOまたは同腹のWTマウスのいずれにおいても特異的Ab反応を誘導するのに十分ではなかった(図2d, e)。免疫反応の局所的な組織依存性はサイトカインの制御された産生に大きく依存しているため、最後の免疫の24時間後に得られた血清と糞中のサイトカインのパネルをLuminexで測定した。p24単独と比較して、p24-SIgAは、NOD2 KOマウスの血清中の試験したすべてのサイトカインの強力な誘導因子であったが、糞便中で測定したTNF-α、INF-γおよびIL-17も誘導した(Fig. 2f)。SIgA単独での免疫では、サイトカインの産生に影響を与えない。IL-10を除き、同腹のWTマウスとNOD2 KOマウスの間でサイトカインの分泌量に差は見られなかった。NOD2 KOマウスでp24-SIgAを免疫した後の血清中のIL-10の増加は、特異的Th細胞応答の最初のプライミングに続く全身性炎症プロセスの制御を示すと考えられる。これらの結果は、p24-SIgA複合体の輸送が機能的なNOD2に依存し、鉤状のAgの制御された通過をもたらし、その後、粘膜および全身性の抗体およびサイトカイン応答の発症を引き起こすことを示唆している。
SIgA-サルモネラ菌はサルモネラ菌によって誘発されたマウスの大腸炎を増幅させる
NOD2 KOマウスのSIgA逆トランスサイトーシスが、結合したAgの輸送を促進することが、特異的免疫反応の検出に反映されていることから、このようなメカニズムが慢性大腸炎の発症に関与している可能性が示唆される。そこで、腸管SIgA逆行性輸送に相反する作用を示すKOマウス(すなわち、腸管逆行性輸送を促進することが確認されたNOD2 KOマウス(本研究)、および逆トランスキュートシスを阻害することが知られているDectin-1 KOマウス19)を用い、WT同腹動物と比較検討した。病態は、飲料水中のデキストラン硫酸ナトリウム(DSS)投与(陽性対照)、サルモネラ・チフスムリウム単独(サルモネラ誘発大腸炎モデル)またはマウスサルモネラ特異的SIgASal4との併用(作業仮説)により誘発された。対照実験として、DSS-colitis34の発症を抑制することが知られているDectin-1アンタゴニストのlaminarinを経口投与し、SIgA逆行性輸送阻害の影響をさらに検証した。
PBS対照群と比較して、同腹のWTマウスにサルモネラ菌のみを経口投与した場合、疾患活動性指数(DAI)の測定により判断すると、炎症の重症度が有意に上昇した(図3a)。サルモネラ-SIgASal4複合体の経口投与は、5日目に弱いながらも統計的に有意なDAIをさらに増加させた(Fig.3a)。DSS処理した同腹のWTマウスは、最も高い疾病の兆候を示した。Dectin-1をブロックし、飲料水中のラミナリンの添加によってSIgAの逆トランスシトシスを減少させると、大腸炎の重症度は著しく減少した。この仮説を裏付けるように、SIgA逆転写が増加し、サルモネラ菌の腸管輸送が増加したNOD2 KOマウスは、DSS処理した動物に似たDAIを示し(図3a)、サルモネラ菌単独の条件で見られた指標をはるかに上回った。このような大腸炎予防効果は、ラミナリンをマウスに投与すると損なわれた(Fig.3a)。また、大腸炎の「臨床的」進行は、Nancy組織学的スコア(図3c)に従って、固有層における好中球浸潤を定量化し(図3b)、体重減少(補足図1a)、血清IL-6、CRP、リポポリサッカライド(LPS)(補足図1b)の測定により確認された。サルモネラ-IgA投与マウスの血中LPSの高値は、IgAによる腸管上皮を介したサルモネラの逆輸送を反映している。このことは、先に述べたように、我々の実験条件下では、Sal4 IgAがサルモネラを中和できないことを示していると思われる35。この点を確認するために、SIgASal4結合後のSalmonella Typhimuriumの凝集を測定した35。SIgA結合後のSalmonellaの凝集体の有意な増加はin vitroでは観察されなかった(補足図1c)。凝集体が存在しないことから、我々の実験条件下では、Sal4 IgAが非中和的な性質を持つことが確認された。このことは、これらの凝集体はin vivoでのみ形成可能であり、IgAの逆輸入能力を変化させないことを示している可能性がある。

図3
図3
SIgA-サルモネラ菌はサルモネラ菌誘発性大腸炎を増幅させる。
ラミナリンを含まないSIgA-Salmonella処理マウスを分離し、プロットし、同腹のWTとNod2KOマウスを比較して有意に強調した(Supplementary Fig.1d)。SIgA-Salmonella投与後5日目のDAIが有意に異なることから、SIgA-Salmonella輸送におけるNod2の役割が明確に確認された。このことは、NOD2 KOマウスとWTマウスにおいて、SIgAを結合したサルモネラ-GFPをPPを含む結紮腸管ループに投与した場合にも確認された(補足図1e)。また、Dectin-1 KOマウスを用い、飲料水にラミナリンを添加してDectin-1をブロックした結果も同様であり(補足図1f)、これまでの報告34と整合的であった。このように、SIgA逆転写はNOD2を介した病原体の輸送の亢進によって大腸炎の誘発に関与しているようである。
NOD2はDectin-1とSiglec-5の発現を調節する
マウス腸管では、上皮を通過する選択的なIgA逆輸送は、M細胞上のDectin-1およびそれより少ない程度のSiglec-5の発現に依存していることが示されている19。IgAの逆トランスキュトーシスは、ヒト偏極Caco-2細胞とM様細胞からなるFAEのin vitroモデルで再現することが可能である。漿液性高分子IgAが偏光上皮を通過して分泌液に移行するには、高分子Igレセプターと、EEA-1, Rab-5, Rab-9, Rab-11, Rab-17, Rab-25 など進化的によく保存されている多数の細胞内タンパク質が必要である。レトロトランスサイトーシス経路における小胞輸送の制御は不明であるため、NOD2が2つの受容体のどちらか、あるいはオルガネラ特異的とされるタンパク質の発現を微調整することに何らかの寄与をしているかどうかを明らかにすることが重要であると考えた。
NOD2が関与している可能性のあるタンパク質の性質を調べるために、我々はFAEのin vitroモデルを活用した。M様細胞の転換がない場合、平板なCaco-2細胞偏光単層(モノカルチャー)は、レポーターIgA-ルシフェラーゼ融合タンパク質(IgA-Luc)の弱いレトロトランスシトシスを可能にし、以前のデータ19と一致している。このバックグラウンドレベルは、Fig. 4aに示すように、細胞外および細胞内タンパク質を選択的に標的とするsiRNAでトランスフェクションした後も影響を受けなかった。偏光単層膜にM様細胞が点在する場合(共培養)、IgA-LucのSIgA逆転写は4倍に増加した(図4a、コントロールとランダムノンターゲッティングオリゴのレーン)。EEA-1、Rab-5、Rab-17、そしてDectin-1シグナル経路に関与するSYKとTAK1タンパク質をターゲティングすると、SIgA-Lucの輸送がコントロールと比較して3倍減少した(図4a)。この減少は、陽性対照として用いたDectin-1やSiglec-5の標的化によってもたらされたものと比べても遜色のないものであった。NOD2 siRNAで処理した細胞におけるIgA輸送の有意な2倍の増加、およびMDP-PAM処理後の有意な3倍の減少は、トランスサイトーシスのプロセスにおけるNOD2の関与を確認し、FAEモデルを通じて得られた結果を間接的に検証する(図4a)。ウェスタンブロット(補足図2a)または定量RT-PCRは、MDP/PAM処理後のmRNAレベルの低下とその予想される増加を関連付けるために実施された(補足図2b)。追加の対照実験では、標的タンパク質のレベルの低下と単層完全性(TEER)の両方を、siRNAトランスフェクション後に系統的にモニターした(補足図2c)。コントロール、ノックダウン、刺激細胞の間に有意な変化は観察されなかった。ZO-1検出を用いたタイトジャンクションの染色により、siRNAトランスフェクション後の単層インテグリティが確認された(補足図2d)。最後に、Rab-5経路を使用することが知られているコレラ毒素(CT)の逆輸送36を、単培養または共培養条件でのsiRNAノックダウンの有効性をテストするために、正の頂膜-底膜輸送コントロールとして使用した(補足図2e)。Rab-5 siRNAノックダウン後,我々の倒立in vitroモデルにおいてCT輸送が有意に減少し,CT輸送におけるRab-5の役割とsiRNAノックダウンの有効性が確認された.
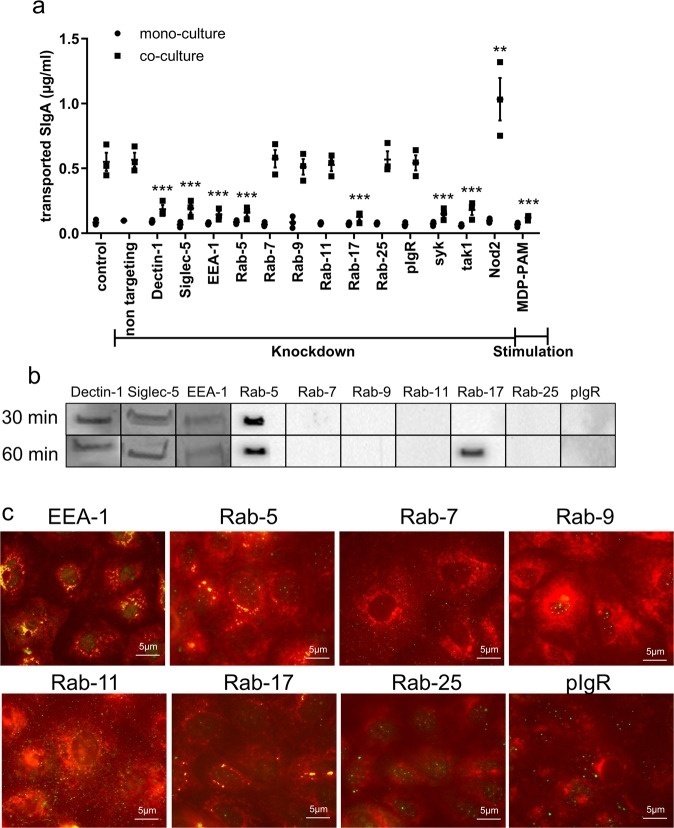
図4
図4
タンパク質阻害または刺激後のIgA逆輸送。
EEA-1、Rab-5、Rab-17、Dectin-1、Siglec-5がIgA逆転輸送のキーパートナーであるかどうかを確認するために、FAEのin vitroモデルでIgA2を頂部に30または60分間添加し、IgA2関連タンパク質複合体をプロテインM-アガロースビーズで免疫沈降し、回収した。IgA2とEEA-1, Rab-5, Rab-17, Dectin-1, Siglec-5との結合は、特異抗体による免疫検出により明らかになった(図4b)。IgA+/EEA-1+, IgA+/Rab-5+, IgA+/Rab-17+の特異的な共局在も免疫蛍光法で確認された。Rab-7、Rab-9、Rab-11、Rab-25、pIgRとIgAとの共局在は観察されなかった(図4c)。
次に、SIgA逆転写に伴うタンパク質発現の調節におけるNOD2の役割について検討した。M様細胞を含むin vitroモデル(共培養)、または含まない(単培養)をそのまま、またはsiRNAによるNOD2ノックダウン後に使用した。全細胞溶解液からタンパク質を回収し、その相対量をウェスタンブロットで評価した(Fig. 5a)。Dectin-1およびSiglec-5の発現は、NOD2ノックダウン後に有意に増加したが、試験したエンドソームタンパク質の分析では関連する変化が観察されなかった。MDP-PAM処理により、2つのIgA受容体の発現が減少した(図5b)。フローサイトメトリーで試験したGP2+ M様細胞におけるDectin-1およびSiglec-5の発現を特に検討すると、腸球表現型の未変換細胞と比較して、NOD2ノックダウン細胞で生じたいずれかの受容体の一貫した3倍増が確認された(図5c)。図5bのデータを支持するように、MDP-PAM処理は、いずれの受容体の発現にも有意な変化をもたらさなかった。Dectin-1および/またはSiglec-5の発現は、腸管細胞上では検出されていない。この観察はNOD2 KOマウスでも確認され、WTマウスと比較してPP M細胞でDectin-1の発現が増加している(図5d)。最後に、粘膜IgA経路の他の段階、例えば産生におけるNOD2の関与について調べる。図5eは、NOD2KOマウスと同腹のWTマウスとの間で血清または糞便中に観察されるIgA濃度に有意な差がないことを明確に示している。これらのデータを総合すると、M様細胞におけるNOD2が、Dectin-1およびSiglec-5を介した、上皮を模倣したIgAの円滑な逆行輸送に関与するプレーヤーとして、もっともらしく示唆される。
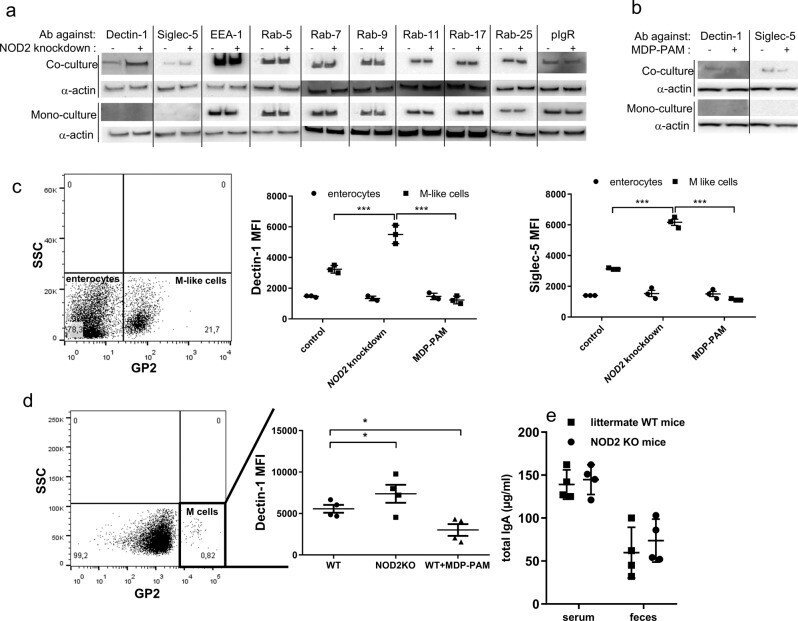
図5.
図5.
NOD2はDectin-1およびSiglec-5受容体の発現を調節している。
考察
これまでのところ、下流のNOD2シグナル伝達に関する機能喪失多型とCDの発症に関与するメカニズムはほとんどわかっていない。一般的に認識されている知見は、NOD2の欠損が構成的に弱い炎症反応をもたらし、それが腸内細菌量の増加を招き、時間と共にCD8,37で観察される慢性腸炎に至るというものである。本論文では、CD患者で観察される粘膜炎症が、M細胞を通じて内腔からPPに存在する免疫細胞にIgA-細菌複合体を輸送することの増加による可能性があることを証明した。まず、NOD2が変異しているか欠損している場合、ヒト(図1)およびマウス(図2)のM細胞を通してIgAの逆トランスサイトーシスが著しく増加することを見いだした。定常状態では、NOD2はM細胞を介したIgA逆行性輸送をダウンレギュレートしているようである。CDや大腸炎モデルマウスでは、NOD2が欠損しているとIgA-細菌複合体の輸送が増加し、粘膜の炎症が誘発される可能性がある。NOD2遺伝子の多型がCDの主要なリスクファクターであることはよく知られている。しかし、このような機能喪失がどのようにCDへの感受性を高めることになるのか、分子的な説明はまだ不明である。Hedlら38 は、NOD2シグナルがmTOR経路を活性化し、抗炎症メディエーターのアップレギュレーションと同時に炎症性サイトカインのダウンレギュレーションを誘導することを明らかにした。これらのデータは、NOD2が腸内細菌叢に対する自然免疫応答を調節しているという考えを支持し、したがって、このような調節の欠如がCDに対する感受性の上昇につながることを示唆している。
Dectin-1 KOマウスと同腹のWTマウスでは、よく知られたサルモネラ大腸炎モデルを用いて、慢性大腸炎の病態におけるIgA逆転写の役割が明らかにされた39,40。Dectin-1シグナルは、常在乳酸菌を介した大腸制御性T細胞の制御により、腸の炎症を制御していることが報告されている34. IgA-細菌複合体がDectin-1受容体19を介してM細胞を介して輸送されると腸管炎症が引き起こされるようであり、M細胞の多さと慢性腸管炎症にはある程度の相関があることが示唆される。Bennetら41は、dextran sodium sulfateとCitrobacter rodentiumの両モデル大腸炎において、大腸上皮の炎症のピーク時にPP M細胞の数が有意に増加することを見いだした。KOマウスを用いて、NOD2がIgA逆転写の免疫制御因子として働いていることを証明した。実際、サルモネラ-IgA複合体を投与したNOD2 KOマウスは、同腹のWTマウスと比較して、炎症の重症度が増加することが示された。この観察は、NOD2がサルモネラ大腸炎時の炎症を調節し、粘膜組織からの細菌の効率的な除去を仲介することを示す研究によって支持されている42,43。
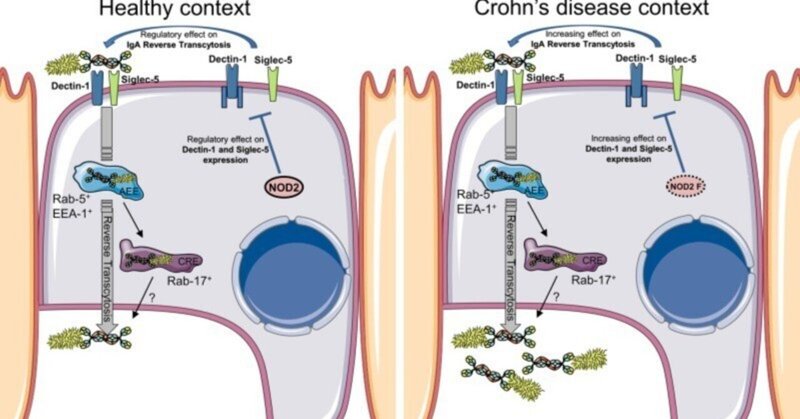
次に、NOD2がIgAの逆行性輸送を調節するメカニズムを説明する分子機構を調べた。M様細胞を含むin vitroモデルにおいて、特異的なsiRNAノックダウン法を用いて、NOD2がIgA輸送の調節因子として関与していることが確認された。また、腸管細胞を介したIgA輸送に関与することが既に知られているエンドソームタンパク質の役割についても検討した44。その結果、M細胞におけるIgAの逆輸送は、上皮性IgAの輸送と同様に、EEA-1, Rab-5, Rab-17エンドソームタンパク質を介するらしいことが判明した。また、Dectin-1とSiglec-5がIgA逆輸送に関与していることも確認された19。NOD2はまた、MHCの交差提示29、オートファジー誘導、細胞内細菌感染に対する抵抗性に影響を与えることが示されている45,46。このように、NOD2 の活性化は、主にその急性シグナル伝達作用でよく知られているが、生体内では様々な細胞変化を引き起こし、免疫恒常性にも重要である可能性が高い。Dectin-1シグナル経路のSYKおよびTAK1タンパク質も、IgAの逆転写の阻害に関与している。NOD2 がロイシンリッチリピート (LRR) 領域を介して TAK1 と相互作用し、TAK1 による NF-κB 活性化に対して抑制効果を発揮していることが発表されている47。このことから、NOD2はTAK1によるNF-κBの活性化を抑制し、その結果、IgA輸送のダウンレギュレーションを引き起こすことが示唆された。本研究では、M細胞においてNOD2をノックダウンするとDectin-1およびSiglec-5の発現が有意に減少することが観察されており、NOD2がSIgAに対するこれら2つの受容体の発現制御に寄与していることが示唆されている(図6)。腸疾患のよりグローバルな文脈で興味深いことに、NOD2は壊死性腸炎におけるTLR248およびTLR4の負のレギュレータとして同定されている49。
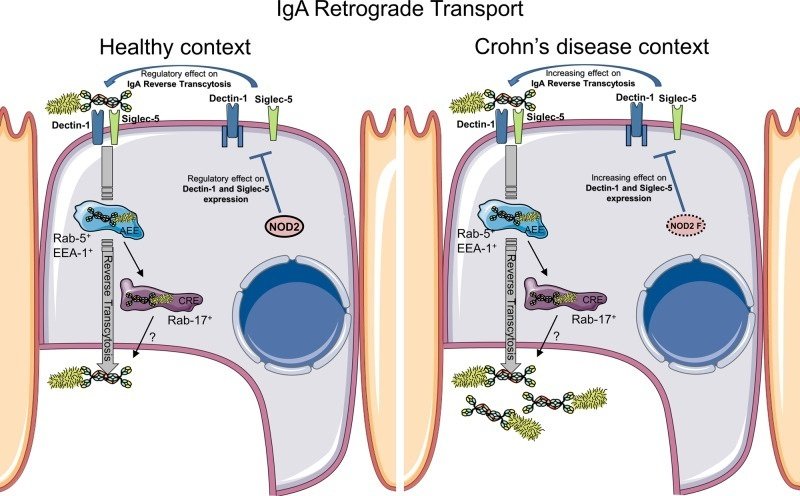
図6
図6
M細胞を介したIgA-病原体複合体の逆行性輸送は、健常者と比較してCD患者で増加している。
CDの病因には、遺伝的要因、環境要因、微生物要因が複合しているため、我々の知見は慎重に解釈されるべきである37。したがって、本研究で同定されたSIgA依存的な経路は、CDで観察される粘膜炎症を最終的に引き起こす、あるいは永続させる他のメカニズムの一つである可能性が高いことを強調しておくのが妥当であろう。いずれにせよ、我々のデータは、NOD2遺伝子型が現在最も強力なCDの経過に関連する遺伝子マーカーであることを確認し、知識を広めるものである。Fig. 1では、研究対象集団のNOD2変異(R702W、1007 fs、R702W/G908R)を比較したが、PPにおけるIgA陽性細胞分布に差は認められなかった。これらの結果は、最もリスクの高い遺伝子型の浸透度が低いという強い証拠を示したHugotらの研究とも一致する。彼らは、研究対象集団における突然変異頻度と疾患発生率との間に明確な関係はなく、健常対照者における二重投与突然変異体保有者の有意な欠損も見いださなかった50。しかし、別の研究では、NOD2変異が1つあると合併症のリスクが8%増加し、2つあると41%増加することが予測されている51。とはいえ、これら2つの研究は、CARD15/NOD2が他の未知のリスク補因子と相互作用していることを確認している。
腸の微生物コロニー形成に反応して生成された抗体は、抗体媒介免疫選択(AMIS)と呼ばれるプロセスを通して、宿主の健康に役立つように微生物叢の構成を形成するという説がある52。免疫選択とは、免疫系を介した宿主生物内の自然淘汰のプロセスであり、微生物の適応度、ひいては微生物の生態と進化に影響を与えるものである。常在菌のかなりの部分は、IgAで強く覆われている26,53,54。しかし、IgAで被覆された画分と被覆されていない画分の間には、細菌種が大きく重複していることから、このような被覆は非特異的であると思われる。このような条件下では、細菌の多様性は著しく減少した。このように、IgAの親和性成熟度の低下は、多様性の低下と偏った微生物相、そして天然のIgAによる細菌の豊富なコーティングと関連していると思われる。最近の論文では、さらに進んで、ヒトSIgMによって認識された細菌は、SIgAによって二重にコーティングされ、IgAのみコーティングされた細菌やコーティングされていない細菌と比較して、豊かさと多様性が増加したと述べている55。このような細菌選択機構は、CD発症の原因物質、あるいはIgA逆輸送が関与する他のIgA系疾患の原因物質である可能性がある。実際、CD患者には、IgA腎症やセリアック病と共通するいくつかの特徴がある。これらの疾患では、小腸粘膜透過性の亢進が証明されている56,57。IgA腎症では、食物や細菌のAgが流入し、免疫複合体の形成や沈着が起こる可能性がある。セリアック病では、無傷のペプチドの逆行性輸送、特にトランスフェリン受容体によるSIgAの先端から基底への移動の説明として、パラおよびトランスセル経路の変化が提唱されている58。
慢性腸炎を引き起こす分子メカニズムの理解が深まったことにより、過去20年間に、現在のIBDの管理に大きな影響を与える治療戦略が生み出されました59,60。しかし、抗TNF療法を中心とした目覚しい成功にもかかわらず、すべての患者がこの薬に反応するわけではなく、反応した患者の約3分の1は短期間で再発します。そのため、IBDの治療分子を同定するためのさらなる研究が必要です。本研究では、IgA逆輸送がM細胞を介したIgA-細菌免疫複合体のPP輸送に作用し、CDの炎症促進に関与していることを明らかにした。CDの急性期におけるIgA逆輸送の阻害を目指した治療戦略は、新しい効率的な免疫療法戦略を設計するために検討されるかもしれない。
研究方法
ヒトPPのex vivoでの免疫標識
同意を得たCD患者、または通常の診断目的で下部内視鏡検査を受けた正常な腸粘膜を持つ健常者から、回腸末端からの生検標本を2つ採取した。生検片は3%パラホルムアルデヒドで2時間固定し、OCT包埋液に入れた後、ライカクライオスタットモデルCM1950を用いて凍結採取した。7マイクロメートルの切片をUltra+ Superfrost顕微鏡用スライドに取り込み、M細胞を染色した。スライドはPBSで洗浄し、残存するOCT包埋液を除去した後、5%FBS含有PBSで30分間室温でブロッキングした。GFP-IgA2 (Invivogen), 抗ヒト PE-GP2 mAb (MBL), 抗ヒト PE-DC-SIGN mAb (ThermoFisher scientific), マウス抗 IgA 分泌成分 Ab (Abcam) を組み合わせ、20μg/mlに希釈したヤギ抗マウス PE-IgG (Abcam) で2時間室温で免疫標識化した。その後、スライドをPBSで洗浄し、風乾し、Fluoprep(Biomérieux)でマウントした。スライドは、免疫蛍光顕微鏡(Eclipse, Nikon)で観察した。
NOD2多型PCRのためのオリゴヌクレオチド配列
NOD2 多型61 (R702W, G908R, FS1007insC) のPCRは、市販の抽出キット (QIAamp DNA mini kit, Qiagen, Hilden, Deutschland) を用いてヒト生検から抽出したDNAを対象に実施した。特定の変異を同定するために、以下のプライマーを使用した。R702W:フォワード、5′-GAA TTC CTT CAC ATC ACT TTC CAG T -3′およびリバース、5′- GTC AAC TTG AGG TGC CCA ACA TT-3′;G908R: forward, 5′-CCC AGC TCC TCC CTC TTC-3′ and reverse, 5′-AAG TCT GTA ATG TAA AGC CAC-3′; FS1007insC: forward, 5′-CTG AGC CTT TGT TGA TGA GC-3′ and reverse, 5′- TCT TCA ACCACA TCC CCA TT-3′. PCR産物をPCR purification kit(Qiagen)で精製してからシークエンス(Eurofins)した。
マウス
NOD2 KOマウスはGabriel Nunez (University of Michigan, USA)から入手した。Dectin-1 KOマウスはGordon D. Brown (University of Aberdeen, UK)から入手した。NOD2 KOマウス62およびDectin-1 KOマウス63は、すでに述べたとおりである。リッターメイトマウスはNod2-heterozygous交配から得た。すべてのマウスは、PLEXAN (Platform for Experiments and Analysis, Faculty of Medicine, Université de Saint-Etienne, France)で生まれ、ホストされ、これは感染セクターP2を有する通常の動物施設である。すべてのマウスは同じ条件(温度20℃、湿度50%、12時間明暗サイクル、餌と水への無制限アクセス)で共同飼育され、2-4ヶ月齢の雌であった。実験プロトコルは、フランス研究省、地方倫理委員会(CEEA-Loire)、PLEXANの動物福祉委員会(契約番号2017011315316714_v4)から承認されている。
結紮ループへのSIgA投与
回腸ループ調製のために、マウスを一晩飢えさせ、ケタミンとキシラジンの混合物(それぞれ100および10mg/kg動物体重)の腹腔内注射によって麻酔し、外科手術の間、37℃で保温した。PBSで希釈したSIgA-Cy3の1mg/ml溶液、またはSalmonella(GFP)-SIgASal4免疫複合体(マウス大腸炎モデルを参照)、BSA(Sigma)、またはマウスIgG(抗ヒトTAK1 mAb(R&D System))100μリットルをPPを含む1.5cm回腸ループ内に投与した。Salmonella Enterica subsp. Enterica serovar Typhimurium GFPはATCCから入手した(14028GFP™)。実験終了後、マウスを頸椎脱臼で犠牲にし、腸の一部を取り出し、PBSで広範囲に洗浄し、3%パラホルムアルデヒドで2時間固定し、最適切断組織(OCT)包埋液に包含させた。7 ミクロメートルの切片(Leica cryostat model CM1950, Leica Microsystems)を Ultra+ superfrost microscope slides (VWR International)で撮影した.スライドは免疫蛍光顕微鏡(Eclipse, Nikon)で観察した。プロトコルは、動物実験に関する地域倫理委員会CREEAの指導に従った(許可番号:No.69387487)。
MDP-PAMで刺激されたマウスには、SIgA-Cy3投与の2時間前に、結紮ループにMDP-PAMを投与した。
マウスSIgAレトロトランスシトシスを測定するために、重合性IgA Ab(S. flexneri血清型5a LPS64に特異的なクローンIgAC5)を以前に記載したように入手した65。精製された遊離ヒトSCは、Chinese Hamster Ovary細胞で生産された66。SIgAは、PBSのpIgA分子と2倍過剰のヒトSCを、先に述べた条件に従って、室温で2時間混合することにより得た67。Cy3-SIgA複合体はFluoroLink mAb Cy3 labeling kit (Amersham Biosciences) を用いてインドカルボシアニン (Cy3) とコンジュゲートすることにより得られた。
IgA/糞便微生物相相互作用の研究 糞便IgAが腸内微生物相と結合する能力は、ウェスタンブロットにより測定されている33。溶菌した細菌をウェスタンブロットアッセイの標的抗原として用いた。一次抗体としてWTマウスまたはNod2KOマウスの血清または糞便上清を、二次抗体として抗IgA-HRPを使用した。この実験は、1群4匹のマウスで繰り返した。また、既に糞便中の細菌と結合しているIgAの量をフローサイトメトリーにより定量した。WTマウスとNod2KOマウスの糞便上清を抗IgA-FITCで染色し、IgA-細菌でのMFIを算出した。この実験は、1群あたり4匹のマウスを用いて解析された。
p24-SIgAのin vivoデリバリー
クレードB株(Px Therapeutics、フランス)からのHIV-1 p24キャプシドタンパク質を、Sulfo-KMUS異種機能性架橋剤(Thermo Scientific)を使用してポリマーSIgAC5と共有結合させた。共有結合複合体形成は、ポリクローナル抗HIV-1血清によるウェスタンブロットで確認し、抗ヒトIgG HRP標識二次抗体(Amersham)で明らかにした。マウスの経口免疫は、イソフルアン(Halocarbon Laboratories)による光麻酔下で、ポリエチレンチューブを用いたオロガストリック挿管により行った。チューブは門歯から1.8cmの距離に固定された状態で導入された。予防接種は、100mlを1週間間隔で3回投与するものであった。同腹のWT(n = 5)、およびNod2 KO(n = 5)マウスに、1回につき100 mgのHIVp24-SIgA、またはSIgA単独、またはHIVp24単独を投与して免疫した。
HIVp24特異的IgGおよびIgA Absの測定
最後の免疫の1週間後に血清および糞便を回収した。各動物から新鮮な糞を5回採取した。糞はHalt Protease Inhibitor Cocktail(Thermo Scientific)とインキュベートし、16000×gで遠心分離し、使用するまで-20℃に保存した。HIVp24に対する特異的Absは、定量ELISA法を用いて測定した。Maxisorp 96ウェルプレートに、50μlのHIVp24 Ag溶液(滅菌PBS中5μg/ml)または50μlの抗マウスIgカッパおよびラムダ軽鎖特異的mAbs(Serotec)の等しい混合物の1/3200希釈液をコーティングし、4℃でO/Nインキュベートした。標準品として、マウスIgGまたはIgA免疫グロブリン(Igs)(Southern Biotech社製)を使用した。結合または捕捉されたIgsはHRP結合ヤギ抗マウス(IgG)とのインキュベーションにより検出し、IgAはビオチン化ヤギ抗マウスIgA(Southern Biotech)およびストレプトアビジン-HRP(Amersham)により検出した。結果は、濃度±SEMの平均値で示した。
サイトカインとケモカイン
複数のサイトカイン・ケモカインの評価は、Luminex 100 instrument (Luminex Corporation, Austin, TX, USA) と Bio-Plex mouse cytokine 23-plex panel および Bio-Plex mouse cytokine Th17 panel B 8-Plex Group III (Bio-Rad, Berkeley, CA, USA) を併用して実施された。生物学的液体は、最後の免疫の1週間後に回収した。サイトカインおよびケモカインの濃度は、3反復の平均値として測定した。
マウス大腸炎モデル
毒性ストレプトマイシン耐性Salmonella Enterica serovar Typhimurium株SL1344を90 μg/mlのストレプトマイシンを添加したLB(LB Broth, Sigma)中で培養した(LB-St)。感染の前日、SL1344のコロニーを3mlのLB-St中で37℃、100rpmで一晩培養した。 サルモネラ ティフィムリウム表面糖鎖に特異的なマウスIgASal4を前述のように製造し、SIgA-サルモネラ複合体によるマウス治療に使用した。他の実験では、飲料水中の5%デキストラン硫酸ナトリウム溶液を7日間自由摂取させることによっても大腸炎を誘発させた68。体重とDAIは毎日モニターした。
NOD2 KO(n = 5)、Dectin-1 KO(n = 5)、および同腹のWT(n = 5)マウスに、イソフルラン(Halocarbon Laboratories)による軽い麻酔下でポリエチレンチューブによる胃管挿入により100 μl PBS中のサルモネラ-SIgASal4複合体またはサルモネラ単独(すなわち、106 CFU/マウス)のいずれかを投与した。正常な微生物叢の中でのSIgA逆転写の役割を測定したいので、マウスにはストレプトマイシンの前処理を行わなかった。Salmonella SL1344の感染性および播種性を、異なる用量で試験した。1×106 CFU/マウスの用量は、致死量ではないが、強い炎症を誘発するため使用した。
NOD2 KO (n = 5), Dectin-1 KO (n = 5), および同腹のWT (n = 5) マウスに、大腸炎誘発の3日前から飲料水中に5%のラミナリンを添加し、大腸炎の誘発を比較した34.
大腸炎重症度の評価
実験期間中、大腸炎の臨床的進行を評価するために、DAIスコアを毎日モニターした69。DAI スコアは、初期体重と比較した体重減少、便の硬さ、直腸出血を含む読み上げ値を組み合わせたものである。スコアは以下のように定義された:体重減少。体重減少:0(減少なし)、1(1-5%)、2(5-10%)、3(10-20%)、4(20%以上)、便の硬さ:0(正常)、2(緩い便)、4(下痢)、直腸出血。直腸出血:0(血液なし)、2(目視によるペレット状出血)、4(肉眼的出血、肛門周囲の血液)。実験終点は、マウスが脱水と下痢を伴い初期体重の20%以上の体重減少を示し、イソフルラン吸入後、頸椎脱臼で安楽死させなければならなくなった時点とした。
大腸炎の重症度を反映する組織学的損傷を評価するために、大腸の小片(0.5cm)を切断し、OCTに埋め込み、液体窒素で冷却したイソペンタン中で凍結させた。7マイクロメートルの切片を既報の方法で作製し、既報の手順でヘマトキシリン/エオジン染色を行った70。好中球浸潤のスコアリングは、盲目の病理学者によって評価されているNancy組織学的スコアを用いて行った。
マウスは、処置の5日後に眼窩後神経叢から出血させた。血清中のIL-6、LPS、およびCRPの存在を、ELISAによって評価した(マウスIL-6 ELISA MAX、Biolegend、San Diego、CA;マウスリポポリサッカライドELISAキット、ELISAgenie、London、UK;マウスC-反応タンパク質/CRP DuoSet ELISA、R&D system、USA)。
IgA-サルモネラ凝集アッセイ
IgASal4 によって形成されたサルモネラ凝集体は、経口チャレンジの前に定量化されている35。IgASal4抗体によるS. typhimuriumのin vitro凝集を調べるため、ハイブリドーマ培養上清(1μg)を0.1mlの細菌一晩培養に加え、丸底ELISAプレートでインキュベートした。非関連IgAハイブリドーマ上清(抗V. cholera71)または新鮮な培養液をコントロールとして使用した。凝集は、23℃で3時間後にフローサイトメトリーで測定した。
細胞培養
ヒト腸管細胞株 Caco-2 (clone 1)(Dr.MariaRescigno,大学より入手)を用いた。Maria Rescigno, University of Milan-Bicocca, Milan, Italy)72は、10%(v/v)牛胎児血清(FBS, Thermo-Fisher)、1%(v/v)非必須アミノ酸(PAA)および1%(v/v)ペニシリン・ストラプトマイシン(PAA)添加のDMEM(完全DMEM)と呼ばれる)で培養された。ヒトバーキットリンパ腫細胞株Raji B(American Type Culture Collection)、10%(v/v)FBS、1%(v/v)非必須アミノ酸、1%(v/v)L-グルタミンおよび1%(v/v)ペニシリン-ストレプトマイシンを補足したRPMI1640で培養した。
ヒト FAE の倒立型 in vitro モデル19,73
倒立トランスウェルポリカーボネートインサート(12ウェル、孔径3.0μm、コーニング社製)に、純DMEMで最終タンパク質濃度100μg/mLに調製した基底膜マトリックスMatrigel™(BD Biosciences)を室温で1時間塗布した。コーティング液を除去し、300μlのDMEMでインサートを反転洗浄した。300μLの完全DMEMに懸濁させたCaco-2細胞(3×105)を下側のインサート側に播種し、一晩培養を行った。その後、インサートを反転させ、12ウェル培養皿に入れ、9日間保持した。Raji B細胞(5×105)を完全DMEMに再懸濁した後、Caco-2細胞の基底側コンパートメントに添加し、共培養を5日間維持した。Caco-2細胞の単培養体は、上記と同様に培養したが、Raji B細胞を逆添加しなかったものをコントロールとして用いた。極性共培養および単培養の確立は、Millicell-ERSオームメーター(Millipore)に接続したEndohmTM組織抵抗チャンバー(Endohm-12、World Precision Instruments)を用いたTEERの測定により制御した。培地のみのTEERの平均値(9Ω/cm2)は、各測定値から差し引かれた。ランダムなサンプルにおいて、タイトジャンクションのバリアー完全性は、zonula occludens-1 (ZO-1) immunolabeling74によって確認された。トランスサイトーシス解析のため、6ウェルプレートでインキュベートする前にインサートを反転させ、培地リザーバーとして機能するシリコンチューブ(14(高さ)×20(直径)mm、Labomoderne)を、細胞単層の基底側極に面する表面に配置した。
小干渉(si)RNAによる遺伝子阻害
FAEの倒立in vitroモデルの細胞は、製造者が提供する手順に従って、Silentfect試薬(Bio-Rad)を用いてON-TARGETplus SMARTpool siRNA(Dharmacon)を最終濃度5nMでトランスフェクションされた。遺伝子ターゲティングのための参照番号は以下の通りである。Dectin-1: L-021476-00-0005; Siglec-5: L-019522-02-0005; EEA-1: L-004012-00-0005; pIgR: L-017729-00-0005; Rab-5: L-004009-00-0005; Rab-7: L-010388-00-0005; Rab-9: L-004177-00-0005; Rab-11: L-004726-00-0005; Rab-25.D: D: L-01076-00-0005; R: L-005729-00-00006; R: L: L-005728-00-00-002; R:.Dは, D: L: L-005727-00-000007; R: L-00571-00-00-000008 L-010366-00-0005、Syk: L-003176-00-0005; NOD2: L-003464-00-0005。TAK-1は、配列番号6317S(Cell Signaling Technology)を用いることによりサイレンシングした。
MDP - Pam3Cys(MDP-PAM)による処理
NOD2を特異的に活性化するために、FAEの逆インビトロモデルを1μg/ml MDPおよび1μg/ml Pam3Cys-Ser-(Lys)4 hydrochloride (Invivogen) に24時間曝露した。
免疫沈降およびウェスタンブロット
10μgのIgA2(Invivogen)を、FAEのin vitroモデルの頂部コンパートメントに添加した。そして、細胞を37℃で30分または60分インキュベートした。PBSで2回洗浄した後、Mammalian Protein Extraction Reagent (Thermo Scientific)を用いて細胞を溶解させた。ライセートを遠心分離によってクリアし、タンパク質濃度を5μg/mlにした。IgA2(および結合タンパク質)を、タンパク質M-アガロースビーズ(Invivogen)を用いた免疫沈降によって濃縮した。洗浄後、0.1mグリシン(pH3.0)で溶出を行い、1Mトリス緩衝液(pH8.0)で直ちに中和した。溶出物をSDS-PAGEし、hybond ECL nitrocellulose membrane (GE Healthcare Life Science) にトランスファーした。標的タンパク質の免疫検出は、以下のようなAbs/抗血清を用いて行った。標的タンパク質の免疫検出は、ヤギ抗ヒトDectin-1/CLEC 7A血清、抗ヒトCD170 (Siglec-5) mAb (mouse IgG1, Clone #194128) 、羊抗ヒトEEA-1血清、抗ヒトpIgR mAb (Mouse IgG3, Clone # 825724) 、抗ヒト SYK mAb (mouse IgG1, Clone # 720402) 、反ヒト TAK1 mAb (mouse IgG1.Clone #491840)、を含むAbs/抗血清を使用して行った。Clone # 491840)はR&D Systemから購入し、ウサギ抗ヒトRab-5血清、抗ヒトRab-7 mAb(マウスIgG2b、Clone # Rab-7-117)、抗ヒトRab-9 mAb(マウスIgG1、Clone # Mab9)、ウサギ抗ヒトRab-11血清、反ヒト Rab-25 mAb(ウサギ IgG、Clone EPR18353) Abcam から取得した。適切なHRP結合二次Absを使用し、"Clarity Western ECL Substrate" (Biorad)で検出した。
免疫蛍光染色 10マイクログラムのIgA2(Invivogen)を、FAEのin vitroモデルの頂部コンパートメントに加えた。細胞は37℃で60分間インキュベートされた。インサートをHBSSで洗浄して残留培地を除去し、4%パラホルムアルデヒドで30分間インキュベートし、0.1%Triton X-100(Sigma-Aldrich)で透過化し、5%FBS含有PBSで室温で15分間ブロックした。免疫標識は、前のセクションで述べた同じ抗ラブと抗EEA-1 mAbsの組み合わせを使用して行った。各試薬は1/100に希釈し、室温で2時間インキュベートした。PEで標識した対応する二次抗体を、室温で1時間インキュベートした。2回の洗浄後、インサートを風乾し、Fluoprep (BioMerieux) でマウントし、免疫蛍光顕微鏡 (Eclipse Ti, Nikon) で観察した。
NOD2 RT-qPCR75
TRIZOL(Invitrogen) を用いて Total RNA を抽出した。PrimeScript RT reagent kit(TaKaRa Biotechnology, Dalian, PRC)を用いて逆転写を行った。GAPDH および NOD2 遺伝子産物の増幅には SYBR Premix Ex Taq™ II kit (TaKaRa Biotechnology) を使用した。使用したオリゴヌクレオチドプライマーは以下の通りである。NOD2:フォワード、5′-CTG AAG AAT GCC CGC AAG GT-3′およびリバース、5′-GTC TCT TG AGC AGG CGG ATG-3′;GAPDH: フォワード、5′-TGC ACC AAC TGC TTA GC-3′ およびリバース、 5′- GGC ATG GAC TGT GGT CAT GAG-3′. 相対的な遺伝子発現を解析するために、二重標準曲線法を用いた76。
IgA RT実験
siRNAによる48時間の遺伝子ノックダウンまたは24時間のMDP-PAM刺激の後、ルシフェラーゼ(Luc)または初乳IgAと結合したAb10μgまたはV. cholerae由来のCT(Σ)1μgを37℃で90分間FAEのインビトロモデルの頂部側に添加した19.その後、底側溶液を回収し、Gaussia Luc Assay Kit(Biolux社)を用いて、メーカー提供の手順に従い、ルミノメーターによりレトロトランスシトーズしたAb-Lucの数を測定した。輸送された初乳IgAとCTは、それぞれビオチン化ヤギ抗ヒトIgA(Southern Biotech)およびビオチン化ウサギ抗CT pAb(Invitrogen)を用い、ストレプトアビジン-HRP(Amersham)を加えたELISA法により検出した。
統計解析
統計解析は、GraphPad SoftwareのInStatバージョン2.01を使用して行った。ノンパラメトリックなMann-Whitney U-testまたは一元配置分散分析に続いてBonferroni post hoc testを適宜使用した77,78. p値の有意限界は0.05とした(プロットでは*でマーク);**はp値≦0.01、***はp値≦0.005を表す。統計的に有意な群間差は、比較対象の列をつなぐバーで強調されている。
報告書の概要
研究デザインに関する詳細な情報は、この論文にリンクされているNature Research Reporting Summaryに掲載されています。
補足情報
補足情報(591K, pdf)
ピアレビューファイル(142K, pdf)
報告書サマリー(76K, pdf)
謝辞
N. Rochereauは、Sir Jules Thorn Charitable Trustからポスドク研究員として、その後Region Rhone-AlpesとANRS(フランス)からポスドク研究員として支援を受けています。S.P.の研究室はANRS、Sidaction、MSD Avenirから、B.C.の研究室はスイス科学研究財団からそれぞれ研究助成を受けている(助成番号3100-156806)。IFR143の技術プラットフォーム「Unité Hospitalo-Universitaire d'expérimentation animale」のスタッフには、サンプル分析でお世話になった。
ソースデータ
ソースデータ(4.4M, xlsx)
著者協力
N.R., E.M., R.G., B.C., F.J. が実験を実施した。N.R.はX.R.、B.C.、S.P.のサポートを得て原稿を執筆した。B.C.とS.P.はプロジェクトを監督した。
データの利用可能性
著者らは、本研究の結果を裏付けるすべてのデータが、本論文およびその補足情報ファイル内で利用可能であることを宣言する。ソースデータは本論文に添付されている。
利害関係
著者らは、競合する利益はないことを宣言した。
脚注
査読情報 Nature Communicationsは、この研究の査読に貢献したニコラス・マンティス氏と他の匿名査読者に感謝します。査読者の報告書はこちら。
出版社からのコメント Springer Natureは、出版された地図や所属機関に関する管轄権の主張に関して中立的な立場を維持しています。
補足情報
本論文の補足情報は、10.1038/s41467-020-20348-0に掲載されています。
論文情報
Nat Commun. 2021; 12: 261.
2021年1月11日オンライン公開 doi: 10.1038/s41467-020-20348-0
PMCID: PMC7801705
PMID: 33431850
Nicolas Rochereau,corresponding author1 Xavier Roblin,1 Eva Michaud,1 Rémi Gayet,1 Blandine Chanut,1 Fabienne Jospin,1 Blaise Corthésy,2 and Stéphane Paul1
1GIMAP/EA3064、リヨン大学、CIC 1408 Vaccinology、F42023 Saint-Etienne、France
2免疫・アレルギー部門の研究開発研究所、CHUV、Centre des Laboratoires d'Epalinges, 1066 Epalinges, Switzerland
Nicolas Rochereau, Email: rf.enneite-ts-vinu@uaerehcor.salocin.
corresponding authorCorresponding author.
Received 2019 May 20; Accepted 2020 Oct 23.
著作権 © The Author(s) 2021
オープンアクセス 本論文は、クリエイティブ・コモンズ 表示 4.0 国際ライセンスのもとで、原著者と出典に適切なクレジットを与え、クリエイティブ・コモンズのライセンスへのリンクを提供し、変更を加えたかどうかを示す限り、あらゆる媒体や形式での使用、共有、適応、配布、複製が許可されています。この記事に掲載されている画像やその他の第三者の素材は、素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれます。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法令上の規制で許可されていない場合、または許可された利用を超える場合には、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
Nature Communicationsの記事は、Nature Publishing Groupの好意によりここに提供されています。
参考文献
ファンデンエルセンLW、ポインツHC、ウェイリッチLS、ヤングW、フォーブス-ブロムEE. 腸内細菌叢の活用:炎症性疾患および感染性疾患に対する新たなフロンティア。Clin. Transl. Immunol. 2017;6:e125. doi: 10.1038/cti.2016.91. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
腸内環境の恒常性維持における自然免疫細胞および常在菌の機能. J. Biochem. 2016;159:141-149. doi: 10.1093/jb/mvv119. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Castro-Dopico T, et al. Anti-commensal IgG drives intestinal inflammation and type 17 immunity in ulcerative colitis. Immunity. 2019;50:1099-1114.e10. doi: 10.1016/j.immuni.2019.02.006. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
4.de Jong RJ, Ohnmacht C. Defining dysbiosis in inflammatory bowel disease.(炎症性腸疾患における腸内細菌の定義). Immunity. 2019;50:8-10. doi: 10.1016/j.immuni.2018.12.028. [PubMed] [CrossRef][Googleスカラー]をご参照ください。Parikh K, et al. Colonic epithelial cell diversity in health and inflammatory bowel disease(健康および炎症性腸疾患における大腸上皮細胞の多様性). Nature. 2019;567:49-55. doi: 10.1038/s41586-019-0992-y. [PubMed] [CrossRef][Googleスカラー]。
Dragasevic S, et al. 炎症性腸疾患の提示と発症に重要な遺伝的および環境的要因. Eur. J. Gastroenterol. Hepatol. 2017;29:909-915. doi: 10.1097/MEG.0000000000000877. [PubMed] [CrossRef][Googleスカラー]を参照。
Goethel A, et al. Nod2は、微生物の回復力と抗生物質曝露後の大腸炎に対する感受性に影響を与える。Mucosal Immunol. 2019;12:720-732. doi: 10.1038/s41385-018-0128-y. [PubMed] [CrossRef] [Google Scholar]を参照してください。
Ramanan D, Tang MS, Bowcutt R, Loke P, Cadwell K. Bacterial sensor Nod2 prevents the inflammation of the small intestine by restricting the commensal Bacteroides vulgatus.細菌センサーは、常在菌であるバクテロイデスの拡大を抑制することで小腸の炎症を防ぐ。Immunity. 2014;41:311-324. doi: 10.1016/j.immuni.2014.06.015. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Shawki A, McCole DF. 付着侵入型大腸菌による腸管上皮バリア機能不全のメカニズム. Cell. Mol. Gastroenterol. Hepatol. 2017;3:41-50. doi: 10.1016/j.jcmgh.2016.10.004. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Kennedy NA, et al.クローン病と消化器疾患のないコントロールにおけるNOD2バリアントが糞便微生物叢に与える影響. Inflamm. Bowel Dis. 2018;24:583-592. doi: 10.1093/ibd/izx061. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Bunker JJ, et al.天然の多反応性IgA抗体は腸内細菌叢を被覆する. Science. 2017;358:eaan6619. doi: 10.1126/science.aan6619. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Hansen, I. S., Baeten, D. L. P. & den Dunnen, J. The inflammatory function of human IgA. Cell. Mol. Life Sci.10.1007/s00018-018-2976-8 (2018). [PMC無料記事】【PubMed】。
Heineke MH, van Egmond M. Immunoglobulin A: magic bullet or Trojan horse? Eur. J. Clin. Invest. 2017;47:184-192. doi: 10.1111/eci.12716. [PubMed] [CrossRef][Googleスカラー]を参照。
Macpherson, A. J., Yilmaz, B., Limenitakis, J. P. & Ganal-Vonarburg, S. C. IgA function in relation to the intestinal microbiota. Annu. Rev. Immunol. 10.1146/annurev-immunol-042617-053238 (2018). [PubMed】をご参照ください。]
Melo-Gonzalez F, et al. 抗原提示ILC3は、大腸粘膜細菌に対するT細胞依存性IgA応答を制御する. J. Exp. Med. 2019;216:728-742. doi: 10.1084/jem.20180871. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Neumann C, et al. c-Maf依存的なTreg細胞の腸内TH17細胞およびIgAの制御は、宿主-微生物叢のホメオスタシスを確立している。Nat. Immunol. 2019;20:471-481. doi: 10.1038/s41590-019-0316-2. [PubMed] [CrossRef] [Google Scholar].
Hansen IS, et al. FcαRI共刺激は、解糖系リプログラミングによりヒト腸管CD103+樹状細胞を炎症性細胞に変換する。Nat. Commun. 2018;9:863. doi: 10.1038/s41467-018-03318-5. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
コルセシーB. 分泌型IgAの往復チケット:粘膜のホメオスタシスにおける役割?J. Immunol. Baltim. Md 1950. 2007;178:27-32. [PubMed][Google Scholar].
Rochereau N, et al. Dectin-1 Is essential for reverse transcytosis of glycosylated SIgA-antigen complexes by intestinal M cells.(デクチン-1は、腸管M細胞の糖鎖複合体の逆トランスシトーシスに必須である)。PLoS Biol.2013;11:e1001658.doi:10.1371/journal.pbio.1001658.PMC free article. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Rochereau, N. et al. Secretory IgA as a vaccine carrier for delivery of HIV antigen to M cells.(HIV抗原をM細胞に送達するためのワクチン担体としての分泌性IgA). Eur. J. Immunol. 10.1002/eji.201444816 (2014). [PubMed] (英語
Rochereau, N. et al. 局所樹状細胞を標的とした分泌性IgAによる鼻関連リンパ組織小葉細胞への抗原の送達は、防御免疫を与える。J. Allergy Clin. Immunol. 10.1016/j.jaci.2015.07.042 (2015). [PubMed】をご参照ください。]
Eom T, Kim YS, Choi CH, Sadowsky MJ, Unno T. Current understanding of microbiota- and dietary-therapies for treating inflammatory bowel disease(炎症性腸疾患を治療するための微生物療法と食事療法に関する現在の理解)。J. Microbiol. Seoul. Korea. 2018;56:189-198. [PubMed] [Google Scholar].
西田明彦、他:炎症性腸疾患の病態における腸内細菌叢. Clin. J. Gastroenterol. 2018;11:1-10. doi: 10.1007/s12328-017-0813-5. [PubMed] [CrossRef] [Google Scholar].
Schultz BM, et al. 炎症性腸疾患の発症におけるサルモネラ菌感染の潜在的役割. Front. Immunol. 2017;8:191.doi:10.3389/fimmu.2017.00191.を参照。[PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jørgensen, S. F. et al. Selective IgA deficiency in humans is associated with reduced gut microbial diversity(ヒトにおける選択的IgA欠損は腸内細菌の多様性の低下と関連している)。J. Allergy Clin. Immunol. 10.1016/j.jaci.2019.01.019 (2019). [PubMed】をご覧ください。]
Palm NW, et al. Immunoglobulin A coating identifies colitogenic bacteria in inflammatory bowel disease(免疫グロブリンAコーティングは炎症性腸疾患の大腸菌を特定する)。Cell. 2014;158:1000-1010. doi: 10.1016/j.cell.2014.08.006. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Bosca-Watts MM, et al. Crohn's diseaseのPathogenesis: bug or no bug. World J. Gastrointest. Pathophysiol. 2015;6:1-12. doi: 10.4291/wjgp.v6.i1.1. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Lin M, Du L, Brandtzaeg P, Pan-Hammarström Q. Human mucosal and systemic immune compartments in IgA subclass switch recombination(ヒト粘膜および全身性免疫コンパートメントにおけるIgAサブクラススイッチの組み替え)。Mucosal Immunol. 2014;7:511-520. doi: 10.1038/mi.2013.68. [PubMed] [CrossRef][Googleスカラー]を参照。
Corridoni, D. et al. 細菌センサーNOD2の遺伝子欠損は、機能的なディスバイオーシスとは無関係にマウス・クローン病様回腸炎を改善する。Mucosal Immunol. 10.1038/mi.2016.98 (2016)に掲載されています。[PMC フリーアーティクル】【PubMed
Jung C, Hugot J-P, Barreau F. Peyer's patches: the immune sensors of the intestine. Int. J. Inflamm. 2010;2010:823710. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Graziani C, et al. 生理的および病理的状態における腸管透過性:主要な決定因子と評価方法. Eur. Rev. Med. Pharmacol. Sci. 2019;23:795-810に記載されています。[PubMed][Google Scholar].
Henckaerts L, Vermeire S. NOD2/CARD15 disease associations other than Crohn's disease. Inflamm. Bowel Dis. 2007; 13:235-241.論文番号: 10.1002/ibd.20066. [PubMed] [CrossRef] [Google Scholar].
BAFF を過剰発現させたマウスは、常在菌叢に依存した IgA 関連腎症を発症する。J. Clin. Invest. 2011;121:3991-4002. doi: 10.1172/JCI45563. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Tang C, et al. Inhibition of dectin-1 signaling Ameliorates colitis byducing lactobacillus-mediated regulatory T Cell expansion in the intestine. Cell Host Microbe. 2015;18:183-197. doi: 10.1016/j.chom.2015.07.003. [PubMed] [CrossRef] [Google Scholar] を参照。
マンティス NJ, フォーブス SJ. 分泌型IgA:上皮の境界で微生物病原体を阻止する。Immunol. Invest. 2010;39:383-406. doi: 10.3109/08820131003622635. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Cho JA, et al.スフィンゴ糖脂質結合性細菌毒素のトラフィッキングとレトロトランスロケーションに関する洞察. Front. Cell. Infect. Microbiol. 2012;2:51. doi: 10.3389/fcimb.2012.00051. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
ラモスGP、パパダキスKA。疾患のメカニズム:炎症性腸疾患。Mayo Clin. Proc. 2019;94:155-165. doi: 10.1016/j.mayocp.2018.09.013. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Hedl M, Abraham C. Secretory mediators regulate Nod2-induced tolerance in human macrophages. Gastroenterology. 2011;140:231-241. doi: 10.1053/j.gastro.2010.09.009. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Sinha, R. et al. Retinoic acid decreases the severity of Salmonella Enterica serovar Typhimurium mediated gastroenteritis in a mouse model.レチノイン酸はマウスモデルで胃腸炎の重症度を低下させる。Immunobiology10.1016/j.imbio.2016.01.011 (2016). [PubMed] (英語
Lo BC, et al. IL-22 preserves gut epithelial integrity and promotes disease remission during chronic Salmonella infection.(IL-22はサルモネラ慢性感染症において腸管上皮の完全性を維持し、疾患の寛解を促進する。J. Immunol. Baltim. Md 1950. 2019;202:956-965. [PubMed】【Google Scholar】。
Bennett KM, et al. Induction of colonic M cells during intestinal inflammation(腸の炎症における大腸M細胞の誘導). Am. J. Pathol. 2016;186:1166-1179. doi: 10.1016/j.ajpath.2015.12.015. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Claes A-K, et al. Salmonella Enterica serovar Typhimurium ΔmsbB triggers exacerbated inflammation in Nod2 deficient mice.(サルモネラ・エンテリカ・セロヴァル・ティフィムリウム ΔmsbB は Nod2 欠損マウスにおいて炎症を悪化させる。PLOS ONE. 2014;9:e113645. doi: 10.1371/journal.pone.0113645. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ロバートソン SJ、ゲッデス K、メゾンヌーブ C、ストレイトカー CJ、フィルポット DJ. 病原性細菌感染後の腸内細菌叢の回復力は、NOD1またはNOD2を介した自然免疫とは無関係である。Microbes Infect. 2016;18:460-471. doi: 10.1016/j.micinf.2016.03.014. [PubMed] [CrossRef][Googleスカラー]を参照。
Garcia-Castillo, M. D., Chinnapen, D. J.-F. & Lencer, W. I.(ガルシア・カスティロ、M.D.、チナペン、D.J.-F.)。極性上皮を介した膜輸送。Cold Spring Harb. Perspect. Biol. 10.1101/cshperspect.a027912 (2017). [PMC フリーアーティクル] [PubMed].
Boyle JP, Parkhouse R, Monie TP. NOD2シグナル伝達経路の分子基盤への洞察。Open Biol. 2014;4:140178. doi: 10.1098/rsob.140178. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Cadwell K. Crosstalk between autophagy and inflammatory signalling pathways: Balancing defence and homeostasis. Nat. Rev. Immunol. 2016;16:661-675. doi: 10.1038/nri.2016.100. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Chen C-M、Gong Y、Zhang M、Chen J-J. Nod2 と TAK1 シグナル経路の間の相互クロストーク。J. Biol. Chem. 2004; 279:25876-25882.論文番号: 10.1074/jbc.M400682200. [PubMed] [CrossRef] [Google Scholar].
NOD2はToll様受容体2を介したTヘルパー1型応答の負のレギュレーターである。Nat. Immunol. 2004;5:800-808.DOI:10.1038/NI1092.PubMed[クロスリファレンス]。[PubMed] [CrossRef] [Google Scholar].
Richardson WM, et al. Nucleotide-binding oligomerization domain-2 inhibits toll-like receptor-4 signaling in the intestinal epithelium.(ヌクレオチド結合オリゴマー化ドメイン-2は、腸上皮におけるtoll様受容体-4シグナルを抑制する。Gastroenterology. 2010;139:904-917, 917.e1-6. doi: 10.1053/j.gastro.2010.05.038. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Hugot J-P, et al. 白人の健康な人における CARD15/NOD2 変異の有病率. Am. J. Gastroenterol. 2007;102:1259-1267. doi: 10.1111/j.1572-0241.2007.01149.x. [PubMed] [CrossRef] [Google Scholar].
Adler J, Rangwalla SC, Dwamena BA, Higgins PDR. NOD2 遺伝子型が複雑なクローン病の予後に与える影響:メタアナリシス。Am. J. Gastroenterol. 2011;106:699-712.DOI:10.1038/AJG.2011.19。[PubMed] [CrossRef] [Google Scholar].
Kubinak JL, Round JL. 抗体は健康な微生物叢を選択するか?Nat. Rev. Immunol. 2016;16:767-774. doi: 10.1038/nri.2016.114. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Sutherland DB, Suzuki K, Fagarasan S. Fostering of advanced mutualism with gut microbiota by Immunoglobulin A. Immunol. Rev. 2016;270:20-31. doi: 10.1111/imr.12384. [PubMed] [CrossRef] [Google Scholar].
Pabst O, Cerovic V, Hornef M. Secretory IgA in the coordination of establishment and maintenance of the microbiota. Trends Immunol. 2016;37:287-296. doi: 10.1016/j.it.2016.03.002. [PubMed] [CrossRef] [Google Scholar]を参照。
Magri G, et al. Human secretory IgM emerges from plasma cells clonally related to gut memory B cells and targets highly diverse commensals.ヒト分泌性IgMは腸管メモリーB細胞とクローン的に関連し、非常に多様な常在菌を標的とする。Immunity. 2017;47:118-134.e8. doi: 10.1016/j.immuni.2017.06.013. [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Clément B-J, Lebreton C, Malamut G, Cerf-Bensussan N. Perméabilité intestinale et maladie cœliaque. Médecine Mal. Métaboliques. 2015;9:19-26. doi: 10.1016/S1957-2557(15)30005-5. [CrossRef] [Google Scholar].
König J, et al. Human intestinal barrier function in health and disease. Clin. Transl. Gastroenterol. 2016;7:e196. doi: 10.1038/ctg.2016.54. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Lebreton C, et al. Secretory immunoglobulin A, CD71, and transglutaminase-2 interactions affect permeability of intestinal epithelial cells to gliadin peptides.(分泌性免疫グロブリンA、CD71、トランスグルタミナーゼ2の相互作用は、グリアジンペプチドの腸管上皮細胞の透過性に影響を及ぼす。Gastroenterology. 2012;143:698-707.e1-4. doi: 10.1053/j.gastro.2012.05.051. [PubMed] [CrossRef] [Google Scholar].
Bilsborough J, Targan SR, Snapper SB. 炎症性腸疾患における治療標的:現在と将来。Am. J. Gastroenterol. Suppl. 2016;3:27-37. doi: 10.1038/ajgsup.2016.18. [CrossRef] [Google Scholar]を参照してください。
Narula N, Rubin DT, Sands BE. 炎症性腸疾患における新規治療法:エビデンスの評価。Am. J. Gastroenterol. Suppl. 2016;3:38-44. doi: 10.1038/ajgsup.2016.19. [CrossRef] [Google Scholar] を参照。
Cooney R, et al. NOD2刺激は樹状細胞のオートファジーを誘導し、細菌処理と抗原提示に影響を与える。Nat. Med. 2010;16:90-97. doi: 10.1038/nm.2069. [PubMed] [CrossRef] [Google Scholar].
Nod2による腸管における自然免疫と適応免疫の制御. Science. 2005;307:731-734. doi: 10.1126/science.1104911. [PubMed] [CrossRef] [Google Scholar].
Taylor PR, et al. Dectin-1 is required for [beta]-glucan recognition and control of fungal infection. Nat. Immunol. 2007;8:31-38. doi: 10.1038/ni1408. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Phalipon A, et al. Shigella flexneri lipopolysaccharide の血清型特異的エピトープに対するモノクローナル免疫グロブリン A 抗体は、マウス実験赤痢に対して防御効果を示した。J. Exp. Med. 1995;182:769-778.doi: 10.1084/jem.182.3.769. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar] 。
Favre LI, Spertini F, Corthésy B. Simplified procedure to recover recombinant antigenized secretory IgA to be used as a vaccine vector. J. Chromatogr. B Anal. Technol. Biomed. Life. Sci. 2003;786:143-151. doi: 10.1016/S1570-0232(02)00723-7. [PubMed] [CrossRef] [Google Scholar].
Phalipon A, et al. Secretory component: a new role in secretory IgA-mediated immune exclusion in vivo. Immunity. Immunity. 2002;17:107-115. doi: 10.1016/S1074-7613(02)00341-2. [PubMed] [CrossRef] [Google Scholar].
Rindisbacher L, Cottet S, Wittek R, Kraehenbuhl J-P, Corthésy B. ウイルス発現系を用いた二量体IgA結合能を有するヒト分泌成分の産生。J. Biol. Chem. 1995;270:14220-14228. [PubMed] [CrossRef] [Google Scholar].
Nyuyki-Dufe K, Cluny NL, Sharkey KA, Swain MG, Pittman QJ. 炎症性腸疾患の動物モデルであるデキストラン硫酸ナトリウム(DSS)大腸炎における行動学的併発症. FASEB J. 2016;30:lb637-lb637. [Google Scholar】をご参照ください。]
Schippers A, et al. β7-Integrin exacerbates experimental DSS-induced colitis in mice by directing inflammatory monocytes into the colon. Mucosal Immunol. 2016;9:527-538. doi: 10.1038/mi.2015.82. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Fischer, A. H., Jacobson, K. A., Rose, J. & Zeller, R. Hematoxylin and eosin staining of tissue and cell sections(組織・細胞切片のヘマトキシリン・エオジン染色). Cold Spring Harb. Protoc. 2008, pdb.prot4986 (2008). [PubMed]
Winner L, et al. 粘膜免疫の解析のための新しいモデル:ハイブリドーマ腫瘍からの特異的モノクローナル免疫グロブリンAの腸内分泌はビブリオコレラ感染から保護される。Infect. Immun. 1991;59:977-982.doi: 10.1128/IAI.59.3.977-982.1991. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Rescigno M, et al. 樹状細胞は、タイトジャンクションタンパク質を発現し、腸管上皮単層に侵入して細菌をサンプリングする。Nat. Immunol. 2001;2:361-367. [PubMed] [CrossRef] [Google Scholar].
Des Rieux A, et al. M細胞によるナノ粒子輸送を研究するためのヒト腸管濾胞関連上皮の改良型in vitroモデル. Eur. J. Pharm. 2007;30:380-391. doi: 10.1016/j.ejps.2006.12.006. [PubMed] [CrossRef] [Google Scholar].
Váradi J, et al. α-メラノサイト刺激ホルモンは、Caco-2腸管上皮単層におけるサイトカイン誘発性バリアー損傷から保護する。PloS ONE. 2017;12:e0170537. doi: 10.1371/journal.pone.0170537. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Brain O, et al. 細胞内センサーNOD2は、ヒト樹状細胞のmicroRNA-29の発現を誘導し、IL-23の放出を制限している。Immunity. 2013;39:521-536. doi: 10.1016/j.immuni.2013.08.035. [PubMed] [CrossRef] [Google Scholar].
BMC Bioinforma. 2005;6:62. doi: 10.1186/1471-2105-6-62. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Clark SR, et al. Platelet aminophospholipid externalization Characterization reveal fatty acids as molecular determinants that regulate coagulation.血小板アミノリン脂質外部化の特性は、脂肪酸が凝固を制御する分子決定因子であることを明らかにした。Proc. Natl Acad. Sci. USA. 2013;110:5875-5880. doi: 10.1073/pnas.1222419110. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Xu W, Südhof TC. 記憶の特異性と般化のための神経回路。Science. 2013;339:1290-1295.doi: 10.1126/science.1229534. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
