虚血性脳卒中後の合併症における腸内細菌叢の役割
24
総閲覧数
5
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
フロント Cell. Infect. 2024年04月05日
Sec.腸内マイクロバイオーム
第14巻-2024年|https://doi.org/10.3389/fcimb.2024.1334581
虚血性脳卒中後の合併症における腸内細菌叢の役割
https://www.frontiersin.org/articles/10.3389/fcimb.2024.1334581/full?utm_source=dlvr.it&utm_medium=twitter


ジンウェイ・チャン1 リン2 レイ・シャン2 ウェンシャ・リー1 ペンナン・バオ1 ウェイ・ユエ1,2*1
1中国、天津市、天津医科大学神経内科、神経外科、神経リハビリテーション臨床学院
2天津環湖病院神経科、中国、天津
虚血性脳卒中(IS)は重篤な中枢神経疾患である。脳卒中後の合併症として、脳卒中後認知障害(PSCI)、脳卒中後うつ病(PSD)、出血性転換(HT)、消化管機能障害、心血管イベント、脳卒中後感染症(PSI)などがあり、神経学的障害をもたらす。微生物叢-腸-脳軸(MGBA)は、腸と脳の双方向のシグナル伝達とコミュニケーションを促進する。最近の研究では、脳梗塞後の腸内細菌叢の多様性の変化が報告されており、細菌移行、免疫調節、腸内細菌代謝産物の産生などさまざまな機序を介して脳梗塞後の合併症に腸内細菌叢が関与し、それによって疾患の予後に影響を及ぼすことが示唆されている。本総説では、IS後の合併症の予防と治療、およびISの長期予後の改善に関する知見を提供するために、IS後の合併症に対する腸内細菌叢の影響とともに、腸内細菌叢とISの相互作用についてまとめる。
1 はじめに
一般的な中枢神経系疾患である虚血性脳卒中(IS)は、世界で最も深刻な健康問題の1つであり、年間発症患者数は2,490万人(Benjamin et al.、2018年)、世界で2番目に大きな死亡原因、3番目に大きな障害原因となっている(Mendelson and Prabhakaran、2021年)。ISにおける脳組織傷害は、脳動脈狭窄、閉塞、または急性血液循環障害によって引き起こされ、全脳卒中型の75~85%を占める(Edwards and Bix, 2019; Yang et al.) ISの特徴は、突然性、急速性、障害、高い死亡率である(Widimskyら、2023)。ISの発症後、何人かの患者は、脳卒中後認知障害(PSCI)、脳卒中後うつ病(PSD)、出血性転換(HT)、消化管機能障害、心血管イベント、脳卒中後感染(PSI)などの様々な合併症を呈し、これらは疾患の予後に影響を与え、進行性の神経障害と高い死亡率をもたらす(Lindner et al、 2019; Ułamek-Kozioł et al., 2020; Huang et al., 2022; Zhang et al., 2022; Hede Ebbesen et al., 2023; Wang et al., 2023b)。
腸内細菌叢とは、ヒトの消化管に生息する細菌、ウイルス、真菌、古細菌を含むすべての微生物を指す(Benakisら、2020)。腸内細菌叢とその周辺環境は、免疫バリアーを制御し、正常な条件下で腸内環境の恒常性を維持し(Victoriaら、2020)、脳を含む遠隔臓器に影響を及ぼす(Delgado Jiménez and Benakis、2021)。腸内細菌叢と中枢神経系は、神経、内分泌、免疫のメカニズムを通じて相互作用し、双方向の調節軸、すなわち微生物叢-腸-脳軸(MGBA)を形成している(Luanら、2019)。また、腸内細菌叢はISの発生と発症に重要な役割を果たしており(Wangら、2022)、その結果、腸内細菌叢の組成が変化し、IS後の合併症の発症に大きく影響し、疾患の予後に影響を及ぼす(Plutaら、2021)。
本総説では、腸内細菌叢とISの相互作用、およびIS後の合併症に対する腸内細菌叢の影響について考察し、IS後の合併症の予防と治療、およびISの長期予後の改善に関する知見を提供する。
2 腸内細菌叢とIS
ヒトの腸内細菌叢には何兆もの微生物が存在し、1,000以上の細菌種が同定され、遺伝子数は約300万で、ヒトゲノムの150倍に相当する(Nam, 2019)。腸内細菌叢は、主にファーミキューテス(Firmicutes)とバクテロイデーテス(Bacteroidetes)で構成され(Tyler Patterson and Grandhi, 2020)、腸管上皮バリアの完全性を維持している(Ballway and Song, 2021)。腸内細菌叢の多様性と存在量が病的に変化すると、MGBAシグナル伝達が阻害され、深刻な病態生理学的結果をもたらすことが報告されている(Chidambaramら、2022a)。腸内細菌叢とISの相互作用は、ISの発症、発症、予後に大きく影響する(Yuanら、2021a;Chidambaramら、2022b;Hanら、2023)。
MGBAは、神経経路、内分泌経路、免疫系、細菌代謝産物、宿主代謝経路が関与する直接的および間接的な経路の両方を介して、脳と腸を接続している(Pehら、2022)。脳は副交感神経線維や交感神経線維を介して、また腸神経系の刺激を通じて間接的に腸と直接連絡している(Browning and Travagli, 2014; Carabotti et al.) さらに、脳の視床下部-下垂体-副腎(HPA)軸における生化学的変化が、腸の生理学的変化を引き起こすこともある(Wangら、2022年)。HPA軸は、腸の透過性、運動性、粘液産生に影響を与えるストレス応答を活性化し、それによって腸内環境を変化させ、腸内細菌叢の組成と活性に影響を与える(Wangら、2022)。IS後、腸内細菌叢におけるファーミキューテス類とバクテロイデーテス類の割合が変化する(Huら、2022)。エンテロバクター(Enterobacter)やデスルホビブリオ(Desulfovibrio)などの条件付き病原性細菌の存在量は増加し(Xiaら、2019)、一方、ブラウチア(Blautia)、ロゼブリア(Roseburia)、バクテロイデス(Bacteroides)、ラクノスピラ科(Lachnospiraceae)、フェーカリバクテリウム(Faecalibacterium)などの有益な短鎖脂肪酸(SCFA)産生細菌の存在量は減少する(Liら、2019;Tanら、2021)。急性IS患者では、腸内細菌叢障害が3週間以上続き、微生物の多様性が著しく減少することが報告されている(Xia et al.、2019);4週間後、腸内細菌叢は徐々に回復する(Xia et al.、2019)。一方、軽症IS患者では腸内細菌科とトリコスピラ科の存在量が増加し、重症IS患者ではルミノコックス科とクリステンセン科の存在量が増加する(Li et al.)
適応免疫と自然免疫の両方を含む免疫系は、腸脳軸において重要な役割を果たしており、腸内細菌叢は、中枢神経系における免疫細胞の発達と機能を制御し、末梢免疫応答を制御し、中枢神経系の免疫活性化と血液脳関門(BBB)の完全性に影響を及ぼすことによって、脳の炎症、傷害、行動において重要な役割を果たしている(Milaniら、2017;Cryanら、2019)。局所脳虚血後、炎症性サイトカインであるインターフェロン-γ(IFN-γ)、インターロイキン-6(IL-6)、腫瘍壊死因子-α(TNF-α)のレベルが上昇する(Muhammadら、2023)。IS後、宿主免疫系は著しく抑制され、腸管免疫バリア機能は破壊される(Breaら、2021)。これは、IS後の腸管タイトジャンクションタンパク質発現の減少(Yeら、2021年)、マイクロRNA(miRNA)によって誘導される腸管上皮透過性の増加(Wuら、2017年)、および腸粘膜上皮に影響を及ぼす毒性代謝産物の増加(Kuritaら、2020年;Rustiaら、2021年)と関連している可能性がある。腸管バリア機能が損傷した後、炎症性サイトカインが腸から循環系に放出され、脳と直接連絡し、病理学的変化を悪化させる(Muhammadら、2023)。リポ多糖(LPS)やペプチドグリカンなど、腸内微生物が産生する内毒素は、透過性の高い腸壁から血流に入り、宿主の自然免疫反応を活性化し、炎症反応を悪化させる(Breaら、2021)。腸と脳における腸内細菌叢のアンバランスは、主に腸上皮の表面に位置する自然免疫機能を持つ細胞群であるγδT細胞(Fangら、2023)などのリンパ球の数に影響を及ぼす(Jiangら、2023)。IS後の腸内細菌叢の変化は、炎症性T細胞応答を誘発し、腸から中枢神経系への免疫細胞の移動を増加させる(Jiangら、2023年)。T細胞によるIL-17の分泌は、末梢髄質細胞(単球や好中球)からのケモカインの産生を引き起こし、それによって血液脳関門を損傷して神経炎症を誘発し、虚血性脳損傷を悪化させる(Samuelsonら、2019;Wangら、2022)。さらに、腸内微生物は循環系や腸管外臓器に侵入し、局所感染や全身感染を引き起こす(Wangら、2023b)。
この双方向コミュニケーションネットワークを通じて、消化管は微生物叢が産生する代謝産物(Carabottiら、2015年)を通じて脳機能にも影響を及ぼす可能性があり、酢酸、プロピオン酸、酪酸が多く含まれ、ギ酸、吉草酸、カプロン酸は少ない(Fangら、2023年)。SCFAは脳卒中の回復を促進し、腸管上皮バリアの保護作用を発揮するため、疾患の予後を改善する(Huら、2022)。血漿中SCFA濃度の低下は、脳卒中の予後不良と有意に関連している(Fangら、2023)。SCFA産生菌の糞便移植またはSCFAの補充は、腸粘膜の完全性を高め、脳虚血領域への腸管Tregの移動を促進し(Wangら、2023c)、それによって神経炎症を抑制し、神経障害を有意に改善することが示されている(Leeら、2020;Sadlerら、2020)。さらに、別の腸内由来微生物代謝産物であるトリメチルアミンオキシド(TMAO)レベルの低下は、脳梗塞後の全身性炎症反応と密接に関連しており、TMAOレベルの早期上昇は脳卒中予後不良の予測因子である(Zhangら、2023a)。
3 IS後の合併症に対する腸内細菌叢の影響
3.1 腸内細菌叢とPSCIおよびPSD
ISは、うつ病、不安、人格変化、躁病、認知機能障害などの様々な精神神経障害を引き起こす可能性があり(Lingら、2020)、中でもPSCIとPSDは最も一般的で(Casoら、2009;Goyalら、2020)、予後不良と死亡率の高さを示している(Jiangら、2021)。認知機能障害はうつ病と密接に関連しており、これらの疾患はしばしば相互に影響し合い(Douven et al.、2018)、脳卒中患者では共存している(Douven et al.、2018)。腸内細菌叢異常症が、PSCIおよびPSDにおいて重要な役割を果たすMGBAを介して、さまざまな神経、免疫、内分泌、代謝経路を通じて、脳の生理学的、行動学的、認知機能に影響を及ぼすことを示唆するエビデンスが増えている(Liら、2018;Lingら、2020;Kangら、2021)(図1)。
図1
www.frontiersin.org
図1 虚血性脳卒中(IS)後の合併症。IS後の合併症は中枢神経系、呼吸器系、循環器系、消化器系、泌尿器系に関与し、脳卒中後認知機能障害(PSCI)、脳卒中後うつ病(PSD)、出血性転換(HT)、消化管機能障害、心血管イベント、脳卒中後感染症(PSI)などがある。図はBioRender.comによって作成された。
PSCIおよびPSD患者では、腸内細菌叢の多様性が健常人と比較して低下しており、腸内細菌叢の多様性が高いことは、急性IS後の比較的健康な状態を反映している可能性が示唆される(Smith and Wissel, 2019; Jiang et al.) さらに、PSCI患者の腸内細菌叢組成は、腸内微小環境の不均衡を誘発し、体内で炎症性環境を作り出し、特定の病原性細菌の免疫回避を引き起こすグラム陰性非胞子病原体であるフソバクテリウム種(Yu et al. フソバクテリウムは、マウスにおいて炎症を促進することで認知障害を悪化させることが報告されている(Yu et al.、2017)。脳卒中後認知障害およびうつ病(PSCCID)患者の腸内細菌叢は、γ-プロテオバクテリウム、腸内細菌、腸内細菌科を含むプロテオバクテリウムのレベルが上昇していることが特徴である(Ling et al.) γ-プロテオバクテリアおよび腸内細菌科細菌の数は、モントリオール認知評価尺度スコアと負の相関があり、これらの腸内細菌が認知障害と関連していることを示唆している(Ling et al.) PSD患者の糞便中のビフィズス菌の数は減少し、一方、腸球菌(Enterococcus faecalis)と大腸菌(Escherichia coli)の数は増加する(Kang et al. フェカリス菌と大腸菌は消化管の重要な日和見病原体である(Sapountzisら、2020)。ビフィズス菌は、病原性細菌の増殖を抑制し、強力な抗うつ作用を発揮し、微生物群集を制御するヒト腸内の有益な細菌である(Tianら、2020年)。
調節不全の腸内細菌叢は、腸管バリア機能の損傷を悪化させ、消化管における局所炎症因子の過剰放出を引き起こし(Puら、2023)、これはうつ症状の発生および悪化と密接に関連している(Buglione-Corbettら、2018)。PSD患者では、PSDでない患者よりもIL-1、IL-2、IL-6、高感度C反応性タンパク質(hsCRP)の血清レベルが高いことが報告されており、PSDの病態機序や炎症反応に炎症性サイトカインが関与していることが示唆されている(Kangら、2021)。PSD患者では、フェカリス菌と大腸菌のレベルはIL-1、IL-2、IL-6、hsCRPレベルと正の相関があるのに対し、ビフィズス菌のレベルは炎症因子と負の相関がある(Kang et al., 2021)。IS後の患者における腸内細菌叢の破壊は、腸管透過性を高め、腸内細菌の移動を促進し、下流の免疫反応を活性化し、炎症反応を悪化させることにより、PSDの発生と発症を促進する(Kangら、2021)。さらに、腸内細菌叢、特にプロテオバクテリアや腸内細菌科などのLPSを含む腸内細菌叢は、慢性的な軽度の炎症反応に関与している(Hiippalaら、2018)。神経炎症は認知障害と関連している(Passamontiら、2019)。したがって、炎症関連の腸内細菌はPSCCIDの発症に関与している可能性がある。
これまでの研究で、SCFAの欠乏とPSCIには有意な相関があることが示されている(Dalile et al.) SCFAは遊離脂肪酸受容体と相互作用し、ヒストン脱アセチル化酵素を阻害し、血液脳関門を通って脳に入り、ミクログリアに影響を与え、神経系の炎症を抑え、MGBAにおいて重要な役割を果たす(Dalile et al., 2019; Parada Venegas et al.) PSCCID患者では、トリコスピラ科などのSCFAを産生する細菌の数が、非PSCCID患者よりも少ない(Lingら、2020)。
さらに、乳酸菌とビフィズス菌からなるプロバイオティクス介入は、不安や抑うつなど脳卒中後の情動状態を改善したが、認知機能には有意な影響を及ぼさなかった(Liu et al.) ポストバイオティクスは、メタバイオティクス、バイオジェニックス、無細胞上清(CFS)とも呼ばれ、生きた細菌から分泌される、あるいは細菌の溶解後に放出される細菌発酵代謝産物や可溶性因子であり、SCFA、酵素、テイコ酸、エンド多糖類、エキソ多糖類、細胞表面タンパク質、ビタミン、プラズマローゲン、有機酸などが含まれる(Vallianou et al.、2020;Sorboni et al.、2022)。最も重要なSCFAは酢酸、プロピオン酸、酪酸である(De Vadderら、2014)。従来の量の乳酸菌やビフィズス菌の代わりに、高用量のSCFAやSCFAを産生するプロバイオティクスを補充することで、PSCIを効果的に改善できる可能性がある(Liuら、2020)。動物実験では、SCFAがin vitroでアミロイドβタンパク質の凝集を抑制することで認知機能を改善する可能性が示されている(Hoら、2018年)。さらに、糞便細菌移植やアッカーマンシアなどの新しいプロバイオティクスの補充は、PSCIを改善する可能性がある(Liu et al.) 脳卒中後の運動トレーニングは、乳酸菌やビフィズス菌の発現を増加させ、腸内細菌叢の機能を改善し、腸組織や脳組織におけるIL-2やIL-6などの炎症因子の発現を減少させ、ミクログリアのM1型からM2型への転換を促進し、神経炎症反応を抑制し、うつ病を改善する(Tianら、2019;Yangら、2021)。
3.2 腸内細菌叢とHT
急性ISの一般的な合併症であるHTは、病態の進行と神経学的損傷の増悪をもたらし、他の合併症のリスクを高める(Hafezら、2015)。HTの根底にある病理学的メカニズムは、血液脳関門の破綻、酸化ストレス、炎症反応、腸内細菌叢障害と関連している(Huangら、2022年)。
脳卒中後のHTは、Actinobacteria、Proteobacteria、Verrucomycetesなどの嫌気性細菌を有意に増加させ、Proteobacteriaの濃縮がHTラットの糞便で観察されている(Huangら、2022)。腸内細菌叢の特異的な変化は、ある種の有機酸とマトリックスメタロプロテアーゼ-9(MMP-9)のレベルに影響されている可能性がある(Huangら、2022)。MMPの発現増加によって調節される初期のBBBの破壊は、虚血性脳卒中におけるHTイベントと密接に関連している(Liuら、2009)。研究により、HTラットにおけるMMP-9のレベルが有意に上昇することが見出され、さらなる解析により、MMP-9と総SCFAおよびプロパン酸濃度との間に負の関係があることが明らかになった(Huangら、2022)。さらに、HoldemaniaとCollinsellaの相対量はMMP- 9濃度と負の相関を示し、Allobaculum、Erysipelotrichi、Erysipelotrichales、ErysipelotrichaceaeはMMP- 9濃度と正の相関を示した(Huang et al.) 酸化ストレスは、高脂血症発症の病理学的過程において重要な役割を果たしている。一部の学者は、高血糖がフリーラジカルの形成を増加させ、一過性虚血ラットにおける酸素産生を減少させると提唱している(Liら、1999)。一方、酸化ストレスもまた腸管内の酸素含量を減少させ、マウスの糞便微生物叢の乱れを引き起こした(Zhaoら、2021)。したがって、高血糖によって誘導されるHTは、腸管内の酸素形成を阻害し、嫌気性細菌の産生を増加させる可能性がある(Huangら、2022)。
SCFA、特に酪酸と吉草酸のレベルは、非HTラットよりもHTラットの腸管の方が低く、SCFAを産生する微生物の数も少ない(Huangら、2022)。酪酸は腸上皮の完全性を維持し、免疫系を制御し、炎症反応を緩和する(Sadlerら、2020)。さらに、HT後のSCFAレベルは、TNF- α、IL-1 β、IL-17などの炎症性サイトカインと有意に相関しており、ISの予後に大きな影響を与えている(Huangら、2022)。
3.3 腸内細菌叢とIS後の胃腸機能障害
IS患者の50%以上が、嚥下障害、腸管運動・吸収障害、消化管出血、腸管漏出、便失禁、腸管敗血症などの消化管合併症を経験している(Durganら、2019;Longら、2022)。ゲノミクス、メタボロミクス、プロテオミクスの広範な研究により、腸内細菌叢が脳卒中後のいくつかの病態生理学的事象に関与していることが明らかになっており、消化管合併症を伴うIS患者は予後不良、死亡率高、神経機能悪化を伴うことが多い(Tuzら、2022;Zhaoら、2023)。
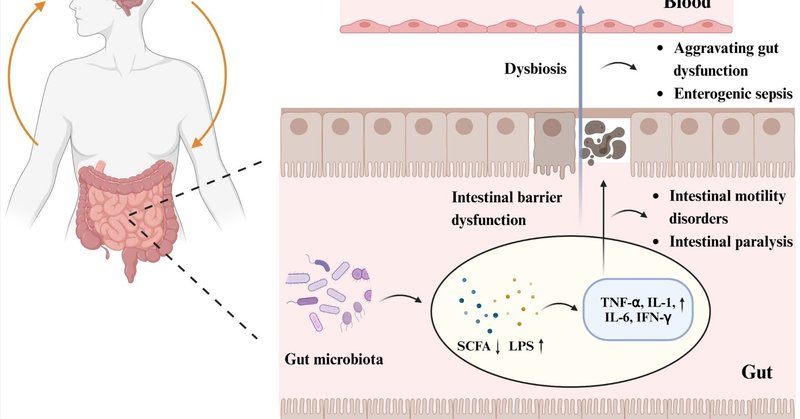
脳卒中後、腸内細菌叢は調節異常をきたし、グラム陰性腸内細菌科細菌の数が増加する(Huang and Xia, 2021)。複数の研究が、IS患者における腸管上皮バリア機能障害、腸管漏出、および腸内細菌叢の変化との相関を示しており(Zhangら、2022)、腸絨毛上皮の損傷、粘液および腸管タイトジャンクションタンパク質の発現低下、腸管透過性の亢進、および腸敗血症を引き起こす可能性がある(Zhaoら、2023)。腸管上皮バリア機能の崩壊は、グラム陰性菌のLPS、SCFAやTMAOなどの優勢菌集団の代謝産物、およびTNF-α、IL-1、IL-6、一酸化窒素合成酵素などの腸管炎症因子と関連している(Chengら、2018;Chenら、2019c;Yuら、2021)。日和見病原体は、Toll様受容体(TLR)4/MyD88シグナル伝達経路を介することで炎症反応を誘発するグラム陰性菌の内毒素細胞壁成分であるLPS(Kuritaら、2020)などの有害物質を産生する(Singhら、2016)。炎症性物質の細胞毒性作用は腸の微絨毛を傷つけ、腸のタイトジャンクションタンパク質の発現レベルに影響を及ぼし、腸のバリア機能の損傷を悪化させ(Kurita et al.、2020)、腸管漏出を引き起こし、それによって炎症性サイトカイン、細菌、有毒な腸内代謝産物が傷ついた腸上皮バリアを透過して循環に入るのを許してしまう(Ye et al.、2021)。LPS、D-乳酸、ゾヌリン、TNF-α、IFN-γ、IL-6のレベルは、健康なマカクと比較して、ISのマカクの血清中で増加している(Chenら、2019c)。内毒素血症および細菌転位は、腸出血、運動障害、腸麻痺などの消化管合併症を悪化させる可能性がある(Wangら、2023a)。腸内細菌叢の代謝産物であるSCFAは、腸内細菌のバランス、上皮の機能的完全性、免疫学、炎症の維持に極めて重要である。IS後のSCFAの減少も確認されている(Zouら、2022)。SCFAは腸管バリアの発達を促進し、NOD様受容体熱タンパク質ドメイン関連タンパク質3(NLRP3)インフラマソームを阻害することにより、LPS損傷から腸管を保護する(図2)。
図2
www.frontiersin.org
図2 腸内細菌叢と脳卒中後の消化管機能障害の病態。脳梗塞後の腸内細菌叢の増加、有益な代謝産物である短鎖脂肪酸(SCFA)の減少、グラム陰性菌のLPSの増加は、腫瘍壊死因子α(TNF-α)、インターロイキン(IL)-1、IL-6、サイトカインであるインターフェロン-γ(IFN-γ)などの炎症因子の発現レベルの上昇を伴う炎症反応を引き起こした。炎症性物質の細胞毒性作用は、腸管微小管障害や腸管上皮タイトジャンクションタンパク質の発現低下を引き起こし、腸管上皮バリア機能障害や腸管漏出を誘発し、腸管運動障害、腸管麻痺、その他の消化管合併症を引き起こす。腸管バリア機能の障害により、炎症性サイトカイン、細菌、有毒な腸内代謝産物が損傷した腸管上皮バリアを通過して循環系に入り込み、消化管機能障害を悪化させ、腸原性敗血症を誘発することさえある。図はBioRender.comによって作成された。
腸管免疫系は、病原体の侵入に抵抗し、免疫恒常性を維持するために、生理的条件下で協力し合う複数の免疫組織と細胞から構成されている(Pu et al.) 正常な生理的条件下では、B細胞はT細胞の存在下でIgA産生B細胞に分化し、毒素や病原体を排除する(Suzuki and Nakajima, 2014)。ラットの脳卒中モデルでは、虚血前ストレスが大腸のIgAレベルと細菌の移動を有意に減少させる(Caso et al.) さらに、IS後のマウス小腸におけるB細胞数の減少が報告されている(Oyama et al., 2018)。したがって、ISは腸の局所および全身免疫系のホメオスタシスに悪影響を及ぼし、局所抗菌防御や消化管合併症を損なう可能性がある(Oyama et al.)
食事介入、プロバイオティクス、微生物代謝産物、糞便微生物叢移植、漢方薬の単独または併用により、脳卒中後の消化管合併症を予防・改善することができる(Liuら、2020;Weiら、2023)(表1)。脳卒中患者では、早期の経腸栄養と乳酸菌やビフィズス菌などのプロバイオティクス療法を併用することで、栄養状態の改善、腸内細菌叢の補充、腸管バリア機能の安定化、免疫寛容の改善、栄養性下痢の発生率の減少が期待できる(Maoら、2022)。プロバイオティクスは、日和見病原体の腸壁への付着を阻害し、病原体の過剰増殖や外来病原体の侵入を防ぎ、病原体による腸上皮細胞のアポトーシスを抑制し、腸粘膜バリアを保護し、細菌の移動を抑制する(Martínez-Guardadoら、2022)。プロバイオティクスはまた、バクテリオシン、有機酸、ビタミン、神経伝達物質などの生理活性化合物を産生し、酸化ストレスや炎症性サイトカインを減少させ、腸および全身の免疫機能を改善することができる(Chen et al.)
表1
www.frontiersin.org
表1 脳卒中後の消化管合併症における腸内細菌叢の治療戦略。
プレバイオティクス、特に炭水化物は、SCFAとムチンの産生に影響を与え、腸関連リンパ組織(GALT)における局所炎症反応を制御する(Markowiak and Śliżewska, 2017)。ラクチュロースサプリメント(一般的なプレバイオティクス)は、腸管バリアの損傷を修復し、腸内細菌叢の不均衡を緩和し、脳卒中後の神経機能を改善することができる(Yuanら、2021b)。さらに、プレバイオティクスである食物繊維豊富な大麦、BARLEYmaxは、胃腸管内の酪酸産生菌の存在量と酪酸レベルを増加させることが報告されている(Akagawaら、2021)。プロバイオティクスとプレバイオティクスを組み合わせると相乗効果がある(Chenら、2019a);実際、イヌリンとSCFA産生菌の組み合わせは、SCFA産生菌の事前投与と比較して、脳卒中後のマウスのSCFA産生を増加させ、神経学的欠損スコアと行動転帰を改善した(Chenら、2019a)。したがって、プロバイオティクスとプレバイオティクスは微生物叢組成と消化管機能を改善し、それによって患者の予後にプラスの影響を与える(Weiら、2023)。
ポストバイオティクスもまた、宿主に生理的利益をもたらす。MCAOマウスにインドール-3-プロピオン酸を経口投与すると、プロバイオティクスの数が増加し、有害な細菌が減少し、腸管バリアの完全性が保護されることが示されている(Xieら、2022;Zhouら、2023)。さらに、食物繊維、酪酸、または酪酸産生プロバイオティクスを食事に含めることで、腸の炎症を抑え、タイトジャンクションタンパク質に影響を与え(Wurtman, 2008; Liu et al., 2020)、ZO-1、オクルージョン、クローディン4の発現レベルをアップレギュレートして腸粘膜の完全性を維持し、上皮の酸素消費に影響を与え、低酸素誘導因子の安定性を維持し、腸のバリア機能不全を改善し、ISに関連する予後不良を軽減することができる(Wang et al.) SCFAが豊富な糞便微生物叢の移植は、腸内細菌叢を再形成し、有益な乳酸菌を豊富にし、腸管漏出を修復することができる(Chenら、2019b)。
伝統的な漢方薬である当帰芍薬散は、IS後の細菌群集の変化を制御し、バクテロイデスの過剰な増加を抑制し、特定の細菌群集の存在量の異常な変化を制御し、T細胞の不均衡による炎症反応を改善し、腸管バリアの機能を回復させることができる(Spence, 2018)。ラットのIS治療において、プエラリア・ロバタ根とChuanxiong Rhizoma(CXR)を組み合わせることで、腸内細菌叢のアンバランスと脳腸関門の損傷を緩和し、神経機能を効果的に改善することが示されている(Chenら、2019a)。電気鍼は多能性幹細胞由来細胞外小胞(iPSC EVs)を誘導し、電気鍼とiPSC EVsを組み合わせた電気鍼は、ニューロン数を増加させ、MCAOマウスの炎症を抑制し、大腸損傷を緩和し、消化管微生物叢を調整し、IS後の消化管合併症の発生を減少させた(Zhang et al.、2023b)。
3.4 腸内細菌叢と脳梗塞後の心血管イベント
心血管系合併症は脳卒中に次いで2番目に多い死因である(吉村ら、2008)。一過性脳虚血発作および脳卒中患者に対するガイドラインに基づく最善の治療にもかかわらず(Haghikia et al., 2018)、急性期IS後初期3ヶ月では、患者の19.0%が少なくとも1つの重篤な心臓有害事象を経験し、患者の28.5%が左室駆出率が50%を下回り、13~29%が心臓収縮機能障害に苦しんでいる(Chen et al., 2017b)。軽度の回復可能な傷害、生涯にわたる心臓の問題、あるいは死に至る脳卒中の心臓合併症には、うっ血性心不全、神経原性ストレス心筋症、たこつぼ心筋症、心停止、不整脈などがある(Samuels, 2007; Holmqvist et al.) IS後、腸管透過性の亢進が炎症反応を促進し、全身性の炎症が腸管透過性を亢進させる(Puら、2023)。細菌や内毒素が血流に移行すると炎症性サイトカインのレベルが上昇し、全身性の炎症は心機能障害を誘発または増悪させる(Masengaら、2023)。
脳卒中患者における心血管イベントデータの解析により、腸内細菌叢代謝産物(TMAO)レベルの上昇と、最初の脳卒中エピソード後の心血管イベントリスク上昇との間に、用量依存的な相関関係があることが明らかになった(Haghikia et al.) 受信者動作特性曲線解析はさらに、TMAOがIS患者における心血管死亡の1年リスクの予測因子であることを示した(Haghikiaら、2018)。ホスファチジルコリン、コリン、カルニチンなど、トリメチルアミン基を有する特定の栄養素を豊富に含む食品は、腸内の腸内細菌叢がコードするトリメチルアミンリアーゼによって分解され、吸収されると、肝臓のフラビン含有モノオキシゲナーゼ(FMO)、特にFMO3によってさらにTMAOに代謝される(Kasahara and Rey, 2019)。TMAOは心臓の代謝性疾患や動脈硬化の発症に関連している(Zhang and Yao, 2023)。微生物依存性TMAOのアテローム性作用には、マクロファージのコレステロール蓄積の亢進と泡沫細胞の形成、動脈壁の炎症性変化、血小板の過反応、動脈血栓症の可能性の亢進などが含まれる(Hemmatiら、2023;Zhang and Yao、2023)。
マウスにおいて、TMAOはマクロファージ上のスカベンジャー受容体CD36およびスカベンジャーA1受容体SR-A1の発現を増加させ、コレステロールの逆輸送を阻害し、アテローム性動脈硬化病変に泡沫細胞を形成することによってアテローム性動脈硬化症の発症を促進し、血管壁マクロファージにおける脂質の蓄積を増加させた(Kasahara and Rey, 2019; Canyelles et al.) これは、微生物トリメチルアミンによって産生される低分子阻害剤による治療後に阻害された(Wangら、2015)。動物モデルでは、FMO3の阻害はTMAOとアテローム性動脈硬化症の両方を減少させた(Shihら、2015)。
さらに、TMAは、血管の炎症を促進するために、内皮細胞-κBシグナルカスケードのマイトジェン活性化プロテインキナーゼ、細胞外シグナル関連キナーゼ、核内因子を活性化する(Hemmatiら、2023)。げっ歯類モデルにTMAOを直接注射すると、大動脈内皮細胞の活性化と接着タンパク質のアップレギュレーションが促進されることが示されている(Hemmatiら、2023)。培養内皮細胞を用いた研究では、TMAOがNLRP3インフラマソームを活性化し、動脈硬化に悪影響を及ぼすことが示されている(Chenら、2017a)。LPS受容体CD14およびFcγⅢ受容体CD16+単球は、特異的な炎症性機能を有するサブグループである。血中TMAO濃度は、炎症性中間体CD14++CD16+単球のレベルと正の相関がある(Yangら、2023)。中間CD14++CD16+単球は、TNF-αなどの炎症性サイトカインを大量に分泌し、炎症反応を促進する(Oktavionoら、2023)。中間単球におけるCD162/P-セレクチン糖タンパク質リガンド-1(PSGL-1)などの接着分子や、自然免疫反応における反応性酸化物質の主要な供給源であるミエロペルオキシダーゼの高発現は、血栓形成性やアテローム形成性に寄与している(Wildgruberら、2016)。IS患者では、中間単球サブセットの増加が脳梗塞後の心血管イベントの発生と密接に関連している。炎症性単球レベルの増加を促進することに加え、腸内細菌叢は血小板の過剰反応に直接つながり、TMAOの生成を通じて細胞内蓄積Ca2+の放出を増加させ、それによって血栓症のリスク(Nesci et al.
3.5 腸内細菌叢とPSI
PSIは脳卒中患者の最大半数で報告されており、肺炎と尿路感染が最も一般的なPSIである(Westendorpら、2011;Shim and Wong、2018)。PSIは患者の再入院や死亡の主な原因でもあり、予後不良と関連している(Kaur et al.) 脳卒中後の肺感染症や尿路感染症の発生は、嚥下困難、高齢、長期不動、あるいは経鼻胃管、静脈カテーテル、カテーテル、機械的人工呼吸器の挿入などの手術の結果に起因する。病院内の日和見病原体も感染源である(Mao et al.) しかし、腸管バリアの完全性とISS後の腸内細菌の移動がPSIの発症に関連している可能性がある(Zbeskoら、2021年)。
腸内細菌叢の移動と免疫機能障害は、PSIの発生と発症において重要な役割を果たす(Stanleyら、2018;Ghelaniら、2021)。脳卒中は免疫抑制を誘導し、サイトカインの恒常性を乱し、末梢の免疫防御を弱め、細菌に対する宿主の防御を低下させ、宿主の感受性を高め、肺への細菌の移動を促進し、肺組織の損傷を悪化させる(Zhangら、2021年)。さらに、脳卒中後の末梢血では白血球とリンパ球の減少が観察されており、最も顕著な減少は3日目に起こっている(Liら、2020年)。脳卒中はまた、グルココルチコイドを介して視床下部-下垂体-副腎系を活性化し、末梢脾臓の萎縮を誘導し、リンパ球産生障害とナチュラルキラー細胞の不足をもたらし、末梢免疫を抑制する可能性がある(Zhangら、2021)。
腸内細菌叢組成の変化は呼吸器疾患への感受性を高め、細菌の移動を促進し、PSIを誘導する(Wattooら、2021年)。IS患者の血液、喀痰、尿から検出される細菌は、大腸菌、腸球菌、モルガネラ・モルガニーなど、ヒトの腸内に存在する一般的な微生物である(Kishoreら、2018、Kishoreら、2019)。脳卒中後、肺の細菌数は有意に増加するが、回腸と結腸では減少する(Hede Ebbesenら、2023)。微生物叢の多様性は著しく変化するが、肺組織と腸内細菌叢の組成は類似したままであり、肺に播種された細菌は腸に由来する可能性が高いことを示している(Hede Ebbesenら、2023年)。回腸は脳卒中後の腸管透過性に最も敏感で、その後3時間後にピークに達し、腸から周囲の組織や臓器への腸内細菌の侵入を促進し、脳卒中後肺炎のリスクを高める(Shim and Wong, 2018)。
さらに、交感神経系は脳卒中後の腸管透過性の交代に関与している(Doyle and Buckwalter, 2017)。脳卒中後のβアドレナリン受容体の活性化は、腸管バリアの破壊と免疫抑制を誘発し、腸内細菌の拡散と感染症の発生を引き起こす(Doyle and Buckwalter, 2017)。PSIマウスから得られたデータでは、腸内に存在する微生物が血液やリンパ節で検出されることが示された。腸内の細菌は肝臓や脾臓でも観察されている(Hede Ebbesen et al.) したがって、脳卒中後の肺への細菌の移行方向には、小腸から血液やリンパ系を介して肺に直接移行する経路や、肝臓を介して肺組織に間接的に移行する経路など、さまざまな経路が関与している可能性がある(Hede Ebbesenら、2023年)。
SCFAは脳の全身循環と免疫調節に重要な役割を果たしており、PSIに影響を与えている可能性がある(Sadlerら、2020;Haakら、2021)。一方、入院後24時間以内の酪酸産生菌の存在量の低さは、脳卒中後感染リスク亢進の独立した予測因子であった(Leeら、2019)。酪酸は、単球やマクロファージの抗菌活性や呼吸器病原体に対する身体の抗菌活性を増強し(Haakら、2018)、循環白血球のヒストン脱アセチル化酵素や哺乳類ラパマイシン標的シグナルを阻害することで免疫調節を発揮し、宿主が侵入病原体に抵抗して防御効果を発揮できるようにする(Schulthessら、2019)。酪酸産生菌は、SCFA、インドール、デサミノチロシンなどの他の代謝産物を産生し、感染症に抵抗するのに役立ち(Haakら、2021)、Tregをアップレギュレートし、住民や侵入炎症細胞の虚血後炎症反応の抑制に役立ち、PSIを改善する(Sadlerら、2020)。
IS後、抗生物質の使用はPSIを減少させる有望な戦略であるが、大規模な臨床研究ではまだ確認されていない(Westendorpら、2018)。抗生物質は有益な腸内細菌叢を破壊する可能性があり、ISによるその変化を悪化させ、炎症反応を増幅させる可能性がある(Singhら、2016;Ghelaniら、2021)。加えて、プロプラノロールで交感神経系の活性化を遮断することで、腸管透過性の亢進を防ぐことができ、これはβアドレナリン受容体拮抗薬が潜在的な治療アプローチであることを示唆している(Westendorpら、2016)。
4 結論
ISは依然として最も困難な疾患の一つである。腸内細菌叢は、微生物多様性の変化、免疫調節、内分泌調節などのいくつかの機序を介して、PSCI、PSD、HT、消化管機能障害、心血管イベント、PSIなどのIS後の合併症において、MGBA双方向シグナル伝達を利用した重要な役割を果たしている。しかし、さまざまな微生物群がISの予後に影響を及ぼす病理学的メカニズムについては、さらなる研究が必要である。腸内細菌叢移植、プロバイオティクスの補充、腸内細菌叢代謝産物など、IS患者の生理学的機能と疾患進行を改善することを目的としたいくつかの治療法が有益な効果を示している。腸内細菌叢の作用機序と的を絞った治療法に関する研究がさらに進めば、IS後の合併症の予防と改善に関する新たな知見が得られるかもしれない。
著者貢献
JZ:方法論、ソフトウェア、監修、検証、執筆-原案、執筆-校閲・編集。LL:バリデーション、執筆-レビューおよび編集。LX: 監修、執筆-校閲・編集。WL: 執筆-校閲・編集。PB: 執筆-校閲・編集。WY: 資金獲得、監督、検証、視覚化、執筆-レビュー&編集。
資金提供
著者は、本論文の研究、執筆、および/または出版のために金銭的支援を受けたことを表明する。本研究は、天津市重点医療分野(専門)建設プロジェクト(助成金番号:TJYXZDXK-052B)の支援を受けた。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
赤川聡、赤川祐子、中井康之、山岸正樹、山之内聡、木俣哲也、他(2021).食物繊維が豊富な大麦はヒト腸内細菌叢の酪酸産生菌を増加させる。Metabolites 11, (8). doi: 10.3390/metabo11080559.
クロスリファレンス全文|Google Scholar
Ballway, J. W., Song, B. J. (2021). アルコールが介在する酸化ストレス、腸内細菌異常症、腸管バリア機能不全、脂肪肝疾患に対する抗酸化ファイトケミカルによるトランスレーショナル・アプローチ。アンチオキシダント(バーゼル)10、(3)。
クロスレフ・フルテキスト|Google Scholar
Benakis, C., Martin-Gallausiaux, C., Trezzi, J. P., Melton, P., Liesz, A., Wilmes, P. (2020). 急性および慢性脳疾患における微生物-腸-脳軸。Curr. Opin. Neurobiol. 61, 1-9. doi: 10.1016/j.conb.2019.11.009
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Benjamin, E. J., Virani, S. S., Callaway, C. W., Chamberlain, A. M., Chang, A. R., Cheng, S., et al. 心臓病と脳卒中の統計-2018更新:米国心臓協会からの報告。Circulation 137, e67-e492. doi: 10.1161/CIR.0000000000000558.
PubMed Abstract | CrossRef Full Text | Google Scholar
Brea,D.、Poon,C.、Benakis,C.、Lubitz,G.、Murphy,M.、Iadecola,C.、他(2021年)。脳卒中は中枢神経系への腸管免疫細胞輸送に影響を及ぼす。Brain Behav. Immun. 96, 295-302. doi: 10.1016/j.bbi.2021.05.008.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Browning, K. N., Travagli, R. A. (2014). 中枢神経系による消化管運動・分泌の制御と消化管機能の調節。Compr. 生理学 4, 1339-1368.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Buglione-Corbett, R., Deligiannidis, K. M., Leung, K., Zhang, N., Lee, M., Rosal, M. C., et al. 周産期抑うつ症状を有する女性における炎症マーカーの発現。Arch. Womens Ment. 健康 21, 671-679.
パブコメ要旨|全文|Google Scholar
Canyelles, M., Borràs, C., Rotllan, N., Tondo, M., Escolà-Gil, J. C., Blanco-Vaca, F. (2023). 腸内細菌叢由来のTMAO:アテローム性動脈硬化性心血管病を促進する原因因子?Int. J. Mol. Sci. 24, (3). doi: 10.3390/ijms24031940
CrossRef 全文|Google Scholar
Carabotti, M., Scirocco, A., Maselli, M. A., Severi, C. (2015). 腸脳軸:腸内細菌叢、中枢および腸神経系間の相互作用。Ann. Gastroenterol. 28, 203-209.
PubMed Abstract|Google Scholar
Caso, J. R., Hurtado, O., Pereira, M. P., García-Bueno, B., Menchén, L., Alou, L., et al. ストレスによる実験的脳卒中転帰の悪化因子としての可能性のある大腸細菌転座。Am. J. Physiol. Regul. Integr. Regul. 生理学 296, R979-R985.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, X., Hu, Y., Yuan, X., Yang, J., Ka, L. (2022). 脳卒中患者におけるプロバイオティクスを併用した早期経腸栄養の効果:ランダム化比較試験のメタアナリシス。Eur. J. Clin. doi: 10.1038/s41430-021-00986-3.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, Y., Liang, J., Ouyang, F., Chen, X., Lu, T., Jiang, Z., et al. カニクイザルにおける脳梗塞後の腸内細菌叢異常と慢性全身性炎症の持続。Front. Neurol. 10, 661. doi: 10.3389/fneur.2019.00661
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, Z., Venkat, P., Seyfried, D., Chopp, M., Yan, T., Chen, J. (2017b). 脳と心臓の相互作用:脳卒中後の心臓合併症。Circ. doi: 10.1161/CIRCRESAHA.117.311170.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Chen,R.、Wu,P.、Cai,Z.、Fang,Y.、Zhou,H.、Lasanajak,Y.、他(2019a)。Puerariae Lobatae Radix with chuanxiong Rhizoma for treatment of cerebral ischemic stroke by remodeling gut microbiota to regulate the brain-gut barrier. J. Nutr. 65, 101-114. doi: 10.1016/j.jnutbio.2018.12.004
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, R., Xu, Y., Wu, P., Zhou, H., Lasanajak, Y., Fang, Y., et al. 短鎖脂肪酸と酪酸に富む糞便微生物叢の移植は、腸内細菌叢を制御することにより脳虚血性脳卒中を治療する。Pharmacol. 論文タイトル:Pharmacol.
PubMedアブストラクト|Ref全文|Google Scholar
Chen, M. L., Zhu, X. H., Ran, L., Lang, H. D., Yi, L., Mi, M. T. (2017a). トリメチルアミン-N-オキシドは、SIRT3-SOD2-mtROSシグナル伝達経路を介してNLRP3インフラマソームを活性化することにより、血管炎症を誘導する。J. Am. 6, (9). doi: 10.1161/JAHA.117.006347
CrossRef 全文|Google Scholar
Cheng, Y., Zan, J., Song, Y., Yang, G., Shang, H., Zhao, W. (2018). マウス脳内出血後の腸管傷害、炎症反応および酸化ストレスの評価。Int. J. Mol. Med. 42, 2120-2128. doi: 10.3892/ijmm
パブコメ抄録|クロスリファレンス全文|Google Scholar
Chidambaram, S. B., Essa, M. M., Rathipriya, A. G., Bishir, M., Ray, B., Mahalakshmi, A. M., et al. 神経変性疾患における腸内環境の異常、オートファジーの欠陥、免疫応答の変化: 悪循環の物語。Pharmacol. Ther. 231, 107988.
パブコメ抄録|クロスリファレンス|Google Scholar
Chidambaram, S. B., Rathipriya, A. G., Mahalakshmi, A. M., Sharma, S., Hediyal, T. A., Ray, B., et al. 虚血性脳卒中の病態と管理における腸内細菌異常症の影響。細胞 11, (7). doi: 10.3390/cells11071239
CrossRef 全文|Google Scholar
Cryan, J. F., O'Riordan, K. J., Cowan, C. S. M., Sandhu, K. V., Bastiaanssen, T. F. S., Boehme, M., et al. 微生物叢-腸-脳軸。Physiol. Rev. 99, 1877-2013. doi: 10.1152/physrev.00018.2018.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dalile, B., Van Oudenhove, L., Vervliet, B., Verbeke, K. (2019). 微生物叢-腸-脳のコミュニケーションにおける短鎖脂肪酸の役割。Nat. Rev. Gastroenterol. Hepatol. 16, 461-478. doi: 10.1038/s41575-019-0157-3
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Delgado Jiménez, R., Benakis, C. (2021). 腸の生態系: 脳卒中における重要なプレイヤー。神経分子医学。23, 236-241.
パブコメ抄録|全文|Google Scholar
De Vadder, F., Kovatcheva-Datchary, P., Goncalves, D., Vinera, J., Zitoun, C., Duchampt, A., et al. 微生物叢が生成する代謝産物は、腸-脳神経回路を介して代謝利益を促進する。細胞 156, 84-96.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Douven, E., Aalten, P., Staals, J., Schievink, S. H. J., van Oostenbrugge, R. J., Verhey, F. R. J., et al. 脳卒中後の抑うつ症状と遂行機能障害の併発:脳病理および予後との関連。J. Neurol. Neurosurg. doi: 10.1136/jnnp-2017-317548.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Doyle, K. P., Buckwalter, M. S. (2017). Bリンパ球を介する自己免疫は脳卒中後の認知症に寄与するか?Brain Behav. Immun. 64, 1-8. doi: 10.1016/j.bbi.2016.08.009.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Durgan, D. J., Lee, J., McCullough, L. D., Bryan, R. M., Jr. (2019). 脳卒中における微生物叢-腸-脳軸の役割を検証する。Stroke 50, 2270-2277.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Edwards, D. N., Bix, G. J. (2019). 脳卒中における血液脳関門インテグリンと細胞外マトリックスの役割。Am. J. Physiol. 316, C252-c263. doi: 10.1152/ajpcell.00151.2018.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Fang, Z., Chen, M., Qian, J., Wang, C., Zhang, J. (2023). 虚血性脳卒中と腸内微生物の架け橋: 短鎖脂肪酸。Cell Mol. Neurobiol. 43, 543-559. doi: 10.1007/s10571-022-01209-4
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ghelani, D. P., Kim, H. A., Zhang, S. R., Drummond, G. R., Sobey, C. G., De Silva, T. M. (2021). 虚血性脳卒中と感染症: 虚血性脳卒中と感染症:機序と潜在的治療法に関する簡単な最新情報。Biochem. Pharmacol. 193, 114768. doi: 10.1016/j.bcp.2021.114768.
パブコメ抄録|全文|Google Scholar
Goyal, M., Ospel, J. M., Menon, B., Almekhlafi, M., Jayaraman, M., Fiehler, J., et al. 急性虚血性脳卒中画像診断における虚血コア概念への挑戦。脳卒中 51, 3147-3155.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Haak, B. W., Littmann, E. R., Chaubard, J. L., Pickard, A. J., Fontana, E., Adhi, F., et al. 酪酸産生微生物叢による腸内コロニー形成が、allo-HCT後の呼吸器ウイルス感染に及ぼす影響。血液 131, 2978-2986.
パブコメ抄録|全文|Google Scholar
Haak, B. W., Westendorp, W. F., van Engelen, T. S. R., Brands, X., Brouwer, M. C., Vermeij, J. D., et al. 嫌気性腸内細菌の乱れは脳卒中および脳卒中後の感染と関連する: 前向き症例対照研究。脳卒中研究 12, 581-592.
PubMedアブストラクト|クロステキスト|Google Scholar
Hafez, S., Hoda, M. N., Guo, X., Johnson, M. H., Fagan, S. C., Ergul, A. (2015). 高血糖性脳梗塞の転帰における虚血/再灌流の異なる方法の比較解析:tPAとの相互作用。論文タイトル:Transl. Stroke Res.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Haghikia, A., Li, X. S., Liman, T. G., Bledau, N., Schmidt, D., Zimmermann, F., et al. 腸内細菌叢依存性トリメチルアミンN-オキシドは、脳卒中患者における心血管イベントのリスクを予測し、炎症性単球と関連している。Arterioscler. Thromb. Vasc. 生物学 38, 2225-2235. doi: 10.1161/ATVBAHA.118.311023
PubMedアブストラクト|全文|Google Scholar
Han, S., Cai, L., Chen, P., Kuang, W. (2023). 過去20年間の脳卒中と腸内細菌叢の相関に関する研究:書誌学的分析。Front. Microbiol. 14, 1191758.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hede Ebbesen, B., Modrau, B., Kontou, E., Finch, E., Crowfoot, G., Crow, J., et al. 一過性脳虚血発作と軽症脳卒中後の持続的障害:系統的レビュープロトコル。Front. Neurol. doi: 10.3389/fneur.2023.1177309.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hemmati, M., Kashanipoor, S., Mazaheri, P., Alibabaei, F., Babaeizad, A., Asli, S., et al. 心血管疾患(CVD)の発症における腸内細菌叢代謝産物の重要性。生命科学 329, 121947.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Hiippala, K., Jouhten, H., Ronkainen, A., Hartikainen, A., Kainulainen, V., Jalanka, J., et al. 腸管バリア機能の強化と炎症緩和における腸内常在菌の可能性。Nutrients 10, (8). doi: 10.3390/nu10080988.
CrossRef 全文|Google Scholar
Ho, L., Ono, K., Tsuji, M., Mazzola, P., Singh, R., Pasinetti, G. M. (2018). アルツハイマー病型βアミロイド神経病理学的メカニズムにおける腸内細菌叢由来短鎖脂肪酸の保護的役割。Expert Rev. Neurother 18, 83-90. doi: 10.1080/14737175.2018.1400909
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Holmqvist, F., Guan, N., Zhu, Z., Kowey, P. R., Allen, L. A., Fonarow, G. C., et al. 閉塞性睡眠時無呼吸と持続気道陽圧療法が心房細動患者の転帰に及ぼす影響-Outcomes Registry for Better Informed Treatment of Atrial Fibrillation(ORBIT-AF)の結果。Am. 169, 647-654.e642. doi: 10.1016/j.ahj.2014.12.024
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hu, W., Kong, X., Wang, H., Li, Y., Luo, Y. (2022). 虚血性脳卒中と腸内細菌叢:脳腸軸の洞察。Eur. J. Med. 論文概要] 脳梗塞と腸内細菌叢:脳-腸軸の洞察.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang, Q., Di, L., Yu, F., Feng, X., Liu, Z., Wei, M., et al. 実験的脳卒中における出血性転換に伴う腸内細菌叢の変化。CNS Neurosci. Ther. 28, 77-91.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang, Q., Xia, J. (2021). 脳卒中後の炎症・免疫反応における腸内細菌叢の影響。Neurol. 神経科学 42, 4937-4951.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jiang,Y.,Dai,Y.,Liu,Z.,Liao,Y.,Sun,S.,Kong,X.,他(2023)。腸脳軸からみた虚血性脳卒中におけるIL-23/IL-17軸の役割。神経薬理学 231, 109505.
パブコメ要旨|全文|Google Scholar
Jiang,W.、Gong,L.、Liu,F.、Ren,Y.、Mu,J.(2021年)。脳卒中後うつ病における腸内細菌叢の変化と脂質代謝の相関。Front. Cell Infect. Microbiol. 11, 663967.
パブコメ抄録|全文|Google Scholar
Kang,Y.、Yang,Y.、Wang,J.、Ma,Y.、Cheng,H.、Wan,D. (2021). 虚血性脳卒中の脳卒中後うつ病における腸内細菌叢と血清炎症因子の相関。J. Coll. Physicians Surg. 論文タイトル:「脳卒中における腸内細菌叢と血清炎症因子の相関」。
PubMedアブストラクト|全文|Google Scholar
Kasahara, K., Rey, F. E. (2019). 心血管疾患における腸内細菌代謝の新たな役割。Curr. Opin. Microbiol. 50, 64-70. doi: 10.1016/j.mib.2019.09.007.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kaur, G., Stein, L. K., Boehme, A., Liang, J. W., Tuhrim, S., Mocco, J., et al. 脳内出血に対する外科的介入後の感染による再入院のリスク。J. Neurol. Sci.399,161-166.doi:10.1016/j.jns.2019.02.016。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kishore, A. K., Jeans, A. R., Garau, J., Bustamante, A., Kalra, L., Langhorne, P., et al. 脳卒中に合併した肺炎に対する抗生物質治療: 脳卒中における肺炎のコンセンサス(PISCES)グループからの勧告。Eur. 4, 318-328. doi: 10.1177/2396987319851335.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kishore, A. K., Vail, A., Jeans, A. R., Chamorro, A., Di Napoli, M., Kalra, L., et al. 脳卒中に合併した肺炎の微生物学的病因: 系統的レビュー。doi: 10.1161/STROKEAHA.117.020250.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
栗田直樹、山城恭一郎、黒木崇、田中良和、占部達夫、上野泰之、他(2020).代謝性エンドトキシン血症は局所脳虚血後の神経炎症を促進する。J. Cereb Blood Flow Metab. 40, 2505-2520.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lee, J., d'Aigle, J., Atadja, L., Quaicoe, V., Honarpisheh, P., Ganesh, B. P., et al. 腸内細菌叢由来の短鎖脂肪酸は、高齢マウスにおける脳卒中後の回復を促進する。Circ. doi: 10.1161/CIRCRESAHA.119.316448.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Lee, J. R., Huang, J., Magruder, M., Zhang, L. T., Gong, C., Sholi, A. N., et al. 腎移植レシピエントにおける酪酸産生腸内細菌とウイルス感染: パイロット研究。Transpl Infect. Dis. 21, e13180. doi: 10.1111/tid.13180.
パブコメ要旨|全文|Google Scholar
Li, P. A., Liu, G. J., He, Q. P., Floyd, R. A., Siesjö, B. K. (1999). 一過性前脳虚血を受けた高血糖ラットの脳組織によるヒドロキシルフリーラジカルの産生。Free Radic. Biol. Med. 27, 1033-1040.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Li, S., Shao, Y., Li, K., HuangFu, C., Wang, W., Liu, Z., et al. 血管性認知障害と腸内細菌叢。J. Alzheimers Dis. 63, 1209-1222. doi: 10.3233/JAD-171103
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li, N., Wang, X., Sun, C., Wu, X., Lu, M., Si, Y., et al. 脳虚血性脳卒中患者における腸内細菌叢の変化.BMC Microbiol. 19, 191. doi: 10.1186/s12866-019-1552-1
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li, Y., Wang, Y., Yao, Y., Griffiths, B. B., Feng, L., Tao, T., et al. cyTOF法を用いた虚血性脳卒中後の免疫成分の系統的研究。J. Immunol. 2020、9132410.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lindner, A., Kofler, M., Rass, V., Ianosi, B., Gaasch, M., Schiefecker, A. J., et al. 自然発症脳内出血患者における感染性合併症の早期予測因子と転帰への影響。Front. Neurol. 10, 817. doi: 10.3389/fneur.2019.00817.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ling, Y., Gu, Q., Zhang, J., Gong, T., Weng, X., Liu, J., et al. 脳卒中後の認知障害とうつ病を合併した患者における腸内細菌叢の構造変化と臨床的特徴との相関。J. Alzheimers Dis. 77, 1595-1608.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu, W., Hendren, J., Qin, X. J., Shen, J., Liu, K. J. (2009). 局所脳虚血におけるMMP-9を介したオクルジンの分解を抑制することにより、正常圧力の高酸素血症は初期の血液脳関門の破綻を抑制する。J. Neurochem. 108, 811-820. doi: 10.1111/j.1471-4159.2008.05821.x
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Liu,Y.,Kong,C.,Gong,L.,Zhang,X.,Zhu,Y.,Wang,H.,他(2020)。脳卒中後の認知障害と腸内細菌叢およびその代謝産物との関連。J. Alzheimers Dis. 73, 1455-1466.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Long, J., Wang, J., Li, Y., Chen, S. (2022). 虚血性脳卒中における腸内細菌叢: 現在地と今後の課題。Front. doi: 10.3389/fnut.2022.1008514.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Luan, H., Wang, X., Cai, Z. (2019). 質量分析ベースのメタボロミクス: 神経変性疾患における腸内細菌叢と脳のクロストークを標的とする。Mass Spectrom Rev. 38, 22-33. doi: 10.1002/mas.21553.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Mao, L., Liu, X., Zheng, P., Wu, S. (2019). 急性脳卒中患者における呼吸器感染症の疫学的特徴、危険因子、および転帰。Ann. Indian Acad. Neurol. 22, 395-400. doi: 10.4103/aian.AIAN_212_18.
パブコメ抄録|全文|Google Scholar
Mao、H. Z., Xiong、F. T., Hu、M., Fu、Z. (2022). 重症脳卒中患者の栄養下痢改善に対する経腸栄養半固形化栄養の効果。ブラティスル レク リスティー 123, 214-217.
PubMed Abstract|全文|Google Scholar
Markowiak, P., Śliżewska, K. (2017). プロバイオティクス、プレバイオティクス、シンバイオティクスのヒトの健康への影響。Nutrients 9, (9). doi: 10.3390/nu9091021.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マルティネス-グアルダード、I.、Arboleya、S.、Grijota、F.J.、Kaliszewska、A.、Gueimonde、M.、Arias、N.(2022)。ストレスの多い脳の状態における運動とプロバイオティクスの治療的役割。Int. J. Mol. Sci. 23, (7). doi: 10.3390/ijms23073610
クロスレフ・フルテキスト|Google Scholar
Masenga, S. K., Povia, J. P., Lwiindi, P. C., Kirabo, A. (2023). 心不全における微生物関連代謝産物の最近の進歩。Doi: 10.3390/biomedicines11082313
クロスリファレンス全文|Google Scholar
Mendelson, S. J., Prabhakaran, S. (2021). 一過性脳虚血発作と急性虚血性脳卒中の診断と管理: 総説。Jama 325, 1088-1098. doi: 10.1001/jama.2020.26867.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Milani, C., Duranti, S., Bottacini, F., Casey, E., Turroni, F., Mahony, J., et al. ヒト腸の最初の微生物コロニー形成者: 乳児腸内細菌叢の組成、活動、健康への影響。Microbiol. Mol. Biol. Rev. 81, (4). doi: 10.1128/MMBR.00036-17
CrossRef 全文|Google Scholar
Muhammad, M., Muchimapura, S., Wattanathorn, J. (2023). 脳卒中の病態における微生物叢-腸-脳軸の障害:強力な治療標的としての意味合い。Biosci. doi: 10.12938/bmfh.2022-067.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nam, H. S. (2019). 腸内細菌叢と虚血性脳卒中: トリメチルアミンN-オキシドの役割。J. Stroke 21, 151-159.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Nesci,A.、Carnuccio,C.、Ruggieri,V.、D'Alessandro,A.、Di Giorgio,A.、Santoro,L.、他(2023)。腸内細菌叢と心血管疾患: 複雑な関係の代謝的・炎症的背景に関する証拠。Int. J. Mol. Sci. 24, (10). doi: 10.3390/ijms24109087
クロスレフ・フルテキスト|Google Scholar
Oktaviono, Y. H., Dyah Lamara, A., Saputra, P. B. T., Arnindita, J. N., Pasahari, D., Saputra, M. E., et al. アテローム性動脈硬化症におけるトリメチルアミン-N-オキシドの役割とその潜在的治療的側面: 文献レビュー。Biomol BioMed. 23, 936-948. doi: 10.17305/bb.2023.8893.
PubMedアブストラクト|全文|Google Scholar
大山直樹、Winek, K.、Bäcker-Koduah, P.、Zhang, T.、Dames, C.、Werich, M.、他(2018)。マウス局所脳虚血後の腸管機能と細菌トランスロケーションの探索的検討。Front. Neurol. 9, 937. doi: 10.3389/fneur.2018.00937
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Parada Venegas, D., de la Fuente, M. K., Landskron, G., González, M. J., Quera, R., Dijkstra, G., et al. 短鎖脂肪酸(SCFAs)が介在する腸上皮および免疫制御と炎症性腸疾患との関連性。Front. Immunol. 10, 277. doi: 10.3389/fimmu.2019.00277
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Passamonti, L., Tsvetanov, K. A., Jones, P. S., Bevan-Jones, W. R., Arnold, R., Borchert, R. J., et al. Neuroinflammation and functional connectivity in alzheimer's disease: interactive influences on cognitive performance. J. Neurosci. 39, 7218-7226. doi: 10.1523/JNEUROSCI.2574-18.2019.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Peh, A., O'Donnell, J. A., Broughton, B. R. S., Marques, F. Z. (2022). 脳卒中における腸内細菌叢とその代謝産物: 諸刃の剣。脳卒中 53, 1788-1801.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pluta, R., Januszewski, S., Czuczwar, S. J. (2021). 虚血性脳卒中における腸内細菌叢の役割。Int. J. Mol. Sci.22、(2).
CrossRef 全文|Google Scholar
Pu,B.、Zhu,H.、Wei,L.、Gu,L.、Zhang,S.、Jian,Z.、他(2023)。虚血性脳卒中と腸内細菌叢における免疫細胞の関与。Transl.脳卒中Res.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rustia, A. J., Paterson, J. S., Best, G., Sokoya, E. M. (2021). 腸内細菌の乱れは脳内皮機能障害を促進する。Physiol. 論文 9, e15100. doi: 10.14814/phy2.15100.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Sadler, R., Cramer, J. V., Heindl, S., Kostidis, S., Betz, D., Zuurbier, K. R., et al. 短鎖脂肪酸は免疫学的機序により脳卒中後の回復を改善する。J. Neurosci. 40, 1162-1173. doi: 10.1523/JNEUROSCI.1359-19.2019
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Samuels, M. A. (2007). 脳と心臓のつながり。循環 116, 77-84. doi: 10.1161/CIRCULATIONAHA.106.678995.
PubMed Abstract | CrossRef Full Text | Google Scholar
Samuelson, D. R., Gu, M., Shellito, J. E., Molina, P. E., Taylor, C. M., Luo, M., et al. アルコール給餌マウスの腸内微生物産物は、腸透過性と末梢免疫活性化に寄与する。アルコール Clin. Exp. 43, 2122-2133. doi: 10.1111/acer.14176.
パブコメ要旨|全文|Google Scholar
Sapountzis, P., Segura, A., Desvaux, M., Forano, E. (2020). 牛の消化管におけるとらえどころのない乗客:志賀毒素産生エシェリヒア・コリの概要。doi: 10.3390/microorganisms8060877.
CrossRef 全文|Google Scholar
Schulthess, J., Pandey, S., Capitani, M., Rue-Albrecht, K. C., Arnold, I., Franchini, F., et al. 短鎖脂肪酸酪酸はマクロファージに抗菌プログラムを刷り込む。Immunity 50, 432-445.e437. doi: 10.1016/j.immuni.2018.12.018.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Shih, D. M., Wang, Z., Lee, R., Meng, Y., Che, N., Charugundla, S., et al. フラビン含有モノオキシゲナーゼ3は、グルコースおよび脂質代謝とアテローム性動脈硬化症に幅広い効果を発揮する。脂質学会誌 56, 22-37.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shim, R., Wong, C. H. Y. (2018). 脳卒中後の感染症に寄与する複数の生物学的システムの複雑な相互作用。Brain Behav. Immun. 70, 10-20. doi: 10.1016/j.bbi.2018.03.019.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Singh, V., Roth, S., Llovera, G., Sadler, R., Garzetti, D., Stecher, B., et al. 微生物叢異常は脳卒中後の神経炎症反応を制御する。J. Neurosci. 36, 7428-7440. doi: 10.1523/JNEUROSCI.1114-16.2016
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Smith, L. K., Wissel, E. F. (2019). 微生物と心: 細菌はどのように情動、神経学的プロセス、認知、社会的関係、発達、病理を形成するか。Perspect. Psychol. サイエンス 14, 397-418. doi: 10.1177/1745691618809379
パブコメ要旨|全文|Google Scholar
Sorboni, S. G., Moghaddam, H. S., Jafarzadeh-Esfehani, R., Soleimanpour, S. (2022). ヒト神経疾患における腸内細菌叢の役割に関する包括的レビュー。Clin. Microbiol. Rev.35、e0033820. doi: 10.1128/CMR.00338-20
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Spence, J. D. (2018). 脳卒中予防のための食事。Stroke Vasc. Neurol. 3, 44-50. doi: 10.1136/svn-2017-000130.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Stanley, D., Moore, R. J., Wong, C. H. Y. (2018). 脳卒中後の腸管粘膜微生物叢の崩壊に関する洞察。論文誌8, 568.
PubMed Abstract|RefRef Full Text|Google Scholar
鈴木一彦・中島明博(2014).腸管におけるIgA合成の新たな側面. Int. Immunol. 26, 489-494.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tan,C.、Wu,Q.、Wang,H.、Gao,X.、Xu,R.、Cui,Z.、他(2021年)。急性虚血性脳卒中における腸内細菌叢と短鎖脂肪酸のディスバイオシスとその後の機能的転帰不良のリスク。日本栄養改善学会誌(JPEN)45, 518-529.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tian, P., O'Riordan, K. J., Lee, Y. K., Wang, G., Zhao, J., Zhang, H., et al. うつ病のサイコバイオティック療法に向けて: ビフィドバクテリウム・ブレーベCCFM1025は、マウスの慢性ストレス誘発性抑うつ症状と腸内細菌異常を逆転させる。Neurobiol. ストレス 12, 100216.
パブコメ要旨|全文|Google Scholar
Tian, P., Zou, R., Song, L., Zhang, X., Jiang, B., Wang, G., et al. ビフィドバクテリウム・ロンガム亜種インファンティス(Bifidobacterium longum subspecies infantis)CCFM687株の摂取は、腸内細菌叢の再形成を通じて、慢性ストレス誘発うつ病マウスの情動行動と中枢BDNF経路を制御した。Food Funct. 10, 7588-7598.
PubMed Abstract|全文|Google Scholar
Tuz, A. A., Hasenberg, A., Hermann, D. M., Gunzer, M., Singh, V. (2022). 虚血性脳卒中と消化管合併症の併発は、患者の回復にとって致命的な組み合わせである。Front. Immunol. doi: 10.3389/fimmu.2022.1037330.
PubMed Abstract|全文|Google Scholar
Tyler Patterson, T., Grandhi, R. (2020). 腸内細菌叢と神経疾患・傷害。Adv. Exp. Med. doi: 10.1007/978-981-15-2385-4_6.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Ułamek-Kozioł, M., Czuczwar, S. J., Januszewski, S., Pluta, R. (2020). 虚血再灌流脳損傷後のアルツハイマー病に関連するタウ蛋白質のプロテオームおよびゲノムの変化。Int. J. Mol. サイエンス 21, (3).
クロスリファレンス全文|Google Scholar
Vallianou, N., Stratigou, T., Christodoulatos, G. S., Tsigalou, C., Dalamaga, M. (2020). プロバイオティクス、プレバイオティクス、シンバイオティクス、ポストバイオティクスと肥満: 現在のエビデンス、論争、展望。Curr. Obes. 論文 9, 179-192.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Victoria, E. C. G., Toscano, E. C. B., Oliveira, F. M. S., de Carvalho, B. A., Caliari, M. V., Teixeira, A. L., et al. 脳内サイトカインとメタロプロテアーゼ1および2のアップレギュレーションは、一過性虚血性脳卒中における神経学的欠損と脳損傷に寄与する。本論文は、一過性脳虚血発作における脳内サイトカインおよびメタロプロテアーゼ1および2のアップレギュレーションが、神経障害および脳損傷に寄与していることを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, J., Liu, X., Li, Q. (2023a). 腸内細菌叢の調節に基づく虚血性脳卒中の介入戦略。Front. Neurosci. 17, 1158057.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
潘 慈(Pan, C.)、謝 慈(Xie, C.)、陳 麗(Chen, L.)、宋 兆(Song, Z.)、廖 浩(Liao, H.)、他(2023c)。微生物叢の代謝産物と免疫制御は虚血性脳卒中の発生、発症、予後に影響する。Mol. Neurobiol. 60, 6176-6187. doi: 10.1007/s12035-023-03473-x
パブコメ要旨|全文|Google Scholar
Wang, Z., Roberts, A. B., Buffa, J. A., Levison, B. S., Zhu, W., Org, E., et al. アテローム性動脈硬化症の治療のための腸内微生物トリメチルアミン産生の非致死的阻害。細胞 163, 1585-1595. doi: 10.1016/j.cell.2015.11.055
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang,H.、Song,W.、Wu,Q.、Gao,X.、Li,J.、Tan,C.、他(2021)。酪酸ナトリウムで処理したdb/dbマウスの糞便移植は虚血性脳卒中障害を減弱させる。Microbiol. Spectr. 9, e0004221. doi: 10.1128/Spectrum.00042-21
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang,L.、Yang,L.、Liu,H.、Pu,J.、Li,Y.、Tang,L.、他(2023b)。急性虚血性脳卒中後のCRP値と認知機能低下: システマティックレビューとメタアナリシス。doi: 10.3390/brainsci13071082
クロスリファレンス全文|Google Scholar
Wang, J., Zhang, H., He, J., Xiong, X. (2022). 虚血性脳卒中の発症における腸内細菌叢の役割。Front. Immunol. doi: 10.3389/fimmu.2022.845243.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wattoo, M. A., Tabassum, M., Bhutta, K. R., Rafi, Z., Kaneez, M., Razzaq, M. T., et al. 虚血性脳卒中患者における院内肺炎の臨床的および微生物学的解析: レトロスペクティブな展望。Cureus 13, e15214. doi: 10.7759/cureus.15214.
PubMed Abstract|RefRef Full Text|Google Scholar
Wei,Y.H.、Bi,R.T.、Qiu,Y.M.、Zhang,C.L.、Li,J.Z.、Li,Y.N.、他(2023)。消化管-脳-微生物叢軸:虚血性脳卒中の有望な治療標的。Front. Immunol. doi: 10.3389/fimmu.2023.1141387.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Westendorp, W. F., Nederkoorn, P. J., Vermeij, J. D., Dijkgraaf, M. G., van de Beek, D. (2011). 脳卒中後の感染症:系統的レビューとメタ解析。BMC Neurol. 11, 110. doi: 10.1186/1471-2377-11-110
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Westendorp, W. F., Vermeij, J. D., Brouwer, M. C., Roos, Y. B., Nederkoorn, P. J., van de Beek, D. (2016). 脳卒中前のβ遮断薬使用は脳卒中後の感染率を低下させない: 脳卒中における予防的抗生物質研究の探索的解析。Cerebrovasc Dis. 42, 506-511.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Westendorp, W. F., Zock, E., Vermeij, J. D., Kerkhoff, H., Nederkoorn, P. J., Dijkgraaf, M. G. W., et al. 脳卒中における予防的抗生物質研究(PASS): 費用対効果研究。Neurology 90, e1553-e1560. doi: 10.1212/WNL.0000000000005412.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Widimsky, P., Snyder, K., Sulzenko, J., Hopkins, L. N., Stetkarova, I. (2023). 急性虚血性脳卒中:再灌流治療における最近の進歩。Eur. doi: 10.1093/eurheartj/ehac684
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wildgruber, M., Aschenbrenner, T., Wendorff, H., Czubba, M., Glinzer, A., Haller, B., et al. 中間」CD14(++)CD16(+)単球サブセットは、ヒトの重症末梢動脈疾患で増加する。サイエンスリポート6, 39483.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Wu, J., Fan, C. L., Ma, L. J., Liu, T., Wang, C., Song, J. X., et al. 虚血性脳卒中および一過性脳虚血発作患者における血清マイクロRNAの特徴的な発現シグネチャー。Thromb. Haemost. 117、992-1001。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wurtman, R. J. (2008). シナプス形成と認知脳の発達:ドコサヘキサエン酸と他の食事成分の影響。メタボリズム 57 Suppl 2, S6-10.
パブコメ要旨|全文|Google Scholar
Xia, G. H., You, C., Gao, X. X., Zeng, X. L., Zhu, J. J., Xu, K. Y., et al. 腸内細菌叢における脳卒中dysbiosis index(SDI)は、脳損傷および脳卒中の予後と関連している。Front. Neurol. 10, 397. doi: 10.3389/fneur.2019.00397.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Xie,Y.、Zou,X.、Han,J.、Zhang,Z.、Feng,Z.、Ouyang,Q.、他(2022年)。インドール-3-プロピオン酸はマウス中大脳動脈閉塞モデルにおける虚血性脳障害を緩和する。Exp. Neurol. 353, 114081.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yang, Y., Karampoor, S., Mirzaei, R., Borozdkin, L., Zhu, P. (2023). 心血管疾患における微生物代謝産物とマクロファージの相互作用: 包括的レビュー。Int. Immunopharmacol 121, 110546.
パブコメ要旨|全文|Google Scholar
Yang,Z.、Wei,F.、Zhang,B.、Luo,Y.、Xing,X.、Wang,M.、他(2022)。虚血性脳卒中から腸病変への脳腸軸を介した細胞免疫シグナル交換。Front. Immunol. 13, 688619.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yang, J., Zhou, G., Ou, Z., Jia, N., Wang, D. (2021). 腸内細菌叢に基づく脳卒中後うつ病ラットに対する運動トレーニングの効果とメカニズム。Comput. Math Methods Med. 2021, 3567447. 論文番号: 10.1155/2021/3567447
パブコメ要旨|全文|Google Scholar
Ye, D., Hu, Y., Zhu, N., Gu, W., Long, G., Tao, E., et al. マウスの脳卒中後の腸の構造と機能の探索的研究。Mediators Inflammation 2021, 1315797.
CrossRef 全文|Google Scholar
吉村慎一郎、豊田耕一郎、大原崇、長澤秀樹、大谷直樹、桑代高志、他(2008).急性虚血性脳卒中におけるたこつぼ心筋症。Ann. Neurol. 64, 547-554.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yu, T., Guo, F., Yu, Y., Sun, T., Ma, D., Han, J., et al. Fusobacterium nucleatumは、オートファジーを調節することにより、大腸がんの化学療法抵抗性を促進する。Cell 170, 548-563.e516. doi: 10.1016/j.cell.2017.07.008.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Yu,X.,Zhou,G.,Shao,B.,Zhou,H.,Xu,C.,Yan,F.,他(2021年)。脳内出血による腸内細菌叢異常はマウスの神経炎症を悪化させる。Front. Microbiol. 12, 647304.
パブコメ抄録|全文|Google Scholar
Yuan, B., Lu, X. J., Wu, Q. (2021a). 腸内細菌叢と急性中枢神経系傷害: 治療介入のための新たな標的。Front. Immunol. doi: 10.3389/fimmu.2021.800796.
パブコメ要旨|全文|Google Scholar
Yuan, Q., Xin, L., Han, S., Su, Y., Wu, R., Liu, X., et al. ラクチュロースは、脳卒中後のマウスにおいて、有害な細菌を抑制し、炎症反応を制御することにより、神経学的転帰を改善する。Front. Cell Infect. Microbiol. 11, 644448.
パブコメ抄録|全文|Google Scholar
Zbesko, J. C., Frye, J. B., Becktel, D. A., Gerardo, D. K., Stokes, J., Calderon, K., et al. 脳卒中後のT細胞非依存性B細胞活性化に伴い、IgA自然抗体が産生される。Brain Behav. Immun. 91, 578-586.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang,Q.,Deng,P.,Chen,S.,Xu,H.,Zhang,Y.,Chen,H.,他(2023b)。電気鍼とヒトiPSC由来小細胞外小胞は、脳腸軸を介して虚血性脳卒中における腸内細菌叢を制御する。Front. Immunol. 14, 1107559.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
張、W., 東、X. Y., 黄、R. (2022). 虚血性脳卒中における腸内細菌叢:腸内細菌由来代謝産物の役割。脳卒中における腸内細菌叢:腸内細菌由来代謝産物の役割。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang,H.、Huang,Y.、Li,X.、Han,X.、Hu,J.、Wang,B.、他(2021年)。脳内出血マウスにおける二次性肺感染の動態。Front. Immunol. doi: 10.3389/fimmu.2021.767155.
PubMedアブストラクト|全文|Google Scholar
Zhang,P.,Wang,R.,Qu,Y.,Guo,Z.N.,Yang,Y.(2023a)。腸内細菌叢由来代謝物トリメチルアミン-N-オキシドと脳卒中転帰:系統的レビュー。Front. Mol. Neurosci. 16, 1165398.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang, H., Yao, G. (2023). 腸内細菌叢由来の代謝産物トリメチルアミン-N-オキシドと脳卒中リスクとの有意な相関:23の観察研究に基づくエビデンス。Eur. J. Clin. 栄養学 77, 731-740.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhao, L., Xiao, J., Li, S., Guo, Y., Fu, R., Hua, S., et al. 腸内微小環境と脳卒中の相互作用。CNS Neurosci. Ther. 29 Suppl 1, 185-199.
PubMed Abstract|RefRef Full Text|Google Scholar
Zhao,Y.、Zhou,C.、Guo,X.、Hu,G.、Li,G.、Zhuang,Y.、他(2021年)。マウスの水銀曝露による酸化ストレス、腸内細菌叢の変化とその関連性。Biol. 199,1900-1907.doi:10.1007/s12011-020-02300-x。
パブコメ要旨|全文|Google Scholar
周陽子、陳陽子、何昊、彭真、曾真、孫昊(2023年)。微生物叢-腸-脳軸におけるインドールの役割と潜在的治療標的: ヒトの神経疾患および精神神経疾患を中心に。神経薬理学 239, 109690.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zou, X., Wang, L., Xiao, L., Wang, S., Zhang, L. (2022). 脳血管疾患における腸内細菌: 腸内細菌叢のアンバランス、潜在的影響メカニズム、有望な治療戦略。フロント。Immunol. 13, 975921.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:腸内細菌叢、虚血性脳卒中、合併症、予後、治療
引用 虚血性脳卒中後の合併症における腸内細菌叢の役割。Front. Cell. Infect. Microbiol. 14:1334581.
受理:2023年11月07日 2023年11月07日;受理:2024年3月25日;
発行:2024年04月05日
編集者
順天堂大学医学部附属浦安病院 山城和夫
査読者
Justyna Agier, ウッチ医科大学, ポーランド
Wenjing Zhao, 中山大学深圳キャンパス, 中国
Copyright © 2024 Zhang, Ling, Xiang, Li, Bao and Yue. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣例に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Wei Yue, hhyuewei2008@163.com
免責事項:本論文で表明されたすべての主張は、あくまでも著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
腸内細菌叢は胆石症と因果関係がある:2標本メンデルランダム化研究
シン・リウ、シン・チー、ロンシュアン・ハン、タオ・マオ、ジビン・ティアン
L. interrogans血清群におけるAMRメカニズム: 包括的研究
パブロ・ペタフ、オレクサンドル・カムシニ
細菌性膣炎女性における膣内細菌叢分子プロファイリングと人工知能支援マルチプレックスPCR検査の診断性能:単一施設での経験
Sihai Lu、Zhuo Li、Xinyue Chen、Fengshuangze Chen、Hao Yao、Xuena Sun、Yimin Cheng、Liehong Wang、Penggao Dai
病原性細菌偏性細胞内寄生体の代謝と生理学
キャメロン・G・マンデル、サバンナ・E・サンチェス、コリーン・C. モナハン、ウィーラワット・プクリア、アンダース・オムスランド
中国北西部の都市部の小児におけるさまざまな要因のもとでの腸内細菌叢と糞便および血液中のメタボロームの特徴づけ
ヤン・ヤン、チェン・ファンジュアン、ガオ・フイユ、キュイ・ミングル、朱・ミンギュ、翔・雪松、ワン・チー
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
