機能性胃腸障害(FGID)におけるイオンチャネルの役割: チャネル病態の証拠と今後の研究および治療標的の可能性
第24巻
第13号
10.3390/ijms241311074
設定
論文の別刷りを注文する
オープンアクセス総説
機能性胃腸障害(FGID)におけるイオンチャネルの役割: チャネル病態の証拠と今後の研究および治療標的の可能性
https://www.mdpi.com/1422-0067/24/13/11074
著
ファティマ・マクード
1,
ドメニコ・トリカリコ
2,
ロザンナ・マラマチ
3,
アントネッラ・オルランド
1名
フランチェスコ・ルッソ
1,*
1
機能性胃腸障害研究グループ、国立消化器病研究所IRCCS "Saverio de Bellis", Castellana Grotte, 70013 Bari, Italy
2
バーリ大学薬学部薬理学科、70125バーリ、イタリア
3
バーリ・アルド・モーロ大学バイオサイエンス・バイオテクノロジー・環境学部、70125 バーリ、イタリア
*
著者
Int. J. Mol. Sci. 2023, 24(13), 11074; https://doi.org/10.3390/ijms241311074
受理:2023年5月31日 受理:2023年5月31日 / 改訂:2023年6月29日 / 受理:2023年7月4日 受理:2023年5月31日 / 改訂:2023年6月29日 / 掲載:2023年7月4日
(この論文は 分子内分泌代謝学部門に属しています。)
ダウンロード
図を見る
バージョン ノート
要旨
機能性消化管障害(FGID)には、内臓過敏症、運動障害、腸管透過性の変化など、いくつかの消化管異常が関与している。イオンチャネルは、上記のすべての機能において重要な役割を果たしている。ホルモンや天然分子はこれらのチャネルを調節し、薬物や細菌毒素の標的となっている。イオンチャネルサブユニットの変異や機能発現異常は、チャネル異常症と呼ばれる疾患の原因となる。消化器病学におけるこれらのチャネル異常症は強い関心を集めており、相関関係の証拠も増えつつある。本総説では、チャネル異常症とFGIDsの相関状況について述べる。さまざまな所見が得られている。中でもABCC7/CFTR遺伝子の変異は便秘や下痢の原因として報告されている。代わりにSCN5A遺伝子の変異が過敏性腸症候群と関連している。対照的に、一過性受容体電位(TRP)スーパーファミリーのTRPV1およびTRPA遺伝子の変異は、知覚神経における知覚過敏や内臓痛を引き起こす。最近、Kir6.1およびSUR2サブユニットをコードするKCNJ8およびABCC9遺伝子の変異に関連するCantu症候群(CS)に罹患したマウスおよびヒトが、腸全体の収縮機能障害を示し、固形食離乳後にマウスが死亡した。チャネル異常症とFIGDの相関の発見は、特定のチャネル異常症に対する新たな直接的創薬標的を発見する新たな道を開くものであり、機能性消化器疾患の診断と治療に重要な示唆を与えるものである。
キーワード
イオンチャネル、機能性消化管障害、トランスポーター、一過性受容体電位、アクアポリン、ATP感受性K+チャネル、カルシウム活性化K+チャネル、電位依存性ナトリウムチャネル、過敏性腸症候群(IBS)、腸管異食症
はじめに
チャネル異常症とは、イオンチャネル遺伝子をコードするサブユニットやその相互作用タンパク質の機能障害や変異によって引き起こされる疾患を指す。
400以上の遺伝子にコードされるイオンチャネルとアクアポリン水チャネル(AQP)は、主に脂質二重層に局在し、半透膜の脂質二重層を介したイオンと水の移動に重要な役割を果たしている。イオンチャネルはすべての細胞に発現しており、多くの細胞の特殊な機能に不可欠である[1]。アクアポリン(AQP)は、様々な臓器や組織の特定の細胞型に広く局在しており、細胞間の体液移動の管理に重要な役割を果たしている [2]。消化管(GI)上皮では、イオンチャネルとAQPが腸全体に発現している。これらは腸機能の大部分に関与しており、その機能不全は機能性腸疾患の症状の一因となっている。上皮細胞や腸平滑筋細胞に存在するイオンチャネルは、体液の分泌、吸収、運動、腸管透過性など、消化に関わるほとんどの局面を駆動している。さらに、異常な痛みや内臓感覚を含む感覚シグナルは、外在性感覚ニューロンのレベルでの受容体やイオンチャネルの発現や機能障害に依存している [3] 。
イオンチャネルの変化は、イオンチャネルのサブユニットをコードする遺伝子の欠陥によって引き起こされる。これらの疾患は、多くの場合、リン酸化、ユビキチン化、グリコシル化、パルミトイル化などのゲノム、転写、翻訳、翻訳後修飾、ノンコーディングRNAによる制御、あるいはイオンチャネルを形成するサブユニットと多タンパク質複合体の相互作用に関連したチャネル機能や発現の異常によって引き起こされる。さらに、環状ヌクレオチドや脂質などの複数のシグナル分子によるイオンチャネルの調節異常が、チャネル障害を引き起こすこともある[4]。チャネル異常症は、心臓病学や神経学の分野ではよく知られているが [5,6,7]、消化器病学においても、消化管機能の制御におけるチャネル異常症の多面的な作用により、その役割が注目されている [8,9]。
消化器疾患では、チャネル異常症が様々な機能性消化管障害(FGID)の発症に関与している可能性がある [8] 。FGIDs」という用語は、消化器系の機能に影響を及ぼすが、明確な構造的または生化学的根拠を持たない疾患群を包含する。これらの疾患は、過敏性腸症候群(IBS)、機能性ディスペプシア(FD)、機能性便秘に分類される [10] 。
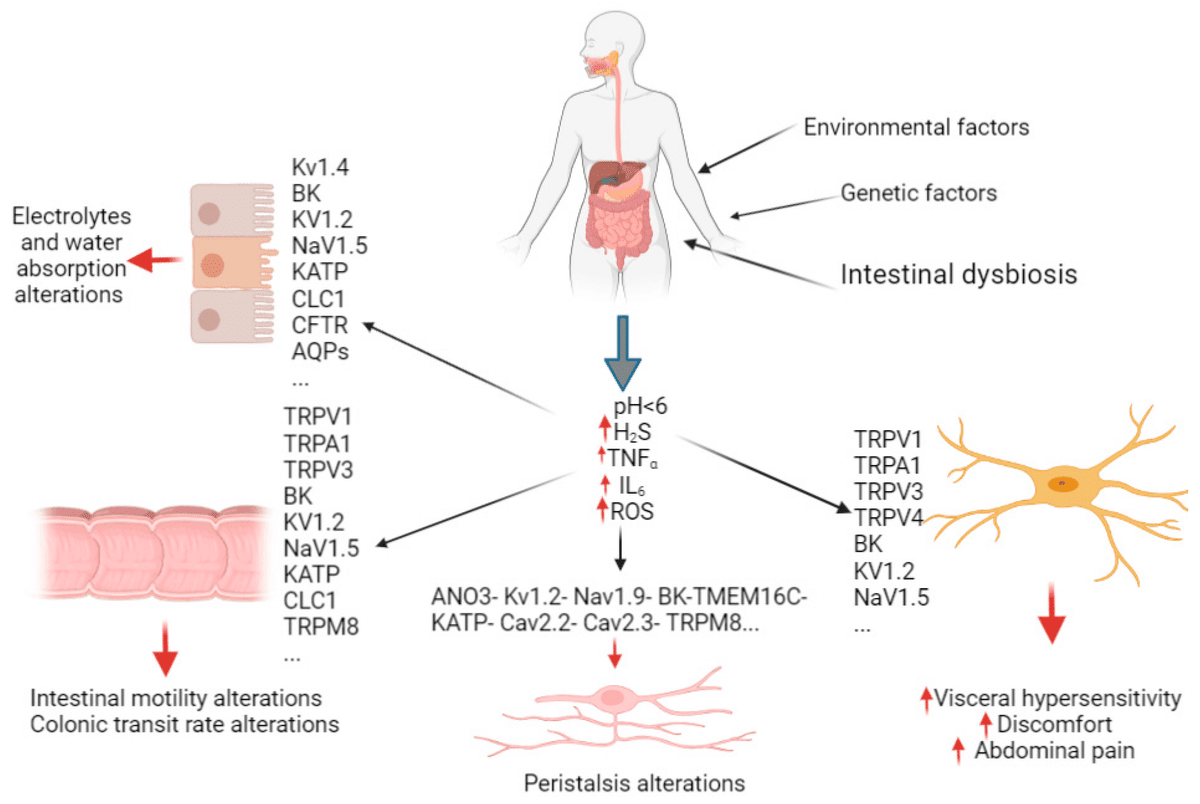
FGIDの発現には、複数の病態生理学的メカニズムが関与している(図1) [10] 。慢性感染症、腸内細菌叢の変化、低悪性度粘膜炎症、発酵および浸透圧効果はすべて、FGIDsの病因に呼び起こされるメカニズムである [11] 。さらに、腸の運動障害、腸管バリア機能障害、腸管免疫機能障害、内臓過敏症、消化管分泌の変化、胆汁酸の存在と程度などの変化も、FGIDに関与する病態生理学的メカニズムである [12] 。これらのプロセスにおいて、イオンチャネルは重要な役割を果たしており、イオン伝導能の障害はFGIDの病態生理につながる可能性がある [8] 。
図1. FGIDにおけるイオンチャネルとAQPの関与の可能性を示す図。様々なイオンチャネルやそのサブタイプは、様々な消化管細胞を標的として、体液分泌、吸収、運動、腸管透過性、感覚シグナル管理などの重要な消化管活動を制御しており、それらの機能不全はFGIDの症状や病態生理学的過程に寄与している。イオンチャネルの中には、一過性受容体電位(TRP)ファミリーのように、知覚過敏や腹痛に関連するものもある。ATP感受性(KATP)やカルシウムチャネル(Cav)のような代謝感知イオンチャネルは、蠕動運動を制御する。クロライドチャネル(CLC)、TRP、ナトリウムチャネル(Nav)は腸の運動調節に関与し、嚢胞性線維症膜貫通調節因子(CFTR)、クロライドチャネル、いくつかのカリウムチャネル(BK、Kv、KATP)、アクアポリン(AQP)は電解質の吸収と水分を調節している。これらの調節は、炎症因子とpHによって媒介される。
この総説では、PubMed、Virtual Library in Health (BVS)、NCBIの電子データベースで、"Virtual Library in Health (BVS) "という検索語を用いて層別化文献検索を行った、 およびNCBIにおいて、"ion channels "または "receptor "または "aquaporin water channels (AQP)"、"visceral hypersensitivity "または "visceral nociception "または "tight junctions interactions "または "colon motility "または "colonic fluid and electrolyte transport "および "syndrome of irritable bowel IBS/FGID "という検索語を用いて層別化した文献検索を行い、IBSに関連するさまざまな側面におけるイオンチャネルおよびAQPの関与について検討した。
また、イオンチャネルやAQPをコードする遺伝子を、低悪性度消化管障害/IBSや炎症の診断、予後、治療標的として研究する可能性を評価した(表1)。これらの疾患には、神経細胞や平滑筋細胞などの興奮性細胞や非興奮性細胞が関与している。
興奮性細胞と非興奮性細胞は、生体内に存在する別個の細胞タイプであり、電気信号、特に活動電位を発生し伝播する能力が異なる。主に神経系(ニューロン)と筋組織(心筋細胞および骨格筋線維)に存在する電気興奮性細胞は、ユニークな能力を持っている。興奮性細胞の特筆すべき特徴としては、静止膜電位を維持すること、細胞膜全体に電荷の差があること(通常、内部は外部と比べて負に帯電している)などが挙げられる。また、興奮性の細胞は膜に特殊なイオンチャネルを持ち、ナトリウム(Na+)、カリウム(K+)、カルシウム(Ca2+)などのイオンの流れを調節する。逆に、非起電性細胞は活動電位や電気信号を発生・伝達することができない。このような細胞は、上皮細胞、結合組織細胞、ほとんどの循環器系や消化器系の細胞など、様々な組織や器官に存在する。非起電性細胞の主な特徴は、興奮性細胞で観察される急激な変動がなく、安定した静止膜電位が維持されていることである。活動電位の代わりに、非可逆性細胞は、ホルモンのような化学メッセンジャー、パラクリンシグナル、あるいは機械的刺激のような別のシグナル伝達メカニズムを通して、生理的プロセスを調節する [13] 。
非可逆性細胞はイオンチャネルを持っているかもしれないが、その役割は興奮性細胞とは異なる。非興奮性細胞のイオンチャネルは、電気信号を発生させるよりも、体液バランス、栄養輸送、細胞間コミュニケーションなどの細胞機能を主に調節している。特定の細胞が、興奮性細胞と非興奮性細胞の両方の特徴を併せ持つ、ハイブリッドな挙動を示すことは注目に値する。例えば、心臓の心筋細胞は、イオンチャンネルやシグナル伝達機構の特定の側面は異なるものの、神経細胞や筋細胞に対する電気的興奮性を示す。Ca2+イオンは、組織の電気的活性と収縮力を調節するのに不可欠である[14]。電位依存性カルシウムチャネルを持つ細胞では、細胞の脱分極により細胞内カルシウムイオンの増加が起こり、これらのカルシウムチャネルが活性化される。一方、TRPチャネルの活性が低下すると細胞は過分極し、電 気化学的勾配が増大する。しかし、細胞が機能的な電位依存性カルシウムチャネルとTRPチャネルの両方を発現している場合、TRPチャネルの活性化は細胞を脱分極させ、それによって電位依存性カルシウムチャネルが活性化され、結果として細胞内カルシウムイオンが増加する [15]。
表1. FGIDにおけるイオンチャネルの役割、文献データ。イオンチャネルとFGID
2.1. イオンチャネルと過敏性腸症候群
IBSは、痛み、不快感、腹部膨満感、排便習慣の変化を引き起こす消化器疾患である。ストレスや不安は、腸管運動、内臓知覚、免疫機能を変化させ、IBS発症の一因となる [29,30] 。ディスバイオーシスや腸内細菌叢組成の変化も、IBSの症状や発症に関与している可能性がある [32] 。研究により、腸管運動、炎症、痛覚などを調節する遺伝子を含む、IBSのリスク上昇に関連するいくつかの遺伝子が同定されている [32] 。
IBSの正確な原因は不明であるが、腸内細菌叢の変化/ディスバイオシスと脳-腸相互作用の変化に関連するいくつかのメカニズムが複雑に絡み合っていると考えられている [33] 。腸管運動および分泌機能異常、内臓過敏症(VH)の亢進、痛覚の変化、腸粘膜免疫活性化の亢進、および身体的・精神的合併症も関与している [42] 。
VHは、正常な生理的刺激に対する異常な反応(アロディニアとして知られる)と腹部領域の疼痛知覚の亢進(痛覚過敏として知られる)を特徴とする。VHは、過敏性腸症候群(IBS)の患者が経験する痛みの主な原因であると考えられている。このような感受性の亢進は、運動活動の変化のみに起因するのではなく、炎症やストレスに関連する様々な因子の影響を受けて、末梢および中枢の侵害受容経路の感作につながると考えられる [44,45] 。最近、チャネル異常症とIBSとの関連を探ることに関心が高まっている。
カリウムチャネルKv7.1をコードするKCNQ1遺伝子の変異は、IBS発症リスクの増加と関連している。さらに、IBS患者は健常者よりもKCNQ1に変異を有する可能性が高かった [46] 。LQT1に一致するKCNQ1 Ser 349 Ter遺伝子の致死的遺伝子変異を有する小児患者の症例報告では、一般的な消化管病原体が存在しないにもかかわらず、広範な腹痛、嘔吐、下痢などの消化器症状が報告されており、これらはすべて陰性であった [47] 。
さらに、QT1型のJervell and Lange-Nielsen症候群(JLNS;ナンセンス変異KCNQ1 p.Arg518Xおよびp.Arg190AlafsX95を有する)の一部の患者では、血清ガストリン値が有意に上昇し、酸分泌の欠如と多発性胃カルチノイド腫瘍の存在を伴う。この証拠は、胃分泌におけるKCNQ1遺伝子の役割と、不整脈重症度のマーカーとしてのガストリンの役割を示唆している [48,49] 。
逆に、電位依存性ナトリウムチャネルNaV1.5のαサブユニットをコードするSCN5Aの変異によって引き起こされる心不整脈患者の多くは、過敏性腸症候群(IBS)の症状も有している [26] 。さらに、SCN1A、SCN2A、SCN8A、KCNB1、KCNQ2、KCNQ3(それぞれ電位依存性ナトリウムチャネルNav1.1、Nav1.2、Nav1.6、Kv2.1、Kv7.2、Kv7.3のαサブユニットをコードする)に変異を持つてんかん患者は、重篤な消化器症状を呈し、経鼻胃管や胃瘻による栄養補給を必要とする患者もいる [50,51] 。これらのデータは、これらの遺伝子がコードするタンパク質が、腸管の収縮活動を制御したり、有害刺激に対する大腸求心性感覚応答を媒介したりするなど、消化管の適切な機能に特異的に関与しているのではないかという疑問を提起している。
このような遺伝学的研究に加えて、IBS症状に対するチャネル遮断薬の薬理学的効果を調べる研究も行われている。その中で、L型カルシウム拮抗薬であるニフェジピンはIBS患者の症状を改善した。IBS患者において、ニフェジピン(20mg)を舌下投与したところ、食後の筋電・大腸収縮活動および運動指数の上昇が抑制された。この研究では、L型カルシウム拮抗薬が痛みを軽減し、消化管の運動を改善した可能性が示唆された [52,53] 。
下痢を主徴とするIBS患者91人を対象とした臨床試験では、消化管平滑筋に特異的なL型カルシウム拮抗薬である臭化ピナベリウム(50mg、1日2回投与)またはメベベリン(100mg、1日2回投与)を2週間投与したところ、下痢を主徴とするIBS患者において、全体的な感覚の改善とともに便の回数が減少した。臭化ピナベリウムとメベベリンによる治療では腹痛を緩和できなかったことから、カルシウムチャネルが上皮細胞や平滑筋細胞の機能に密接に関係していることが示唆された [54] 。
2.2. イオンチャネルと機能性ディスペプシア
機能性ディスペプシア(FD)は、持続性または再発性の上腹部痛、不快感、早期満腹感、食後満腹感、腹部膨満感などの症状を引き起こす一般的な消化器疾患で、根本的な構造異常はない。その病因論的機序には、生理学的、心理学的、環境的、遺伝的因子が関与している [55] 。胃運動および胃排出、内臓知覚過敏、胃酸分泌異常は、FD発症と関連している。ストレス、不安、食習慣は、心理的および環境的因子のひとつである。遺伝的要因も同定されている。胃の運動や分泌の調節、炎症、痛みの知覚に関わる遺伝子など、FDリスクの上昇に関連する遺伝子がいくつか同定されている。善玉菌の減少や病原性細菌(すなわち、ビフィズス菌やヘリコバクター・ピロリ菌)の増加を含む腸内細菌叢の変化 [59] も、その一因として示唆されている。
チャネル異常症とFDの関係については、さまざまな研究がなされている。ナトリウムチャネルNav1.5をコードするSCN5A遺伝子の変異は、FD発症リスクの増加と関連していた。この研究では、FDを発症している人は、FDを発症していない人よりもSCN5Aに変異を有している可能性が高いことがわかった [8,60]。
これらの遺伝学的研究に加えて、チャネル遮断薬のFD症状への影響も過去数年間に検討されている [8,61]。
カルシウムチャネル遮断薬は、平滑筋収縮を抑制し、細胞分泌を阻害することによって消化管機能を調節することができるため、これまでの研究では、主に平滑筋収縮を阻害するこれらの薬剤の能力に焦点が当てられてきた [62] 。ベラパミルやジルチアゼムはオポッサムやヒヒなどの動物で食道平滑筋の収縮を抑制し、その結果、蠕動運動の振幅が減少し、食道括約筋圧が低下することが示されている。同様に、ヒトでの研究でも、経口用量のジルチアゼムとニフェジピンが食道に対して同様の作用を示すことが証明されており、現在ではニフェジピンがアカラシアの治療に主に用いられている [63] 。しかし、これらの薬剤がFD治療に大きな影響を及ぼすことを裏付ける実験的証拠はない。
2.3. イオンチャネルと機能性便秘
機能性便秘(FC)は、慢性便秘の一種であり、基礎疾患や消化管の構造的異常によって引き起こされるものではない。これは、世界中の小児および成人によくみられる症状であり、一般人口の約14%が、人生のどこかで機能性便秘に苦しんでいると推定されている [64] 。
機能性便秘の正確な原因はよくわかっていない。しかし、生活習慣や食習慣、腸内細菌叢、心理社会的因子など、いくつかの因子がその発症に関与していることが提唱されている [65] 。
運動不足や座りがちな行動などの生活習慣因子は、FCの発症リスクを高める [66] 。同様に、食物繊維の摂取量が少ない、加工食品や精製食品の摂取量が多いなどの食事要因も、便秘リスクの上昇と関連している [67] 。
腸内細菌叢もまた、FCの発症に不可欠な役割を果たしている。研究により、腸内細菌叢の構成および機能の変化が便秘の発症に寄与することが示されている [68] 。例えば、FC患者では、ビフィドバクテリウム属やラクトバチルス属の減少や、クロストリジウム・ディフィシル(Clostridium difficile)などの病原性細菌の増加が観察されている [69] 。
ストレス、不安、うつ病などの心理社会的因子もFC発症の一因となりうる。ストレスや不安は、腸-脳軸を変化させ、腸の運動や分泌の変化を引き起こし、IBSや便秘の一因となることがある [70] 。
科学文献では、FCが腸神経障害から生じるのか、またその発症に遺伝的要因が関与しているのかについて、長い間議論がなされてきた。この議論は、主に早期発症の症状や家族性のパターンに関する臨床的観察に基づいて、1960年代から続けられてきた。しかし、この文献を詳しく調べてみても、メンデル遺伝、非罹患の一卵性双生児、地域対照における同程度の家族歴の割合については、ほとんど証明されていない [71] 。最近、チャネル異常とFCの関係に関心が高まっている。
機能性便秘に関与するイオンチャネルのひとつに、大腸の平滑筋細胞に存在するナトリウムチャネルNav1.5がある。Nav1.5の発現や機能の変化が大腸の運動異常や便秘に関与している可能性があることが研究で示されている。Nav1.5ナトリウムチャネルをコードするSCN5A遺伝子の変異は、IBSおよび機能性便秘の潜在的な遺伝的危険因子として同定されている [72] 。
機能性便秘に関連するもう1つのイオンチャネルは、カルシウム活性化クロライドチャネル(CaCC)である。クロライドチャネルファミリーは、体液の粘度調節に関与しており、セカンドメッセンジャーによって調節される [73] 。研究により、CaCCは腸管内腔への体液分泌に重要な役割を果たしており、これは正常な排便に必要であることが示されている。CaCCの機能不全は体液分泌を障害し、便秘を引き起こす可能性がある。
治療の観点から、FC症状に対するチャネル調節薬の効果も評価されている。最近の研究 [61] では、ピナシジルと呼ばれるカリウムチャネルオープナーがFC患者の症状を改善したことが報告されている。この研究では、カリウムチャネル開口薬がFC患者の大腸運動を改善し、腹痛を軽減した可能性が示唆されている。さらに、FCや便秘を主徴とする炎症性腸症候群(IBS-C)に使用される最近の薬剤のほとんどは、主に上皮分泌を増加させるイオン輸送経路を標的としている [8] 。これらの薬剤のうち、ルビプロストンは、CLC2遺伝子にコードされるクロライドチャネルのアゴニストであり [75]、リナクロチドもまた、GUCY2C遺伝子にコードされるグアニル酸2Cの活性化によるcGMPの増加を介して、嚢胞性線維症膜貫通コンダクタンス調節因子(CFTR)を刺激することによって作用する [76]。イオンチャネルとFIGDの病態生理
3.1. イオンチャネルとタイトジャンクションの変化
タイトジャンクション(TJ)は、上皮細胞の先端側領域に位置するユニークな小器官であり、上皮細胞の輸送機能において重要な役割を果たしている。タイトジャンクションの2つの主要な機能は、ゲートとフェンス機能である。
IBS患者におけるTJタンパク質の発現と分布の変化の存在は広く報告されている。オクルディン、クローディン-1、クローディン-4の発現低下は、IBS患者の大腸生検、特に下痢を主徴とするサブタイプでみられた [77] 。クローディン-2の発現増加がIBS患者の大腸粘膜で検出されており [78] 、これは細胞間透過性の亢進につながる可能性がある。
サイトカイン、成長因子、神経伝達物質などのTJs制御因子もまた、IBSの病因に関与している [79] 。Awadらによる最近の研究 [80] では、オクルディン発現の減少が観察され、それによってトリセルリンが三細胞TJから非局在化した。この非局在化により、高分子の透過性が増加し、抗原の粘膜への流入が助長された。その結果、IBS患者では低グレードの炎症プロセスが持続した。
さらに、堀江ら [81]は、5HTが他のTJ関連タンパク質の発現に影響を与えることなく、オクルジンの発現を低下させることを示した。この現象の背後にあるメカニズムは不明であるが、著者らは、セロトニンが誘発する酸化ストレスがオクルディンのアミノ酸残基を修飾し、オクルディンの発現を低下させるのではないかという仮説を立てた。
膜貫通タンパク質と膜周辺タンパク質からなる多タンパク質複合体がTJのレベルに存在することで、TJは動的な構造となる。TJを介して起こる細胞外輸送の過程は、様々な細胞外・細胞内シグナルによって複雑な形で厳密に制御されている。TJの透過性は、イオンやそのトランスポーターを含む複数の因子によって制御されている [26] 。
成長因子(EGF、HGF、VEGF、FGF、TGF-β)、サイトカイン、ホルモン、薬物、栄養素からなる生理的・病理的因子 [5,26,46,82] は、急性的にも長期的にもタイトジャンクションのバリア特性を変化させる。いくつかの疾患(例えば、炎症性腸疾患、多発性硬化症、アレルギー、微生物感染症、糖尿病とその合併症、がんなどの慢性炎症性疾患)[46,77,83]では、上皮と内皮のTJのバリア機能の調節異常が起こる可能性がある。TJ機能の調節や調節不全の根底には多くの因子がある。例えば、Na, K-ATPaseは、ATP依存的に1ポンプサイクルにつき3個のナトリウムイオンと2個のカリウムイオンを細胞内に輸送する触媒作用を持ち、その結果、上皮の分極に必要な細胞膜を横切るナトリウムとカリウムの勾配を生成する。このイベントはTJ形成において重要な役割を果たしている [84] 。Na,K-ATPアーゼは、細胞接着分子E-カドヘリンと相乗的に協力してTJを形成する [66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86]。
最近の研究では、ATP感受性K+(KATP)チャネルが上皮TJ透過性を制御していることも示唆されている [21,87]。KATPチャネルは、細胞の代謝状態を電気的活動に結合させるのに不可欠である [5,87,88,89]。KATPチャネルは、それぞれKCNJ8およびKCNJ11遺伝子によってコードされる2つのKir6.1サブユニットと、それぞれABCC8およびABCC9遺伝子によってコードされるスルホニル尿素受容体(SUR1および2)サブユニットからなるヘテロ八量体タンパク質複合体であり、CFTRのようなABCトランスポータースーパーファミリーに属する。Kir6.1/SUR2A複合体は、ヒトの胃粘膜ではTJに限定され、肝臓ではオクルディンと共免疫沈殿し、共局在する [88] 。
Kir6.1とSUR2サブユニットをコードするKCNJ8とABCC9遺伝子の変異に関連するCantu症候群(CS)に罹患したマウスとヒトは、腸全体の収縮機能障害を示し、固形食の離乳後にマウスは死亡した [21] 。KATPチャネルは、インスリンやセカンドメッセンジャーなどのホルモンによって調節され、抗糖尿病薬や心血管治療薬、アミノ酸、スタウロスポリンのような細菌毒素など、腸の収縮力に影響を及ぼす可能性のある治療薬の標的となっている [90,91] 。ラットを用いたin vivo研究では、KATPチャネル拮抗薬であるトルブタミドがタイトジャンクションの透過性を増加させることが示された。対照的に、アゴニストであるジアゾキシドは、小腸の細胞間透過性の低下を引き起こした [21]。スタウロスポリンは、最近、この毒素を産生するデスルホビブリオ・ピガー(Desulfovibrio piger)が豊富であることから、アジア人の腸管小胞菌症におけるサルコペニアと関連している [92] 。
他の研究では、ルビプロストンを用いたCLC-2アゴニズムが、虚血傷害を受けたブタの腸粘膜において、経上皮電気抵抗の急速な回復を誘導し、副細胞透過性を有意に減少させることが示された [93] 。
一過性受容体電位(TRP)チャネルのスーパーファミリーメンバーであるTRPV4は、上皮細胞側細胞膜レベルでE-カドヘリンと共分布していることが、いくつかの研究で示されている。さらに、その活性化はタイトジャンクションフィラメントの切断を引き起こし、クローディン-4の発現を減少させた [30]。
3.2. 内臓知覚過敏と運動性変化におけるイオンチャネル
層別研究は、IBSにおける内臓知覚過敏とイオンチャネル機能障害およびAQPとの強い関連を示している(表1)。電位依存性ナトリウム(Nav) [46,83]、カルシウム(Cav)、特にCav3.2 [8]、一過性受容体電位バニロイドTRPV1、TRPV3、TRPV4、TRPA1 [45,77]、電位依存性ナトリウム(Nav)(Nav1. 1、Nav1.3、Nav1.5、Nav1.6、Nav1.7、Nav1.8、およびNav1.9) [5,94]、および大/大コンダクタンスCa2+活性化K(BKCa)チャネル [23,95]が、IBSにおける内臓知覚過敏の発生に関与している。
BKチャネルは、高カリウム血症 [96]、てんかん、アルコール依存症、脳腫瘍における細胞増殖 [97,98]、およびエストロゲン [99]による血管緊張の調節に関与していることが知られている。BKチャネルサブユニットは腎上皮細胞、神経細胞、骨格筋において炭酸脱水酵素と機能的に結合している。この酵素は腸や細菌性微生物に発現しており、腸管異微生物症関連疾患に関与している [100]。例えば、細菌の炭酸脱水酵素は、微生物の生合成経路に不可欠なCO2とHCO3-/プロトンを供給する。したがって、その阻害は微生物の生存を損なうかもしれないが、ヒトゲノムはα酵素しかコードしておらず、系統学的にも構造的にも、細菌のβ酵素とγ酵素とはよく隔たっている。BKチャネルαサブユニットは、ヒトの炭酸脱水酵素と相互作用する共通の分子領域を共有しており、炭酸脱水酵素阻害剤、天然のグリコシド型ステロイド系分子[101,102]、細胞増殖を制御するフラボノイド[62]の薬物標的となっている。炭酸脱水酵素-1タンパク質の発現活性の低下は、疲労と関連している [103,104]。さらに、これらのタンパク質は、IBS患者の血清中 で特に上昇していることが最近発見され、有望なバイオ マーカーとして注目されている。
Nav1.5チャネルは、腸平滑筋細胞やカハール間質細胞が適切に機能する上で重要な役割を担っていることに注目すべきである [27]。Nav1.5の孔形成αサブユニットをコードするSCN5Aの変異は、IBSや機能性ディスペプシアの患者で見つかっている [8]。IBS患者の2%がSCN5Aに変異を有していると推定されるが、そのほとんどは機能喪失型変異であり、IBS患者の下痢優位のサブタイプとは対照的に、主に便秘と関連している [26,27] 。
このように、チャネル異常症は消化管機能障害とIBSの根底にある潜在的な異常である。健常人と比較したIBS患者におけるイオンチャネルをコードする遺伝子の発現プロファイルと変異体の評価研究では、IBSに関連するプロセスにおけるいくつかの遺伝子の病態生理学的関与が強調された。 8、Nav1.1、Nav1.2、Nav1.7、BK、Kir6.1、AQP3、AQP4、AQP7、AQP8、TRPM2、TRPM3、TRPM8、TRPV1、TRPV3、TRPV4などである[30,32]。
加えて、イオンチャネルは機械伝導に直接関与している(TRPV1、TRPA1、TRPV3、TRP4、Kv7.1、BK)。したがって、感覚求心性神経による大腸の機械的刺激をコードすることは、IBS患者の関連内臓痛の基礎となるメカニズムにとって極めて重要である [84] 。TRPV1チャンネルは、様々な組織における侵害受容のセンサーである。TRPV1部位に直接結合するオキシトシンなどのホルモンによって制御され [105,106]、侵害受容を媒介するいくつかの天然分子によって調節され、開発中の新規鎮痛薬の標的でもある。また、細胞増殖を制御する [107,108]。
3.3. イオンチャネルと腸管透過性
腸管透過性(IP)の亢進とは、腸管上皮バリアを通して血液中に分子や物質が取り込まれることである。この機能は、栄養吸収と腸からの有害物質排除の適切なバランスを維持するために不可欠である [109] 。
IBS患者ではしばしばIPの増加がみられ、これが腸管内細菌やその産物の全身循環への移行につながり、免疫反応や炎症反応を誘発することがある [110] 。腸管透過性の亢進とIBSとの関係は複雑であり、双方向的である可能性が高い。透過性の亢進はIBS発症の一因となる可能性があるが、IBS症状やそれに伴うストレスや炎症もまた、腸管透過性に影響を及ぼす可能性がある。さらに、透過性の亢進とIBSのサブタイプ(下痢優位型、便秘優位型、混合型など)との関係は異なる可能性があり、その根底にあるメカニズムが異なることを示唆している [111,112] 。
IPの増加は、VH [85]を含むIBS [113]における症状の発生に関連している。イオンチャネルは、腸の運動と自発的収縮の制御に直接関与している。いくつかの研究グループは、イオンチャネルとAQPチャネルの機能不全を、IBS病態生理学における透過性と運動性の調節異常の発現に関連づけた。
Amatoら[86]は、TRPM8受容体が健常時のヒト遠位結腸に発現していること、そしてTRPM8のリガンド依存的な活性化が、おそらく大伝導性Ca2+活性化K+チャネルの開口を通じて、自発的な結腸運動を低下させ、それによってIBS患者の疼痛発現に寄与することを示した[34,114]。
さらに、AQPはほとんどの組織に発現しており、いくつかの生理的・病態生理学的プロセスに関連している。
AQPを介した移動は共通の受動的プロセスによって起こるが、AQPの制御や配置は特定の細胞タイプや組織によって異なる。AQPは細胞容積、細胞間の水の流れ、および水分バランスを調節する役割を果たし、膜タンパク質の表面発現に影響を与え、細胞接着を促進し、特殊なチャネルを介する様々な細胞膜を介した迅速な水分輸送を可能にする [115,116]。
文献的には、ヒトの大腸上皮細胞でいくつかのAQPチャネルが検出されている(AQP1、AQP3、AQP4、AQP7-9)[41,55,117,118,119]。これらは、内腔から間質への細胞横断的な水分輸送に役割を果たしている [118]。AQP8は水の流れを可能にし、AQP3、7、9はグリセロールの流れも促進する [119]。また、AQP3は大腸の水輸送において最も重要な機能分子の一つと考えられており、その大腸での発現レベルは浸透圧性下剤や刺激性下剤の緩下作用に重要な役割を果たしている。
IBS-D患者の直腸S状結腸粘膜の生検におけるAQP発現プロファイルの研究では、上行結腸および下行結腸におけるAQP8レベルは健常人より有意に低いことが示された。D-IBS患者では、発現の差によって大腸の吸収機能が損なわれ、大腸の水分吸収が低下し、その結果、緩い便や下痢を形成している可能性がある。したがって、AQP8の分布の変化が、IBS-D患者における下痢の原因である可能性がある [41] 。
IBSの動物モデルに関する研究によると、IBSラットの大腸では、AQP1、AQP3、AQP8および炎症性サイトカイン(IL-1β、TGF-β、TNFα)の発現が低下していた。代わりに、IBSラットにフォルスコリン(5mg/kg/day、7日間)を腹腔内注射で投与すると、AMP活性化によりAQP1、AQP3、AQP8、炎症性サイトカインが上昇した。
したがって、これらのデータに照らすと、cAMP/PKA経路の活性化作用を有する薬物/分子は、炎症性サイトカインの放出調節、免疫系の活性化、および大腸における液体水分代謝異常の調節を通じて、IBSにおいて重要な役割を果たしている可能性があるという仮説が成り立つ [120] 。
3.4. IBSとイオンチャンネル標的薬
現在、IBSの薬理学的治療は、リナクロチドやプレカナチドによる消化管グアニリルシクラーゼC受容体、ルビプロストンによるクロライドチャネル、イオン交換体3阻害剤テナパノールによるトランスポーター、ロペラミドやエルキサドリンによる末梢オピオイド受容体、テガセロドやラモセトロンによる腸セロトニン受容体、抗生物質リファキシミンによる腸内マイクロバイオームを標的としている [121] 。これらのうち、最も古い薬剤のひとつがルビプロストンで、慢性特発性便秘の治療薬として米国食品医薬品局(FDA)から承認されている。ルビプロストンは経口の二環式脂肪酸であり、腸管上皮細胞の先端膜にある2型クロライドチャネルを選択的に活性化し、ナトリウムと水の受動的分泌とともにクロライドの分泌を促し、消化管平滑筋を刺激することなく、蠕動運動と弛緩を誘導する。いくつかの臨床試験で、慢性特発性便秘症やIBS-Cに対する有効性が示されている。プリン作動性薬物はまた、IBD、IBS、機能性ディスペプシア、炎症性下痢に対する前向き臨床試験において、有望な安全性/有効性プロファイルを示している。遺伝子多型やカフェイン摂取は、治療に対する感受性に影響する可能性がある [122] 。
さらに最近では、リガンドゲートK+チャネルであるパロノセトロン結合5-HT3受容体の凍結電子顕微鏡構造が利用できるようになったため、分子動力学法を用いてパロノセトロン、グラニセトロン、ドラセトロン、オンダンセトロン、シランセトロンの結合を調べることが可能になり、臨床で使用されている拮抗薬一式を網羅することができるようになった [123] 。
抗てんかん薬として使用される非選択的KV7活性化剤であるフルピルチンは、マウス遠位結腸の基礎Cl-分泌を阻害し、腸管神経伝達の様々な成分を標的とする薬物の効果を消失または減弱させた。フルピルチンは、上皮を標的とした薬剤であるVIP(内因性VPAC受容体リガンド)やカルバコール(非選択的コリン作動薬)に対する反応を阻害しなかった。フルピルチンは、全層結腸および漿膜剥離した遠位結腸(腸管神経叢ではなく粘膜下層を含む)の両方でCl-分泌を阻害したが、上皮T84細胞単層では反応を生じなかった。KV7チャネル活性化剤は、大腸上皮におけるニューロン主導性のCl-分泌を阻害し、下痢を伴う過敏性腸症候群のような、過興奮性腸神経系に関連する病態の治療に有益である可能性がある [124]。
上記で報告したように、IBSはブルガダ症候群1型患者によくみられる併存疾患である。現在の片頭痛および片頭痛の既往歴は、FBD患者における基礎疾患の予測因子である。IBSとブルガダ症候群が頻繁に共存することから、IBSの治療選択肢のうち、不整脈を伴うブルガダ表現型を悪化させることが知られている特定の薬剤の使用には注意が必要である [125] 。
天然混合物もイオンチャネルを介して作用する可能性がある。例えば、主に消化器関連疾患の治療に用いられる伝統的な漢方薬の混合物であるバンハサシムタンは、IBS治療において可能性があるかもしれない [126]。この混合物は、IBSが介在する内臓知覚過敏に関連するTRPA1、NaV1.5、NaV1.7イオンチャネルを阻害した。SiNiSanは、現在の過敏性腸症候群の臨床治療でよく知られている古代漢方薬であり、複数の標的を介して作用する: ADRA2A、HTR2A、F2RL1、F2RL3、PKC、PKA、IL-1Β、NGF、TRPV1である。結論
正常な消化管機能は、主に正常なイオンチャネル機能によって支えられており、その結果、イオンチャネルの異常は消化管疾患に関連している [32] 。FGID/IBSプロファイルを有する患者は、影響を受けやすい遺伝的因子、エピジェネティック因子、および環境因子の複雑な相互作用を持っていることは確かである。
いくつかの研究は、FGID/IBSにおけるイオンチャネルとイオンチャネルに影響を及ぼす変異(チャネル異常症)の役割と強い関連性を強調している。しかしながら、イオンチャネルに関するFGID/IBSの特徴的な疾患の根底にある病態生理をより深く理解するためには、多くの側面からの研究が必要である。
第一に、イオンチャネルの分子および構造データの深い研究が必要であり、得られた結果を機能データと相関させることが極めて重要である。第二に、新しい実験プロトコール(平滑筋収縮と機械感受性によるその調節)を開発することは、チャネル異常症の分子メカニズムを追跡し理解するために必須である。最後に、GIレベルでのイオンチャネルの役割とタンパク質複合体との相互作用を調べる必要がある。
この側面をよりよく調べるためには、動物モデルや細胞モデル系から得られた初代細胞系を用いたin vitro研究、患者の家族系譜、ハイスループットシークエンスデータ、FGID/IBSコホートとFGID/IBS陰性の大規模集団との比較解析から得られたデータを統合した研究を行う必要がある。ほとんどの消化管組織には、興奮性組織と非興奮性組織を含むさまざまなタイプの細胞が存在する。これらの遺伝子変化がどの細胞タイプあるいは組織で起こっているかを決定することは困難であろう。この枠組みでは、シングルセル解析がこの問題の解決に役立つであろう。
チャネル異常症の文脈では、性別の違いも重要視されなければならない。例えば、男性と女性では、同じチャネルに影響を及ぼす変異があっても、機能異常を発症する確率が異なる。残念ながら、現在のデータベースはFGIDのこのような側面を考慮していないため、健常患者とFGID/IBSのゲノムを性差を考慮して大規模に比較することは非常に困難である。
FGID/IBS患者におけるチャネル異常の役割をよりよく理解することは、個別化治療の可能性に対応したイオンチャネルを標的とする効果的な治療法を開発するための進歩と将来の道を提供することになるであろう。
この研究の限界は、論文中の多くの記述が実際には炎症性腸疾患に関するものであることである。従って、この論文で提案された遺伝子変化の多くは誇張されている可能性がある。さらに、多くの遺伝子変化は機能的なタンパク質発現を持たない。
著者貢献
構想、F.R.およびF.M.、方法論、F.R.、F.M.、R.M.、A.O.およびD.T.、データキュレーション、F.R.、F.M.、D.T.およびA.O.、執筆-原案作成、F.R.、F.M.、執筆-校閲および編集、F.R.、F.M.、A.O.およびD.T.、監修、F.R. 著者全員が本原稿を読み、掲載版に同意した。
資金提供
本研究は、イタリア保健省RC2020-2021、Prog. N° 16(DDG番号700/2020)の助成を受けた。
施設審査委員会声明
該当なし。
インフォームド・コンセントに関する声明
該当なし。
データ利用声明
該当なし。
利益相反
著者らは利益相反はないと宣言している。
略語
AQPsアクアポリンFC機能性便秘FDF機能性ディスペプシアFGIDs機能性胃腸障害GIG消化管IBS過敏性腸症候群IP腸管透過性KATPATP感受性K+チャネルTJタイトジャンクション
参考文献
Roux, B. イオンチャネルとイオン選択性. Essays Biochem. 2017, 61, 201-209. [Google Scholar] [CrossRef] [PubMed].
Li, C.; Wang, W. Molecular Biology of Aquaporins. Adv. Exp. Med. Biol. 2017, 969, 1-34. [Google Scholar] [CrossRef] [PubMed].
消化機能と摂食行動における化学伝達とメカノトランスダクションにおけるイオンチャネルの役割.Int. J. Mol. Sci. 2022, 23, 9358. [Google Scholar] [CrossRef] [PubMed].
Kim, J.-B. Channelopathies. Korean J. Pediatr. [Google Scholar] [CrossRef] [PubMed].
下痢優位の過敏性腸症候群に伴う腹痛に対して直腸内リドカインは有効な治療法である。J. Pain 2005, 6, 493-496. [Google Scholar] [CrossRef] [PubMed].
神経炎症におけるATP感受性カリウムチャネルサブユニット: 神経変性疾患における新規創薬標的。CNS Neurol. Disord.-Drug Targets 2021, 20, 1. [Google Scholar] [CrossRef].
また、このような神経炎症は、神経変性疾患における新たな薬物標的として注目されている。Front. Pharmacol. 2020, 11, 604885. [Google Scholar] [CrossRef].
機能性消化管障害におけるイオンチャネルパチー。Am. J. Physiol. Gastrointest. Liver Physiol. [Google Scholar] [CrossRef].
Bonfiglio, F.; Henström, M.; Nag, A.; Hadizadeh, F.; Zheng, T.; Cenit, M.C.; Tigchelaar, E.; Williams, F.; Reznichenko, A.; Ek, W.E.; et al. A GWAS meta-analysis from 5 population-based cohorts implicates ion channel genes in the pathogenesis of irritable bowel syndrome. Neurogastroenterol. Motil. 2018, 30, e13358. [Google Scholar] [CrossRef].
Holtmann, G.; Shah, A.; Morrison, M. Pathophysiology of Functional Gastrointestinal Disorders: A Holophysiology of Functional Gastrointestinal Disorders: A Holistic Overview. Dig. Dis. 2017, 35 (Suppl. S1), 5-13. [Google Scholar] [CrossRef].
Camilleri, M.; Katzka, D.A. 過敏性腸症候群: 方法、メカニズム、病態生理学。過敏性腸症候群における遺伝疫学と薬理遺伝学。Am. J. Physiol. Gastrointest. Liver Physiol. 2012, 302, G1075-G1084. [Google Scholar] [CrossRef] [PubMed].
消化管運動障害と機能性消化管障害に対する現在の治療選択肢と治療的洞察。Front. Pharmacol. 2022, 13, 808195. [Googleスカラー] [CrossRef][PubMed]。
マイクログリアの電気生理学的研究(Avignone, E.; Milior, G.; Arnoux, I.; Audinat, E.). Methods Mol. Biol. 2019, 2034, 111-125. [Google Scholar] [CrossRef].
哺乳類蝸牛の非感作性組織脈管の電気化学的特性は音に敏感である。J.Physiol.2021、599、4497-4516。[Google Scholar] [CrossRef].
心線維芽細胞の病態生理における一過性受容体電位(TRP)イオンチャネルの新たな役割。Front. Physiol. [Google Scholar] [CrossRef].
Jankipersadsing、S.A.、Hadizadeh、F.、Bonder、M.J.、Tigchelaar、E.F.、Deelen、P.、Fu、J.、Andreasson、A.、Agreus、L.、Walter、S.、Wijmenga、C.、他。 GWASメタアナリシスにより、便の回数の生物学における異種物質代謝とイオンチャネル活性の役割が示唆された。Gut 2017, 66, 756-758. [Google Scholar] [CrossRef].
Bonfiglio, F.; Zheng, T.; Garcia-Etxebarria, K.; Hadizadeh, F.; Bujanda, L.; Bresso, F.; Agreus, L.; Andreasson, A.; Dlugosz, A.; Lindberg, G.; et al. 染色体9上のバリアントと過敏性腸症候群の自己申告診断との女性特異的関連。Gastroenterology 2018, 155, 168-179. [Google Scholar] [CrossRef] [PubMed].
Villeda-Ramírez, M.A.; Meza-Guillen, D.; Barreto-Zúñiga, R.; Yamamoto-Furusho, J.K. ABCC7/CFTR Expression Is Associated with the Clinical Course of Ulcerative Colitis Patients. Gastroenterol. Res. Pract. 2021, 2021, 5536563. [Google Scholar] [CrossRef].
Bonfiglio、F.; Liu、X.; Smillie、C.; Pandit、A.; Kurilshikov、A.; Bacigalupe、R.; Zheng、T.; Nim、H.; Garcia-Etxebarria、K.; Bujanda、L.; et al. 便の回数に関するGWASは、消化管運動と過敏性腸症候群に関する洞察を提供する。Cell Genom. 2021, 1, 100069. [Google Scholar] [CrossRef].
Currò, D. Chapter Seven-The Modulation of Potassium Channels in the Smooth Muscle as a Therapeutic Strategy for Disorders of the Gastrointestinal Tract. In Ion Channels as Therapeutic Targets, Part B; Donev, R., Ed.; Academic Press: Cambridge, MA, USA, 2016; 第104巻, pp.263-305. ISBN 1876-1623. [Google Scholar].
ヨーク、N.W.;パーカー、H.;謝、Z.;タイス、D.;ワヒード、M.A.;ヤン、Z.;グランジ、D.K.;レメディ、M.S.;イングランド、S.K.;フー、H.;他。 Kir6.1-およびSUR2依存性KATP過剰活性は、カントー症候群のマウスモデルにおいて腸の運動性を破壊する。JCI Insightig. 2020, 5, e141443. [Google Scholar] [CrossRef].
Scala,R.、Maqoud,F.、Zizzo,N.、Passantino,G.、Mele,A.、Camerino,G.M.、McClenaghan,C.、Harter,T.M.、Nichols,C.G.、Tricarico,D. Cantu症候群モデルマウスの骨格筋におけるSUR2[A478V]変異の結果。Cells 2021, 10, 1791. [このような研究は、日本ではほとんど行われていない。
このような疾患では、内臓過敏症(IBS)モデルにおいてBKチャネルの遮断が慢性的な内臓過敏症を抑制することが知られている。Mol. Pain 2021, 17, 17448069211040364. [Google Scholar] [CrossRef] [PubMed].
この研究では、IBSモデルラットにおける電位依存性カリウムチャネルの存在を明らかにした。IB4陽性大腸感覚ニューロンの電位依存性カリウムチャネルはラットの内臓知覚過敏を媒介する。Am. J. Gastroenterol. 2009, 104, 2014-2027. [Google Scholar] [CrossRef].
Luo, J.-L.; Qin, H.-Y.; Wong, C.-K.; Tsang, S.-Y.; Huang, Y.; Bian, Z.-X. (1)大腸DRGニューロンにおける興奮性の亢進と制御された電位依存性カリウムチャネル。J. Pain 2011, 12, 600-609. [Google Scholar] [CrossRef].
過敏性腸症候群患者における電位依存性ナトリウムチャネルNaV1.5の機能喪失(チャネル異常症)。Gastroenterology 2014, 146, 1659-1668. [Google Scholar] [CrossRef] [PubMed].
過敏性腸症候群およびその他の消化器疾患におけるSCN5Aコードされたチャネル異常の役割。Neurogastroenterol. Motil. Off. J. Eur. Gastrointest. Motil. Soc. 2015, 27, 906-913. [Google Scholar] [CrossRef].
Howell、K.B.; McMahon、J.M.; Carvill、G.L.; Tambunan、D.; Mackay、M.T.; Rodriguez-Casero、V.; Webster、R.; Clark、D.; Freeman、J.L.; Calvert、S.; et al. SCN2A脳症: 移動性焦点発作を伴う乳児期てんかんの主な原因。Neurology 2015, 85, 958-966. [Google Scholar] [CrossRef].
Phatarakijnirund, V.; Mumm, S.; McAlister, W.H.; Novack, D.V.; Wenkert, D.; Clements, K.L.; Whyte, M.P. 先天性疼痛不感症: 電位依存性ナトリウムチャネル1.9をコードするSCN11Aの常染色体優性第2変異による、明らかな骨格病理学的病態を伴わない骨折。Bone 2016, 84, 289-298. [Google Scholar] [CrossRef].
Henström, M.; Hadizadeh, F.; Beyder, A.; Bonfiglio, F.; Zheng, T.; Assadi, G.; Rafter, J.; Bujanda, L.; Agreus, L.; Andreasson, A.; et al. IBS-CおよびIBS-Mのリスク増加と関連するTRPM8多型。Gut 2017, 66, 1725-1727. [Google Scholar] [CrossRef].
Zhang, M.; Leung, F.-P.; Huang, Y.; Bian, Z.-X. 過敏性腸症候群モデルラットにおける大腸運動亢進は、大腸平滑筋細胞におけるL型カルシウムチャネルのアップレギュレーションと関連している。Neurogastroenterol. Motil. 2010, 22, e162-e170. [Google Scholar] [CrossRef].
過敏性腸症候群における腸管化学感受性は、小腸TRPVチャネル発現と関連する。Aliment. Pharmacol. Ther. 2021, 54, 1179-1192. [Google Scholar] [CrossRef] [PubMed].
過敏性腸症候群におけるTRPM8の抗炎症的役割-探索的研究-. Neurogastroenterol. Motil. Off. J. Eur. Gastrointest. Motil. Soc. 2021, 33, e14170. [Google Scholar] [CrossRef] [PubMed].
下痢または便秘を伴う過敏性腸症候群における回腸および大腸生検でのmRNA発現の違い。Am. J. Physiol. Gastrointest. 2022, 323, G88-G101. [Google Scholar] [CrossRef].
過敏性腸症候群における病態生理学的要因としての大腸内細菌発酵の変化。Am. J. Gastroenterol. 2015, 110, 1339-1346. [Google Scholar] [CrossRef] [PubMed].
ベッカーズ、A.B.; Weerts、Z.Z.R.M.; Helyes、Z.; Masclee、A.A.M.; Keszthelyi、D. 総説: 過敏性腸症候群の治療標的となりうる一過性受容体電位チャンネル。Aliment. Pharmacol. Ther. 2017, 46, 938-952. [Google Scholar] [CrossRef] [PubMed].
感覚ニューロンにおける一過性受容体電位TRPA1チャネルの脱感作は、アゴニスト依存的であり、TRPV1指向性の内在化によって制御される。J.Physiol.2007、583、175-193。[Google Scholar] [CrossRef].
Banik、G.D.; De、A.; Som、S.; Jana、S.; Daschakraborty、S.B.; Chaudhuri、S.; Pradhan、M. 呼気中の硫化水素: IBSにおける小腸細菌過剰増殖の潜在的バイオマーカー。J. Breath Res. 2016, 10, 26010. [Google Scholar] [CrossRef].
Li,X.、Cao,Y.、Wong,R.K.M.、Ho,K.Y.、Wilder-Smith,C.H. 機能性ディスペプシアにおける内臓および体性感覚機能。Neurogastroenterol. Motil. Off. J. Eur. Gastrointest. Motil. Soc. 2013, 25, 246-e165. [Google Scholar] [CrossRef].
Cenac, N.; Bautzova, T.; Le Faouder, P.; Veldhuis, N.A.; Poole, D.P.; Rolland, C.; Bertrand, J.; Liedtke, W.; Dubourdeau, M.; Bertrand-Michel, J.; et al. 過敏性腸症候群患者における一過性受容体電位チャネルの内因性アゴニストの定量化と潜在的機能。Gastroenterology 2015, 149, 433-444.e7. [Google Scholar] [CrossRef].
Wang, J.; Hou, X. Expression of aquaporin 8 in colonic epithelium with diarrhoea-predominant irritable bowel syndrome. Chin. Chin. J. (Engl). 2007, 120, 313-316. [Google Scholar] [CrossRef].
Lacy, B.E.; Mearin, F.; Chang, L.; Chey, W.D.; Lembo, A.J.; Simren, M.; Spiller, R. Bowel Disorders. Gastroenterology 2016, 150, 1393-1407.e5. [Google Scholar] [CrossRef] [PubMed].
Wolitzky-Taylor, K.; Craske, M.G.; Labus, J.S.; Mayer, E.A.; Naliboff, B.D. Visceral sensitivity as a mediator of outcome in the treatment of irritable bowel syndrome. Behav. Res. Ther. 2012, 50, 647-650. [Google Scholar] [CrossRef][PubMed]。
Lackner, J.M.; Mesmer, C.; Morley, S.; Dowzer, C.; Hamilton, S. 過敏性腸症候群の心理学的治療: 系統的レビューとメタアナリシス。J. Consult. Clin. Psychol. 2004, 72, 1100-1113. [Google Scholar] [CrossRef].
Cenac, N.; Altier, C.; Motta, J.-P.; d'Aldebert, E.; Galeano, S.; Zamponi, G.W.; Vergnolle, N. ヒスタミンとセロトニンによるTRPV4シグナルの増強:内臓過敏症の重要なメカニズム。Gut 2010, 59, 481-488. [Google Scholar] [CrossRef] [PubMed].
de Carvalho Rocha, H.A.; Dantas, B.P.V.; Rolim, T.L.; Costa, B.A.; de Medeiros, A.C. 過敏性腸症候群における内臓過敏症に関連する主なイオンチャネルと受容体. Ann. Gastroenterol. 2014, 27, 200-206. [Google Scholar].
Allen、K.Y.; Vetter、V.L.; Shah、M.J.; O'Connor、M.J. KCNQ1変異を有する小児における家族性QT延長症候群と拡張型心筋症の遅発性発症: 症例報告。HeartRhythm Case Rep. [Google Scholar] [CrossRef].
Rice、K.S.、Dickson、G.、Lane、M.、Crawford、J.、Chung、S.-K.、Rees、M.I.、Shelling、A.N.、Love、D.R.、Skinner、J.R. JervellおよびLange-Nielsen症候群における血清ガストリン値の上昇: 重症KCNQ1機能障害のマーカーか?Heart Rhythm. 2011, 8, 551-554. [Google Scholar] [CrossRef].
Behere, S.P.; Weindling, S.N. 遺伝性不整脈: The cardiac channelopathies. Ann. Pediatr. Cardiol. 2015, 8, 210-220. [Google Scholar] [CrossRef].
Aydemir, Y.; Carman, K.B.; Yarar, C. Screening for functional gastrointestinal disorders in children with epilepsy. Epilepsy Behav. 2020, 111, 107267. [Google Scholar] [CrossRef].
Beck、V.C.、Isom、L.L.、Berg、A.T. 胃腸症状とチャネルパシー関連てんかん。J.Pediatr.2021、237、41-49.e1。[Google Scholar] [CrossRef].
Narducci, F.; Bassotti, G.; Gaburri, M.; Farroni, F.; Morelli, A. Nifedipine reduces the colonic motor response to eating in patients with irritable colon syndrome. Am. J. Gastroenterol. 1985, 80, 317-319. [Google Scholar]
Aspiroz、F.; Bouin、M.; Camilleri、M.; Mayer、E.A.; Poitras、P.; Serra、J.; Spiller、R.C. IBSおよび機能障害における過敏症のメカニズム。Neurogastroenterol. Motil. Off. J. Eur. Gastrointest. Motil. Soc. 2007, 19, 62-88. [Google Scholar] [CrossRef] [PubMed].
呂 翠玲(Lu, C.-L.; Chen, C.-Y.; Chang, F.-Y.; Chang, S.-S.; Kang, L.-J.; Lu, R.-H.; Lee, S.-D. 下痢優位の過敏性腸症候群におけるカルシウム拮抗薬および鎮痙薬の効果。J. Gastroenterol. Hepatol. 2000, 15, 925-930. [Google Scholar] [CrossRef] [PubMed].
Stanghellini, V.; Chan, F.K.L.; Hasler, W.L.; Malagelada, J.R.; Suzuki, H.; Tack, J.; Talley, N.J. Gastroduodenal Disorders. Gastroenterology 2016, 150, 1380-1392. [Google Scholar] [CrossRef] [PubMed].
機能性ディスペプシア-症状、定義、Rome III基準の妥当性。Nat. REV. Gastroenterol. Hepatol. 2013, 10, 134-141. [Google Scholar] [CrossRef].
魏, Z.; 興, X.; 丹泰, X.; 蕭, C.; 楊, Q.; 江, X.; 昊, Y.; 劉, N.; 王, Y.; 王, J. 機能性ディスペプシアの症状と心理に対する心理学的介入の効果:系統的レビューとメタアナリシス。Front. Psychol. 2022, 13, 827220. [Google Scholar] [CrossRef].
Kourikou, A.; Karamanolis, G.P.; Dimitriadis, G.D.; Triantafyllou, K. 機能性ディスペプシアと関連する遺伝子多型。World J. Gastroenterol. 2015, 21, 7672-7682. [Google Scholar] [CrossRef].
Tziatzios, G.; Gkolfakis, P.; Papanikolaou, I.S.; Mathur, R.; Pimentel, M.; Giamarellos-Bourboulis, E.J.; Triantafyllou, K. 機能性ディスペプシアにおける腸内細菌叢異常。Microorganisms 2020, 8, 691. [Google Scholar] [CrossRef].
Locke、G.R.、3rd; Ackerman、M.J.; Zinsmeister、A.R.; Thapa、P.; Farrugia、G. SCN5Aコード心筋チャネル症患者の家族における胃腸症状:腸チャネル症の証拠。Am. J. Gastroenterol. 2006, 101, 1299-1304. [Google Scholar] [CrossRef].
カルシウムチャネルブロッカーと消化管運動: 基礎的および臨床的側面。Pharmacol. Ther. 1993, 60, 121-148. [Google Scholar] [CrossRef]。
Castell, D.O. 胃腸障害に対するカルシウムチャンネル遮断薬。Am. J. Cardiol. 1985, 55, b210-b213. [Google Scholar] [CrossRef][PubMed]。
Vaezi, M.F.; Pandolfino, J.E.; Yadlapati, R.H.; Greer, K.B.; Kavitt, R.T. ACG臨床ガイドライン: アカラシアの診断と管理。Am. J. Gastroenterol. 2020, 115, 1393-1411. [Google Scholar] [CrossRef] [PubMed].
Suares、N.C.; Ford、A.C. 地域社会における慢性特発性便秘の有病率と危険因子: 系統的レビューおよびメタアナリシス。Am. J. Gastroenterol. 2011, 106, 1582-1591. [Google Scholar] [CrossRef] [PubMed].
Mugie、S.M.; Benninga、M.A.; Di Lorenzo、C. 小児および成人における便秘の疫学: 系統的レビュー。ベストプラクティス。Res. Clin. Gastroenterol. 2011, 25, 3-18. [Google Scholar] [CrossRef].
Camilleri, M.; Ford, A.C.; Mawe, G.M.; Dinning, P.G.; Rao, S.S.; Chey, W.D.; Simrén, M.; Lembo, A.; Young-Fadok, T.M.; Chang, L. 慢性便秘。Nat. Rev. Dis. Prim. 2017, 3, 17095. [Google Scholar] [CrossRef] [PubMed].
Eswaran, S.; Muir, J.; Chey, W.D. 食物繊維と機能性胃腸障害。Am. J. Gastroenterol. J. Gastroenterol. 2013, 108, 718-727. [Google Scholar] [CrossRef].
便秘患者の腸内細菌叢における構造的変化。Physiol. Genomics 2014, 46, 679-686. [Google Scholar] [CrossRef].
Cao, H.; Liu, X.; An, Y.; Zhou, G.; Liu, Y.; Xu, M.; Dong, W.; Wang, S.; Yan, F.; Jiang, K.; et al. Dysbiosis contributes to chronic constipation development via regulation of serotonin transporter in the intestine. Sci. Rep. 2017, 7, 10322. [Google Scholar] [CrossRef].
Moloney、R.D.、Johnson、A.C.、O'Mahony、S.M.、Dinan、T.G.、Greenwood-Van Meerveld、B.、Cryan、J.F.内臓痛におけるストレスと微生物叢-腸-脳軸: 過敏性腸症候群との関連性。CNS Neurosci. Ther. 2016, 22, 102-117. [Google Scholar] [CrossRef].
Scott, S.M.; Simrén, M.; Farmer, A.D.; Dinning, P.G.; Carrington, E.V.; Benninga, M.A.; Burgell, R.E.; Dimidi, E.; Fikree, A.; Ford, A.C.; et al. 成人における慢性便秘: 現代の展望と臨床的課題。1:疫学、診断、臨床的関連、病態生理学および調査。Neurogastroenterol. Motil. 2021, 33, e14050. [Google Scholar] [CrossRef].
過敏性腸症候群におけるナトリウムチャネル変異: イオンチャネル障害の証拠。Am. J. Physiol. Liver Physiol. 2009, 296, G211-G218. [Google Scholar] [CrossRef].
Tricarico、D.; Conte Camerino、D.; Govoni、S.; Bryant、S.H. ラット骨格筋クロライドチャネルのプロテインキナーゼCの活性化剤と阻害剤による調節 Pflügers Arch. 1991, 418, 500-503. [Google Scholar] [CrossRef].
便秘治療のための夜間作用薬: A Review Based on Literatures and Patents. Front. Pharmacol. 2017, 8, 418. [Google Scholar] [CrossRef].
Lacy, B.E.; Levy, L.C. Lubiprostone: Lubiprostone: A chloride channel activator. J. Clin. Gastroenterol. 2007, 41, 345-351. [Google Scholar] [CrossRef]。
グアニル酸シクラーゼCアゴニスト: Emerging gastrointestinal therapies and actions. Gastroenterology 2015, 148, 483-487. [Google Scholar] [CrossRef].
Stucky, C.L.; Dubin, A.E.; Jeske, N.A.; Malin, S.A.; McKemy, D.D.; Story, G.M. Roles of transient receptor potential channels in pain. Brain Res. Rev. 2009, 60, 2-23. [Google Scholar] [CrossRef].
過敏性腸症候群の遺伝学。Mol. Cell. Google Scholar] [CrossRef].
健康および消化器疾患における腸管バリア機能。Neurogastroenterol. Motil. 2012, 24, 503-512. [Google Scholar] [CrossRef].
過敏性腸症候群(IBS-M)患者における三細胞タイトジャンクションの腸管透過性障害。Cells 2023, 12, 236. [Google Scholar] [CrossRef].
上皮下セロトニンは閉塞性発現の減少を介して小腸上皮細胞の緊密性を低下させる。Turkish J. Gastroenterol. Turkish J. Gastroenterol. J. Turkish Soc. Gastroenterol. 2022, 33, 74-79. [Google Scholar] [CrossRef].
Camilleri、M過敏性腸症候群の生理学的基盤: 神経ホルモンのメカニズム。J. Physiol. [Google Scholar] [CrossRef] [PubMed].
アクバー、A.; ウォルターズ、J.R.F.; ゴーシュ、S. 総説: 過敏性腸症候群における内臓過敏症: 分子メカニズムと治療薬。Aliment. Pharmacol. Ther. 2009, 30, 423-435. [Google Scholar] [CrossRef] [PubMed].
大腸・直腸の内臓痛:メカノトランスダクションとバイオメカニクス.J. Neural Transm. 2020, 127, 415-429. [Google Scholar] [CrossRef] [PubMed].
過敏性腸症候群における腸管膜透過性と知覚過敏。痛 2009, 146, 41-46. [Google Scholar] [CrossRef].
Amato, A.; Terzo, S.; Lentini, L.; Marchesa, P.; Mulè, F. TRPM8チャネルの活性化はヒト遠位結腸の自発収縮を抑制する。Int. J. Mol. Sci. 2020, 21, 5403. [Google Scholar] [CrossRef] [PubMed].
腸管透過性の胃腸障害における役割と現在の評価法. Front. Nutr. 2021, 8, 585. [Google Scholar] [CrossRef].
Rajasekaran, S.A.; Beyenbach, K.W.; Rajasekaran, A.K. タイトジャンクションと膜チャネルおよびトランスポーターとの相互作用。Biochim. Biophys. Acta-Biomembr. 2008, 1778, 757-769. [Google Scholar] [CrossRef].
Mele, A.; Buttiglione, M.; Cannone, G.; Vitiello, F.; Camerino, D.C.; Tricarico, D. 神経・筋KATPチャネルに対するピルビン酸キナーゼ抗体の開口/遮断作用。Pharmacol. Res. 2012, 66, 401-408. [Google Scholar] [CrossRef].
KATP channel is a molecular sensor of atrophy in skeletal muscle. このことは、骨格筋の萎縮の分子センサーであることを示唆している。[Google Scholar] [CrossRef].
スタウロスポリンに対するKATPチャネルの二重応答: 異なる骨格筋表現型における萎縮の制御におけるSUR2B、SUR1およびKir6.2サブユニットの新規な役割。Biochem. Pharmacol. 2014, 91, 266-275. [Google Scholar] [CrossRef].
Wang,Y.、Zhang,Y.、Lane,N.E.、Wu,J.、Yang,T.、Li,J.、He,H.、Wei,J.、Zeng,C.、Lei,G. Population-based metagenomics analysis reveals altered gut microbiome in sarcopenia: Xiangya Sarcopenia Studyのデータ。J. Cachexia. Sarcopenia Muscle 2022, 13, 2340-2351. [Google Scholar] [CrossRef].
腸管バリア機能のClC-2制御: 基礎科学から治療標的への転換。Tissue Barriers 2015, 3, e1105906. [Google Scholar] [CrossRef] [PubMed].
このような背景のもとで、日本では、日本脳炎の治療薬として、Nav1.8Naチャネル遮断薬A-803467が開発され、神経障害性疼痛や炎症性疼痛を抑制することが期待されている。Proc. Natl. Acad. Sci. USA 2007, 104, 8520-8525. [Google Scholar] [CrossRef] [PubMed].
マウス大腸平滑筋におけるSTREX欠損BKCaチャネルのメカノセンシティビティ。Am. J. Physiol. Gastrointest. Liver Physiol. 2010, 299, G1231-G1240. [Google Scholar] [CrossRef] [PubMed].
炭酸脱水酵素阻害剤は筋のCa2+活性化K+チャネルを開口することによりラットの低カリウム性周期性麻痺の症状を改善する。Neuromuscul. Disord. 2006, 16, 39-45. [Google Scholar] [CrossRef].
このような細胞生存能の制御には、HEK293細胞におけるカリウムイオンのチャレンジと薬理学的調節に伴うカルシウム活性化カリウムチャネルの新たな役割が関与している。PLoS ONE 2013, 8, e69551. [Google Scholar] [CrossRef].
Curci、A.; Maqoud、F.; Mele、A.; Cetrone、M.; Angelelli、M.; Zizzo、N.; Tricarico、D. 未分化神経芽腫細胞における大きなCa2+活性化K+(BK)チャネルを標的とした神経保護薬の抗増殖効果。Curr. Top. Pharmacol. 2016, 20, 113-131. [Google Scholar].
Ancatén-González, C.; Segura, I.; Alvarado-Sánchez, R.; Chávez, A.E.; Latorre, R. Ca(2+) and Voltage-Activated K(+) (BK) Channels in the Nervous System: 一つの遺伝子で無数の生理機能。Int. J. Mol. Sci. 2023, 24, 3407. [Google Scholar] [CrossRef].
微生物叢、細菌性炭酸脱水酵素、およびその活性調節因子: ヒト疾患との関連は?Mediat. Inflamm. 2021, 2021, 6926082. [Google Scholar] [CrossRef].
Tricarico, D.; Barbieri, M.; Mele, A.; Carbonara, G.; Camerino, D.C. 炭酸脱水酵素阻害剤はK+欠損ラットの骨格筋BKチャネルの特異的開口薬である。FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 2004, 18, 760-761. [Google Scholar] [CrossRef].
グラナドス、S.T.;カスティーヨ、K.;ブラボ-モラガ、F.;セプルベダ、R.V.;カラスケル-ウルスラエス、W.;ロハス、M.;カルモナ、E.;ロレンソ-セバロス、Y.;ゴンサレス-ニロ、F.;ゴンサレス、C.;ら。 電位およびCa2+活性化K+(BK)チャネルβ1サブユニットにおける17β-エストラジオール結合部位の分子的性質。Sci. Rep. 2019, 9, 9965. [Google Scholar] [CrossRef] [PubMed].
Shaikh, A.B.; Fang, H.; Li, M.; Chen, S.; Shang, P.; Shang, X. 骨格筋における炭酸脱水酵素IIIの発現低下は筋疲労に関連している可能性がある: ラット筋疲労モデル。J. Orthop. 2020、22、116-123。[Google Scholar] [CrossRef] [PubMed].
Bager, P.; Hvas, C.; Rud, C.; Dahlerup, J. Letter: チアミンの高用量投与に関する今後の研究では、疲労に対する効果が炭酸脱水酵素の阻害と関連しているかどうかを検討すべきである。著者からの回答。Aliment. Pharmacol. Ther. 2021, 53, 853-854. [Google Scholar] [PubMed].
Gonzalez-Hernandez, A.; Charlet, A. Oxytocin, GABA, and TRPV1, the Analgesic Triad? Front. Mol. Neurosci. 2018, 11, 398. [Google Scholar] [CrossRef].
Conte, E.; Romano, A.; De Bellis, M.; de Ceglia, M.; Rosaria Carratù, M.; Gaetani, S.; Maqoud, F.; Tricarico, D.; Camerino, C. Oxtr/TRPV1 expression and acclimation of skeletal muscle to cold-stress in male mice. J. Endocrinol. 2021, 249, 135-148. [Google Scholar] [CrossRef].
Scala, R.; Maqoud, F.; Angelelli, M.; Latorre, R.; Perrone, M.G.; Scilimati, A.; Tricarico, D. Zoledronic Acid Modulation of TRPV1 Channel Currents in Osteoblast Cell Line and Native Rat and Mouse Bone Marrow-Derived Osteoblasts: 細胞増殖とミネラリゼーション効果。Cancers 2019, 11, 206. [Google Scholar] [CrossRef].
Scala, R.; Maqoud, F.; Latorre, R.; Scilimati, A.; Tricarico, D. Zoledronic Acid Activates TRPV1 Channels: 細胞増殖と疼痛における役割の可能性。FASEB J. 2020, 34, 1. [Google Scholar] [CrossRef].
ファルハディ、A.; バナン、A.L.I.; フィールズ、J.; ケシャヴァルジアン、A.L.I. 腸関門: 健康と疾病の接点。J. Gastroenterol. Hepatol. 2003, 18, 479-497. [Google Scholar] [CrossRef]。
Russo, F.; Chimienti, G.; Riezzo, G.; Linsalata, M.; D'Attoma, B.; Clemente, C.; Orlando, A. Adipose Tissue-Derived Biomarkers of Intestinal Barrier Functions for Characterization of Diarrhoea-Predominant IBS. Dis. Markers 2018, 2018, 1827937. [Google Scholar] [CrossRef].
Mujagic、Z.; Ludidi、S; Keszthelyi、D; Hesselink、M.A.M.; Kruimel、J.W.; Lenaerts、K; Hanssen、N.M.J.; Conchillo、J.M.; Jonkers、D.M.A.E.; Masclee、A.A.M. 下痢優位のIBSでは小腸透過性が亢進しているが、すべてのIBSサブタイプにおける胃十二指腸透過性の変化は主に交絡因子に起因する。Aliment. Pharmacol. Ther. 2014, 40, 288-297. [Google Scholar] [CrossRef].
Linsalata, M.; Riezzo, G.; D'Attoma, B.; Clemente, C.; Orlando, A.; Russo, F. 腸管バリア機能の非侵襲的バイオマーカーは、下痢優勢型IBSを患う患者の2つのサブタイプを特定する: 症例対照研究。BMC Gastroenterol. 2018, 18, 167. [Google Scholar] [CrossRef].
Camilleri, M.; Oduyebo, I.; Halawi, H. 過敏性腸症候群における化学的および分子的要因: 過敏性腸症候群における化学的および分子的因子:現在の知識、課題、および未回答の質問。Am. J. Physiol. Gastrointest. Liver Physiol. 2016, 311, G777-G784. [Google Scholar] [CrossRef] [PubMed].
Koh,S.D.;Ward,S.M.;Dick,G.M.;Epperson,A.;Bonner,H.P.;Sanders,K.M.;Horowitz,B.;Kenyon,J.L.マウス結腸平滑筋の電気活動に対する遅延整流カリウム電流の寄与。J.Physiol.1999、515、475-487。[Google Scholar] [CrossRef] [PubMed].
Chao, G.; Zhang, S. Aquaporins 1, 3 and 8 expression in irritable bowel syndrome rat's colon via NF-κB pathway. Oncotarget 2017, 8, 47175-47183. [Google Scholar] [CrossRef] [PubMed].
消化器におけるアクアポリン. Med. electron Microsc. Off. J. Clin. Electron Microsc. 日本電子顕微鏡学会 2004, 37, 71-80. [Google Scholar] [CrossRef] [PubMed].
ヒト組織マイクロアレイにおけるAQP2およびAQP3水チャネルの分布。J. Mol. Histol. 2005, 36, 1-14. [Google Scholar] [CrossRef] [PubMed].
マウス、ラット、ヒトの大腸におけるAQPの特性と胆汁酸による選択的制御。Front. Nutr. [Google Scholar] [CrossRef] [PubMed].
El-Matary, W.; Spray, C.; Sandhu, B. 過敏性腸症候群: 小児の再発性腹痛の最も一般的な原因。Eur. J. Pediatr. [Google Scholar] [CrossRef].
過敏性腸症候群ラットの大腸におけるcAMP-PKA経路を介したアクアポリン1、3および8の発現とサイトカイン。Int. J. Clin. Exp. Pathol. 2018, 11, 4117-4123. [Google Scholar] [CrossRef].
過敏性腸症候群の標的薬物療法。Curr. Opin. Endocrinol. Diabetes Obes. 2021, 28, 214-221. [Google Scholar] [CrossRef].
Ochoa-Cortes、F.; Liñán-Rico、A.; Jacobson、K.A.; Christofi、F.L. 消化器疾患に対するプリン作動性薬剤開発の可能性。Inflamm. Bowel Dis. 2014, 20, 1259-1287. [Google Scholar] [CrossRef] [PubMed].
パロノセトロンと他の制吐薬のセロトニン5-HT3受容体への結合。Structure 2020, 28, 1131-1140.e4. [Google Scholar] [CrossRef] [PubMed].
腸管ニューロンのKCNQ(K(V)7)K(+)チャネルの活性化はマウス遠位結腸の上皮Cl(-)分泌を抑制する。Am. Am. Physiol. Cell Physiol. [Google Scholar] [CrossRef] [PubMed].
ブルガダ症候群および薬剤誘発性1型ブルガダパターン患者における過敏性腸症候群の頻度。Am. J. Cardiol. 2021, 151, 51-56. [Google Scholar] [CrossRef] [PubMed].
崔 稔亮(Choi, N.R.; Kwon, M.J.; Choi, W.-G.; Kim, S.C.; Park, J.-W.; Nam, J.H.; Kim, B.J. 伝統的な漢方薬の混合物であるバナサシムタンは、TRPA1、NaV1.5およびNaV1.7チャネルの調節を介して過敏性腸症候群の症状を緩和する。J. Ethnopharmacol. 2023, 312, 116499. [蔡 毅; 汪 拓; 蔡 拓; 汪 拓; 汪 拓; 汪 拓; 汪 拓
蔡 毅; 王 旭; 李 薇; 匈 菲; 呉 浩; 楊 旭; 楊 旭: シネフリン、ペオニフロリン、ナリンギンの複合効果。Phytomedicine 2021, 86, 153527. [Google Scholar] [CrossRef] [PubMed].
免責事項/出版者注:すべての出版物に含まれる声明、意見およびデータは、著者および寄稿者個人のものであり、MDPIおよび/または編集者のものではありません。MDPIおよび/または編集者は、コンテンツで言及されているアイデア、方法、指示、製品に起因する人または財産の損害について、一切の責任を負いません。
著者による© 2023。ライセンシー MDPI, Basel, Switzerland. 本論文は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条項および条件の下で配布されるオープンアクセス論文である。
共有と引用
MDPIおよびACSスタイル
Maqoud、F.; Tricarico、D.; Mallamaci、R.; Orlando、A.; Russo、F. 機能性胃腸障害(FGID)におけるイオンチャネルの役割: 胃腸機能障害(FGID)におけるイオンチャネルの役割:チャネル異常の証拠と今後の研究および治療標的の可能性。Int. J. Mol. Sci. 2023, 24, 11074. https://doi.org/10.3390/ijms241311074
AMAスタイル
機能性胃腸障害(FGID)におけるイオンチャネルの役割: 胃腸機能障害(FGID)におけるイオンチャネルの役割。International Journal of Molecular Sciences. 2023; 24(13):11074. https://doi.org/10.3390/ijms241311074
シカゴ/チュラビアンスタイル
Maqoud, Fatima, Domenico Tricarico, Rosanna Mallamaci, Antonella Orlando, and Francesco Russo. 2023. 「機能性胃腸障害(FGID)におけるイオンチャネルの役割: Evidence of Channelopathies and Potential Avenues for Future Research and Therapeutic Targets" International Journal of Molecular Sciences 24, no. 13: 11074. https://doi.org/10.3390/ijms241311074
他のスタイルを探す
2016年創刊号より、本誌はページ番号の代わりに論文番号を使用しておりますのでご注意ください。詳細はこちらをご覧ください。
論文指標
引用
この記事の引用は見つかりませんでしたが、Google Scholarで確認することができます。
論文アクセス統計
記事アクセス統計記事閲覧数4. 7月5日 7月6日 7月7日 7月8日 7月050100150200250
ジャーナル統計の詳細はこちらをご覧ください。
同一IPアドレスからの複数のリクエストは1ビューとしてカウントされます。
Int. J. Mol. Sci., EISSN 1422-0067, MDPI発行
RSSコンテンツアラート
その他の情報
論文処理料金請求書の支払いオープンアクセスポリシーお問い合わせMDPIJobs at MDPI
ガイドライン
著者の方へ査読者の方へ編集者の方へライブラリアンの方へ出版社の方へ学会の方へ学会主催者の方へ
MDPIの取り組み
SciforumMDPI書籍Preprints.orgScilitSciProfilesEncyclopediaJAMSProceedingsシリーズ
MDPIをフォローする
LinkedInFacebookTwitter
MDPIジャーナルからの発行通知やニュースレターを購読する
Acoustics Actuators Administrative Sciences Adolescents Advances in Respiratory Medicine Aerospace Agriculture AgriEngineering Agrochemicals Agronomy AI Air Algorithms Allergies Alloys Analytica Analytics Anatomia Anesthesia Research Animals Antibiotics Antibodies Antioxidants Applied Biosciences Applied Mechanics Applied Microbiology Applied Nano Applied Sciences Applied System Innovation AppliedChem AppliedMath Aquaculture Journal Architecture Arthropoda Arts Astronomy Atmosphere Atoms Audiology Research Automation Axioms Bacteria Batteries Behavioral Sciences Beverages Big Data and Cognitive Computing BioChem Bioengineering Biologics Biology 生物学・生命科学フォーラム Biomass バイオマス Biomechanics BioMed Biomedicines BioMedInformatics バイオミメティクス Biomolecules Biophysica バイオセンサー BioTech Birds ブロックチェーン Brain Sciences Buildings Businesses C Cancers Cardiogenetics Catalysts Cells Ceramics Challenges ChemEngineering Chemistry Chemistry Proceedings Chemosensors 子どもたち チップ CivilEng クリーンテクノロジー 気候 臨床とトランスレーショナル神経科学 臨床と実践 時計と睡眠 海岸 コーティング コロイドと界面 着色剤 商品 複雑性 化合物 計算 計算機科学と数学 フォーラム コンピューター 物性 保存 建設材料 腐食と材料劣化 化粧品 COVID 作物 暗号化 結晶 分子生物学の最新の問題 現在の腫瘍学 酪農データ 歯科学 Journal Dermato Dermatopathology Designs Diabetology Diagnostics Dietetics Digital Disabilities Diseases Diversity DNA Drones Drugs and Drug Candidates Dynamics Earth Ecologies Econometrics Economies Education Sciences Electricity Electrochem Electronic Materials Electronics Encyclopedia Endocrines Energies Eng Engineering Proceedings Entropy Environmental Sciences Proceedings Environments Epidemiologia Epigenomes European Burn Journal European Journal of Investigation in Health、 Fermentation Fibers FinTech Fire Fishes Fluids Foods Forecasting Forensic Sciences 森林 Fossils Foundations Fractal and Fractional Fuels Future Future Internet Future Pharmacology Future Transportation Galaxies Games Gases Gastroenterology Insights Gastrointestinal Disorders Gastronomy Gels Genealogy Genes Geographies GeoHazards Geomatics Geosciences Geotechnics Geriatrics Gout, Urate、 and Crystal Deposition Disease Grasses ハードウェア ヘルスケア Hearts Hemato Hematology Reports Heritage Histories Horticulturae Hospitals Humanities Humans Hydrobiology Hydrogen Hydrology Hygiene Immuno Infectious Disease Reports Informatics Information Infrastructures Inorganics Insects Instruments International Journal of Environmental Research and Public Health International Journal of Financial Studies International Journal of Molecular Sciences International Journal of Neonatal Screening International Journal of Plant Biology International Journal of Translational Medicine International Journal of Turbomachinery、 国際医学教育発明IoT ISPRS国際地理情報ジャーナル 加齢・長寿ジャーナル 心臓血管の発達と疾患ジャーナル 臨床・トランスレーショナル眼科学ジャーナル 臨床医学ジャーナル 複合材料科学ジャーナル サイバーセキュリティとプライバシージャーナル 発生生物学ジャーナル 実験・理論解析ジャーナル 機能性バイオマテリアルジャーナル 機能形態学・運動学ジャーナル 菌類学ジャーナル イメージングジャーナル 知能ジャーナル 低電力エレクトロニクスと応用ジャーナル 製造・材料加工ジャーナル 海洋科学・工学ジャーナル 分子病理学ジャーナル ナノテラノスティクスジャーナル 原子力工学ジャーナル 耳鼻咽喉科学ジャーナル 個別化医療ジャーナル 呼吸学ジャーナル リスクと財務管理ジャーナル センサとアクチュエータネットワークジャーナル 理論と応用電子商取引研究ジャーナル 血管疾患ジャーナル 異種生物学ジャーナル 動物園・植物園ジャーナリズムとメディア 腎臓と透析 キナーゼとホスファターゼ 知識 土地 言語 法律 生命 Limnological Review 液体 文学 肝臓 論理学 物流 潤滑剤 リンパ管 機械学習と知識抽出 機械 Macromol 磁性 磁気化学 海洋薬物 材料 材料会議 数理・計算応用 数学 医学 医学フォーラム Medicina メディシン メンブレン メリット メタボライト 金属 気象学 メタン メソッドとプロトコル 計量学 マイクロ微生物学研究 マイクロマシン 微生物 マイクロプラスチック 鉱物 鉱山 モデリング Molbank 分子 マルチモーダル技術と相互作用 筋肉 ナノエネルギーの進歩 ナノ製造 ナノ材料 NDTネットワーク ニューログリア 神経学 国際神経科学 窒素 非 看護学レポート 栄養補助食品 栄養素 肥満症 海洋 オンコ オプティクス オーラル オルガノイド オステオロジー 酸素 パラシトロジア パーティクル 病原体 病態生理学 小児科レポート 医薬品 製薬学 薬剤疫学 薬学哲学 フォトケミックス フィコロジー フィケム 物理科学フォーラム 物理学 物理学 植物 プラズマ プラットフォーム 汚染物質 ポリマー 多糖類 家禽類 粉末 会議録 プロセス プロテオーム 精神医学 国際精神作用学 出版物 量子ビーム 科学 量子レポート 第四紀放射線 反応 受容体 リサイクル 宗教 リモートセンシング レポート 生殖医療 リソース リューマート リスク ロボット工学 反芻動物 安全科学 サイエンティア 薬剤学 硬化症 種子 センサー 分離 性別 シグナル 副鼻腔炎 スマートシティ 社会科学 社会 ソフトウェア 土壌システム 太陽固体 分光学 ジャーナル スポーツ 規格 統計 ストレス 表面 手術 手術手技 開発 持続可能性 持続可能な化学 シンメトリー シンバイオ システム 目標 分類技術 電気通信 繊維製品 サラセミア レポート サーモ・トモグラフィ ツーリズムとホスピタリティ トキシックス 毒素 移植学 トラウマケア 高等教育の動向 熱帯医学と感染症 宇宙 都市科学 ウロワクチン 自動車 性病学 獣医科学 振動 仮想世界 ウイルス 視覚 廃棄物 水 風 女性 世界 電気自動車ジャーナル 青少年 人獣共通感染症
オプションを選択
購読申し込み
© 1996-2023 MDPI (スイス、バーゼル) 特に明記されていない限り
免責事項 利用規約 プライバシーポリシー
この記事が気に入ったらサポートをしてみませんか?
