樹状細胞の活性を調節する微生物叢物質: 批判的見解
本文へスキップ記事へスキップ
エルゼビアのロゴ
ヘリヨン
オンラインで入手可能 2024年2月25日, e27125
In Press, Journal Pre-proofこれは何ですか?
総説
樹状細胞の活性を調節する微生物叢物質: 批判的見解
https://www.sciencedirect.com/science/article/pii/S2405844024031566


著者リンク オーバーレイパネルを開くYuliia Shvets a, Natalia Khranovska b, Natalia Senchylo a, Danylo Ostapchenko a, Iryna Tymoshenko c, Svitlana Onysenko a, Nazarii Kobyliak c d, Tetyana Falalyyeva a d
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.heliyon.2024.e27125
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
微生物叢は、様々な生物学的活性を持つ細菌抗原の供給源である。
樹状細胞は細菌の生化学的シグナルを統合し、免疫反応を誘導・形成する。
一般的にリポ多糖やペプチドグリカンなどの細菌細胞壁成分は樹状細胞の炎症活性を誘導する。
微生物群の代謝産物は樹状細胞の抗炎症活性を誘導する。
微生物叢からの生化学的シグナルの統合が樹状細胞の活性と免疫応答を形成する。
要旨
微生物叢の分野における現代の研究は、常在細菌が、脳、肺、免疫系、代謝系など、ヒト生体のさまざまな器官やシステムの生理活性に影響を及ぼすことを示している。この影響は様々なプロセスによって実現される。そのひとつが免疫機構の調節である。微生物叢とヒトの免疫系との相互作用は複雑で曖昧であることが知られている。樹状細胞(DC)は、適応免疫応答の発達と分極化を開始するユニークな細胞である。これらの細胞はまた、ネイティブで特異的な免疫反応性を相互接続している。微生物叢からは、さまざまな微生物叢関連分子パターン(MAMPs)や細菌の代謝産物という形で、ヒト生体の局所的・遠隔的に作用する一連の生化学的シグナルが発信されている。その結果、常在細菌は樹状細胞の成熟度と活性に影響を与え、ヒト生体の全体的な免疫反応性に影響を与える。その結果、常在細菌は病原性微生物に対する反応や、さまざまな病態に関連する炎症を決定し、さらにはワクチン接種の効果にも影響を及ぼす。
キーワード
常在細菌抗原提示細胞ペプチドグリカンリポ多糖短鎖脂肪酸二次胆汁酸オートインデューサー
はじめに
遺伝学的研究手法を用いた科学プロジェクトMetaHIT(Metagenomics of the Human Intestinal Tract Consortium)とHMP(Human Microbiome Project)により、人体に生息する細菌の種の豊富さ、量、重要性についての知見が大きく解明された[[1]、[2]、[3]]。以前は、細菌は皮膚や粘膜にのみ存在すると考えられていた。しかし、現在では、細菌とその代謝産物は、流動性を持ついくつかのタイプの組織(「リーキーガム」や「リーキーガット」の現象)[4,5]を介して循環系に入り込み[6]、そこから様々な臓器や組織に入り込み、組織微小環境の重要な構成要素となることが知られている[7], [8], [9], [10]。哺乳類のいくつかの臓器、例えば乳腺は、腸からの細菌輸送のユニークな、まだ十分に研究されていないメカニズムを持っている [11,12]。常在細菌と接触している組織で病理学的プロセスが発生する際、微生物叢の組成と代謝活性の変化が観察される[[13]、[14]、[15]、[16]]。長い進化の過程で、常在細菌はヒトの体内での生活に完全に適応し、ユニークで特別な「代謝器官」として、一般的な代謝プロセスにおいて不可欠な重要な役割を果たしている[17,18]。
したがって、常在細菌は人体に広く存在している。常在細菌は常に免疫系の細胞と接触しており、免疫反応のメカニズムに影響を与えている。無菌動物の免疫系に関する多くの研究において、微生物叢を持たない動物の発育条件における免疫系は、解剖学的にも機能的にも未発達であることが示されている[[19]、[20]、[21]]。一般に、ヒトの常在細菌の種数は約10,000種と計算されている[22]。同時に、現在までに約1500種の病原性細菌が報告されている[23]。生涯を通じて、人体は約1,000種の常在細菌と、数十種の病原体と接触している。したがって、ヒトの生体とその免疫系は、ほとんどが常在菌と接触している。それらの多くは日和見的であり、状況によっては感染プロセスの発症を誘発する可能性がある。このように、微生物叢は免疫系を教育すると考えられている。動物の微生物叢組成を人為的に変化させることで、抗感染性免疫応答のメカニズムに影響を与えることが可能であることが示されており [24]、さらにはワクチン接種の効果にも影響を与えることが可能である [25]。
この総説の主旨は、ヒト樹状細胞(DC)に対する常在細菌が産生するいくつかの物質の影響を、in vitroおよびin vivoの研究において、共刺激分子の発現、サイトカイン産生、エフェクターT細胞の分化誘導に焦点を当てて分析することである。細胞壁成分であるリポ多糖(LPS)[26,27]やペプチドグリカン(PGN)[26]、短鎖脂肪酸(SCFA)[28]、二次胆汁酸(SBA)[29]、自己誘導因子などの細菌代謝産物など、さまざまな細菌物質が、DCに対して多様で、時には正反対の作用を示すことがある[30]。したがって、DCは細菌からの様々な生化学的シグナルを統合して、最も適切な「答え」を出さなければならない。さらにDCは、サイトカイン、他の細胞との接触、細胞外マトリックスなど、環境からの他のシグナルも感知しなければならない。このような複雑なシグナルによるDCの活性化状態が、さらに免疫反応の方向性や性質に影響を及ぼす。
樹状細胞 重要な機能と意義
歴史的文献によると、ポール・ランゲルハンスが1868年に初めて皮膚でDCを発見した。その特殊なプロセスのような形態から、この科学者は樹状細胞を特殊なタイプの神経細胞であると考えた [31] 。これらの細胞は「ランゲルハンス細胞」と名付けられ、今日に至っている。長い間、科学界はこれらの細胞の存在を知らなかった。それからわずか100年以上後の1973年、リーデンで開催された単核食細胞に特化した学会で、若い科学者ラルフ・スタインマンが、脾臓から単離された特殊な細胞について報告した。これらの細胞は最初「樹状細胞」と呼ばれた。ラルフ・スタインマンは科学者としての全生涯をDCの研究に捧げ、この分野で多くの発見をし、2011年にノーベル賞を受賞した。
DCは免疫系のゲートキーパーであり、免疫系の適切な発達と制御には、DCと微生物叢との接触が不可欠であると考えられている。常在DCは様々な臓器や組織に存在する。DCは胚由来で、自己複製が可能である。必要に応じて、末梢血単球は組織に入るとDCに分化することができる。
現在では、DCにはその起源、局在、機能によって多くの集団があることがわかっている [33,34] 。最もよく知られているのは、従来型DC(cDC)と形質細胞様DC(pDC)の2種類である。従来型DCは、cDC1とcDC2の2つのグループに細分され、それぞれ異なる転写プログラムと機能特性を持つ。ヒトとマウスのDCサブセットは、サブセットの形成と転写因子の活性において類似している。異なる集団の細胞の機能も、いくらか異なっている。
抗原提示細胞(APC)は、様々な抗原物質(微生物、真核細胞の残骸など)を非特異的に取り込み、取り込まれた抗原を処理し、MHC I、MHC II分子、または他のMHC-I様分子(CD1)と複合体を形成して二次リンパ臓器に提示し、ナイーブαβT細胞のプライミング、またはNK-T細胞やγδT細胞の活性化を行う。一般に、成熟したDCは、ナイーブT細胞をプライミングし活性化するために、いくつかの重要な活性化表面リガンドや分泌因子を示す。その中には、抗原ペプチド-MHC複合体(シグナル1)、コスティミュレイトリー分子CD80/86(シグナル2)、サイトカイン(シグナル3)がある。抗原の性質、微小環境刺激、DCの種類と成熟状態は、T細胞エフェクター集団の形成を伴う適応免疫応答の極性化に非常に大きく影響する: Th1、Th2、Th17、あるいはTregである。
未熟細胞から成熟細胞へと発達する過程で、DCは細菌性物質に対して異なる能力を示す。高い貪食機能を持つDC前駆体は、細菌分子パターンを認識するためのレセプターを最も活発に発現する。例えば、未熟なCD11c + DCはTLR1、2、3を発現するが、pDCの前駆細胞はTLR7と9を顕著に発現する。このことは、異なる集団のDCが、微生物の異なる物質を検出し、さらに多方向の免疫反応を引き起こすように調整されていることを示している。
組織内に常在するDCは未熟であり、顕著な貪食活性を示すが、コスティミュレイトリー分子CD80、CD86、CD83、CD40、OX40L、ICOS-Lの発現レベルは低く、サイトカインの分泌がないことが特徴である。DCは外来抗原の摂取や特定の細菌物質との相互作用の後に成熟する。成熟したDCは、貪食作用がないこと、コスティミュレイトリー分子の発現が高いこと、サイトカインを分泌していることで区別される。
したがって、DCは、その種類、成熟状態、および産生されるサイトカインに応じて、エフェクター細胞の異なる集団の関与により、幅広い免疫応答反応を誘導することができる。さらに、DCは自然免疫と適応免疫の間をつなぐ重要な役割を担っている。適応免疫応答を開始する上で重要な役割を果たすため、DCはワクチン作製に利用されている [39]。
組織から単離される分化型ヒトDCは、in vitroではうまく増殖しない。したがって、試験管内でヒトDCを得るための最も一般的で簡便なアプローチは、末梢血単球における成熟誘導である。末梢血単核球は、密度勾配(ρ = 1.077)での遠心分離によって得られる。次に、プラスチックへの接着能力や単球マーカーCD14の発現を考慮した様々な技術を用いて単球を分離する[40]。単球はさらに、顆粒球単球コロニー刺激因子(GM-CSF)やインターロイキン-4(IL-4)などのサイトカインで刺激され、1週間培養される。このようにして、単球由来の未熟なヒトDCが得られる[41]。in vitro実験用のマウスDCを得るためのプロトコールはいくつかある。そのひとつによると、大腿骨と脛骨から得た骨髄懸濁液から骨髄由来DC(BM-DC)を調製した。未熟なDCを得るために、骨髄細胞をマウスGM-CSFで培養した [42]。
成熟誘導のために試験管内でDCを増殖させる標準的なプロトコールでは、未熟なDCは通常、大腸菌LPSで処理される。抗腫瘍ワクチン作製のためにDCを成長させる場合、DCはさらに腫瘍抗原を負荷される。これらの操作の後、得られたDCの成熟度を決定しなければならない。そのために、HLA-DR、CD80、CD86、CD40などのDC表面マーカーの発現やサイトカイン分泌を測定する。組織内に存在する未熟なDCは抗原を積極的に取り込み、末梢リンパ器官のT依存性ゾーンに移動する。同時にDCは成熟し、MHCとコスティミュレイトリー分子を高発現する。DCは特定のT細胞に効果的に抗原を提示し、これらの細胞の分化に影響を与える。数百万年にわたる進化の過程で、免疫系は病原体や常在菌に反応するための非常に効率的なメカニズムを発達させてきた。これらの機構は、DCのような免疫センチネル細胞が細菌の分子パターンを認識したときに開始される。さらに、DCによる細菌物質の最初の認識は、DCの成熟と免疫応答の極性化の両方に影響を与える。
微生物関連分子パターンとDCの相互作用
いかなる常在細菌や病原性細菌も、遺伝的に外来な情報と、多数の抗原構造の両方のキャリアである。真核生物には存在しないこれらのユニークな抗原性構造は、一般に微生物関連分子パターン(MAMP)または病原体関連分子パターン(PAMP)と呼ばれる。生化学的構造から見ると、PAMPには従来、ペプチド、多糖類、細胞壁の脂質構造、細胞内タンパク質、さらには細菌のDNAやRNAが含まれていた(図1)。DCによるこれらの細菌抗原の認識は、一般にパターン認識受容体(PRR)と呼ばれる多くの膜および細胞内に保存された受容体の関与によって起こる。PRRの概念は、1989年にCharles Janewayによって初めて提唱され、発展したものである[45]。最もよく知られたタイプのレセプターには、膜型Toll様レセプター(TLR)、C型レクチンレセプター(CLR)、細胞内NOD様レセプター(NLR)、RIG様レセプター(RLR)などがあります[46]。各タイプの受容体は、微生物の様々な物質と相互作用し、対応するシグナル伝達カスケードの展開を開始する多くの分子変異体を持っている。
図1
ダウンロード 高解像度画像ダウンロード(516KB)
ダウンロード フルサイズ画像をダウンロード
図1. 細菌のMAMPs、代謝産物、および細胞成分。OMV-外膜小胞、SCFA-短チン脂肪酸、AA-酸性酸、PA-プロピオン酸、BA-酪酸、SBA-二次胆汁酸、AI-自己誘導物質、MDP-ムラミルジペプチド、AHL-アシルホモセリンラクトン。残基は六角形で示す: GlcNはグルコサミン、Kdoは3-デオキシ-d-マンノ-oct-2-ウロソン酸、Hepはl-グリセロ-d-マンノ-ヘプトース、Galはガラクトース、Gluはグルコース。リン酸基は丸で囲んだPで示す。
従って、細菌の分子パターンには、実際に細菌細胞の構成成分であり、細菌の存在を確認できるような物質が含まれることが従来から認められている。細菌の代謝産物とそれに対応するレセプターは、現在のところ、一般的に受け入れられているMAMPsとPRRsの枠組みでは考えられていない。というのも、SCFA、SBA、自己誘導物質(AI)のようなバクテリアの代謝産物は、進化の観点からは極めて保守的な分子だからである。これらは細菌によってのみ産生され、LPSやPGNと同様、生きた細菌が活発に情報伝達や代謝を行っていることを示す生化学的な「バーコード」である。したがって、これらの分子の存在と濃度は、バクテリアの存在だけでなく、集団としての代謝や行動の状態も示している。これらは微生物代謝関連分子パターン(MMAMPs)と呼ばれる。
この総説では、PGNやLPSのような細菌の細胞壁成分など、最も研究されている細菌の分子抗原パターンに焦点を当てる。PGNは、細胞壁を持つすべての細菌の細胞壁成分である[47]。LPSはグラム陰性菌の細胞壁に存在する。表面からの脱落や腸内などでの細菌細胞の破壊の結果、これらの物質は血流に検出され、様々な臓器や組織に導入される。そして、PGNとLPSは全身的に免疫系の活性に影響を及ぼす。
in vitro研究の文献では、科学者はサイトカイン(IL-4、GM-CSF)とインキュベートすることにより、ヒト末梢血単球から未熟なDCを得た。マウスの未成熟DCは、骨髄骨髄系前駆細胞から得られ、その後GM-CSF処理、あるいは脾臓組織から通常のDC単離を行った。次に、未熟なDCを細菌性物質で処理し、成熟状態、DCの分泌活性、場合によってはエフェクターT細胞レベルでの免疫応答の分極化に対する影響を調べた。このために、DCを自家または同種ナイーブCD4+Tリンパ球とインキュベートし、これらのエフェクターリンパ球の機能活性を測定した。
3.1. PGNとDCの相互作用
PGNは細菌細胞壁の主要な生体高分子である。PGNの基本構造は直鎖状の糖鎖(β-1,4結合のN-アセチルグルコサミン、GlcNAcとN-アセチルムラミン酸、MurNAc残基が交互に結合したもの)からなり、短いペンタペプチド鎖によって架橋されている(図1)。ペンタペプチド鎖にはL-アミノ酸とd-アミノ酸が含まれ、後者は細菌のPGNに特徴的である[47]。異なる種の細菌性ペプチドグリカンは、その生化学的構造と抗原性においてやや異なっている。
ほとんどのin vitro研究では、日和見菌である黄色ブドウ球菌由来のPGNがDCの治療に用いられた。表1に示した研究結果は、異なる種の細菌のPGNが、ヒトDCの成熟状態や機能活性に対して、わずかに異なる影響を及ぼすことを示している。例えば、黄色ブドウ球菌のPGNはDCの成熟を刺激し、抗原提示に関連する分子(HLA-DR、CD80)、コスティミュレイトリー分子(CD40)、二次リンパ臓器のT依存性ゾーンへの移動に必要な受容体(CCR7)の発現を増加させた。また、黄色ブドウ球菌で刺激されたPGN DCは、炎症性サイトカインであるIL-1β、IL-6、IL-23を産生した [48,49]。これらのDCはさらに、in vitro系でTh17のナイーブCD4+Tリンパ球の発生を刺激した(表1)。マウス由来のDCを用いたin vitro研究では、黄色ブドウ球菌のPGNもDCの成熟に寄与し、MHC II、CD80、CD86などの表面マーカーの発現を増加させることが示された [50]。DCによる炎症性サイトカインIL-12p70とTNF-αの産生、および抗炎症性サイトカインIL-10が検出された。このようなDCの表現型は、免疫反応をTh1形成方向に極性化させた。黄色ブドウ球菌を死滅させる免疫応答の重要なメカニズムが、好中球とマクロファージの参加による細菌の貪食であることは、研究データからも理解でき、確認されている。これらの自然免疫応答は、それぞれTh17とTh1によって大きく増強される。
表1. 試験管内でPGNとLPSで刺激したヒトとマウスのDC。
細菌物質 DCの成熟 T細胞の分極化と産生サイトカイン Ref.
ペプチドグリカン (PGN)
PGN 黄色ブドウ球菌
PGN S. aureus
PGN L. rhamnosus
PGN S. aureus
PGN S. aureus
PGN S. aureus
PGN S. aureus
PGN S. aureus
PGN S. aureus
PGN S. gordonii
hMDDC: HLA-DR↑、CD83↑、CD40↑、CD86↑、CCR7↑、IL-23↑、 IL-6↑、IL-1β↑、(IL-12p70は除く) Th17
IL-17↑、IL-21↑、[26]。
hMDDC: IL-23↑、IL-6↑、IL-10↑、IL-12↓ Th17 [43]
hMDDC: CD86 ↑、TNF-α↑ [46]
hMDDC: CD86 ↑、HLA-DR↑、CD83↑。
hMoLC CD86↑、HLA-DR↑、CD83↑ [50]
[50]
mBM-DC: IL-12p70↑、IL-10↑、TNF-α↑が低い。
mBM-DC: MHC II↑、CD80↑、CD86↑。
mBM-DC:MHC II↑、CD86↑。
マウス・ランゲルハンス細胞 CXCL10↑、CCL17↑。
mBM-DC: CD80↑、CD86↑、TNF-α↑、IL-6↑、IL-10↑ Th1 [47]
[44]
[48]
[49]
[45]
リポ多糖(LPS)
LPS 大腸菌
LPS 大腸菌
LPS 大腸菌
LPS P. gingivalis
LPS A. アクチノミセテムコミタンス
LPS 大腸菌
LPS P. gingivalis
LPS 大腸菌
LPS 大腸菌 hMDDC: CD86 ↑, HLA-DR↑, CD83↑ [27].
hMDDC:HLA-DR↑、CD86↑、CD40↑ [65]
hMDDC:CD86↑、HLA-DR↑、ICOS-L↑ PDL1↑、PDL2↑、TNF-α↑、IL-6↑、IL-10↑、IFN-γ↑、IL-2↑ [64]
hMDDC: HLA-DR↑、CD80 low↑、CD40 low↑、CD83 low↑、低TNF-α↑、低IL-10↑。
hMDDC:HLA-DR↑、CD80↑、CD40↑、CD83↑、低TNF-α↑、低IL-10↑。
hMDDC:HLA-DR↑、CD80↑、CD40↑、CD83↑、TNF-α↑、IL-10↑、IFN-γ↑、Th1発現誘導
hMDDC:低TNF-α↑、低IL-10↑、
hMDDC: IL-12 p70↑、IP-10↑、TNF- α↑、IL-10↑、IL-6↑、IL-1 β↑ ↑。
hMDDC:CD83↑、CD209↑、IL-6↑、IL-12p40↑、Th2、
IL-13, IL-5
Th1、高いIFN-γ、IL-2、しかしIL-5は少ない [67] 。
[67]
[67]
[68]
[68]
[66]
ヒト単球由来DC(hMDDC)、マウス骨髄由来DC(mBM-DC)、ヒト単球由来ランゲルハンス様細胞(hMoLC)、IFN-γ誘導性タンパク質10(IP-1)。
口腔内細菌叢常在菌Streptococcus gordoniiのPGNは、マウスBM-DCのCD80とCD86の発現増加を誘導し、IL-6、TNF-α、IL-10の分泌も促進することが示されている[51]。同じ研究において、UVで不活性化した全細菌細胞は、DCの成熟とサイトカイン産生の表面マーカーをより効果的に刺激することが示されている。上記のサイトカインに加えて、全細菌細胞で処理したBM-DCはIL-12p70も産生した[51]。
ヒトMDDCをラクトバチルス・ラムノサスのPGNで処理すると、少し異なる効果が観察された。HLA-DR、CD80、CD83マーカーの発現はDC上で変化しなかった。しかし、CD86の発現とTNF-αの分泌は増加した。
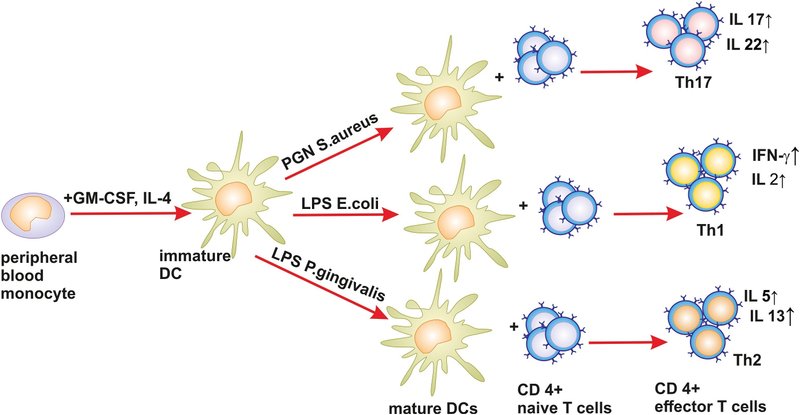
一般に、in vitroでDCを様々な種類の細菌のペプチドグリカンで処理すると、DCはより成熟した表現型を獲得し、表面マーカーであるHLA-DR、CD83、CD86、CCR7を高発現し、サイトカインであるTNF-α、IL-6、IL-1βを分泌することが判明した(表1)[53]、[54]、[55]、[56])。PGNで処理したDCは、炎症性特異的免疫応答のエフェクター細胞であるTh1やTh17の形成をさらに促進した(図2)。
図2
ダウンロード 図2 高解像度画像のフイルムダウンロード (476KB)
ダウンロード フルサイズ画像のダウンロード
図2. LPSとPGNがin vitroでDCの成熟と機能に及ぼす影響のスキーム。
ヒトの生体内では、DCは純粋なPGNと相互作用することができる。PGNは細菌細胞の活発な増殖や破壊の結果として形成される。例えば、指数関数的増殖期にある黄色ブドウ球菌感染症では、PGNが剥離され、それがDCの活性化とTh17依存性の炎症性機序を発達させる方向への免疫応答の分極化に寄与することが研究されている [48]。同時に、PGNは、DC [57] によるIL-12の産生と、Th1形成方向への免疫応答の極性化を阻害した [48]。好中球の活性を伴うTh17依存性の免疫応答は、細胞外病原体を排除するのに必要である。黄色ブドウ球菌が増殖の定常期にある場合、あるいは菌が真核細胞内にある場合、細胞内に内在する菌の破壊に必要なTh1細胞偏極に免疫系機構が偏ることになる[48]。
Lisbeth Drozd Lundらは、初期の指数関数的増殖期にある黄色ブドウ球菌が、マウスのDCにおいてIL-12、TNF-α、IL-10の産生を刺激することを示した。定常増殖期にある細菌は、DCのサイトカイン合成および分泌をあまり誘導しなかった。紫外線(UV)による細菌の殺傷も、DCサイトカイン分泌誘導能を低下させた。指数関数的増殖期にある無傷の黄色ブドウ球菌のみが、DCによるIL-12分泌を誘導することが示されている。紫外線で細菌を死滅させると、IL-12を含むすべてのサイトカインの産生は部分的に減少したが、消失はしなかった。CD86とCD40の最大レベルの発現も、DCを無傷の細菌で処理したときに観察された[57]。ポリ-N-アセチルグルコサミン(PNAG)を産生しない黄色ブドウ球菌変異株は、野生株と比較して、DCによるIL-12の産生をより多く誘導することが示された[57]。したがって、健康な生体で発現する免疫反応は、細菌そのものだけでなく、感染プロセスを発症した場合の細菌の増殖段階にも最大限に適応していることは明らかである。
このような研究を行う場合、いくつかの点が注目される。第一に、炎症性免疫反応を誘導するPGNの能力は、生体高分子の構造に依存する。PGNの生化学的修飾を担う遺伝子の活性が変化した結果、細菌によってPGNの構造が変化した場合、免疫応答反応にも変化が観察されることが示されている。例えば、酵素であるグルコサミニダーゼSagB [58] の活性低下や、黄色ブドウ球菌 [59] におけるPGNのO-アセチル化により、DCの効果的な成熟や炎症促進機能の発現を阻害するPGNが産生される。細菌は通常、宿主の免疫反応を回避するためにこのようなメカニズムを利用する。
第二に、DCとリンパ球を共培養した実験結果を解釈する際には、DCがCD40分子を介してリンパ球からさらなる活性化刺激を受けることを理解する必要がある。この場合、MAMPsとCD40ライゲーションは相乗効果を持つ。そのため、いくつかの研究では、CD40リガンドを用いてこの点を別途調査している[56]。
第三に、ある種のPRRの発現は、DCの様々な集団で異なっている。したがって、異なるタイプのDCは、同じMAMPsに対して特徴的な反応を示す。ヒトMDDCsとMoLCsを用いた実験では、PGNとCD40ライゲーションによる刺激という同じ条件下で、CD80とCD83の発現レベルはMDDCsの方が高いことが示された。さらに、細菌の分子パターンと相互作用する受容体の発現レベルは、単球からDCが分化する過程で変化する。例えば、TLR2とTLR4の発現レベルは著しく低下しており [60]、これはDCの発達のある初期段階において、細菌抗原に応答するためのある種の「機会の窓」があることを示している。この成熟状態は、組織におけるDCの存在段階に相当する。組織内で抗原を取り込み、二次リンパ器官のT依存性ゾーンに移動し、そこで抗原を提示した後、DCはナイーブT細胞の効果的な活性化に必要な成熟した表現型を獲得する。
このように、ほとんどのin vitro実験において、細菌性PGNはDCの炎症活性を誘導する能力を示した。
3.2. DCとLPSの相互作用
LPSはグラム陰性菌の細胞壁の成分であり、その完全性を支えている。化学構造によると、LPSはリピドA、コアオリゴ糖、サイドO-抗原部分からなる複雑な構造をしている(図1)。LPSは細菌外膜(OM)の外側に局在する。ーLPSはー主要なー病原性因子のーでありー[ー]、自然免疫応答をー[ー]をー[ー]重要なー[ー]である[ー[ー]。LPSは内毒素とも呼ばれ、その毒性は主に脂質Aに関係している。ータはータはータはータはータはータはー ー脂質Aのーにおけるーにおけるー [63] 。LPSのメチル化されたオリゴ糖鎖はドコア部分はドコアとメチル化されたオリゴ糖鎖のメチル化されたオリゴ糖鎖メチル化されたオリゴ糖鎖。インナーコアはより保守的であるが、アウターコアは可変的である。ー3-デオキシ-d-マンノ-oct-2-ウロソン酸(ーKdo)を少なくとも内核は内核は内核は内核は内核は内核は内核は内核は. ー3-デオキシ-d-マンノ-oct-2-ウロソン酸(ー3-デオキシ-d-マンノ-oct-2-ウロソン酸(ーKdo)を有する。] これはLPSの中で最も多様な部分である。異なる細菌株は、特定のO-抗原に対する特異的抗血清によって区別することができる[64]。
LPSは最も有名なMAMPsの一つであり、LPS研究の歴史は150年以上に及ぶ[27]。LPSリピドAは、自然免疫および適応免疫の細胞、上皮細胞上で、TLR4受容体および補助分子LBP、CD14、MD2と相互作用する[65]。DC上でTLR4が活性化されると、共刺激分子の発現が高まり、炎症性サイトカインやケモカインの合成が促進される。大腸菌LPSは、DCに対するLPSの影響を調べるために、in vitro研究で主に使用された。腫瘍性疾患の免疫療法を目的として、末梢血単球から試験管内でDCを調製する標準的なスキームには、炎症性活性化刺激として大腸菌LPSによる処理が含まれていることにも留意すべきである [43,66]。
ヒトMDDCをin vitroで大腸菌LPSで処理した後のDCの代謝プロフィールの変化が研究されている [67]。DCにおけるいくつかの代謝経路の活性化の時間依存性が見出された。最も影響を受けたのは、TCAサイクル、ヌクレオチド、ヌクレオチド糖、ポリアミン経路であり、アルギニン経路はそれほど影響を受けなかった。
実験的研究では、LPSの暴露時間と濃度が、MDDCの活性化に異なる影響を与えることが示された[[68]、[69]、[70]、[71]、[72]]。ある研究では、著者はB7コスティミュレイトリー分子の発現が、LPS濃度や刺激時間の違いによって異なることを発見した[69]。彼らは、刺激時間が早く、抗原濃度が低い場合に、共抑制分子である PD-L1 と PD-L2 の発現を観察した。一方、コスティミュレイトリー分子である CD86 と ICOS-L は、抗原濃度に関係なく、刺激後期(48 時間)に発現した。また、TNF-α、IL-6、IL-10の産生亢進はLPS刺激初期(12時間、24時間)に認められ、PD-L1、PD-L2の発現に影響を与えていると考えられた。対照的に、T細胞の活性化に関連するサイトカインであるIFN-γとIL-2は、CD86とICOS-Lの発現と同様に、評価した最も長い時間(48時間)に最大分泌ピークを示した[69]。したがって、活性化マーカーと抑制マーカーの発現および DC サイトカインの分泌の動態は、in vitro 実験の条件下でのみ制御可能な抗原との接触時間とその濃度に依存する。
Rangsini Mahanondaらの研究では、大腸菌および歯周病菌であるPorphyromonas gingivalisとActinobacillus actinomycetemcomitansから得たLPSのヒト単球由来DCに対する効果が比較された[73]。その結果、3種類すべてのLPSが、MDDC上のHLA-DR、CD40、CD80、CD83の発現を用量依存的にアップレギュレートすることが示された。A. actinomycetemcomitans LPSと大腸菌LPSは、これらの表面分子を同程度のレベルで誘導し、これらのレベルはP. gingivalis LPSで誘導されるレベルよりも一貫して高かった。LPSによるサイトカイン産生に関しては、歯周病菌LPSはいずれもMDDCから低レベルのTNF-αと無視できる量のIL-10を誘導した。対照的に、大腸菌LPSはかなりのレベルのTNF-αと中程度の量のIL-10を誘導した[57]。3種の細菌由来のLPSは、IL-12 p70の産生をほとんど誘導しなかったか、全く誘導しなかった。ナイーブCD4+T細胞の分化を誘導するMDDCの能力を研究したところ、P. gingivalisとA. actinomycetemcomitansから得たLPSは、大腸菌LPSに比べて活性がはるかに低いことが判明した。
Ravi Jotwaniらは、大腸菌LPSをパルスしたヒトMDDCが、高レベルのIL-12 p70、IFN誘導性タンパク質10(IP-10)、TNF-α、IL-6、IL-1β、IL-10からなるTh1-biasingサイトカインを放出することを示した[74]。対照的に、P. gingivalis LPSでMDDCを誘導すると、IL-12 p70やIP-10は認められず、TNF-αとIL-10は低レベルであった。同系ナイーブT細胞反応の調査は一貫していた: 大腸菌LPSパルスMDDCは、P. gingivalis LPSパルスMDDCと共培養したT細胞よりも高いT細胞増殖を誘導し、T細胞はより多くのIFN-γとIL-2を放出したが、IL-5の放出は少なかった。さらに、P. gingivalis LPSパルスMDDCに反応したナイーブCD45RA + CD45RO- CD4+T細胞からはIL-13が分泌された。これらの結果は、歯周病菌P. gingivalisのLPSがヒトMDDCを極性化し、in vitroでTh2エフェクター応答を誘導することを示唆している。
したがって、一連のin vitro研究において、異なるタイプの細菌のLPSで処理したヒトMDDCは、多様なタイプのエフェクターT細胞の形成を誘導し、免疫応答の発達を異なる方向に誘導することが示された。このように、大腸菌LPSはMDDCを刺激してTh1形成を活性化する一方、P. gingivalis LPSはMDDCの別の表現型の形成を促進し、それに続いてTh2形成を活性化した(図2)。
3.3. DCとSCFAの相互作用
よく知られているように、腸内にはヒトの常在細菌叢の約97%が存在し、生物全体に最も大きな影響を及ぼしている [75]。細菌細胞を構成する分子パターンに加えて、細菌はユニークな代謝産物を産生する。これらは細菌代謝の分子パターンと呼ぶことができる。これらの代謝産物の存在とその濃度は、腸内のある種の細菌が活発に活動していることを示す。そのような代謝産物は以下の通りである: SCFA、SBA、トリプトファン代謝産物(インドール)、ビタミン、神経伝達物質、細菌のAIなどである。
酢酸、酪酸、プロピオン酸などのSCFAは、腸(回腸と結腸)で食物繊維を微生物が発酵させた最終産物であり、腸内の総SCFA含有量の95%を占める。異なる種の細菌は、異なる生化学的経路(表2)を用いてSCFAを産生する可能性がある[[76]、[77]、[78]、[79]]。健康な大腸における酢酸、プロピオン酸、酪酸産生のモル比は、それぞれ約60:25:15である [28]。この比率は、発酵部位、食事、微生物叢の構成、病態によっても変化する。これらの化合物は低分子量であるため、血液中に容易に吸収され、門脈を通って肝臓に入り、そこで一部が利用され、残りの一部は循環に入り、酢酸/プロピオン酸/酪酸のモル比は、門脈、肝、末梢由来によってそれぞれ90-55/35-5/10-4となる [80]。したがって、アセテート/プロピオン酸/酪酸エステルは、血液を通して全身に分布し、組織へ到達するため、局所的かつ全身的に活性を発揮する。
表2. SCFAを産生する細菌[[67]、[68]、[69]]。
SCFAの種類 細菌-生産者
酢酸 Prevotella spp.、Bifidobacterium spp.、Bacteroides spp.、Akkermansia muciniphila、Clostridium spp.、Streptococcus spp.、Ruminococcus spp.、Blautia hydrogenotrophica
プロピオン酸 バクテロイデス属、メガスファエラ・エルスデニイ、ベヨネラ属、コプロコッカス・カトゥス、 アッカーマンシア・ムチニフィラ、ファスコラクトバクテリウム・サクシナチューテンス、 ダイアリスター属、ローズベリア・イヌリボランス、ブラウティア・オベウム、 ユウバクテリウム・ハリイ
酪酸 Clostridium属、Coprococcus comes属、C. catus属、C. eutactus属、Faecalibacterium prausnitzii属、 Eubacterium hallii属、E. rectale属、Ruminococcus bromii属、 Anaerostipes属、Roseburia属、Subdoligranulum属、 Anaerobutyricum属。
SCFAは3つの基本的に異なるメカニズムで感受性の高い細胞に作用する。第一に、SCFAは適切な細胞受容体と相互作用し、細胞増殖と分化過程に関与するシグナルカスケードを開始する。第二に、SCFAは細胞膜のチャネルを通して細胞内に直接侵入し、細胞の代謝プロセスに影響を与える。第三に、酪酸塩と、より少ない程度ではあるがプロピオン酸塩は、細胞内に直接浸透する際に、ヒストン脱アセチル化酵素(HDAC)の阻害に関与し、それによって細胞ゲノムの機能に影響を及ぼす [72,76]。
SCFAは、Gタンパク質共役受容体(GPCR)を介してその作用を発揮する。主なGPCRは、マウスとヒトの免疫細胞ともにGPR43(FFAR2)、GPR41(FFAR3)、GPR109A(HCAR2)である[[82]、[83]、[84]]。異なるSCFAは多様な親和性でFFAR受容体と相互作用する(FFAR2 - C2double bondC3 > C4 > C5double bondC1、FFAR3 - C3double bondC4double bondC5 > C2 > C1)[84]。これらの受容体に関与した後、SCFAは特定のシグナル伝達カスケードを誘導する。さらに、SCFAはトランスポーター、例えばMCT1 (SLC16A1)、MCT4 (SLC16A3)、SMCT1 (SLC5A8)、SMCT2 (SLC5A12)の関与により直接細胞に入り [85]、特定の生化学的事象に影響を与える。例えば、酪酸は大腸細胞に入ると、トリカルボン酸サイクルのエネルギー源となる。
さらに、SCFAには免疫調節作用がある [86,87]。SCFAの中でも酪酸は、細胞のエネルギー代謝、免疫機能、腸のホメオスタシスに有益な影響を及ぼすことから、特に注目されている [88]。一般に、プロピオン酸や酪酸のようなSCFAは、好中球、マクロファージ、内皮細胞による刺激誘発性の接着分子発現、ケモカイン産生を減少させる。その結果、炎症部位への単球・マクロファージや好中球の動員を抑制する。酪酸で処理したマクロファージは、M2様治癒促進表現型を裏付けるトランスクリプトームシグネチャーを示した。その上、酪酸塩はLPSを介したマクロファージの異化と貪食を抑制し、in vitroとin vivoで炎症性マクロファージの死を誘導した。これはSCFAの抗炎症作用を示唆している。しかし、条件によってはSCFAの炎症促進作用を支持する証拠もある[90,91]。
SCFAはT細胞の活性に直接影響を与える可能性がある。例えば、SCFAはHDAC阻害を介してTリンパ球のエフェクター制御性T細胞(Treg)への分化を促進する [92]。酪酸とプロピオン酸は、CD8+細胞傷害性Tリンパ球(CTL)とT細胞傷害性17(Tc17)細胞の遺伝子発現に直接影響し、これらの細胞の活性を高める [93]。Arpaia Nらはモデルマウスを用いた実験で、酪酸がin vitroおよびin vivoでTregの分化を誘導することを示した。その結果、酪酸塩の効果は、直接的なものとDCを介するものの両方であると結論づけられた [75]。
SCFAは、APCとして免疫系の反応を形成する能力を持つヒトDCの生理的活性に影響を与える。DCはSCFAに対して異なる受容体を発現している。Caudia Nastasiら(2015)は、一次ヒトCD1c+およびCD141+ DCと同様に、ヒト単球由来DCがGPR41およびGPR109Aを発現し、これらの受容体を介してSCFAに応答する能力を有することを調査した[28]。ヒトMDDCsをLPSに暴露した後、酢酸、プロピオン酸、酪酸で交互に処理したところ、HLA-DRやCD86分子の発現に顕著な変化は見られなかった。一方、LPSによって誘導されたCD83の発現は、正常に成熟したDCと比較して、プロピオン酸塩と酪酸塩の両方への暴露によって有意に減少した。また、プロピオン酸と酪酸の両方が、LPS誘導性のIL12p40とIL-6の産生とそれに対応する遺伝子発現を減少させることも示された。DCにおけるサイトカイン遺伝子の発現を分析した結果、SCFAが及ぼす一般的な効果は、酢酸塩<プロピオン酸塩<酪酸塩のようにランク付けできることが示された。特筆すべきは、酪酸がMDDCに対してより深い効果を示したことである[28]。この研究では、SCFAが炎症性ケモカインの遺伝子発現とタンパク質合成を減少させることも示された。酢酸塩はCCL3の放出を減少させ、酪酸塩はCCL4、CCL5、CXCL9、-10、-11を減少させ、プロピオン酸塩はCCL3、CCL5、CXCL9、-10、-11を減少させた。これらの炎症性ケモカインは、二次リンパ組織内の細胞交通を制御し、抗原認識後のT細胞の発達に影響を及ぼす可能性がある。著者らはまた、SCFAは、炎症性Th1およびTh17表現型を減少させることにより、ナイーブT細胞の極性を形成し、その結果、Tregのような抗炎症性集団へとバランスを変化させる可能性があると仮定した。さらに、酪酸とプロピオン酸の活性は、CD86、HLA-DR、IL-1A、IL-1Bのような他のLPS応答遺伝子は影響を受けないが、TNF-αファミリー遺伝子やCCL2のような主要なLPS応答遺伝子に影響を与えるため、ある程度選択的であることが示された [62]。マウスBM-DCモデルにおいて、これらの細胞を酪酸で処理すると、以前LPSによって誘導されたTnf遺伝子の発現も減少することが見いだされた [85]。
Claudia Nastasiら(2017)[94]は、酪酸とプロピオン酸がヒトMDDCの成熟状態と機能に影響を及ぼすことを示した。LPS刺激MDDCsにおいて、酪酸塩処理後の共刺激分子CD83、CD80、CD40の発現の有意な低下と、プロピオン酸塩処理後のCD83とCD80発現の顕著な低下が検出された。彼らは、酪酸とプロピオン酸がMDDCにおけるIL-12とIL-23の産生を阻害することを見出した。そして、これらのSCFAがT細胞-DC共培養におけるCD8+ CTLの活性化を低下させることが示された。その結果、酪酸とプロピオン酸が、DCによる表面マーカー発現とサイトカイン分泌の阻害を介してCD8+ T細胞の活性化を調節する上で極めて重要な役割を果たしていることが強調された。これらの結果から、SCFAsとしての細菌発酵産物がCD8+ T細胞の機能を調節するという新しいメカニズムが明らかになった。この知見は、抗がん免疫療法戦略に応用できる可能性がある。
Urribe-Herranz Mireiaのグループが得た結果は、DCのAPC機能が酪酸単独で阻害されることを示した。それは、酪酸で処理したBMDCでナイーブマウスのT細胞を培養すると、未処理のコントロールに比べてIFN-γ分泌細胞の量が減少することから示された。興味深いことに、プロピオン酸で処理したDCも、単独で使用した場合には抗原提示の部分的阻害を示したが、酪酸塩単独で誘導された阻害を増強することはなかった。これらのデータは、SCFAがDCの表現型と抗原提示阻害に影響を与えることを裏付けている。酪酸産生菌の除去は一般に、CD11c+DCによる抗原の処理と提示を改善し、IFN-γの効果的な分泌とCD8+エフェクターT細胞の活性をもたらし、放射線療法の有効性に寄与した[95]。得られた結果は、マウスにおける抗腫瘍療法への反応は、微生物と免疫系の相互作用の間の複雑な相互作用によって媒介されることを示唆している。
Eleonora Ciarloら[96]は、マウスの感染プロセスにおけるプロピオン酸の役割を研究した。彼らはin vitro研究で、LPS、Pam3CSK4(TLR1/TLR2を介して細胞を誘発するリポペプチド)、または黄色ブドウ球菌処理に応答して、マウスのBM-DCがプロピオン酸によってTNFとIL-12p40を産生することが有意に阻害されることを示した。その上、プロピオン酸はBM-DCによる大腸菌誘発IL-6とIL-12p40産生をわずかに増加させた[96]。しかしながら、日和見微生物である黄色ブドウ球菌、クレブシエラ・ニューモニエ、カンジダ・アルビカンスによって誘発された内膜血症を用いたマウスのin vivoモデルにおいて、動物をプロピオン酸で前処理(食物中)しても、最終的な結果、つまり誘発された感染による動物の罹患率や死亡率には影響がないことが示されている[96]。
Maria M. M. Kaisarら [97]は、ヒトのDCに対する酪酸の影響の複雑なメカニズムを提唱した。彼らはまた、酪酸塩、そしてより低い程度ではあるが、プロピオン酸塩と酢酸塩が、LPSによって誘導されたコスティミュレイトリーマーカーCD83、CD80、CD40のアップレギュレーションを抑制し、hMDDCsによるIL-10とIL-12の両方の産生を減少させることを確認した。彼らはまた、酪酸が表面受容体GPR109Aに関与し、脱アシチル化阻害のメカニズムを通して、ヒトDCのレチナアルデヒド脱水素酵素1(RALDH1)の発現と活性を誘導することを見出した[97]。この結果、DCによるレチノイン酸の産生が起こり、免疫反応をTreg細胞の発生へと極性化する。彼らはまた、酪酸塩が解糖と酸化的リン酸化(OXPHOS)を低下させることによって、DCの代謝に影響を与えることも発見した [97]。このように、酪酸塩処理は、ヒトDCにおいて寛容原性表現型を誘導した。
Wenbo Xiuら [98]は、SCFAがDCに与える影響の別のメカニズムを示した。彼らは、酪酸がマウスDCによる上皮成長因子(EGF)ファミリーメンバーであるアムファイアグリン(AREG)の産生を誘導することを発見した。最近、AREGはTreg細胞の発達に寄与する新規なサイトカインであることが明らかになった [99]。
免疫寛容機構の発達を促進する酪酸のこの性質、すなわち高Treg含量の促進は、負の結果をもたらす可能性がある。Clélia Coutzacら [100]は、酪酸塩がin vitroで抗CTLA-4 MKATで処理したDCのCD80とCD86分子の発現を減少させることを調べた。さらにin vivo系では、マウスの血清中の酪酸濃度はDC上のCD80とCD86の発現と逆相関していた。マウスの末梢血中の酪酸含量を人為的に増加させると、CTLA-4遮断療法の効果が損なわれた。従って、酪酸塩はDCの成熟を阻害し、腫瘍モデルマウスにおけるCTLA-4遮断の抗腫瘍効果を阻害することが示された[100]。
Kayting Yangら[101]は、in vitroで酪酸ナトリウムで処理したマウスのBM-DCは、遺伝子レベルでもタンパク質レベルでもINF-βの発現が減少することを示した。著者らは、これらの結果をin vivoの状況に外挿し、酪酸菌によって産生された酪酸が全身的に作用し、抗腫瘍免疫の抑制を介して放射線抗腫瘍療法の効果を低下させる可能性を疑った。in vivoモデルにおいて、彼らはビンコマイシンを用いて酪酸産生菌のいくつかの種を根絶し、マウスの循環および腫瘍組織中の酪酸濃度を低下させた。これは電離放射線に対する抗腫瘍反応の増強と関連していた。一方、バンコマイシン感受性菌の一種であるLachnospiraceaeをGFマウスに経口投与すると、全身および腫瘍内の酪酸濃度が上昇し、電離放射線の抗腫瘍効果が低下した。最終的に、彼らは酪酸が様々な癌に対する電離放射線療法の効果を低下させる可能性があると結論づけた[101]。
DCの活性を通して、酪酸は腸内の体液性免疫反応に影響を及ぼす。磯部潤也ら [102]は、酪酸がin vitroでCD103 + CD11b + DCによるTGF-βとオールトランスレチノイン酸の産生を増強することを示した。この効果は、Gタンパク質共役型受容体41(GPR41/FFA3)とGPR109a/HCA2、およびヒストン脱アセチル化酵素活性の阻害によって媒介された。DCによって産生されるサイトカインは、T非依存性IgAの産生に必要である。これは細菌の侵入に対する粘膜の完全性と抵抗性を維持するために重要である。
酪酸産生菌の基質である消化繊維を多く含む食事は、生体の免疫活性の変化と関連している。高繊維(HF)食を与え、腸内の酪酸含量を増加させたマウスでは、腸間膜リンパ節におけるCD103+ DCの増加が認められた。これらの細胞についてin vitroで調べたところ、ナイーブT細胞をFoxP3+ Tregリンパ球に変換する力がより強いことが示された。したがって、HF食はCD103 + DCの含量と寛容化活性を高め、これはレチノイン酸シグナル伝達経路に依存している [103]。別の研究では、in vitroでClostridium butyricum(大腸の酪酸産生者として知られる)の濾過上清で処理したマウスのBM-DCは、炎症性サイトカインIL-1βとIL-6の産生を減少させた。
このように、ある種の腸内細菌叢が産生するSCFAは、全身的にヒトDCの成熟と生理活性に影響を及ぼす。研究された3つのSCFAのうち、酪酸とプロピオン酸は、DCの遺伝子発現プロファイルに直接影響を与え、これらの細胞の寛容原性表現型に寄与する主な免疫調節的役割を発揮する。異なる生理学的状況では、それは多様な結果と結果をもたらす可能性がある。酪酸がDCに対するLPSの炎症促進作用を抑制することは注目に値する。これらのデータは、SCFAがDCを通して免疫反応を形成し、白血球のリクルートと特異的免疫反応の分極化を制御する能力について、新たな展望を開くものである。
3.4. 二次胆汁酸のDCに対する作用
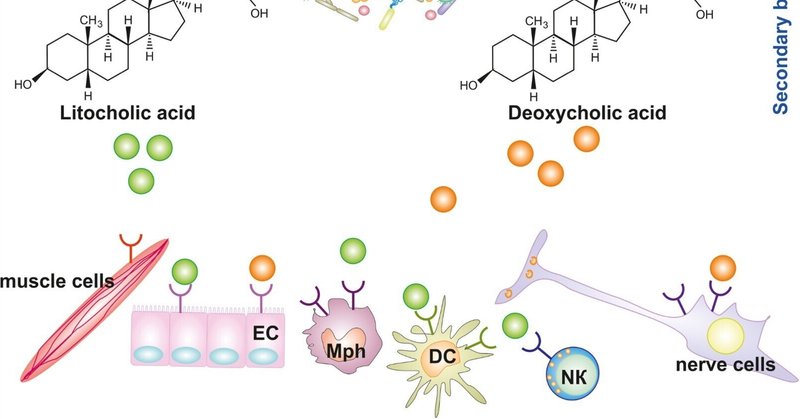
ヒトの体内常在細菌は、胆汁酸のような、大器官内で産生される特定の生物学的に活性な物質の代謝変換に関与している [105]。一次胆汁酸は肝臓でコレステロールから合成され、主にコール酸(CA)とチェノデオキシコール酸(CDCA)に代表される。その後、さらにグリシンやタウリンと結合し、胆管を通って十二指腸に放出される。一次胆汁酸の約95%はリサイクルされる。胆汁酸は回腸の末端部で積極的に再吸収され、門脈を通って肝臓に戻される。しかし、胆汁酸の約5%は常在菌の酵素によって脱共役され、SBAに生体内変換される。回腸の細菌(Clostridium属、Bifidobacterium属、Enterococcus属、Lactobacillus属、Bacteroides属、Methanobrevibacter smithii属、Methanosphera stadmanae属)は、胆汁酸を脱共役する胆汁酸ヒドロラーゼ(Bile Salt Hydrolase、BSH)を産生する。さらに、他の細菌(ClostridiumとEubacterium)の7α-ジヒドロキシル化の過程による酵素は、デオキシコール酸(DCA)、リトコール酸(LCA)、ウルソデオキシコール酸(UDCA)という二次胆汁酸の生成に寄与する[106](図3)。さらに、ヒト腸内細菌の対応する酵素は、二次胆汁酸であるリトコール酸を3-オキソリトコール酸(3-oxoLCA)と豊富な腸内代謝産物であるイソリトコール酸(isoLCA)に変換する[107]。
図3
ダウンロード 高解像度画像ダウンロード(929KB)
ダウンロード フルサイズ画像のダウンロード
図3. 微生物叢による一次胆汁酸から二次胆汁酸への変換、胆汁酸代謝産物、およびそれらがDCに及ぼす影響。EC-上皮細胞、Mph-マクロファージ、NK-ナチュラルキラー細胞。
一次および二次胆汁酸とその代謝産物は、ある種のシグナル伝達機能を果たしているが、現在では完全には解明されていない。胆汁酸はシグナル伝達分子として特定の胆汁酸受容体(BAR)と相互作用する。最も研究されている例は、核内FXR(ファルネソイドX受容体)と細胞膜受容体GPBAR1(Gタンパク質胆汁酸受容体1)である。筋肉細胞、神経細胞、腸内皮、免疫系細胞はこの2つの受容体を発現しています。免疫細胞の中でも単球、マクロファージ、DC、ナチュラルキラー細胞(NK)、NK-T細胞は広くこれらの受容体を発現している [108,109]。一般的に、DC、NK-Tおよびマクロファージ上のBARを介したシグナルが、その性質上抗炎症性であるこのような反応の発現につながることが知られている[[110]、[111]、[112]]。最近、胆汁酸代謝産物に対する他の受容体の特徴が明らかにされた。例えば、LCAの代謝産物であるisoLCAは、核内ホルモン受容体(NhR)RORγtの機能を阻害することにより免疫細胞に作用し[113]、Th17の機能を阻害する[107]。
常在細菌が形成する二次胆汁酸や胆汁酸代謝産物がDCに及ぼす影響に関する研究はまれである。しかし、二次胆汁酸がDCの成熟状態や機能活性に影響を与えることは研究されており、in vitroおよびin vivoで証明されている。In vitroの実験では、ヒトMDDCを二次胆汁酸(LCAとDCA)で処理すると、細胞によるIL-12p40とTNF-αの産生が減少することが示された[72]。しかしながら、この研究の著者らは、この効果は重要ではないとしている。Jianping Huら[29]もまた、LCA、DCA、UDCAがマウスBMDCsによるIL-12/p70、IL-1β、IL-23、IL-6、TNF-αを含むいくつかの炎症性サイトカインの分泌を阻害することを示した。しかし、DCAとLCAはさらに、マウスBM-DCの表面マーカーCD40、CD86、CD80、MHCIIの発現をわずかに阻害した。これらの実験ではLCAが最大の効果を示した。これらの結果から、LCAは武田薬品Gタンパク質共役型受容体5(TGR5)を介したシグナル伝達を介してDCの機能を制御していることが示唆された。LCA食を与えたTGR5+/+マウス(実験的自己免疫性ぶどう膜炎を発症)から単離したCD11c + DCは、Th17細胞とTh1細胞の分化、IL-17とIFN-γの分泌をそれぞれ有意に抑制した[29]。したがって、微生物叢の活動の結果として形成される二次胆汁酸および胆汁酸代謝産物のDCに対する効果は、これらの細胞の抗炎症機能を高めるようなものである。他のin vivo研究では、腸内常在菌が産生する胆汁酸が実験的自己免疫性ぶどう膜炎の重症度を抑制することが示されている。著者らは、この効果がTGR5誘導によるDC活性化抑制を介して媒介されることを証明した [114]。
3.5. 細菌の自己誘導物質とDC
人体の微生物叢を含む自然環境に生息する細菌は、数百万年の進化の過程で生化学的コミュニケーション機構を発達させてきた。これらの機構は、特定の遺伝子の発現を同期させることによって、ある種または異なる種に属する細菌群集の行動を制御している。この細菌の細胞間コミュニケーションの原理は、集団内の細菌数に依存することから、クォーラムセンシング(QS)と名付けられた。QSの下では、様々な生理学的活動、必要な代謝産物や高分子物質の産生、細菌集団のサイズの調節が行われている。QS原理の応用として最も研究されている分野は、細菌のバイオフィルムの形成と感染過程の進展である[116,117]。
細菌の細胞間コミュニケーションの「言語」は、AIと呼ばれる小さなシグナル伝達ホルモン様分子によって実現されている。グラム陰性菌は、アシル化ホモセリンラクトン(AHLまたはHSL)と拡散性シグナル伝達因子(DSF)を自己誘導物質として使用する。グラム陽性菌はAIの自己誘導ペプチド(AIP)として利用される。種間コミュニケーションのために、細菌は主に自己誘導因子2(AI-2)とインドールを使用する [118,119]。人体の細胞も細菌の化学言語を「理解」している。免疫系の細胞を含む様々な組織の細胞は、オートインデューサーとの相互作用に反応し、これが「インターキングダム・シグナリング」という現象である[120,121]。真核細胞に対するAIの作用の分子メカニズムは、現在も研究中である。例えば、AHLは、真核生物の何百もの生物学的機能に関与するエイコサノイドファミリーの脂質ホルモンやステロイドホルモンのような多くの脂質ベースのホルモンと化学的に類似しており、宿主細胞内に侵入し、細胞内受容体に結合し、遺伝子の転写を制御しうることが知られている[122]。
免疫細胞の機能に対する自己誘導物質の直接的な影響に関する研究はかなり限られているが、細菌の自己誘導物質が免疫調節特性を示すことが示されている [120,123]。in vitroとin vivoの実験結果は矛盾している。異なるAIは抗炎症活性と炎症促進活性の両方を示した。例えば、非病原性大腸菌によって産生されたAI-2は、腸上皮細胞によるIL-8分泌を6時間と12時間で有意に増加させ、その後24時間で有意に減少させた。これは、単一のシグナル分子としてのAI-2が、上皮細胞処理後の初期段階で炎症促進活性を持つことを意味する[96]。上皮細胞は自然免疫応答の発達に寄与し、好中球の走化性因子IL-8の初期産生者である[124]。別の研究では、AI-2は宿主による血清アミロイドタンパク質-1(SAA1)とSAA2の産生を促進し、マウスにおけるTh17細胞の産生を増加させた。F. nucleatumによって産生されたAI-2は、炎症反応を誘導し、マクロファージにおける複数のシグナル伝達経路を活性化した [35]。Jiao Wuら[126]は、F. nucleatum AI-2が、おそらくTNFSF9/TRAF1/p-ACT/IL-1βシグナル伝達を介して、マクロファージの移動性とM1偏極を促進することを示した。しかし、いくつかのin vivo実験では、AI-2の抗炎症活性が検出された。マウスの壊死性腸炎モデルにおいて、外因性AI-2は微生物叢の乱れを部分的に逆転させ、炎症を減少させた[127]。注目すべきは、この実験モデルにおいて、自己誘導物質の効果は直接的なものだけでなく、微生物叢の組成の変化によっても媒介されたことである。この研究では、AI-2によるマウスの腸における炎症の軽減は、微生物叢組成の部分的な回復と関連していた[127]。
Yifat Glucksam-Galnoyら[128]は、緑膿菌が産生することで知られる細菌の自己誘導物質N-3-oxo-dodecanoyl-l-homoserine lactone(3-oxo-C12-HSL)が、LPS刺激マウスマクロファージにおけるIL-10の発現増加と正の相関を示す主要な炎症性サイトカインである腫瘍壊死因子α(TNFα)の産生をダウンレギュレートする能力をin vitroで示した。別の研究では、このAIはヒトT細胞の増殖とIL-2の分泌を阻害した[129]。
AIが直接DCに与える影響に関する研究は非常に少ない。いくつかの研究 [30]では、DCに対するAIの影響が示されている。N-オクタノイル-l-ホモセリン-ホモセリンラクトン(C8-HSL)は、主にグラム陰性菌の主要な種間・種内伝達物質として使用され、免疫原性を有することが証明された。in vitroの研究では、C8-HSLはDCのオートファジーとNO-放出を増加させた。微粒子製剤中のこの自己誘導物質はアジュバントの可能性を示し、抗菌・抗ウイルスワクチンの成分として使用することが提案された。
緑膿菌N-(3-oxododecanoyl)-l-homoserine lactone (3-oxo-C12-HSL)と緑膿菌キノロンシグナル(PQS)が産生する2つの自己誘導因子は、IL-10放出を変化させることなく、大腸菌LPS刺激マウスBM-DCによるインターロイキン-12(IL-12)産生を減少させる。さらに、抗原刺激中にPQSと3-oxo-C12-HSLに暴露されたBM-DCは、in vitroでのT細胞増殖誘導能の低下を示した。これらの結果は、緑膿菌の自己誘導物質である3-oxo-C12-HSLとPQSの両方が、刺激されたDCの成熟パターンを炎症性Tヘルパー1型反応から変化させ、適応免疫防御の抗菌活性を低下させる可能性を示唆した。このように、3-oxo-C12-HSLとPQSは、感染プロセスにおいて、細菌の病原性因子を誘導すると同時に、病原体が宿主の免疫応答を回避するのを促進する免疫調節因子として、二重の活性を持っているようであった[130]。
Pisake Boonthamら [131]は、3-oxo-C12-HSLがヒトMDDCsの増殖を阻害し、LPS誘発CD86発現を減少させることを示した。この自己誘導因子はまた、シトクロムc放出とカスパーゼ3活性化経路を通じて、DCのアポトーシスを誘導した。3-oxo-C12-HSLで処理したDCは、リンパ球-樹状細胞混合反応における同種リンパ球のIL-4とIL-10の産生を誘導した。一方、IL-6、TNF-α、IFN-γの産生は減少した。
このように、細菌の自己誘導物質には多くの作用機序があると考えられる。細菌の集団行動を直接制御する以外にも、これらの物質は細菌間のコミュニケーションに重要である可能性がある。また、免疫調節活性も示す。さまざまな自己誘導物質は、免疫系の細胞に直接作用するメカニズムを持っており、炎症促進作用と抗炎症作用の両方を実現することができる。例えば、AI緑膿菌3-oxo-C12-HSLの作用による炎症発症の抑制は、日和見菌による免疫応答回避の一種と考えることができる[130]。
微生物叢の組成と代謝活性の調節によって実現されるAIの間接的効果も考慮する必要がある。その結果、微生物叢と免疫系との相互作用が変化する。炎症性腸疾患を治療する可能性のあるターゲットとして、AI(AI-2およびAHL)を使用することを提案する著者もいる[123,127]。
DCは同時に微生物叢から複雑なシグナルを受け取る。
もちろんヒトの生体内では、in vitroの実験とは対照的に、DCは常在細菌やマクロオーガニズム自身の細胞やサイトカインから多くの異なるシグナルを同時に受け取り、統合している。これを達成するために、DCは様々な細菌物質を認識するための適切な受容体を幅広く持っている。MAMPを認識するために、DCはPRRレセプターを使用し、細菌の代謝産物をSCFAやBAとして認識するために、DCはそれぞれFFARやBARを使用する。
DCに対する細菌物質の複雑な作用は、LPSとPGN、生きた細菌細胞と不活化細菌細胞全体、細菌細胞外小胞、および細菌培養の秘密を組み合わせた実験で示された。同様の研究は、真核細胞と細菌細胞を同時に培養するための特別なインサートシステムを用いれば、in vitroで行うことができる。このような研究では、DC上の異なる細菌物質の組み合わせが、異なる種の細菌が産生するこれらの物質の生化学的性質に依存する特別な方法で、APCの活性を調節できることが示された。
例えば、ヒトMDDCを大腸菌LPSで処理した後、L. rhamnonusのPGNで処理すると、HLA-DR、CD80、CD83マーカーの発現低下が観察された(純粋なPGNで処理した後、MDDC上のこれらのマーカーの発現は変化しなかった)。また、サイトカインTNF-αとIL-10の分泌増加が検出された(純粋なPGNはTNF-αの分泌のみを誘導した)[49]。同時に、細胞壁調製物がDCの機能的および表現型の成熟に及ぼす影響も研究された。精製PGNと比較して、細胞壁の調製はCD80の発現レベルには影響しなかったが、HLA-DR、CD86、CD83の発現を増加させた。細胞壁の調製はまた、炎症性サイトカインTNF-αとIL-8の分泌を刺激した。
ある研究では、皮膚常在細菌の分泌物を用いてヒトDCを活性化し、同種CD4+ T細胞を極性化した [132]。分泌物は、増殖の定常期にある細菌を一晩培養した培地RPMI1640の濾液であった。したがって、要するに、セクレトームとは、ブドウ球菌の外毒素と同様に、増殖の定常期に剥離する細菌の代謝産物や細胞壁の成分の組成物である[48]。S. aureusとS. epidermidisのセクレトームは、DCの表現型と機能に対して相反する方向性を持つことが示された。前者は、DC成熟マーカーであるCD86、CD83、HLA-DRを高発現し、IFN-γを産生するDCの成熟を促進したが、後に、CD86、CD83、HLA-DRを低レベルで発現し、IL-10を分泌するDCの発生を誘導した [132]。黄色ブドウ球菌の分泌物を刺激したMDDCはTh1の分化を誘導し、S. epidermidisの分泌物を刺激したMDDCはTregの分化を誘導した。MoDCをS. epidermidis分泌物とS. aureus分泌物の混合物で様々な比率でパルスし、その後同種CD4+ T細胞と共培養すると、相反する効果が得られたことは重要である。S.アウレウス菌分泌物に対してS.エピデルミディス菌分泌物の添加量を増やすと、T細胞の増殖が有意に低下した。このことは、S. epidermidisのような常在菌が、皮膚黄色ブドウ球菌の炎症作用をDCのレベルで制御する上で重要な役割を果たしている可能性を示唆している。したがって、異なる種の細菌に属する細菌の分泌物質は、DCの機能活性に多様な影響を及ぼし、受け取ったシグナルのバランスが免疫反応全般の「運命」を決定する。
Natalia Diaz-Garridoら[133]は、健康なヒト成人ECOR12の糞便サンプルから分離したプロバイオティクス株Escherichia coli EcNおよび常在性Escherichia coli株から得た細菌エクソソーム(BEV)でヒトMDDCを処理したことを示した。プロバイオティクスEcN株由来のBEVで刺激したDCは、常在菌ECOR12株由来のBEVで刺激したDCよりも高いレベルのTh1ドライバーサイトカインINF-γとIL-12を分泌した。さらに、Treg偏極サイトカインであるTGF-βは、ECOR12のBEVで処理した後に最も高いレベルが検出された。プロバイオティクスEcNのBEVもまた、DCによるTGF-β分泌を誘導した。EcNおよびECOR12のBEVは、Th2およびTh17偏極性サイトカイン(IL-4およびIL-6)とIL-10の分泌を活性化したが、株間で有意差は認められなかった。このように、プロバイオティクスEcN由来のBEVで刺激したDCと通常の常在菌ECOR12由来のBEVで刺激したDCでは、Th1およびTreg極性化サイトカインに有意差が認められた。つまり、常在細菌の菌株は、炎症を誘導することなく、宿主生体内での増殖に高度に適応している可能性があるということである。
生体内の免疫系細胞に対する細菌性物質の複合効果に関する研究は、非常に興味深いものである [134,135]。DCは臓器や組織中に少量しか存在しないため、DCに対するこのような影響を研究するのはかなり問題がある。同様の研究が、肺胞マクロファージを用いて行われた。この研究では、ヒトとマウスの生体試料を用いて、腸内細菌叢が産生するLPSとSCFAが肺組織に存在することが示された。プロピオン酸は、LPSで刺激された肺胞マクロファージの代謝再プログラミングに、用量依存的に影響を与えることが判明した [134]。肺胞マクロファージをLPSで処理すると、解糖が増加した。さらに、このようなLPSで誘導された肺胞マクロファージをプロピオン酸で処理すると、解糖から酸化的リン酸化への代謝の切り替えに影響を与えた。無菌マウスを用いて、肺組織のLPSとプロピオン酸の両方が腸内細菌叢に由来することが示された。これらの細菌物質は微小環境の構成要素であり、肺組織における免疫反応発現の背景を作る。肺胞マクロファージの炎症促進活性は、LPSへの曝露に依存しており、プロピオン酸によって用量依存的に再プログラムされうる [134] 。DCも同様の影響を受けると推測される。別の研究では、著者らはマウスにおいて、常在細菌叢とpDCが定常状態のcDCを「指導」するメカニズムについて研究した [135]。この現象は、pDCが産生したIFN-IシグナルがcDC組織に持続的に作用することで実現した。このメカニズムにどのような細菌物質が関与しているかはまだ不明である。この現象の本質を理解し、この知識をDCに基づく抗腫瘍免疫療法の有効性を高めるために応用するためには、この分野における今後の研究が必要である。
以上をまとめると、一般的に細菌物質は、PGN、LPS、細菌DNAのように細菌の存在を示すものと、細菌の生命活動に関する情報を提供するもの、すなわち細菌の代謝産物であるSCFA、SBA、AIに分けられる。常在細菌から様々なシグナルを受け取った免疫系の細胞は、それらを統合し、特定の免疫応答機構を開始しなければならない。DCは様々な細菌物質を認識するための最も幅広い受容体を持っている。免疫系は、多種多様な常在細菌からの様々な生化学的シグナルを統合することによって、免疫応答を実行しているようである。
そこで我々は、細菌性物質がDCに与える影響について単純化したモデルを提案した。PRRレセプター(シグナル1)の関与は、そのような細菌細胞の存在に関する情報を提供する。LPSやいくつかの細菌種PGNと対応するPRR、TLR4、TLR2との相互作用は、炎症性免疫反応の発現につながる。しかし、ヒトの体内で生きている細菌は、その細菌だけに特徴的な代謝産物を産生する。これらの代謝産物は、Microoganism Metabolism Associated Molecular Patterns(MMAMPs)と呼ばれる。SCFAsやsBAsのようなこれらの細菌代謝産物は、それぞれFFARsやBARsとして対応する受容体によっても認識される。したがって、これらの受容体の活性化(シグナル2)は、細菌が生きており、活発に代謝を行っていることを示している。このような常在細菌の代謝産物であるSCFAsやsBAsが免疫系に及ぼす影響は、ほとんどが抗炎症性である。したがって、細菌壁の成分による炎症促進作用は、常在菌の代謝産物による抗炎症作用によって部分的に補われる。シグナルのバランスが免疫反応の方向を決定する(図4)。
図4
ダウンロード 高解像度画像ダウンロード(381KB)
ダウンロード フルサイズ画像のダウンロード
図4. 微生物シグナルがDCに与える影響に関する単純化したモデルの提案。
したがって、免疫系とそのセンチネル細胞であるDCは、多種多様な受容体とシグナル伝達カスケードにより、一連のシグナルを同時に統合し、抗原反応と組織状況反応に最も適したシグナルを生成する。
結論
あらゆる臓器や組織におけるDCの生理的機能は、局所的な組織微小環境の影響を受ける。今日、この環境の重要な因子の一つが、常在細菌が産生する細菌性物質であることがわかっている。
生きている常在細菌が生体全体のレベルでDCの機能と腫瘍増殖に及ぼす影響については、2015年にScience誌に発表された研究の一つで論じられている。B16黒色腫のC57BLマウスモデルにおいて、腸内細菌叢におけるビフィドバクテリウム属の細菌含量の増加が、腫瘍プロセスのより少ない侵攻性の経過と関連していることが示された[136]。より詳細な研究により、免疫系がより効果的に機能する根拠は、DCの抗腫瘍活性の上昇であることが証明された。腸内のビフィズス菌含量が高いマウスのDCは、MHC IIをより多く発現し、CD8+細胞傷害性Tリンパ球の効果的な提示と活性化に必要な抗原量が少なかった。さらに、腫瘍特異的CD8+ CTLは腫瘍排出リンパ節に多く存在し、IFN-γの産生も顕著に多かった。腸内のビフィズス菌含量が減少したマウスでは、生きたビフィズス菌(加熱不活性化したものは含まない)の経口投与により、抗腫瘍免疫の効果を部分的に高めることができた。同時に、腸から腫瘍の微小環境、脾臓、腸間膜リンパ節への細菌の拡散は検出されなかった。この現象を説明する一つの可能性は、生きた細菌物質、例えば代謝産物がDCに全身的に影響を及ぼすことであろう。他の種の細菌が免疫系に及ぼす間接的な影響も否定できない。結局のところ、ビフィドバクテリウム属の細菌を導入すると、腸内の細菌組成全体が変化し、他の属の細菌、例えばクロストリジウム属の細菌が減少した。この研究では、抗PD-L1免疫療法の効果に対するビフィズス菌のポジティブな効果も証明された[136]。
細菌物質は、細菌細胞と細菌の代謝物の両方の成分になりうる。これらの構造物はすべて、大器官の様々な器官やシステム、とりわけ免疫系に影響を及ぼす。多くの研究結果が示すように、異なるタイプの細菌産物が免疫反応に対して正反対の効果を示すことがある。同時に、PGNやLPSのような細菌細胞壁の成分は、ほとんどが炎症反応を引き起こすが、多くの細菌代謝産物(プロピオン酸塩、酪酸塩、二次胆汁酸)は抗炎症作用を示す[137]。ヒトの生体内では、常在細菌からの化学的シグナルのこのようなバランスが、DCの機能に大きく影響しているようである。数百万年にわたる進化の過程でさまざまな物質が作用した結果、常在細菌はヒトの大器官内で生き残り、免疫系を操作できるように適応した。
細菌物質の精製製剤を使用することで、実験条件を完全にコントロールすることができ、一般用ワクチン製剤の開発にも有用である。生体内では、生化学的環境はより複雑であることは明らかである。異なる種の細菌に属する様々な細菌物質が同時にDCに作用する。したがって、微生物叢の代表に対する免疫反応は非常に曖昧であり、細菌の種類、体内での局在、代謝活性、さらに各個人の免疫系の遺伝的に決定された特徴に依存する。従って、常在細菌が単体または複合体(BEV、分泌物、全細菌細胞)で産生する低分子および高分子物質がDCに及ぼす影響に関する今後の研究は、非常に重要である。細菌が免疫系、特にDCに影響を与えるこれらの自然なメカニズムを研究することで、ヒトの様々な病態に対する免疫調節や免疫療法の現代的なアプローチを開発する方法をよりよく理解することができる。
倫理承認および参加同意
該当なし。
論文発表の同意
該当なし。
資金提供
なし。
引用されていない文献
[81].
CRediT著者貢献声明
ユリア・シュベッツ: 原案執筆、監修、構想。Natalia Khranovska: 検証、調査。Natalia Senchylo:調査。Danylo Ostapchenko:検証。Iryna Tymoshenko:検証。Svitlana Onysenko: バリデーション、調査。Nazarii Kobyliak: 執筆-校閲・編集、監督。テチヤナ・ファラリェーエワ 執筆-校閲・編集、監修。
利益相反宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的関係はないことを宣言する。
謝辞
申告するものはない。
参考文献
[1]
統合ヒトマイクロバイオームプロジェクト
Nature, 569 (2019), 641-648頁, 10.1038/s41586-019-1238-8
Google Scholar
[2]
D.R. Plichta、A.S. Juncker、M. Bertalan、E. Rettedal、L. Gautier、E. Varela、C. Manichanh、C. Fouqueray、F. Levenez、T. Nielsen、J. Doré、A.M.D. Machado、M. C.R. de Evgrafov、T. Hansen、T. Jørgensen、P. Bork、F. Guarner、O. Pedersen、M.O.A. Sommer、S.D. Ehrlich、T. Sicheritz-Pontén、S. Brunak、H.B. Nielsen
転写相互作用が示唆するヒト腸内微生物間のニッチ棲み分け
Nat. Microbiol., 1 (2016), Article 16152, 10.1038/nmicrobiol.2016.152
ScopusGoogle Scholarで見る
[3]
J. ロイド=プライス、A.マフルカー、G.ラーナバード、J.クラブツリー、J.オービス、A.B.ホール、A.ブレイディ、H.H.クリーシー、C.マクラッケン、M.G.ギリオ、D.マクドナルド、E.A.フランゾーザ、R.ナイト、O.ホワイト、C.ハッテンハワー
拡大ヒトマイクロバイオームプロジェクトにおける菌株、機能、動態
Nature, 550 (2017), 61-66頁, 10.1038/nature23889
スコープで見るGoogle Scholar
[4]
D.-Y. Park, J.Y. Park, D. Lee, I. Hwang, H.-S. キム
リーキーガム:全身性疾患の再考された起源
Cells, 11 (7) (2022), p. 1079, 10.3390/cells11071079
スコープで見るGoogle Scholar
[5]
M. カミレリ
リーキーガット:ヒトにおけるメカニズム、測定および臨床的意義
Gut, 68 (8) (2019), 1516-1526頁, 10.1136/gutjnl-2019-318427
スコープで見るGoogle Scholar
[6]
H.S.チェン、S.P.タン、D.M.K.ウォン、W.L.Y.クー、S.H.ウォン、N.S.タン
血液マイクロバイオームと健康:現在のエビデンス、論争、および課題
Int. J. Mol. Sci., 24 (2023), p. 5633, 10.3390/ijms24065633
スコープで見るGoogle Scholar
[7]
J.G.ナタリーニ、S.シン、L.N.シーガル
健康と疾患におけるダイナミックな肺マイクロバイオーム
Nat. Rev. Microbiol., 21 (2023), 222-235頁, 10.1038/s41579-022-00821-x
スコープで見るGoogle Scholar
[8]
L. Costantini、S. Magno、D. Albanese、C. Donati、R. Molinari、A. Filippone、R. Masetti、N. Merendino
多変量16S-rRNA遺伝子領域の解析によるコアニードル生検からのヒト乳房組織微生物叢の特性化
Sci. Rep., 8 (2018), Article 16893, 10.1038/s41598-018-35329-z
スコープで見るGoogle Scholar
[9]
O. コロツキイ、A.ヒュエ、K.ドボルシュチェンコ、N.コビリアク、T.ファラリエワ、L.オスタプチェンコ
プロバイオティクス組成物とコンドロイチン硫酸は、実験的変形性関節症においてTLR-2/4を介したNF-κB炎症経路と軟骨代謝を制御する
Probiotics Antimicrob. Proteins (2021), 10.1007/s12602-020-09735-7
Google Scholar
[10]
J.A.ユネス、E.リーベンス、R.フンメレン、R.ファン・デル・ウェステン、G.リード、M.I.ペトロワ
女性と微生物:予期せぬ友情
Trends Microbiol., 26 (2018), 16-32頁, 10.1016/j.tim.2017.07.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
[11]
W. ヤング、B.C.ハイン、O.A.ウォレス、M.キャラハン、R.ビビローニ
牛の乳腺分泌物への腸内細菌成分の移行
PeerJ (2015), 10.7717/peerj.888
グーグル奨学生
[12]
Z. He、C. Zhao、Y. He、Z. Liu、G. Fan、K. Zhu、Y. Wang、N. Zhang、Y. Fu、X. Hu
腸内病原性ステノトロフォモナス・マルトフィリアは、カルシウム-ROS-AMPK-mTOR-オートファジー経路を活性化することにより、乳腺に移行して乳腺炎を誘発する。
J. Anim. Sci. Biotechnol., 14 (2023), p. 157, 10.1186/s40104-023-00952-y
Google Scholar
[13]
Y.V.シュベッツ、O.O.リホワ、V.F.チェフン
ヒト微生物叢と乳がん
Exp. Oncol., 44 (2022), 95-106頁
スコープで見るGoogle Scholar
[14]
N. Kobyliak、L. Abenavoli、G. Mykhalchyshyn、T. Falalyyeva、O. Tsyryuk、L. Kononenko、D. Kyriienko、I. Komisarenko
プロバイオティクスとスメクタイト吸収性ゲル製剤は、2型糖尿病に伴うNAFLDにおいて肝硬度、トランスアミナーゼ、サイトカイン値を低下させる:無作為化臨床試験
Clin. Diabetol., 8 (2019), 205-214頁, 10.5603/dk.2019.0016
スコープで見るGoogle Scholar
[15]
N. コビリアク、M.ホメンコ、T.ファラリエワ、A.フェドチェンコ、O.サヴチュク、Y.ツェイスライヤー、L.オスタフチェンコ
膵β細胞機能に対するプロバイオティクス:作用機序の可能性から有効性の評価まで
Crit. Rev. Microbiol. (2023), 10.1080/1040841X.2023.2257776
Google Scholar
[16]
O. コロツキイ、A.ヴォフク、T.ガレノワ、T.ヴォフク、K.ドヴォルシェンコ、F.ルッツァ、L.アベナヴォリ、N.コビリアク、T.ファラリエワ、L.オスタプチェンコ
ラットにおけるモノヨード酢酸誘導性変形性関節症の血清サイトカインおよびマトリックスメタロプロテアーゼプロファイルに対するプロバイオティクスの効果
Minerva Biotecnol., 31 (2019), 68-73頁, 10.23736/S1120-4826.19.02548-5
ScopusGoogle Scholarで見る
[17]
A. ヴァールストレム、S.I.サイン、H.-U. Marschall, F. Bäckhed
胆汁酸と微生物叢の腸内クロストークと宿主代謝への影響
Cell Metabol., 24 (2016), 41-50頁, 10.1016/j.cmet.2016.05.005
PDFを見る記事を見るScopusで見るGoogle Scholar
[18]
G.クラーク、R.M.スティリング、P.J.ケネディ、C.スタントン、J.F.クライアン、T.G.ディナン
ミニレビュー:腸内細菌叢:無視された内分泌器官
Mol. Endocrinol., 28 (2014), 1221-1238頁, 10.1210/me.2014-1108
スコープで見るGoogle Scholar
[19]
M. アル・アスマフ、F・ザジャリ
微生物関連研究における無菌動物モデルの使用
J. Microbiol. Biotechnol., 25 (2015), 1583-1588頁, 10.4014/jmb.1501.01039
ScopusGoogle Scholarで見る
[20]
E.A.ケネディ、K.Y.キング、M.T.ボールドリッジ
マウス微生物叢モデル:腸内細菌を改変するツールとしての無菌マウスと抗生物質治療の比較
Front. Physiol., 9 (2018), 10.3389/fphys.2018.01534
Google Scholar
[21]
J. シュエ、K.M.アジュウォン、R.ファン
腸内細菌叢と宿主免疫および炎症との相互作用に関するメカニズム的洞察
Animal Nutr., 6 (2020), pp.421-428, 10.1016/j.aninu.2020.05.007
PDFを見る記事を見るScopusで見るGoogle Scholar
[22]
NIHヒトマイクロバイオームプロジェクトが体内の正常な細菌構成を定義 (2012)
https://www.nih.gov/news-events/news-releases/nih-human-microbiome-project-defines-normal-bacterial-makeup-body
Google Scholar
[23]
A. バートレット、D.パッドフィールド、L.リア、R.ベンダル、M.ヴォス
ヒトに感染する細菌病原体の包括的リスト
微生物学, 168 (2022), 10.1099/mic.0.001269
Google Scholar
[24]
S.P. Wiertsema、J. van Bergenhenegouwen、J. Garssen、L.M.J. Knippels
生涯を通じた感染症の文脈における腸内細菌叢と免疫系の相互作用、および治療戦略の最適化における栄養の役割
栄養素, 13 (2021), p. 886, 10.3390/nu13030886
Google Scholar
[25]
D.J.リン、S.C.ベンソン、M.A.リン、B.プレンドラン
微生物叢によるワクチン接種に対する免疫応答の調節:その意味と潜在的メカニズム
Nat. Rev. Immunol., 22 (2022), 33-46頁, 10.1038/s41577-021-00554-7
スコープで見るGoogle Scholar
[26]
C.A.ニコレット、D.ヒーリー、I.チェレパノヴァ、P.ウィルトン、T.モネスミス、L.クームス、L.H.フィンケ、T.ホワイトサイド、F.ミエソヴィッチ
能動免疫療法のための樹状細胞:商業的・臨床的に実行可能な製品を開発するためのデザインと製造の最適化
Vaccine, 25S (2007), pp.B47-B60, 10.1016/j.vaccine.2007.06.006
PDFで記事を見るScopusで記事を見るGoogle Scholar
[27]
A.E. Gauthier、R.D. Rotjan、J.C. Kagan
自然免疫系によるリポ多糖検出は、自然界では珍しい防御戦略かもしれない
Open Biol., 12 (2022), 10.1098/rsob.220146
Google Scholar
[28]
C. Nastasi, M. Candela, C.M. Bonefeld, C. Geisler, M. Hansen, T. Krejsgaard, E. Biagi, M.H. Andersen, P. Brigidi, N. Ødum, T. Litman, A. Woetmann
ヒト単球由来樹状細胞に対する短鎖脂肪酸の効果
Sci. Rep., 5 (2015), Article 16148, 10.1038/srep16148
スコープで見るGoogle Scholar
[29]
J. Hu, Y. Zhang, S. Yi, C. Wang, X. Huang, S. Pan, J. Yang, G. Yuan, S. Tan, H. Li
リトコール酸はTGR5シグナルを介して細胞内グルタチオンを減少させることにより樹状細胞の活性化を阻害する。
Int. J. Biol. Sci., 18 (2022), 4545-4559頁, 10.7150/ijbs.71287
スコープで見るGoogle Scholar
[30]
S.M.シャー、D.ジョシ、C.チビブ、M.A.ロニ、M.N.ウディン
ワクチン製剤における潜在的アジュバントとしての自己誘導物質N-オクタノイル-L-ホモセリンラクトン(C8-HSL)
医薬品, 16 (2023), p. 713, 10.3390/ph16050713
スコープで見るGoogle Scholar
[31]
M. メラド、F. ジンホウ、M. コラン
ランゲルハンス細胞およびランゲリンを発現する樹状細胞の起源、恒常性、および機能
Nat. Rev. Immunol., 8 (2008), 935-947頁, 10.1038/nri2455
スコープで見るGoogle Scholar
[32]
D.A.ローリー、F.W.フィッチ
樹状細胞発見への道、ラルフ・スタインマンへのオマージュ
Cell. Immunol., 273 (2012), 95-98頁, 10.1016/j.cellimm.2012.01.002
PDFを見る記事を見るScopusで見るGoogle Scholar
[33]
S. バラン、M. サクセナ、N. バルドワジ
樹状細胞サブセットと場所
(2019), pp.1-68, 10.1016/bs.ircmb.2019.07.004
PDFを見る記事を見るScopusで見るGoogle Scholar
[34]
C. マクリ、E.S.パン、T.パットン、M.オキーフ
樹状細胞サブセット
Semin. Cell Dev. Biol., 84 (2018), pp.11-21, 10.1016/j.semcdb.2017.12.009
年12月12日(年) 10:1016/j.
[35]
J.
Fusobacterium nucleatum autinducer-2処理マクロファージにおけるTMTプロテオミクス解析により同定された免疫誘導
Expet Rev. Proteonomics, 17 (2020), 175-185頁, 10.1080/14789450.2020.1738223
Googleスカラー
[36]
抗原提示細胞とT細胞間のクロストークは腸の恒常性、細菌感染、腫瘍形成に影響する
Front. Immunol., 10 (2019), 10.3389/fimmu.2019.00360
グーグル スカラー
[37]
S.C.アイゼンバース
ーT細胞プログラミングにおけるー樹状細胞サブセット:ー位置がー機能ー
Nat. Rev. Immunol., 19 (2019), 89-103頁, 10.1038/s41577-018-0088-1
フグーグルスカラー
[38]
J. 劉, 張, 鄭, 曹
樹状細胞遊走による
Cell. Mol. Immunol., 18 (2021), 2461-2471頁, 10.1038/s41423-021-00726-4
ーScopusGoogle Scholarで
[39]
P.J. Tacken、I.J.M. de Vries、R. Torensma、C.G. Figdor
樹状細胞免疫療法:生体外負荷から生体内標的へ
Nat. Rev. Immunol., 7 (2007), 790-802頁, 10.1038/nri2173
ーGoogle Scholar
[40]
J.D.M. Campbell、C. Piechaczek、G. Winkels、E. Schwamborn、D. Micheli、S. Hennemann、J. Schmitz
CliniMACSシステムを用いた臨床グレード樹状細胞の単離と作製
B. Ludewig, M.W. Hoffmann (Eds.), Adoptive Immunotherapy: Methods and Protocols, Methods in Molecular Medicine, 109巻, Humana Press Inc.
スコープで見るGoogle Scholar
[41]
F. Sallusto, A. Lanzavecchia
培養ヒト樹状細胞による可溶性抗原の効率的な提示は、顆粒球/マクロファージコロニー刺激因子+インターロイキン4によって維持され、腫瘍壊死因子αによって抑制される。
J. Exp. Med., 179 (1994), pp. 1109-1118, 10.1084/jem.179.4.1109
スコープで見るGoogle Scholar
[42]
M.B. Lutz、N. Kukutsch、A.L. Ogilvie、S. Rößner、F. Koch、N. Romani、G. Schuler
マウス骨髄から高純度の樹状細胞を大量に作製するための高度な培養法
J. Immunol. Methods, 223 (1999), 77-92頁, 10.1016/S0022-1759(98)00204-X
PDFを見る記事を見るScopusで見るGoogle Scholar
[43]
A.P.カリンスキー、E.ヴィエコフスキー、R.ムスワミ、E.ジョング
第7章 安定なTh1/CTL-、Th2-、Th17誘導ヒト樹状細胞の作製、樹状細胞プロトコル
Springer protocols, Second edition, Humana press (2010), 117-139頁, 10.1007/978-1-60761-421-07
スコープで見るGoogle Scholar
[44]
M. コリン、V.ビグリー
ヒト樹状細胞サブセット:最新情報
Immunology, 154 (2018), pp.3-20, 10.1111/imm.12888
スコープで見るGoogle Scholar
[45]
C.A.ジェインウェイ
漸近線に近づいている?免疫学における進化と革命
Cold Spring Harbor Symp. Quant. 生物学, 54 (1989), pp.1-13, 10.1101/SQB.1989.054.01.003
スコープで見るGoogle Scholar
[46]
H. クマール、河合俊雄、晶正博
自然免疫系による病原体認識
Int. Rev. Immunol., 30 (2011), pp. 16-34, 10.3109/08830185.2010.529976
スコープで見るGoogle Scholar
[47]
M. パゾス、K. ピータース
ペプチドグリカン (2019), 127-168頁, 10.1007/978-3-030-18768-2_5
ScopusGoogle Scholarで見る
[48]
P.P. Balraadjsing、L.D. Lund、Y. Souwer、S.A.J. Zaat、H. Frøkiær、E.C. de Jong
黄色ブドウ球菌に対する抗菌性適応免疫応答の性質は、増殖期と細胞外ペプチドグリカンに依存する
Infect. Immun., 88 (2019), 10.1128/IAI.00733-19
グーグル スカラー
[49]
S. ターナー、B.レイズリー、K.ローチ、S.バハニャ、M.E.マンロー、J.A.ジェームズ、K.M.コゲス、S.コバッツ
グラム陽性菌細胞壁ペプチドグリカンポリマーはヒト樹状細胞を活性化し、IL-23とIL-1βを産生させ、TH17細胞の分化を促進する。
微生物, 11 (2023), p. 173, 10.3390/microorganisms11010173
スコープで見るGoogle Scholar
[50]
A. Patidar, S. Selvaraj, P. Chauhan, C.A. Guzman, T. Ebensen, A. Sarkar, D. Chattopadhyay, B. Saha
ペプチドグリカンで処理した腫瘍抗原パルス樹状細胞は、腫瘍の再チャレンジに対して完全な抵抗性を付与する。
Clin. Exp. Immunol., 201 (2020), 279-288頁, 10.1111/cei.13468
スコープで見るGoogle Scholar
[51]
M.L.メイヤー、C.M.フィリップス、R.A.タウンゼント、S.A.ハルペリン、S.F.リー
グラム陽性ワクチンベクターStreptococcus gordoniiから単離されたToll様受容体アゴニストによる樹状細胞の分化活性化
Scand. J. Immunol., 69 (2009), pp.351-356, 10.1111/j.1365-3083.2009.02232.x
スコープで見るGoogle Scholar
[52]
S. サルバ、I. ティスコルニア、F. グティエレス、S. アルバレス、M. ボラーティ-フォゴリン
乳酸菌ラムノサス・ポストバイオティクスによる免疫調節は、生菌の使用に代わるより安全な方法である。
サイトカイン, 146 (2021), Article 155631, 10.1016/j.cyto.2021.155631
PDFで記事を見るScopusで記事を見るGoogle Scholar
[53]
H. Qi, T.L. Denning, L. Soong
微生物Toll様受容体活性化因子による樹状細胞でのインターロイキン10とインターロイキン12の分化誘導とT細胞サイトカインプロファイルの歪み
Infect. Immun., 71 (2003), 3337-3342頁, 10.1128/IAI.71.6.3337-3342.2003
スコープで見るGoogle Scholar
[54]
K.S.ミケルセン、A.アイヒャー、M.モハウプト、T.ハートゥング、S.ディメラー、C.J.キルシュニング、R.R.シューマン
細菌によるマウス樹状細胞(DC)の成熟におけるToll様受容体(TLR)の役割
J. Biol. Chem., 276 (2001), 25680-25686頁, 10.1074/jbc.M011615200
PDFで記事を見るScopusで記事を見るGoogle Scholar
[55]
K. 松井一郎、東福寺秀樹、池田亮太
黄色ブドウ球菌細胞壁成分で刺激したマウスランゲルハンス細胞によるCCL17産生
生物学 Pharmaceut. Bull., 38 (2015), 317-320頁, 10.1248/bpb.b14-00614
スコープで見るGoogle Scholar
[56]
R. Gramlich, E. Aliahmadi, M. Peiser
細菌アゴニストによるヒト単球由来ランゲルハンス細胞様細胞の相乗的活性化によるTヘルパー17細胞のin vitro誘導
Int. J. Mol. Sci., 20 (2019), p. 1367, 10.3390/ijms20061367
スコープで見るGoogle Scholar
[57]
L.D. Lund, H. Ingmer, H. Frøkiær
指数関数的増殖期における黄色ブドウ球菌のテイコ酸のD-アラニル化とポリ-N-アセチルグルコサミンの消失は、マウス樹状細胞におけるIL-12産生を促進する
PLoS One, 11 (2016), Article e0149092, 10.1371/journal.pone.0149092
Google Scholar
[58]
Z.J.レスコ、C.M.アンダーソン、M.J.フェデル、F.アロンゾ
ブドウ球菌のグルコサミニダーゼは、ペプチドグリカン鎖を生理的な長さに加工することで炎症反応を促進する。
Infect. 免疫学, 91 (2023), 10.1128/iai.00500-22
Google Scholar
[59]
M. Sanchez, S.L. Kolar, S. Müller, C.N. Reyes, A.J. Wolf, C. Ogawa, R. Singhania, D.D. De Carvalho, M. Arditi, D.M. Underhill, G.A. Martins, G.Y. Liu
ペプチドグリカンのO-アセチル化はヘルパーT細胞のプライミングを制限し、黄色ブドウ球菌の再感染を許容する
Cell Host Microbe, 22 (2017), pp.543-551.e4, 10.1016/j.chom.2017.08.008
PDFを見る記事を見るScopusで見るGoogle Scholar
[60]
N. 門脇、S. Ho、S. Antonenko、R. de Waal Malefyt、R.A. Kastelein、F. Bazan、Y.-J. Liu
ヒト樹状細胞前駆体のサブセットは、異なるToll様受容体を発現し、異なる微生物抗原に応答する。
J. Exp. Med., 194 (2001), pp.863-870, 10.1084/jem.194.6.863
Google Scholar
[61]
P. Sperandeo, A.M. Martorana, A. Polissi
リポ多糖の生合成とグラム陰性菌外膜への輸送
(2019), pp.9-37, 10.1007/978-3-030-18768-2_2
ScopusGoogle Scholarで見る
[62]
J.C.ケーガン
生命界におけるリポ多糖の検出
Trends Immunol., 38 (2017), pp.696-704, 10.1016/j.it.2017.05.001
PDFを見る記事を見るScopusで見るGoogle Scholar
[63]
C.R.H.レーツ、C.M.レイノルズ、M.S.トレント、R.E.ビショップ
グラム陰性菌における脂質A修飾系
Annu. Rev. Biochem., 76 (2007), pp. 295-329, 10.1146/annurev.biochem.76.010307.145803
スコープで見るGoogle Scholar
[64]
C.R.H. Raetz, C. Whitfield
リポ多糖エンドトキシン
Annu. Rev. Biochem., 71 (2002), pp. 635-700, 10.1146/annurev.biochem.71.110601.135414
スコープで見るGoogle Scholar
[65]
B.S. Park, J.-O. リー
TLR4複合体によるリポ多糖パターンの認識
Exp. Mol. Med., 45 (2013), p. e66, 10.1038/emm.2013.97
スコープで見るGoogle Scholar
[66]
T.Q. Chometon、M. da S. Siqueira、J.C. Sant´anna、M.R. Almeida、M. Gandini、A.C. Martins de Almeida Nogueira、P.R.Z. Antas
単球の迅速分離と特異的ヒト単球由来樹状細胞の作製プロトコール
PLoS One, 15 (2020), Article e0231132, 10.1371/journal.pone.0231132
スコープで見るGoogle Scholar
[67]
J. Michieletto, A. Delvaux, E. Chu-Van, C. Junot, F. Fenaille, F.A. Castelli
リポ多糖活性化に伴う樹状細胞の代謝再配線を研究するためのアンターゲットメタボロミクス戦略の開発
Metabolites, 13 (2023), p. 311, 10.3390/metabo13030311
スコープで見るGoogle Scholar
[68]
A. ランゲンカンプ、M.メッシ、A.ランザベッキア、F.サルスト
樹状細胞活性化の動態:TH1、TH2および非極性T細胞のプライミングへの影響
Nat. 免疫学, 1 (2000), 311-316頁, 10.1038/79758
スコープで見るGoogle Scholar
[69]
H. ベラスケス-ソト、F.レアル-サンミゲル、S.M.ペレス-タピア、M.C.ヒメネス-マルティネス
LPS暴露中のヒト樹状細胞におけるB7コスティミュレイトリー分子とIRF4発現の速度論的変化
バイオモレキュールズ, 12 (2022), p. 955, 10.3390/biom12070955
スコープで見るGoogle Scholar
[70]
N.-S. キム、T. トレズ、W. ラングリッジ
LPSはヒト樹状細胞におけるIDO1およびIL-10合成のCTB-INSULIN誘導を増強する
Cell. Immunol., 338 (2019), pp.32-42, 10.1016/j.cellimm.2019.03.003
PDFを見る記事を見るScopusで見るGoogle Scholar
[71]
A. カサソラ・ラマッキア、M.S.リトルト、R.J.スワード、N.アヒイ・アメンダ、A.チャルラ、T.P.ヒックリング、H.ノイベルト
樹状細胞株および単球由来樹状細胞における標的質量分析法によるヒト白血球抗原クラスIIの定量化
Sci. Rep., 11 (2021), p. 1028, 10.1038/s41598-020-77024-y
スコープで見るGoogle Scholar
[72]
B. van der Lugt, M.C.P. Vos, M. Grootte Bromhaar, N. Ijssennagger, F. Vrieling, J. Meijerink, W.T. Steegenga
炎症性in vitroヒト腸管モデルにおける硫酸化二次胆汁酸の腸管バリア機能と免疫反応への影響
Heliyon, 8 (2022), Article e08883, 10.1016/j.heliyon.2022.e08883
PDFを見る記事を見るScopusで見るGoogle Scholar
[73]
R. マハノンダ、P.ポティラクサノン、N.サードイアム、山崎和彦、R.E.シファーレ、C.ヒルンペットチャラット、K.ヨンバニチット、S.ピチャンクル
Porphyromonas gingivalis LPSおよびActinobacillus actinomycetemcomitans LPSのヒト樹状細胞に対するin vitroおよびin vivoモデルマウスでの影響
Asian Pac. アレルギー免疫学, 24 (2006), pp.
スコープで見るGoogle Scholar
[74]
R. Jotwani, B. Pulendran, S. Agrawal, C.W. Cutler
ヒト樹状細胞は、in vitroでTh2エフェクター応答を促進することにより、Porphyromonas gingivalis LPSに応答する。
Eur. J. Immunol., 33 (2003), 2980-2986頁, 10.1002/eji.200324392
スコープで見るGoogle Scholar
[75]
N. Arpaia, C. Campbell, X. Fan, S. Dikiy, J. van der Veeken, P. DeRoos, H. Liu, J.R. Cross, K. Pfeffer, P.J. Coffer, A.Y. Rudensky
常在細菌が産生する代謝産物は末梢制御性T細胞の生成を促進する
Nature, 504 (2013), 451-455頁, 10.1038/nature12726
スコープで見るGoogle Scholar
[76]
E.E. Blaak、E.E. Canfora、S. Theis、G. Frost、A.K. Groen、G. Mithieux、A. Nauta、K. Scott、B. Stahl、J. van Harsselaar、R. van Tol、E.E. Vaughan、K. Verbeke
ヒトの腸と代謝の健康における短鎖脂肪酸
ベネフィット Microbes, 11 (2020), pp.411-455, 10.3920/BM2020.0057
スコープで見るGoogle Scholar
[77]
V. シン、G. リー、H. ソン、H. コー、E.S. キム、T. Unno、J.-H. シン
腸の歩哨」である酪酸産生菌:酪酸産生菌の腸内における意義と、酪酸産生菌以外の微生物治療薬としての将来性
Front. Microbiol., 13 (2023), 10.3389/fmicb.2022.1103836
Google Scholar
[78]
W. Ratajczak、A. Rył、A. Mizerski、K. Walczakiewicz、O. Sipak、M. Laszczyńska
腸内細菌由来の短鎖脂肪酸(SCFAs)の免疫調節ポテンシャル
Acta Biochim. Pol. (2019), 10.18388/abp.2018_2648
グーグル スカラー
[79]
N. コビリアク、T.ファラリエーエワ、Y.キリアチェンコ、Y.ツェイスライヤー、O.コバルチュク、O.ハディリア、M.エスラミ、B.ユセフィ、L.アベナボリ、S.ファゴニー、R.ペリカーノ
代謝異常の治療における新たな強力な細菌プレーヤーとしてのAkkermansia muciniphila
Minerva Endocrinol. (2022), 10.23736/S2724-6507.22.03752-6
Google Scholar
[80]
J.H.カミングス、E.W.ポマーレ、W.J.ブランチ、C.P.ネイラー、G.T.マクファーレン
ヒト大腸、門脈、肝および静脈血中の短鎖脂肪酸
Gut, 28 (1987), 1221-1227頁, 10.1136/gut.28.10.1221
スコープで見るGoogle Scholar
[81]
M. Waldecker, T. Kautenburger, H. Daumann, C. Busch, D. Schrenk
大腸内で生成する短鎖脂肪酸およびいくつかのポリフェノール代謝産物によるヒストン脱アセチル化酵素活性の阻害
J. Nutr. Biochem., 19 (2008), pp.587-593, 10.1016/j.jnutbio.2007.08.002
PDFを見る記事を見るScopusで見るGoogle Scholar
[82]
E. Le Poul, C. Loison, S. Struyf, J.Y. Springael, V. Lannoy, M.E. Decobecq, S. Brezillon, V. Dupriez, G. Vassart, J. Van Damme, M. Parmentier, M. Detheux
短鎖脂肪酸に対するヒトレセプターの機能的特徴と多形核細胞活性化におけるその役割
J. Biol. Chem., 278 (2003), 25481-25489頁, 10.1074/jbc.M301403200
PDFを見る記事を見るScopusで見るGoogle Scholar
[83]
D. ワンダース、E.C.グラフ、R.L.ジャッド
GPR109AとGPR81遺伝子の発現に対する高脂肪食の影響
Biochem. Biophys. Res. Commun., 425 (2012), 278-283頁, 10.1016/j.bbrc.2012.07.082
PDFを見る記事を見るScopusで見るGoogle Scholar
[84]
J. He, P. Zhang, L. Shen, L. Niu, Y. Tan, L. Chen, Y. Zhao, L. Bai, X. Hao, X. Li, S. Zhang, L. Zhu
短鎖脂肪酸と炎症、グルコースおよび脂質代謝におけるシグナル伝達経路との関連性
Int. J. Mol. Sci., 21 (2020), pp.1-16, 10.3390/ijms21176356
Google Scholar
[85]
S. シヴァプラカサム、Y.D.ブティア、S.ヤン、V.ガナパシー
短鎖脂肪酸トランスポーター:大腸ホメオスタシスにおける役割
Comprehensive Physiology, Wiley (2017), pp.299-314, 10.1002/cphy.c170014
Google Scholar
[86]
P. ゴンサルベス、J.R.アラウージョ、J.P.ディ・サント
微生物叢由来の短鎖脂肪酸と宿主粘膜免疫系との間のクロストークは、腸のホメオスタシスと炎症性腸疾患を制御する
Inflamm. Bowel Dis., 24 (2018), 558-572頁, 10.1093/ibd/izx029
ScopusGoogle Scholarで見る
[87]
Y. バフマン、M.マリアム、B.アイサ、T.ファラリエワ、N.コビリアク、E.マジド
肥満と代謝異常におけるFaecalibacterium prausnitziiの免疫調節的役割
Minerva Biotechnol. Biomol. Res., 33 (2021), 76-85頁, 10.23736/S2724-542X.21.02759-2
スコープで見るGoogle Scholar
[88]
H. リュー、ワン、ヘー、ベッカー、チャン、リー、マX.
酪酸:健康のための諸刃の剣?
Adv. Nutr., 9 (2018), 21-29頁, 10.1093/advances/nmx009
PDFで記事を見るScopusで記事を見るGoogle Scholar
[89]
A. サルカール、P.ミトラ、A.ラヒリ、T.ダス、J.サルカール、S.ポール、P.チャクラバルティ
酪酸はNASHにおける炎症性マクロファージニッチを制限する
Cell Death Dis., 14 (2023), p. 332, 10.1038/s41419-023-05853-6
スコープで見るGoogle Scholar
[90]
M.A.R.ヴィノロ、H.G.ロドリゲス、R.T.ナッハバー、R.キュリ
短鎖脂肪酸による炎症の制御
栄養素, 3 (2011), pp.858-876, 10.3390/nu3100858
スコープで見るGoogle Scholar
[91]
S.J. Miller、G.P. Zaloga、A.M. Hoggatt、C. Labarrere、W.P. Faulk
短鎖脂肪酸は血管内皮細胞接着分子の遺伝子発現を調節する
栄養学, 21 (2005), 740-748頁, 10.1016/j.nut.2004.11.011
PDFを見る記事を見るScopusで見るGoogle Scholar
[92]
J. Park, M. Kim, S.G. Kang, A.H. Jannasch, B. Cooper, J. Patterson, C.H. Kim
短鎖脂肪酸は、ヒストン脱アセチル化酵素の抑制とmTOR-S6K経路の制御により、エフェクターT細胞と制御性T細胞の両方を誘導する。
粘膜免疫学, 8 (2015), 80-93頁, 10.1038/mi.2014.44
PDFで記事を見るScopusで記事を見るGoogle Scholar
[93]
M. Luu, K. Weigand, F. Wedi, C. Breidenbend, H. Leister, S. Pautz, T. Adhikary, A. Visekruna
腸内細菌叢由来の代謝産物である酪酸によるCD8+T細胞のエフェクター機能の制御
Sci. Rep., 8 (2018), Article 14430, 10.1038/s41598-018-32860-x
スコープで見るGoogle Scholar
[94]
C. Nastasi, S. Fredholm, A. Willerslev-Olsen, M. Hansen, C.M. Bonefeld, C. Geisler, M.H. Andersen, N. Ødum, A. Woetmann
酪酸およびプロピオン酸は、抗原提示細胞によるIL-12産生を抑制することにより、抗原特異的CD8+ T細胞の活性化を阻害する。
Sci. Rep., 7 (2017), Article 14516, 10.1038/s41598-017-15099-w
スコープで見るGoogle Scholar
[95]
M. ウリベ=ヘランズ、S.ラフェイル、S.ベギ、L.ギル=デ=ゴメス、I.ヴェルギナディス、K.ビッティンガー、S.プスティルニコフ、S.ピエリーニ、R.ペラレス=リナレス、I.A.ブレア、C.A.メサロス、N.W.スナイダー、F.ブッシュマン、C.コウメニス、A.ファッチャベーネ
腸内細菌叢は樹状細胞の抗原提示と放射線治療による抗腫瘍免疫応答を調節する
J. Clin. Invest., 130 (2019), 466-479頁, 10.1172/JCI124332
グーグル スカラー
[96]
E. Ciarlo、T. Heinonen、J. Herderschee、C. Fenwick、M. Mombelli、D. Le Roy、T. Roger
微生物由来の短鎖脂肪酸プロピオン酸がin vivoにおける細菌および真菌感染に対する宿主感受性に及ぼす影響
Sci. Rep., 6 (2016), Article 37944, 10.1038/srep37944
スコープで見るGoogle Scholar
[97]
M.M.M.カイザー、L.R.ペルグロム、A.J.ファン・デル・ハム、M.ヤズダンバフシュ、B.エバーツ
酪酸は、ヒストン脱アセチル化酵素阻害とGタンパク質共役型受容体109Aシグナル伝達の両方を介して、1型制御性T細胞をプライムするようにヒト樹状細胞を調整する。
Front. Immunol., 8 (2017), 10.3389/fimmu.2017.01429
Google Scholar
[98]
W. シュウ、Q. チェン、Z. ワン、J. ワン、Z. シュウ
樹状細胞による微生物叢由来短鎖脂肪酸のアンフィレグリン発現促進はGPR43とBlimp-1によって制御される
Biochem. Biophys. Res. Commun., 533 (2020), pp. 282-288, 10.1016/j.bbrc.2020.09.027
PDFを見る記事を見るScopusで見るGoogle Scholar
[99]
S. Wang, Y. Zhang, Y. Wang, P. Ye, J. Li, H. Li, Q. Ding, J. Xia
アンフィレグリンは、EGFR/GSK-3β/Foxp3軸を介して制御性T細胞抑制機能と腫瘍浸潤をもたらす。
J. Biol. Chem., 291 (2016), 21085-21095頁, 10.1074/jbc.M116.717892
PDFで記事を見るScopusで記事を見るGoogle Scholar
[100]
C. C. Coutzac, J.-M. Jouniaux、A. Paci、J. Schmidt、D. Mallardo、A. Seck、V. Asvatourian、L. Cassard、P. Saulnier、L. Lacroix、P. L. Woerther, A. Vozy, M. Naigeon, L. Nebot-Bral, M. Desbois, E. Simeone, C. Mateus, L. Boselli, J. Grivel, E. Soularue, P. Lepage, F. Carbonnel, P.A. Ascierto, C. Robert, N. Chaput
短鎖脂肪酸の全身投与は、がん患者におけるCTLA-4遮断の抗腫瘍効果を制限する
Nat. Commun., 11 (2020), p. 2168, 10.1038/s41467-020-16079-x
スコープで見るGoogle Scholar
[101]
K. Yang, Y. Hou, Y. Zhang, H. Liang, A. Sharma, W. Zheng, L. Wang, R. Torres, K. Tatebe, S.J. Chmura, S.P. Pitroda, J.A. Gilbert, Y.-X. Fu, R.R. Weichselbaum
腸内細菌叢由来の酪酸による局所I型インターフェロンの抑制は電離放射線の抗腫瘍効果を損なう
J. Exp. Med., 218 (2021), 10.1084/jem.20201915
Google Scholar
[102]
J. 磯部潤一郎, 前田聡, 小畑由紀夫, 飯塚耕一郎, 中村祐之, 藤村祐之, 君塚哲也, 服部和彦, Y.-G. キム、森田貴宏、木村伊量、オッフェルマンズ、足立哲也、中尾彰宏、清野裕之、高橋大輔、長谷和彦
腸内細菌由来の酪酸は大腸におけるT細胞非依存性IgA応答を促進する
Int. 免疫学, 32 (2020), 243-258頁, 10.1093/intimm/dxz078
スコープで見るGoogle Scholar
[103]
J. タン、C.マッケンジー、P.J.ヴュイエルミン、G.ゴバース、C.G.ヴィヌエサ、R.E.メビウス、L.マシア、C.R.マッケイ
食物繊維と細菌のSCFAは、多様な細胞経路を介して経口耐性を増強し、食物アレルギーから保護する
Cell Rep., 15 (2016), 2809-2824頁, 10.1016/j.celrep.2016.05.047
PDFを見る記事を見るScopusで見るGoogle Scholar
[104]
Q. Zhao, W.-R. ヤン、X.-H. 王、G.-Q. Li, L.-Q. Xu、X. Cui、Y. Liu、X.-L. Zuo
クロストリジウム・ブチリカムは、TNBS誘発過敏性腸症候群マウスの腸管低悪性度炎症を、lamina propria樹状細胞の機能状態を制御することにより緩和する。
World J. Gastroenterol., 25 (2019), pp.5469-5482, 10.3748/wjg.v25.i36.5469
スコープで見るGoogle Scholar
[105]
M. ビアジオーリ、A. カリーノ
腸から宿主へのシグナル伝達: 胆汁酸はどのように腸管と肝臓の免疫を制御するか
(2019), 95-108頁, 10.1007/164_2019_225
Scopusで見るGoogle Scholar
[106]
M. 船橋、T.L.グローブ、M.ワン、Y.ヴァルマ、M.E.マクファデン、L.C.ブラウン、C.グオ、S.ヒギンボトム、S.C.アルモ、M.A.フィッシュバッハ
腸内マイクロバイオームによる胆汁酸デヒドロキシル化の代謝経路
Nature, 582 (2020), 566-570頁, 10.1038/s41586-020-2396-4
スコープで見るGoogle Scholar
[107]
D. Paik、L. Yao、Y. Zhang、S. Bae、G.D. D'Agostino、M. Zhang、E. Kim、E.A. Franzosa、J. Avila-Pacheco、J.E. Bisanz、C.K. Rakowski、H. Vlamakis、R.J. Xavier、P.J. Turnbaugh、R.S. Longman、M.R. Krout、C.B. Clish、F. Rastinejad、C. Huttenhower、J.R. Huh、A.S. Devlin
ヒト腸内細菌はΤ17調節性胆汁酸代謝産物を産生する
Nature, 603 (2022), 907-912頁, 10.1038/s41586-022-04480-z
スコープで見るGoogle Scholar
[108]
M.L.チェン、武田和也、M.S.サンドラッド
粘膜免疫と炎症における胆汁酸の新たな役割
Mucosal Immunol., 12 (2019), 851-861頁, 10.1038/s41385-019-0162-4
PDFで記事を見るScopusで記事を見るGoogle Scholar
[109]
V. Massafra、N. Ijssennagger、M. Plantinga、A. Milona、J.M. Ramos Pittol、M. Boes、S.W.C. van Mil
FXRを介したDSS大腸炎の改善における脾臓樹状細胞の関与
Biochim. Biophys. Acta (BBA) - Mol. Basis Dis., 1862 (2016), 166-173頁, 10.1016/j.bbadis.2015.11.001
PDFを見る記事を見るScopusで見るGoogle Scholar
[110]
S. フィオルッチ、M.ビアジョリ、A.ザンペラ、E.ディストルッティ
胆汁酸活性化受容体は自然免疫を制御する
Front. Immunol., 9 (2018), 10.3389/fimmu.2018.01853
Google Scholar
[111]
R.M. Gadaleta、K.J. van Erpecum、B. Oldenburg、E.C.L. Willemsen、W. Renooij、S. Murzilli、L.W.J. Klomp、P.D. Siersema、M.E.I. Schipper、S. Danese、G. Penna、G. Laverny、L. Adorini、A. Moschetta、S.W. C van Mil
ファルネソイドX受容体の活性化は、炎症性腸疾患における炎症を抑制し、腸管バリアを維持する。
Gut, 60 (2011), 463-472頁, 10.1136/gut.2010.212159
スコープで見るGoogle Scholar
[112]
S. フィオルッチ、A.ザンペラ、P.リッチ、E.ディストルッティ、M.ビアジョリ
FXRの免疫調節機能
Mol. Cell. Endocrinol., 551 (2022), Article 111650, 10.1016/j.mce.2022.111650
PDFで記事を見るScopusで記事を見るGoogle Scholar
[113]
S. Hang、D. Paik、L. Yao、E. Kim、J. Trinath、J. Lu、S. Ha、B.N. Nelson、S.P. Kelly、L. Wu、Y. Zheng、R.S. Longman、F. Rastinejad、A.S. Devlin、M.R. Krout、M.A. Fischbach、D.R. Littman、J.R. Huh
胆汁酸代謝産物はTH17細胞とTreg細胞の分化を制御する
Nature, 576 (2019), 143-148頁, 10.1038/s41586-019-1785-z
スコープで見るGoogle Scholar
[114]
J. Hu、C. Wang、X. Huang、S. Yi、S. Pan、Y. Zhang、G. Yuan、Q. Cao、X. Ye、H. Li
腸内細菌叢が介在する二次胆汁酸は樹状細胞を制御し、TGR5シグナルを介して自己免疫性ぶどう膜炎を抑制する
Cell Rep., 36 (2021), Article 109726, 10.1016/j.celrep.2021.109726
Googleスカラー
[115]
S. ーB.L.バスラー
、ー複雑でダイナミックにー変化する環境におけるー
Nat. Rev. Microbiol., 17 (2019), 371-382頁, 10.1038/s41579-019-0186-5
ダブリュー・イン・スコパス・ダブGoogle Scholar
[116]
S. アジミ、A.D.クレメンティエフ、M.ホワイトリー、S.P.ディグル
感染時の細菌クオラムセンシング
Annu. Rev.Microbiol.、74(2020)、201-219頁、10.1146/annurev-micro-032020-093845
フクオウエキス(フクオウエキスフオウエキスフオウエキスフオウエキスフオウエキス
[117]
Y. ー王, Z. Bian, Y. Wang
ーバイオフィルム形成とーバイオフィルム形成とーバイオフィルム形成の年ー
Appl. Microbiol. バイオテクノロジー, 106 (2022), pp.6365-6381, 10.1007/s00253-022-12150-3
Google Scholar
[118]
S. Wu, J. Liu, C. Liu, A. Yang, J. Qiao
Cell. Mol. 生命科学, 77 (2020), 1319-1343頁, 10.1007/s00018-019-03326-8
ーScopusGoogle Scholarで
[119]
A.
細菌のクオラムセンシングとN-アシルホモセリンラクトンと真核生物の領域横断的相互作用
J. Chem. Ecol., 38 (2012), 704-713頁, 10.1007/s10886-012-0141-7
スコープで見るGoogle Scholar
[120]
Q. Li, Y. Ren, X. Fu
腸内細菌叢と宿主との間の領域間シグナル伝達
Cell. Mol. Life Sci., 76 (2019), 2383-2389頁, 10.1007/s00018-019-03076-7
グーグル スカラー
[121]
M. ナギ、I.L.C.チャップル、P.シャルマ、S.A.キューネ、J.ヒルシュフェルド
口腔バイオフィルムにおけるクオラムセンシング:宿主細胞への影響
微生物, 11 (2023), p. 1688, 10.3390/microorganisms11071688
スコープで見るGoogle Scholar
[122]
E.K.シャイナー、K.P.ランボー、S.C.ウィリアムズ
アシルホモセリンラクトンの言語解読:ドメイン間シグナル伝達
FEMS (Fed. Eur. Microbiol. Soc.) Microbiol. Rev., 29 (2005), 935-947頁, 10.1016/j.femsre.2005.03.001
PDFを見る記事を見るScopusで見るGoogle Scholar
[123]
G. Coquant, J.-P. グリル、P.
クオラムセンシング分子であるN-アシルホモセリンラクトンが腸管免疫に及ぼす影響
Front. Immunol., 11 (2020), 10.3389/fimmu.2020.01827
Google Scholar
[124]
A. ザルガー、D.N.クアン、K.K.カーター、M.グオ、H.O.シンティム、G.F.ペイン、W.E.ベントレー
非病原性大腸菌の分泌物が炎症経路を惹起する:細胞間シグナル伝達の詳細な検討
mBio, 6 (2015), 10.1128/mBio.00025-15
Google Scholar
[125]
E.M. Medina-Rodriguez、D. Madorma、G. O'Connor、B.L. Mason、D. Han、S.K. Deo、M. Oppenheimer、C.B. Nemeroff、M.H. Trivedi、S. Daunert、E. Beurel
マウスにおいてマイクロバイオームがTh17細胞を介するうつ様行動を制御するシグナル伝達機構の同定
Am. J. Psychiatr., 177 (2020), pp.974-990, 10.1176/appi.ajp.2020.19090960
スコープで見るGoogle Scholar
[126]
J. Wu、K. Li、W. Peng、H. Li、Q. Li、X. Wang、Y. Peng、X. Tang、X. Fu
Fusobacterium nucleatumのAutoinducer-2は、TNFSF9/IL-1βシグナルを介してマクロファージのM1偏極を促進する。
Int. Immunopharm., 74 (2019), Article 105724, 10.1016/j.intimp.2019.105724
PDFで記事を見るScopusで記事を見るGoogle Scholar
[127]
Y.-C. Ji, Q. Sun, C.-Y. Fu, X. She, X.-C. Liu、Y. He、Q. Ai、L.-Q. Li、Z.-L. W. Li, Z.-L. Wang
新生児壊死性腸炎モデルマウスにおいて、外因性オートインデューサー-2が腸内細菌異常症と腸炎を改善した。
Front. Cell. Infect. Microbiol., 11 (2021), 10.3389/fcimb.2021.694395
Google Scholar
[128]
Y. グルキサム-ガルノイ、R. サナネス、N. シルバースタイン、P. クリーフ、V.V. クラフチェンコ、M.M. メイラー、T. ゾール
細菌のクオラムセンシングシグナル分子N-3-オキソ-ドデカノイル-l-ホモセリンラクトンは、活性化マクロファージにおいて炎症性サイトカインと抗炎症性サイトカインを相互に調節する。
J. Immunol., 191 (2013), 337-344頁, 10.4049/jimmunol.1300368
スコープで見るGoogle Scholar
[129]
D.S.W. Hooi、B.W. Bycroft、S.R. Chhabra、P. Williams、D.I. Pritchard
緑膿菌クオラムセンシングシグナル分子の異なる免疫調節活性
Infect. Immun., 72 (2004), 6463-6470頁, 10.1128/IAI.72.11.6463-6470.2004
スコープで見るGoogle Scholar
[130]
M.E. Skindersoe、L.H. Zeuthen、S. Brix、L.N. Fink、J. Lazenby、C. Whittall、P. Williams、S.P. Diggle、H. Froekiaer、M. Cooley、M. Givskov
緑膿菌クオラムセンシングシグナル分子は樹状細胞誘導性T細胞増殖を妨害する
FEMS Immunol. Med. Microbiol., 55 (2009), 335-345頁, 10.1111/j.1574-695X.2008.00533.x
スコープで見るGoogle Scholar
[131]
P. Boontham、A. Robins、P. Chandran、D. Pritchard、M. Cámara、P. Williams、S. Chuthapisith、A. McKechnie、B.J. Rowlands、O. Eremin
緑膿菌クオラムセンシングシグナル分子の有意な免疫調節作用:ヒト敗血症における関連性の可能性
Clin. Sci., 115 (2008), 343-351頁, 10.1042/CS20080018
スコープで見るGoogle Scholar
[132]
E. Laborel-Préneron, P. Bianchi, F. Boralevi, P. Lehours, F. Fraysse, F. Morice-Picard, M. Sugai, Y. Sato'o, C. Badiou, G. Lina, A.-M. Schmitt, D. Redoulès, C. Casas, C. Davrinche
アトピー児の皮膚微生物叢から分離された黄色ブドウ球菌および表皮ブドウ球菌のセクレトームがCD4+ T細胞活性化に及ぼす影響
PLoS One, 10 (2015), Article e0141067, 10.1371/journal.pone.0141067
スコープで見るGoogle Scholar
[133]
N. ディアス-ガリド、J.バディア、L.バルドマ
微生物細胞外小胞による樹状細胞の調節はサイトカインプロファイルとエクソソームカーゴに影響する
栄養素, 14 (2022), p. 344, 10.3390/nu14020344
スコープで見るGoogle Scholar
[134]
Q. リュー、田X.、丸山大介、アルジョマンディM.、A.プラカシュ
腸-肺軸を介した肺免疫緊張:腸由来のLPSおよび短鎖脂肪酸による肺IL-1β、FFAR2、FFAR3発現の免疫代謝制御
Am. J. Physiol. Lung Cell Mol. Physiol., 321 (2021), pp. L65-L78, 10.1152/ajplung.00421.2020
スコープで見るGoogle Scholar
[135]
L. Schaupp、S. Muth、L. Rogell、M. Kofoed-Branzk、F. Melchior、S. Lienenklaus、S. C. Ganal-Vonarburg、M. Klein、F. Guendel、T. Hain、K. Schütze、U. Grundmann、V. Schmitt、M. Dorsch、J. Spanier、P. K. Larsen、T. Schwanz、S. Jäckel、C. Reinhardt、T. Bopp、S. Danckwardt、K. Mahnke、G.A. Heinz、M.F. Mashreghi、P. Durek、U. Kalinke、O. Kretz、T.B. Huber、S. Weiss、C. Wilhelm、Andrew J. Macpherson、H. Schild、A. Diefenbach、H.C. Probst
微生物によって誘導されたI型インターフェロンは、樹状細胞のポイズド基底状態を指示する
Cell, 181 (2020), pp.1080-1096.e19, 10.1016/j.cell.2020.04.022
PDFで記事を見るScopusで記事を見るGoogle Scholar
[136]
A. シヴァン、L.コラレス、N.ヒューバート、J.B.ウィリアムズ、K.アキノ-ミカエル、Z.M.アーリー、F.W.ベニヤミン、Y.マンレイ、B.ジャブリ、M.-L.アレグレ、E.B.チャン、T.F.ガジェフスキー
通性ビフィズス菌は抗腫瘍免疫を促進し、抗PD-L1効果を促進する
Science, 350 (2015), pp.1084-1089, 10.1126/science.aac4255
スコープで見るGoogle Scholar
[137]
C.H.キム
マイクロバイオーム代謝産物による免疫制御
Immunology, 154 (2018), 220-229頁, 10.1111/imm.12930
ScopusGoogle Scholarで見る
引用者: (0)
© 2024 エルゼビア社発行
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当サイトではクッキーを使用しています。クッキー設定
このサイトのすべてのコンテンツ: 著作権 © 2024 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条項が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
