大腸内細菌の侵入を抑制するシアリル化粘液の構造形成
大腸内細菌の侵入を抑制するシアリル化粘液の構造形成
https://www.mucosalimmunology.org/article/S1933-0219(23)00049-1/fulltext
谷口無限 † 奥村龍
奥村 龍
松崎 隆久
木田 俊之
亀山 昭彦
武田 潔
すべての著者を表示する
脚注を表示する
オープンアクセス掲載:2023年6月27日DOI:https://doi.org/10.1016/j.mucimm.2023.06.004
要旨
腸内ではムチン2(Muc2)が網目構造を形成し、細菌の侵入を防いでいる。Muc2のバリア機能には糖鎖が不可欠である。Muc2の様々な糖鎖付加パターンの中で、シアリル化は細菌依存的なMuc2の分解を抑制する。しかしながら、Muc2がネットワーク構造を形成し、シアリル化がムチンの分解を抑制するメカニズムは不明である。ここでは、ジシアリル化糖鎖の生成を仲介する2つの大腸特異的糖転移酵素、St6galnac6とB3galt5に注目し、シアル化によって負電荷と親水性が付与され、Muc2のネットワーク構造が形成されることを示した。St6galnac6とB3galt5を欠損したマウスの大腸粘液は、シアル化度が低く、薄く、微生物叢に対してより透過性であった。炎症性腸疾患(IBD)に関連するB3galt5変異を持つマウスでも、粘液のジシアリル化糖鎖の欠損と高い腸炎感受性が示されたことから、Muc2のシアル化度の低下がIBDの病態に関連していることが示唆された。シアル化度が低下したマウスのムチンでは、負の電荷が減少し、ネットワーク構造が乱れ、多くの細菌が侵入した。従って、シアリル化はMuc2の負帯電を仲介し、Muc2ポリマーの架橋を促進してネットワーク構造を形成し、大腸における細菌の侵入を抑制して腸の恒常性を維持している。
はじめに
腸粘膜バリアは、常在細菌と宿主との適切な相互作用を確立することにより、腸の恒常性維持に寄与している。大腸では、高度にグリコシル化されたムチンからなる厚い粘液層が常在細菌の侵入から大腸上皮を保護している
[1]
. 従って、腸で最も多く分泌される分泌性ムチンであるムチン2(Muc2)の欠乏は、常在菌による大腸組織の侵襲に起因する大腸炎の発症を引き起こす
1
,
2
. Muc2は自己会合して高分子となり、粘弾性層のネットワーク構造を形成することで、常在菌の侵入を物理的に阻止する。
3
,
4
. Muc2以外にも、腸管上皮細胞から放出されるLy6 plaur-containing 8(Lypd8)やDeleted in malignant brain tumors 1(Dmbt1)が常在菌と結合し、常在菌の侵入を抑制することが示されている5 。
5
,
6
. Lypd8もDmbt1も高度にグリコシル化されたタンパク質である。このように、常在細菌と宿主の相互作用を制御し、腸の恒常性を維持する分子は、高グリコシル化されている。
高グリコシル化タンパク質が宿主と微生物叢の相互作用を制御しているという事実とともに、糖鎖そのものが腸の恒常性維持に必要であることも示されている[7]。
[7]
. 腸管内腔の高グリコシル化タンパク質に結合した糖鎖は、バクテロイデス属細菌などの共生細菌の増殖のための炭素源として機能し、腸管出血性大腸菌などの病原性細菌の病原性遺伝子の発現を抑制し、腸内常在菌と宿主の共生関係を維持することが示されている[8]。
8
,
9
,
10
,
11
. 哺乳類では様々な糖転移酵素によって様々なタイプのグリコシレーションが生成される
[12]
. 糖鎖のいくつかの修飾パターンの中で、シアル化は哺乳類の糖タンパク質中の糖鎖の末端にシアル酸の付加を介して起こる
[13]
. 特にムチン糖鎖は高度にシアル化されていることが知られている
14
,
15
,
16
. 腸内では最近、シアリル化が微生物叢依存的なムチンの分解から保護することが示されている
[17]
. しかしながら、シアル化によってムチンに対する細菌の攻撃がどのように防がれるかはまだ不明である。
タンパク質や脂質のグリコシル化は様々な糖転移酵素によって厳密に制御されており、それぞれの糖転移酵素の発現は細胞の種類によって異なる
[7]
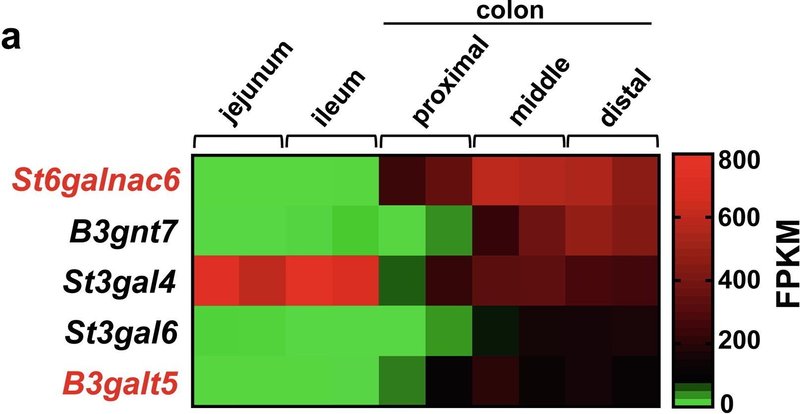
. 従って、腸管上皮細胞はユニークな糖鎖修飾パターンを示すことが予想される。糖転移酵素の発現を網羅的に解析した結果、β-1,3-ガラクトース転移酵素5(B3galt5)やSt6 N-アセチルガラクトサミニドα-2,6-シアリル転移酵素6(St6galnac6)などのいくつかの糖転移酵素遺伝子が、マウスの遠位結腸の結腸上皮で高選択的に発現していることがわかった。この2つの糖転移酵素はジシアリル化糖鎖の生合成に重要な役割を果たしている。本研究では、糖鎖のシアル酸修飾が粘液バリア機能を強化するメカニズムを解析した。
結果
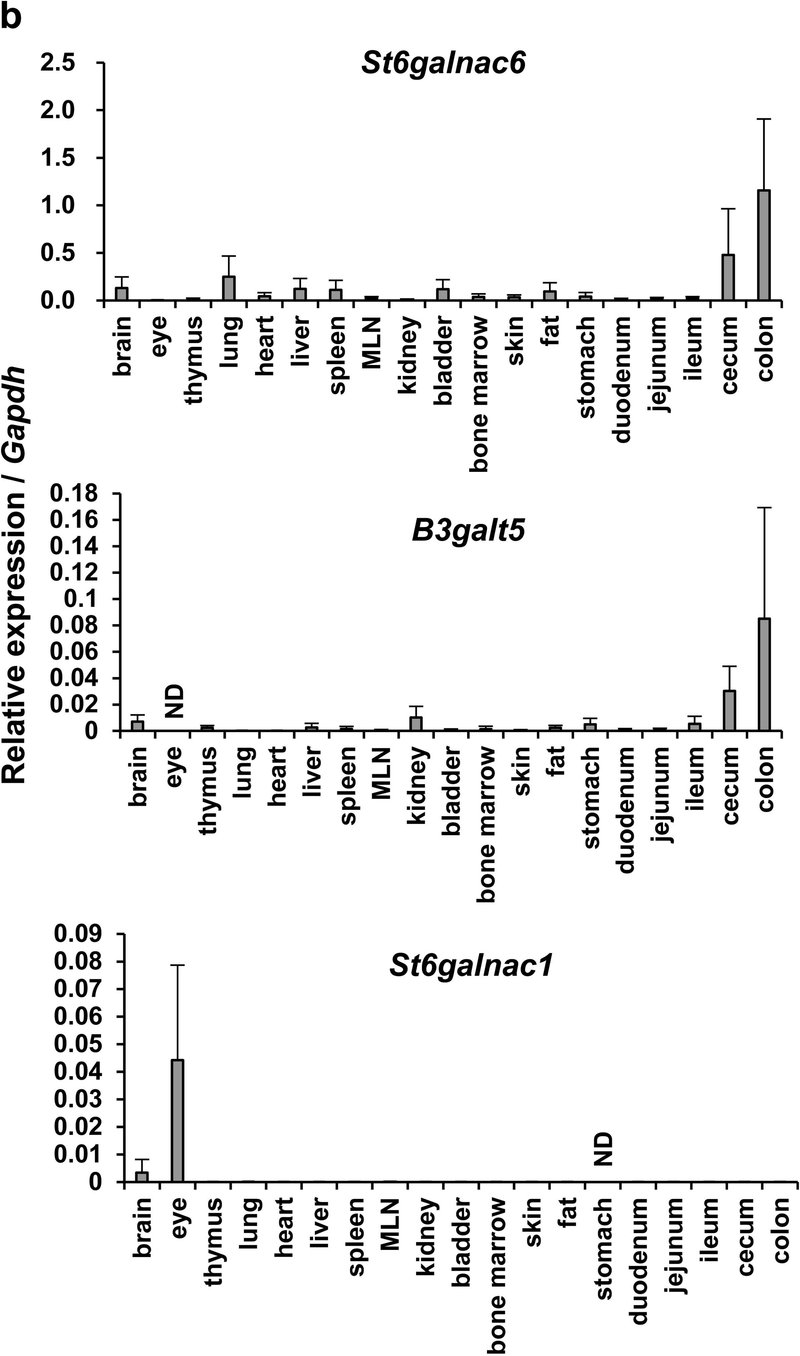
B3galt5とSt6galnac6はマウスの大腸上皮で選択的に発現している
糖鎖はムチンのバリア機能に関与していることから、我々は大腸における特異的な糖鎖構造の同定を試み、RNAシークエンシングによってマウスの腸のいくつかの部分の上皮における178の糖転移酵素遺伝子(表1)のmRNA発現レベルを調べた(補足図1a)。β-1,3-ガラクトース転移酵素ポリペプチド5(B3galt5)やSt6 N-アセチルガラクトサミニドα-2,6-シアリル転移酵素6(St6galnac6)を含むいくつかの糖転移酵素遺伝子は、他の糖転移酵素遺伝子のレベルに比べて大腸上皮で高発現していた。これらの遺伝子は遠位結腸で最も高発現している(図1a)。B3galtファミリー遺伝子とSt6galnacファミリー遺伝子のうち、B3galt5とSt6galnac6だけが大腸上皮で高発現していた(補足図1b, c)。さらに、様々な臓器のリアルタイムポリメラーゼ連鎖反応(RT-PCR)解析から、これら2つの糖転移酵素が大腸で選択的に高発現していることが示された(図1b)。ヒトでは、ST6GALNAC1が大腸で高発現していることが示されている
[17]
ヒトではST6Galnac1が大腸で高発現していることが示されているが[17]、マウスの大腸では発現していなかった(図1b)。マウスとヒトの大腸上皮細胞のsingle-cell RNA (scRNA) シークエンシングデータから、B3galt5/B3GALT5とSt6galnac6/ST6GALNAC6はマウスとヒトの両方で杯細胞を含む大腸上皮細胞に発現しているが、St6galnac1はマウスの大腸上皮細胞ではほとんど発現していないことが示された(補足図1d, e)。St6galnac1とSt6galnac6のタンパク質構造は類似しており[二乗平均平方根偏差:2.366Å(ヒト)、1.826Å(マウス)]、シアル化を仲介する機能も類似していることから、本研究ではSt6galnac6に焦点を当てた。St6galnac6とB3galt5の発現量を大腸の上皮と固有層で比較したところ、両遺伝子の発現量は上皮の方が固有層よりも顕著に高かった(補図1f)。これらの結果は、B3galt5とSt6galnac6が大腸上皮で高選択的に発現していることを示唆している。
表1マウス糖転移酵素遺伝子
酵素活性糖鎖遺伝子酵素活性糖鎖遺伝子ALGDol-P-マン合成Dpm1N-アセチルグルコサミニル転移酵素β1、 6(コア2)Gcnt1Dpm1-adnpGcnt3Dpm2Gcnt4Dpm3Gcnt7Dol-P Glc合成Alg5血液I抗原Gcnt2細胞質ALG(GnT)Alg14MGATファミリーMgat1Alg13Mgat2Dpagt1Mgat3細胞質ALG (ManT)Alg1Mgat4aAlg2Mgat4bAlg11Mgat4cER 内腔ALG (ManT)Alg3Mgat4dAlg9Mgat4eAlg12Mgat5ER 内腔ALG (GlcT)Alg6Mgat5bAlg8O- リンクOgtAlg10bEogtフコース転移酵素フコース転移酵素Fut1タンパク質O-結合フコースb1、 3-N-アセチルグルコサミニル転移酵素LfngFut2RfngFut4タンパク質O-結合マンノースb1,2-N-アセチルグルコサミニル転移酵素Pomgnt1Fut4-ps1Fut7タンパク質O-結合マンノースb1、 4-N-アセチルグルコサミニルトランスフェラーゼPomgnt2Fut8Fut9CAGCsgalnact1O-フコシルトランスフェラーゼPofut1Csgalnact2Pofut2Extl1フコシルトランスフェラーゼ(活性不明)Fut10Extl2Fut11Extl3ガラクトシルトランスフェラーゼαA3galt2シアリルトランスフェラーゼβ-Galα2、 3-シアル酸転移酵素St3gal1A4galtSt3gal2β1,3B3galt1St3gal3B3galt2St3gal4B3galt4St3gal5B3galt5St3gal6B3galt6β-Galα2,6-シアル酸転移酵素St6gal1C1galt1St6gal2β1、 4B4galt1β-GalNAcα2,6-シアル酸転移酵素St6galnac1B4galt2St6galnac2B4galt3St6galnac3B4galt4St6galnac4B4galt5St6galnac5B4galt6St6galnac6B4galt7αNeuAcα2、 8- シアル酸転移酵素St8sia1グルコシル転移酵素グルコシル転移酵素B3glctSt8sia2LargeSt8sia3Gyltl1bSt8sia3osグルクロニル転移酵素グルクロニル転移酵素B3gat1St8sia4B3gat2St8sia5B3gat3St8sia6マンノシル転移酵素マンノシル転移酵素Pomt1硫酸転移酵素HNKChst4Pomt2Chst5PigbChst10PigxChst14N アセチルガラクトサミニルトランスフェラーゼβ1、 3B3galnt1Gal 3-O-硫酸転移酵素Gal3st1B3galnt2Gal3st2β1,4B4galnt1Gal3st3B4galnt2Gal3st4B4galnt3Gal 6-O-硫酸転移酵素Chst1B4galnt4Chst3UDP-GalNAc: ポリペプチドN-アセチルガラクトサミニルトランスフェラーゼGalnt1Chst7Galnt2GalNAc 4-O-硫酸転移酵素Chst8Galnt3Chst9Galnt4Chst11Galnt5Chst12Galnt6Chst13Galnt7GalNAc4S 6-O-硫酸転移酵素Chst15Galnt9GlcNAc 6-O-硫酸転移酵素Chst2Galnt102-O 硫酸転移酵素(ヘパラン硫酸)Hs2st1Galnt113-O-硫酸転移酵素(ヘパラン硫酸)Hs3st1Galnt12Hs3st2Galnt13Hs3st3a1Galnt14Hs3st3b1Galnt15Hs3st4Galnt16Hs3st5Galnt18Hs3st6Galntl56-O-硫酸転移酵素(ヘパラン硫酸) O-硫酸転移酵素(ヘパラン硫酸)Hs6st1Galntl6Hs6st2N-アセチルグルコサミニルトランスフェラーゼα1、 4A4gntHs6st3α1,6PigaN-脱アセチル化酵素/N-硫酸転移酵素Ndst1PigcNdst2PigyNdst3β1、 3B4gat1Ndst4B3gnt2XylosyltransferaseXylosyltransferaseXylt1B3gnt3Xylt2B3gnt4Gxylt1B3gnt5Gxylt2B3gnt6α-ジストログリカン修飾α-ジストログリカン修飾FkrpB3gnt7B3gnt8B3gnt9その他その他PomkB3gntl1C1galt1c1
酵素活性により分類された178のマウス糖転移酵素遺伝子を示す。本研究で取り上げたB3galt5とSt6galnac6は太字で示した。ALG:アスパラギン結合型糖鎖、CAG:グリコサミノグリカン、Dol-P-Man:ドリコール-リン酸-マンノース、Dol-P-Glc:ドリコール-リン酸-グルコース、ER:小胞体、Gal:ガラクトース、GalNAc: N-アセチルガラクトサミン、GlcNAc: N-アセチルグルコサミン、GlcT:グルコシルトランスフェラーゼ、GnT:N-アセチルグルコサミニルトランスフェラーゼ、HNK:ヒトナチュラルキラー細胞糖鎖、ManT:マンノシルトランスフェラーゼ、MGAT:マンノシル糖タンパク質N-アセチルグルコサミニルトランスフェラーゼ、NeuAc: N-アセチルノイラミン酸。
新しいタブで表を開く
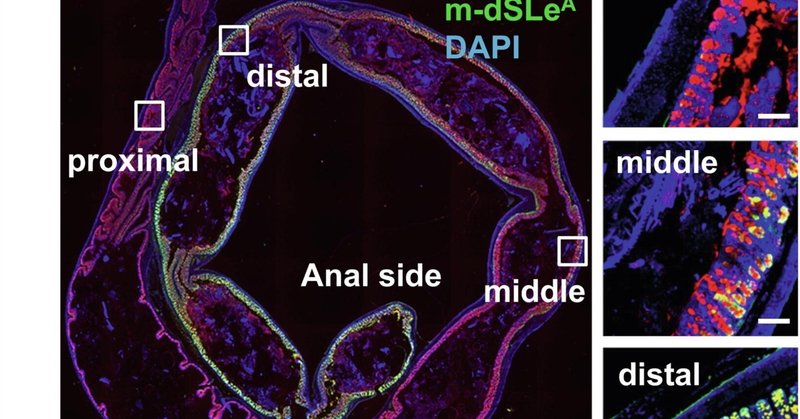
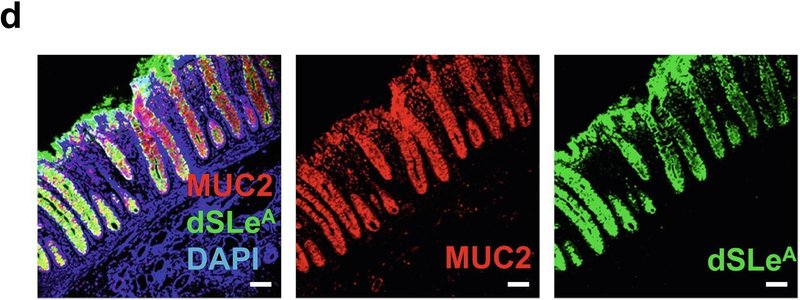
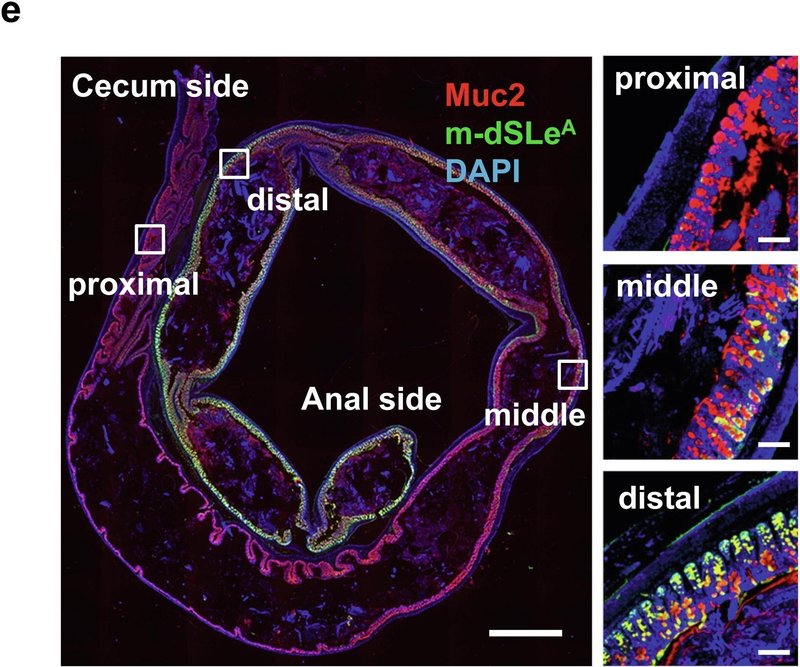
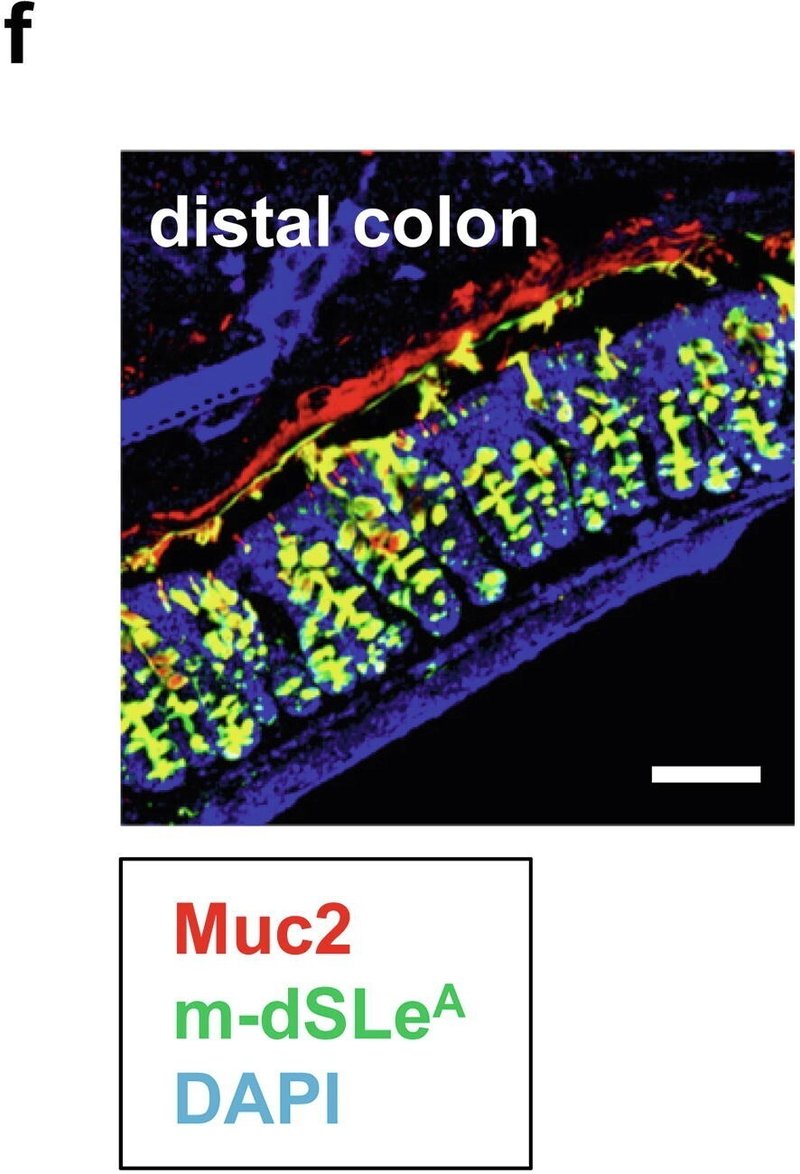
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸の上皮で高発現している上位5つの糖転移酵素遺伝子の発現のヒートマップ。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
大きな画像を見る
高解像度画像のダウンロード
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸の上皮で高発現している上位5つの糖転移酵素遺伝子の発現をヒートマップで示す。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
大きな画像を見る
高解像度画像のダウンロード
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸の上皮で高発現している上位5つの糖転移酵素遺伝子の発現をヒートマップで示す。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
大きな画像を見る
高解像度画像のダウンロード
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸の上皮で高発現している上位5つの糖転移酵素遺伝子の発現をヒートマップで示す。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
大きな画像を見る
高解像度画像のダウンロード
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸の上皮で高発現している上位5つの糖転移酵素遺伝子の発現をヒートマップで示す。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
大きな画像を見る
高解像度画像のダウンロード
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸の上皮で高発現している上位5つの糖転移酵素遺伝子の発現をヒートマップで示す。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
大きな画像を見る
高解像度画像のダウンロード
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸の上皮で高発現している上位5つの糖転移酵素遺伝子の発現をヒートマップで示す。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
大きな画像を見る
高解像度画像のダウンロード
遠位結腸の粘液層はジシアリル化糖鎖を含む
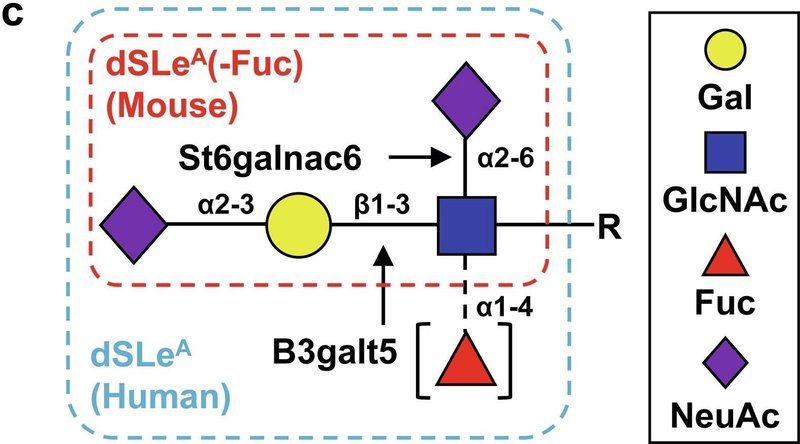
B3galt5はN-アセチルグルコサミン(GlcNAc)にβ1-3結合でガラクトースを結合させるが、これはシアリルルイスA(SLeA)の生合成に必要である(図1c)。
[18]
. St6galnac6はα2-6結合を持つSLeA構造中のGlcNAcへのシアル酸の転移を仲介する(Fig. 1c)
[18]
. したがって、これら2つの糖転移酵素の共発現は糖鎖のシアル化を促進し、最終的にジシアリルルイスA(dSLeA)を生成する(図1c)。B3galt5とSt6galnac6は大腸上皮で高発現しているので、抗ヒトdSLeA抗体(FH7)を用いた免疫染色により、ヒト大腸でdSLeAが発現しているかどうかを調べた。以前の研究で示されたように
[19]
に示されているように、dSLeAのシグナルはヒト大腸上皮、特にMUC2を発現している杯細胞で観察された(図1d)。フコシルトランスフェラーゼ3(FUT3)は、dSLeA構造におけるα1-4フコシル化を仲介する遺伝子産物であり、マウスの偽遺伝子である[20]。
[20]
したがって、α1-4フコースを欠失したdSLeA(図1c)はマウスdSLeA(m-dSLeA)と呼ばれ、マウスの大腸に存在すると予測される。FH7抗体は、α1-3/4フコシダーゼで処理したヒト大腸組織切片中のdSLeAと反応し、その構造はm-dSLeAと同等であった(補足図2a)。そこで、FH7抗体を用いた免疫染色により、マウスの大腸におけるm-dSLeAの発現を調べた。m-dSLeAのシグナルは大腸の中遠位部の粘液層と杯細胞で観察されたが、近位部では観察されなかった。また、m-dSLeAのシグナル強度は、消化管全体でSt6galnac6の発現が中・遠位結腸で最も高いことに伴い、中・遠位結腸から徐々に増加した(図1e, f)。回腸ではm-dSLeAのシグナルは検出されず、これは回腸でのSt6galnac6の発現が低いことと一致している(補足図2b)。シアル化糖鎖構造を検出するFH7抗体の能力は、マウスの結腸切片をシアリダーゼで処理することで確認された(補足図2c)。さらに、糞便はm-dSLeA(黄色)に包まれており、糞便微生物叢に混在する非シアリル化ムチン(赤色)とは対照的である(図1g)。Muc2-/-マウスの結腸ではm-dSLeAの量が大幅に減少しており、Muc2が遠位結腸におけるdSLeA修飾の主要な標的タンパク質であることが示唆された(図2a)。
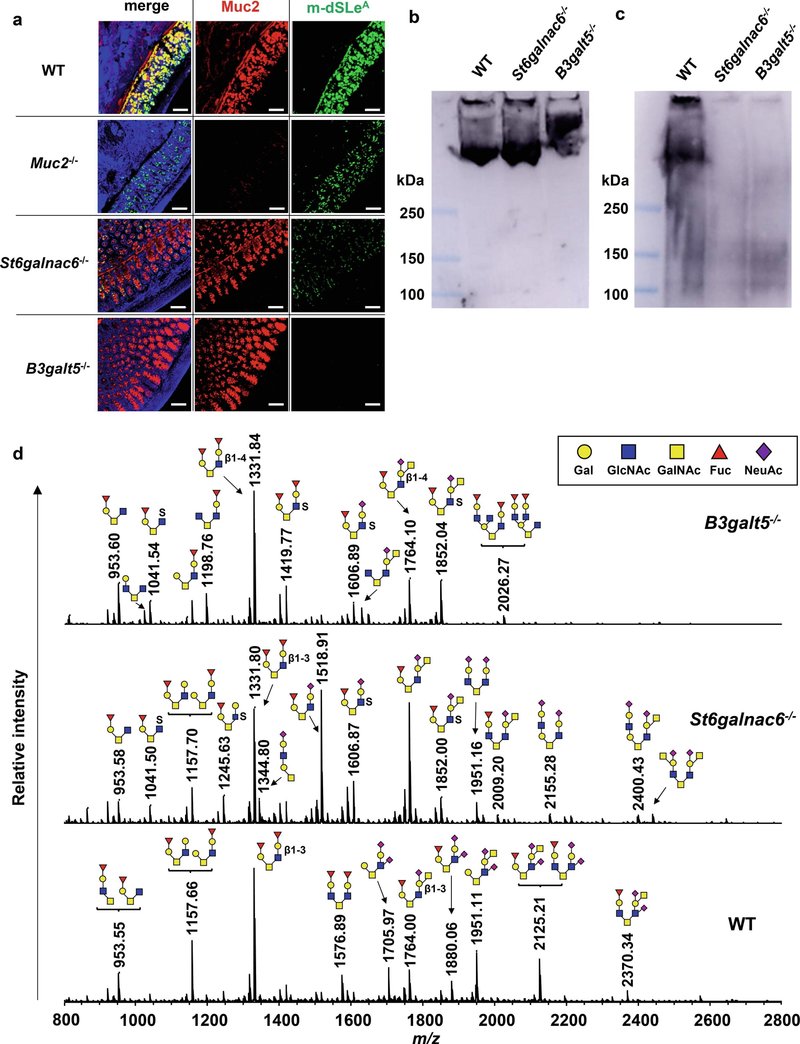
図2St6galnac6-/-マウスとB3galt5-/-マウスの大腸ムチンはジシアリル化糖鎖を欠く。(a) 野生型マウス、Muc2-/-マウス、St6galnac6-/-マウス、B3galt5-/-マウスの結腸切片を抗Muc2抗体と抗ジシアリルルイスA(m-dSLeA)抗体で免疫染色した。スケールバーは100μm。(b, c) 抗Muc2抗体(b)と抗ジシアリルLewis A抗体(c)による大腸表面精製ムチンのイムノブロット。(d) WTマウス、St6galnac6-/-マウス、B3galt5-/-マウスの大腸ムチンのMSスペクトルと、タンデムMSで推定した各MSピークの糖鎖構造を示す。GalNAc: N-アセチルガラクトサミン。
大きな画像を見る
高解像度画像のダウンロード
St6galnac6とB3galt5は大腸でジシアリル化糖鎖構造を生成する
遠位結腸におけるdSLeA修飾の役割を解析するために、CRISPR/Cas9システムを用いてSt6galnac6-/-マウスとB3galt5-/-マウスを作製した(補足図3a, b)。m-dSLeAのシグナルは、St6galnac6-/-マウスでは大幅に減少し、B3galt5-/-マウスではほとんど見られなかった(図2a)。このことは、St6galnac6とB3galt5が大腸におけるm-dSLeAの生合成に決定的に関与していることを示している。抗Muc2抗体とFH7を用いたウェスタンブロット解析から、WTマウスの大腸粘液から精製したMuc2にはm-dSLeAが含まれていたが、両ノックアウトマウスでは検出されなかった(図2b, c)。次に、St6galnac6-/-マウスとB3galt5-/-マウスにおける大腸ムチンの糖鎖付加パターンの変化を広範に調べるために、質量分析(MS)を用いて大腸ムチンの糖鎖を解析した。大腸ムチンのN型糖鎖の液体クロマトグラムには両群間で明らかな差は認められなかったが(補足図4a, c)、WTマウスのO型糖鎖の液体クロマトグラムでは、ジシアリル化糖鎖の構成に相当する2つのピークがSt6galnac6-/-マウス、B3galt5-/-マウスともに消失していた(補足図4b, d)。タンデムMS解析の結果、WTマウスのコア2またはコア4のO-糖鎖に観察されたm-dSLeAを含むジシアル化糖鎖に対応するいくつかの質量ピークが、St6galnac6-/-マウスおよびB3galt5-/-マウスのものでは消失していることが明らかになった(図2dおよび補足図5a, b)。これらの結果は、St6galnac6-/-マウスとB3galt5-/-マウスではムチンのO-糖鎖のシアル化が減少していることを明確に示している。
図3St6galnac6-/-およびB3galt5-/-マウスは腸炎を起こしやすい。(a, b) WTマウス(n = 9:雄5匹、雌4匹)またはSt6galnac6-/-マウス(n = 7:雄4匹、雌3匹)に2%DSSを投与した後の体重変化率(a)および疾患活動性指数(DAI)スコア(b)。(c, d) DSS投与開始後8日目のWTマウス(n = 9: 雄5匹、雌4匹)およびSt6galnac6-/-マウス(n = 7: 雄4匹、雌3匹)の結腸切片のヘマトキシリン&エオシン(H&E)染色(c)および組織学的スコア(d)。スケールバー、500μm(上段)および100μm(下段)。(e, f)WTマウス(n = 8:雄5匹、雌3匹)またはB3galt5-/-マウス(n = 8:雄5匹、雌3匹)に2%DSSを投与した後の体重変化率(e)およびDAIスコア(f)。(g, h) DSS投与開始後9日目のWTマウス(n = 8: 雄5匹、雌3匹)およびB3galt5-/-マウス(n = 8: 雄5匹、雌3匹)の結腸切片のH & E染色(g)および組織学的スコア(h)。スケールバー、500μm(上段)および100μm(下段)。データは平均値±SD。グループ間の比較には両側スチューデントのt検定を行った。データは2つの独立した実験からプールした。*p < 0.05, **p < 0.01, ***p < 0.005, ****p < 0.001。
大きな画像を見る
高解像度画像をダウンロード
図4IBDに関連するB3GALT5変異体では酵素活性が欠失し、腸の炎症が起こりやすくなっている。(a)B3GALT5エクソン7におけるIBD関連一塩基置換の位置を表すシェーマ。CDS:コード配列。(b) B3GALT5の118番目のアラニンは様々な生物間で保存されている。(c) PyMOLによるB3GALT5の構造モデリング。(d) B3GalT5またはマウス(上)もしくはヒト(下)の変異型B3GalT5を発現させたHEK293T細胞の、抗Siaα2-3Galβ1-3GlcNac抗体を用いたフローサイトメトリー解析。(e) WTおよびB3galt5D116Aマウスの結腸切片を抗Muc2抗体および抗ジシアリルLewis A抗体(m-dSLeA)で免疫染色した。(f-i)WTマウス(n = 5: 雄5匹)またはB3galt5D116Aマウス(n = 5: 雄5匹)に2%DSSを投与した後の体重変化率(f)および疾患活動性指数(DAI)スコア(g)。DSS投与開始後7日目のWTマウス(n = 5: 5匹雄)またはB3galt5D116Aマウス(n = 5: 5匹雄)の結腸切片のH & E染色(h)および組織学的スコア(i)。スケールバー、500μm(上段)および100μm(下段)。データは平均値±SD。グループ間の比較には両側スチューデントのt検定を行った。データは2つの独立した実験からプールした。*p < 0.05, **p < 0.01, ***p < 0.005。
大きな画像を見る
高解像度画像をダウンロード
図5Muc2ムチンのシアリル化が低下すると、粘液層は常在細菌に対して透過性になる。(a) WT、St6galnac6-/-、B3galt5-/-マウスの結腸切片の細菌FISHとMuc2染色。スケールバー、100μm。(b) WT、St6galnac6-/-およびB3galt5-/-マウスの遠位結腸における粘液層の厚さを示す(各マウスにつき20点のデータを平均した(n = 7:雄5匹、雌2匹))。(c) WT、St6galnac6-/-およびB3galt5-/-マウスの遠位結腸における管腔内容物(粘液層および細菌)中の粘液層の面積比を示す(n = 7:雄5匹、雌2匹)。データは平均値±SDで示した。一元配置分散分析を用いて群間差の有意性を決定した。*p < 0.05, **p < 0.01, ***p < 0.005, ns: 有意でない。(d) St6galnac6-/-マウスとB3galt5-/-マウスの大腸固有層における細菌の存在を示す。スケールバー、100μm(上段)。上段の白四角で囲まれた部分の高倍率画像を下段に示す。(e, f) 細菌特異的プライマーを用いた大腸組織(e)および腸間膜リンパ節(f)における細菌DNAの定量的PCR。データはWTマウス群と比較した細菌DNA量を示す(n=6:各群オス3匹、メス3匹(e)、n=8:各群オス4匹、メス4匹(f))。データは平均値±SD。一元配置分散分析(e)およびクラスカル・ワリス検定(f)を用いて群間差の有意性を判定した。*p < 0.05, **p < 0.01, ns: 有意でない。(g-l)WT、St6galnac6-/-、B3galt5D116Aマウスの大腸上皮細胞のRNA配列決定(n = 2:各群につき雄1匹、雌1匹)。(g)最も変動が大きい遺伝子(top2000)のヒートマップと階層的クラスタリング。(h) トランスクリプトーム発現の主成分分析。(i) WTマウスとSt6galnac6-/-マウスの大腸上皮細胞におけるトランスクリプトームのボルケーノプロット。(j)St6galnac6-/-マウスの大腸上皮における差次発現遺伝子(DEG)の上流制御因子(p値<10-6)を示す。(k) St6galnac6-/-マウスとB3galt5D116Aマウスに関連するDEGsの上流制御因子(p-value < 10-3)の数を示すベン図。一般的な上流制御因子をSt6galnac6-/-マウスのp値の大きい順に右側に示した。(l)St6galnac6-/-マウスに関連するDEGをもとに、IPAによる下流影響解析で同定された疾患と機能を示す。
大きな画像を見る
高解像度画像ダウンロード
ムチンのシアリル化が減少したマウスは腸の炎症に敏感である
Muc2のシアル化度の減少の影響を調べるために、St6galnac6-/-マウスとB3galt5-/-マウスのデキストラン硫酸ナトリウム(DSS)誘発腸炎に対する感受性を調べた。St6galnac6-/-マウスは、WTマウスよりも激しい体重減少、下痢、出血を示した(図3a, b)。それに伴い、St6galnac6-/-マウスでは、重度の潰瘍と粘膜固有層および粘膜下層への細胞浸潤が観察された(図3c, d)。さらに、B3galt5-/-マウスでもDSS処理後に重篤な大腸炎が認められた(図3e-h)。The Inflammatory Bowel Disease (IBD) Exomes Portal [(Cambridge, MA (URL: http://ibd.broadinstitute. org)]では、エクソームシーケンスに基づく3つの集団コホートのメタアナリシスによるIBD症例対照関連結果が示されており、IBD患者、特にクローン病(CD)患者は、コントロールよりもB3GALT5のエクソン7にミスセンス変異(21:41032839 A/C)を有する頻度が高いことが示されている[オッズ比:4.75(3.222, 7.004)、CDにおけるp値:0.0008971](図4a)。この変異は、哺乳類間で保存されている118番目の残基アスパラギン酸(D)をアラニン(A)に変えている(図4b)。PyMOL(https://pymol.org/2/)を用いたB3GNT2の構造(PDB: 7JHN)に基づくB3GALT5の構造モデリングにより、D118A置換はAsp118がモチーフIのArg77と水素結合している活性部位を不安定化する可能性が高いことが示された(図4c)。実際、正常なB3galt5を過剰発現させるとHEK293T細胞でSiaα2-3Galβ1-3GlcNac糖鎖の細胞表面発現が誘導されるのに対し、変異マウスB3galt5(D116A、ヒトD118Aに相当)またはヒトB3GALT5(D118A)を過剰発現させても誘導されなかったことから(図4d)、この置換はB3GALT5の機能喪失につながることが示唆された。ヒトのD118Aに相当するB3galt5のD116A置換が、in vivoでの腸炎感受性に影響を及ぼすかどうかを調べるために、マウスの生殖系列にD116A置換を導入した(B3galt5D116Aマウス)(補足図3c)。B3galt5D116Aマウスの大腸では、m-dsLeAが消失した(図4e)。さらに、B3galt5D116AマウスはWTマウスよりも重症のDSS誘発大腸炎を示した(図4f-i)。これらの結果は、Muc2のm-dsLeAのようなジシアリル化糖鎖が腸炎の予防に寄与していること、またMuc2のシアル化度の低下が腸炎の病態に関連していることを示している。
糖鎖シアル化の欠損は粘液を腸内細菌に透過させる
ジシアリル化糖鎖が腸の炎症予防にどのように寄与しているかをさらに調べるため、次に特定病原体フリー(SPF)条件下で飼育した変異マウスの大腸を組織学的に調べた。34週齢のSt6galnac6-/-マウス(補足図6a, b)と27週齢のB3galt5D116Aマウス(補足図7a, b)の大腸では、粘膜の軽度の肥厚と固有層の細胞数の増加が観察された。組織学的所見と同様に、フローサイトメトリー解析から、12週齢のSt6galnac6-/-マウスの固有層では、IFN-γ+ CD4+T細胞、IL-17+ CD4+T細胞、好中球を含む炎症性免疫細胞サブセットが劇的に増加していることが明らかになった(補足図6c)。さらに、12週齢のB3galt5D116Aマウスでも同様の免疫学的変化が見られたことから(補足図7c)、粘液糖鎖のシアル化不全が過剰な免疫応答を引き起こすことが示唆された。次に、St6galnac6-/-マウスとB3galt5-/-マウスの結腸粘液層を免疫染色で注意深く観察した(図5a)。両変異マウスとも、大腸の粘液層が著しく薄くなっていた(図5b、c、補足図8)。さらに、両変異マウスの遠位結腸では、細菌による固有層への侵入が観察され(図5d)、このことは、両変異マウスの結腸組織における細菌数の増加を示す定量的PCR解析によって裏付けられた(図5e)。さらに、両変異マウスの腸間膜リンパ節でより多くの細菌が検出されたことから(図5f)、St6galnac6-/-およびB3galt5-/-マウスの粘液層は、野生型マウスの粘液層よりも常在菌に対して透過性が高いことが示唆された。St6galnac6-/-マウスおよびB3galt5D116Aマウスの大腸上皮細胞の遺伝子発現をRNA-sequencingにより解析した(図5g-lおよび補足図7d-f)。上記の結果に従い、両変異マウスで同様の遺伝子発現パターンが見られた(図5g, h)。特に、リポ多糖(LPS)や炎症性サイトカインによって発現が上昇すると報告されているAng4、Retnlb、Reg4などのいくつかの抗菌遺伝子の発現は、両変異体マウスで共通していた21。
21
,
22
,
23
,
24
は、両変異マウスの大腸上皮で有意に増加した(図5iおよび補足図7d)。さらに、ingenuity pathway analysis (IPA)により、St6galnac6-/-マウスでは、LPSといくつかの炎症性サイトカインが発現差のある遺伝子(DEG)の上流制御因子として同定された(図5j)。IPAは、B3galt5D116AマウスでもLPSといくつかの炎症性サイトカインをDEGの上流制御因子として予測したが、その多くはSt6galnac6-/-マウスでも上流制御因子として同定された(図5kおよび補足図7e)。さらに、IPAによる下流効果解析から、両変異マウスで同定されたDEGは慢性大腸炎や免疫疾患と関連していることが示された(図5lおよび補足図7f)。これらの結果は、シアリル化が欠損した粘液層は常在菌に対してより透過性が高く、その結果、大腸において過剰な免疫応答を引き起こすことを明確に示している。
図6シアル化度の低下したムチンは低い電気陰性度と強い硬さを示す。(a)支持分子マトリックス電気泳動(SMME)で分離したWT、St6galnac6-/-、B3galt5-/-マウスの大腸ムチンの比較。参照ムチンとして豚胃ムチン(PGM)を用いた。アルシアンブルーで染色したSMME膜の代表的な画像を示す。(b) ヒートマップは各走査スポットのヤング率(Pa)を示す。(c)WT、St6galnac6-/-、B3galt5-/-マウスの粘液層のヤング率(Pa)(各マウスにつき64-128個のスキャンスポットのデータを平均したもの(n=8:各群につきオス6匹、メス2匹))を、横線が平均値を表すドットプロットで可視化した。群間差の有意性を判定するためにKruskal-Wallis検定を用いた。*p<0.05、ns:有意でない。
大きな画像を見る
高解像度画像のダウンロード
図7 St6galnac6-/-マウスとB3galt5-/-マウスではムチンのネットワーク構造が乱れている。(a) WTマウス、St6galnac6-/-マウス、B3galt5-/-マウスの結腸粘膜表面の走査型電子顕微鏡(SEM)像。上段の緑の点線で囲まれた部分は、上皮表面を覆っている粘液を示す。上段の白点で囲まれた部分の高倍率画像を中段に示す。中央の白四角で囲まれた部分の高倍率画像を下段に示す。赤と青の点線で囲まれた領域は、それぞれ線維が密な領域と線維が疎な領域を示す。スケールバーは100μm(上段)、1μm(中段)、100nm(下段)。(b) 繊維配向解析に用いたWT、St6galnac6-/-、B3galt5-/-マウスの粘液層の代表的な画像。オリジナルのSEM画像(上段)、上段の画像からの2値化画像(2段目)、2段目の画像からの2D-FFT画像(3段目)、フーリエ係数の振幅に基づく近似楕円(下段)を示す。スケールバーは100nm。(c)長軸bの平方根を((b):下段)で示した短軸aで割った値を示す(各マウス(n=5:各群オス3匹、メス2匹)あたり5点のデータの平均)。データは平均±SDを表す。一元配置分散分析を用いて群間差の有意性を決定した。**p < 0.01, ***p < 0.005, ns: 有意でない。(d) 大腸粘液中の腸内細菌の代表的なSEM画像を示す。赤い点線は棒状の細菌の向きを示す。青い点線で囲まれた部分は、一方向に整列したムチン・ポリマーのゾーンを示す。青い矢印はムチンポリマーの方向を示す。赤い矢印は、ムチン・ポリマー間の裂け目に入り込んだ棒状細菌を示す。上段の白い四角で囲まれた部分の高倍率画像を下段に示す。スケールバー、5μm(上のパネル)および1μm(下のパネル)。(e)細菌の割合 (i)一方向に整列したムチン・ポリマー(赤)または網目構造を持つムチン(青:円グラフの内側)上に存在し、(ii)ムチン・ポリマーの配向に沿って存在するか否か(中央)、(iii)ムチン・ポリマー間の裂け目に侵入するか否か(外側)。データは遺伝子型不一致マウス(n = 7:各群オス5匹、メス2匹)の大腸のSEM画像から得られた。
大きな画像を見る
高解像度画像のダウンロード
ムチンの糖鎖は数種類の腸内細菌によって利用されるので
[25]
次に、WTマウス、St6galnac6-/-マウス、B3galt5-/-マウスの糞便細菌組成を比較した(補足図9)。16S rRNAの塩基配列解析の結果、微生物の多様性はグループ間で差がなかったが(補足図9a)、属レベルの微生物組成はWTマウスと変異マウスの間で変化していた(補足図9b, c)。特に、Sutterella属などのβ-プロテオバクテリアやDesulfovibrio属などのδ-プロテオバクテリアを含むプロテオバクテリア門の割合は、St6galnac6-/-マウス、B3galt5-/-マウスともにWTマウスよりも高かった(補足図9d-f)。これらの細菌は、マウスやヒトの炎症を起こした大腸でしばしば増加することから
26
,
27
,
28
上皮細胞における抗菌分子のアップレギュレーションを含む炎症反応によって、変異マウスにおけるディスバイオーシスが誘導されている可能性がある。
シアル酸付加は粘液層のムチンネットワーク構造を規定する
シアル酸残基は、糖タンパク質に負電荷と親水性を付与することにより、糖タンパク質の複雑なポリマー構造を形成することが示された
29
,
30
. さらに、シアル酸を含む陰イオン性糖鎖は、ムチンの粘弾性と柔軟性の向上に寄与していると報告されている
29
,
31
. さらに最近、シアル酸付加は微生物叢依存的なムチンの分解から保護することが示された
[17]
. そこで、シアル化糖鎖が粘液層のバリア機能にどのように寄与しているかを調べるために、我々はシアル化度の減少が遠位結腸の粘液層の化学的、物理的性質(それぞれ電荷と硬さ)および構造に及ぼす影響を調べた。まず、WT、St6galnac6-/-、B3galt5-/-マウスのムチンのO-糖鎖の電荷状態を比較した(図6a)。ムチンを単離し、支持分子マトリックス電気泳動(SMME)を行った後、アルシアンブルー染色を行った。St6galnac6-/-マウスおよびB3galt5-/-マウスから単離したムチンは、WTマウスのムチンよりもプラス電極への移動が遅く、このことは両ノックアウトマウスにおいてムチンのマイナス電荷が減少していることを示唆している。
FH7抗体による免疫染色から、遠位結腸の糞便のない領域では、m-dSLeAを含む粘液層が上皮を覆っていることが示された(補足図10a)。そこで、シアル化度の低下が粘液の物性に及ぼす影響を調べるために、次に大腸遠位部の糞便のない部分を覆っているUlex europaeusレクチン1で染色した粘液のヤング率(E Pa)を原子間力顕微鏡(AFM)を用いて評価した(図6b, cおよび補図10b-e)。St6galnac6-/-マウスの粘液層の弾性率(ヤング率)はWTマウスのそれよりも有意に高く、シアル酸の欠損によって粘液層が硬くなったことが示唆された。ヤング率はB3galt5-/-マウスの方がSt6galnac6-/-マウスよりも低く、St6galnac6-/-マウスの粘液が非常に硬いことが示された。
次に、走査型電子顕微鏡(SEM)で遠位結腸の粘液層を観察した。WTマウスでは、粘液層の表面は滑らかで、層はムチン・ポリマーからなる網目構造によってしっかりと編まれていた(図7a、左パネル)。しかし、B3galt5-/-マウスでは、粘液層の表面は非常に粗く、粘液層中にムチンが多い領域と少ない領域が共存していた(図7a、右パネル)。このことは、B3galt5の欠損によるシアル酸の消失がムチンポリマーの不規則な凝集を引き起こすことを示唆している。St6galnac6-/-マウスでは、ムチン・ポリマーはネットワーク構造ではなく、細い糸(すなわちファイバー)の配列を形成しているように見えた(図7a、中パネル)。そこで、WTマウスと変異マウスのムチンポリマーの向きを正確に比較した(図7b, c)。二次元高速フーリエ変換(2D-FFT)は以前、紙やパルプの繊維配向を解析するのに使われた。
32
,
33
,
34
. ムチン構造体の2値化SEM画像を2D-FFTにかけ(図7b)、各半径方向の平均振幅を算出し、各マウスのムチンポリマー配向図および近似楕円として表した(図7b)。ムチンポリマーの配向パラメータとしては、長軸bを近似楕円の短軸aで割った平方根を評価した(図7b, c)。2D-FFT解析の結果、St6galnac6-/-マウスとB3galt5-/-マウスのムチンポリマーは有意に一方向であったことから、粘液層の多方向ネットワーク構造の生成にはMuc2糖鎖のシアリル化が必要であることが示唆された。最後に、大腸粘液層上の常在細菌をSEMで観察した(図7d, eおよび補足図11)。St6galnac6-/-マウスとB3galt5-/-マウスでは、60%の細菌が一方向のムチン・ポリマー上に存在していた(図7d, eおよび補足図11a, b)。興味深いことに、St6galnac6-/-マウスとB3galt5-/-マウスでは、一方向性のムチン・ポリマー上に存在する細菌のほとんどが、ムチン・ポリマーと同じ方向に存在していた(図7d, eおよび補足図11c, d)。さらに、St6galnac6-/-マウスとB3galt5-/-マウスでは、ムチン重合体の方向に沿って存在する細菌の割合が高く、一方向に整列したムチン重合体の間の裂け目に侵入したのに対し、WTマウスではほとんどの細菌が侵入することなく、多方向のムチン重合体のネットワーク上に存在した(図7d, eおよび補足図11e-j)。これらの結果を総合すると、B3galt5とSt6galnac6の発現によるMuc2の糖鎖のシアリル化が、大腸の細菌侵入から粘膜表面を守る粘液層の適切な構造と物理的、化学的性質の形成に決定的に関与していることが示された。
考察
本研究では、Muc2のO-糖鎖のシアリル化が大腸の粘液バリア機能の増強に必要であることを示した。腸における糖鎖は、恒常性の維持に重要な役割を果たしていることが示されている[7]。
[7]
. 現在までのところ、これは主に、微生物叢に対する栄養素とリガンドの供給によって媒介され、最終的には宿主と微生物叢の相互作用の制御に寄与していることが示されている。
8
,
9
,
10
,
11
. 最近の研究では、糖鎖構造の最外端にシアル酸を付加する糖鎖修飾であるシアリル化が、細菌依存性の分解からムチンを保護することが示された
[17]
. 本研究では、2つの糖転移酵素に注目することで、シアル酸付加がどのようにして大腸ムチンのバリア性を高めるのかについて、明確なメカニズム的洞察を提供する: St6galnac6とB3galt5である。粘液層への細菌の侵入を防ぐために必要なムチンポリマーのネットワーク構造は、シアリル化によって作られる。
腸の粘液は高度にシアル化されたMuc2ポリマーのネットワーク構造からなる。シアル化度が低下した条件下(St6galnac6とB3galt5を欠損させたマウス)では、ムチンは負電荷を帯びにくくなり、その網目構造は乱れる。シアル酸にカルボキシル基が付加すると、標的分子に負の電荷と親水性が与えられる
[3]
. St6galnac6とB3galt5を欠損したマウスでは、ムチンポリマーのネットワーク構造は乱れ、ムチンポリマーはそれぞれ本質的に繊維状構造と不規則な凝集体を形成するようになった。この点から、Muc2の重合は2つのタイプの相互作用によって処理される。
[35]
(ii)ムチン自身や粘液成分との非共有結合的相互作用(静電相互作用、疎水性相互作用、水素結合形成など
[3]
. この一般的な概念と本研究で得られた知見に基づき、われわれは、細菌の侵入に抵抗性のある粘液層のネットワーク構造が形成されるメカニズムについて、以下のように提案する。ジスルフィド結合の形成は、N末端とC末端部分におけるムチンとムチンの会合による線状オリゴマー化を媒介する
36
,
37
したがってムチンの繊維状構造の形成に寄与している。シアリル化が減少した条件下では、粘液は繊維状構造と負電荷の減少した非シアリル化ムチンポリマーの密な配列からなり、ムチンポリマーとともに存在する運動性の高い棒状の細菌が密接に吸着することにより、細菌侵入の標的となる可能性がある。シアリル化(WTマウスの場合)は、負の電荷と親水性の付加により、ムチンポリマーの稠密な配列をゆるめ、ムチンポリマーを柔軟にし、非共有結合によるムチンポリマーの架橋によるネットワーク構造の形成を促進する。ネットワーク構造の形成に加えて、細菌の細胞表面は負に帯電しているため、シアル酸による負電荷は細菌の粘液層への吸着を電気的に阻止する。実際、WTマウスの大腸粘液層では、棒状の細菌が粘液層のネットワーク構造のベッドに横たわっているように見えた。
粘液のレオロジー特性は、水和、pH、Ca2+濃度、トレフォイル因子などのいくつかの分泌ペプチドを含むいくつかの因子に影響される
31
,
38
. 粘液のレオロジー特性を決定する最も重要な因子の一つである水和は、シアル酸を含む糖鎖によって調節される。シアル酸は、ムチンのような糖タンパク質上の負電荷を持つ末端糖鎖であり、ムチンに親水性と安定性を与える [39
[39]
. これまでのin-vitro研究では、ムチンのシアル酸が粘液に粘性、弾力性、潤滑性を与えることが示されている
29
,
40
. しかしながら、シアル酸が腸粘液のレオロジー特性に及ぼす影響を調べたin-vivoの研究はなかった。この点で、我々のAFM解析は、St6galnac6の欠損によってムチン中のα2-6シアル酸が失われると、粘液が硬くなることを明確に示した。一方、B3galt5-/-マウスの粘液の硬さはSt6galnac6-/-マウスのそれよりも低く、WTマウスのそれと有意差はなかった。この点で、B3galt5-/-マウスではシアル化度の低下がより深刻であり、これが粘液の強い疎水性につながっているのかもしれない。疎水性の強いムチンポリマーは互いに凝集しやすい。実際、B3galt5-/-マウスの粘液には、ムチンが密集している領域と疎な領域があり、これは、St6galnac6-/-マウスの粘液ではムチンポリマーがぎっしりと並んでいるのとは対照的に、B3galt5-/-マウスのヤングモジュールのばらつきが大きいことと一致している。ムチンポリマーの不規則な凝集は粘液の硬さを低下させる。
St6galnac6+/-マウスとB3galt5+/-マウスの交配によって3つの遺伝子型の十分な数の同腹仔を作製することはほとんど不可能であるため、本研究の限界として、3つの遺伝子型(WTマウス、St6galnac6-/-マウス、B3galt5-/-マウス)間の粘液の厚さと性質の比較には、互いに隣接する異なるケージで別々に繁殖させた非同腹仔マウスを用いた。
Muc2ムチンのシアル化度の低下とヒトIBDとの関係については、ST6GalNAC1の機能不全がMuc2の分解を亢進させ、IBDの病態に寄与することが以前の研究で示されている
[17]
. ヒトのST6Galnac1とは異なり、ネズミのSt6galnac1は大腸では発現していないが、ネズミのSt6galnac6は大腸で高度に選択的に発現している。さらに、St6galnac6のタンパク質構造はSt6galnac1のそれと関連している。従って、St6galnac6はヒトST6Galnac1のマウス対応遺伝子であると考えられる。以前の研究では、St6galnac1の機能不全がMuc2の細菌による分解を引き起こし、その結果、過剰な酪酸産生を引き起こし、それが黄砂大腸炎への高い感受性を引き起こすことが示された
[17]
. しかし、St6galnac1欠損マウスの大腸におけるMuc2の糖鎖付加の変化は十分に評価されておらず、St6galnac1がマウスの大腸におけるMuc2のシアル化に関与しているかどうかは不明である。一方、St6galnac6とB3galt5の欠損では、Muc2のシアル化と陰性荷電が減少することが、タンデムMS解析と支持分子マトリックス電気泳動で明らかになった。さらに、St6galnac6-/-マウスとB3galt5-/-マウスはともに軽度の大腸炎を発症したが、St6galnac1変異マウスは発症しなかった
[17]
. ST6Galnac1はヒト大腸の杯細胞に発現しているが、St6galnac6とB3galt5はマウス大腸の多くの種類の上皮細胞に発現している。Muc2-/-マウスではdsLeAの発現が大幅に減少したことから、Muc2はSt6galnac6とB3galt5の主要な標的タンパク質であるが、Muc2が存在しない場合でもdsLeAの発現は存在することから、腸細胞によって遠位結腸に豊富に発現され、腸の炎症制御に重要な役割を果たしていると報告されているMuc13のような細胞表面ムチンを含む他の糖タンパク質が
[41]
や杯細胞から分泌される非ムチン分子は、St6galnac6やB3galt5を介してdSLeAで修飾される可能性がある。従って、St6galnac6-/-マウスやB3galt5-/-マウスの表現型には、これらの糖タンパク質のシアル化度の低下が関与している可能性がある。
シアル化ムチン(m-dSLeA)は中位結腸の最も内側の粘液層に存在した。このことは、微生物叢が遠位結腸に豊富であり、そのため細菌の侵入を阻害する特に強力なバリアが必要であることを考えれば、妥当なことであろう。さらに、中・遠位結腸では、糞便はジシアリル化ムチン(m-dSLeA)で固化され、カプセル化される。ムチンはシアル化によって親水性も付与されるため、最外層にシアル酸を多く持つムチンは水溶性で柔軟であり、大腸遠位部での糞便の適切な通過に寄与する可能性がある。
今回我々は、シアル酸付加が大腸ムチンMuc2のバリア機能を高めるメカニズムを明らかにした。Muc2はCitrobacter rodentium
42
,
43
Muc2のシアル化度の減少が腸内病原体に対する防御機能に及ぼす影響については、今後の興味深い課題であろう。さらに、ST6GALNAC1とB3GALT5の機能欠損変異がIBD患者において同定された。従って、ムチンのシアル化を回復させることは、IBD患者を治療するための新しいターゲットになると考えられる。
方法
マウス
C57BL/6JマウスをJapan SLC (Hamamatsu, Japan)から購入した。擬妊娠ICR雌性マウスはCLEA Japan Inc(東京、日本)から購入した。Muc2-/-マウスは前述と同様である
44
,
45
. B3galt5-/-マウス、B3galt5D116Aマウス、St6galnac6-/-マウスは、CRISPR/Cas9システムを用いて作製した。実験には、年齢と性別が一致したマウスを用いた。デキストラン硫酸ナトリウム(DSS)誘発大腸炎実験には、特定病原体フリー(SPF)条件下で同じケージ内で飼育した同腹マウス(St6galnac6+/+対(vs)St6galnac6-/-、B3galt5+/+対B3galt5-/-、B3galt5+/+対B3galt5D116A)を用いた。
46
,
47
. その他の生体内実験には、SPF条件下で隣り合わせに設置した異なるケージで別々に飼育したマウスを用い、3つの遺伝子型(野生型 vs St6galnac6-/- vs B3galt5-/-)を解析した。すべての動物実験は大阪大学動物愛護委員会のガイドラインに従って行われた。
大腸粘膜からのムチン抽出
縦に開いた大腸から糞便を除去した後、粘液を含んだ表面上皮をピンセットを用いて下層の粘膜から掻き取った。上皮の削り取りを5容量の氷冷した8M尿素抽出緩衝液[8M尿素(ナカライテスク)、10mMリン酸ナトリウム緩衝液(pH6.5)、5mM EDTA]に入れ、4℃で16時間穏やかに撹拌した。粘液溶液を23,000×g、4℃で45分間遠心分離した。上清を除去した後、抽出残渣に8M尿素還元バッファー[8M尿素、100mM Tris-HCl(pH8.0)、5mM EDTA、10mMジチオスレイトール(DTT)(MERCK)]を加え、37℃で5時間インキュベートした、 23,000×g、4℃で45分間遠心後、上清をMuc2ムチンを含む不溶性ムチン画分として回収し、抗Mucin2ポリクローナル抗体(GTX100664;GeneTex)または抗ジシアリルLewis A抗体(クローンFH7;Novus Biologicals)を用いてウェスタンブロッティングを行った。)
Muc2 O-グリカンのタンデム質量分析
O-グリカンのマススペクトルは、マトリックス支援レーザー脱離イオン化四重極イオントラップ飛行時間型質量分析計(MALDI-QIT-TOF MS、AXIMA-QIT、島津製作所)を用いて取得した。MS用のO-グリカン試料は、過去の報告に従って調製した
48
,
49
. 簡単に説明すると、100 mM NaBH4中50 mM NaOHを用いた還元的除去によってO-グリカンをムチンから遊離させ、ジメチルスルホキシド中NaOH存在下、ヨードメタンによって過メチル化した。誘導体化されたO-糖鎖は混合物として質量分析に供された。タンデム質量分析では、誘導体化したO-糖鎖を、質量分析の前に、TSKgel ODS-80TsQA column (4.6 i.d. ×250 mm; Tosoh Corp., Tokyo, Japan)を用いたHPLCで分離した。2,5-ジヒドロキシ安息香酸(2,5-DHB)をMALDIのマトリックスとして用いた。衝突誘起解離(CID)スペクトルは、コリジョンガスとしてアルゴンを用いて取得した。
デキストラン硫酸ナトリウム(DSS)誘発大腸炎モデル
DSS誘発大腸炎実験には、8-12週齢の雄性C57BL6/J、B3galt5-/-、B3galt5D116A、St6galnac6-/-マウスを用いた。野生型マウスと各遺伝子変異マウス群との比較には、各実験に同腹兄弟を用いた。急性大腸炎は、オートクレーブ滅菌した飲料水中に2%のDSS(36-50 kDa;MP Biomedicals社製、カリフォルニア州サンタアナ、USA)を5日間経口投与することで誘発した。マウスの体重変化、潜血メレナの有無、便の硬さをモニターした。疾患活動性指数(DAI)スコアは、以前の論文 [2] に記載されているように評価した。
[2]
. DSS投与開始後7-9日目に大腸を切除し、4%パラホルムアルデヒドリン酸緩衝液(ナカライテスク)で固定した。パラフィン包埋組織のヘマトキシリン・エオジン染色切片を、前掲の論文にも記載されているように、組織学的スコアリングのために分析した
[2]
.
支持分子マトリックス電気泳動(SMME)
SMME分析の前に、粗Muc2をトリプシン処理してO-グリコシル化ドメインを濃縮した。簡単に説明すると、粗Muc2ムチン溶液を100 mM Tris-HCl緩衝液(pH 8.6)で希釈して尿素濃度を2 Mにした後、トリプシンにより37℃で18時間消化した。反応混合物を遠心フィルター装置(10 kDaカットオフ)に通して消化ペプチドを除去した。濃縮したO-グリコシル化ドメインを8M尿素で再構築した。SMME膜は、PVDF膜(Immobilon-P; Merck KGaA, Darmstadt, Germany)とポリ(ビニルアルコール)(PVA, MW 22,000, 88% saponified, MP Biomedicals)を用いて、以前の報告[48]に従って調製した。
[48]
を使用し、サンプル塗布前にランニングバッファー(100 mM ピリジン-ギ酸、pH 4.0)で平衡化した。電気泳動は、メンブレン電気泳動チャンバー(EPC105AA;アドバンテック、東京、日本)を用い、1.0 mA/cmの定電流モードで30分間行った。電気泳動後、膜をメタノール中の30%酢酸で30分間インキュベートし、アルシアンブルー溶液(pH4.5)で染色した。
原子間力顕微鏡による粘液層の分析
排泄物を含まない縦開きの遠位結腸の粘液層の力学的解析を原子間力顕微鏡(AFM, Nano Wizard 3; JPK Instruments, Berlin, Germany)で行った。バネ定数kが約0.09 N/mまたは約0.3 N/mで先端が円錐形のシリコンカンチレバー(CSC38またはCSC37、μmasch inc.) 粘液層の力-圧痕(f-i)曲線は10mMダルベッコリン酸緩衝生理食塩水(pH7.4)中で得た。粘液層のヤング率Eは、HertzモデルのSneddonによる修正によって、接近曲線から計算した。
[42]
F=2tan(α)πE1−v2δ2�=2tan(α)π�1-�2δ2
(1)
ここで、F は荷重、δは圧痕深さ、v はポアソン比、αは圧子の半垂直角である。本研究では、vとαをそれぞれ0.5と20°と仮定した。Eはδ〜10μmの領域をフィッティングして求めた。
さらに、δに対する粘液層の剛性変化を統計的に解析した。解析方法については、以前の研究
[50]
に詳述されているが、ここでは簡単に説明する。まず、粘液層のf-i曲線をδ=0を起点としてΔδの長さでn本の曲線に分割する。次に分割された各曲線(i = 1, 2, ..., n)を式(1)でフィッティングし、分割された各曲線のヤング率(Ei)を計算する。このプロセスを複数のf-i曲線に適用する。最後に、δに対するEiのヒストグラムが得られる。本研究では、Δδを1μmとした。
走査型電子顕微鏡による粘液層の分析
粘液が流れ出ないように両端を糸で縛った管状遠位結腸を0.1Mリン酸緩衝液(pH7.4)中2.5%グルタルアルデヒドで4℃、2時間固定した後、1%OsO4溶液で4℃、90分間後固定した。固定後、組織を段階的濃度のエタノールで脱水した。脱水後、組織をtert-ブチルアルコール中で凍結乾燥した。最後に、管状のサンプルを切り開き、オスミウムプラズマコーター(メイワフォーシス、東京、日本)を用いてオスミウムでコーティングした。オスミウムコーティングしたサンプルを走査型電子顕微鏡(S-4800;日立、東京、日本)で観察した。
繊維配向の解析には、既報[32]と同様に二次元高速フーリエ変換(2D-FFT)を用いた。
[32]
. 簡単に説明すると、遺伝子型盲検マウスから無作為に得られた粘液層の二値化SEM画像(1024×1024ピクセル)を2D-FFTに適用し、角度θの各方向のフーリエ係数の振幅A(θ)を以前の論文[32]に従って計算した。
[32]
榎前博士が開発したFiberOri8single03を用いた(http://www.enomae.com/FiberOri/index.htm)。A(θ)の値に基づいて記述された曲線は、繊維の配向方向に垂直な角度θにいくつかのピークを持つ関数であり、楕円に近似された。繊維配向パラメータについては、近似楕円の長軸bを短軸aで割った値の平方根を評価した。
統計解析
コントロール群と実験群間の差は、GraphPad Prism 9.4.0を用いて、両側無対Student's t-test、パラメトリック検定としては一元配置分散分析にTukeyの多重比較検定を加えたもの、ノンパラメトリック検定としてはKruskal-Wallis検定にDunnの多重比較検定を加えたものによって評価した。統計的有意性を評価する前にデータの正規性を検定するため、Kolmogorov-Smirnov検定を行った(有意水準はα=0.05とした)。p値が0.05未満の差は、統計的に有意であるとみなされた。
著者の貢献
M.T.はほとんどの実験を行い、データを分析し、原稿を執筆した。R.O.は研究の計画、指導、データ解析、原稿執筆を行った。T.M.、M.H.、H.Y.はAFM実験を行った。A.N.、K.S.、S.O.、A.I.、H.T.が動物実験を行った。K.S.は構造モデリングを行った。D.M.、D.O.およびS.N.が次世代シークエンス解析を行った。T.K.が研究を監督した。A.K.は糖鎖のMS解析を行い、研究を監督した。K.T.は研究を計画・指揮し、原稿の校閲・編集を行った。
利害関係
著者らは、競合する利益はないと宣言している。
データの入手
今回のRNA-seqデータ(GSE #214864および #214866)は、Gene Expression Omnibus(GEO)に寄託されている。これらのデータおよび我々の以前のRNA-seqデータ(GSE #160379 )は、SPFマウスおよび無胚葉マウスの腸管上皮細胞の遺伝子発現プロファイルである[51]。
[51]
本研究では、これらのデータを統合した。
謝辞
技術協力のY. 技術協力の孫田陽子氏、原稿の校正をしていただいたエダンズグループ、秘書の日高慈子氏に感謝する。2-AB標識糖鎖のLC/MS分析には、住友ベークライト株式会社エスバイオ事業部の三浦靖彦氏、坂口正樹氏、豊田正樹氏にご協力いただいた。また、走査型電子顕微鏡による解析は、大阪大学大学院医学系研究科附属医学教育研究センターの大木英夫氏、水野哲也氏の協力を得た。B3galt5D116Aマウスの作製は、大阪大学大学院医学系研究科附属ゲノム編集研究開発センターの小谷陽一郎氏、宇野陽一郎氏にご協力いただいた。Helmsley IBD Exomes Programおよび比較のためにエクソームバリアントデータを提供してくださったグループに感謝する。提供グループの全リストはhttp://ibd.broadinstitute.org/about。本研究は、文部科学省科学研究費補助金の助成を受けた: JP18K15187(RO)、JP21H050430(KT)、日本医療研究開発機構: JP21gm1010004 (KT)、独立行政法人科学技術振興機構FORESTプログラム: JPMJFR205N (TM)、および上原記念財団 (RO, TM)。
参考文献
ヨハンソン M.E.
フィリップソン M.
ピーターソン J.
ヴェルチッチ A.
ホルム L.
ハンソンG.C.
大腸の2つのMuc2ムチン依存性粘液層の内側には細菌が存在しない。
Proc Natl Acad Sci U S A. 2008; 105: 15064-15069
論文で見る
哺乳類
PubMed
クロス
グーグル奨学生
ヴァン・デル・スルイス M.
デ・コーニングB.A.
デ・ブルインA.C.
ヴェルチッチ A.
メイエリンクJ.P.
ヴァン・グードーバーJ.B.
ほか
Muc2欠損マウスは自然に大腸炎を発症し、MUC2が大腸保護に重要であることを示している。
Gastroenterology. 2006; 131: 117-129
論文で見る
日本消化器病学会雑誌(1125)
PubMed
要旨
全文
全文PDF
グーグル奨学生
カールソンT.L.
ロックJ.Y.
キャリア R.L.
エンジニアリング・ザ・ミューカス・バリア。
Annu Rev Biomed Eng. 2018; 20: 197-220
論文で見る
スコープス (67)
PubMed
クロス
グーグル奨学生
ヨハンソン M.E.
ラーションJ.M.
ハンソンG.C.
大腸の2つの粘液層はMUC2ムチンによって組織化されているが、外層は宿主と微生物の相互作用の立法者である。
Proc Natl Acad Sci U S A. 2011; 108: 4659-4665
論文で見る
スコパス (894)
PubMed
クロス
グーグル奨学生
奥村理恵子
倉川 隆
中野剛志
香山秀昭
木下雅人
本岡大介
et al.
Lypd8は鞭毛虫性微生物叢と大腸上皮の分離を促進する。
Nature. 2016; 532: 117-121
論文で見る
スコープス (122)
PubMed
クロス
グーグル奨学生
レンナー M.
バーグマンG.
クレブス I.
エンドC.
ライアー S.
ヒルバーグF.
et al.
DMBT1はin vivoで粘膜を保護し、欠失変異体はクローン病と関連する。
Gastroenterology. 2007; 133: 1499-1509
論文で見る
日本消化器病学会雑誌 (0)
PubMed
要旨
全文
全文PDF
グーグル奨学生
クデルカ M.R.
ストウェル S.R.
カミングス R.D.
ニーシュ A.S.
IBDにおけるホメオスタシスと腸内細菌叢相互作用における腸管上皮のグリコシレーション。
Nat Rev Gastroenterol Hepatol. 2020; 17: 597-617
論文で見る
スコープス (80)
PubMed
クロス
グーグル奨学生
パチェコ A.R.
カーティス M.M.
リッチー・J.M.
ムネラ D.
ウォルドー M.K.
モレイラ C.G.
ほか
フコースセンシングは腸内細菌のコロニー形成を制御する。
Nature. 2012; 492: 113-117
論文で見る
麹菌 (0)
PubMed
クロス
グーグル奨学生
後藤祐之
小畑貴志
国沢純一
佐藤 聡
イワノフ I.I.
ラミチェーン A.
ほか
自然リンパ球は腸管上皮細胞の糖鎖形成を制御する。
Science. 2014; 345: 1254009
論文で見る
スコパス (0)
PubMed
クロス
グーグル奨学生
ファム T.A.
クレア S.
グールディングD.
アラステ J.M.
スターズM.D.
ブラウン H.P.
他
上皮IL-22RA1を介したフコシル化は、日和見病原体に対する腸管コロニー形成抵抗性を促進する。
Cell Host Microbe. 2014; 16: 504-516
論文で見る
スコープス (213)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ピカード J.M.
モーリス C.F.
キネブリューM.A.
アプトM.C.
シェンテン D.
ゴロフキナ T.V.
他
腸上皮の迅速なフコシル化は、病気における宿主-共生を維持する。
Nature. 2014; 514: 638-641
論文で見る
スコパス (0)
パブコメ
クロス
グーグル奨学生
リニ J.M.
モレメンK.W.
デイビスB.G.
エスコ J.D.
糖転移酵素と糖鎖処理酵素。
において: カミングスR.D.エスコJ.D.スタンレーP.ハートG.W.Th.ヴァルキA.コールドスプリングハーバー(NY)、糖鎖生物学の要点2022: 67-78
論文で見る
Google Scholar
シャウアー R.
Kamerling J.P.
シアル酸の世界の探検。
Adv Carbohydr Chem Biochem. 2018; 75: 1-213
論文で見る
スコープス (164)
PubMed
クロス
グーグル奨学生
バードJ.C.
Bresalier R.S.
大腸癌におけるムチンとムチン結合タンパク質。
Cancer Metastasis Rev. 2004; 23: 77-99
論文で見る
抄録集 (0)
PubMed
クロス
グーグル奨学生
スロミアニーB.L.
ムルティV.L.
ピオトロフスキJ.
スロミアニーA.
口腔粘膜防御における唾液ムチン。
Gen Pharmacol. 1996; 27: 761-771
論文で見る
スコープス (140)
PubMed
クロス
グーグル奨学生
シーハン J.K.
ソーントン D.J.
サマーヴィル M.
カールステット I.
ムチンの構造。
呼吸器粘液糖タンパク質の構造と不均一性。
Am Rev Respir Dis. 1991; 144: S4-S9
論文で見る
PubMed
クロスレフ
グーグル奨学生
Yao Y.
キムG.
シェーファー S.
チェン Z.
Kubo S.
Ji Y.
ら。
粘液のシアリル化は腸の宿主-宿主間恒常性を決定する。
Cell. 2022;
論文で見る
スコープ (30)
要旨
全文
全文PDF
グーグル奨学生
土田 敦
岡島 崇
古川和彦
安藤哲也
石田博之
吉田亜紀子
他
α-シリーズガングリオシドの合成に関与するシアル酸転移酵素ST6GalNAc VIによる大腸癌細胞株でのジシアリルルイスa(Le(a))構造の合成。
J Biol Chem. 2003; 278: 22787-22794
論文で見る
麹菌 (0)
PubMed
要旨
全文
全文PDF
グーグル奨学生
宮崎和彦
大森和彦
井澤正明
小池 崇
熊本和彦
古川和彦
他
リンパ球抑制受容体シアル酸結合免疫グロブリン様レクチン-7(Siglec-7)のリガンドであるジシアリルLewis(a)の欠損とヒト大腸癌におけるシアリルLewis(a)発現の亢進との関連。
癌研究 2004; 64: 4498-4505
論文で見る
膵臓がん
PubMed
クロス
グーグル奨学生
エングル D.D.
ティリアックH.
リベラ K.D.
ポミエ A.
ウォーレン S.
オニ T.E.
他
糖鎖CA19-9はマウスにおいて膵炎と膵臓癌を促進する。
Science. 2019; 364: 1156-1162
論文で見る
スコープス (130)
PubMed
クロス
グーグル奨学生
フーパー L.V.
スタッペンベックT.S.
ホン C.V.
ゴードン J.I.
アンジオジェニン:自然免疫に関与する微生物殺傷タンパク質の新しいクラス。
Nat Immunol. 2003; 4: 269-273
論文で見る
スコパス (751)
PubMed
クロス
グーグル奨学生
He W.
Wang M.L.
ジアン H.Q.
Steppan C.M.
シン M.E.
Thurnheer M.C.
他
細菌のコロニー形成は、新規杯細胞特異的タンパク質であるRELMbeta/FIZZ2の大腸分泌を引き起こす。
Gastroenterology. 2003; 125: 1388-1397
論文で見る
哺乳類
PubMed
概要
全文
全文PDF
グーグル奨学生
ヌールZ.
バージェス S.L.
ワタナベK.
ペトリJr.
インターロイキン-25を介したアンジオジェニン-4の誘導はインターロイキン-13依存性である。
PLoS One. 2016; 11: e0153572
論文で見る
スコープス (4)
PubMed
クロス
グーグル奨学生
レヴィ M.
タイスC.A.
Zeevi D.
ドハナロワL.
ジルバーマン-シャピラG.
マハディJ.A.
他
NLRP6 インフラマソームシグナルを制御することにより、微生物叢が調節する代謝産物が腸内微小環境を形成する。
Cell. 2015; 163: 1428-1443
論文で見る
スコープス (613)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
ベル A.
ジュゲ N.
腸内細菌叢による宿主の粘膜糖鎖分解。
糖鎖生物学。2021; 31: 691-696
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
ローワン F.
ドカティ N.G.
マーフィー M.
マーフィー B.
カルヴィン・コフィーJ.
オコンネルP.R.
潰瘍性大腸炎におけるDesulfovibrio菌種の増加。
Dis Colon Rectum. 2010; 53: 1530-1536
論文で見る
スコープス (204)
PubMed
クロス
グーグル奨学生
Mukhopadhya I.
ハンセンR.
ニコルC.E.
アルハイダン Y.A.
トムソン J.M.
ベリー S.H.
他
炎症性腸疾患から分離されたSutterella wadsworthensisの大腸粘膜分離株の包括的評価。
PLoS One. 2011; 6: e27076
論文で見る
膵臓
PubMed
クロス
グーグル奨学生
ハカンソン A.
トルモ=バディアN.
バリディ A.
Xu J.
モリン・G.
ハグスラットM.L.
他
マウスにおけるデキストラン硫酸ナトリウム(DSS)投与後の免疫学的変化と腸内細菌叢の変化。
Clin Exp Med. 2015; 15: 107-120
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
マルツィンスキー M.
バルツァーB.N.
江 K.
ルッツ T.M.
Crouzier T.
Lieleg O.
電荷を帯びた糖鎖残基は、ムチンの吸着性と潤滑性に決定的に寄与する。
Colloids Surf B Biointerfaces. 2020; 187110614
論文で見る
スコープス(22)
PubMed
クロス
グーグル奨学生
ルイス A.L.
ルイス W.G.
宿主のシアロ糖鎖と細菌のシアリダーゼ:粘膜の観点から。
Cell Microbiol. 2012; 14: 1174-1182
論文で見る
スコープス(115)
PubMed
クロス
グーグル奨学生
ライ・S.K.
ワン Y.Y.
Wirtz D.
ヘインズJ.
粘液のミクロおよびマクロレオロジー。
2009; 61: 86-100
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
榎前 毅
ハン Y.-H.
磯貝 敦
画像解析による紙表面の繊維配向分布.
Nordic Pulp and Paper Research Journal. 2004; 21: 253-259
論文で見る
スコープス (47)
クロス
グーグル奨学生
西村敏明
アンセル M.P.
OSBの繊維配向の高速フーリエ変換とフィルター画像解析。
Wood Sci Technol. 2002; 36: 287-307
論文で見る
スコープス (24)
クロス
グーグル奨学生
ユスファニ S.H.S.
ゴン R.H.
ポラット I.
抄紙法によるガラス繊維不織布の製造と繊維配向の研究。
Fibres Text East Eur. 2012; 20: 61-67
記事で見る
Google Scholar
ガム・ジュニア, J.R.
ヒックス J.W.
鳥原N.W.
ローテ E.M.
ラゲイス R.E.
キム・Y.S.
ヒトMUC2腸管ムチンは、その中央反復領域の上流と下流の両方にシステインに富んだサブドメインを持つ。
J Biol Chem. 1992; 267: 21375-21383
論文で見る
PubMed
要旨
全文PDF
グーグル奨学生
ジャビットG.
カルボM.L.G.
Albert L.
レズニック N.
イラニ T.
ディスキンR.
ら
腸管ゲル形成ムチンは、ジスルフィドを介したD3ドメインの二量体化によって重合する。
J Mol Biol.
論文で見る
スコープス (23)
PubMed
クロス
グーグル奨学生
ガレゴ P.
ガルシア・ボネテ M.J.
トリヨ-ムヨS.
レクテンワルド C.V.
ヨハンソン M.E.V.
ハンソンG.C.
腸管MUC2ムチンのC末端は、von Willebrand因子や他のゲル形成性ムチンと比較して、余分なジスルフィド結合によって安定化されている。
Nat Commun. 2023; 14: 1969
論文で見る
哺乳類
PubMed
クロス
グーグル奨学生
ティム L.
マドセン F.
ポウルセン S.S.
粘液ゲルの粘弾性特性に及ぼすトレフォイル因子の影響。
Eur J Clin Invest. 2002; 32: 519-527
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
トラヴィングC.
シャウアー R.
シアル酸の構造、機能および代謝。
細胞分子生命科学 1998; 54: 1330-1349
論文で見る
スコープ (349)
PubMed
クロス
グーグル奨学生
スロミアニーB.L.
サロシエクJ.
スロミアニーA.
胃ムチンの粘性と水素イオン透過性における糖質の役割。
Biochem Biophys Res Commun. 1987; 142: 783-790
論文で見る
スコープス (23)
PubMed
クロス
グーグル奨学生
シェン Y.H.
ルーリーR.
リンデン S.K.
ジェフェリー P.L.
ロシュ D.
トラン T.V.
他
MUC13細胞表面ムチンは、上皮細胞のアポトーシスを抑制することにより腸の炎症を防ぐ。
Gut. 2011; 60: 1661-1670
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
シェドン I.N.
任意形状のパンチの軸対称ブシネスク問題における荷重と貫入の関係.
Int J Engng Sci.
論文で見る
スコープス (3500)
クロスリファレンス
グーグル奨学生
マクガッキン M.A.
リンデン S.K.
サットン P.
フローリン T.H.
ムチンの動態と腸内病原体。
Nat Rev Microbiol. 2011; 9: 265-278
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
北田慎一郎
香山秀昭
奥崎大介
古賀理恵子
小林正樹
有馬芳郎
他.
BATF2はTrypanosoma cruzi感染時のIl23a発現を抑制することにより、免疫病理学的Th17応答を抑制する。
J Exp Med. 2017; 214: 1313-1331
論文で見る
スコープス (27)
PubMed
クロス
グーグル奨学生
許 C.C.
奥村理恵子
本岡大介
佐々木理恵子
中村 聡
飯田哲也
他。
炎症性腸疾患モデルマウスにおけるLypd8による大腸炎症の緩和。
Int Immunol. 2021; 33: 359-372
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
エリナフE.
ストローウィグT.
カウ A.L.
ヘナオ・メヒアJ.
タイス C.A.
ブース C.J.
他
NLRP6 インフラマソームは、大腸微生物の生態系と大腸炎のリスクを制御する。
Cell. 2011; 145: 745-757
論文で見る
日本学術振興会特別研究員
PubMed
要旨
全文
全文PDF
グーグル・スカラー
フォースター S.C.
クレア・S.
ベレスフォード-ジョーンズB.S.
ハーコートK.
ノトリー G.
スターズM.D.
他
広く用いられている大腸炎モデルマウスにおける疾患変動と関連する腸内細菌種の同定。
Nat Microbiol. 2022; 7: 590-599
論文で見る
スコープス (12)
PubMed
クロス
グーグル奨学生
松野祐子
齋藤知行
後藤正明
成松秀行
亀山 敦
支持分子マトリックス電気泳動:糖タンパク質の特性解析のための新しいツール.
Anal Chem. 2009; 81: 3816-3823
論文で見る
スコープス (36)
PubMed
クロス
グーグル奨学生
井坂英之
杉浦俊之
橋本和彦
菊田和彦
穴澤宇一
野村卓也
他。
粘表皮癌に発現する腫瘍関連MUC1とその糖鎖の特性解析。
Oncol Lett.
論文で見る
スコープス (1)
PubMed
クロス
グーグル奨学生
小林N.T.
小林直樹, 松崎哲也, 橋世子, 川村恭平, 菅沼正樹, 中林聡, 米山雄一, 大内亮一, 武部武志, 吉川裕之.
AFMを用いた圧痕深さ方向の剛性分布解析により、細胞やオルガノイドの力学的特徴が明らかになった。
Applied Physics Express. 2020; 13
論文で見る
スコープ (0)
クロスレビュー
グーグル奨学生
谷 浩史
李乙。
Kusu T.
奥村理恵子
西村 J.
奥崎D.
et al.
ATP加水分解エクト酵素E-NTPD8は、骨髄系細胞におけるP2X4受容体依存性代謝の調節を介して大腸炎を抑制する。
Proc Natl Acad Sci U S A. 2021; 118
論文で見る
スコパス(3)
クロス
Google Scholar
論文情報
発表履歴
受理 2023年6月7日
改訂版受理 受理:2023年6月7日
受理:2023年6月7日 2022年12月13日
出版段階
インプレス受理原稿
識別
DOI: https://doi.org/10.1016/j.mucimm.2023.06.004
著作権
© 2023 The Author(s). Society for Mucosal Immunologyを代表してElsevier Inc.が発行。
ライセンス
クリエイティブ・コモンズ 表示 - 非営利 - 改変禁止(CC BY-NC-ND 4.0)
再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図1St6galnac6とB3galt5は、大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸上皮における高発現上位5糖転移酵素遺伝子の発現ヒートマップ、各群n = 2マウス(雄1匹、雌1匹)。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸上皮における高発現上位5糖転移酵素遺伝子の発現ヒートマップ、各群n = 2マウス(雄1匹、雌1匹)。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸上皮における高発現上位5糖転移酵素遺伝子の発現ヒートマップ、各群n = 2マウス(雄1匹、雌1匹)。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸上皮における高発現上位5糖転移酵素遺伝子の発現ヒートマップ、各群n = 2マウス(雄1匹、雌1匹)。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸上皮における高発現上位5糖転移酵素遺伝子の発現ヒートマップ、各群n = 2マウス(雄1匹、雌1匹)。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸上皮における高発現上位5糖転移酵素遺伝子の発現ヒートマップ、各群n = 2マウス(雄1匹、雌1匹)。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
図1St6galnac6とB3galt5は大腸におけるジシアリル化糖鎖の生合成に決定的に関与している。(a)遠位結腸上皮における高発現上位5糖転移酵素遺伝子の発現ヒートマップ、各群n = 2マウス(雄1匹、雌1匹)。(b) リアルタイム定量PCR解析。2匹のマウス(雄1匹、雌1匹)の様々な臓器におけるSt6galnac6、B3galt5およびSt6galnac1の発現。MLN:腸間膜リンパ節。(c) ヒトとマウスのジシアリルルイスA(dsLeA)構造のシェーマ。Fuc:フコース、Gal:ガラクトース、GlcNAc: N-アセチルグルコサミン、NeuAc: N-アセチルノイラミン酸。(d) ヒト結腸切片の抗MUC2抗体と抗ジシアリルLewis A抗体(dSLeA)による免疫染色。スケールバー、100μm。DAPI: 4',6-ジアミノ-2-フェニルインドール。(e) Carnoy固定液で固定したマウス結腸切片の抗Muc2抗体と抗ジシアリルLewis A抗体(m-dSLeA)による免疫染色。スケールバー、2000μm(左)、100μm(右)。(f,g)遠位結腸の切片(f)と腹膜で包んだ糞便ペレット(g)を抗Muc2抗体と抗ジシアリルLewis A抗体で染色した代表的な画像。スケールバー、100μm(f)、1000μm(g)。
図2St6galnac6-/-マウスとB3galt5-/-マウスの大腸ムチンはジシアリル化糖鎖を欠く。(a) 野生型(WT)、Muc2-/-、St6galnac6-/-、B3galt5-/-マウスの結腸切片を抗Muc2抗体と抗ジシアリルLewis A (m-dSLeA)抗体で免疫染色した。スケールバーは100μm。(b, c) 抗Muc2抗体(b)と抗ジシアリルLewis A抗体(c)による大腸表面精製ムチンのイムノブロット。(d) WTマウス、St6galnac6-/-マウス、B3galt5-/-マウスの大腸ムチンのMSスペクトルと、タンデムMSで推定した各MSピークの糖鎖構造を示す。GalNAc: N-アセチルガラクトサミン。
図3St6galnac6-/-およびB3galt5-/-マウスは腸炎に非常に罹患しやすい。(a, b) WTマウス(n = 9:雄5匹、雌4匹)またはSt6galnac6-/-マウス(n = 7:雄4匹、雌3匹)に2%DSSを投与した後の体重変化率(a)および疾患活動性指数(DAI)スコア(b)。(c, d) DSS投与開始後8日目のWTマウス(n = 9: 雄5匹、雌4匹)およびSt6galnac6-/-マウス(n = 7: 雄4匹、雌3匹)の結腸切片のヘマトキシリン&エオシン(H&E)染色(c)および組織学的スコア(d)。スケールバー、500μm(上段)および100μm(下段)。(e, f)WTマウス(n = 8:雄5匹、雌3匹)またはB3galt5-/-マウス(n = 8:雄5匹、雌3匹)に2%DSSを投与した後の体重変化率(e)およびDAIスコア(f)。(g, h) DSS投与開始後9日目のWTマウス(n = 8: 雄5匹、雌3匹)およびB3galt5-/-マウス(n = 8: 雄5匹、雌3匹)の結腸切片のH & E染色(g)および組織学的スコア(h)。スケールバー、500μm(上段)および100μm(下段)。データは平均値±SD。グループ間の比較には両側スチューデントのt検定を行った。データは2つの独立した実験からプールした。*p < 0.05, **p < 0.01, ***p < 0.005, ****p < 0.001。
図4IBDに関連するB3GALT5変異体では酵素活性が欠失し、腸の炎症が起こりやすくなっている。(a)B3GALT5エクソン7におけるIBD関連一塩基置換の位置を表すシェーマ。CDS:コード配列。(b) B3GALT5の118番目のアラニンは様々な生物間で保存されている。(c) PyMOLによるB3GALT5の構造モデリング。(d) B3GalT5またはマウス(上)もしくはヒト(下)の変異型B3GalT5を発現させたHEK293T細胞の、抗Siaα2-3Galβ1-3GlcNac抗体を用いたフローサイトメトリー解析。(e) WTおよびB3galt5D116Aマウスの結腸切片を抗Muc2抗体および抗ジシアリルLewis A抗体(m-dSLeA)で免疫染色した。(f-i)WTマウス(n = 5: 雄5匹)またはB3galt5D116Aマウス(n = 5: 雄5匹)に2%DSSを投与した後の体重変化率(f)および疾患活動性指数(DAI)スコア(g)。DSS投与開始後7日目のWTマウス(n = 5: 5匹雄)またはB3galt5D116Aマウス(n = 5: 5匹雄)の結腸切片のH & E染色(h)および組織学的スコア(i)。スケールバー、500μm(上段)および100μm(下段)。データは平均値±SD。グループ間の比較には両側スチューデントのt検定を行った。データは2つの独立した実験からプールした。*p < 0.05, **p < 0.01, ***p < 0.005。
図5Muc2ムチンのシアル化度が低下すると、粘液層は常在細菌に対して透過性になる。(a) WT、St6galnac6-/-、B3galt5-/-マウスの結腸切片の細菌FISHとMuc2染色。スケールバー、100μm。(b) WT、St6galnac6-/-およびB3galt5-/-マウスの遠位結腸における粘液層の厚さを示す(各マウスにつき20点のデータを平均した(n = 7:雄5匹、雌2匹))。(c)WT、St6galnac6-/-およびB3galt5-/-マウスの遠位結腸における管腔内容物(粘液層および細菌)中の粘液層の面積比を示す(n = 7:雄5匹、雌2匹)。データは平均値±SDで示した。一元配置分散分析を用いて群間差の有意性を決定した。*p < 0.05, **p < 0.01, ***p < 0.005, ns: 有意でない。(d) St6galnac6-/-マウスとB3galt5-/-マウスの大腸固有層における細菌の存在を示す。スケールバー、100μm(上段)。上段の白四角で囲まれた部分の高倍率画像を下段に示す。(e, f) 細菌特異的プライマーを用いた大腸組織(e)および腸間膜リンパ節(f)における細菌DNAの定量的PCR。データはWTマウス群と比較した細菌DNA量を示す(n=6:各群オス3匹、メス3匹(e)、n=8:各群オス4匹、メス4匹(f))。データは平均値±SD。一元配置分散分析(e)およびクラスカル・ワリス検定(f)を用いて群間差の有意性を判定した。*p < 0.05, **p < 0.01, ns: 有意でない。(g-l)WT、St6galnac6-/-、B3galt5D116Aマウスの大腸上皮細胞のRNA配列決定(n = 2:各群につき雄1匹、雌1匹)。(g)最も変動が大きい遺伝子(top2000)のヒートマップと階層的クラスタリング。(h) トランスクリプトーム発現の主成分分析。(i) WTマウスとSt6galnac6-/-マウスの大腸上皮細胞におけるトランスクリプトームのボルケーノプロット。(j)St6galnac6-/-マウスの大腸上皮における差次発現遺伝子(DEG)の上流制御因子(p値<10-6)を示す。(k) St6galnac6-/-マウスとB3galt5D116Aマウスに関連するDEGsの上流制御因子(p-value < 10-3)の数を示すベン図。一般的な上流制御因子をSt6galnac6-/-マウスのp値の大きい順に右側に示した。(l)St6galnac6-/-マウスに関連するDEGをもとに、IPAによる下流影響解析で同定された疾患と機能を示す。
図6シアル化度の低下したムチンは電気陰性度が低く、強い硬さを示す。(a)支持分子マトリックス電気泳動(SMME)で分離したWT、St6galnac6-/-、B3galt5-/-マウスの大腸ムチンの比較。参照ムチンとして豚胃ムチン(PGM)を用いた。アルシアンブルーで染色したSMME膜の代表的な画像を示す。(b) ヒートマップは各走査スポットのヤング率(Pa)を示す。(c)WT、St6galnac6-/-、B3galt5-/-マウスの粘液層のヤング率(Pa)(各マウスにつき64-128個のスキャンスポットのデータを平均したもの(n=8:各群につきオス6匹、メス2匹))を、横線が平均値を表すドットプロットで可視化した。群間差の有意性を判定するためにKruskal-Wallis検定を用いた。*p<0.05、ns:有意でない。
図7 St6galnac6-/-マウスとB3galt5-/-マウスでは、ムチンのネットワーク構造が乱れている。(a) WTマウス、St6galnac6-/-マウス、B3galt5-/-マウスの結腸粘膜表面の走査型電子顕微鏡(SEM)像。上段の緑の点線で囲まれた部分は、上皮表面を覆っている粘液を示す。上段の白点で囲まれた部分の高倍率画像を中段に示す。中央の白四角で囲まれた部分の高倍率画像を下段に示す。赤と青の点線で囲まれた領域は、それぞれ線維が密な領域と線維が疎な領域を示す。スケールバーは100μm(上段)、1μm(中段)、100nm(下段)。(b) 繊維配向解析に用いたWT、St6galnac6-/-、B3galt5-/-マウスの粘液層の代表的な画像。オリジナルのSEM画像(上段)、上段の画像からの2値化画像(2段目)、2段目の画像からの2D-FFT画像(3段目)、フーリエ係数の振幅に基づく近似楕円(下段)を示す。スケールバーは100nm。(c)長軸bの平方根を((b):下段)で示した短軸aで割った値を示す(各マウス(n=5:各群オス3匹、メス2匹)あたり5点のデータの平均)。データは平均±SDを表す。一元配置分散分析を用いて群間差の有意性を決定した。**p < 0.01, ***p < 0.005, ns: 有意でない。(d) 大腸粘液中の腸内細菌の代表的なSEM画像を示す。赤い点線は棒状の細菌の向きを示す。青い点線で囲まれた部分は、一方向に整列したムチン・ポリマーのゾーンを示す。青い矢印はムチンポリマーの方向を示す。赤い矢印は、ムチン・ポリマー間の裂け目に入り込んだ棒状細菌を示す。上段の白い四角で囲まれた部分の高倍率画像を下段に示す。スケールバー、5μm(上のパネル)および1μm(下のパネル)。(e)細菌の割合 (i)一方向に整列したムチン・ポリマー(赤)または網目構造を持つムチン(青:円グラフの内側)上に存在し、(ii)ムチン・ポリマーの配向に沿って存在するか否か(中央)、(iii)ムチン・ポリマー間の裂け目に侵入するか否か(外側)。データは遺伝子型不一致マウス(n=7:各群オス5匹、メス2匹)の大腸のSEM画像から得た。
表
表1マウスの糖転移酵素遺伝子
関連論文
ホーム
論文・号外
プレス記事
最新号
号外リスト
執筆者の方へ
執筆許可
研究者アカデミー
原稿を投稿する
ジャーナル情報
ジャーナルについて
アブストラクト/索引付け
採用情報
連絡先
編集委員会
広告主情報
リプリント
新着情報
社会
SMI
その他の定期刊行物
定期刊行物の検索
製品カタログへ
このサイトのコンテンツは医療従事者向けです。
当サイトでは、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
Copyright © 2023 Elsevier Inc.第三者から提供された一部のコンテンツを除く。
プライバシーポリシー
利用規約
アクセシビリティ
ヘルプ&コンタクト
この記事が気に入ったらサポートをしてみませんか?
