結核患者とその家族内接触者におけるB細胞応答の差異と共通性
結核患者とその家族内接触者におけるB細胞応答の差異と共通性
Komal Singh、調査、Rajesh Kumar、調査、[...], and Amita Aggarwal、概念化、資金獲得、プロジェクト管理、資源、監督、検証、執筆 - 査読と編集
論文情報
関連データ
補足資料
データ利用許諾書
要旨
本研究は、「潜在性結核感染症(LTBI)」と「活動性結核疾患」を区別できるB細胞応答を明らかにすることを目的とした。対象は塗抹陽性結核患者(n = 54)とその無病者家庭内接触者(HHC,n = 120)であった。血清は,ELISA法による結核菌膜抗原(MtM)に対する抗体レベル(ΔOD値)の測定と,イムノブロット法による血清反応性MtM抗原の可視化に使用された.全血試料中のB細胞サブセットはフローサイトメトリーで測定した。結核菌の血清では、IgG抗体のレベルがIgMおよびIgAよりも有意に高かったが、IgMおよびIgA抗体のレベルは同程度であった。逆に、HHC血清では、IgM抗体レベルがIgGおよびIgAよりも有意に高値であった。HHCのIgM抗体とIgG抗体の比率も、患者に比べて有意に高かった。イムノブロッティングの結果、MtM抗原の一部(<10、~12および~25 kDa)は結核およびHHC血清と反応したが、他の抗原(~16、~36、~45および~60 kDa)は結核の大部分およびHHC血清の一部と反応した。古典的メモリーB細胞(cMBC、CD19+CD27+)の頻度は、患者よりもHHCで有意に高く、IgG+ cMBCの頻度は、患者よりもHHCで有意に低かった。IgA+ cMBCの頻度は、HHCと患者で同程度であったが、両者ともIgG+ cMBCの頻度より有意に高かった。非定型MBC(aMBC、CD19+CD27-)の頻度もHHCと患者で同等であり、IgG+ aMBCよりも有意に高かった。HHCと患者におけるプラズマブラスト(CD19+CD27++CD38++)の頻度も同程度であった。これらの結果は、IgM/IgG抗体比、選択されたMtM抗原に対する抗体結合、MBCサブセットの相対頻度が、Mtbの初感染後の防御または病原性免疫応答を示す可能性を示唆している。静止型」LTBIにつながる防御を組織化する反応は、結核に対する効果的なワクチン接種戦略の手がかりを提供する可能性がある。
はじめに
2019年には約1,000万人が結核を発症し、140万人が結核で死亡しています[1]。この状況は、治療失敗の発生率の増加と相まって、効果的なワクチンの必要性を再認識しています。細胞媒介免疫(CMI)が結核に対する重要な防御的役割を果たすと考えられていますが、BCGやCMIを標的とする他のワクチンの性能は期待を下回っており[1、2]、免疫系の他の構成要素も重要である可能性が示唆されています。結核菌に対する早期の免疫反応により、感染は「潜伏性結核感染(LTBI)」として知られる無症状状態に制限されます。この反応が有効であることは、潜伏感染者の10%未満が生涯に結核を発症するという事実からも明らかである[3]。したがって、LTBIを支える免疫機構を理解することは、結核に対する防御に関わる構成要素を知る手がかりになるかもしれません。
蓄積された証拠から、B細胞もまた結核に対する防御に重要な役割を果たすことが示唆されている [4, 5]。肺肉芽腫のB細胞は、抗原を処理してT細胞に提示し、抗体を分泌し、炎症を調節することができます[6]。結核感染者は、結核抗原に対する豊富な抗体を循環しており、これらの抗体は、その性質と特異性によって、結核の病因または結核に対する防御に重要な役割を果たすことが示唆されています [6]。結核予防における抗体の役割は、私たち[7, 8]だけでなく、他の人々[9-11]によっても強調されています。私たちは、潜伏感染者の血清中に存在するオプソニン化抗体が、ファゴソームの成熟過程を促進することによって、宿主マクロファージ内でのMtbの生存を制限することを示しました[8]。また、ヒトFcαRIトランスジェニックマウスにおいて、Mtbαクリスタリン抗原に対するヒトIgA抗体とマウスIFN-γの併用による受動免疫により、Mtb感染が抑制されるという興味深い研究結果も報告されている[12]。しかし、自然に産生される抗体のアイソタイプが、感染の経過を調節できるかどうかは明らかでない[4, 13]。
Mtbに対する循環抗体の抗体価は、基礎となる感染症の量子を反映している[6]。しかし、これらの抗体が認識する抗原には、人により大きな違いがあります。ある研究では[15]、結核容疑者の血清はMtbプロテオームの約10%を認識したのに対し、活動性結核患者の抗体反応はプロテオームの約0.5%にとどまりました。この研究および私たちの研究 [7-9, 16] を含む他の研究において、Mtb膜(MtM)はB細胞抗原の主要な構成要素であることが明らかになりました。イムノブロット法は、B細胞抗原を研究するための無仮説的アプローチであり、結核患者やLTBIを含む他の研究グループからの血清によって認識されるMtb抗原を可視化するために、何人かがこれを使用しています[13, 17-21]。しかし、その結果は、主に研究集団や研究プロトコルの違いにより、結論が出ないことがほとんどでした。インドの研究では、Mtbの細胞壁、膜、細胞質でイムノブロッティングを行い、細胞壁と膜が血清反応性抗原の大部分を含んでいることを示した[19]。
免疫学的記憶の形成は、適応免疫の特徴である。古典的記憶B細胞(cMBC)はCD27を発現し、IgGとIgAからなるクラススイッチB細胞受容体(BCRs)からその効力を得ている[22]。しかし、クラススイッチ型MBCのサブセットは、「非定型」MBC(aMBCs)と呼ばれ、CD27を発現していない。aMBCは、体細胞超変異が少なく、増殖が抑えられ、幅広い特異性を持つ抗体を発現する[23]。抗原の再チャレンジにより、MBCはCD27を発現し、CD38を発現する抗体分泌型プラズマブラスト(PB)に分化する[22]。LTBIと活動性結核を区別するB細胞の表現型についてはあまり知られていない。既存の報告は、抗原特異性に関係なく循環B細胞サブセットの頻度を決定するフローサイトメトリーか、選択した抗原に特異的な抗体分泌細胞(ASC)をカウントするELISPOTアッセイに基づくものである。しかし、ASCの数は選択した抗原によって異なる可能性があります[24]。ELISPOT法のもう一つの限界は、MBCをASCに変換するためにin vitroで予め活性化する必要があることである。フローサイトメトリーに基づく研究では、LTBIの方が活動性結核よりもcMBCの頻度が有意に高く、PBの頻度が有意に低いことが判明した [9, 25, 26]。さらに、Zimmermann ら [9] は、PBs が産生する抗体が MtM 抗原を優先的に標的としていることを示した。ELISPOT を用いた研究でも、LTBI では活動性結核よりも抗原特異的 MBC の頻度が高く、PB の頻度が低かった [24, 25, 27]。しかし、クラススイッチされたcMBCやaMBCに関する報告は乏しく、矛盾していることさえある[25, 28]。
利用可能な文献は、B細胞応答が活動性結核疾患とLTBIで異なる調節を受けることを示唆している。しかし、これらの違いの測定可能な結果については、十分に明らかにされていない。これらの違いを再検討するために、我々は塗抹陽性結核患者とその家庭内接触者(HHC)のコホートでこの研究を実施した。塗抹陽性患者のHHCは、塗抹陰性患者や非コンタクト者のHHCよりも培養陽性結核の発症に対するハザード率が高いことが示されている[29]。したがって、これらは、LTBIの静止状態または進行状態に関連するB細胞応答に関する決定的な手がかりを提供すると思われる。我々は、血清中の抗MtM抗体のレベルおよび抗原認識パターン、末梢血中のB細胞のMBCおよびPBサブセットを測定し、結果を示した。
研究方法
倫理規定
研究プロトコルは、Sanjay Gandhi Postgraduate Institute of Medical Sciences(SGPGIMS)、LucknowのInstitutional Ethics Committeeによって承認された[IECコード:2017-197-EMP-99(B)]。参加者全員が書面によるインフォームドコンセントを提供し、本研究はヘルシンキ宣言に準拠して実施された。
研究対象者
研究対象者(n = 174)は、肺結核患者(TB、n = 54)およびその家庭内接触者(HHC、n = 120)のコホートで構成されていた。すべての患者は、WHO [30]で定義された活動性疾患を有し、喀痰塗抹標本で抗酸菌が陽性であった。全員がXpert MTB/RIF assay [31]で確認された薬剤感受性疾患であり、全員がHIV血清陰性であった。HHCは、それぞれの指標となる症例(結核患者)と1年以上同居しており、「結核接触者」の定義に関するWHOの基準を満たし、それを超えていた[32]。以下の条件を満たす対象者は除外した。妊娠中および授乳中の女性、糖尿病などの二次的な免疫不全状態の存在、臓器移植、悪性腫瘍、コルチコステロイドによる治療、結核を示唆する兆候や症状のあるHHCは除外した。
ツベルクリン反応検査
TSTは、IUATLD [33]とWHO [34]の勧告に従って、HHCで実施された。そのため、PPD(Arkray Healthcare, Surat, India)のツベルクリン単位(TU)5個を左前腕に皮内注射した。48~72時間後に硬結の平均径を測定し、10mm以上の硬結を陽性とした。
血液サンプル
血液は、B細胞サブセット測定用にはヘパリンナトリウムチューブ(2 ml)に、抗体測定用にはプレーンチューブ(3 ml)に、標準的な静脈穿刺により採取した。
Mtb抗原
Mtb細胞膜(MtM)は、既報のプロトコルを用いて単離した[35]。簡単に言えば、Lowenstein-Jensen培地上でのMtb(H37Ra株、ATCC 25177)の3週間培養を収穫し、細菌沈殿物を洗浄してPBSに再懸濁した(0.2 g wet wt/ml)。超音波処理により得られた細胞溶解液を遠心分離(23,000g)し、壊れていない細胞と細胞壁の残骸を沈降させた。上清を再遠心分離(150,000g)し、メンブレン(沈殿物)とサイトゾル(上清)を得た。膜を洗浄し、PBSで再構成し、膜タンパク質に適した修正Lowryの方法[16]を用いてタンパク質を推定した。すべてのタンパク質アリコートは、-80 ⁰Cで保存した。品質管理対策として、MPT64抗原のイムノクロマト検出により、Mtbの同一性を定期的に検証した[16]。
ELISA
以前に記載されたプロトコルを、若干の修正を加えて使用した[16]。コーティングバッファー(0-05M炭酸塩、pH9-5)中の抗原(10μg/ml MtMタンパク質)またはコーティングバッファー単独をU底ELISAプレート(Nunc Maxisorp)に分注(50μl/ウェル)し、4℃で一晩インキュベートした。0〜05%Tween20(TBS-T)を含むトリス緩衝生理食塩水(0〜05M Tris、0〜1M NaCl、pH7〜4)で洗浄後、ブロッキング液(TBS-Tに溶解した2%脱脂粉乳、100μl/ウェル)でプレートをインキュベート(90分、37度)した。ブロッキング液を除去した後、試験血清(1%牛乳-TBS-Tで1:500に希釈)を抗原および緩衝液でコートしたウェルに分注し(50μl/ウェル、二重)、インキュベートした(90分、37℃)。その後、プレートをTBS-Tで洗浄し、ヒトIgG、IgAまたはIgMに対するアフィニティー精製ペルオキシダーゼ標識抗体(Sigma)(1%ミルク-TBS-Tで1:4000に希釈)でインキュベート(50μl/ウェル、90分間、37℃)した。最後にプレートをTBS-Tで洗浄し、基質溶液(TMB, Bio Rad)を加え(50μl/ウェル)、室温でインキュベートした(20分、暗所)。7%H2SO4(50μl/well)を加えて反応を停止させた。光学濃度(OD)は、プレートリーダー(BioTek Synergy H1)を用いて450nmで読み取った。各血清について、抗原と緩衝液でコートしたウェルの平均 OD の差を ΔOD として表した。
SDS-PAGEとイムノブロット
SDS-PAGEは、mini Protean-II cell (Bio Rad)を用いて、12.5%分解ゲルで行った。分離した抗原をmini trans-blot cell (Bio Rad)でニトロセルロース紙 (NCP, Millipore)にエレクトロブロットした。抗原(MtM)と分子量マーカー(PAGE Ruler Prestained Protein Ladder, Thermo Scientific, Cat No.26616)を同一ゲル内で並行して走らせた。エレクトロブロッティングの後、抗原に対応する領域をストリップに切り出した。個々のストリップは、以下のようにTBとHHCの血清でプローブされた。ストリップを2% BSA-TBS-T (50 mM Tris, 100 mM NaCl, 0.05% Tween 20; pH 7.4 中の2%ウシ血清アルブミン)でブロックし (2時間, RT)、1% BSA-TBS-T で希釈 (1:100) した血清とインキュベート (2 h, RT) した。TBS-Tで広範囲に洗浄した後、ストリップを、1%BSA-TBS-Tで希釈(1:2000)したヒトIgG(Sigma A3187)に対するアルカリホスファターゼ標識抗体とインキュベート(2時間、RT)した。もう一回洗浄した後、ストリップを基質溶液(BCIP/NBT、Sigma B5655)と共にインキュベートした。発色反応は水洗で停止させた。ブロット画像はImageQuant LAS 500 (GE Healthcare)で取得した。
B細胞サブセットの定量化
以前に記載されたプロトコール[22, 23]に従った。簡単に言うと、血液サンプルは、ヒトCD19(PE-ラベル、クローンSJ25C1、BD)、CD27(APC-ラベル、クローンM-T271、BD)、CD38(PercPCy5.5-ラベル、クローンHIT2、BD)、IgG(PECy7-ラベル、クローンG18-145、BD)およびIgA(FITC-ラベル、クローンM24A、Sigma)への蛍光ラベル抗体の組み合わせとともにインキュベートされた。赤血球を溶解バッファー(BD)で溶解し、約105個のWBCをフローサイトメーター(FACS Canto-II, BD)にて取得した。前方散乱と側方散乱でゲーティングされたリンパ球の中から、CD19染色でB細胞をゲーティングした。データはFloJoソフトウェア(Tree Star)で解析し、以下のB細胞タイプの頻度を決定した:古典的メモリー(CD19+CD27+)、スイッチ古典的メモリー(CD19+CD27+IgA+/IgG+)、異型メモリー(CD19+CD27-IgA+/IgG+)、プラズマブラスト(CD19+CD27++CD38++)。
統計解析
結果は、中央値および四分位範囲(IQR)で示した。データセット間の差は、Wilcoxon Matched pair signed rank test(対のデータの場合)またはMann-Whitney test(非対データの場合)によって計算された。データセット間の相関は、Spearmanのrhoによって計算された。P値<0.05は有意とみなした。すべての統計解析は、GraphPad Prism 7 ソフトウェアを使用して実施した。
結果
被験者の人口統計学的特徴
指標となる症例(結核患者)とそのHHCの人口統計学的特徴を表1にまとめた。すべての患者が活動性で塗抹陽性(Bacterial Index 1+から3+)であり、薬剤耐性結核やHIVとの併存はなかった。HHCはすべて指標患者の近親者(夫/妻/母/父/息子/娘)であり、1年以上同じ世帯に住んでいた。
表1
表1
被験者のベースライン特性
MtM抗原に対する血清抗体レベル
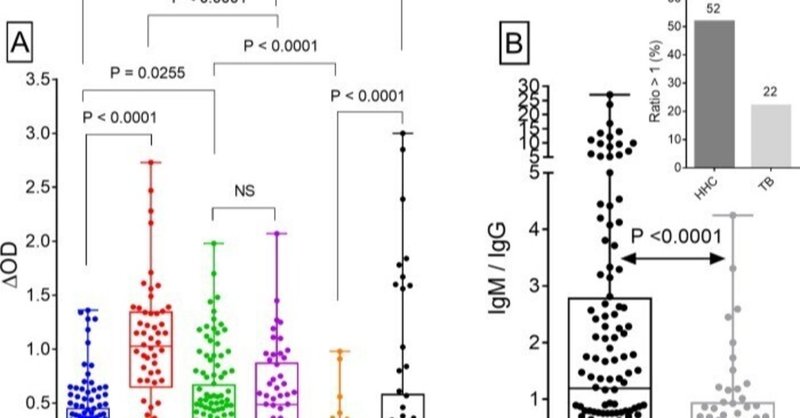
MtMに対する血清IgG、IgMおよびIgA抗体濃度を図1Aに示す。患者(n = 54)では、IgG(中央値ΔOD、IQR:1、0.65-1.3)のレベルは、IgM(0.49、0.24-0.87)またはIgA(0.21、0.13-0.58)レベルよりも有意に高かった。しかし、HHC(n = 120)では、IgM(0.32、0.14-0.67)のレベルがIgG(0.28、0.14-0.45)またはIgA(0.1、0.07-0.14)よりも有意に高いことが示された。IgMと他の2つのIgアイソタイプの関係については、さらに興味深い観察がなされた。HHCと結核患者のIgM抗体レベルは同等であったが、HHCのIgM/IgG比(1.19, 0.53-2.78) は患者の比(0.55, 0.26-0.93; Fig 1B)より有意に高かった。その結果、HHCの52%、結核患者の22%において、この比率は1を超えていた(図1B挿入図)。
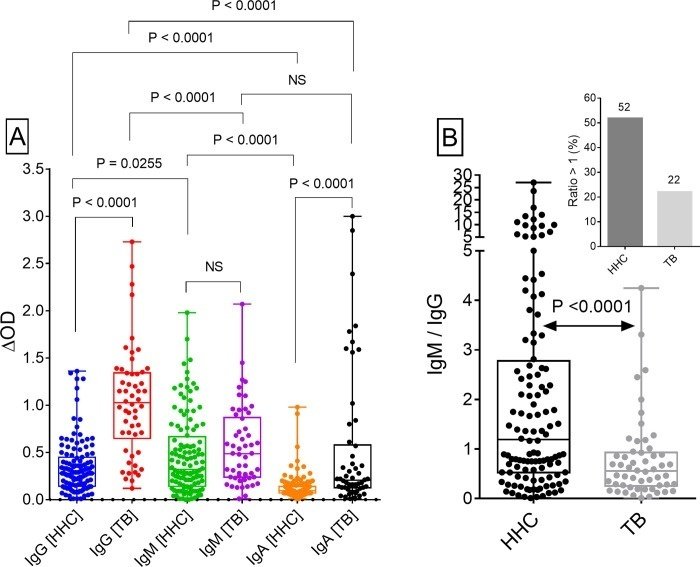
図1
図1
[A] MtM抗原に対するHHCおよび結核患者の血清IgG、IgMおよびIgA抗体反応(ΔOD値)。[B] HHCと結核患者におけるIgM/IgG抗体比。挿入図は、1以上の比率を示した被験者の割合(%)を示す(数字...)。
また、HHCや患者におけるIgMとIgGの抗体レベルには相関がなかったが、他の抗体ペア(IgA vs IgMまたはIgA vs IgG)には有意な相関が見られた(図2)。また、HHCではIgMがIgAより有意に高かったが、患者ではIgMとIgAの抗体価が同等であることも興味深い観察結果であった(図1)。これらの結果から、MtM抗原に対するIgM応答は感染の不顕性期または潜伏期に優勢であり、一方、IgG応答は結核の活動期に優勢であることが示唆された。また、一部の結核患者においては、IgA応答が上昇している可能性がある。
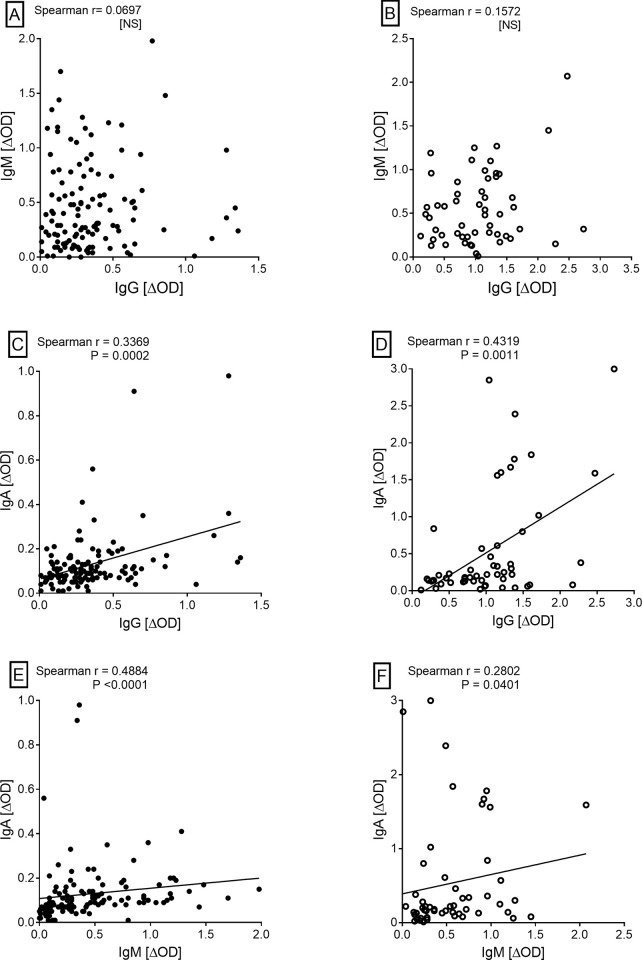
図2
図2
HHC(パネルA、C、E)および結核患者(パネルB、D、F)におけるIgG、IgM、IgA抗体(ΔOD値)の相関関係。SpearmanのrhoとP値は、各XYペアについて示されている。NS、有意ではない(P > 0.05)。
TBおよびHHC血清によるMtM抗原の認識パターン
MtM抗原に対するTBおよびHHC血清の代表的なイムノブロット(各20枚)をFig 3に示した。どの抗原もTBまたはHHC血清にのみ認識されることはなく、個々の血清が認識する抗原の選択には著しいばらつきがあった。それでも、ある種の認識パターンが見て取れた。ほぼすべての血清(TBおよびHHC)は、分子量25kDa(ボックスD)、12kDa(ボックスF)および10kDa未満(ボックスG)の抗原に、強度に差はあるものの、反応することがわかった。一方、60kDa(ボックスA)、45kDa(ボックスB)、36kDa(ボックスC)、16kDa(ボックスE)の範囲の抗原と反応した血清はごく一部であった。興味深いことに、ボックスA、B、CおよびEの抗原は、ほとんどの患者の血清によって認識される以外に、HHCの血清の一部(例えば、血清H1〜H8)によっても認識された。ある種のHHC血清がこれらの抗原に反応しないのは、他の抗原(例えばボックスDとF)には良好な反応性を示したので、全体的に反応性が低いためとは考えにくい。これらの結果から、ある種のMtM抗原はHHCだけでなく結核患者の血清にも認識され、対応する抗体はMtb感染(活動性または潜伏性)のバイオマーカーとして機能することが示唆された。さらに、HHCの血清の一部は、結核の血清と同様の抗原認識パターンを示す可能性がある。
図3
図3
結核菌(n = 20、T1-T20)およびHHC(n = 20、H1-H20)血清のMtM抗原に対する比較イムノブロット解析。
末梢血中のB細胞サブセットの頻度
古典的MBC(cMBC、CD19+CD27+)、クラススイッチcMBC(CD19+CD27+IgA+/IgG+)、非典型MBC(aMBC、CD19+CD27-IgA+/IgG+)およびプラズマ芽球(PBs, CD19+CD27++CD38++)を、図4に示すゲーティング戦略でフローサイトメトリーにより測定した。
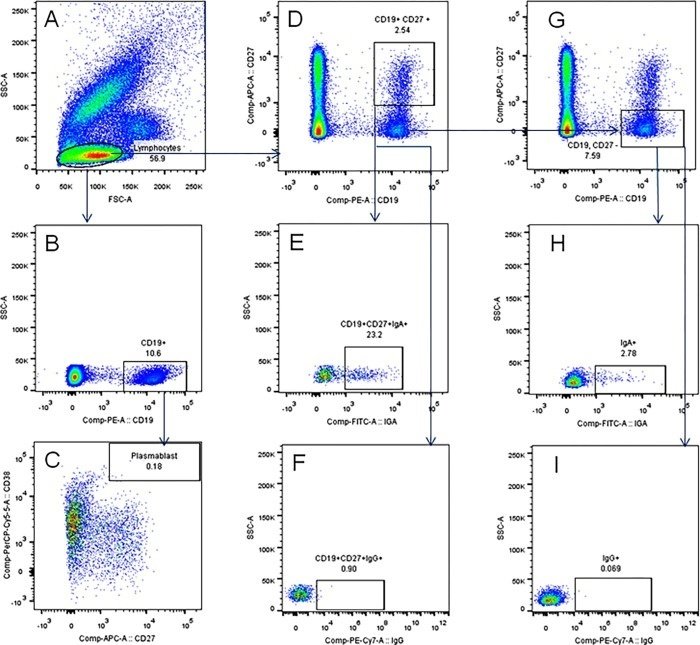
図4
図4
全血中のB細胞サブセットの同定。
HHCのリンパ球のうちcMBCの頻度(中央値、IQR: 1.8, 1.2-2.6) は、患者(0.95, 0.52-1.7) に比べて有意に高かった(Fig 5A)。逆に、HHCのcMBCのうちIgG+ cMBCの頻度(1.6, 0.92-2.8) は、患者(3, 1.9-5.1) に比べ有意に低かった。HHCにおけるIgA+ cMBCの頻度(22、12-28)と結核患者(24、9-38)は同等であり、B細胞中のプラズマブラストの頻度(HHCでは0.14、0.08-0.26、結核では0.23、0.06-0.45)も同じであった。しかし、IgA+ cMBCの頻度は、HHCと結核患者で、IgG+ cMBCの頻度よりも有意に高かったことが印象的であった。
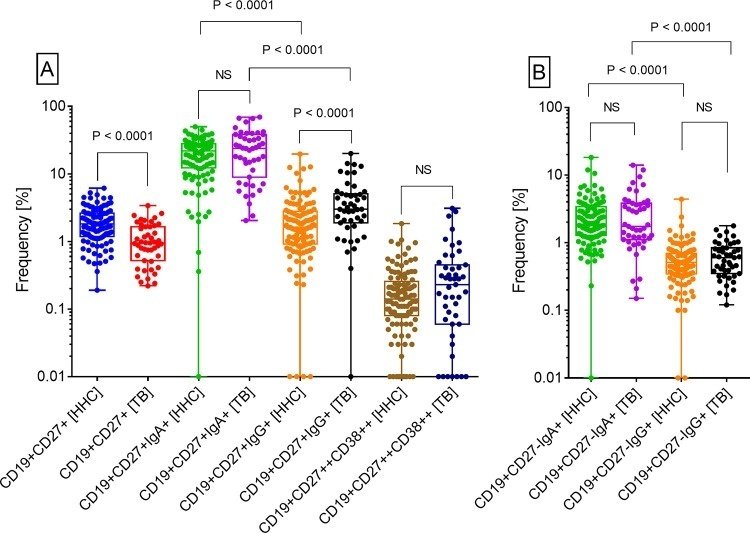
図5
図5
結核患者(結核、n=47)とその家庭内接触者(HHC、n=113)の末梢血におけるB細胞サブセットの頻度。
HHCと結核患者のCD19+CD27- B細胞におけるaMBC(IgA+またはIgG+)の頻度に有意な差はなかった。しかし、cMBCの場合と同様に、HHCおよび患者におけるIgA+ aMBCの頻度は、対応するIgG+ aMBCの頻度より有意に高かった(図5B)。両カテゴリーとも、IgA+ cMBCとIgA+ aMBCの間に有意な相関が見られた。しかし、IgG+ MBCについては、いずれのカテゴリーでもそのような相関は見られなかった(図6)。
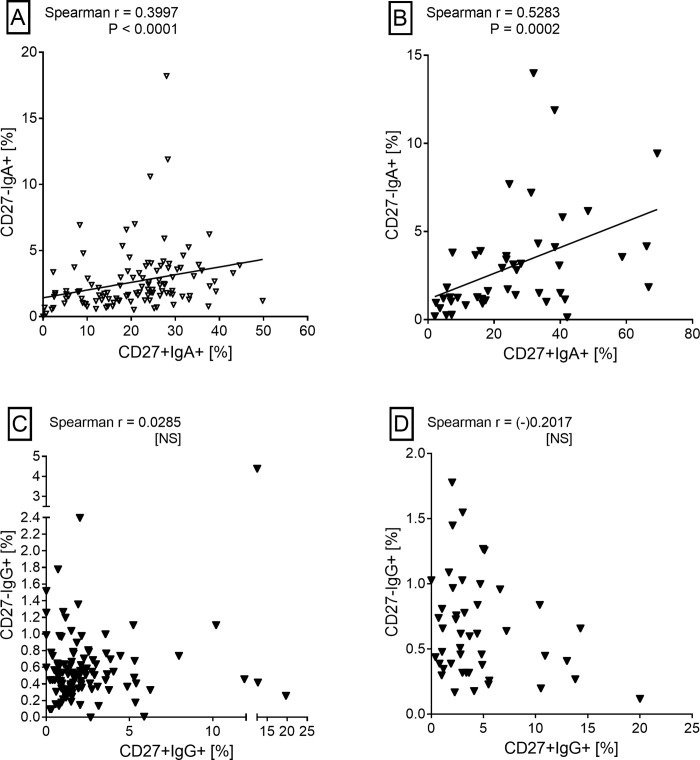
図6
図6
B細胞サブセット間の相関
これらの結果は、明らかに基礎となる感染症の量子に関連していた。結核患者では、HHCに比べてcMBCの頻度が相対的に低いのは、クラススイッチされたcMBCの頻度が高いためであると思われる。逆に、感染症がない場合、HHCはcMBCの頻度が高く、他のB細胞タイプの頻度が低いことが示された。
ツベルクリン反応とB細胞反応との関係
TST陽性(皮膚硬結10mm以上)は、HHCの45%に見られた(表1)。S1 Figから明らかなように、TST反応と抗体アイソタイプのレベルや様々なB細胞サブセットの頻度との間には関連はなかった。この結果は、細胞性免疫と体液性免疫の不一致を反映している。
考察
近年、結核菌の自然感染や結核ワクチンの予後を予測する免疫学的バイオマーカーの探索が、B細胞にスポットライトを当てている[4, 5]。本研究は、世界の結核患者の4分の1以上が居住するインドの結核患者とその家庭内連絡者を対象に実施された[1]。我々は、塗抹陽性患者のHHCは、Mtbの不顕性感染後の防御や発症に関与する免疫機構を知る上で最も適切な個人であると推論している。インドの画期的な研究 [29] では、培養陽性結核の年間発生率(10万人当たり)は、塗抹陽性患者のHHCでは526、塗抹陰性患者のHHCでは271、非接触者では198であった。我々のHHCにおけるTST陽性率は、インドの先行研究 [36, 37] で報告されたものと同等であった。理由は完全には解明されていないが、活動性結核患者に長期間持続的に接触しても、TSTやIGRA(インターフェロンガンマ放出アッセイ)に反応しない人がかなりの割合で存在する[38]。一方、結核流行地の一見健康な住民の血清には、高レベル(最大96%の陽性)のMtb特異的抗体が認められる[38, 39]。この研究でも、B細胞反応とT細胞反応(TSTで表される後者)の間に関連性がないことに注目し、地域社会におけるLTBIの有病率が推定されているよりもはるかに高い可能性を示唆した [3, 37]。
抗MtM抗体のレベルは、結核患者でIgGクラス、HHCでIgMクラスが最も高かった。もう一つの注目すべき点は、患者の一部でIgA抗体のレベルが高く、IgAとIgMのレベルの比較可能性につながっていることである。結核患者におけるIgG抗体の高値は、いくつかの研究で報告されており、感染の負荷を反映していると考えられている[6, 14, 15]。また、ある種のMtb抗原に対する高いIgA値も報告されている[40]。LTBIにおける優勢なIgM応答は、我々だけでなく他の研究者によっても以前に報告されている。私たちは、Mtbに暴露された健康なインド人被験者で高い抗MtM IgMレベルを示した[16]。別の研究では、LTBIの被験者はMtB溶解液の抗原(MtMを含む)に対して高いIgMレベルを保持していた[41]。さらに別の研究では、空洞性結核患者の接触者は、Mtb培養濾液抗原に対して高いIgMレベルを有していた[42]。これらの研究は、HHCにおけるIgM反応の優位性は、Mtb抗原の性質に依存しないことを示唆している。これらの結果は、基本的に空気感染であるMtb感染の自然経過との関連で考察することが適切であろう。例えば、HHCにおけるMtbへの最初の曝露は、体液性免疫反応において最初に放出される抗体であるIgMの産生を引き起こすと思われる。リンパ系器官の形質細胞から放出された後、IgMは分泌型IgM(sIgM)として粘膜分泌物に入り [43] 、感染負荷の増加の結果、sIgAの生産が徐々に優勢になるまで、感染初期段階での保護を提供すると考えられる [44](※1) 。IgGは下気道ではIgAよりも豊富であり、上気道では感染の増加とともにその濃度が上昇する。おそらく、IgGもsIgAやsIgMと協調して気道で防御機能を発揮しているのであろう[43]。粘膜と全身の免疫領域は相互に排他的ではなく、細胞、抗体、抗原は血液やリンパ液を介して一方から他方へ移動することが可能である。正規のT依存性B細胞反応によって産生された抗原特異的抗体は、オプソニン化とそれに続く貪食によって細菌の排除を促進することができる[8, 9]。この研究および以前の研究の結果は、感染負荷の増大とともに、抗体反応がIgM型からIgG型に移行する可能性を示唆している。この印象は、IgMとIgGの抗体レベルに相関がなく、HHCのIgM/IgG比が患者よりも有意に高いことからも裏付けられている。同様の所見は別の研究でも報告されており[41]、HHCにおけるIgM/IgG抗体比の漸減は、感染レベルの上昇を示す可能性があることが示唆された。
免疫ブロッティングによって決定された興味のあるMtM抗原は、2つのカテゴリーに分類された。すなわち、強度に差はあるものの、検査したすべての血清(TBおよびHHC)によって認識されるもの(例えば、<10、〜12および〜25 kDa)と、ほぼすべてのTB血清およびHHC血清のサブセットによって認識されるもの(例えば、〜16、〜36、〜45および〜60 kDa)であった。これまでの研究でも、これらの抗原は結核菌の主要な血清反応性抗原として同定されているが、それぞれの研究結果は異なっている[13, 17-21]. 本研究と過去の研究との間の不一致にはいくつかの理由が考えられる。最も可能性の高い理由は、我々は塗抹陽性者のみを対象としてHHCを研究しているので、研究対象者の人口統計学の違いであろう。もう一つの理由は、イムノブロット分析に使用したMtb抗原の性質である。ほとんどの研究では、全細胞溶解液または培養濾液の抗原が使用されているが、インドからの研究[19]では、MtM抗原も検討されている。さらに、いくつかの研究[13, 17, 21]では、タンパク質は使用前に塩漬けされていた。また、抗原が可視化される分子量の範囲も様々で、3-45 kDa [21], 20-97 kDa [20] または≥12 kDa [19] とされている。このイムノブロットの結果は、2つの重要な意味をもっている。第一に、選択されたMtM抗原に対する血清反応性に基づいて、Mtb感染(活動性または潜伏性)を検出することが可能であることである。第二に、結核患者に類似した抗原認識パターンを示すHHCは、高い感染負担を抱えている可能性がある。潜伏結核から活動性結核への移行は、細菌抗原の発現の量的変化だけでなく質的な変化を伴うと考えられている[15]。
古典的なMBC(CD27+ B細胞)の頻度は、患者よりもHHCの方が有意に高かった。cMBCは、クラススイッチ型cMBCの前駆体であり、抗原の再チャレンジにより速やかに抗体分泌細胞に変化するため、真のMBCとみなされる。IgG+ cMBCは、スイッチドcMBCの最も顕著なサブセットと考えられている[45]。したがって、患者におけるIgG+ cMBCの頻度は、HHCよりも有意に高いことも明らかになった。結核やHHCにおけるIgG+ MBCの頻度について、先行研究はない。しかし、Ashenafiら[26]は、LTBIよりも活動性結核におけるIgG+ PBsの頻度が有意に高いことを報告している。注目すべきは、HHCおよび患者におけるIgA+ cMBCの頻度が、IgG+ cMBCよりも有意に高かったことである。Soeら[25]も、結核患者についてこの解析を行っていないが、LTBIの被験者ではIgA+ cMBCがIgG+ cMBCより有意に高いことを示している。Mtb感染は空気感染であり、気道反応は通常IgAに偏っている[44]。したがって、感染初期にIgA+ cMBCが有意に増加することは、感染の拡大を防ぐ上で重要な役割を果たす可能性がある[9]。また、粘膜免疫反応中に生成されたIgA+ MBCが、肺から末梢に移動する可能性もある[9]。定常状態では、末梢血中のIgA+ cMBCの大部分は、粘膜ホーミング受容体CCR10およびα4β7を共発現しており、粘膜免疫反応から発生したことを示唆している[46]。IgA+ cMBCsに見られるように、HHCおよび結核患者におけるIgA+非定型MBCsの頻度も、対応するIgG+ aMBCsより有意に高かった。さらに、両研究グループにおいて、IgA+ cMBCとIgA+ aMBCの間に有意な相関が見られた。IgA+ aMBCは、T非依存性B細胞反応から生じ、その産生する抗体は細菌の糖鎖とプロミスクに結合することが示されている[47]。Mtbの細胞エンベロープには、そのような複合糖質が豊富に含まれているため [48] 、IgA+ aMBCは、IgA+ cMBCとともに、Mtbに対する粘膜防御機構の一部であると考えられる [22](※1) 。IgG+ aMBCの役割に関する重要な情報は得られていないが、これらも粘膜免疫監視機構の一部である可能性がある[22, 49]。以前の研究では、結核のPBsの頻度がLTBIよりも有意に高いことが示されていたが、我々はHHCと結核患者のPBsの頻度に有意差を見いだせなかった[9]。この不一致の最もありそうな理由は、我々の研究では、より大規模なコホートを使用したことと、HHCのMtb感染への曝露が比較的多かったことであろう。
我々の研究にはいくつかの重要な限界がある。第一に、横断的な研究のため、LTBIの持続または再活性化を示唆するB細胞応答を検証することができなかった。この点に関して何らかの決定的な結論を出すには、数年の追跡期間にわたって十分に大規模なコホートを対象とした縦断的研究が必要である[29]。第二に、我々の目的は、一般に真のB細胞記憶とみなされる主要なクラススイッチ型(IgG+およびIgA+)MBCをプロファイルすることだったので、「IgMのみ」(IgM+IgD-)MBCの頻度を決定していない[45]。IgMのみ」の記憶もまた、さらなるクラススイッチの可能な「プレスイッチ」状態であると考えられている[22]。IgMのみのMBCに関する研究は、IgM+IgD-とIgM+IgD+のサブセットが必ずしも分離されていないことと、IgD-集団がしばしば細分化されていないことの2点が障害となっている[23]。そのため、クラススイッチB細胞とIgM+メモリーB細胞が混在している。Du Plessisら [50] は、IgM+ cMBCとIgM+ PBの頻度が、治療済みの結核患者および対照者よりも未治療の結核患者で有意に高いことを明らかにした。しかし、著者らはIgM+およびIgM- B細胞のみに着目していた。IgM-細胞の免疫グロブリンのアイソタイプは明らかにされていない。また、IgM+細胞がIgDを共発現しているかどうかも明らかにされていない。
結論として、本研究は塗抹陽性結核患者とその家庭内接触者のB細胞反応の相違点と類似点を明らかにした。例えば、IgM抗体とIgG抗体の比率、選択抗原に対する抗体結合、メモリーB細胞とスイッチメモリーB細胞の相対頻度などが、Mtbの初感染後の防御的あるいは病原的免疫反応の指標となり得ることが示唆された。また、この研究は、粘膜免疫の誘発が結核に対するワクチンの重要な目標になり得るという見解を支持するものである[51]。
参考資料
S1 生画像
Fig 3.の未処理のオリジナル画像。
(PDF)
追加データファイルはこちら(535K, pdf)
S1 図
ツベルクリン反応とB細胞反応との関係。
(PDF)
追加データファイルはこちら(705K, pdf)
S1 表
図1、,2,2、,55、,66の生データ。
(PDF)
追加データファイルはこちら(741K, pdf)
謝辞
本研究への参加に同意していただいた患者さんとそのご家族に感謝します。
資金提供について
本研究は、インド医学研究評議会(icmr.gov.in)のAAへのアドホック研究助成金(No. 5/8/5/60/ITRC/adhoc/2018/ECD-1)により行われたものである。資金提供者は、研究デザイン、データ収集と分析、発表の決定、原稿の作成に関与していない。
データの利用可能性
すべての関連データは、論文およびそのSupporting Informationファイル内にあります。
論文情報
PLoS One. 2022; 17(10): e0276610.
2022年10月25日オンライン公開 doi: 10.1371/journal.pone.0276610
PMCID: PMC9595562
PMID: 36282846
Komal Singh、調査、1 Rajesh Kumar、調査、1 Fareha Umam、調査、1 Prerna Kapoor、調査、2 Sudhir Sinha、概念化、データキュレーション、形式分析、方法論、プロジェクト管理、リソース、監督、可視化、執筆 - 原案、対応著者1 ,* および Amita Aggarwal、概念化、資金獲得、プロジェクト管理、リソース、監督、検証、執筆 - レビューと編集対応著者1 ,* 。
Juraj Ivanyi 編集
1 Sanjay Gandhi Postgraduate Institute of Medical Sciences, Lucknow, India 臨床免疫学・リウマチ学部門
2 DOTSセンター、Sanjay Gandhi Postgraduate Institute of Medical Sciences、インド、ラクナウ
キングス・カレッジ・ロンドン、イギリス
corresponding authorCorresponding author.
競合する利益 著者は、競合する利害関係が存在しないことを宣言している。
E-mail: moc.liamg@atima.aa (AA); moc.liamg@rihdus.ahnis (SS)
2022年9月6日受領; 2022年10月11日受理.
著作権 © 2022 Singh et al
本論文は、Creative Commons Attribution Licenseの条件の下で配布されるオープンアクセス論文であり、原著者と出典を明記することを条件に、いかなる媒体においても無制限の使用、配布、複製を許可するものです。
PLOS ONEからの記事は、PLOSの好意によりここに提供されています。
参考文献
世界保健機関(WHO). 世界結核レポート2020. [Google Scholar].
Tameris MD, Hatherill M, Landry BS, Scriba TJ, Snowden MA, Lockhart S, et al. BCG接種済みの乳児における新しい結核ワクチンMVA85Aの安全性と有効性:無作為化プラセボ対照第2b相試験. Lancet 2013; 381:1021-8. doi: 10.1016/S0140-6736(13)60177-4 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Getahun H, Matteelli A, Chaisson RE, Raviglione M. Latent Mycobacterium tuberculosis infection(結核菌の潜伏感染). N Engl J Med. 2015; 372: 2127-35. doi: 10.1056/NEJMra1405427 [PubMed] [CrossRef] [Google Scholar].
Jacobs AJ, Mongkolsapaya J, Screaton GR, McShane H, Wilkinson RJ.(ジェイコブスAJ、モンコルサパヤJ、スクレイトンGR、マクシェーンH、ウィルキンソンRJ)。抗体と結核。Tuberculosis (Edinb) 2016; 101:102-113. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ロクストンAG. 結核におけるB細胞とその制御機能。潜伏期と活動性疾患。Mol Immunol. 2019; 111: 145-151. doi: 10.1016/j.molimm.2019.04.012 [PubMed] [CrossRef] [Google Scholar].
Rao M, Valentini D, Poiret T, Dodoo E, Parida S, Zumla A, et al. B in TB: B cells as mediators of clinically relevant Immune responses in tuberculosis.結核における臨床的関連性のある免疫反応のメディエーターとしてのB細胞。Clin Infect Dis. 2015; 61 (Suppl 3): S225-34. doi: 10.1093/cid/civ614 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Gaikwad AN, Sinha S. Determinants of natural immunity against tuberculosis in an endemic setting: factors operating at the level of macrophage- Mycobacterium tuberculosis interaction(流行地における結核に対する自然免疫の決定要因:マクロファージと結核菌の相互作用のレベルで働く要因)。Clin Exp Immunol. 2008; 151: 414. doi: 10.1111/j.1365-2249.2007.03585.x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Kumar SK, Singh P, Sinha S. Naturally produced opsonizing antibodies restricting the Mycobacterium tuberculosis in human macrophages by augmenting phagosome maturation.天然に産生されたオプソニン化抗体は、ヒトマクロファージの結核菌の生存を制限する。Open Biol, 2015; 5: 150171. doi: 10.1098/rsob.150171 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Zimmermann N, Thormann V, Hu B, Köhler AB, Imai-Matsushima A, Locht C, et al. Human isotype-dependent inhibitory antibody responses against Mycobacterium tuberculosis(結核菌に対するヒトのアイソタイプ依存的抑制抗体反応). EMBO Mol Med. 2016; 8: 1325-1339. doi: 10.15252/emmm.201606330 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Li H, Wang XX, Wang B, Fu L, Liu G, Lu Y, et al. 結核に曝露された潜伏感染者および非感染者の医療従事者は結核菌に対する防御抗体を作る. Proc Natl Acad Sci U S A 2017; 114: 5023-8. doi: 10.1073/pnas.1611776114 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Watson A, Li H, Ma B, Weiss R, Bendayan D, Abramovitz L, et al. Mycobacterium transporter proteinを標的とするヒト抗体は結核に対する防御を媒介する. Nat Commun. 2021; 12:602. doi: 10.1038/s41467-021-20930-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Balu S, Reljic R, Lewis MJ, Pleass RJ, McIntosh R, van Kooten C, et al. A novel human IgA monoclonal antibody protects against tuberculosis. J Immunol. 2011; 186: 3113-9. doi: 10.4049/jimmunol.1003189 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sánchez-Rodríguez C, Estrada-Chávez C, García-Vigil J, Laredo-Sánchez F, Halabe-Cherem J, Pereira-Suárez A, et al. メキシコのトトナカ族の肺結核で抗原 85 複合体の IgG 抗体応答は良い予後に関連していること。Int J Tuberc Lung Dis. 2002; 6:706-12. [PubMed] [Google Scholar].
Lyashchenko K, Colangeli R, Houde M, Jahdali HA, Menzies D, Gennaro ML. 結核における不均一な抗体反応。Infect Immun 1998; 66: 3936-3940. doi: 10.1128/IAI.66.8.3936-3940.1998 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Kunnath-Velayudhan S, Salamon H, Wang HY, Davidow AL, Molina DM, Huynh VT, et al. Dynamic antibody responses to the Mycobacterium tuberculosis proteome(結核菌プロテオームに対する動的抗体反応). Proc Natl Acad Sci USA 2010; 107: 14703-14708. doi: 10.1073/pnas.1009080107 [PMCフリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Kumar SK, Arya S, Aggarwal A, Kapoor P, Nath A, Misra R, et al. αクリスタリンを含む結核菌膜関連抗原に対する免疫応答は、潜在感染と活動性結核疾患を識別できる可能性があること。PLoS ONE 2020; 15: e0228359. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Espitia C, Cervera I, González R, Mancilla R. A 38-kD Mycobacterium tuberculosis antigen associated with infection.Its isolation and serologic evaluation.A 38-kD結核菌抗原の分離と血清評価。その分離と血清学的評価。臨床 Exp Immunol 1989; 77: 373-7. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Verbon A, Kuijper S, Jansen HM, Speelman P, Kolk AH. 結核菌の培養上清中の抗原:モノクローナル抗体とヒト抗体によって定義されたエピトープ。J Gen Microbiol 1990; 136: 955-64. doi: 10.1099/00221287-136-5-955 [PubMed] [CrossRef] [Google Scholar].
Das S, Narayanan S, Paramasivan CN, Lowrie DB, Narayanan PR. ヒト結核血清は、結核菌の微粒子画分に対して顕著な抗体反応を示す。J Clin Immunol. 1991. Mar;11(2):74-7. doi: 10.1007/BF00917743 [PubMed] [CrossRef] [Google Scholar].
結核と肺疾患の国際ジャーナル2001; 5: 958-962。[PubMed][Google Scholar].
Beck ST, Leite OM, Arruda RS, Ferreira AW. 結核患者および接触者による結核菌の低分子量抗原に対する体液性応答。ブラジル J Med Biol Res. 2005; 38: 587-96. doi: 10.1590/s0100-879x2005000400013 [PubMed] [CrossRef] [Google Scholar].
Sanz I, Wei C, Jenks SA, Cashman KS, Tipton C, Woodruff MC, et al. Human B Cell and Plasma Cell Populationsの一貫した分類に対する挑戦と機会(Challenges and Opportunities for Consistent Classification of Human B Cell and Plasma Cell Populations. Front Immunol. 2019; 10: 2458. doi: 10.3389/fimmu.2019.02458 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Berkowska MA, Driessen GJ, Bikos V, Grosserichter-Wagener C, Stamatopoulos K, Cerutti A, et al. Human memory B cells originate from three distinct germinal center-dependent and -independent maturation pathways.ヒトメモリーB細胞の成熟経路は、胚中心依存性及び非依存性である。Blood 2011; 118: 2150-8. doi: 10.1182/blood-2011-04-345579 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Gindeh A, Owolabi O, Donkor S, Sutherland JS. Mycobacterium tuberculosis-specific plasmablast levels are differentially modulated in tuberculosis infection and disease(結核感染と疾病における結核菌特異的プラスマブラストレベルの調節)。Tuberculosis (Edinb) 2020. S; 124:101978. doi: 10.1016/j.tube.2020.101978 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Soe PT, Hanthamrongwit J, Saelee C, Kyaw SP, Khaenam P, Warit S, et al. 活動性および潜在性結核における結核休眠関連抗原 Rv2659c および Rv3128c に対する循環性 IgA/IgG メモリ B 細胞。Int J Infect Dis. 2021; 110:75-82. doi: 10.1016/j.ijid.2021.07.033 [PubMed] [CrossRef] [Google Scholar].
Ashenafi S, Aderaye G, Zewdie M, Raqib R, Bekele A, Magalhaes I, et al. BCG特異的IgG分泌末梢プラズマブラストはHIV陰性およびHIV陽性患者における活動性結核の潜在的バイオマーカとして. Thorax 2013; 68:269-76. doi: 10.1136/thoraxjnl-2012-201817 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Sebina I, Biraro IA, Dockrell HM, Elliott AM, Cose S. Circulating B-lymphocytes as potential biomarkers of tuberculosis infection activity.(結核感染活動の潜在的バイオマーカーとしての循環Bリンパ球)。PLoS One 2014; 9: e106796. doi: 10.1371/journal.pone.0106796 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Joosten SA, van Meijgaarden KE, Del Nonno F, Baiocchini A, Petrone L, Vanini V, et al. 結核患者は機能不全の循環B細胞コンパートメントを持ち、それは治療成功後に正常化する。PLoS Pathog 2016; 12:e1005687. doi: 10.1371/journal.ppat.1005687 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
結核研究センター. 摂取時に家に結核患者がいる世帯員の結核発症の追加リスク:15年間の研究。Int J Tuberc Lung Dis 11: 282-288. [PubMed] [Google Scholar].
世界保健機関. 結核の定義と報告の枠組み。2013a. [Google Scholar].
世界保健機関(WHO). 結核とリファンピシン耐性を迅速かつ同時に検出するための自動化リアルタイム核酸増幅技術。Xpert MTB/RIF assay for the diagnosis of pulmonary and extrapulmonary TB in adults and children: policy update. 2013b. [PubMed] [Google Scholar].
世界保健機関. 世界保健機関(WHO):低・中所得国における感染性結核患者の接触者調査のための推奨事項。2012. [PubMed][Google Scholar].
Rieder HL, Chadha VK, Nagelkerke NJD, van Leth F, van der Werf MJ. 高蔓延国での皮膚テスト調査実施のためのガイドライン。Int J Tuberc Lung Dis 2011; 15:S1-S25. [PubMed] [Google Scholar].
世界保健機関. 潜在性結核感染症:プログラム管理のための更新および統合ガイドライン。2018. [PubMed][Google Scholar].
Sinha S, Kosalai K, Arora S, Namane A, Sharma P, Gaikwad AN, et al. Immunogenic membrane-associated proteins of Mycobacterium tuberculosis revealed by proteomics.(プロテオミクスによって明らかになった結核菌の免疫原性膜関連タンパク質). Microbiology 2005; 151:2411-19. doi: 10.1099/mic.0.27799-0 [PubMed] [CrossRef] [Google Scholar].
このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。Trans R Soc Trop Med Hyg, 2017; 111: 55-61. doi: 10.1093/trstmh/trx016 [PubMed] [CrossRef] [Google Scholar].
Arya S, Kumar SK, Nath A, Kapoor P, Aggarwal A, Misra R, et al. Synergy between tuberculin skin test and proliferative T cell responses to PPD or cell-membrane antigens of Mycobacterium tuberculosis for detection of latent TB infection in a high disease-burden setting.結核感染症潜伏の検出におけるツベルクリン皮膚反応と増殖性T細胞反応との相乗効果。PLoS One 2018; 13: e0204429. doi: 10.1371/journal.pone.0204429 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Lu LL, Smith MT, Yu KKQ, Luedemann C, Suscovich TJ, Grace PS, et al. IFN-γ-independent immune markers of Mycobacterium tuberculosis exposure(結核菌曝露のIFN-γ-独立した免疫マーカー)。Nature Med 2019; 25: 977-987. doi: 10.1038/s41591-019-0441-3 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Hoff ST, Abebe M, Ravn P, Range N, Malenganisho W, Rodriques DS, et al. タンザニア、エチオピア、ブラジル、デンマークの異なる曝露レベルの集団における結核菌特異的抗体反応の評価。Clin Infect Dis 2007; 45:575-582. doi: 10.1086/520662 [PubMed] [CrossRef] [Google Scholar].
Talavera-Paulín M, García-Morales L, Ruíz-Sánchez BP, Caamal-Ley ÁD, Hernández-Solis A, Ramírez-Casanova E, et al. 活動中の結核患者は、IgA 抗α-クリスタリンおよびイソクエン酸リアーゼ蛋白質が高値になることがわかった。Int J Tuberc Lung Dis. 2016; 20:1681-1688. doi: 10.5588/ijtld.16.0250 [PubMed] [CrossRef] [Google Scholar].
Perley CC, Frahm M, Click EM, Dobos KM, Ferrari G, Stout JE, et al. The human antibody response to the surface of Mycobacterium tuberculosis.(結核菌の表面に対するヒト抗体反応). PLoS One. 2014; 11; 9: e98938. doi: 10.1371/journal.pone.0098938 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
結核患者および健康な家庭内接触者における分泌抗原に対する抗体アイソタイプおよび免疫グロブリンGサブクラス反応の選択的増加。Clin Diag Lab Immunol 1995; 2:726-732. doi: 10.1128/cdli.2.6.726-732.1995 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Chen K, Magri G, Grasset EK, Cerutti A. 粘膜抗体反応の再考。IgM、IgG、IgDがIgAに加わる。Nat Rev Immunol. 2020; 20: 427-441. doi: 10.1038/s41577-019-0261-1 [PubMed] [CrossRef] [Google Scholar].
Bemark M, Angeletti D. Know your enemy or find your friend?-Induction of IgA at mucosal surfaces. Immunol Rev. 2021; 303: 83-102. doi: 10.1111/imr.13014 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Engels N, Wienands J. B細胞抗原受容体による記憶制御. Immunol Rev 2018; 283: 150-160. doi: 10.1111/imr.12651 [PubMed] [CrossRef] [Google Scholar].
Mei HE, Yoshida T, Sime W, Hiepe F, Thiele K, Manz RA, et al. Blood-borne human plasma cells in steady state are derived from mucosal immune responses. Blood 2009; 113: 2461-9. doi: 10.1182/blood-2008-04-153544 [PubMed] [CrossRef] [Google Scholar].
Berkowska MA, Schickel JN, Grosserichter-Wagener C, de Ridder D, Ng YS, van Dongen JJ, et al. Circulating Human CD27-IgA+ Memory B Cells Recognize Bacteria with Polyreactive Igs(血中CD27-IgA+メモリーB細胞は、多価イグを持つバクテリアを認識する。J Immunol. 2015; 195: 1417-26. doi: 10.4049/jimmunol.1402708 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Batt SM, Minnikin DE, Besra GS. マイコバクテリアの厚いワックス状の被膜、抗生物質と宿主の免疫システムに対する保護層。Biochem J. 2020; 477: 1983-06. doi: 10.1042/BCJ20200194 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Fecteau JF, Côté G, Néron S. A new memory CD27-IgG+ B cell population in peripheral blood expressing VH genes with low frequency of somatic mutation. J Immunol 2006; 177: 3728-36. doi: 10.4049/jimmunol.177.6.3728 [PubMed] [CrossRef] [Google Scholar].
du Plessis WJ, Keyser A, Walzl G, Loxton AG. 結核菌感染時および疾患時の末梢B細胞集団の表現型解析。J Inflamm (Lond). 2016; 13:23. doi: 10.1186/s12950-016-0133-4 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Stylianou E, Paul MJ, Reljic R, McShane H. Mucosal delivery of tuberculosis vaccines: a review of current approaches and challenges. Expert Rev Vaccines. 2019; 18:1271-1284. doi: 10.1080/14760584.2019.1692657 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
2022; 17(10): e0276610.
2022年10月25日オンライン公開。doi: 10.1371/journal.pone.0276610.r001
ディシジョンレター0
Juraj Ivanyi 学術担当編集者
著作権 © 2022 Juraj Ivanyi
本論文は、クリエイティブ・コモンズ表示ライセンスの条件の下で配布されるオープンアクセス論文であり、原著者および出典を明記することを条件に、いかなる媒体においても無制限の使用、配布、および複製を許可するものです。
2022年10月4日
PONE-D-22-24848Distinct and shared B cell responses of tuberculosis patients and their household contactsPLOS ONE(結核患者とその家庭内連絡者のB細胞反応の相違と共有)。
Aggarwal博士へ。
PLOS ONEに原稿をご投稿いただきありがとうございます。慎重に検討した結果、メリットはあるが、現状ではPLOS ONEの掲載基準を十分に満たしていないと思われる。そこで、査読過程で指摘された点を解決した改訂版の原稿を提出していただくようお願いします。
改訂版の原稿は、11月18日 2022年11月59日までにご提出ください。改訂版の完成にこれ以上の時間が必要な場合は、このメッセージに返信していただくか、ジャーナル事務局(gro.solp@enosolp)までご連絡ください。リビジョンを投稿する準備ができたら、https://www.editorialmanager.com/pone/ にログインし、「Submissions Needing Revision」フォルダを選択して、原稿ファイルを探します。
改訂原稿を提出する際には、以下のものを同封してください。
学術編集者および査読者から指摘された各点に対応する反論の手紙。このレターは、「Response to Reviewers(査読者への回答)」というラベルを付けた別のファイルとしてアップロードしてください。
原著論文からの変更点をマークアップした原稿。Revised Manuscript with Track Changes(変更履歴付き改訂版)'というラベルの付いた別のファイルとしてアップロードしてください。
変更履歴のない改訂版(無印)。Manuscript'とラベル付けされた別のファイルとしてアップロードしてください。
財務情報の開示を変更したい場合は、カバーレターに最新の財務情報を記載してください。図ファイルの再提出のためのガイドラインは、このレターの最後にある査読者コメントの下にあります。
結果の再現性を高めるため、実験プロトコルをprotocols.ioに預けることをお勧めします。Protocols.ioはあなたのプロトコルに独自の識別子(DOI)を付与し、将来独立して引用できるようにします。手順については、https://journals.plos.org/plosone/s/submission-guidelines#loc-laboratory-protocols をご覧ください。さらに、PLOS ONEでは、protocols.ioにホストされているプロトコルを記述した査読付きラボプロトコル論文を出版するオプションが用意されています。プロトコルの共有に関する詳しい情報は、https://plos.org/protocols?utm_medium=editorial-email&utm_source=authorletters&utm_campaign=protocols をご覧ください。
改訂された原稿を受け取ることを楽しみにしています。
よろしくお願いします。
Juraj Ivanyi
アカデミック・エディター
PLOS ONE
ジャーナル要件
リビジョンを投稿する際には、以下の追加要件に対応していただく必要があります。
原稿がPLOS ONEのスタイル要件(ファイル名に関する要件を含む)を満たしていることを確認してください。PLOS ONEのスタイルテンプレートは
https://journals.plos.org/plosone/s/file?id=wjVg/PLOSOne_formatting_sample_main_body.pdf および
Data Availability Statementにおいて、原稿に記載された結果の基礎となる最小限のデータセットをどこで入手できるかが明記されていない。PLOSでは、研究の最小限のデータセットを、原稿で導き出された結論に到達するために使用された基礎データと、報告された研究結果を完全に再現するために必要な追加データと定義しています。すべてのPLOSジャーナルは、最小限のデータセットを完全に利用可能にすることを要求しています。データポリシーの詳細については、http://journals.plos.org/plosone/s/data-availability をご覧ください。
修正原稿を再投稿する際には、研究の最小限の基礎データセットをSupporting Informationファイルまたは安定した公開リポジトリにアップロードし、関連するURL、DOIまたはアクセッション番号を修正カバーレターに記載してください。許容されるリポジトリの一覧は、http://journals.plos.org/plosone/s/data-availability#loc-recommended-repositories を参照してください。患者を特定できる可能性のある情報は、完全に匿名化する必要があります。
重要:データの公開に倫理的または法的な制約がある場合は、その制約を詳細に説明してください。データの一般公開に許容できない制限については、ガイドライン(http://journals.plos.org/plosone/s/data-availability#loc-unacceptable-data-access-restrictions)をご覧ください。データ利用を確保するための責任者が著者だけであることは容認できないことに留意してください。
私たちは、あなたがカバーレターで提供した情報を反映させるために、あなたのData Availability Statementを更新します。
PLOS ONEでは、投稿論文の図表や補助情報ファイルで報告されたすべてのブロットやゲルの結果について、トリミングや調整をしていないオリジナルの画像を提供することを著者に義務付けています。この方針と、ブロット/ゲルの報告および図の作成に関する本誌のその他の要件については、https://journals.plos.org/plosone/s/figures#loc-blot-and-gel-reporting-requirements および https://journals.plos.org/plosone/s/figures#loc-preparing-figures-from-image-files で詳しく説明しています。改訂原稿を提出する際には、図がこれらのガイドラインに完全に準拠していることを確認し、投稿で報告されたすべてのブロットまたはゲルデータの元の画像を提供してください。オリジナルの画像データの提供方法については、次のリンクを参照してください: https://journals.plos.org/plosone/s/figures#loc-original-images-for-blots-and-gels.
カバーレターには、ブロット/ゲル画像データがSupporting Informationにあるか、公開データレポジトリにあるか、該当する場合はリポジトリのURLを記載し、どのブロット/ゲル画像が利用できないか、具体的な詳細を記載してください。ご質問がある場合は、gro.solp@enosolp までメールでお問い合わせください。
参考文献リストが完全で正しいものであることを確認してください。撤回された論文を引用している場合は、その理由を原稿に記載するか、これらの文献を削除し、最新の関連する文献に置き換えてください。参考文献リストを変更した場合は、修正原稿に添付するrebuttal letterに記載してください。撤回された論文を引用する必要がある場合は、References listにその論文が撤回されたことを明記し、撤回通知の引用と完全な参考文献も記載する。
[注:HTMLマークアップは以下の通りです。 編集しないでください]。
査読者のコメント
査読者の質問に対する回答
著者へのコメント
原稿は技術的に適切か、またデータは結論を裏付けているか。
原稿は、技術的に健全な科学研究を、結論を支持するデータとともに記述していなければならない。実験は、適切なコントロール、再現性、サンプルサイズを用いて厳密に実施されていなければならない。結論は、提示されたデータに基づいて適切に導き出されたものでなければならない。
レビュアー#1: Yes
レビュアー#2: はい
統計解析が適切かつ厳格に行われているか。
レビュアー#1: Yes
レビュアー#2: はい
著者らは、論文で発見されたすべてのデータを完全に利用可能にしているか?
PLOS Data Policyでは、著者は原稿に記載された研究結果の根拠となる全てのデータを、稀な例外を除き、制限なく完全に利用できるようにすることが求められている(原稿PDFファイル内のData Availability Statementを参照)。データは、原稿またはその補助資料の一部として提供されるか、公的リポジトリに寄託される必要があります。例えば,要約統計量に加え,平均値,中央値,分散測定の背後にあるデータポイントが利用可能であるべきである。参加者のプライバシーや第三者からのデータの利用など、データの公開に制約がある場合は、その旨を明記すること。
レビュアー#1: はい
レビュアー#2: はい
原稿は分かりやすく、標準的な英語で書かれているか。
PLOS ONEでは、採用された原稿のコピー編集は行っていないため、投稿論文の言語は明確で、正しく、曖昧さがないものでなければなりません。誤植や文法的な間違いは修正時に訂正する必要がありますので、具体的な間違いはここに記入してください。
レビュアー#1: はい
レビュアー#2: はい
著者へのレビューコメント
上記の質問に対する回答は、所定のスペースに記入してください。また、二重出版、研究倫理、出版倫理に関する懸念など、著者への追加コメントを記載することもできます。(2万字を超える場合は、添付ファイルとしてアップロードしてください。)
査読者1:この原著論文は、結核患者とその家庭内接触者のB細胞反応の特徴を明らかにし、これらの反応が潜伏結核と活動性結核を区別することができるかどうかを判断することを目的としたものである。著者らは、塗抹陽性結核患者とその無病者である家族内接触者を募集した。血清サンプルを採取し、様々な結核菌膜抗原に対する抗体レベルを測定した。また、全血を採取し、フローサイトメトリーによりB細胞サブセット集団の特徴を明らかにした。簡単に言えば、結核患者はMtb膜抗原に対するIgGレベルが高く、一方、家庭内接触者はIgMレベルが高いことが判明したのである。興味深いことに、著者らは、結核患者と家庭内接触者の血清のMtb膜抗原に対する反応性に差異を見出し、イムノブロット法で可視化した。さらに、著者らは、古典的メモリーB細胞(CD19+CD27+)の頻度が結核患者とその家庭内接触者の間で異なること、IgA+非典型メモリーB細胞(CD19+CD27-)の頻度が結核患者および家庭内接触者の両方でIgG+より高いことを見いだした。この論文は、観察された結核患者と家庭内接触者のB細胞反応の違いは、結核に対する防御免疫反応に役割を果たす可能性があり、同時にワクチン開発における防御の相関を示す有用な情報を提供すると結論づけている。
全体として、英語の質が高く、方法論に関しても十分な詳細が記載されている論文であった。真の」陰性対照群が存在しないことが気になった。この対照群の欠如にもかかわらず、この論文でなされた結論は有効であるが、このデータを含めることができれば、より強力な事例となるであろう。
主なコメント
本研究のデータや数値は、陰性対照群(BCG接種の有無にかかわらず、活動性結核患者の家庭内接触者ではない結核陰性者の検体)を含めることで大きな利益を得ることができるだろう。これにより、環境マイコバクテリア抗原への曝露のような交絡因子をさらに議論することができるだろう。また、膜タンパク質の異なるタンパク質分画に対する免疫反応性を議論する際に、特異性の議論に重みを持たせることができるだろう。
著者は、BCGの有無(ほとんどの被験者がBCGの傷跡を持っていると思われる)がデータの解釈に与える影響について議論する必要がある。
病気の進行やワクチンによる防御免疫の観点からデータが有用であるという著者のコメントには感謝します。しかし、高分子量タンパク質の中には、血清学的に結核患者と潜伏結核を区別するための候補(診断的価値)となるものがあるのではないだろうか?
マイナーなコメント
60行目 文は "The role of antibodies in protection..." とすべきである。
176行目。使用したプレートリーダーのメーカー・機種を記載
212 行目。GraphPad Prismのバージョン番号を記載する。
表1。スペルチェック、2は "GeneXpert "と読むべき。
査読者2:この論文で著者らは、結核患者とその塗抹陽性家庭内接触者のコホートにおいて、Mtb-膜特異的抗体レベルを測定することにより、体液性適応免疫コンパートメントを評価しました。さらに、彼らは末梢血中のB細胞サブセットも評価した。
その結果、結核患者ではIgGがIgMやIgAよりも有意に高い値を示したが、IgMとIgAの抗体レベルは同程度であった。HHCでは、血清中のIgM抗体濃度がIgGおよびIgAよりも有意に高かった。また、HHCのIgM/IgG抗体比は結核患者より有意に高かった。イムノブロッティングの結果、HHCと結核患者は、特定の低分子量MtM抗原を認識する能力を共有していることが示された。B細胞については、古典的メモリーB細胞頻度が有意に高く、IgG+ cMBCが有意に低いことが示された。
著者らは、IgM/IgG抗体比、選択されたMtM抗原に対する抗体結合、MBCサブセットの相対頻度は、Mtbの初感染後の防御的あるいは病原性の免疫応答を示す可能性があると結論づけている。
私見では、この論文はよく書けており、Mtb感染と結核における体液性反応のまだ議論のある役割について興味深い考えを示している。
ただ、結果や考察について、いくつか気になる点があります。
図1と図5の凡例に、使用した統計学的検定を追加すべきです。
統計量については、登録された患者数やHHCを考慮すると、中央値ではなく平均値でデータを示し、正規のデータ分布であればパラメトリック統計検定を用いることができる。
298行目と304行目の間が十分に明確になっていない。例えば、cMBCの頻度中央値はHHCで1.8、結核患者で0.95と書いているが、IgG+ cMBCの頻度はHHCで1.6、結核患者で3.0と書いた後、最後の値は0.95より高くなっている。私見では、たとえgating strategyを示したとしても、報告された頻度がどの集団からカウントされたものなのか、あるいはB細胞集団全体に対する頻度を報告すべきなのではと思う。
349行目、罹患率は年間10万人を基準にしているのですか?明記してください。
353行目 HHCのTST反応者とIgM、IgG、IgA、その他B細胞に関するパラメータとの間に相関関係があるかどうか、著者らは確認したのでしょうか?
358行目、著者らはLTBIという略語を論文中で初めて使用しましたが、この略語の正式な単語を記載すべきです。
365行目、文献上、結核や結核感染における抗体やB細胞の濃度や役割については、多くの矛盾したデータがあります。したがって、著者はこの点について、より徹底した背景を説明すべきである。
407行目、著者らはこう書いている。"結核患者と同様の抗原認識パターンを示すHHCは、高い感染負担を抱いている可能性がある。" これは興味深い点である。著者らは、この仮説を検証する予定があるのでしょうか?
PLOSの著者は、論文の査読履歴を公開するオプションがあります(これはどういう意味でしょうか)。公開された場合、あなたの査読全文と添付ファイルが含まれます。
いいえ」を選択した場合、あなたの身元は匿名のままですが、あなたの査読は公開される可能性があります。
この査読であなたの身元を公開したいですか?同意の撤回を含むこの選択に関する情報については、当社のプライバシーポリシーをご覧ください。
レビュアー#1: いいえ
レビュアー#2: いいえ
[注:査読者コメントが添付ファイルとして提出された場合、このメールに添付され、投稿サイト経由でアクセスできます。アカウントにログインし、原稿の記録を探し、「View Attachments」というアクションリンクが表示されているか確認してください。このリンクが表示されない場合は、添付ファイルがありません] 。
投稿原稿を修正しながら、図ファイルをデジタル診断ツールPreflight Analysis and Conversion Engine (PACE)(https://pacev2.apexcovantage.com/)にアップロードしてください。PACEは、図がPLOSの要求事項を満たしているかどうかを確認するのに役立ちます。PACEを使用するには、まずユーザー登録をする必要があります。登録は無料です。ログイン後、「UPLOAD」タブに移動すると、ツールの詳しい使い方が表示されます。PACEを使用する際に何か問題が発生したり、質問がある場合は、PLOS gro.solp@serugifまでメールでお問い合わせください。なお、Supporting Informationファイルはこのステップを必要としません。
2022; 17(10): e0276610.
2022年10月25日オンライン公開。doi: 10.1371/journal.pone.0276610.r002
決定通知書に対する著者の回答 0
著作権表示
2022年10月8日
査読者への回答
レビュアー1号
一般的なコメント この原著論文は、結核患者とその家庭内連絡者のB細胞反応の特徴を明らかにし、これらの反応が潜伏結核と活動性結核を区別することができるかどうかを判断することを目的としたものである。著者らは、塗抹陽性結核患者とその無病者である家族内接触者を募集した。血清サンプルを採取して、さまざまな結核菌膜抗原に対する抗体レベルを測定した。また、全血を採取し、フローサイトメトリーによりB細胞サブセットの集団の特徴を明らかにした。簡単に言えば、結核患者はMtb膜抗原に対するIgGレベルが高く、一方、家庭内接触者はIgMレベルが高いことが判明したのである。興味深いことに、著者らは、結核患者と家庭内接触者の血清のMtb膜抗原に対する反応性に差異を見出し、イムノブロット法で可視化した。さらに、著者らは、古典的メモリーB細胞(CD19+CD27+)の頻度が結核患者とその家庭内接触者の間で異なること、IgA+非典型メモリーB細胞(CD19+CD27-)の頻度が結核患者および家庭内接触者の両方でIgG+より高いことを見いだした。この論文は、観察された結核患者と家庭内接触者のB細胞反応の違いは、結核に対する防御免疫反応に役割を果たす可能性があり、同時にワクチン開発における防御の相関を示す有用な情報を提供すると結論づけている。全体として、英語の質が高く、方法論に関しても十分な詳細が記載された論文であった。
回答 このような大変心強いコメントをいただき、ありがとうございました。
コメント 真の」陰性対照群がないことが気になる。この対照群がないにもかかわらず、この論文の結論は妥当であるが、このデータを含めることができれば、より強い主張ができるだろう。
回答 この回答は、コメント1(下記)への回答とセットになっている。
主なコメント
コメント-1: 本研究のデータや数値は、陰性対照群(BCG接種の有無にかかわらず、活動性結核患者の家庭内接触者ではない結核陰性者の検体)を含めることで大きな利益を得ることができるだろう。これにより、環境マイコバクテリア抗原への曝露のような交絡因子をさらに議論することができるだろう。また、膜タンパク質の異なるタンパク質分画に対する免疫反応性を議論する際に、特異性の議論に重みを持たせることができるだろう。
回答 確かに、このデータは陰性対照を含めることで恩恵を受けることができたかもしれない。しかし、世界的な結核の流行から、結核に感染していない人を見つけることは困難である。健康」または「非結核」対照群(TSTまたはIGRA陰性で定義)を含む研究(例えば、イムノブ ロット法について引用した研究)においてさえ、対照群の大部分は、実際にMtb抗原に対する免疫反応を示すに至っ ているのである。考察の最初の段落で述べたように、活動性結核患者に長期間持続的に接していても、TSTやIGRAに反応しない人がかなりの割合で存在する。実際、結核流行地の健康な住民の96%までは、血清中にMtb特異的な抗体を示している。この状況は、特にインドのような「結核高負担国」にとって重要である。考察(第1段落)で引用したインドの研究 [Ref 29] によると、追跡期間中に結核を発症した健康な被験者のかなりの数が、結核患者との接触がなかったという。北インドの別の研究では、TST/IGRA陽性および陰性の接触者から発せられる結核の発生率は同等であり、両方の検査がMtb感染者の大きな割合を見落とす可能性があることを示唆しています(Sharma et al, PLoS ONE, 2017; 12: e0169539)。地域社会におけるMtb感染の真の範囲を過小評価している可能性があることは、最近の論文(Dowdy and Behr, Lancet Infect Dis, 2022 Sep: e271-e278)でも強調されている。
コメント-2:著者は、BCGの有無(ほとんどの被験者がBCG痕を持っていると思われる)がデータの解釈に与える影響について議論すべきです。
回答 研究対象者はすべて成人で、北インドの半都市部または農村部に居住しており、乳児期にBCGワクチンの接種を受けた者はごく少数であった(インドの予防接種政策による)。インドの半都市・農村部における予防接種率は年々拡大していますが、貧困世帯と富裕世帯、あるいは教育を受けた母親と教育を受けていない母親に属する子どもの間には、依然として接種率のギャップが存在しています(Khan and Saggurti, Vaccine.) BCGワクチンの抗体反応への影響については、インドからの研究(Das et al, Clin Exp Immunol.1992; 89:402-6)で、BCG接種状況はインド人、イギリス人のいずれの被験者でもMtb抗原に対する抗体レベルに影響を及ぼさないことが明らかにされている。
コメント3:著者のデータは、病気の進行やワクチンによる防御免疫の観点から有用であるというコメントには感謝しています。しかし、高分子量タンパク質の中には、血清学的に結核患者や潜伏結核を区別するための候補(診断的価値)となるものがあるのではないでしょうか?
回答 ご指摘ありがとうございます。しかし、現在のデータでは、このような主張をするには不十分であると思われる。
軽微なコメント
60 行目。文は、"The role of antibodies in protection... "とすべきである【回答:修正済み】。
176 行目。使用したプレートリーダーのメーカー/モデルを記載する【回答:記載済み】。
212 行目 GraphPad Prism のバージョン番号を記載【回答:記載あり】。
表 1. スペルチェック、2は "GeneXpert "とすべきである【回答:修正済み】。
査読者番号 2
総評 この論文で著者らは、結核患者とその塗抹陽性家庭内接触者のコホートにおいて、結核菌特異的抗体価を測定することにより、体液性適応免疫コンパートメントを評価した。さらに、彼らは末梢血中のB細胞サブセットも評価した。その結果、結核患者ではIgGがIgMやIgAよりも有意に高かったが、IgMとIgAの抗体レベルは同程度であった。HHCでは、血清中のIgM抗体濃度がIgGおよびIgAよりも有意に高かった。また、HHCのIgM/IgG抗体比は結核患者より有意に高かった。イムノブロッティングの結果、HHCと結核患者は特定の低分子量MtM抗原を認識する能力を共有していることがわかった。B細胞については、古典的メモリーB細胞頻度が有意に高く、IgG+ cMBCが有意に低いことが示された。著者らは、IgM/IgG抗体比、選択されたMtM抗原に対する抗体結合、MBCサブセットの相対頻度は、Mtbの初感染後の防御的あるいは病原性の免疫応答を示す可能性があると結論づけている。私見では、この論文はよく書けており、Mtb感染と結核における体液性反応のまだ議論のある役割について興味深い考えを示している。ただ、結果や考察について、いくつか気になる点があります。
回答 大変ありがたいコメントです。
コメント1:図1と図5の凡例に、使用した統計学的検定を追加すべきです。
回答 回答:このような追加を行いました。
コメント2:統計量について、登録患者数、HHC数を考えると、中央値でなく平均値で示し、正規のデータ分布であればパラメトリック統計量検定を用いることができる。
回答 回答:データ分布が歪んでいるため、中央値(IQR と共に)を使用した。同じ理由で、ノンパラメトリック検定も使用した。
コメント3:298 行目と 304 行目の間の期間が十分に明確でない。例えば、cMBCの頻度中央値はHHCで1.8、結核患者で0.95と書いているが、IgG+ cMBCの頻度はHHCで1.6、結核患者で3.0と書いた後、最後の値が0.95より高くなっている。私見では、たとえゲーティング戦略を示していても、報告された頻度がどの集団からカウントされたものであるかをもっと明確にするか、B細胞集団全体に対する頻度を報告すべきであると思います。
回答 この重要な問題をご指摘いただきありがとうございます。現在、図4と5の説明文と、関連する「結果」セクションのテキストを修正した。これらの修正により、この問題が明確になったことを期待する。
コメント-4: 349行目、発症率の結果は、年間10万人の被験者に基づいているのでしょうか?具体的に教えてください。
回答 はい、確かに発症率は、被験者10万人/年あたりです。この情報は、改訂版で追加されました。
コメント5:353行目 HHCのTST反応者とIgM、IgG、IgA、その他B細胞に関するパラメータとの間に相関があるかどうか、著者らは確認したのでしょうか?
回答 はい。このデータは、Resultsセクションに記載し、補足図S2として示しました。
コメント6:358行目、著者らはLTBIという略語を論文中で初めて使用しましたが、この略語の正式な単語を記載すべきです。
回答 回答:「はじめに」の最初の段落で、LTBI の略語を使用しています。
コメント7:365行目、文献上、結核や結核感染における抗体やB細胞の濃度や役割については、多くの不一致のデータがあります。そのため、この点については、著者はより詳細な背景を説明する必要があります。
回答 ご指摘のとおり、「はじめに」(第2段落)を改訂しました。それに伴い、文献番号6をより適切な総説に差し替えました。
コメント-8:407行目、著者はこう書いています。「結核患者と同様の抗原認識パターンを示すHHCは、高い感染負担を抱いている可能性がある。これは興味深い点です。著者らは、この仮説を検証する予定があるのでしょうか?
回答 ご指摘ありがとうございます。これは確かに興味深いのですが、まだほとんど解明されていない分野です。なぜなら、イムノブロッティングは、血清学的に活性な免疫優性抗原を検出するための、偏りのない、仮説に基づかないアプローチであるからです。今後、十分に大きなデータセットを作成し、確かな結論を導き出す予定です。
添付資料
提出したファイル名 査読者への回答.docx
追加データファイルはこちら(22K, docx)
2022; 17(10): e0276610.
2022年10月25日オンライン公開 doi: 10.1371/journal.pone.0276610.r003
ディシジョンレター1
ジュライ・イヴァーニ 学術編集者
著作権 © 2022 Juraj Ivanyi
この記事は、原著者と出典を明記することを条件に、いかなる媒体でも無制限に使用、配布、複製を許可するクリエイティブ・コモンズ表示ライセンスの条件の下で配布されるオープンアクセス記事です。
2022年10月11日
結核患者とその家庭内接触者のB細胞反応の差異と共通性
PONE-D-22-24848R1
Aggarwal博士へ。
あなたの原稿は、科学的に出版に適していると判断され、すべての優れた技術的要件を満たした後、正式に出版が許可されることをお知らせします。
1週間以内に、必要な修正事項の詳細を電子メールでお送りします。修正が完了したら、正式なアクセプトレターをお送りし、出版を予定しています。
正式受理後、すぐにお支払い用の請求書が届きます。効率的な処理を行うため、Editorial Manager(http://www.editorialmanager.com/pone/)にログインし、ページ上部の「Update My Information」リンクをクリックし、ユーザー情報が最新であることを再確認してください。課金に関するご質問は、直接Author Billing部門(gro.solp@gnillibrohtua)までお問い合わせください。
あなたの所属する機関や団体にプレスオフィスがある場合は、論文のインパクトを最大化するために、近日中にプレスオフィスへ通知してください。プレス向け資料を作成する場合は、できるだけ早く、遅くとも正式受理後48時間以内に、プレスチームにお知らせください。原稿は、出版日の午後2時(東部標準時)まで厳重に報道機関への公開が禁止されます。詳しくは、gro.solp@sserpenoまでご連絡ください。
よろしくお願いします。
Juraj Ivanyi
アカデミック・エディター
PLOS ONE
追加編集者コメント(任意)。
査読者のコメントです。
2022; 17(10): e0276610.
2022年10月25日オンライン公開 doi: 10.1371/journal.pone.0276610.r004
アクセプタンスレター
Juraj Ivanyi 学術担当編集者
著作権 © 2022 Juraj Ivanyi
本論文は、クリエイティブ・コモンズ表示ライセンスの条件の下で配布されるオープンアクセス論文であり、原著者および出典を明記することを条件に、いかなる媒体においても無制限の使用、配布、および複製を許可しています。
2022年10月14日
ポン-D-22-24848R1
結核患者とその家庭内接触者のB細胞反応の差異と共通性
親愛なるAggarwal博士。
あなたの原稿がPLOS ONEに掲載するのに適していると判断されたことをお知らせします。おめでとうございます。あなたの原稿は現在、弊社の制作部門にあります。
もし、あなたの所属する機関や団体にプレスオフィスがあれば、今すぐあなたの論文のことを伝え、その影響力を最大限に高めてください。もし、報道関係者向けの資料を準備されるのであれば、48時間以内に弊社報道チームにお知らせください。原稿は、出版日の東部時間午後2時まで厳重に報道禁止となります。詳しくはgro.solp@sserpenoまでご連絡ください。
その他、何かありましたら、gro.solp@enosolpまでメールにてお問い合わせください。
PLOS ONEにご投稿いただき、オープンアクセスをご支援いただきありがとうございます。
よろしくお願いします。
PLOS ONE編集部スタッフ
を代表して
Juraj Ivanyi博士
アカデミック・エディター
PLOS ONE
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
