
ランズサイクルを介した脂肪細胞のホスファチジルイノシトール生合成がインスリン抵抗性を予防する
解説|64巻6号100383号2023年6月号
ランズサイクルを介した脂肪細胞のホスファチジルイノシトール生合成がインスリン抵抗性を予防する
https://www.jlr.org/article/S0022-2275(23)00056-1/fulltext
カリン・E・ボーンフェルト
Open AccessDOI:https://doi.org/10.1016/j.jlr.2023.100383
プラムXメトリックス
略称:LPI
LPI(リゾホスファチジルイノシトール)、MBOAT7(膜結合型O-アシルトランスフェラーゼドメイン含有7)、PI(ホスファチジルイノシトール)、WAT(白色脂肪組織)。
リンク記事
脂肪細胞におけるMBOAT7駆動のリゾホスファチジルイノシトールアシル化は全身のグルコースホメオスタシスに寄与している
脂質研究会誌64巻4号
プレビュー
全文
PDF
オープンアクセス
ランズサイクルは、William (Bill) Lands博士によって解明されたもので、脂質アシルトランスフェラーゼによるリゾリン脂質への脂肪アシル鎖の付加とホスホリパーゼによる脂肪アシル鎖の切断によるリゾリン脂質の生成によるリン脂質のリサイクルを表している(
1
). ランズ博士は、1950年代後半から1960年代半ばにかけて、一連のエレガントな生化学的研究を発表した(例えば、以下のようなものである。
2
))、これらのプロセスを記述したものである(図1)。ランズ・サイクルは、細胞が膜リン脂質のアシル鎖組成をリモデリングし、それによってその物理的・機能的特性を変化させることを可能にする (
1
). 最近の研究では、ランズサイクルが代謝性疾患において重要な役割を担っていることが明らかになっており、このようなリモデリングは非常に重要である。
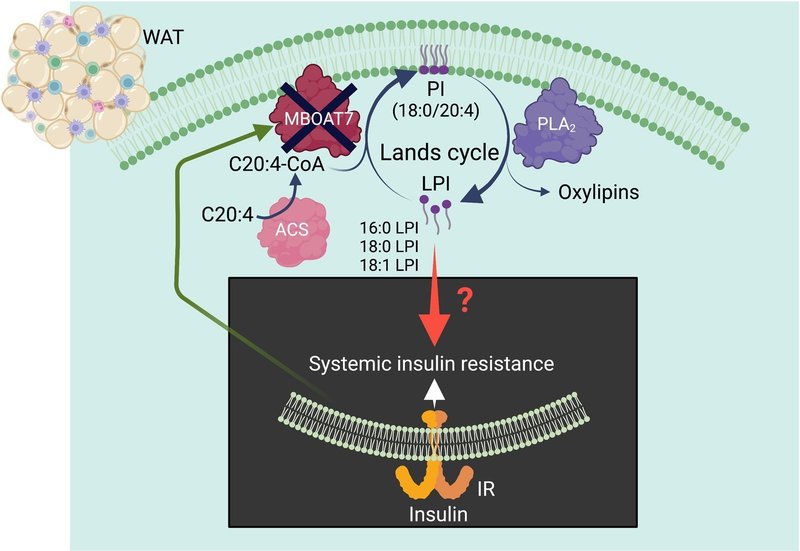
図1白色脂肪組織におけるLandsサイクルを介したホスファチジルイノシトール生合成は、どのようにして全身のインスリン抵抗性を防ぐのだろうか?Masseyらによる知見(
3
)は、白色脂肪組織(WAT)でMBOAT7の発現を選択的に欠失させると、脂肪摂取マウスにおいて全身性のインスリン抵抗性が生じることを示し、WATにおけるMBOAT7を介したLandsサイクルによるPI生合成が全身性のインスリン感受性に必要であると示唆しました。WATのMBOAT7を介したLandsサイクルが全身のインスリン抵抗性を調節するメカニズムは、まだ大部分が「ブラックボックス」であり、さらなる研究が必要です。Masseyらのデータは、インスリン抵抗性がWATに蓄積された16:0-、18:0-または18:1-リゾホスファチジルイノシトール(LPI)のオートクラインまたはパラクリン効果によるものだという提案を支持しているが、他の解釈も可能である。興味深いことに、MBOAT7 の発現はインスリンによってダウンレギュレートされる (
4
)、インスリン抵抗性を悪化させる可能性がある。ACS、アシル-CoA合成酵素、IR、インスリン受容体、PLA2、ホスホリパーゼA2。BioRender.comで作成された。
大きな画像を見る
高解像度画像をダウンロードする
哺乳類のリゾリン脂質アシルトランスフェラーゼの1つはMBOAT7(membrane bound O-acyltransferase domain containing 7)と呼ばれています。最近、MBOAT7をLPLAT11(lysophospholipid acyltransferase 11)と改名する最新の命名法が提案されている(
5
). MBOAT7は、ゲノムワイド関連研究により、MBOAT7遺伝子を含む連鎖不平衡ブロック内に、非アルコール性脂肪性肝疾患を含む肝臓疾患と関連する感受性遺伝子座(rs641738)が特定されたことから、代謝疾患領域で関心が高まっている (
6
).
MBOAT7は、図1に示すように、リゾホスファチジルイノシトール(LPI)をアラキドノイル-CoA(C20:4-CoA)にエステル化し、ホスファチジルイノシトール(PI[18:0/20:4])を生成する選択性に優れている。ゲノムワイド関連研究と一致して、アンチセンスオリゴヌクレオチドによってMBOAT7をサイレンシングすると、主に肝臓、脂肪組織、網状内皮系内の細胞でMBOAT7の発現が低下し、脂肪飼育マウスで非アルコール性脂肪性肝疾患表現型を引き起こした (
7
). 体重や循環リポタンパク質に差は認められなかったが、MBOAT7をサイレンシングすると、耐糖能異常、血漿インスリンおよびCペプチド値の上昇、肝細胞におけるインスリン受容体βサブユニットのリン酸化および下流のAktリン酸化を誘導するインスリンの能力の低下によって特徴づけられるインスリン抵抗性も生じた。これらのマウスの白色脂肪組織(WAT)では、MBOAT7の発現がほぼ同様に抑制されていたにもかかわらず、肝臓でのインスリン作用の減弱は脂肪組織では観察されなかった (
7
). そのメカニズムとして、肝脂肪滴の膨張が亢進することが示唆されたが、このメカニズムがどのようにインスリンの作用を阻害するのかは不明であった。
しかし、その後、MBOAT7欠失を肝細胞に特異的に導入したところ、上記のMBOAT7アンチセンスオリゴヌクレオチド研究で観察された脂肪肝の表現型は再現されたが、インスリン抵抗性は再現されなかった (
8
). したがって、一つの可能性として、脂肪組織におけるMBOAT7発現の抑制が、Helsleyらによって観察されたインスリン抵抗性を説明できる可能性がある(
7
).
このような知見を踏まえて、Masseyらによる研究(
3
)は、その重要な背景を見出すことができる。これまで、MBOAT7の肝発現が肥満のヒトや齧歯類で抑制されていることを明らかにしてきた(
7
)、WATにおけるMboat7発現がマウスの脂肪パッド重量および体脂肪率と負の相関があること、WATにおけるMboat7発現がインスリン感受性指標と負の相関があることを示したが、本研究グループは、これらの知見を確認し、高脂肪高ショ糖食を与えたマウスにおいてWATにおけるMboat7発現がWAT量と負の相関があることを明らかにした(影響を受ける脂肪部位には性差も見られた)。
肝臓と脂肪組織におけるMBOAT7の影響を解明するため、研究グループは、Mboat7フロックスマウスとアディポネクチン-Creおよびアルブミン-Creマウスを交配して、それぞれ脂肪細胞を標的としたMBOAT7欠損マウスと肝細胞を標的としたMBOAT7欠損マウスを作成しました。これらのマウスの肝病理とインスリン抵抗性を解析した結果、MBOAT7の肝ターゲット欠失は脂肪肝の表現型をもたらすが、インスリン抵抗性はもたらさないことがわかり、これまでの研究と一致した (
8
). 逆に、肝細胞のMBOAT7を欠損させた脂肪食マウスでは空腹時血漿インスリン濃度が上昇したが、脂肪細胞のMBOAT7を欠損させると高インスリン血症とインスリン感受性低下が起こり、肝脂肪への影響は軽微であった。したがって、インスリン抵抗性の表現型は、脂肪細胞におけるMBOAT7の欠損に大きく選択されるようである。興味深いことに、MBOAT7は肝臓と脂肪組織の両方で、インスリンの急性注射によってダウンレギュレートされる(
4
)、高インスリン血症がMBOAT7のダウンレギュレーションを通じて全身のインスリン抵抗性を悪化させる可能性が示唆された。
また、Masseyらによる研究(
3
)は、脂肪細胞MBOAT7欠損が脂肪食マウスのインスリン抵抗性を悪化させるメカニズムや、脂肪細胞を標的としたMBOAT7欠損マウスのインスリン抵抗性表現型が脂肪細胞のインスリン抵抗性に起因するのかなどの多くの興味ある疑問を投げかける。後者の疑問の解決に着手するため、著者らは高インスリン血症-血糖値クランプを実施した。これらの研究から、脂肪細胞を標的としたMBOAT7欠損マウスのインスリン抵抗性は、肝臓や他のインスリン標的組織ではなく、脂肪組織でインスリン抵抗性をもたらすオートクリンまたはパラクリン機構によるものである可能性が高いと考えられた。
Masseyはさらに、MBOAT7欠損により、アラキドノイルアシル鎖を持つPI種(主にPI(18:0/20:4))が著しく減少し、WATでは18:0-LPIと18:1-LPIレベルが増加することを示した(図1)。しかし、このような変化がどのようにしてインスリン抵抗性につながるのだろうか?ランズサイクルによるPI生合成の減少が、ホスファチジルイノシトールリン酸キナーゼを介したインスリンシグナルの減少につながる可能性はあるのだろうか?グリコシルホスファチジルイノシトールを介したタンパク質脂質アンカーのレベルの変化が説明となりうるか?これらの疑問に対する答えは、著者らが指摘するように、さらなる研究が必要である。一方、Masseyらによって、WATにおける特定の脂質種の変化を介するいくつかの潜在的なメカニズムが除外された(
3
). WATの包括的なリピドミクス解析により、多価不飽和アシル鎖を含むリン脂質のいくつかの変化以外に、遊離脂肪酸、非LPIリゾリン脂質、ホスファチジルコリン、スフィンゴミエリン、セラミド、トリアシルグリセロール、ジアシルグリセロール、オキシリピンの変化はインスリン抵抗性の増大を説明しそうになかった。さらに、血漿中の非エステル化脂肪酸レベルは、脂肪細胞選択的MBOAT7欠損マウスでは増加しないようであり、脂肪細胞の脂肪分解の増加が全身性のインスリン抵抗性を説明しないことを示唆した。
脂肪細胞でMBOAT7を欠損したマウスでは、PIやLPIの脂質種の肝臓や血漿のレベルに有意な差はなく、脂肪組織の局所的なメカニズムが指摘された。LPIが実際にWATのインスリンシグナルに影響を与えるかどうかを検証するため、脂肪細胞MBOAT7欠損マウスとそうでないマウスに18:1-LPIを注射し、生殖腺WATグローバルリンフォプロテオームを分析した。パスウェイ濃縮解析の結果、LPIを注射したMBOAT7欠損マウスでは、インスリンシグナルとインスリン抵抗性のシグネチャーが増加した。本研究では、WATにおけるインスリン誘導性のAktおよびPI3K活性の直接測定は行わなかったが、これらの結果は、脂肪組織におけるLPIの局所的な蓄積により、MBOAT7依存的にインスリンシグナルが変化するという著者らの結論を支持している。
しかし、このような現象が起こるメカニズムは、まだブラックボックスの謎に包まれています(図1)。上述したメカニズムに加えて、可能性として、脂肪組織の炎症が亢進していること(
3
)、Cd11c-/Cd206+細胞集団(ヒトではスカベンジャー受容体を発現する脂肪組織マクロファージ集団;(
9
))とCd11c+/Cd206+二重陽性細胞(ヒトの抗原提示型脂質負荷脂肪組織マクロファージ集団)の相互減少(
9
))、T細胞やB細胞の増加がインスリン抵抗性に寄与している可能性がある。脂肪組織マクロファージと全身のインスリン抵抗性の因果関係は、他の研究者によって示されている(
10
). このような作用は、LPIに応答してマクロファージの炎症活性化を促進することが示唆されているLPI受容体GPR55を介する可能性がある (
11
)、脂肪細胞から放出されるLPIのパラクリン効果により、脂肪組織デポの局所的な炎症活性化を促進することが示唆されている。
MBOAT7とランズサイクルによるPI生合成が、肝疾患、脂肪組織の炎症、インスリン抵抗性、そして糖尿病を予防するメカニズムについて、Masseyらの研究は間違いなく、さらなる研究を促すであろう。
利益相反
K.E.B.は、Esperion Therapeutics, Inc.の科学諮問委員会のメンバーである。
著者の貢献
K. K.E.B.は、本論文のすべての側面について責任を負う。
資金調達と追加情報
K.E.B.の研究室での作業は、National Institutes of Health P01HL151328, R01HL149685, R35HL150754 からの助成金によって支援されています。内容はあくまで著者の責任であり、必ずしもNational Institutes of Healthの公式見解を示すものではない。
参考文献
O'Donnell V.B.
古い経路に対する新しい評価:ランズサイクルは健康と病気における新しい領域へ移行する。
Biochem. Soc. Trans. 2022; 50: 1-11
記事で見る
スコープス (3)
PubMed
クロスフィルム
グーグル奨学生
ランズW.E.
グリセロ脂質の代謝. 2. リゾレシチンの酵素的アシル化。
J. Biol. Chem. 1960; 235: 2233-2237
論文で見る
PubMed
要旨
全文PDF
グーグル奨学生
マッシー W.J.
バラダラジャンV.
バネルジーR.
ブラウン A.L.
ホラックA.J.
ホーエ R.C.
et al.
脂肪細胞におけるMBOAT7駆動のリゾホスファチジルイノシトールアシル化は、全身のグルコースホメオスタシスに寄与している。
J. Lipid Res. 2023; 64100349https://doi.org/10.1016/j.jlr.2023.100349
記事で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
Google Scholar
メローニ M.
ドンジョバンニP.
ロンゴ M.
カルリ F.
バセリG.
ラメッタR.
ら。
高インスリン血症によるMboat7のダウンレギュレーションは肝細胞の脂肪蓄積を誘導する。
EBioMedicine. 2020; 52102658
記事で見る
スコープス (48)
PubMed
要旨
全文
全文PDF
Google Scholar
バレンタインW.J.
柳田和男
川名浩一
河野直樹
野田直樹(Noda N.N.
青木 淳
他
膜リン脂質の多様性を生み出す哺乳類リゾリン脂質アシルトランスフェラーゼの更新と命名法の提案。
J. Biol. Chem. 2022; 298101470
記事で見る
スコープス (22)
PubMed
概要
全文
全文PDF
Google Scholar
ヴァラダラジャンV.
マッシーW.J.
ブラウン J.M.
進行性肝疾患における膜結合型O-アシルトランスフェラーゼ7(MBOAT7)駆動のホスファチジルイノシトールリモデリング(Membrane-bound O-acyltransferase 7 (MBOAT7) -driven phosphatidylinositol remodeling in advanced liver disease.
J. リピッドレズ 2022; 63100234
記事で見る
スコープス(4)
PubMed
要旨
全文
全文PDF
Google Scholar
ヘルスリーR.N.
ヴァラダラジャンV.
ブラウンA.L.
グロモフスキーA.D.(Gromovsky A.D.
シュガー・R.C.
ラマチャンディランI.
他
肥満に伴う膜結合型O-アシルトランスフェラーゼ7(MBOAT7)の抑制が非アルコール性脂肪性肝疾患を促進する。
Elife. 2019; 8e49882
記事で見る
スコープス(53)
パブコメ
クロスレフ
グーグル奨学生
シャ M.
チャンドラセカランP.
Rong S.
Fu X.
ミッチェ M.A.
Mboat7(LPIAT1)の肝欠損は、SREBP-1cの活性化と脂肪肝を引き起こす。
J. リピッドレズ 2021; 62100031
記事で見る
要旨
全文
全文PDF
Google Scholar
ミューア L.A.
チョウ・K.W.
ゲレトカL.M.
ベーカーN.A.
フレッシャーC.G.
エーラーA.P.
et al.
ヒトCD206+マクロファージは、糖尿病や脂肪組織リンパクラスターと関連する。
JCI Insight. 2022; 7e146563
記事で見る
スコープス(10)
PubMed
クロスフィルム
グーグル奨学生
Cao S.
パン Y.
Tang J.
ターカー A.S.
アロヨ・オルネラスJ.P.
ジン・G.N.
他
脂肪組織マクロファージのEGFRを介した活性化は、肥満とインスリン抵抗性を促進する。
Nat. Commun. 2022; 13: 4684
記事で見る
スコープス(7)
パブコメ
クロスフィルム
グーグル奨学生
倉野美穂
小林忠雄
坂井英樹
塚本和彦
矢富雄一
リゾホスファチジルイノシトール、特にアルブミン結合型は、マクロファージにおいて炎症性サイトカインを誘導する。
FASEB J. 2021; 35e21673
記事で見る
スコープス (16)
PubMed
クロスフィルム
グーグル奨学生
記事情報
掲載履歴
受理されました: 2023年4月5日
識別
DOI: https://doi.org/10.1016/j.jlr.2023.100383
著作権について
© 2023 The Author. 米国生化学・分子生物学会の委託によりエルゼビア社より発行。
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0) |.
再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図版
図1白色脂肪組織におけるランズサイクルを介したホスファチジルイノシトール生合成は、どのようにして全身のインスリン抵抗性を防ぐのか?Masseyらによる知見(
3
)は、白色脂肪組織(WAT)でMBOAT7の発現を選択的に欠失させると、脂肪摂取マウスにおいて全身性のインスリン抵抗性が生じることを示し、WATにおけるMBOAT7を介したLandsサイクルによるPI生合成が全身性のインスリン感受性に必要であると示唆しました。WATのMBOAT7を介したLandsサイクルが全身のインスリン抵抗性を調節するメカニズムは、まだ大部分が「ブラックボックス」であり、さらなる研究が必要です。Masseyらのデータは、インスリン抵抗性がWATに蓄積された16:0-、18:0-または18:1-リゾホスファチジルイノシトール(LPI)のオートクラインまたはパラクリン効果によるものだという提案を支持しているが、他の解釈も可能である。興味深いことに、MBOAT7 の発現はインスリンによってダウンレギュレートされる (
4
)、インスリン抵抗性を悪化させる可能性がある。ACS、アシル-CoA合成酵素、IR、インスリン受容体、PLA2、ホスホリパーゼA2。BioRender.comで作成した。
関連記事
ホーム
論文・巻号
プレスリリース
最新巻
巻号一覧
著者の皆様へ
著者向け情報
執筆許可証
原稿の投稿
お問い合わせ
お問い合わせ先
ジャーナル・インフォメーション
2023年メディアキット
オープンアクセス
ジャーナルについて
編集委員会
新着情報
特別コレクション
画像で見る脂質研究
バーチャルイシュー
テーマ別レビュー
メソッド論文
解説書
患者さん向け
定期的な研究記事
その他のASBMB出版物
バイオロジカル・ケミストリー誌
分子・細胞プロテオミクス(Molecular & Cellular Proteomics
ASBMB Today
ISSN 0022-2275
弊社では、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定にアクセスしてください。
著作権 © 2022 Elsevier Inc.第三者から提供された一部のコンテンツを除く。本サイトのコンテンツは、医療従事者を対象としています。
プライバシーポリシー
ご利用条件
アクセシビリティ
エルゼビアのヘルプ&コンタクト
この記事が気に入ったらサポートをしてみませんか?
