メタボライト:メタオーガニズムを説明するための宿主と微生物の収束ノード
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
記事のダウンロード
共有する
39
総閲覧数
23
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
Front. 微生物学, 05 3月 2024
システム微生物学
第15巻 - 2024年|https://doi.org/10.3389/fmicb.2024.1337368
この論文は次の研究テーマの一部です。
精神医学・心理学的疾患に対するシステム生物学的アプローチ: 複雑性を解明する
すべての記事を見る
メタボライト:メタオーガニズムを説明するための宿主と微生物の収束ノード
https://www.frontiersin.org/journals/microbiology/articles/10.3389/fmicb.2024.1337368/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit

ナバルン・チャクラボルティ
ナバルン・チャクラボルティー
*
医療準備システム生物学、CMPN、WRAIR、シルバースプリング、メリーランド州、米国
宿主と常在微生物叢を包括するメタ生物は、病気との闘いやストレスへの対応において重要な役割を果たしている。そのため、この生態系に関する知識ベースを構築すること、特に宿主と微生物叢の双方向の関係を明らかにすることへの関心が高まっている。このような状況の中で、メタボロミクスはこの生態系全体の主要な収束ノードとして浮上してきた。この有用なオミックス要素を系統的に理解することで、生物固有の応答軌跡と、メタ生物を含む生態系全体のコミュニケーショングリッドを解明することができる。この知識を栄養補助食品や次世代治療の設計に応用することは、現在進行中である。その大きな障害となっているのは、この生態系の中で微妙なバランスを保っている根本的なメカニズムに関する知識のギャップである。この知識のギャップを埋めるために、微生物叢と代謝物の関係ダイナミクスに主眼を置いて、利用可能な情報の全体像を提示した。本稿の中心テーマは、腸脳軸と、大脳機能に影響を与える関与微生物代謝産物である。
はじめに
常在細菌叢、すなわち「人体内または人体上に生息する微生物の集合体」(Merriam-Webster, n.d.)の総数は、ヒトの細胞数をわずかに上回る(Sender et al.) 体重70kgの成人男性には39兆個の細菌が存在し、30兆個のヒト細胞(有核細胞および無核細胞、例えば赤血球を含む)と共生していると推定される(Sender et al. 細菌と宿主細胞の比率は、成人男性で1.3、成人女性で2.2と幅がある(Sender et al.) 成人女性におけるより高い微生物細胞負荷は、女性生殖管(Punzon-Jimenez and Labarta, 2021)と膣(Fu et al., 2020; Srinivasan et al., 2022)にコロニー形成された微生物の独特で複雑な生態系に起因しており、この生態系は月経周期(Krog et al. したがって、この研究分野で何らかの推論を行うには、男女を問わずこの多様な微生物生態系を考慮することが不可欠である(Auriemma et al.
人体の内因性微生物叢は、そのほとんどが腸内に集中している。腸内微生物群集は、細菌(109~1011個/g)(Senderら、2016;Cani、2018)と古細菌(108~1010個/g)(Kimら、2020)によって主に濃縮されている。腸管内腔をコロニー形成するもう一つの主要な微生物は、細胞内寄生生物であるウイルスであり、バクテリオファージは宿主の細菌多様性を制御する主要なウイルス種である(Scanlan, 2017)。ヒトの糞便1グラムあたり109〜1010個のウイルス様粒子(VLP)が存在することから、細菌はウイルスを約10対1で上回っている(Shkoporov and Hill, 2019)。ヒトゲノムには約20,000の遺伝子が含まれているが、宿主と常在微生物の組み合わせであるホロゲノムには3,300万以上の遺伝子が含まれている(Lloyd-Price et al.) これらの遺伝子の93%は細菌に属し(Sender et al., 2016)、ウイルスはDNA全体の5.8%など、2番目に大きなシェアを占めている(Arumugam et al., 2011)。この腸内細菌叢は共に、宿主とのバランスの取れた生態系を育み、この相互作用的な環境がメタオーガニズム(Theis et al. 理論的には、メタオーガニズムまたはホロビオント概念は、宿主と常在微生物叢の両方の生物学、生態学、進化を含むホリスティックな宿主-微生物叢相互作用圏を研究するものである。ここでは、メタ生物の生物学に焦点を当てる。
機能的マイクロバイオーム(Lam et al., 2015; Berg et al., 2020)は、メタゲノミクス、メタトランスクリプトミクス、メタプロテオミクス、メタボロミクス(しばしばメタボロミクスと呼ばれる)など、微生物に関連するさまざまなオミクス層によって構成されている(Zhang et al. 機能的マイクロバイオームの重要な役割の一つは、常在微生物と宿主の末梢組織(心臓、肺、腎臓、脳など)との間のクロストークを強固に維持することである。この文脈でおそらく最も研究されているテーマである腸脳軸は、神経炎症、神経変性、神経毒性、行動・感情・記憶構成など、いくつかの脳機能を制御する宿主の脳と腸内常在菌との間の双方向コミュニケーションを具体化したものである(Mayer et al.)
ユビオシス、すなわち常在細菌叢のバランスのとれた存在量プロファイル(Iebbaら、2016;Al-Rashidi、2022)は、宿主に利用可能な資源がその常在細菌叢と体系的に共有されることで、宿主との共生関係を育む。共生微生物組成は炎症を制御し、エネルギーの恒常性と強固な腸脳軸を維持する(Lloyd-Price et al.) 対照的に、ライフスタイルの変化や外敵からの挑戦など、ストレスの多い状況は、宿主のリソースに対する要求を高め、最終的には宿主と微生物叢が共有プールからリソースを奪い合うことを余儀なくされる。その結果、微生物の多様性が変化すると、適応性微生物叢と通性微生物叢が増殖し、生態系全体が腸脳軸を含む宿主-微生物間のコミュニケーションを混乱させる可能性のあるディスバイオーシスへと移行する(Chen and Devaraj, 2018; Dabke et al., 2019; Louis-Jean and Martirosyan, 2019; Cryan et al.)
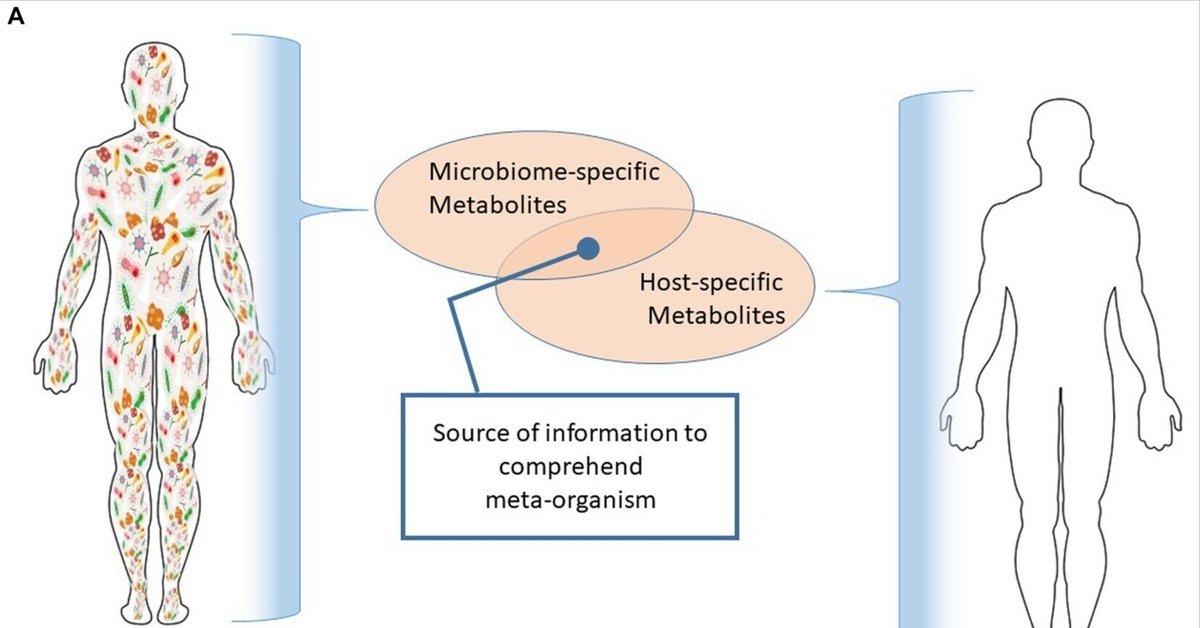
腸-脳軸を含む宿主-微生物叢のコミュニケーショングリッドは代謝物の交換によって構築されているため、代謝物はメタ生物の重要な情報ハブである(Ramautarら、2013;Wishart、2019;Wachsmuthら、2022)。宿主細胞や微生物における生物学的ネットワークの中間体であり誘導体である代謝産物は、生態系の収束ノードであるように見える(Krautkramer et al.、2021)。この概念を説明するために、図1Aは、宿主とその常在微生物叢の間のクロストークの主要なノードとして代謝物を描いている。図1Bは、様々な代謝産物スーパーファミリーのサイズを示している。これらの代謝産物スーパーファミリーは、宿主、環境、常在微生物叢、およびそれらの間の相に関連している。微生物代謝産物は最も数が少ない(Krautkramer et al.、2021)。
図1
www.frontiersin.org
図1 (A)複数の王国の収束ノードとしての代謝物。この図は、宿主(例えばこの場合はヒト)が代謝産物クラスターを産生することを示している。同様に、常在細菌叢は別の代謝物クラスターを生成する。これら2つのクラスターの機能的相互作用の特徴を明らかにすることで、メタオーガニズムを制御する根本的なメカニズムを知ることができる。(B)ヒト、環境、およびヒトにコロニー形成する微生物から生成される代謝産物の比較数。円は、その存在量の違いを目で見て推定できるように縮尺を変えて描かれている。
本総説では、あらかじめ設定した除外・包含基準によって引用文献をキュレーションするのではなく、仮説に基づいて引用文献を選択し、以下の順序でレビューを作成した。第1章では、メタボロミクスについて簡単に説明し、利用可能な検出ツールや関連データベースを中心に、代謝物と他のオミックス成分との関連を明らかにする。第2章では、常在細菌のマイクロバイオームとその多様性プロファイル、そしてこの生態系が宿主の健康をどのようにコントロールしているかについて述べている。第3章では、微生物の代謝産物、例えば宿主内または宿主上にコロニー形成された常在菌によって合成される代謝産物に焦点を当てる。第4章では、腸脳軸について論じている。このコミュニケーションの枠組みを支える代謝産物とマイクロバイオームの潜在的な役割、および中枢神経系(CNS)に関連する疾患の病因について、付随的に論じている。結論として、メタオーガニズムを理解する上での知識のギャップを強調し、ヘルスケアやそれ以外の分野での将来の応用を示唆する。この総説で使用される重要な用語は、Box 1で定義されている。
代謝物:現在の展望
代謝物は、細胞、組織、臓器レベルでの生物学的活動の基質、中間体、最終産物である(Ramautar et al.) 代謝物は、宿主のゲノム、エピゲノム、プロテオミクス活動の典型的な下流産物である。現在の機能では、ヒトゲノムにコードされた約1,900種類の代謝酵素に関連する200,000種類以上の内因性代謝物を検出することができる(Kanehisa and Goto, 2000)。一方、微生物は約16,000種類の代謝物を産生するが、そのうち約1,800種類は微生物群集のみが産生し、残りはヒトと微生物の両方が産生する。さらに、多くの代謝産物は環境と関連している。例えば、~32,000、~900、~160の代謝物が、それぞれ食事、毒素、薬物と関連している(Metabolite Statistics, n.d.)。約100万~300万個の異種生物代謝物や合成産物は、医薬品、化粧品、食品サプリメント、汚染物質などに相当し(Idle and Gonzalez, 2007; Johnson et al. これらの代謝物のサブセットは、毒性物質やメタ生物に対する異物刺激物質として分類されている(Gonzalez-Sanchez and DeNicola, 2021)。
新たな知見により、代謝物の役割は、疾患発症(Mamasら、2011)、免疫調節(Levyら、2016)、臓器間コミュニケーション(Levyら、2016;Frezza、2017)など、多くの生物学的機能と関連付けられている。実際、生理学的および心理学的ストレス、外部刺激物への曝露、または食事やライフスタイルの変化による生化学的活動の変化は、代謝物の発現を変化させ(Liuら、2021)、最終的にメタ生物の全体的な健康に影響を及ぼす(Milovicら、2000;Amaralら、2009)。したがって、メタボロミクスは、宿主、その常在微生物叢、および包括的な環境を構成する複数の生物にまたがって共起する分子活性に関するタイムセンシティブな情報を保持している。
代謝物を検出する技術的能力は、最先端のツールや高度に充実したデータベースの開発により、近年、高分解能かつ頑健な水準に達しています。表1に代謝物の検出と特性解析に利用できる代表的なツールを示します。質量分析ベースのツールは、その高いスループットと高感度検出能力により最も普及している (Dührkop et al., 2021)。分光光度計の小型化における最近の技術開発により、これらのツールの携帯性、手頃な価格、過酷な条件下での操作性が向上したため、その適用性は大きく変化した(Alseekh et al.) 代謝物に関する知識をさらに深めることができる補助的なツールもある。例えば、核磁気共鳴(NMR)分光法は代謝物の構造を明らかにすることができる(Wishart et al.) 空間分解能で代謝物を検出するラマン分光法の能力は、最近、単一細胞のメタボロミクス研究に応用されている(Berry and Loy, 2018)。組織化学のような低スループットのオプションは、標的代謝産物の空間的濃縮を検出するユニークな機会を提供する。この空間情報は、中枢神経系(CNS)への代謝物のマッピングに不可欠である可能性がある。この空間情報は、血液脳関門(BBB)を介したメタボローム発現の差異を明らかにすることができる。推測ではあるが、この知識は腸-脳軸における代謝産物の役割の理解に役立つ(Mayer et al.)
表1
www.frontiersin.org
表1. 代謝物を測定する機器/ツールの比較説明。
代謝物を同定する技術的能力がデータベース構築の限界であるため、適切なデータベースの開発は現在も継続中である。表 2 に、代謝物の特性評価に役立つ代表的なデータベースを 3 つの方法で示します。例えば、これらのデータベースは、(1)代謝物と宿主の生体機能との関連を見つける、(2)代謝物と微生物の機能との関連を見つける、(3)代謝物によって強化された生体ネットワークやパスウェイを介して宿主と微生物叢をつなぐシステム統合を促進する、などの機能を備えています。これら3種類のデータベースのうち、宿主特異的データベースはおそらく最も成熟した段階にある。その理由のひとつは、微生物群集全体の分類学的決定要因をまだ完全に理解できていないからである(Zhu et al.)
表2
www.frontiersin.org
表2. メタボロミクスと機能的メタゲノミクスを用いた予測機能モデルの開発に利用可能な計算ツール。
これらの代謝物の生物学的機能を理解し、その機能的・生物学的関係に基づいて、さまざまな界(哺乳類、細菌など)およびウイルスを横断して統合する取り組みが活発化している。これらの関係は通常、統計的手法(共発現代謝物の相関分析や濃縮分析など)か、あるいは先験的情報に基づいて代謝物と特定の疾患(癌腫など)や生物学的ネットワーク(HPA軸異常など)を関連付けるのに役立つ利用可能な文献をキュレーションして生化学的情報を収集する(Amara et al. その後、この情報を収束させて第一原理代謝物ネットワークトポロジーを構築します(Naake and Fernie, 2019)。例えば、表2に示したIPAおよびKEGGパイプラインは、先験的知識を統計的に統合し、メタボロミクスをネットワーク層の1つとするマルチオミクス連想行列を推論する(Subramanian et al. 次に、このネットワークトポロジーをメタ生物全体にマッピングし、洞察を得ることができる。表2に、異なる界や生物にまたがるメタボロミクスを統合することで、メタ生物に関する情報を得ることができるMIMOSA(Noecker et al.、2016)、BioTransformer、およびgutMGene(Cheng et al.、2022)データベースを示します。この知識は、治療戦略の設計につながる可能性がある(Shi et al.)
本章を要約すると、メタボロミクスは汎オミクスファミリーの重要なサブ分野であり(Brestoff and Artis, 2015; Bae et al., 2019; Krautkramer et al., 2021; Spivak et al. 現在進行中の取り組みでは、代謝物を、潜在的な治療標的となりうる上流および下流の制御因子に結びつけることを目指している(Olivotto et al., 1984; Lee and Finkel, 2013)。代謝物の発現レベルは、宿主の疾患病態、食事、地理的位置、概日リズムの影響を受けやすいため、この情報収集プロセスにはカスタマイズが必要である(Jones et al.) 詳しく説明すると、腸内細菌由来のTMAの肝臓酸化産物であるトリメチルアミンオキシド(TMAO)の存在量は、2型糖尿病や肝/腎疾患などの特定の疾患タイプだけでなく、魚強化食を摂取する集団の間でも有意に過剰発現している(Subramaniam and Fletcher, 2018)。さらに、代謝物プロファイルの地理的位置に対する感受性は、母乳誘発代謝物および微生物叢の大陸横断的多様化によって強調されている(Gómez-Gallego et al.) 糞便微生物叢および対応する代謝産物の組成と特性は、多くの固有および外因性因子の影響を非常に受けやすい。したがって、糞便代謝物の検出精度と再現性は、研究デザインとサンプリングプロトコルに決定的に依存する(Weinstock, 2012; Scherz et al.) ここでは、糞便サンプル採取の最適化される可能性のあるプロトコルについて議論する(Mathayら、2015;Vogtmannら、2017;Jonesら、2021)。糞便サンプルの1回の採取で微生物叢の動的性質を正確に表現できるとは考えにくいため、糞便サンプルを縦断的に収集することが不可欠である可能性がある(Jonesら、2021;Zhengら、2022)。
代謝物の真の影響を理解するためには、これらすべての要因を考慮する必要がある。結論として、システム知識の統合は、異なる界、生態系、および機能的微生物叢の縦断的プロファイル間の関係ダイナミクスを解明する鍵となる可能性がある。以下の章では、機能的メタゲノミクス(微生物叢と宿主の双方向の関係)を決定する上で、代謝物がいかに重要な役割を果たすかを明らかにする。
微生物生態系:多様性プロファイルと疾患発症
ホロゲノムには、宿主ゲノムの約1,600倍もの微生物遺伝子が含まれている(Lloyd-Price et al.) この推定だけでも、宿主と常在微生物叢の共生的双方向関係で繁栄するメタオーガニズムの本質的な複雑さを強調することができる。この宿主と微生物叢のクロストークは、宿主とその常在微生物の共進化、外来要素との同調的相互作用、共生的関連性、生態学的または相互主義的協力関係によって形成され、それに寄与している(Ogunrinola et al. したがって、微生物の多様性を定量化することで、疾患の病因を明らかにすることができると考えられる。
微生物の多様性の推定は、主に次の2つの要素に依存する:豊かさ(独立した種の数を測定)と均等性(異なる種の相対的な存在量を定量化)。アルファ多様性は、群集内の微生物プロファイルの均等性と豊かさを測定する(Baczkowski et al.) ルーチン、すなわちシャノン多様性、シンプソン多様性、チャオ1は、アルファ多様性の異なる特徴を定量化する(GitHub, n.d.)。シャノン多様性は、特定の群集にコロニー形成された有効な種の数を推定し、微生物プロファイルの均等性と豊かさ(均等性に重み付け)の両方を定量化する。チャオ1は、特定の生物群集の種の数または総豊富度を推定する。シンプソン多様性は主に優性指数であり、この推定では一般的な種や優性種に重みが置かれるからである。一方、ベータ多様性は、群集横断的な微生物プロフィールの特徴である(Baczkowski et al.、1998)。重み付けされていないUnifracは、群集全体の異なる分類群の有無を定量化するのに対し、重み付けされたUnifracは異なる分類群の存在量を考慮する。Bray-Curtis指数は群落間の存在量ベースの非類似度を推定し、Jaccard指数は群落間の出現率(存在対不在)ベースの多様性を測定する(GitHub, n.d.)。
バランスの取れた生態系からの変化や生物多様性生態系の異常は、食事や生活習慣の変化(Ghosh et al.、2013)、年齢(Mariat et al.、2009)、肥満(Magne et al.、2020)、概日リズム(Thaiss et al、 2014, 2015)、がん(Sheflin et al., 2014; Biragyn and Ferrucci, 2018)、心血管障害(Lau et al., 2017)、免疫機能障害(de Oliveira et al., 2021)、いくつかの精神疾患(Sarkar et al., 2018; Parker et al., 2020)などの疾患病態に関与している。例えば、注意欠陥多動性障害(ADHD)の若年成人(平均年齢:~13歳)において、腸内細菌叢のα多様性の低下が認められた。この測定はシャノン多様性とチャオ1指数によって推定され、ADHDに関連する腸内微生物の豊かさの低下を示している可能性が高い(Prehn-Kristensen et al.) 独立した若年(平均年齢~8歳)のコホートからは、対照的な像が浮かび上がり、ADHDの被験者のシャノン多様性とチャオ1指数は、健常者の基準値よりも高いことが明らかになった(Wang L. J. et al.、2020)。これらの研究は、微生物の多様性に複数の要因が同時に影響することを浮き彫りにした。
多くの場合、微生物生態系の全体的な変化を特徴づけるために、アルファ多様性とベータ多様性の指標を組み合わせた分析が用いられる。例えば、子宮頸がん患者の糞便微生物叢におけるアルファ多様性には差が見られなかった。それでも、加重ユニフラック・アルゴリズムとブレイ・カーティス・アルゴリズムによって測定されたベータ多様性は、コミュニティ内ではなく、コミュニティ横断的な微生物量のシフトを強調する有意差を明らかにした(Wang Z. et al.) 同様に、生理的ストレスは、若い男性の腸内微生物に有意なアルファ多様性とベータ多様性を引き起こした。シャノン非類似度とチャオ1指数は、群集内の微生物の豊かさのシフトを示唆し、ブレイ・カーティス分析は、トランス群集のシフトを示唆した(Karl et al.)
高分解能検出技術の進歩により、腸内常在菌の個々のコミュニティメンバーをプローブできるようになった。単一の微生物の存在量プロファイルや、隣接する常在菌との関連した存在量プロファイルは、精度の高い情報を提供することができる。例えば、バクテロイデーテス(Bacteroidetes)とファーミキューテス(Firmicutes)の比率の変化は、年齢(Mariat et al. 微生物の存在量プロファイルを概日リズムと関連付けると、乳酸桿菌の相対的な存在量は、活動期よりも休息期にエスカレートすることが報告されている(Thaissら、2014年)。
次世代介入戦略を開発するために微生物多様性プロファイルを利用することへの評価が高まっている。サクセスストーリーの聖火ランナーは、微生物多様性を操縦することによって腫瘍増殖を停止させ(Riquelmeら、2019年)、心血管疾患を改善し(Huら、2019年)、病原性侮辱を排除した(Huiら、2019年)糞便微生物叢移植(FMT)法である。しかし、この介入方法のトレーサビリティ、安全性、標準化プロセスに関する懸念のために、治療オプションとしてのFMTの可能性はおそらく制限されている(Osmanら、2022;Vaughnら、2023)。腫瘍内の低酸素状態が嫌気性微生物にとって好都合であるという仮説に後押しされ、嫌気性細菌の組織的コロニー形成が腫瘍細胞の増殖と転移を阻止することに成功した(Drozdzら、2020年)。さらに、ディスバイオシスの知識は、がん腫を治療する免疫療法のための食事サプリメントのカスタマイズに役立った(Routyら、2018年)。
微生物コロニーの体系的な操作は、いくつかの疾患と闘うための潜在的な治療オプションとして浮上してきた。それにもかかわらず、この介入プロセスを強固で効果的なものにするためには、その分子基盤の包括的な理解が必要である。このような背景から、次章では微生物に基づく治療戦略を設計する上で重要な役割を果たす可能性のある微生物代謝産物に焦点を当てる。宿主の代謝産物と統合されれば、その知識は共生関係の生物学的基盤を明らかにし、新たな治療法の選択肢につながる可能性がある。
微生物代謝産物とその生物機能スペクトル
恒常的な状態では、微生物代謝産物の発現レベルは、宿主の遺伝的素質、年齢(Connellら、2022)、地理的位置、食習慣、様々な生活習慣の特徴などの環境要因によって制御される(Guptaら、2020;Krautkramerら、2021)。興味深いことに、ヒトの微生物特異的代謝産物は、宿主の代謝産物が20万個以上であるのに対し、微生物特異的代謝産物は2000個以下である。しかし、微生物ゲノムのサイズはヒトゲノムをはるかに上回っている(Lloyd-Price et al.) 微生物代謝産物の数が少ないのは、微生物が行う代謝機能がかなり合理化されているためである可能性がある。Ahmedら(2022)とKrautkramerら(2021)は、これらの微生物由来の代謝産物について幅広くレビューし、それらの生物学的機能がどのように様々な末梢組織に到達し、宿主の健康と体力を確保するかを報告している。
微生物の多様性は、微生物の代謝産物プロファイルによって効果的に反映される。そのため、宿主の健康を改善するために微生物の代謝産物を操作することを目的とした複数の継続的な取り組みが行われているが、適切な知識が不足しているため、これらの取り組みは大きな課題に直面している(Entwistle et al.) いくつかの利用可能な文献(Yano et al., 2015; Rath et al., 2017; Fung et al., 2019; Wang S. P. et al., 2020; Krautkramer et al., 2021; Mou et al., 2021; Otaru et al., 2021; Ahmed et al., 2022)をスクリーニングした後、細菌と代謝物の関係ネットワーク(図2)が構築された。このネットワークは、特定の代謝物ファミリーが合成される生物学的部位(細菌など)を通知する。このようなネットワークは主に先験的知識に基づいて構築されているため、その妥当性は文献と実験的フィードバックの継続的なクロスチェックにかかっていることに注意することが重要である(Amara et al.) 第二に、代謝産物とウイルスや古細菌などの他の生物とを結びつける同様の関連ネットワークは、微生物代謝産物の機能的なアウトリーチを完全に特徴付けるために不可欠であり、この側面はまだ未開発である。表 2 にこの知識ギャップを埋めることを目的としたデータベースを示し、図 2 にこれらの微生物代謝物とその細菌源をマッピングします。
図2
www.frontiersin.org
図2. 細菌と代謝物の関係ネットワーク。楕円形と四角形のノードは、それぞれ常在細菌の属または種と代謝物ファミリーを表す。実線のエッジは細菌の種または属とその秘書代謝物を結ぶ。セロトニンに収束する一連の破線エッジは、これらの細菌からのセロトニン産生の直接的な証拠はないが(Yano et al., 2015; Fung et al., 2019)、存在量の相関シフトを示した細菌種に接続している。二重実線でGABAとBacteroidetesを結び、BacteroidetesがGABAを産生する酵素をコードしていることを示唆した(Otaru et al.、2021)。このネットワークシステムは、多くの発表文献(Pokusaeva et al., 2017; Rath et al., 2017; Wang et al., 2020; Krautkramer et al., 2021; Mou et al., 2021; Ahmed et al., 2022)を参考にして構築した。黄色、緑色、青色のボックスはそれぞれ、小鎖脂肪酸(SCFA)、アミノ酸およびその誘導体、その他に関連する代謝物を表す。GABA、γ-アミノ酪酸;TMA、トリメチルアミン;Imp、イミダゾールプロピオン酸;PAGln、フェニルアセチルグルタミン;PAGly、フェニルアセチルグリシン。
二次胆汁酸(SBA)と短鎖脂肪酸(SCFA)は、ヒトにおける2つの主要な微生物代謝産物である。高脂肪食は、腸管内腔におけるSBAの生合成を誘発する(Ridlonら、2016;Zengら、2019)。デオキシコール酸とリトコール酸は、一次胆汁酸の脱水素化によって産生される2つの重要なSBAである(Ridlonら、2016;Zengら、2019)。さらに、腸内細菌叢は一次および二次胆汁酸をエピマー化および酸化して、iso-、alo-、oxo-およびketoファミリーのSBAを産生するが、これらは比較的発現量が低く、その機能的属性はまだ完全に理解されていない(Wahlstrom et al.)
SCFAは主に酢酸、プロピオン酸、酪酸から構成され、健康な宿主ではそれぞれ約60:20:20のモル比で存在する。その他の低量SCFAとしては、フマル酸、コハク酸、乳酸、ピルビン酸があり、これらは異なる微生物間の相互摂食に利用される(Macfarlane and Macfarlane, 2003; Silva et al.) ペントースリン酸経路とエンブデン-マイヤーホフ-パルナス解糖経路が、それぞれ炭素数5の基質(キシレン、ペクチンなど)と炭素数6の基質(フルクトース、スクロース、デンプン、セルロースなど)を異化してSCFAを生産するため、難消化性炭水化物の嫌気性発酵がSCFA生産の主要な経路である(Krautkramer et al.) 簡単に説明すると、ペントースリン酸経路と解糖経路の共通の最終産物はホスホエノールピルビン酸であり、これはNADPHとNAD+の間の吸熱性循環変換によってピルビン酸に変換される。ピルビン酸は基本的にすべての主要なSCFAの上流基質である。例えば、酢酸と酪酸はピルビン酸からアセチルCo-A中間体を経由して生成され、二酸化炭素とエタノールが主な副生成物であり、プロピオン酸は二酸化炭素を主な補因子とするコハク酸経路を経由して生成される(Fernandez-Veledo and Vendrell, 2019)。乳酸とギ酸は、ピルビン酸代謝からのさらなる下流産物である。微生物におけるこれらの代謝産物の生産は、通常、食餌資源へのアクセスとストレス因子によって制御される。例えば、酢酸と乳酸は通常、炭水化物が過剰な場合に産生される。一方、微生物群に対するエネルギーが制限されると、一般的にプロピオン酸の合成が促進される(Macfarlane and Macfarlane, 2003)。
炭水化物の不足および/または高い結腸pHは、タンパク質発酵を介したSCFAの生成を誘導する(Neisら、2015)。SCFAsに加えて、微生物におけるタンパク質発酵は葉酸、フェノール、インドールを生成する。ロイシン、イソロイシン、バリンなどの分岐鎖アミノ酸の異化により、イソ酪酸とイソバレレートが生成されるが、これらは通常低濃度で蓄積される(Macfarlane and Macfarlane, 2003; Silva et al.) キヌレニンとセロトニンは、必須アミノ酸であるトリプトファンの異化の主要産物である(Ostapiuk and Urbanska, 2022)。人体のセロトニンの90%近くは大腸、特に大腸上皮のエンテロクロマフィン細胞で産生されている。現在のところ、マイクロバイオームがセロトニンを産生するという直接的な証拠はないが、マイクロバイオームがセロトニン作動性ネットワークに典型的に寄与するいくつかのコンティグをコードしていることから、そのような可能性を否定することはできない(Yano et al.) さらに、セロトニンの濃度低下は、無菌マウスにおけるトリプトファンの存在量の増加と関連して報告されており、これはセロトニン産生に対する微生物の影響を間接的に示唆している(Strasser et al.) 別の必須アミノ酸、すなわちヒスチジンは、様々な細菌種で脱炭酸を受けてヒスタミンを産生し、この最近の発見は、アレルギーや免疫治療の分野で大きな可能性を持つ可能性がある(Mou et al.) チロシンやL-ドーパなどの非必須アミノ酸やSCFA、特に酪酸は、様々な細菌種で代謝され、腸脳軸の重要な調節因子であるドーパミンを産生する(Villageliu and Lyte, 2018)。
微生物代謝産物は、代謝産物の発現レベルと標的臓器によって、有益な役割も有毒な役割も持ちうる。例えば、SBAの低発現(5~50μM)は結腸がん細胞の増殖と浸潤を促進する。一方、発現レベルが高い場合(50μM以上)、SBAは大腸細胞周期を阻害し、がん細胞のアポトーシスを活性化する(Milovic et al.) 中枢神経系では、キヌレン酸は神経保護剤として働くが、肝臓と腎臓ではインスリン合成を阻害する(Ostapiuk and Urbanska, 2022)。SCFAは、生体エネルギー産生、腸の完全性の維持、活性酸素種産生を介した抗炎症の促進など、様々な機能を持つ(Tan et al.) 一方、ホスファチジルコリン誘導体であるTMAOは、酸化ストレス、高脂血症、炎症促進に関連している(Agusら、2021)。
このような背景から、腸内細菌叢が末梢臓器とどのようにコミュニケーションしているかについての関心が高まっている。例えば、腸内常在菌のディスバイオーシスは、肺の健康や喘息(Hufnaglら、2020年)、肝臓免疫学(Trebickaら、2021年)、腎不全(Zakyら、2021年)、複数のがん発症(Alexander and Turnbaugh、2020年;Sánchez-Alcoholadoら、2020年;Zhengら、2020年;Kandalaiら、2023年;Xiaら、2023年)と関連している。実際、in vivoモデルでは、微生物代謝産物が概日リズムとその乱れにどのように関連しているかが示唆された(Tahara et al.、2018)。生体エネルギー産生、体性炎症(Alexander and Turnbaugh, 2020)、生理的パフォーマンス(Borrego-Ruiz and Borrego, 2024)における微生物代謝産物の役割は、幅広く研究されている。現代社会では心理的な問題が健康上の懸念事項として広まっているため、腸脳軸に関する研究は宿主マイクロバイオーム研究の震源地となっている。図3は、これらの微生物代謝産物と様々な脳疾患や併存疾患との機能的関連性を示す図であり、次章では腸内細菌-メタボライト-脳軸に焦点を当てる。
図3
www.frontiersin.org
図3. 微生物代謝産物と関連する脳機能および併存疾患。緑色のノードは、細菌の属や種のようなその生成者と関連付けるために図2でマッピングされた微生物代謝産物を表す。エッジは代謝物と様々な機能との関連を表し、すべてのエッジは異なる結合様式を強調するために異なる方法で作られています。機能は、脳機能と心理的ストレスの併存疾患の2つのグループに分類されている。SCFA、小鎖脂肪酸;TMAO、トリメチルアミンN-オキシド;NADP、ニコチンアミドアデニンジヌクレオチドリン酸;NAD+、ニコチンアミドアデニンジヌクレオチド。
腸内細菌叢-メタボライト-脳軸
腸内細菌叢-脳軸は、腸と脳の間の主要なメッセンジャーとして代謝産物を採用するフィードバック制御回路である(Mayerら、2015;Ahmedら、2022)。ヒトの脳へのアクセスが限られているため、腸脳軸の概念はこれまで主に動物モデルに基づいて構築されてきた。腸内細菌叢-メタボライト-脳軸が神経生理学とシグナル伝達ネットワークを制御し、さまざまな行動構成を制御していることを示す証拠が増えつつある。常在腸内細菌と大脳の健康との関連は、無菌マウスのコロニーを調べたところ、BBB上のタイトジャンクションタンパク質の発現が阻害され、BBB透過性が亢進したことから示唆された(Branisteら、2014;Parkerら、2020)。同様に、抗生物質の長期投与はマウスの腸内常在菌の量を減少させ、このコホートは認知機能の欠損と記憶喪失を示し、記憶を処理する主要な脳領域である海馬の神経新生も低下した(Fröhlichら、2016)。無菌マウスでは、交感神経系の主要な構成要素である視床下部-下垂体-副腎(HPA)軸の活動が亢進し、Bdnf遺伝子発現の上昇(Mancaら、2020年)と血流中のコルチコステロンの蓄積(Neufeldら、2011年)が組織化された可能性がある。Desbonnetら(2014)は、腸内常在菌と社会的スキルの発達を関連付け、無菌マウスが社会的関与の低下とともに社会的回避と自己グルーミングの増加を示したと報告している。このネガティブな結果は、宿主の常在菌の増殖を助けるプロバイオティクス食を投与することで逆転した(Desbonnetら、2014;Fröhlichら、2016)。
生態系全体の多様性の変化(Uronis et al., 2011; Prehn-Kristensen et al., 2018; Tran et al., 2019; Wang L. J. et al., 2020)や、特定の分類群(例えば、ファーミキューテスとバクテロイデーテスの比率)の比較存在量の変化(Mariat et al. 詳しく説明すると、外傷性脳損傷と心的外傷後ストレス障害-現代戦で最も多く見られる2つの精神障害-は、糞便微生物叢と関連している。例えば、PTSD様形質を刺激する社会的ストレスモデルマウスは、ファーミキューテスとバクテロイデーテスの比率の時間分解的変化とともに、腸内細菌の全体的な存在量プロファイルの時間非依存的変化を引き起こした(Gautam et al.) 同時に、これらのストレスマウスは行動欠損、代謝機能障害、神経毒性(Muhieら、2017)、海馬、扁桃体、前頭前皮質における神経細胞形態の変化を示した(Anilkumarら、2022)。糞便サンプルでは、細菌門の総存在量、すなわちActinobacteria、Lentisphaerae、Verrucomicrobiaは、PTSD指数の上昇と直接関連していた(Hemmingsら、2017)。外傷性脳損傷(TBI)患者の糞便サンプルにおけるDeferribacteresのような偏性嫌気性細菌の増殖は、TBIが内因性のエネルギー欠乏により結腸内腔の低酸素状態を誘発することを潜在的に強調している(Nicholson et al.)
腸と脳のコミュニケーションは、血流やリンパ系を介した神経伝達物質や神経調節物質の伝達、迷走神経(VN)を介したシナプス伝達によって促進される。血液中の微生物代謝産物のほとんどは、BBB上に発現するキャリアタンパク質や受容体を介して、あるいはBBBの完全性を損なうことによってBBBを通過する(Ahmedら、2022年)。副交感神経系の重要な構成要素であるVNは、CNSと腸神経系(ENS)を包含する、腸内細菌叢と神経系との間の並列コミュニケーションチャネルを構成している(Parkerら、2020)。In vivoの研究では、神経線維が腸上皮を貫通しないため、微生物集団はVNと直接つながっていないことが観察された。その代わりに、微生物生態系の変化とそれに対応する代謝産物レベルのシフトが、宿主消化管の神経内分泌シグナルを撹乱する。下流のシグナルは、迷走神経求心性神経上の一連の受容体および神経脚細胞を介するシナプス伝達を介して脳に伝わる(Parkerら、2020;Ahmedら、2022)。
腸管上皮は、脳と腸内細菌叢のコミュニケーションに不可欠な役割を果たしている。ストレスや環境の変化に擾乱され、腸管上皮のニューロン、免疫細胞、粘膜細胞は、カテコールアミン、セロトニン、ダイノルフィン、サイトカインを腸管内腔に放出する。このプロセスにおいて重要な役割を果たす腸上皮のエンテロクロマフィン細胞は、食物摂取に関する情報を受け取る第一線として働く可能性があり、VNを活性化すること[時にはミリ秒の時間枠内で単一のシナプスを介して(Kaelberer et al、 Bohórquezら、2015;Gribble and Reimann、2016)。このエンテロクロマフィン細胞を介したセロトニン産生は、クロストリジウム属などの微生物や、インドール、ノルエピネフリン、酪酸などの代謝産物によって調節される(Yano et al.) このセロトニンプールはしばしば末梢セロトニンと呼ばれ(El-Merahbiら、2015)、セロトニンはBBBを通過できないため、CNS内部で生成されるセロトニンプールとは独立して機能する(Bergerら、2009)。気分、睡眠、ストレス反応の制御における脳内セロトニンの役割は比較的よく研究されているが(Bergerら、2009;Strasserら、2016)、末梢セロトニンの役割はまだ十分に理解されていない(El-Merahbiら、2015)。SBAは、BBBを通過できないもう一つの主要な微生物代謝産物であるが、予備的な知見では、脳機能の調節におけるSBAの一定の役割が示唆されている(Monteiro-Cardosoら、2021年)。
腸上皮細胞を介して腸管内腔に放出されるストレスシグナルは、腸管内腔の温度や圧力とともに、胃腸液のpHや粘度を変化させる(Parkerら、2020;Ahmedら、2022)。その結果、微生物組成とその運動性は、過剰な乳酸や減少した生体エネルギーなど、利用可能な資源を最適に利用するように適応し、不利な環境でも生き延びるようになる。腸内微生物生態系の変化が正常な恒常性の範囲を超えた場合、治療的介入が必要となる。さらに、これらのプロセスを放置すると、腸管上皮が透過性になり、腸内微生物叢が血流に入り込むようになる-この状態は腸管漏出として知られている(Chakaroun et al.) 機能的メタゲノミクスの変化は、発現量の異なる微生物代謝産物によって反映される。
常在菌の生態が変化すると、芳香族アミノ酸に由来する多種多様な神経伝達物質が分泌され、それらは興奮性神経伝達物質(グルタミン酸、ドーパミン、アセチルコリンなど)や抑制性神経伝達物質(GABAやグリシンなど)として脳機能に作用する(Spivak et al.) また、これらの神経伝達物質の合成や生体機能は、様々な補因子(年齢など)や複数の末梢組織(腎臓や肝臓など)によって制御されていることも重要である。しかし、これらの補因子が腸内常在菌に及ぼす影響の程度については、まだほとんど解明されていない。
脳の大脳皮質領域で最も顕著な神経伝達物質であるグルタミン酸は、キヌレン酸によって制御されており、大腸乳酸桿菌とシュードモナス属はトリプトファン代謝を介して全身のキヌレン酸蓄積のかなりの部分を担っている(Ostapiuk and Urbanska, 2022)。もう一つの興奮性神経伝達物質であるドーパミンの合成は、p-クレゾールによって制御され、いくつかの末梢組織と大腸乳酸菌およびクロストリジウム属で合成される(Pascucci et al.) p-クレゾールはドーパミン作動性ネットワークの調節に加えて、オキシトシン作動性ネットワークとオピオイド作動性ネットワークを調節し、行動の可塑性を誘導する(Putnam and Chang, 1858)。一方、最も豊富な糞便微生物の一つであるバクテロイデーテスは、脳の主要な抑制性神経伝達物質であるGABAの産生に関連するグルタミン酸脱炭酸酵素コード遺伝子をコードしている(Otaru et al.)
クロストリジウム属、フソバクテリウム属、アシダミノバクター属はSCFAの主要産生菌であり、糞便中に多く存在するファーミキューテス属は主に酪酸を分泌する(Eeckhaut et al.) SCFA、主にプロピオン酸と酪酸は、多くの健康に有益な機能に関与している(Louis and Flint, 2017);例えば、適応免疫系を制御し(Louis and Flint, 2017)、この過程で、炎症性サイトカインであるヒストン脱アセチル化酵素1の産生を抑制することにより、神経炎症を緩和する(Song et al.)
健康な腸内環境では、乳酸は微生物叢へのクロスフィードに使われ、SCFAを絶え間なく産生する。恒常的な状態では、ファーミキューテス属を含む多くの腸内細菌が乳酸をプロピオン酸や酪酸に変換し(Abedi and Hashemi, 2020)、腸管内腔における乳酸の蓄積を低く維持するのに役立っている(Duncan et al.) 乳酸産生の増加は、一般的にpHを介したものであり、ファーミキューテス属やバクテロイデーテス属が乳酸産生性の放線菌、乳酸桿菌、プロテオバクテリアに置き換わったときに、しばしばディスバイオシスのマーカーとして同定される。この現象は、酪酸とプロピオン酸の合成を阻害する(Abedi and Hashemi, 2020; Wang S. P. et al.) 興味深いことに、運動中の腸内嫌気性菌による乳酸産生の増加は、宿主のミトコンドリア呼吸をサポートし(Brooks, 2020)、Sirtuin1ネットワークのアップレギュレーションを介して間接的に大脳BDNF産生を促進する可能性がある。これは、運動体制下のマウスが学習・記憶保持力の増加を示したことから、乳酸が脳に及ぼす用量依存的な影響と考えられる(El Hayekら、2019)。
乳酸以外にも、いくつかの微生物代謝産物が神経細胞の生体エネルギーとグルコースの恒常性に積極的に関与している(Zhang et al.) 腸クロム親和細胞によって誘導される可能性があるが、腸管内腔内の微生物は糖新生を介してグルコースを産生し(Sotyら、2017)、エネルギー欠乏や低酸素状態では乳酸産生に切り替わる(Brooks、2020)。微生物が誘導するグルコース代謝は比較的よく研究されているが(van Olden et al., 2015; Utzschneider et al. 例えば、ペプチドYYやGLP-1のようなエネルギー調節ホルモンは腸管上皮に発現しており、対応する受容体は視床下部に発現していることが報告されている(Steinert et al.
最後に、最近の研究では、宿主微生物群集とリンパ系との間に関連性がある可能性が示唆されている(Hablitz and Nedergaard, 2021)。これは、哺乳類の中枢神経系から排泄される老廃物のクリアランス経路を説明する新しい概念である(Meyerhoff et al.) リンパ系はBBBや睡眠構築と密接に関連しており、したがってトリプトファン経路や迷走神経逆行性シグナル伝達ネットワークとも関連していることから、腸内細菌叢とリンパ系を関連付けることに興味をそそられる(Hablitz and Nedergaard, 2021)。しかし、このメカニズムを完全に理解するには多くの研究が必要である。
課題と展望
機能的メタゲノム、メタオーガニズム、宿主のオミックスによるシステム解明と知識の統合は、宿主のストレス応答を駆動する全体的な分子メカニズムを明らかにするために注目を集めている。利用可能なデータのほとんど、特に腸脳軸に焦点を当てたデータは、ヒトの脳を利用できる範囲が限られているため、動物モデルに基づいて構築されている。しかし、げっ歯類のメタゲノミックデータのトランスレーショナルな可能性については、しばしば議論の的となっている。というのも、ヒトの回脳型脳は大脳皮質に明瞭な凸凹と膨張があり、齧歯類の立脳型脳の滑らかな表面の大脳皮質よりも、はるかに幅広い情動構造を扱いやすいからである(Sun and Hevner, 2014)。さらに、げっ歯類の微生物の生態系はヒトのそれとはかけ離れており、逆にイヌなどの家畜はヒトとのメタゲノム相同性が高い(Wardeh et al.) ポジティブな面では、げっ歯類のエンテロクロマフィン細胞はヒトのそれと遺伝学的に相同であることが判明したが、その機能的相同性、特にストレス下での相同性は、まだ完全に解明されていない(Roberts et al.) 無菌モデルやgnotobioticヒト化モデルなど、カスタマイズされたげっ歯類モデルのいくつかは、より大きなトランスレーショナルポテンシャルを持つものとして推進されている(Uzbay, 2019)。これらのモデルは、メタゲノムデータの研究室間のばらつきを減らすことができる。とはいえ、無菌マウスは、その非典型的な生息環境、限られた母体ケア、独特な生活様式と食餌のために、様々な独特な特徴を持つ素因がある(Mayer et al.) これらの特徴を総合すると、無菌マウスのコロニーから得られる成果のトランスレーショナルな可能性が制限される可能性がある(Mayer et al.)
宿主と腸内微生物の関係の真の特徴はまだ不明である。そもそも、この関係が本質的に因果関係なのか相関関係なのかがまだわかっていない。宿主と微生物の関係を理解するには、おそらく次の2つの基本的な情報が必要である:(i)腸内微生物が末梢臓器とどのようにコミュニケーションしているのか、(ii)腸管内腔の細菌、ウイルスなどの異なる微生物がどのようにクロストークしているのか。この総説では、腸内微生物-臓器軸に光を当てるために、腸内微生物-脳軸のトピックを詳細に論じたが、その他の腸内微生物と肺、肝臓、腎臓などの末梢臓器との関係マトリックスについては、ざっと論じた。微生物間関係、特に細菌とウイルスの相互関係は、宿主防御の制御因子であると考えられてきた。腸内ウイルスの多くはバクテリオファージと真核ウイルスに代表されるが(Li et al., 2021)、ウイルス遺伝子配列のマッピングには限界があるため、ウイルス組成の特徴付けには課題があった(Minot et al., 2011; Manrique et al.) バクテリオファージが細菌を死滅させることができることを考えると、腸内におけるバクテリオファージとの関係や存在量の比較は、依然として興味深い課題である。腸管内腔の他の部分と比較して、腸管粘膜表面におけるバクテリオファージの対細菌比が有意に高いこと(Barr et al., 2013)は、細菌感染に対する防御の最前線となる可能性があり、それによって宿主の防御や免疫応答を含む多くの拮抗作用や有益な作用を制御している(Almeida et al., 2019; Kirsch et al.) 細菌-古細菌(Hoegenauer et al., 2022)や細菌-原虫(Dubik et al., 2022)のような、さらなる領域間関係に対する理解はまだ初期段階にあるが、新たな研究により、疾患発症における協調的な取り組みが確認されている(Kodio et al., 2020; Mafra et al.)
言うまでもなく、微生物代謝産物と疾患病態との関連については、まだ十分に解明されていない。この知識ギャップを埋める方法の一つとして、病気の腸と病気の宿主を系統的に分離することが考えられる。帰無仮説は、病気の宿主の糞便微生物が健康な宿主に悪影響を及ぼすことはないというものである。この仮説を支持するために、ストレスまたは病気のげっ歯類から糞便サンプルを採取し、FMTを用いて健康なげっ歯類にコロニー形成させることができる(Wang J. W. et al.) その後の分析により、病気の微生物叢が、不利な条件がない場合に宿主の健康をどのようにコントロールできるのかに光を当てることができる。健康な常在菌(すなわち、健康なコホートから採取した糞便サンプル)を病気のげっ歯類に同時にFMTすることで、微生物叢が宿主とどのようにコミュニケーションし、宿主の全体的な健康を制御しているかについての完全なシナリオを得るのに役立つ。
同じコンセプトに従って、VNの外科的欠失または化学的操作は、食事摂取を感知するこの神経系の役割(Brownら、2011;Yaoら、2018)と、体重の変化(Burneoら、2002)のようなヒトへの結果的影響を強調することができる。
上述の手法の成果は、プレバイオティクス、ポストバイオティクス、シンバイオティクス食などの伝統的な栄養補助食品や、パラバイオティクス(非生存微生物から作られる)およびポストバイオティクス生物療法(代謝産物などの微生物誘導体から作られる)という、より新しいサプリメントのカスタマイズに用いられてきた(Nataraj et al. さらなる治療的アプローチには、遺伝子編集技術(CRISPRなど)を用いたり、合成プロモーターを腸管内腔に移植したりすることで、目的の微生物を遺伝的に家畜化する方法がある(Mimeeら、2016;Indaら、2019)。最近では、最も豊富な腸内常在菌の1つであるバクテロイデーテス(Bacteroidetes)のシステム工学化に成功した(Mimee et al. これは、宿主の反応を強化するために、近隣の微生物(バクテロイデーテスと同居するファーミキューテスなど)および/または補因子(食餌源など)とともに微生物を系統的に変化させることができる、普遍的に適用可能なツールの設計に向けた一歩である(Wexler, 2007; Inda et al.)
メタオーガニズムデータに基づく疾患診断および予後予測能力は、著しい進歩を示している。小型カメラを用いた高度な大腸内視鏡検査は、pH、温度など、大腸の幅広い生理的属性をリアルタイムでモニターできる(Yungら、2016;Kalantar-Zadehら、2017)。デジタル錠剤」のような摂取可能なセンサーのプロトタイプが、疾患診断プラットフォームへの最前線に登場した(Kalantar-Zadeh et al.) これらの高度なセンサーは、微生物量のシフトによる大腸の酸化ポテンシャルを決定し(Baltsaviasら、2020)、大腸内腔内に放出される酸素や水素などのガスをプロファイルすることができる(Kalantar-Zadehら、2018)。ボックス2には、微生物や微生物の代謝物をモニターする従来型のプロトタイプとともに、これらの新しい診断コンセプトが記されている。
その周辺環境に焦点を移すと、メタゲノムと代謝産物は、360°の監視アウトリーチを可能にする大きな可能性を示している。マイクロバイオームの廃水サーベイランスにより、COVID-19感染がさまざまなコミュニティーに広がっている縦断的プロファイルが得られた(Brumfieldら、2022年)。蘚苔類や魚類の幼生における代謝物モニタリング(Sanches-Fernandes et al.
微生物代謝産物は、宿主と微生物叢の間のクロストークの主要な仲介物である。これは、脳と腸の間の食後のニューロンやホルモンの交換という従来の見方を本質的に洗練させる新たな概念である(Wachsmuth et al.) マイクロバイオームは、いくつかの疾患の病態生理やストレスに対する宿主の適応反応と決定的に関連している。したがって、マイクロバイオームの体系的な調節とモニタリングが、病気と闘うための重要な手段となることが予想される。全体として、メタオーガニズムと機能的微生物叢は非常に活発な研究の対象であり、今後数年で大きな進展が見られることが期待される。
ボックス1. 本稿で使用する主要用語の定義。は定義に異論があるもので、詳細は本文を参照のこと。
www.frontiersin.org
ボックス2. メタオーガニズムと代謝産物の知識から容易に恩恵を受けることができる、従来から将来的なツール/テクノロジーの展望。
www.frontiersin.org
著者の貢献
NC:概念化、データ管理、調査、執筆-原案、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または出版に関して、金銭的支援を受けていないことを宣言する。
謝辞
著者は、CPT Kevin Swift博士とRasha Hammamieh博士の科学的・編集的サポートに心から感謝したい。
利益相反
著者は、潜在的な利益相反と解釈され得る商業的または金銭的関係がない中で研究を行ったことを宣言する。
担当編集者BDは、著者NCとの過去の共同研究を宣言した。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、あるいはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
著者免責事項
本資料はWalter Reed Army Institute of Researchの査読を受けたものである。その発表および/または公表に異論はない。ここに含まれる意見や主張は著者の個人的見解であり、陸軍省または国防総省の公式見解または真の見解を反映するものと解釈されるものではない。
参考文献
Abedi, E., and Hashemi, S. M. B. (2020). 乳酸生産微生物と基質-State of Art. ヘリヨン6:e04974. doi: 10.1016/j.heliyon.2020.e04974.
PubMedアブストラクト|フルテキスト|Google Scholar
Agus, A., Clement, K., and Sokol, H. (2021). 代謝疾患における中心的調節因子としての腸内細菌叢由来代謝産物。Gut 70, 1174-1182. doi: 10.1136/gutjnl-2020-323071.
PubMedアブストラクト|フルテキスト|Google Scholar
Ahmed,H.、Leyrolle,Q.、Koistinen,V.、Kärkkäinen,O.、Layé,S.、Delzenne,N.、他(2022)。腸-脳コミュニケーションのドライバーとしての微生物叢由来代謝産物。Gut Microbes 14:2102878.
Google Scholar
Alexander, M., and Turnbaugh, P. J. (2020). 食事-微生物-免疫相互作用のメカニズムの解明。免疫 53, 264-276.
PubMedアブストラクト|フルテキスト|Google Scholar
Almeida, G. M. F., Laanto, E., Ashrafi, R., and Sundberg, L. R. (2019). 粘液へのバクテリオファージの付着は、病原性細菌に対する予防的防御を媒介する。
パブコメ抄録|全文|Google Scholar
Al-Rashidi, H. E. (2022). 腸内細菌叢と免疫の関連性。Saudi J. Biol. この論文では、腸内細菌叢と免疫の関連性を明らかにした。
パブコメ抄録|全文|Google Scholar
Alseekh, S., Aharoni, A., Brotman, Y., Contrepois, K., D'Auria, J., Ewald, J., et al. 質量分析ベースのメタボロミクス:アノテーション、定量化、およびベストレポーティングプラクティスのためのガイド。Nat. doi: 10.1038/s41592-021-01197-1.
PubMedアブストラクト|全文|Google Scholar
Amara, A., Frainay, C., Jourdan, F., Naake, T., Neumann, S., Novoa-del-Toro, E. M., et al. メタボロミクスデータの解析と解釈におけるネットワークとグラフの発見。Front. Mol. Biosci. 9:841373. doi: 10.3389/fmolb.2022.841373.
メタボロミクスデータを解析した結果。
Amaral, J. D., Viana, R. J., Ramalho, R. M., Steer, C. J., and Rodrigues, C. M. (2009). 胆汁酸:ウルソデオキシコール酸によるアポトーシスの制御。J.脂質研究 50, 1721-1734.
PubMedアブストラクト|フルテキスト|Google Scholar
Angoa-Pérez, M., Zagorac, B., Anneken, J. H., Briggs, D. I., Winters, A. D., Greenberg, J. M., et al. 反復性の軽度外傷性脳損傷は、進行性の白質病理、認知機能の低下、および一過性の腸内細菌叢異常症をもたらす。論文誌10:8949.doi: 10.1038/s41598-020-65972-4.
PubMedアブストラクト|フルテキスト|Google Scholar
Anilkumar、S.、Chakraborty、N.、Meyerhoff、J.、Campbell、R.、Muhie、S.、Hammamieh、R.、他(2022年)。海馬と扁桃体の樹状突起棘密度の縦方向乖離:加害者に暴露された社会的ストレスの影響。Horz. Neurosci. 46.
Google Scholar
Arumugam, M., Raes, J., Pelletier, E., Le Paslier, D., Yamada, T., Mende, D. R., et al. ヒト腸内細菌叢の腸型。Nature 473, 174-180.
PubMedアブストラクト|フルテキスト|Google Scholar
Auriemma, R. S., Scairati, R., Del Vecchio, G., Liccardi, A., Verde, N., Pirchio, R., et al. 膣マイクロバイオーム:女性の生涯を通じて長い泌尿生殖器のコロニー形成。Front. Cell. Infect. Microbiol. 11:686167.
PubMedアブストラクト|フルテキスト|Google Scholar
Baczkowski, A. J., Joanes, D. N., and Shamia, G. M. (1998). 一般化された多様性指数H (アルファ, ベータ)のアルファとベータの有効範囲。Math. Biosci. 148, 115-128. doi: 10.1016/s0025-5564(97)10013-x
パブコメ要旨|全文|Google Scholar
Bae, S. A., Fang, M. Z., Rustgi, V., Zarbl, H., and Androulakis, I. P. (2019). ライフスタイル、行動、概日リズムの接点で:代謝の意味。Front. doi: 10.3389/fnut.2019.00132.
PubMedアブストラクト|フルテキスト|Google Scholar
Baltsavias, S., van Treuren, W., Weber, M. J., Charthad, J., Baker, S., Sonnenburg, J. L., et al. 腸内細菌叢の酸化還元モニタリングのための生体内ワイヤレスセンサー。IEEE Trans. Biomed. Eng. 67, 1-1830. doi: 10.1109/TBME.2019.2948575.
PubMedアブストラクト|フルテキスト|Google Scholar
Barr, J. J., Auro, R., Furlan, M., Whiteson, K. L., Erb, M. L., Pogliano, J., et al. 粘液に付着したバクテリオファージは、非宿主由来の免疫を提供する。Proc. Natl. Acad. 米国)110, 10771-10776.
パブコメ抄録|全文|Google Scholar
Beardslee, L. A., Banis, G. E., Chu, S., Liu, S., Chapin, A. A., Stine, J. M., et al. 低侵襲診断とモニタリングのための体内センサーとセンシングシステム:低侵襲スクリーニングの次なるフロンティア。ACS Sens.5, 891-910.
PubMedアブストラクト|フルテキスト|Google Scholar
Berg, G., Rybakova, D., Fischer, D., Cernava, T., Vergès, M. C. C., Charles, T., et al. マイクロバイオームの定義の再検討:古い概念と新たな課題。doi: 10.1186/s40168-020-00875-0
PubMedアブストラクト|全文|Google Scholar
Berger, M., Gray, J. A., and Roth, B. L. (2009). セロトニンの拡大生物学。Annu. Rev. Med. 60, 355-366. doi: 10.1146/annurev.med.60.042307.110802
パブコメ抄録|全文|Google Scholar
Berry, D., and Loy, A. (2018). ヒトおよび動物のマイクロバイオーム機能の安定同位体プロービング。Trends Microbiol. 26, 999-1007. doi: 10.1016/j.tim.2018.06.004.
PubMedアブストラクト|フルテキスト|Google Scholar
Biragyn, A., and Ferrucci, L. (2018). 腸内細菌異常症:加齢と炎症老化におけるがんリスク増加の潜在的関連性。Lancet Oncol. 19, e295-e304. doi: 10.1016/S1470-2045(18)30095-0
PubMedアブストラクト|フルテキスト|Google Scholar
Bohórquez, D. V., Shahid, R. A., Erdmann, A., Kreger, A. M., Wang, Y., Calakos, N., et al. 感覚性腸内分泌細胞の神経支配によって形成される神経上皮回路。J. Clin. Invest. 125, 782-786. doi: 10.1172/JCI78361
パブコメ抄録|全文|Google Scholar
Borrego-Ruiz, A., and Borrego, J. J. (2024). ヒト腸内細菌叢の異常と精神医学的・心理学的疾患との関係に関する最新の概説。Prog. Neuro-Psychopharmacol. Biol. 精神医学 128:110861. doi: 10.1016/j.pnpbp.2023.110861
PubMedアブストラクト|フルテキスト|Google Scholar
Braniste, V., Al-Asmakh, M., Kowal, C., Anuar, F., Abbaspour, A., Tóth, M., et al. 腸内細菌叢はマウスの血液脳関門透過性に影響する。Sci. Transl. Med. 6:263ra158. doi: 10.1126/scitranslmed.3009759.
PubMedアブストラクト|フルテキスト|Google Scholar
Brestoff, J. R., and Artis, D. (2015). 健康および疾患における代謝ホメオスタシスの免疫制御。細胞 161, 146-160.
PubMedアブストラクト|フルテキスト|Google Scholar
Brooks, G. A. (2020). 代謝の支点としての乳酸。酸化還元生物35:101454.
PubMedアブストラクト|フルテキスト|Google Scholar
Brown, T. A., Washington, M. C., Metcalf, S. A., and Sayegh, A. I. (2011). コレシストキニンによって誘発される摂食反応は、迷走神経と脾神経によって媒介される。この論文では、「食欲は迷走神経と脾神経によって媒介される」ことを明らかにした。
パブコメ抄録|全文|Google Scholar
Brumfield, K. D., Leddy, M., Usmani, M., Cotruvo, J. A., Tien, C. T., Dorsey, S., et al. COVID-19期間中の廃水サーベイランスのためのマイクロバイオーム解析。
PubMedアブストラクト|フルテキスト|Google Scholar
Brunet, M. A., Leblanc, S., and Roucou, X. (2020). 小さなORFとalternative ORFの機能的調査によるプロテオミクスの多様性の再考。Exp. 細胞研究393:112057.
PubMedアブストラクト|フルテキスト|Google Scholar
Burneo, J. G., Faught, E., Knowlton, R., Morawetz, R., and Kuzniecky, R. (2002). 迷走神経刺激による体重減少。神経学 59, 463-464.
PubMedアブストラクト|全文|Google Scholar
Cani, P. D. (2018). ヒト腸内細菌叢:希望、脅威、そして約束。Gut 67, 1716-1725. doi: 10.1136/gutjnl-2018-316723.
PubMedアブストラクト|フルテキスト|Google Scholar
Caspi, R., Billington, R., Keseler, I. M., Kothari, A., Krummenacker, M., Midford, P. E., et al. 代謝経路と酵素のMetaCycデータベース-2019年最新版。Nucleic Acids Res. 48, D445-D453.
PubMedアブストラクト|フルテキスト|Google Scholar
Chakaroun, R. M., Massier, L., and Kovacs, P. (2020). 代謝性疾患における腸内細菌叢、腸管透過性、組織細菌:加害者か傍観者か?doi: 10.3390/nu12041082.
PubMedアブストラクト|フルテキスト|Google Scholar
Chen, X., and Devaraj, S. (2018). 肥満、メタボリックシンドローム、糖尿病における腸内細菌叢。Curr. Diab. doi: 10.1007/s11892-018-1104-3
全文|Google Scholar
腸内細菌および微生物代謝産物の標的遺伝子の網羅的データベース。遺伝子発現を解析した。
PubMedアブストラクト|フルテキスト|Google Scholar
Connell, E., Le Gall, G., Pontifex, M. G., Sami, S., Cryan, J. F., Clarke, G., et al. 加齢に伴う認知機能低下と認知症の危険因子としての微生物由来代謝産物。Mol. Neurodegener. 17:43. doi: 10.1186/s13024-022-00548-6
PubMedアブストラクト|全文|Google Scholar
Cottret, L., Frainay, C., Chazalviel, M., Cabanettes, F., Gloaguen, Y., Camenen, E., et al. MetExplore: 代謝ネットワークの共同編集と探索。Nucleic Acids Res. 46, W495-W502.
抄録|全文|Google Scholar
Cryan, J. F., O'Riordan, K. J., Sandhu, K., Peterson, V., and Dinan, T. G. (2020). 神経疾患における腸内細菌叢。Lancet Neurol. 19, 179-194. doi: 10.1016/S1474-4422(19)30356-4
全文|Google Scholar
Dabke, K., Hendrick, G., and Devkota, S. (2019). 腸内マイクロバイオームとメタボリックシンドローム。J. Clin. Invest. 129, 4050-4057. doi: 10.1172/JCI129194
PubMedアブストラクト|フルテキスト|Google Scholar
de Oliveira, G. L. V., Cardoso, C. R. B., Taneja, V., and Fasano, A. (2021). 論説:炎症性疾患における腸内細菌異常症。Front. Immunol. doi: 10.3389/fimmu.2021.727485.
PubMedアブストラクト|フルテキスト|Google Scholar
Desbonnet, L., Clarke, G., Shanahan, F., Dinan, T. G., and Cryan, J. F. (2014). 微生物叢はマウスの社会性の発達に必須である。Mol. 精神医学 19, 146-148.
PubMedアブストラクト|フルテキスト|Google Scholar
Drozdz, M., Makuch, S., Cieniuch, G., Wozniak, M., and Ziolkowski, P. (2020). がん標的治療における偏性嫌気性細菌と通性嫌気性細菌:現在の戦略と臨床応用。生命科学 261:118296.
PubMedアブストラクト|フルテキスト|Google Scholar
Dubik, M., Pilecki, B., and Moeller, J. B. (2022). 腸内常在原生動物-腸内微生物群集の過小評価されたメンバー。生物学11:1742.
PubMedアブストラクト|フルテキスト|Google Scholar
Dührkop, K., Nothias, L. F., Fleischauer, M., Reher, R., Ludwig, M., Hoffmann, M. A., et al. 高分解能フラグメンテーションマススペクトルを用いた未知代謝物の系統的分類。Nat. Biotechnol. 39, 462-471.
PubMedアブストラクト|フルテキスト|Google Scholar
Duncan, S. H., Louis, P., and Flint, H. J. (2004). ヒトの糞便から分離され、主要発酵産物として酪酸を産生する乳酸利用細菌。Appl. Environ. Microbiol. 70, 5810-5817. doi: 10.1128/AEM.70.10.5810-5817.2004
パブコメ要旨|全文|Google Scholar
Eeckhaut, V., Van Immerseel, F., Croubels, S., De Baere, S., Haesebrouck, F., Ducatelle, R., et al. ニワトリ盲腸から分離された系統学的に多様なファーミキューテスにおける酪酸産生。Microb. Biotechnol. 4, 503-512. doi: 10.1111/j.1751-7915.2010.00244.x
パブコメ抄録|全文|Google Scholar
El Hayek, L., Khalifeh, M., Zibara, V., Abi Assaad, R., Emmanuel, N., Karnib, N., et al. 乳酸は、海馬脳由来神経栄養因子(BDNF)のSIRT1依存的活性化を通じて、学習と記憶に対する運動の効果を媒介する。J. Neurosci. 39, 2369-2382. doi: 10.1523/JNEUROSCI.1661-18.2019
PubMedアブストラクト|フルテキスト|Google Scholar
El-Merahbi, R., Loffler, M., Mayer, A., and Sumara, G. (2015). 代謝ホメオスタシスにおける末梢セロトニンの役割。FEBS Lett. 589, 1728-1734. doi: 10.1016/j.febslet.2015.05.054
フルテキスト|Google Scholar
Entwistle, S., Li, X., and Yin, Y. (2019). 病原性ゲノムに共有されるオーファン遺伝子は、細菌の病原性とより関連する。
PubMedアブストラクト|フルテキスト|Google Scholar
Fernandez-Veledo, S., and Vendrell, J. (2019). 腸内細菌叢由来のコハク酸:ヒト代謝疾患における敵か味方か?Rev. Endocr. Metab. Disord. 20, 439-447. doi: 10.1007/s11154-019-09513-z
PubMedアブストラクト|フルテキスト|Google Scholar
Frezza, C. (2017). ミトコンドリアの代謝産物:覆面シグナル分子。インターフェース・フォーカス 7:20160100.
PubMedアブストラクト|フルテキスト|Google Scholar
Fröhlich, E. E., Farzi, A., Mayerhofer, R., Reichmann, F., Jačan, A., Wagner, B., et al. 抗生物質誘発性腸内細菌異常症による認知障害:腸内細菌叢-脳コミュニケーションの解析。Brain Behav. Immun. 56, 140-155. doi: 10.1016/j.bbi.2016.02.020
PubMedアブストラクト|フルテキスト|Google Scholar
Fu, M., Zhang, X., Liang, Y., Lin, S., Qian, W., and Fan, S. (2020). 着床不全を繰り返す女性における膣内細菌叢の変化と関連するメタボローム。
Google Scholar
Fung, T. C., Vuong, H. E., Luna, C. D. G., Pronovost, G. N., Aleksandrova, A. A., Riley, N. G., et al. 腸内セロトニンとフルオキセチン曝露は腸内細菌のコロニー形成を調節する。Nat. Microbiol. 4, 2064-2073. doi: 10.1038/s41564-019-0540-4
PubMedアブストラクト|フルテキスト|Google Scholar
Gautam, A., Kumar, R., Chakraborty, N., Muhie, S., Hoke, A., Hammamieh, R., et al. 心的外傷後ストレス障害の特徴をシミュレートする全雄性加害者曝露げっ歯類モデルにおける糞便微生物叢組成の変化。J. Neurosci. Res. 96, 1311-1323. doi: 10.1002/jnr.24229.
Google Scholar
Ghosh, S., Molcan, E., DeCoffe, D., Dai, C., and Gibson, D. L. (2013). n-6 PUFAが豊富な食事は、高齢マウスにおいて腸内微生物のディスバイオシスを誘発する。この論文では、腸内細菌叢の異常増殖を抑制するために、n-6系PUFAを多く含む餌の摂取が有効であることを示した。
PubMedアブストラクト|フルテキスト|Google Scholar
GitHub. (n.d.). 第6章マイクロバイオームの多様性. https://microbiome.github.io/OMA/microbiome-diversity.html。
Google Scholar
Gómez-Gallego, C., Morales, J. M., Monleón, D., Du Toit, E., Kumar, H., Linderborg, K., et al. 特定の地理的場所にわたるヒト母乳NMRメタボロームプロファイルと乳汁微生物叢との関連。栄養成分 10:1355.
パブコメ抄録|全文|Google Scholar
Gonzalez-Sanchez, P., and DeNicola, G. M. (2021). マイクロバイオームとがん:汝の隣人を知れ。J. Pathol. 254, 332-343.
PubMedアブストラクト|フルテキスト|Google Scholar
Gribble, F. M., and Reimann, F. (2016). 腸内分泌細胞:腸上皮における化学センサー。Annu. 生理学雑誌 78, 277-299.
パブコメ抄録|全文|Google Scholar
Guirimand, T., Delmotte, S., and Navratil, V. (2015). VirHostNet 2.0:ウイルス/宿主分子相互作用データのネットサーフィン。Nucleic Acids Res. 43, D583-D587.
PubMedアブストラクト|フルテキスト|Google Scholar
Gupta, A., Osadchiy, V., and Mayer, E. A. (2020). 肥満と食中毒における脳-腸-マイクロバイオームの相互作用。Nat. Rev. Gastroenterol. Hepatol. 17, 655-672. doi: 10.1038/s41575-020-0341-5
PubMedアブストラクト|フルテキスト|Google Scholar
Hablitz, L. M., and Nedergaard, M. (2021). リンパ系:基礎神経生物学の新しい構成要素。J. Neurosci. 41, 7698-7711. doi: 10.1523/JNEUROSCI.0619-21.2021
パブコメ抄録|全文|Google Scholar
Hemmings, S. M. J., Malan-Müller, S., van den Heuvel, L. L., Demmitt, B. A., Stanislawski, M. A., Smith, D. G., et al. 心的外傷後ストレス障害とトラウマ曝露対照群におけるマイクロバイオーム:探索的研究。Psychosom. Med. doi: 10.1097/PSY.000000000512.
PubMedアブストラクト|フルテキスト|Google Scholar
Hoegenauer, C., Hammer, H. F., Mahnert, A., and Moissl-Eichinger, C. (2022). ヒト消化管におけるメタン生成古細菌。Nat. Rev. Gastroenterol. Hepatol. 19, 805-813. doi: 10.1038/s41575-022-00673-z
PubMedアブストラクト|フルテキスト|Google Scholar
Hoke, A., Chakraborty, N., Gautam, A., Hammamieh, R., and Jett, M. (2022). 心的外傷後ストレス様障害を誘発するストレスの急性および遅発性効果は、雄性マウスモデルにおいて糞便微生物叢組成を異なって変化させる。Front. Cell. Infect. Microbiol. 12:810815.
PubMedアブストラクト|フルテキスト|Google Scholar
Hu, X. F., Zhang, W. Y., Wen, Q., Chen, W. J., Wang, Z. M., Chen, J., et al. 糞便微生物叢移植は、微生物叢組成の回復により心筋炎の心筋障害を緩和する。Pharmacol. doi: 10.1016/j.phrs.2018.11.042
PubMedアブストラクト|フルテキスト|Google Scholar
Hufnagl, K., Pali-Scholl, I., Roth-Walter, F., and Jensen-Jarolim, E. (2020). 腸と肺のマイクロバイオームのディスバイオーシスは喘息に関与する。Semin. Immunopathol. 42, 75-93. doi: 10.1007/s00281-019-00775-y
PubMedアブストラクト|フルテキスト|Google Scholar
Hui, W., Li, T., Liu, W., Zhou, C., and Gao, F. (2019). 再発性C. difficile感染症治療のための糞便微生物叢移植:最新のランダム化比較試験メタアナリシス。PLoS One 14:e0210016. doi: 10.1371/journal.pone.0210016.
PubMed Abstract|フルテキスト|Google Scholar
Idle, J. R., and Gonzalez, F. J. (2007). メタボロミクス。Cell Metab. 6, 348-351. doi: 10.1016/j.cmet.2007.10.005.
PubMedアブストラクト|フルテキスト|Google Scholar
Iebba, V., Totino, V., Gagliardi, A., Santangelo, F., Cacciotti, F., Trancassini, M., et al. エビオーシスとディスバイオシス:微生物叢の2つの側面。New Microbiol. 39, 1-12.
PubMedアブストラクト|Google Scholar
Inda, M. E., Broset, E., Lu, T. K., and de la Fuente-Nunez, C. (2019). Emerging frontiers in microbiome engineering. Trends Immunol. 40, 952-973. doi: 10.1016/j.it.2019.08.007.
フルテキスト|Google Scholar
Johnson, C. H., Patterson, A. D., Idle, J. R., and Gonzalez, F. J. (2012). Xenobiotic metabolomics: メタボロームへの大きな影響。Annu. Rev. Pharmacol. Toxicol. 52, 37-56. doi: 10.1146/annurev-pharmtox-010611-134748
PubMedアブストラクト|フルテキスト|Google Scholar
Jones, J., Reinke, S. N., Ali, A., Palmer, D. J., and Christophersen, C. T. (2021). 糞便サンプルの採取方法と時間帯はマイクロバイオーム組成と短鎖脂肪酸濃度に影響を与える。Sci.Rep.11:13964.doi:10.1038/s41598-021-93031-z。
PubMedアブストラクト|フルテキスト|Google Scholar
Kaelberer, M. M., Buchanan, K. L., Klein, M. E., Barth, B. B., Montoya, M. M., Shen, X., et al. 栄養感覚伝達のための腸脳神経回路。Science 361:eaat5236. doi: 10.1126/science.aat5236.
PubMedアブストラクト|フルテキスト|Google Scholar
Kalantar-Zadeh, K., Berean, K. J., Ha, N., Chrimes, A. F., Xu, K., Grando, D., et al. 腸内のさまざまなガスを感知できる摂取可能な電子カプセルのヒトパイロットトライアル。Nat. Electron. 1, 79-87. doi: 10.1038/s41928-017-0004-x
全文|Google Scholar
Kalantar-Zadeh, K., Ha, N., Ou, J. Z., and Berean, K. J. (2017). Ingestible sensors. doi: 10.1021/acssensors.7b00045.
全文|Google Scholar
Kandalai, S., Li, H., Zhang, N., Peng, H., and Zheng, Q. (2023). ヒトマイクロバイオームとがん:診断と治療の観点から。Cancer Biol. Ther. Doi: 10.1080/15384047.2023.2240084.
PubMedアブストラクト|フルテキスト|Google Scholar
金久正明、古道正明、田辺正明、佐藤由紀夫、森島和彦(2017). KEGG: ゲノム、パスウェイ、疾患、薬剤に関する新たな視点. Nucleic Acids Res. 45, D353-D361. doi: 10.1093/nar/gkw1092.
PubMedアブストラクト|フルテキスト|Google Scholar
金久正明・後藤真一 (2000). KEGG: Kyoto encyclopedia of genes and genomes. 核酸研究, 28, 27-30.
PubMedアブストラクト|全文|Google Scholar
金久正明、佐藤恭子、森島和彦(2016). BlastKOALAおよびGhostKOALA:ゲノムおよびメタゲノム配列の機能解析のためのKEGGツール. J. Mol. 生物 428, 726-731. doi: 10.1016/j.jmb.2015.11.006
PubMedアブストラクト|フルテキスト|Google Scholar
Karl, J. P., Margolis, L. M., Madslien, E. H., Murphy, N. E., Castellani, J. W., Gundersen, Y., et al. 腸内細菌叢の組成と代謝の変化は、長時間の生理的ストレスを受けた若年成人における腸管透過性の亢進と一致している。Am. J. Physiol. Gastrointest. 312, G559-G571. doi: 10.1152/ajpgi.00066.2017
PubMedアブストラクト|フルテキスト|Google Scholar
Kim, J. Y., Whon, T. W., Lim, M. Y., Kim, Y. B., Kim, N., Kwon, M. S., et al. ヒト腸内アーキオーム:韓国人被験者における多様なハロアルカイアの同定。微生物ゲノム8:114. doi: 10.1186/s40168-020-00894-x
Google Scholar
Kirsch, J. M., Brzozowski, R. S., Faith, D., Round, J. L., Secor, P. R., and Duerkop, B. A. (2021). 腸内におけるバクテリオファージと細菌の相互作用:無脊椎動物から哺乳類まで。Annu. Rev. Virol. 8, 95-113. doi: 10.1146/annurev-virology-091919-101238
PubMedアブストラクト|全文|Google Scholar
Kodio, A., Menu, E., and Ranque, S. (2020). 真核微生物と原核微生物の相互作用。微生物 8:12.
PubMedアブストラクト|フルテキスト|Google Scholar
Krautkramer, K. A., Fan, J., and Backhed, F. (2021). マルチドメイン中間体としての腸内微生物代謝産物。Nat. Rev. Microbiol. 19, 77-94. doi: 10.1038/s41579-020-0438-4
PubMedアブストラクト|フルテキスト|Google Scholar
Krog, M. C., Hugerth, L. W., Fransson, E., Bashir, Z., Nyboe Andersen, A., Edfeldt, G., et al. 健康な女性のマイクロバイオーム:ホルモン避妊薬と月経周期の影響。Hum. Reprod. 37, 1525-1543.
PubMedアブストラクト|全文|Google Scholar
Lam, K. N., Cheng, J., Engel, K., Neufeld, J. D., and Charles, T. C. (2015). 機能的メタゲノミクスのための現在のリソースと将来のリソース。Front. Microbiol. 6:1196. doi: 10.3389/fmicb.2015.01196.
PubMedアブストラクト|フルテキスト|Google Scholar
Lau, K., Srivatsav, V., Rizwan, A., Nashed, A., Liu, R., Shen, R., et al. 腸内細菌異常症と心血管疾患のギャップを埋める。doi: 10.3390/nu9080859.
PubMedアブストラクト|フルテキスト|Google Scholar
Lee、I.H.、Finkel、T.(2013)。細胞周期の代謝制御。Curr. Opin. 細胞生物学 25, 724-729.
パブコメ抄録|全文|Google Scholar
Levy, M., Thaiss, C. A., and Elinav, E. (2016). 代謝産物:微生物叢と免疫系をつなぐメッセンジャー。Genes Dev. 30, 1589-1597.
PubMedアブストラクト|フルテキスト|Google Scholar
Li, Y., Handley, S. A., and Baldridge, M. T. (2021). 腸のダークサイド:腸の恒常性と疾患におけるウイルス-宿主相互作用。J. Exp. Med. doi: 10.1084/jem.20201044.
パブコメ抄録|全文|Google Scholar
Liu, K. H., Owens, J. A., Saeedi, B., Cohen, C. E., Bellissimo, M. P., Naudin, C., et al. 微生物代謝産物δ-バレロベタインは、食事依存性の肥満誘発物質である。Nat. Metab. 3, 1694-1705. doi: 10.1038/s42255-021-00502-8
PubMedアブストラクト|フルテキスト|Google Scholar
Lloyd-Price, J., Abu-Ali, G., and Huttenhower, C. (2016). 健康なヒトのマイクロバイオーム。Genome Med. 8:51. doi: 10.1186/s13073-016-0307-y
PubMedアブストラクト|フルテキスト|Google Scholar
Louis, P., and Flint, H. J. (2017). ヒト大腸内細菌叢によるプロピオン酸および酪酸の形成。Environ. Microbiol. 19, 29-41. doi: 10.1111/1462-2920.13589.
Google Scholar
Louis-Jean, S., and Martirosyan, D. (2019). Nutritionally attenuating the human gut microbiome to prevent and manage metabolic syndrome. J. Agric. Food Chem. 67, 12675-12684. doi: 10.1021/acs.jafc.9b04879.
PubMedアブストラクト|フルテキスト|Google Scholar
Macfarlane, S., and Macfarlane, G. T. (2003). 短鎖脂肪酸産生の制御。Proc. 栄養学会誌 62, 67-72.
Google Scholar
Mafra, D., Ribeiro, M., Fonseca, L., Regis, B., Cardozo, L. F. M. F., Fragoso dos Santos, H., et al. ヒトの腸内細菌叢に含まれる古細菌:慢性疾患に関連する可能性はあるか?アナエロべ77:102629.
PubMedアブストラクト|フルテキスト|Google Scholar
Magne, F., Gotteland, M., Gauthier, L., Zazueta, A., Pesoa, S., Navarrete, P., et al. ファーミキューテス/バクテロイデーテス比:肥満患者における腸内細菌異常症の関連マーカー?栄養成分 12:1474.
PubMedアブストラクト|フルテキスト|Google Scholar
Magnúsdóttir, S., Heinken, A., Kutt, L., Ravcheev, D. A., Bauer, E., Noronha, A., et al. ヒト腸内細菌叢の773メンバーのゲノムスケール代謝再構築の生成。Nat. Biotechnol. 35, 81-89.
PubMedアブストラクト|フルテキスト|Google Scholar
Mallick,H.、Rahnavard,A.、McIver,L. J.、Ma,S.、Zhang,Y.、Nguyen,L. H.、他(2021)。集団規模のメタオミクス研究における多変量関連発見。PLoS Comput. バイオロジー17:e1009442. doi: 10.1371/journal.pcbi.1009442.
PubMedアブストラクト|フルテキスト|Google Scholar
Mamas, M., Dunn, W. B., Neyses, L., and Goodacre, R. (2011). 臨床応用可能な疾患バイオマーカーにおける代謝物とメタボロミクスの役割。Arch. Toxicol. 85, 5-17. doi: 10.1007/s00204-010-0609-6
PubMedアブストラクト|フルテキスト|Google Scholar
Manca, C., Shen, M., Boubertakh, B., Martin, C., Flamand, N., Silvestri, C., et al. 無菌マウスにおける脳内カンナビノイドームシグナル伝達の変化。Biochim. Biophys. Acta Mol. Cell Biol. 脂質 1865:158786.
PubMedアブストラクト|フルテキスト|Google Scholar
Manor,O.、Dai,C. L.、Kornilov,S. A.、Smith,B.、Price,N. D.、Lovejoy,J. C.、他(2020)。健康マーカーと疾患マーカーは、数千人の腸内細菌叢組成と相関する。Nat. Commun. 11:5206. doi: 10.1038/s41467-020-18871-1
PubMedアブストラクト|フルテキスト|Google Scholar
Manrique, P., Bolduc, B., Walk, S. T., van der Oost, J., de Vos, W. M., and Young, M. J. (2016). 健康なヒト腸内ファージオーム。Proc. Natl. Acad. 米国)113, 10400-10405.
PubMedアブストラクト|全文|Google Scholar
Mariat, D., Firmesse, O., Levenez, F., Guimarăes, V. D., Sokol, H., Doré, J., et al. ヒト微生物叢のファーミキューテス/バクテロイデーテス比は年齢とともに変化する。BMC Microbiol. 9:123. doi: 10.1186/1471-2180-9-123
PubMed Abstract|フルテキスト|Google Scholar
Mathay, C., Hamot, G., Henry, E., Georges, L., Bellora, C., Lebrun, L., et al. 糞便サンプル採取と糞便DNA抽出のための方法最適化。Biopreserv. Biobank. 13, 79-93. doi: 10.1089/bio.2014.0031.
Google Scholar
Mayer, E. A., Tillisch, K., and Gupta, A. (2015). 腸/脳軸と微生物叢。J. Clin. Invest. 125, 926-938. doi: 10.1172/JCI76304
PubMedアブストラクト|フルテキスト|Google Scholar
Merriam-Webster. (n.d.). Merriam-Webster dictionary: マイクロバイオームの定義. https://www.merriam-webster.com/dictionary/microbiome
Google Scholar
Metabolite Statistics. (n.d.). https://hmdb.ca/statistics。
Google Scholar
Meyerhoff, J., Chakraborty, N., and Hammamieh, R. (2022). Glymphatics: a transformative development in medical neuroscience related to injuries in military central nervous system. Mil. Mil. Med. 187, e1086-e1090. doi: 10.1093/milmed/usab344
パブコメ抄録|全文|Google Scholar
Milovic, V., Stein, J., Odera, G., Gilani, S., and Murphy, G. M. (2000). 低用量デオキシコール酸は結腸癌細胞(Caco-2)におけるプトレシンの取り込みを刺激する。Cancer Lett. 154, 195-200. doi: 10.1016/s0304-3835(00)00400-6
PubMedアブストラクト|フルテキスト|Google Scholar
Mimee, M., Tucker, A. C., Voigt, C. A., and Lu, T. K. (2016). ヒト常在細菌バクテロイデス・テタイオタミクロンをプログラミングし、マウス腸内細菌叢の刺激を感知し、それに応答するようにした。Cell Syst. 2:214. doi: 10.1016/j.cels.2016.03.007
PubMedアブストラクト|フルテキスト|Google Scholar
Minot, S., Sinha, R., Chen, J., Li, H., Keilbaugh, S. A., Wu, G. D., et al. ヒト腸内ビローム:個体間変動と食事に対する動的応答。ゲノム研究 21, 1616-1625.
パブコメ抄録|全文|Google Scholar
Monteiro-Cardoso, V. F., Corliano, M., and Singaraja, R. R. (2021). 胆汁酸:腸脳軸におけるコミュニケーションチャンネル。神経分子医学。23, 99-117.
パブコメ抄録|全文|Google Scholar
Mou, Z., Yang, Y., Hall, A. B., and Jiang, X. (2021). ヒト腸内細菌叢におけるヒスタミン分泌細菌の分類学的分布。BMCゲノム22:695.
PubMedアブストラクト|フルテキスト|Google Scholar
Muhie, S., Gautam, A., Chakraborty, N., Hoke, A., Meyerhoff, J., Hammamieh, R., et al. 心的外傷後ストレス障害の特徴をシミュレートしたマウスモデルにおけるストレス誘発性神経炎症の分子指標。Transl. doi: 10.1038/tp.2017.91.
PubMedアブストラクト|フルテキスト|Google Scholar
Naake, T., and Fernie, A. R. (2019). MetNet: metabolite network prediction from high-resolution mass spectrometry data in R aiding metabolite annotation. Anal. Chem. 91, 1768-1772. doi: 10.1021/acs.analchem.8b04096.
Google Scholar
Nataraj, B. H., Ali, S. A., Behare, P. V., and Yadav, H. (2020). ポストバイオティクス-パラバイオティクス:微生物生物療法と機能性食品における新たな地平。Microb. doi: 10.1186/s12934-020-01426-w
パブコメ抄録|全文|Google Scholar
Neis, E. P., Dejong, C. H., and Rensen, S. S. (2015). 宿主代謝における微生物アミノ酸代謝の役割。Nutrients 7, 2930-2946.
PubMedアブストラクト|フルテキスト|Google Scholar
Neufeld, K. M., Kang, N., Bienenstock, J., and Foster, J. A. (2011). 無菌マウスにおける不安様行動の減少と中枢神経化学的変化。Neurogastroenterol. Motil. 23, 255-e119. doi: 10.1111/j.1365-2982.2010.01620.x
パブコメ抄録|全文|Google Scholar
Nicholson, S. E., Watts, L. T., Burmeister, D. M., Merrill, D., Scroggins, S., Zou, Y., et al. 中等度外傷性脳損傷は時間依存的に消化管マイクロバイオームを変化させる。ショック 52, 240-248.
PubMedアブストラクト|フルテキスト|Google Scholar
Noecker, C., Eng, A., Srinivasan, S., Theriot, C. M., Young, V. B., Jansson, J. K., et al. 微生物群の分類学的プロファイルとメタボロームプロファイルの代謝モデルベースの統合により、生態学的変動と代謝変動とのメカニズム的関連性が明らかになった。
PubMedアブストラクト|フルテキスト|Google Scholar
Ogunrinola, G. A., Oyewale, J. O., Oshamika, O. O., and Olasehinde, G. I. (2020). ヒトマイクロバイオームとその健康への影響。Int. J. Microbiol. 2020, 8045646-8045647.
PubMedアブストラクト|フルテキスト|Google Scholar
Olivotto, M., Arcangeli, A., Caldini, R., Chevanne, M., Cipolleschi, M. G., and Dello Sbarba, P. (1984). 正常細胞および癌細胞における細胞周期制御の代謝的側面。Toxicol. Pathol. 12, 369-373. doi: 10.1177/019262338401200411
Google Scholar
Osman, M., Budree, S., Kelly, C. R., Panchal, P., Allegretti, J. R., Kassam, Z., et al. Clostridioides difficile感染症に対する糞便微生物叢移植の有効性と安全性:5344例のコホート研究の結果。消化器病学 163, 319-322.
PubMedアブストラクト|フルテキスト|Google Scholar
Ostapiuk, A., and Urbanska, E. M. (2022). 神経変性疾患におけるキヌレン酸-ユニークな神経保護作用か、諸刃の剣か?CNS Neurosci. Ther. 28, 19-35.
PubMedアブストラクト|フルテキスト|Google Scholar
Otaru, N., Ye, K., Mujezinovic, D., Berchtold, L., Constancias, F., Cornejo, F. A., et al. ヒト腸内バクテロイデス属によるGABA産生:有病率、制御、酸ストレス耐性における役割。Front. Microbiol. 12:656895.
パブコメ抄録|全文|Google Scholar
Parker, A., Fonseca, S., and Carding, S. R. (2020). 血液脳関門の完全性と脳の健康の調節因子としての腸内微生物と代謝産物。Gut Microbes 11, 135-157. doi: 10.1080/19490976.2019.1638722
PubMedアブストラクト|フルテキスト|Google Scholar
Pascucci, T., Colamartino, M., Fiori, E., Sacco, R., Coviello, A., Ventura, R., et al. P-クレゾールは脳内ドーパミン代謝を変化させ、BTBRマウスにおける自閉症様行動を悪化させる。脳科学 10:233.
PubMedアブストラクト|全文|Google Scholar
Pokusaeva, K., Johnson, C., Luk, B., Uribe, G., Fu, Y., Oezguen, N., et al. GABA産生ビフィズス菌は腸の内臓感受性を調節する。Neurogastroenterol. Motil. 29:e12904. doi: 10.1111/nmo.12904
PubMedアブストラクト|フルテキスト|Google Scholar
Prehn-Kristensen, A., Zimmermann, A., Tittmann, L., Lieb, W., Schreiber, S., Baving, L., et al. ADHDの若年患者におけるマイクロバイオームα多様性の減少。PLoS One 13:e0200728. doi: 10.1371/journal.pone.0200728.
PubMedアブストラクト|フルテキスト|Google Scholar
Punzon-Jimenez, P., and Labarta, E. (2021). 女性の健康と生殖における女性性器マイクロバイオームの影響:総説。J. Assist. Reprod. Genet. 38, 2519-2541. doi: 10.1007/s10815-021-02247-5
PubMedアブストラクト|全文|Google Scholar
オキシトシンとオキシトニンの相互作用。社会的行動の制御におけるオキシトシン系とオピオイド系の相互作用。Philos. Trans. (1858)社会行動制御におけるオキシトシン系とオピオイド系の相互作用.
パブコメ抄録|全文|Google Scholar
Ramautar, R., Berger, R., van der Greef, J., and Hankemeier, T. (2013). ヒトのメタボロミクス:生物学を理解するための戦略。Curr. Opin. Chem. doi: 10.1016/j.cbpa.2013.06.015.
クロステキスト|Google Scholar
Rath, S., Heidrich, B., Pieper, D. H., and Vital, M. (2017). ヒト腸内細菌叢のトリメチルアミン産生細菌の解明。微生物ゲノム5:54. doi: 10.1186/s40168-017-0271-9
PubMedアブストラクト|フルテキスト|Google Scholar
Ridlon, J. M., Harris, S. C., Bhowmik, S., Kang, D. J., and Hylemon, P. B. (2016). 腸内細菌による胆汁酸塩の生体内変換の結果。Gut Microbes 7, 22-39. doi: 10.1080/19490976.2015.1127483.
PubMedアブストラクト|フルテキスト|Google Scholar
Riquelme, E., Zhang, Y., Zhang, L., Montiel, M., Zoltan, M., Dong, W., et al. 腫瘍マイクロバイオームの多様性と組成は膵臓がんの転帰に影響する。Cell 178, 795-806.e12. doi: 10.1016/j.cell.2019.07.008.
PubMedアブストラクト|フルテキスト|Google Scholar
Roberts, G. P., Larraufie, P., Richards, P., Kay, R. G., Galvin, S. G., Miedzybrodzka, E. L., et al. トランスクリプトームおよびペプチドームプロファイリングによるヒトおよびマウス腸内分泌細胞の比較。糖尿病 68, 1062-1072.
PubMedアブストラクト|フルテキスト|Google Scholar
Routy, B., Le Chatelier, E., Derosa, L., Duong, C. P. M., Alou, M. T., Daillère, R., et al. 腸内細菌叢は、上皮性腫瘍に対するPD-1に基づく免疫療法の有効性に影響を及ぼす。Science 359, 91-97. doi: 10.1126/science.aan3706.
PubMedアブストラクト|フルテキスト|Google Scholar
Salminen, S., Collado, M. C., Endo, A., Hill, C., Lebeer, S., Quigley, E. M. M., et al. ポストバイオティクスの定義と範囲に関する国際プロバイオティクス・プレバイオティクス科学協会(ISAPP)のコンセンサス・ステートメント。Nat. Rev. Gastroenterol. Hepatol. 18, 649-667.
PubMedアブストラクト|フルテキスト|Google Scholar
Salvato, F., Hettich, R. L., and Kleiner, M. (2021). 宿主関連マイクロバイオームにおける機能的相互作用を理解するツールとしてのメタプロテオミクスの5つの重要な側面。PLoS Pathog. 17:e1009245. doi: 10.1371/journal.ppat.1009245.
PubMedアブストラクト|フルテキスト|Google Scholar
Sanches-Fernandes, G. M. M., Califano, G., Castanho, S., Soares, F., Ribeiro, L., Pousão-Ferreira, P., et al. 藻類由来の抗菌性代謝産物を用いた生餌操作が魚類仔魚のマイクロバイオーム構築に及ぼす影響:分子ベースの評価。Aquac. 3, 1062-1083. doi: 10.1111/are.15648.
Google Scholar
Sánchez-Alcoholado, L., Ramos-Molina, B., Otero, A., Laborda-Illanes, A., Ordóñez, R., Medina, J. A., et al. 大腸癌の発生と治療反応における腸内細菌叢の役割。Cancers 12:1406. doi: 10.3390/cancers12061406.
PubMedアブストラクト|フルテキスト|Google Scholar
Sarkar, A., Harty, S., Lehto, S. M., Moeller, A. H., Dinan, T. G., Dunbar, R. I. M., et al. 心理学と認知神経科学におけるマイクロバイオーム。Trends Cogn. Sci. 22, 611-636. doi: 10.1016/j.tics.2018.04.006
フルテキスト|Google Scholar
Scanlan, P. D. (2017). Bacteria-bacteriophage coevolution in the human gut: implications for microbial diversity and functionality. Trends Microbiol. 25, 614-623. doi: 10.1016/j.tim.2017.02.012
PubMedアブストラクト|フルテキスト|Google Scholar
Scherz, V., Greub, G., and Bertelli, C. (2022). 臨床微生物叢プロファイリングの構築:クオリティフレームワークの提案。Crit. Rev. Microbiol. 48, 356-375. doi: 10.1080/1040841X.2021.1975642.
PubMedアブストラクト|フルテキスト|Google Scholar
Sender, R., Fuchs, S., and Milo, R. (2016). ヒトと細菌の体内細胞数の推定値の改訂。doi: 10.1371/journal.pbio.1002533.
PubMedアブストラクト|フルテキスト|Google Scholar
Sheflin, A. M., Whitney, A. K., and Weir, T. L. (2014). 微生物ディスバイオシスのがん促進作用。Curr. Oncol. doi:10.1007/s11912-014-0406-0。
PubMedアブストラクト|フルテキスト|Google Scholar
Shi,Z.、Li,X.、Wang,X.、Zhang,L.、Li,L.、Fu,X.、他(2021年)。節外性NK/T細胞リンパ腫鼻腔型における鼻腔微生物叢の特徴と臨床的意義。Front. Cell Infect. Microbiol. 11:686595. doi: 10.3389/fcimb.2021.686595
PubMedアブストラクト|フルテキスト|Google Scholar
Shkoporov, A. N., and Hill, C. (2019). ヒト腸内のバクテリオファージ:マイクロバイオームの「既知の未知」。細胞宿主微生物25, 25, 195-209.
全文|Google Scholar
Silva, Y. P., Bernardi, A., and Frozza, R. L. (2020). 腸-脳コミュニケーションにおける腸内細菌叢由来の短鎖脂肪酸の役割。Front. Endocrinol. 11:25. doi: 10.3389/fendo.2020.00025
PubMedアブストラクト|フルテキスト|Google Scholar
Simon, J. C., Marchesi, J. R., Mougel, C., and Selosse, M. A. (2019). 宿主と微生物叢の相互作用:ホロビオント理論から解析まで。微生物ゲノム 7:5.
PubMedアブストラクト|フルテキスト|Google Scholar
Song,L.、Sun,Q.、Zheng,H.、Zhang,Y.、Wang,Y.、Liu,S.、他(2022)。Roseburiaホミニスは、ヒストン脱アセチル化酵素阻害を介して、短鎖脂肪酸を介して神経炎症を緩和する。Mol. Nutr. 食品研究 66:e2200164. doi: 10.1002/mnfr.202200164
Google Scholar
Soty, M., Gautier-Stein, A., Rajas, F., and Mithieux, G. (2017). エネルギー恒常性における腸-脳グルコースシグナル伝達。Cell Metab. 25, 1231-1242. doi: 10.1016/j.cmet.2017.04.032
PubMedアブストラクト|フルテキスト|Google Scholar
Spivak, I., Fluhr, L., and Elinav, E. (2022). 微生物由来の代謝産物の局所的および全身的作用。EMBO Rep.23:e55664.
PubMedアブストラクト|フルテキスト|Google Scholar
Srinivasan, S., Hua, X., Wu, M. C., Proll, S., Valint, D. J., Reed, S. D., et al. 閉経後女性の膣内細菌叢とメタボロームに対する局所介入の影響:無作為化臨床試験の二次解析。JAMA Netw. doi: 10.1001/jamanetworkopen.2022.5032.
PubMed Abstract|フルテキスト|Google Scholar
Steinert, R. E., Gerspach, A. C., Gutmann, H., Asarian, L., Drewe, J., and Beglinger, C. (2011). グルカゴン様ペプチド-1(GLP-1)およびペプチドYY(PYY)のグルコース刺激分泌における腸管発現甘味受容体の機能的関与。Clin. 栄養学 30, 524-532.
PubMedアブストラクト|フルテキスト|Google Scholar
Strasser, B., Gostner, J. M., and Fuchs, D. (2016). 気分、食物、認知:トリプトファンとセロトニンの役割。Curr. Opin. Clin. Nutr. Metab. ケア 19, 55-61.
全文|Google Scholar
Subramaniam, S., and Fletcher, C. (2018). トリメチルアミンN-オキシド:新しい命を吹き込む。Br. J. Pharmacol. 175, 1344-1353.
PubMedアブストラクト|フルテキスト|Google Scholar
Subramanian, I., Verma, S., Kumar, S., Jere, A., and Anamika, K. (2020). マルチオミクスデータの統合、解釈、およびその応用。Bioinform. Biol. doi: 10.1177932219899051.
PubMedアブストラクト|フルテキスト|Google Scholar
Sun, T., and Hevner, R. F. (2014). 哺乳類大脳皮質の成長と折りたたみ:分子から奇形まで。Nat. Rev. Neurosci. 15, 217-232.
パブコメ抄録|全文|Google Scholar
田原靖之、山崎正樹、鋤柄秀樹、本橋秀樹、佐々木秀樹、宮川博之、他(2018)。腸内細菌叢由来の短鎖脂肪酸はマウス末梢組織において概日時計の同調を誘導する。Sci. Rep. 8:1395. doi: 10.1038/s41598-018-19836-7
PubMedアブストラクト|フルテキスト|Google Scholar
Tan, J., McKenzie, C., Potamitis, M., Thorburn, A. N., Mackay, C. R., and Macia, L. (2014). 健康と疾患における短鎖脂肪酸の役割。Adv. Immunol. 121, 91-119. doi: 10.1016/B978-0-12-800100-4.00003-9
Google Scholar
Thaiss, C. A., Zeevi, D., Levy, M., Segal, E., and Elinav, E. (2015). A day in the life of the meta-organism: diurnal rhythms of the intestinal microbiome and its host. Gut Microbes 6, 137-142. doi: 10.1080/19490976.2015.1016690
全文|Google Scholar
Thaiss, C. A., Zeevi, D., Levy, M., Zilberman-Schapira, G., Suez, J., Tengeler, A. C., et al. 微生物叢の日内振動のトランスキングダムコントロールは、代謝ホメオスタシスを促進する。細胞 159, 514-529.
PubMedアブストラクト|フルテキスト|Google Scholar
Theis, K. R., Dheilly, N. M., Klassen, J. L., Brucker, R. M., Baines, J. F., Bosch, T. C. G., et al. ホロゲノムの概念を正しく理解する:宿主とそのマイクロバイオームの生態進化学的枠組み。
PubMedアブストラクト|フルテキスト|Google Scholar
Tran, T. T., Cousin, F. J., Lynch, D. B., Menon, R., Brulc, J., Brown, J. R. M., et al. 虚弱高齢者におけるプレバイオティクス補給は、特定の腸内細菌叢分類群に影響を与えるが、グローバルな多様性には影響を与えない。Microbiome 7:39. doi: 10.1186/s40168-019-0654-1
PubMedアブストラクト|フルテキスト|Google Scholar
Trebicka, J., Bork, P., Krag, A., and Arumugam, M. (2021). 肝硬変および急性肝不全における腸内細菌叢の活用。Nat. Rev. Gastroenterol. Hepatol. 18, 167-180.
PubMedアブストラクト|フルテキスト|Google Scholar
Uronis, J. M., Arthur, J. C., Keku, T., Fodor, A., Carroll, I. M., Cruz, M. L., et al. 腸内微生物の多様性はプロバイオティクスVSL#3によって減少し、TNBS誘発大腸炎の減少と相関する。Inflamm. Bowel Dis. 17, 289-297.
PubMedアブストラクト|フルテキスト|Google Scholar
Utzschneider, K. M., Kratz, M., Damman, C. J., and Hullar, M. (2016). 腸内細菌叢とグルコース代謝を結びつけるメカニズム。J. Clin. Endocrinol. Metab. 101, 1445-1454. doi: 10.1210/jc.2015-4251
PubMedアブストラクト|フルテキスト|Google Scholar
Uzbay, T. (2019). 腸内細菌叢研究における無菌動物実験。Curr. Opin. Pharmacol. 49, 6-10. doi: 10.1016/j.coph.2019.03.016
フルテキスト|Google Scholar
van Olden, C., Groen, A. K., and Nieuwdorp, M. (2015). 糖尿病における脂質およびグルコース代謝における腸内細菌叢の役割。Clin. Ther. 37, 1172-1177. doi: 10.1016/j.clinthera.2015.03.008
Google Scholar
Vaughn, B. P., Fischer, M., Kelly, C. R., Allegretti, J. R., Graiziger, C., Thomas, J., et al. 再発性Clostridioides difficile感染症に対する大腸およびカプセル糞便微生物叢移植の有効性と安全性。Clin. Gastroenterol. Hepatol. 21, 1330-1337.e2. doi: 10.1016/j.cgh.2022.09.008
PubMedアブストラクト|フルテキスト|Google Scholar
Villageliu, D., and Lyte, M. (2018). Enterococcus faeciumにおけるドーパミン産生:神経化学物質産生能に基づくプロバイオティクス選択のための微生物内分泌学に基づくメカニズム。PLoS One 13:e0207038. doi: 10.1371/journal.pone.0207038.
Google Scholar
Vogtmann, E., Chen, J., Amir, A., Shi, J., Abnet, C. C., Nelson, H., et al. マイクロバイオーム研究における糞便サンプルの採取方法の比較。Am. J. Epidemiol. 185、115-123。
PubMedアブストラクト|フルテキスト|Google Scholar
Wachsmuth, H. R., Weninger, S. N., and Duca, F. A. (2022). エネルギー代謝とグルコース代謝における腸脳軸の役割。Exp. Mol. Med. 54, 377-392. doi: 10.1038/s12276-021-00677-w
PubMedアブストラクト|フルテキスト|Google Scholar
Wahlstrom, A., Sayin, S. I., Marschall, H. U., and Backhed, F. (2016). 胆汁酸と微生物叢の腸内クロストークと宿主代謝への影響。Cell Metab. 24, 41-50. doi: 10.1016/j.cmet.2016.05.005
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, J. W., Kuo, C. H., Kuo, F. C., Wang, Y. K., Hsu, W. H., Yu, F. J., et al. 糞便微生物叢移植:レビューとアップデート。J. Formos. Med. 118, S23-S31. doi: 10.1016/j.jfma.2018.08.011.
Google Scholar
Wang, S. P., Rubio, L. A., Duncan, S. H., Donachie, G. E., Holtrop, G., Lo, G., et al. ヒト大腸微生物生態系の安定性におけるpH、乳酸、乳酸資化性細菌の重要な役割。
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, Z., Wang, Q., Zhao, J., Gong, L., Zhang, Y., Wang, X., et al. 子宮頸がん患者における腸内細菌叢の多様性と組成の変化。AMB Express 9:40. doi: 10.1186/s13568-019-0763-z
PubMedアブストラクト|フルテキスト|Google Scholar
Wang, L. J., Yang, C. Y., Chou, W. J., Lee, M. J., Chou, M. C., Kuo, H. C., et al. 注意欠陥・多動性障害児の腸内細菌叢と食事パターン。Eur. Child Adolesc. Psychiatry 29, 287-297.
PubMedアブストラクト|フルテキスト|Google Scholar
Wardeh,M.、Risley,C.、McIntyre,M. K.、Setzkorn,C.、Baylis,M. (2015). 宿主-病原体および関連種の相互作用とその世界分布のデータベース。科学データ 2:150049.
PubMedアブストラクト|フルテキスト|Google Scholar
Weinstock, G. M. (2012). ヒトの微生物叢を研究するためのゲノムアプローチ。Nature 489, 250-256.
PubMedアブストラクト|フルテキスト|Google Scholar
Wexler, H. M. (2007). バクテロイデス:良いこと、悪いこと、そして細かいこと。Clin. Microbiol. Doi: 10.1128/CMR.00008-07.
パブコメ抄録|全文|Google Scholar
Wishart, D. S. (2019). Metabolomics for investigating physiological and pathophysiological processes. Physiol. Rev. 99, 1819-1875. doi: 10.1152/physrev.00035.2018.
PubMedアブストラクト|フルテキスト|Google Scholar
Wishart, D. S., Cheng, L. L., Copié, V., Edison, A. S., Eghbalnia, H. R., Hoch, J. C., et al. NMRとメタボロミクス-未来へのロードマップ。Metabolites 12:678.
PubMedアブストラクト|フルテキスト|Google Scholar
Xia, B., Wang, J., Zhang, D., and Hu, X. (2023). ヒトマイクロバイオームと前立腺がんリスクおよび治療との関連(総説)。Oncol. doi:10.3892/or.2023.8560。
PubMedアブストラクト|フルテキスト|Google Scholar
Xu, C., Lee, S. K., Zhang, D., and Frenette, P. S. (2020). 腸内細菌叢は心理的ストレス誘発性炎症を制御する。免疫 53, 417-428.e4. doi: 10.1016/j.immuni.2020.06.025
PubMedアブストラクト|フルテキスト|Google Scholar
Yano, J. M., Yu, K., Donaldson, G. P., Shastri, G. G., Ann, P., Ma, L., et al. 腸内細菌叢の常在細菌は宿主のセロトニン生合成を制御する。細胞 161, 264-276.
PubMedアブストラクト|フルテキスト|Google Scholar
Yao, G., Kang, L., Li, J., Long, Y., Wei, H., Ferreira, C. A., et al. 植え込み型自力迷走神経刺激装置による効果的な体重コントロール。Nat. Commun. 9:5349. doi: 10.1038/s41467-018-07764-z
PubMedアブストラクト|フルテキスト|Google Scholar
Yung, D. E., Rondonotti, E., and Koulaouzidis, A. (2016). Review: Capsule colonoscopy-a concise clinical overview of current status. Ann. Transl. Med. 4:398. doi: 10.21037/atm.2016.10.71
PubMedアブストラクト|フルテキスト|Google Scholar
Zaky, A., Glastras, S. J., Wong, M. Y. W., Pollock, C. A., and Saad, S. (2021). 糖尿病と肥満に関連する腎臓病における腸内細菌叢の役割。Int. J. Mol. Sci.22:9641.doi:10.3390/ijms22179641。
PubMedアブストラクト|フルテキスト|Google Scholar
Zeng, H., Umar, S., Rust, B., Lazarova, D., and Bordonaro, M. (2019). 大腸における二次胆汁酸と短鎖脂肪酸:大腸マイクロバイオーム、細胞増殖、炎症、および癌に焦点を当てて。Int. J. Mol. 論文タイトル:大腸における二次胆汁酸と短鎖脂肪酸:大腸マイクロバイオーム、細胞増殖、炎症、がんを中心に。
パブコメ抄録|全文|Google Scholar
Zhang, X., Li, L., Butcher, J., Stintzi, A., and Figeys, D. (2019). メタオミクスアプローチを用いた機能的かつトランスレーショナルなマイクロバイオーム研究の推進。微生物ゲノム7:154.
PubMedアブストラクト|フルテキスト|Google Scholar
Zhang、L., Liu、C., Jiang、Q., and Yin, Y. (2021). エネルギー代謝における酪酸:学ぶべきことはまだある。Trends Endocrinol. Metab. 32, 159-169. doi: 10.1016/j.tem.2020.12.003
PubMedアブストラクト|フルテキスト|Google Scholar
Zheng, Y., Fang, Z., Xue, Y., Zhang, J., Zhu, J., Gao, R., et al. 特異的腸内細菌叢シグネチャーは早期肺癌を予測する。Gut Microbes 11, 1030-1042.
PubMedアブストラクト|フルテキスト|Google Scholar
Zheng, W., Zhao, S., Yin, Y., Zhang, H., Needham, D. M., Evans, E. D., et al. ヒトの腸内細菌叢に適用した、株分解能を持つ高スループットの単一微生物ゲノム解析。ヒトの腸内細菌叢に適用した。
PubMedアブストラクト|フルテキスト|Google Scholar
Zhu, Z., Ren, J., Michail, S., and Sun, F. (2019). MicroPro: Using metagenomic unmapped reads to provide insights into human microbiota and disease associations. Genome Biol. 20:154. doi: 10.1186/s13059-019-1773-5
PubMedアブストラクト|フルテキスト|Google Scholar
Zolkiewicz, J., Marzec, A., Ruszczynski, M., and Feleszko, W. (2020). ポストバイオティクス-プレバイオティクスとプロバイオティクスを超える一歩。doi: 10.3390/nu12082189.
PubMedアブストラクト|フルテキスト|Google Scholar
Zou, Y., Xue, W., Luo, G., Deng, Z., Qin, P., Guo, R., et al. 培養ヒト腸内細菌から得られた1,520の参照ゲノムにより、機能的マイクロバイオーム解析が可能になった。Nat. Biotechnol. 37, 179-185. doi: 10.1038/s41587-018-0008-8
PubMedアブストラクト|フルテキスト|Google Scholar
キーワード: 代謝物, マイクロバイオーム, メタゲノム, ホロビオント, 糞便微生物, 腸脳軸, 微生物の多様性, 小分子
引用 Chakraborty N(2024)メタボライト:メタオーガニズムを説明するための宿主と微生物の収束ノード。Front. Microbiol. 15:1337368.
受理された: 15 November 2023; Accepted: 受理:2023年11月15日
発行:2024年3月5日
編集者
バーニー・ダイグル(メンフィス大学、米国
査読者
マルコ・パネ、Probiotical SpA、イタリア
Sangyong Jung, CHA大学, 韓国
Copyright © 2024 Chakraborty. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Nabarun Chakraborty, Nabarun.Chakraborty2.civ@health.mil
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
フッター
ガイドライン
探る
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
