胆汁酸による粘膜炎症と腸管運動の制御: IBDおよび顕微鏡的大腸炎における病態形成から治療への応用まで
zoom_out_地図検索メニュー
ジャーナル
栄養素
第14巻
第13号
10.3390/nu14132664
PDFダウンロード
設定
論文別刷りを注文する
オープンアクセスエディターズチョイス総説
胆汁酸による粘膜炎症と腸管運動の制御: IBDおよび顕微鏡的大腸炎における病態形成から治療への応用まで
https://www.mdpi.com/2072-6643/14/13/2664

著
フェデリカ・ディ・ヴィンチェンツォ
1,2,*,
ピエルイジ・プーカ
1,2,
ロリス・リッカルド・ロペトゥーゾ
1,
ヴァレンティーナ・プティート
1,
レティツィア・マッシ
1,
ビアンカ・バルトッチ
2,
マルコ・ムルジャーノ
2,
マルゲリータ・デ・フェリーチェ
2,
ロレンツォ・ペトロニオ
2,
アントニオ・ガスバリーニ
1,2、そして
フランコ・スカルダフェッリ
1,2
1
IBDユニット-UOS慢性腸炎病棟、CEMAD、消化器病センター、ポリクリニコ・ウニベルシタリオ "A.ジェメッリ "IRCCS財団、サクロ・クオーレ・カトリカ大学、L. Go A. Gemelli 8, 00168 Rome, Italy
2
イタリア、00168ローマ、サクロ・クオーレ・カットォーレ大学外科医学部、L. Go F. Vito 1
*
著者宛先
Nutrients 2022, 14(13), 2664; https://doi.org/10.3390/nu14132664
投稿受理: 2022年6月7日/改訂:2022年6月23日/受理:2022年6月25日/発行:2022年6月27日
(この論文は、特集「健康および炎症性腸疾患における腸管機能の制御における胆汁酸とプロバイオティクス」に属しています)
ダウンロードキーボード_arrow_down
図表を見る
総説 レポート バージョン ノート
概要
炎症性腸疾患(IBD)および顕微鏡的大腸炎は、消化管に影響を及ぼす慢性の免疫介在性炎症性疾患であり、宿主の遺伝的危険因子、環境因子、腸内細菌叢異常の複雑な相互作用から生じる。腸管粘膜のホメオスタシス、免疫寛容、腸内細菌叢を結びつける正確なメカニズム経路は、いまだ重要な研究課題である。我々は、これらの複雑な相互作用における胆汁酸の役割と、腸内細菌叢の調節における胆汁酸の代謝、ひいては腸粘膜の炎症について深く分析することにした。最近のメタボロミクス研究では、IBD患者における胆汁酸代謝の重大な欠陥が明らかになり、一次胆汁酸の増加と二次胆汁酸の減少がみられた。本総説では、胆汁酸代謝産物と、アポトーシスやインフラマソーム活性化など、IBD発症に関与する免疫学的経路とを関連づける証拠を探る。さらに、さまざまなタイプの胆汁酸誘発性下痢(BAD)の主な病因機序と、その主な新規診断アプローチを要約する。最後に、IBDとBADの両方に対する現在および将来の最先端治療戦略における胆汁酸の役割について論じる。
キーワード
胆汁酸;腸内マイクロバイオーム;炎症性腸疾患;顕微鏡的大腸炎;胆汁酸誘発性下痢症
はじめに 胆汁酸生理学の基礎
胆汁の組成は胆汁酸(BA)だけに限定されない。実際には、水、電解質、胆汁酸、リン脂質、コレステロールで構成されている。胆汁は肝臓から分泌され、消化や脂肪吸収、コレステロールの恒常性維持、抗菌性腸管防御の維持など、いくつかの機能を担っている [1] 。
胆汁の生産、再吸収、または機能の不均衡は、様々な胃腸障害と関連している [2] 。
1.1. 胆汁の産生と組成
胆汁の組成は胆汁酸だけに限定されるものではない。実際、胆汁酸が胆汁組成の大部分(約65~70%)を占めるとすれば、その他の重要な溶質は、リン脂質(20~25%)、コレステロール(4%)、ビリルビン、タンパク質(4%)、その他の電解質やミネラル、例えばナトリウム、カリウム、塩化物、炭酸水素塩、カルシウム、リン酸塩、マグネシウム、鉄、銅などである[3]。
胆汁酸の合成は肝細胞内で始まる。このレベルでは、「一次胆汁酸」(PBA)と呼ばれる2つの酸、コール酸(CA)とチェノデオキシコール酸(CDCA)が生成される。これら2つの酸は、2つの異なる経路をたどってコレステロールから生成される:
(1).
古典的経路」は、Cyp7A1およびCyp8B酵素を介するもので、この経路ではCyp7A1が制限段階となる。
(2).
代替経路」は、Cyp27とCyp7B1を介し、チェノデオキシコール酸を産生する[4]。
古典的経路は、新生児や小児で優勢な代替経路に比べ、成人のヒトで優勢であり、より多く見られると考えられている[5]。
胆汁酸が胆管に分泌される前に、グリシンまたはタウリンがCAまたはCDCAの側鎖に付加される。これは、一次胆汁酸をより親水性にし、腸管細胞から受動的に吸収されることなく消化管内に留まれるようにすることが目的である。このようにして、胆汁酸は消化管内腔でその作用を発揮することができ、腸管での再吸収には特異的なトランスポーターが必要となる [6]。
消化管粘膜腔内では、CAとCDCAは、腸内細菌叢の細菌種によってさらなる修飾過程を受ける。この過程にはいくつかの分子修飾が含まれるが、最も重要な修飾は7α/βジヒドロキシル化である。この修飾により、コール酸(CA)とチェノデオキシコール酸(CDCA)から、それぞれデオキシコール酸(DCA)とリトコール酸(LCA)が生成される。これらは一次胆汁酸の修飾に由来するため、DCAとLCAは「二次胆汁酸」(SBA)とも呼ばれる[7,8]。7αジヒドロキシル化は、異なるBA誘導性(bai)遺伝子によって行われる多段階経路であり、Clostridium scindes、C. hiranonis、C. hylemonaeなどの異なる菌株に属するようである[9]。最近では、Faecalicatena contorta S122もBA誘導可能なオペロンを持つことから、CA/CDCAからDCA/LCAへの変換に関与していると考えられている。いくつかの研究から、Eggerthella lentaはBA水酸基を酸化しエピマー化する能力があり、"bai-like genes "を含んでいることが示されていることから、E. lentaもBA代謝に関与している可能性がある。7βジヒドロキシル化に関しては、Ruminococcus gnavusの介入が重要であるようだ[10]。
もう一つの重要な役割は、共役胆汁酸の加水分解である。胆汁酸塩ヒドロラーゼ(BSH)は、胆汁酸と共役アミノ酸をつなぐC-24-N-アシル結合を加水分解することにより、共役胆汁酸を遊離胆汁酸とグリシンまたはタウリンに分解する [8]。この反応は、クロストリジウム、エンテロコッカス、ビフィドバクテリウム、ラクトバチルスなど、数種類のグラム陽性菌がBSHを発現する下部小腸と近位結腸で主に起こる。
最後に、脱硫についても言及しなければならない。しかし、腸内細菌がBAの脱硫に果たす役割についてはあまり知られていない。この反応機構はまだ解明されておらず、酵素の特性も明らかにされていない[12]。
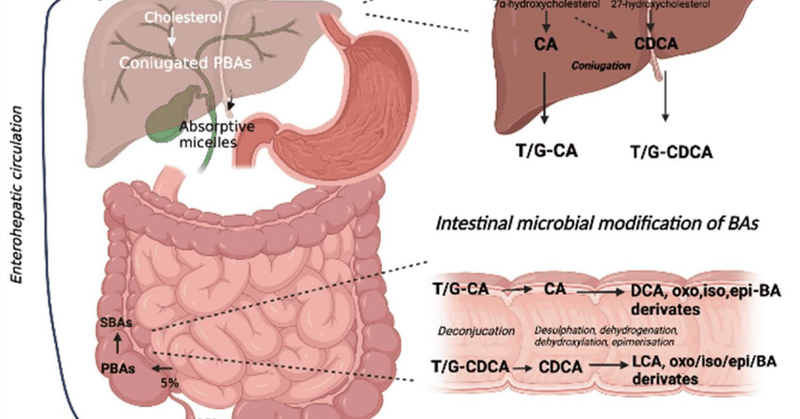
BAの生物変換の概要を図1に示す。
図1. 胆汁酸の生体内変換。BAの代謝はコレステロールから始まり、肝臓でPBAに変換される(CAとCDCA)。その後、これらはグリシンまたはタウリンと共役し(T/G-CAおよびT/G-CDCA)、胆嚢に貯蔵され、腸で放出される。ここで、共役BAはまず腸内細菌によって脱共役され、その後、細菌酵素によって触媒される一連の化学反応(脱硫、脱水素化、ジヒドロキシル化、エピマー化)を経て、他のタイプのSBA(DCA、LCA、オキソ、イソ、エピBA誘導体)に代謝される。
1.2. 肝内循環
肝臓から分泌された胆汁は、胆嚢内に蓄積される。したがって、食後、コレシストキニンなどの特定のホルモンの作用により、胆汁は消化管に分泌される。実際、コレシストキニンはOddi括約筋の弛緩を促し、BAや他の胆汁成分の十二指腸への移行を促進する [13] 。
消化管内に入ると、BAは門脈循環に広く再吸収され、その後再び胆道へ分泌される。BAは、一部は胆管細胞によって、一部は腎近位尿細管細胞によって再吸収される。このシステム全体は非常に効率的であるため、消化管に送り込まれたBAのうち、このプロセスを逃れるのはわずか10%である。この複雑なホメオスタシスの維持には、いくつかのトランスポーターと転写因子が関与している。特に、SLC10A2遺伝子にコードされるトランスポーターASBT(apical sodium bile transporter)は、消化管レベルでBAとナトリウムを再吸収する主要なチャネルである。腸細胞の反対側では、有機溶質トランスポーター(OST)がBAを門脈循環に分泌する[14]。
肝細胞に到達すると、BAはまず、SLC10A1遺伝子にコードされるトランスポーターNTCP(Na taurocholate cotransporting polypeptide)により、再びナトリウムと結合して肝細胞細胞質内に移行され、その後、OATP1B1/B3によるATP分子の加水分解により、再び胆道系に積極的に分泌される[15]。IBDおよびディスバイオシスの病態におけるBAおよび胆汁酸受容体(BAR)の役割
2.1. 胆汁酸代謝
腸に到達した胆汁酸プールの吸収効率は通常約95%である。残りの5%(0.3-0.6g/日)は吸収を免れ、腸内細菌叢によって代謝される。上述したように、BAが受ける可能性のある生体内変換には、脱共役(胆汁酸とそのアミノ酸結合体をつなぐN-アシルアミド結合の酵素的加水分解)とジヒドロキシル化(水酸基の水素への置換)がある。脱共役はBAの殺菌活性を低下させるようである。基質が制限されるこの反応は、消化管全体で起こる可能性があり、結腸で完了する [16]。
多くの研究により、無菌マウスモデルでは、非共役胆汁酸と二次胆汁酸が欠乏し、共役胆汁酸と3-OH-硫酸胆汁酸の含量が増加するため、BA種の多様性が減少することが示されている [17,18]。
IBD患者においても、同様のシナリオが検出される。実際、健常人では少なくとも100~150種の腸内細菌が存在するが、IBD患者の大部分では、真菌やバクテリオファージの増加に伴って細菌の多様性が低下している [19] 。典型的なIBDの腸内細菌異常症は、プロテオバクテリア(Proteobacteria)とフソバクテリア(Fusobacteria)の増加と、ファーミキューテス(Firmicutes)、特にクロストリジウム(Clostridiales)、F. prausnitzii、E. rectalisなどの他の門の減少によって特徴づけられる。このような腸内細菌異常症は、短鎖脂肪酸、トリプトファン代謝産物、Basなどの保護代謝産物や抗炎症代謝産物の産生低下につながる [18] 。
IBD患者では、腸内細菌叢の変化とともに、BAプールとBA代謝の著しい変化が検出される。
IBD患者におけるBAプールの組成については、これまでにいくつかの研究がなされている。一般に、これらの研究では、特にクローン病(CD)患者では、回腸の病変による胆汁酸の吸収不良があり、正常者と比較して胆汁酸プールのサイズが減少することが示された。Vantrappenらによる先駆的な研究では、胆汁酸プールサイズの減少がクローン病活動性指標(CDAI)と逆相関することが示され [20]、Rutgeertsらは、一次胆汁酸の動態から、回腸機能障害を有するIBD患者ではターンオーバーが亢進しており、CAの損失は回腸病変の拡大と相関することを示した [21]。いくつかの研究では、健常対照と比較して、大腸病変を有する活動性CDおよびUC患者では、共役胆汁酸の割合が増加し、非共役胆汁酸および二次胆汁酸が減少していることが示されている。これらの研究を総合すると、胆汁酸の吸収不良は主にCD患者で起こり、一次胆汁酸から二次胆汁酸への生体内変換において大腸が重要な役割を担っていることが立証された[22,23]。さらに、糞便中の胆汁酸含量は非活動性IBD患者と健常者で同じであるが、疾患中は共役胆汁酸と3-OH-硫酸胆汁酸の割合が増加し、さらに二次胆汁酸の数が減少する [24] 。同様の結果がFranzosaらによって最近発表された論文で見出されている。著者らは、CD、UC患者および健常対照者の便サンプルを対象に、アンターゲットLC-MSメタボロームおよびショットガンメタゲノムプロファイリングを行い、活動性のIBD患者では、糞便中のDCAとLCAが著しく減少し、CAやCDCAなどのPBAの存在量が増加していることを示した[18]。
103名のIBD患者を対象としたマルチオミクスプロファイリングでは、CD患者の便サンプルにおいて、SBA、LCA、DCAの有意な減少、およびCAとそのグリシンおよびタウリン結合体の濃縮が、dysbiosisのない患者と比較して示された[25]。
Jacobsらは、小児IBD患者において、CA、硫酸CDCA、7-suplohoCAなどの一次胆汁酸およびその共役体、7-ケトデオキシコール酸、3-スルホデオキシコール酸の増加が観察されたことから、同様のデータを報告している。Wangらも、29人の小児CD患者において、20人の健常人と比較して、二次BAと非共役BAが有意に減少していることを見いだした。BAプールのこれらの変動は、BSHや7α-デヒドロキシル化酵素を持つ細菌種、例えばバクテロイデス、ビフィズス菌、クロストリジウム、ユウバクテリウム、ラクトバチルスなどの菌量の減少と相関していた[26]。
全体として、これらの知見と無菌マウスモデルのデータは、胆汁酸の脱共役、ジヒドロキシル化、脱硫における微生物叢の重要な役割を浮き彫りにしている。二次胆汁酸はTGR5やその他の抗炎症・保護作用を持つ胆汁受容体(後述)のリガンドとして働くため、この減少はIBD患者にみられる免疫機能障害を悪化させる可能性がある。
2.2. 胆汁酸受容体
BARの中でも、一次胆汁酸によって活性化される核内転写因子であるファルネソイドX受容体(FXR)、7回膜貫通型Gタンパク質共役型受容体であるGタンパク質胆汁酸活性化受容体(GPBAR)-1またはTGR5、プレグナンX受容体(PXR)、ビタミンD受容体(VDR)、およびスフィンゴシン1リン酸受容体(SP1R)2に注目が集まっており、これらはすべて一次および二次胆汁酸によって活性化される [27] 。
2.3. ファルネソイドX受容体(FXR)
ファルネソイドX受容体(FXR)は、NR1H4という遺伝子によってコードされており、肝臓、脳、腎臓、膵臓、心臓血管系、消化管など多くの臓器で発現しており、回腸で主に発現している。BAによってリゲーションされると、FXRはER-2 DNAモチーフへの特異的結合を介してFXRα2アイソフォームを通してその機能を果たす [28]。
FXRの最もよく知られた古典的な作用は、胆汁酸、脂肪、糖、アミノ酸代謝に関与している。肝臓では、FXRは薬物誘発性肝障害と肝細胞癌の発症を阻害する。他の臓器では、腫瘍形成を阻害し、組織のウェルビーイングを促進する。
腸では、FXRは二重の役割を果たしている。実際、FXRはBAの腸肝循環の調整と炎症の調節の両方に役立っている。
FXRの存在量は、内腔の胆汁酸によって増加し、炎症によって減少する [30]。FXRは、BAの吸収と合成の両方において重要な役割を果たしている。FXRの活性化は、腸細胞内のアピカルナトリウム依存性胆汁酸トランスポーター(ASBT)の発現/活性をダウンレギュレートすることにより、胆汁酸の取り込みを減少させる。さらに、腸管細胞内に入ると、FXRは、細胞内の腸管BA結合タンパク質(IBABP)と、腸管細胞基底側の有機溶質トランスポーターαおよびβ(OSTαおよびOSTβ)の両方を増加させることにより、細胞を横切る胆汁酸の輸送と、腸管細胞基底側からの門脈循環への排泄を促進する[31,32]。
FXRはまた、胆汁酸合成の転写抑制因子であることも歴史的に知られている。実際、FXRはBAによって配位されると、MAP bZIP転写因子Gの活性化を通じて、腸内BA合成の律速酵素であるCYP27A1やCYP7B1など、BA合成の代替経路に関与する遺伝子の転写を阻害する。FXRはCYP7A1には作用しない [33]。
さらに、BAが腸内に取り込まれると、腸FXRが活性化され、線維芽細胞増殖因子(FGF)19の合成と排泄が調節される。IECから門脈循環で分泌されたFGF19は肝臓に到達し、そこでβ-Klothoと複合体を形成して肝FGF受容体4(FGFR4)と結合する。FGFR4-β-Klotho複合体は、CYP7A1をコードする遺伝子を抑制し、BA合成の抑制につながる[34]。
現在では、免疫系との相互作用能力とともに、様々なレベルや複数の臓器における炎症の調節におけるFXRの役割が脚光を浴びている。
炎症状態におけるFXRの役割を示した最初の実験では、NF-κBとFXRの間の負の相互制御が示された。実際、FXRアゴニストによるFXR活性化は、TNFa依存的にNF-kB炎症経路の阻害を決定し、一方、NF-kBの肝活性化はFXR媒介遺伝子発現を抑制した[26]。
IBD患者で検出されたBA代謝の変化は、上皮性腸細胞および免疫細胞の両方への影響を通じて、炎症性腸粘膜反応に寄与している可能性があることが、新たな証拠によって示されている。オキソおよびイソBA誘導体を含む一次および二次BAは、IECだけでなく、3型自然リンパ球(ILC)、Th17細胞、マクロファージ/単球、ナチュラルキラー細胞(NKC)、樹状細胞(DC)に発現するさまざまな受容体に作用する[35]。腸管免疫系の制御におけるFXRの役割は、P. VavassoriとA. Mencarelliによって初めて提唱された。彼らは、FXR -/-マウスが、WTモデルと比較して、大腸粘膜の軽度/中等度の細胞浸潤、laminae propria CD11b+細胞の増加、サイトカインの産生亢進を伴う腸管炎症状態を特徴とすることを示した。また、FXR遺伝子の欠損は、トリニトロベンゼンスルホン酸(TNBS)の直腸内投与やデキストラン硫酸ナトリウム(DSS)の経口投与によって誘発される大腸炎モデルマウスにおいて、腸炎の重症度を悪化させることが示された。さらに、強力な半合成FXRリガンドである6-エチルCDCAをマウスに投与すると、WTマウスでは大腸炎の重症度、免疫細胞の活性化、TNFα、IL-1β、IL-6などの様々な炎症性サイトカインの発現が抑制されたが、FXR -/-マウスでは抑制されなかった[36]。
この効果は、IBD患者から単離された固有層単核球(LPMCs)でも観察された。LPSによるLPMCsのin vitro刺激中にFXRアゴニストが存在すると、FXRアゴニストが存在しない場合と比較して、INFy、IL17、TNFaなどの炎症性サイトカインの産生が減少することが決定された[37]。さらに、DSS誘発大腸炎マウスにおいて、FXR活性化は局所的IL1βを減少させ、全身的IL10発現を増加させた [38]。
免疫反応の直接的な制御の他に、FXRはtoll様受容体(TLR)とも相互作用する。特に、膜型TLR(TLR2、4、5、6など)の活性化は減少させるが、細胞内TLR(TLR3、7、8、9など)の活性化は、インターフェロン調節因子7(IRF7)を介してFXRの発現を増加させることが実証されている[39]。
Dubocらは、Caco-2ヒト結腸腺がん細胞株において、SBAはIL1b誘発性のIL8分泌を阻害したが、PBAは阻害しなかったことを示した [24]。
Haiping Haoらは、FXRがNLRP3およびカスパーゼ1との物理的相互作用を介して、NLRP3依存性インフラマソーム活性化に対する負の制御を媒介することを発見し、実際に、FXRを過剰発現したマウスが内毒素性ショックに対してより抵抗性であることを示した。最近、NLRP3炎症酵素複合体は、炎症促進作用が疑われるIBDの病態に関与していることが示唆されている。NF-kB、CARD8、IL18、IL1b、NLRP3遺伝子そのものなど、多くの感受性多型がNLRP3炎症酵素IL-1b/18軸と関連している[40]。
他の研究では、胆汁酸がNLRP3依存性インフラムソームの活性化を阻害することにより、自然免疫系を抑制する能力があることが明らかにされている[41]。
胆汁酸とFXRはまた、腸管バリアの完全性の維持にも重要な役割を果たしている。これまでの研究で、胆管結紮による胆汁流の閉塞は、腸管透過性の亢進と腸間膜リンパ節への高率の細菌移行を伴う細菌の過剰増殖と粘膜傷害につながることが示されている[37]。これらの影響は、胆汁酸の経口投与によって軽減される可能性がある。さらに稲垣らは、FXRノックアウトマウスは野生型マウスと比較して上皮バリアーの完全性が低下し、細菌過剰増殖の発生率が高いことを指摘している。これらの結果は、BAを介した腸管透過性の調節にFXRが主に関与していることを示唆している。FXRシグナル伝達の重要性は、胆管結紮を行ったWTマウスモデルにおいて、FXRリガンドであるGW4064の投与が、腸管バリアの完全性の改善と細菌トランスロケーションの減少を決定づけたという知見によって、より強調されている[42]。
実際、最近では、FXRがタイトジャンクションの形成に関与するタンパク質であるZO-1、オクルディン、クローディン-1の発現を増加させることが明らかになっている [43]。さらにFXRは、腸内細菌量の減少に関与する分子であるディフェンシン(特にβディフェンシン-1)の発現を誘導する [44]。
2.4. 武田Gタンパク質共役型受容体5(TGR5)
GPBAR1(またはTGR5)はGタンパク質共役型受容体(GPCR)のスーパーファミリーに属し、その発現は回腸遠位部と結腸で高く、肝臓では発現していない。その天然リガンドはLCA > DCA > CDCA > UDCA > CAである。ここ数年、腸の炎症調節におけるこの受容体の役割について多くの研究がなされてきた。
特に、BAR 501のようなリガンドによるTGR5の活性化は、IL6、TNFa、INFyの減少、IL10の増加、マクロファージのM1からM2への分化促進を介した抗炎症作用が、大腸炎モデルマウスで観察されている。WTマウスにBAR 501を投与したところ、TGR5依存的に腸炎から回復した。実際、TGR5の活性化は、M1炎症性大腸マクロファージの抗炎症性M2表現型への移行を促進する可能性がある。TGR5の活性化は、プロテインキナーゼA(PKA)の活性化を決定し、次に転写因子であるcAMP応答エレメント結合タンパク質(CREB)をリン酸化する。リン酸化されたCREBは、炎症性サイトカイン(TNFaとIL1b)の転写を阻害する一方で、IL-10のような抗炎症性サイトカインの転写を誘導する。この効果は、TNBS大腸炎モデルマウスで観察された炎症の改善に関与している[35]。
Sinhaらは、直腸SBA投与がDSS、TNBS、CD45RB(hi)T細胞移植大腸炎モデルマウスの炎症を改善することを示した。また、DSS大腸炎モデルマウスにLCAを投与したところ、遠位結腸組織においていくつかの炎症性サイトカイン(CXCL10、IL17A、TNFa、CCL5)の減少が観察された[45]。LCAのこの抗炎症作用は、上皮細胞よりもむしろ免疫細胞、特にマクロファージにおけるTGR5受容体の発現に依存しているようである。特に米野らは、TGR5がマクロファージのサブセットで高発現していることを発見した。マクロファージは、IBD発症に関与する炎症性腸管CD14+マクロファージサブタイプに酷似している。これらの免疫細胞では、LCAとDCAを介したTGR5の活性化が、cAMP-NF-kB経路を介して、炎症性細菌抗原に暴露された後のTNFa産生を抑制する。同じ研究で、デオキシコール酸やリトコール酸のようなTGR5アゴニストが、cAMP-NF-kB依存的な経路で細菌性LPS刺激後のTNFa産生を抑制する可能性が推測された。クローン病患者の炎症粘膜から単離されたLPMCsは、非炎症粘膜や健常対照のLPMCsに比べてTGR5の発現が増加しており、TGR5アゴニストを用いるとTNFa産生を抑制することができた[46]。
TGR5はまた、腸管バリアの完全性の維持にも重要な役割を果たしているようである。TGR5を欠損させたマウスモデルでは、大腸粘膜の形態異常と、ゾヌリン1の発現増加と異常分布を伴う上皮大腿接合部の分子構造の変化からなる腸管透過性の亢進がみられた [47] 。
TGR5は腸の運動にも関与している。TGR5は腸管ニューロン上に発現しており、BAが大腸の運動性に及ぼす影響を媒介する。
このような免疫調節作用により、TGR5はIBDの発症に重要な役割を果たしている可能性がある。興味深いことに、TGR5の変異解析により、一塩基多型(rs11554825)とUSおよび原発性硬化性胆管炎との間に強固な関連があることが明らかにされている[49]。
FXRとTGR5がもたらす主な効果を図2にまとめた。
図2. TGR5およびFXR受容体を介したBAの作用。(A)BAはTGR5(武田G-protein-coupled receptor 5)を活性化し、PKA(protein kinase A)の活性化を決定し、PKAはCREB(cAMP response element-binding protein)をリン酸化する。CREBは炎症性サイトカインの転写を抑制し、抗炎症性サイトカインの転写を誘導する。(B)ASBPT(ナトリウム依存性胆汁酸トランスポーター)は、BA(胆汁酸)の回腸腸細胞への侵入を可能にし、次いでFXR(ファルネソイド-X-受容体)の活性化を引き起こし、FGF19(線維芽細胞増殖因子)の合成と発現を制御する。これはBAの合成を抑制する。門脈循環におけるBAの輸送と排泄は、IBABP(腸胆汁酸結合タンパク質)とOSTαおよびOSTβ(有機溶質トランスポーター)によって行われる。
2.5. その他のBAR
レチノイド関連オーファン受容体γt(RORyt)は、Th17リンパ球と自然リンパ球グループ3(ILC3)に発現している。ROR-ytに依存したILC3の活性化は腸粘膜保護作用を発揮するが、Th17の活性化とIL17産生は炎症促進作用を持つ [50] 。
Hangらによる最近の研究では、LCAの2つの異なる誘導体、3-oxoLCAとiso-alloLCAが発見された。これらの分子はT細胞制御因子として働く。実際、異なる経路を通して、両者とも抗炎症作用を示す。3-オキソLCAは、RORγtに直接結合することでTH17細胞の分化を阻害し、iso-alloLCAは、FOXP3の発現を増加させるミトコンドリアの活性酸素種の産生を介して、Treg細胞の分化を増加させる [51]。
これらの代謝産物はいずれもGFマウスモデルでは認められず、微生物叢に由来することが示唆された。さらに、大腸炎モデルマウスでは、この結合がIL17産生とTh17細胞数を減少させ、腸内炎症の抑制につながる [52]。
Paikらは、LCAを3-oxoLCAとisoLCAに変換するのに必要な12のヒト腸内細菌属と対応する酵素を同定した:Adlercreutzia、Bifidobacterium、Enterocloster、Clostridium、Collinsella、Eggerthella、Gordonibacter、Monoglobus、Peptoniphilus、Phocea、Raoultibacter、Mediterraneibacter [53]。
PXRは核内受容体であり、多くの内因性化合物や異種化合物とともに、LCAとも結合する。PXRの活性化は、NF-kB依存的に抗炎症作用を決定する。PXRはヒトCD4+、CD8+Tリンパ球、CD19+Bリンパ球、CD14+単球に発現しており、抗生物質のリファキシミンによっても活性化される。その活性化は、in vitroでTリンパ球の増殖とCD25とINFyの発現を阻害するが、IL6、TNFa、IL8のmRNAの発現を減少させる一方で、NF-kB依存的にTGFbの発現を促進する[54,55]。
スフィンゴシン1リン酸受容体2(S1PR2)は、回腸と結腸の両方で発現している。共役一級胆汁酸(グリコール酸(GCA)、タウロコール酸(TCA)、グリコチェノデオキシコール酸(GCDCA)、タウロチェノデオキシコール酸(TCDCA))によって活性化される。最近のデータでは、タウロコール酸の阻害は、細胞外シグナル制御キナーゼ(ERK)経路を介したCD4+ Tリンパ球の増殖亢進とゾヌリン-1の発現低下を通じて腸の炎症を悪化させ、腸管透過性の亢進につながることが示唆されている [56]。
ビタミンD受容体(VDR)は、ヒトの代謝、免疫、がんの制御に関与する核内受容体である。主に1.25-ジヒドロキシビタミンDによって活性化されるが、LCAやその代謝物である3-オキソLCA、3-ケトLCA、酢酸LCA、プロピオン酸LCA、イソアロLCAによっても活性化される。FXRとは異なり、VDRはCDCAやCAのようなPBAでは活性化されない。VDRは、自然免疫系と適応免疫系の調節に重要な役割を果たしている [27]。骨、皮膚、腎臓、腸、白血球で発現している [57]。腸において、LCAによるVDR活性化は、おそらく腸肝循環へのLCAの過剰流入から肝臓を保護するために、有毒なLCAを代謝するCYP3Aの発現を誘導する [27]。VDRの活性化は、BおよびTリンパ球の継続的な増殖を減少させ [58]、活性化B細胞のアポトーシスを誘導し [59]、正常ヒト末梢血単核球(PBM)細胞によるIg産生を阻害し [60]、転写因子c-mafおよびGATA-3の産生増加、INF-γ産生の阻害、IL4、IL5およびIL10産生の増加を通じて、Th1からTh2表現型への移行を促進する [61]。これまでの研究で、1.25-ジヒドロキシビタミンD(3)の経口投与は、CD4+、CD25+およびFoxp3+ T制御性リンパ球の抑制能を増強し [62]、樹状細胞を寛容化し、制御性T細胞の分化を促進し [63]、RORytを介してIL17産生およびTh17細胞分化を阻害することが示されている [64]。
マウスモデルにおいて、カルシトリオールの投与は、IL1、IL6、IL8、IL12、IL23、IL17、TNFaなどの様々な炎症性サイトカインの減少を決定する一方で、TGFb、FOXP3、IL10の産生を誘導する [65] 。加えて、ヒトVDRをトランスジェニック発現させたマウスモデルは、DSS大腸炎から保護され、IECのアポトーシスが減少していた。
いくつかの研究で、血清ビタミンD低値は、内視鏡的または組織学的悪性度とは無関係に、12ヵ月以内の手術や臨床的再発のリスク上昇など、IBDの予後不良と関連している [67,68] 。さらに、Le-Ning Xueらによるメタアナリシスでは、いくつかのVDR多型は、CDやUCの発症感受性の上昇(TaqIのtt遺伝子型、FokIのff遺伝子型、ApaIのtt遺伝子型)または低下(ApaIの "a "対立遺伝子保有状態)と関連している [69]。胆汁酸誘発性下痢(BAD)
3.1. 分類
BA、CDCA、DOAは、特に高濃度(3〜5mmol/L)で腸粘膜に接触すると腸の運動を刺激することができ、いわゆるBA誘発性下痢を引き起こす[70]。下痢の発症は、特にIBDや回盲部切除を基礎疾患とする患者においては、しばしば臨床的アプローチや管理を複雑にする交絡因子である。
胆汁酸による下痢は、歴史的に4つのサブタイプに分類されている [71] 。
タイプ1は、クローン病でしばしばみられるように、回腸の機能障害または切除によるものである。回腸はBAの大部分が再吸収される部位である。回腸の機能障害や切除は腸肝循環を制限するため、より多くのBAが結腸に到達し、下痢を引き起こす。上述したように、このサブタイプはIBDに最も頻繁に関与するものである。
ラットの大腸炎モデルにおいて、著者らは、大腸炎の急性期において、回腸のアピカルナトリウム依存性胆汁酸トランスポーター(ASBT)の発現が低下し、それに伴って糞便中のBAの排泄が増加し、下痢を起こすことを明らかにした [73]。これらの結果は、BAの恒常性の維持にASBTの発現が関与していることを示唆している。生化学的構造による結腸内のBAの増加は、電解質/水の分泌の増加と粘膜透過性の増加を刺激し、また、下痢の発症につながる近位結腸で生じる高振幅の伝播性収縮を引き起こす [74]。
Van den Bosscheらは2017年に、腸炎が炎症性サイトカインTNF-alfaに依存するTNFΔARE/WTマウス回腸炎モデルにおけるASBTの発現を調査した。このモデルは、胆汁酸プールの95%以上が回腸遠位部で効率的に再吸収されるため、大腸に到達しないことから、BA代謝の変化を研究するためのより適切なIBDモデルであると著者らは述べている。このモデルを用いて、著者らは回腸炎マウスでASBT、OstαおよびOstβの発現が低下していることを示した。これらの結果は、TNF-alfaに暴露したCaco-2細胞単層の研究者たちによっても確認された。さらに、二次胆汁酸であるタウロウルソデオキシコール酸(TUDCA)をマウスに経口投与すると、マウス回腸炎の臨床的および病理組織学的パラメータが減少し、これらのマウスにおける胆汁酸トランスポーターのダウンレギュレーションが緩和された [75]。
ASBTの発現低下は、イヌ、ウサギ、マウスの腸炎症モデルでも報告されている。慢性炎症性腸症(CIE)のイヌでは、回腸ASBTタンパク質の発現が低下している。Giarrettaらは、回腸ASBT発現と回腸障害の病理組織学的累積スコアとの間に有意な負の相関を見出した。さらに、CIEを発症した犬では、糞便中の一次BAの割合がコントロールと比較して増加し、糞便のdysbiosis indexが上昇した [76]。同様の結果が、慢性腸症の犬においてもWangらによって検出された。彼らは、腸内細菌異常に伴う糞便中のSBAc(LCAおよびDCA)の減少を示した。加水分解タンパク質を投与すると、糞便中のBA産生菌(Clostridium hiranonis)のレベルが上昇する一方で、病原性細菌種(大腸菌、C. perfrigens)の量が減少した。これらの結果は、病気の犬の臨床的寛解と関連していた[77]。
BADタイプ2は特発性である。FGF19の機能変化に関連していると考えられている。この転写因子は、胆汁合成の抑制因子として働き、回腸上皮細胞から通常分泌されるが、この種の病態の患者では減少しているようである。このような状況により、結腸に流入するBAプールが過剰に膨張する [78] 。
タイプ3には、慢性膵炎、顕微鏡的大腸炎、胆嚢摘出、SIBO、放射線性腸炎など様々な病態が含まれる。病態機序の完全な理解はまだ得られていない。この疾患群の中で最も多いのは、腹腔鏡下胆嚢摘出術後の下痢である [79] 。この病態では、胆汁とBAの貯留場所がないため、増加したBAが腸粘膜に接触し、下痢を引き起こす [80] 。
第4のタイプのBA誘発性下痢は、通常、小児年齢層で診断されるまれな疾患である。これは、ナトリウム依存性胆汁酸トランスポーター遺伝子(SLC10A2)の先天的欠損による回腸レベルでのBA再吸収の欠損を特徴とする。
最近発表されたCamilleriらの研究では、過敏性腸症候群患者161人と胆汁酸下痢患者44人の分子生物学的および生化学的パラメータが比較されている。BAD患者では、αおよびβの多様性が低く、Firmicutesが増加し、胆汁酸チオールリガーゼ(一次BAから二次BAへの変換に関与)の発現が低下し、スルファターゼが減少した。さらに、同じ研究において、BAD患者の生検では、BAトランスポーター(特にSLC44A5)のダウンレギュレーションとバリアー脆弱化遺伝子(CLDN2など)のアップレギュレーションが認められ、同時に固有層内の炎症活性が増加していた [82]。
3.2. 診断
BAによる下痢は、炎症性腸疾患、特にクローン病でよくみられる。実際、特に回腸・大腸切除後、胆汁酸性下痢は非炎症性下痢の最も一般的な原因である [83] 。
このような患者における回腸・大腸切除後の下痢の発症は、臨床医にとって診断および治療の重要な課題となる。実際、下痢は、疾患の再活性化、小腸細菌の過剰増殖 [84] 、過敏性腸症候群 [85] 、またはBA吸収不良そのものによって誘発される可能性がある。
このような症例において、有用で、低コストで、利用しやすい第一レベルの診断ツールは、糞便カルプロテクチンの測定である。糞便カルプロテクチンの高値(>100μg/g便)は腸炎症の存在と相関するため、十分な感度と特異性をもって疾患の再活性化を示唆する [86,87] 。一方、糞便カルプロテクチンが低値であれば、医師は他の下痢の原因を調べる必要がある。
BAによる下痢が疑われる場合、コレスチラミンの試用は通常、下痢の原因を明らかにするのに有効である。しかし、長い年月の間に、古い診断手段だけでなく、新しい診断手段も完成されてきた。
最初の手段は、C4(7α-ヒドロキシ-4-コレステン-3-オン)の血中濃度の測定である。C4は胆汁酸合成の中間体であるため、BAが大腸で失われ、肝での合成が増加すると、この中間体の血清中濃度が上昇する [88] 。
第二の潜在的な診断手段は、FGF19の血清中濃度である。上述したように、FGF19はBAの合成調節に関与している。BA誘発性下痢患者において、FGF19はBAD発症の良い予測因子であるようである [89] 。
Battatらによる最近の発表では、クローン病患者における血清C4とBADの関係が調査されている。彼らは、回腸切除を受けたCD患者において、潰瘍性大腸炎患者と比較して、BA合成阻害因子であるFGF19の血清中濃度が低く、C4の血清中濃度が有意に高いことを観察した。C4濃度は毎日の液体排便と相関し、FGF19とは逆相関であった。これらの所見は、BAR依存性下痢を示すCD患者と活動性CD患者を鑑別するために、臨床で使用できるバイオマーカーとしてのC4の大きな可能性を示唆している[90]。
炎症性腸疾患以外にも、BAMはリンパ球性大腸炎や膠原病性大腸炎などの顕微鏡的大腸炎でもよくみられることが、長年にわたる様々な研究によって証明されている [91] 。最近の研究で、著者らは、BAD診断のためのバイオマーカーとして、C4の診断精度を調査し、FGF19と比較した。彼らは、活動性IBD、非活動性IBD、手術後IBD、IBS、顕微鏡的大腸炎、および健常人の慢性下痢患者を登録した。7α-ヒドロキシ-4-コレステン-3-オン>48.9ng/mLおよびFGF19<60pg/mLの血清レベルは、慢性下痢患者において感度82.6%、特異度84.3%で胆汁酸吸収不良を検出した。活動性IBD患者におけるC4の中央値は53.1ng/mL、IBD寛解期は52.2ng/mL、手術後IBDは85.7ng/mL、IBS-Dは7.5ng/mL、顕微鏡的大腸炎は69.3ng/mL、健常対照は3.7ng/mLであった。著者らは、C4とFGF19の両方が、顕微鏡的大腸炎および炎症性腸疾患における胆汁酸吸収不良のスクリーニングバイオマーカーとして、高い診断精度で使用できることを実証した[92]。
3.3. seHCAT検査
第3の診断手段は、80年代に特にアングロサクソン諸国で脚光を浴びたSeHCAT検査である。この検査では、セレン標識胆汁酸SeHCATを用いて、腸肝循環の完全性を評価する。回腸の胆汁酸再吸収能力を測定し、定量化することを目的としている。この検査は、コレスチラミンを7日間懸濁した状態で実施する必要がある [93]。
SeHCATに関する先駆的研究のひとつは、1994年にNyhlinらによって行われたもので、クローン病患者53人が登録された。回盲部切除の既往のある患者では、93%がBA吸収不良の検査で陽性であった。一方、回盲部切除のない患者では、BA吸収不良の検査で陽性であったのは28%だけであった。
SeHCATテストは、膠原病性大腸炎と胆汁酸誘発性下痢との間に存在する関連性を検出するためにも使用されている。ある研究では、膠原病性大腸炎患者の44%(12/27)がSeHCAT検査により胆汁酸誘発性下痢を認めた。長期追跡(中央値4.2年)では、21/27人の患者でコレスチラミンによる治療後、下痢が急速に改善した: BAM患者の11/12、SeHCAT検査が正常(75)であった患者の10/15であった [95] 。胆汁酸性下痢とリンパ球性大腸炎との関連はそれほど明確ではないが、これらの患者では75SeHCAT値が対照群(範囲8-91、中央値38%)よりも低い(範囲1.7-53、中央値24%) [96] 。これらの結果は、胆汁酸ホメオスタシスの障害が顕微鏡的大腸炎の特徴であることを示唆している。
SeHCATは、胆汁酸による治療に対する反応を予測する役割を果たすと考えられている。2008年から2014年の間にSeHCATで検査された患者のレトロスペクティブ分析では、75SeHCAT陽性は、66.7%(軽度)、78.6%(中等度)、または75.9%(重度BAD)のBASに対する良好または部分的奏効を予測した。CDに加え、BADの発生と強く関連した因子は、胆嚢摘出術と他の原因による回腸切除であった [97] 。
最近では、系統的メタアナリシスにより、2つの異なる集団(IBS様下痢症患者とクローン病患者)におけるSeHCAT実施の費用対効果が調査されたが、有意な結論は得られなかった[98]。
3.4. 治療と治療の観点
コレスチラミンによる対症療法は、BA誘発性下痢に対する治療アプローチにおいて画期的なものであり、現在でも、BADが疑われるか証明された患者に対する第一の治療選択肢となっている。コレスチラミンは、BADの症状および臨床症状を軽減するのに効果的であることは間違いない [99] 。しかしながら、コレスチラミン製剤は、しばしば好ましくない副作用(便秘、吐き気、腹鳴、鼓腸、腹痛)を引き起こし、患者の治療へのアドヒアランスを損なう可能性がある [100] 。このため、コレスベラムやコレスチポールのような新しい製剤や新しい分子が開発されている。
コレスチラミンがIBDや他の類似疾患におけるBADの管理において中心的な役割を果たしているにもかかわらず、新たな治療の地平が脚光を浴びている。その中で、最も興味深く研究されているのがFXRアゴニストである。実際、FXRにはBADを治療するための魅力的なターゲットとなる特性がある。第一に、上皮性結腸液分泌を阻害すること、第二に、FGF19を介して肝胆汁酸合成をダウンレギュレートすることである[102]。
FXRアゴニストのカテゴリーに属する最も有望な薬剤は、間違いなくオベチコール酸(OCA)である。この薬剤は、UDCA不応性CBPの治療薬として2016年に初めて承認され[103]、その後、非アルコール性脂肪肝炎の治療薬として試験され、良好な結果が得られている[104]。
最近、BADの治療にOCAを使用することに注目が集まっている。さらに、非アルコール性脂肪肝疾患(NAFLD)が、BAサイクルの不均衡、FXR-FGF19軸の調節異常、および結果として生じる下痢と多少関連していることは、Applebyらによる興味深い研究 [105]で実証されている。
胆汁誘発性下痢の治療におけるOCAの使用については、実験モデルでも臨床診療でも、文献上ますます多くのデータが生み出されている。
CaCo細胞とマウスの両方において、FXRアゴニストは分泌抑制剤としての潜在的な活性を示している [106]。この特徴は、すでにUDCAについて研究されており、同様の結果が得られている[107]。
2018年、Hvasは、下痢を呈し、重度の胆汁吸収不全と診断された休止期クローン病の32歳女性の症例を報告した。ロペラミド、オクトレオチド、PPIによる従来療法に不応であったことから、OCAを試みたところ、下痢はすぐに改善した。不思議なことに、OCAを中止すると、すぐに下痢が再発した [108] 。
Waltersらは、28人の患者を3群(原発性BAD、続発性BAD、特発性BAD)に分けて小規模臨床試験を行った。OCA 25mg/日を2週間投与したところ、特に原発性BAD患者、二次性BAD患者で回腸切除が短い患者において、便の回数と形状が有意に増加した。下痢の改善は、血清FGF19の増加と血清C4の減少によって証明された [109] 。
BADの管理、特にIBDと回腸切除歴のある患者におけるBADの管理に関する興味深い見解にもかかわらず、OCAに副作用や禁忌がないわけではない。特に、重篤な肝機能障害(CPT BまたはC肝硬変)を有する患者では、OCAの投与を制限または回避しなければならないことを忘れてはならない。さらに、OCAの投与は、そう痒症などの厄介な副作用を伴う。
このような理由から、最近、新しいFXR作動薬が脚光を浴び、OCAの代替薬を見つけるために試験が行われている。その中でも興味深いのはトロピフェクサーである [110]。
ヒトを対象とした最初の研究では、トロピフェクサーを1日3000μgまで投与しても安全性に問題はなく、興味深い結果が得られた[111]。二重盲検、多施設、無作為、クロスオーバー試験において、患者は60μgのトロピフェキサーを投与された。この分子は安全性と忍容性の点で良好なデータを示し、薬剤投与期間中にそう痒症を訴える患者はいなかった [112]。
最後になるが、BAの代謝を調節する上で重要な役割を果たすのがプロバイオティクスである。実際、いくつかの研究で、さまざまなプロバイオティクスの有益な特性が示されている。これらの効果は、胆汁酸塩ヒドロラーゼ(BSH)によるBAの脱共役作用が主な原因である。興味深いことに、BAの脱共役はプロバイオティクスのコレステロール低下作用の原因である [113]。特に、現在臨床で使用されている2つのプロバイオティクスを挙げる必要がある。プロバイオティクス混合物であるVSL#3は、BAの脱共役と糞便中への排泄を促進し、その結果、腸-肝臓FXR-FGF15軸がダウンレギュレーションされ、肝臓内でのBAの新合成が増加する [114]。BA新合成のためのコレステロール消費量の増加とは別に、BAの脱共役から遊離する遊離アミノ酸(タウリンまたはグリシン)が果たす役割も排除できない。実際、グリシンはグリシン受容体のクロライドチャネルを介して神経伝達を抑制するのに対し、タウリンはGABAA、GABAB、グリシン受容体に作用する。さらに、タウリンは抗酸化剤としても抗炎症剤としてもいくつかの有益な機能を発揮する[115]。
乳酸菌の組み合わせは、IBS症状の改善に有効であることが示されている [116]。
クロストリジウム・シンデンスは、C.ディフィシル感染に対する防御と関連していることで有名である。Charlie G. Buffieらは、この防御機構は、胆汁酸7α-ヒドロキシステロイドデヒドロゲナーゼ酵素のような、baiオペロン遺伝子に代表される二次的なBA合成のための重要な酵素の発現に由来しているのではないかという仮説を立てた。胆汁酸7-デヒドロキシラーゼを持つ細菌のほとんどはクラスターXIVaのClostridiaであり、このクラスターは臨床的に関連性のあるディスバイオシスを改善するプロバイオティクスの候補となる可能性がある [117]。
3.5. 胆汁酸代謝における糞便微生物叢移植(FMT)の役割
最後に、糞便微生物叢移植(FMT)もまた、胆汁酸代謝とその結果としてのBADの制御において注目に値する。Seekatz[118]らによる研究では、FMTを受けた患者における胆汁酸の変化が調査された。FMT後、胆汁酸プロファイルに有意な変化が観察され、タウリン共役胆汁酸塩であるTCAおよびTCDCA、非共役胆汁酸キレートおよび一部のグリシン共役胆汁酸塩が減少し、二次胆汁酸であるDCA、LCAおよびUDCAが増加した。特に、二次胆汁酸の濃度はドナーで観察された濃度を上回り、ある時点から別の時点までの回復期間中に劇的な変動がみられたことから、微生物由来の二次胆汁酸がダイナミックに回復していることが示唆された。このような結果は、クロストリジウム・ディフィシル感染症(CDI)に対してFMT治療を受けた患者において、以前の研究ですでに報告されていた。著者らは、FMT前の糞便サンプルでは一次胆汁酸と胆汁酸塩が優勢であったのとは対照的に、FMT後の糞便サンプルでは二次胆汁酸の濃度が高いことを観察した。著者らは、再発性CDI患者では胆汁酸の代謝が障害されているが、これはおそらくこれらの患者の重要な腸内細菌叢の異常によるもので、一次胆汁酸を代謝することができない。胆汁酸代謝の正常化は、FMT前にCDIの標準治療を受けた患者が経験した軽度の下痢症状の解消に寄与している可能性がある。一方、FMT前の糞便検体ではほとんど検出されなかったリトコール酸やその他の二次胆汁酸は、C. difficileの発芽やコロニー形成を阻害する。Difficileの発芽とコロニーの増殖を阻害し、感染の消失に寄与する [119]。結論
胆汁酸代謝と胆汁酸と胆汁酸レセプターの相互作用はともに、下痢症状の悪化と顕微鏡的大腸炎を含む炎症性腸疾患の病因を決定する上で中心的な役割を果たしている。
実際、胆汁酸の合成および代謝の変化は、FXRおよびTGR5受容体を介して、いくつかの機序で腸粘膜に炎症促進作用を及ぼし、炎症反応の亢進を決定する。
一方、特に解剖学的な素因が明らかな患者では、胆汁酸による下痢は、しばしば過小評価され、治療が十分でない臨床的実体である。
これらの要因が組み合わさることで、IBDおよび顕微鏡的大腸炎の病態生理学における胆汁酸の役割について、新たな展望と洞察が得られる。胆汁酸の炎症と下痢に関連する機序をよりよく理解することで、臨床結果と患者のQOLを改善するための新たな治療・診断法が得られる可能性がある。
著者貢献
F.D.V.およびP.P.:執筆-原案、V.P.およびL.M.:資料、L.R.L.、V.P.およびL.M.:執筆-校閲および編集、B.B.、L.P.、M.M.およびM.D.F.:視覚化、F.S.およびA.G.:監督、F.S: 概念化。すべての著者が本原稿の出版版を読み、同意した。
資金提供
本研究は外部資金援助を受けていない。
施設審査委員会声明
該当なし。
インフォームド・コンセント
該当なし。
データ利用声明
データは一般にアクセス可能なリポジトリで入手可能。本研究で発表されたデータはPubmedで公開されている。
謝辞
我々の科学研究を継続的に支援してくださったローマ財団に感謝する。
利益相反
著者らは利益相反がないことを宣言する。
参考文献
Marin, J.J.; Macias, R.; Briz, O.; Banales, J.; Monte, M.J. Bile Acids in Physiology, Pathology and Pharmacology. Curr. Drug Metab. 2015, 17, 4-29. [Google Scholar] [CrossRef].
炎症性腸疾患のキーアクターとしての腸内細菌叢由来代謝産物。Nat. Rev. Gastroenterol. Hepatol. 2020, 17, 223-237. [Google Scholar] [CrossRef].
Albers, C.J.E.M.; Huizenga, J.R.; Krom, R.A.F.; Vonk, R.J.; Gips, C.H. Composition of Human Hepatic Bile. Ann. Clin. Biochem. Int. J. Lab. Med. 1985, 22, 129-132. [Google Scholar] [CrossRef].
Vaz, F.M.; Ferdinandusse, S. 胆汁酸生合成のヒト障害における胆汁酸分析。Mol. Asp. Med. 2017, 56, 10-24. [Google Scholar] [GoogleRef].
Crosignani, A.; Zuin, M.; Allocca, M.; Del Puppo, M. 胆汁酸代謝におけるオキシステロール。Clin. Chim. Acta 2011, 412, 2037-2045. [Google Scholar] [CrossRef].
胆汁酸代謝を研究するための動物モデル。Biochim. Biophys. Acta (BBA)-Mol. Basis Dis. 2018, 1865, 895-911. [Google Scholar] [CrossRef].
Devlin、A.S.;A Fischbach、M. A biosynthetic pathway for a prominent class of microbiota-derived bile acids. Nat. Chem. Biol. 2015, 11, 685-690. [Google Scholar] [CrossRef] [Green Version].
Ridlon, J.M.; Harris, S.C.; Bhowmik, S.; Kang, D.-J.; Hylemon, P.B. Consequences of bile salt biotransformations by intestinal bacteria. Gut Microbes 2016, 7, 22-39. [Google Scholar] [CrossRef] [Green Version].
Ridlon, J.M.; Kang, D.J.; Hylemon, P.B.; Bajaj, J.S. 胆汁酸と腸内マイクロバイオーム. Curr. Opin. Gastroenterol. 2014, 30, 332. [Google Scholar] [CrossRef] [Green Version].
Cai, J.; Sun, L.; Gonzalez, F.J. 腸管免疫、炎症、腫瘍形成における腸内細菌叢由来の胆汁酸。Cell Host Microbe 2022, 30, 289-300. [Google Scholar] [CrossRef]。
バクテロイデス・フラギリス(Bacteroides fragilis subsp. Biochim. Biophys. Acta (BBA)-Enzym. 1976, 452, 165-176. [Google Scholar] [CrossRef].
ヒト糞便細菌によるリトコール酸とリトコール酸-3-α-硫酸の代謝。脂質 1982, 17, 477-482. [Google Scholar] [CrossRef].
Stellaard, F.; Lütjohann, D. 健常人における胆汁酸の腸肝循環の動態。Am. J. Physiol. 2021, 321, G55-G66. [Google Scholar] [CrossRef].
胆汁酸の腸肝循環とコレステロールホメオスタシスを制御する重要な腸管トランスポーター: アピカルナトリウム依存性胆汁酸トランスポーター(SLC10A2/ASBT)。Clin. 肝疾患の研究。Gastroenterol. 2017, 41, 509-515. [Google Scholar] [CrossRef].
Klaassen, C.D.; Aleksunes, L.M. Xenobiotic, Bile Acid, and Cholesterol Transporters: 機能と制御。Pharmacol. 2010年、62, 1-96. [Google Scholar] [CrossRef] [Green Version].
IBDと代謝性疾患における治療標的としての腸内細菌叢: 胆汁酸受容体FXRとTGR5の役割。Microorganisms 2015, 3, 641-666. [Google Scholar] [CrossRef] [Green Version].
Sayin、S.I.; Wahlström、A.; Felin、J.; Jäntti、S.; Marschall、H.-U.; Bamberg、K.; Angelin、B.; Hyötyläinen、T.; Orešič、M.; Bäckhed、F. 腸内細菌叢は、天然に存在するFXRアンタゴニストであるタウロ-β-ムリコール酸のレベルを低下させることによって胆汁酸代謝を制御する。Cell Metab. 2013, 17, 225-235. [Google Scholar] [CrossRef] [Green Version].
炎症性腸疾患における腸内細菌叢の構造と代謝活性. Nat. Microbiol. 2019, 4, 293-305. [Google Scholar] [CrossRef].
Norman, J.M.; Handley, S.A.; Baldridge, M.T.; Droit, L.; Liu, C.Y.; Keller, B.C.; Kambal, A.; Monaco, C.L.; Zhao, G.; Fleshner, P.; et al. Disease-Specific Alterations in the Enteric Virome in Inflammatory Bowel Disease. Cell 2015, 160, 447-460. [Google Scholar] [CrossRef] [Green Version].
Vantrappen, G.; Ghoos, Y.; Rutgeerts, P.; Janssens, J. 非合併性クローン病における胆汁酸研究。Gut 1977, 18, 730-735. [Google Scholar] [CrossRef].
Rutgeerts, P.; Ghoos, Y.; Vantrappen, G. Kinetics of primary bile acids in patients with non-operated Crohn's disease. Eur. J. Clin. Investig. 1982, 12, 135-143. [Google Scholar] [CrossRef].
回腸切除下痢症における結腸の役割。Lancet 1973, 301, 344-347. [Google Scholar] [CrossRef]。
Mekhjian, H.S.; Phillips, S.F.; Hofmann, A.F. Colonic absorption of unconjugated bile acids. Am. J. Dig. Dis. 1979, 24, 545-550. [Google Scholar] [CrossRef].
Duboc、H.; Rajca、S.; Rainteau、D.; Benarous、D.; Maubert、M.-A.; Quervain、E.; Thomas、G.; Barbu、V.; Humbert、L.; Despras、G.; et al. 炎症性腸疾患におけるディスバイオシス、胆汁酸代謝異常および腸炎症の関連性。Gut 2012, 62, 531-539. [Google Scholar] [CrossRef]。
Lloyd-Price, J.; Arze, C.; Ananthakrishnan, A.N.; Schirmer, M.; Avila-Pacheco, J.; Poon, T.W.; Andrews, E.; Ajami, N.J.; Bonham, K.S.; Brislawn, C.J.; et al. 炎症性腸疾患における腸内細菌生態系のマルチオミクス。Nature 2019, 569, 655-662. [Google Scholar] [CrossRef].
Wang, Y.-D.; Chen, W.-D.; Wang, M.; Yu, D.; Forman, B.M.; Huang, W. Farnesoid X receptor antagonizing nuclear factor κB in hepatic inflammatory response. Hepatology 2008, 48, 1632-1643. [Google Scholar] [CrossRef] [Green Version].
Shin, D.-J.; Wang, L. 胆汁酸活性化受容体: FXRと他の核内受容体に関する総説。Handb. Exp. Pharmacol. 2019, 256, 51-72. [Google Scholar] [CrossRef].
Panzitt, K.; Wagner, M. FXR in liver physiology: 肝代謝を制御する複数の顔。Biochim. Biophys. アクタ(BBA)-Mol. Basis Dis. 2021, 1867, 166133. [Google Scholar] [CrossRef].
FXR生物学の最新情報: Promising Therapeutic Target? Int. J. Mol. Sci. 2018, 19, 2069. [Google Scholar] [CrossRef] [Green Version].
Ding, L.; Yang, L.; Wang, Z.; Huang, W. Bile acid nuclear receptor FXR and digestive system diseases. Acta Pharm. Sin. B 2015, 5, 135-144. [Google Scholar] [CrossRef] [Green Version].
Tiratterra, E.; Franco, P.; Porru, E.; Katsanos, K.H.; Christodoulou, D.K.; Roda, G. Role of bile acids in inflammatory bowel disease. Ann. Gastroenterol. 2018, 31, 266-272. [Google Scholar] [CrossRef].
Plass, J.R.M.; Mol, O.; Heegsma, J.; Geuken, M.; Faber, K.N.; Jansen, P.L.M.; Muller, M. Farnesoid X receptor and bile salts are involved in transcriptional regulation of the gene encoding the human bile salt export pump. Hepatology 2002, 35, 589-596. [Google Scholar] [CrossRef].
Vallim, T.Q.D.A.; Tarling, E.J.; Ahn, H.; Hagey, L.R.; Romanoski, C.E.; Lee, R.G.; Graham, M.J.; Motohashi, H.; Yamamoto, M.; Edwards, P.A. MAFGは胆汁酸合成と代謝の転写抑制因子である。Cell Metab. 2015, 21, 298-311. [Google Scholar] [CrossRef].
肝臓と腸におけるファルネソイドX受容体による胆汁酸ホメオスタシスの制御の違い。J. Lipid Res. 2007, 48, 2664-2672. [Google Scholar] [CrossRef] [Green Version].
Biagioli、M; Carino、A; Cipriani、S; Francisci、D; Marchianò、S; Scarpelli、P; Sorcini、D; Zampella、A; Fiorucci、S. 胆汁酸受容体GPBAR1は腸マクロファージのM1/M2表現型を制御し、GPBAR1の活性化はマウス大腸炎からマウスを救う。J. Immunol. 2017, 199, 718-733. [Google Scholar] [CrossRef] [Green Version].
Vavassori, P.; Mencarelli, A.; Renga, B.; Distrutti, E.; Fiorucci, S. The Bile Acid Receptor FXR Is a Modulator of Intestinal Innate Immunity. J. Immunol. 2009, 183, 6251-6261. [Google Scholar] [CrossRef] [Green Version].
ファルネソイドX受容体の活性化は、炎症を抑制し、炎症性腸疾患における腸管バリアを維持する。Gut 2011, 60, 463-472. [Google Scholar] [CrossRef]。
Massafra、V.; Ijssennagger、N.; Plantinga、M.; Milona、A.; Pittol、J.M.R.; Boes、M.; van Mil、S.W. FXRを介したDSS大腸炎の改善における脾臓樹状細胞の関与。Biochim. Biophys. Acta (BBA)-Mol. Basis Dis. 2016, 1862, 166-173. [Google Scholar] [CrossRef].
胆汁酸センサーFXRは腸炎症におけるTLR-9の免疫制御活性に必要である。PLoS ONE 2013, 8, e54472. [Google Scholar] [CrossRef] [Green Version].
NLRP3インフラムソームのファルネソイドX受容体制御が胆汁うっ滞に伴う敗血症に関与することを明らかにした。Cell Metab. 2017, 25, 856-867.e5. [Google Scholar] [CrossRef] [Green Version].
胆汁酸活性化S1P受容体2はスフィンゴシンキナーゼ2と肝遺伝子発現の重要な制御因子である。Hepatology 2014, 61, 1216-1226. [Google Scholar] [CrossRef] [Green Version].
稲垣 威; Moschetta, A.; Lee, Y.-K.; Peng, L.; Zhao, G.; Downes, M.; Yu, R.T.; Shelton, J.M.; Richardson, J.A.; Repa, J.J.; et al. 核内胆汁酸受容体による小腸の抗菌性防御の制御。Proc. Natl. Acad. Sci. USA 2006, 103, 3920-3925. [Google Scholar] [CrossRef] [Green Version].
宋 睦; 葉 潤; 張 富; 蘇 浩; 楊 熙; 何 浩; 劉 福; 朱 熙; 王 乐; 高 鵬; 他. チェノデオキシコール酸(CDCA)はFXR-MLCK経路を介してリポ多糖誘発腸管上皮バリア機能障害から保護する. J. Agric. Food Chem. 2019, 67, 8868-8874. [Google Scholar] [CrossRef].
β-Defensin 1 Is Prominent in the Liver and Induced During Cholestasis by Bilirubin and Bile Acids via Farnesoid X Receptor and Constitutive Androstane Receptor. Front. Immunol. 2018, 9, 1735. [Google Scholar] [CrossRef] [Green Version].
Sinha, S.R.; Haileselassie, Y.; Nguyen, L.P.; Tropini, C.; Wang, M.; Becker, L.S.; Sim, D.; Jarr, K.; Spear, E.T.; Singh, G.; et al. Dysbiosis-Induced Secondary Bile Acid Deficiency Promotes Intestinal Inflammation. Cell Host Microbe 2020, 27, 659-670.e5. [Google Scholar] [CrossRef].
TGR5シグナルはクローン病におけるin vitro分化炎症性マクロファージおよび腸管マクロファージによる炎症性サイトカインの産生を抑制する。Immunology 2013, 139, 19-29. [Google Scholar] [CrossRef] [Green Version].
Cipriani、S; Mencarelli、A; Chini、M.G.; Distrutti、E; Renga、B; Bifulco、G; Baldelli、F; Donini、A; Fiorucci、S. 胆汁酸受容体GPBAR-1(TGR5)は、腸管バリアの完全性と実験的大腸炎に対する免疫応答を調節する。PLoS ONE 2011, 6, e25637. [Google Scholar] [CrossRef].
TGR5受容体は腸胆汁酸の運動促進作用を媒介し、マウスの正常な排便に必要である。Gastroenterology 2013, 144, 145-154. [Google Scholar] [CrossRef].
Hov, J.R.; Keitel, V.; Laerdahl, J.K.; Spomer, L.; Ellinghaus, E.; ElSharawy, A.; Melum, E.; Boberg, K.M.; Manke, T.; Balschun, T.; et al. 原発性硬化性胆管炎における胆汁酸受容体TGR5の変異特性。PLoS ONE 2010, 5, e12403. [Google Scholar] [CrossRef] [Green Version].
RORγt+自然リンパ球は共生微生物叢からのネガティブシグナルを統合することで腸の恒常性を制御する。Nat. Immunol. 2011, 12, 320-326. [Google Scholar] [CrossRef] [Green Version].
Hang, S.; Paik, D.; Yao, L.; Kim, E.; Trinath, J.; Lu, J.; Ha, S.; Nelson, B.N.; Kelly, S.P.; Wu, L.; et al. 胆汁酸代謝産物はTH17細胞とTreg細胞の分化を制御する。Nature 2019, 576, 143-148. [Google Scholar] [CrossRef].
Song,X.;Sun,X.;Oh,S.F.;Wu,M.;Zhang,Y.;Zheng,W.;Geva-Zatorsky,N.;Jupp,R.;Mathis,D.;Benoist,C.;他。 微生物胆汁酸代謝産物が腸内RORγ+制御性T細胞の恒常性を調節する。Nature 2020, 577, 410-415. [Google Scholar] [CrossRef]。
ヒト腸内細菌は、ΤH17を調節する胆汁酸代謝産物を産生する。Nature 2022, 603, 907-912. [Google Scholar] [CrossRef].
Staudinger, J.L.; Goodwin, B.; Jones, S.A.; Hawkins-Brown, D.; MacKenzie, K.I.; LaTour, A.; Liu, Y.; Klaassen, C.D.; Brown, K.K.; Reinhard, J.; et al. 核内受容体PXRは、肝毒性から保護するリトコール酸センサーである。Proc. Natl. Acad. Sci. USA 2001, 98, 3369-3374. [Google Scholar] [CrossRef] [Green Version].
プレグナンX受容体の活性化は、NF-κB標的遺伝子の発現抑制を介してDSS誘発炎症性腸疾患を改善する。Am. J. Physiol. Liver Physiol. 2007, 292, G1114-G1122. [Google Scholar] [CrossRef].
腸管上皮細胞におけるスフィンゴシン-1-リン酸/スフィンゴシン-1-リン酸受容体2軸は、腸管上皮細胞-CD4+T-細胞相互作用における腸管バリア機能を制御する。Cell. Physiol. Biochem. 2018, 48, 1188-1200. [Google Scholar] [CrossRef].
Wang, Y.; Zhu, J.; DeLuca, H.F. Where is the vitamin D receptor? Arch. Biochem. Biophys. 2012, 523, 123-133. [Google Scholar] [CrossRef]。
Bhalla, A.K.; Amento, E.P.; Krane, S.M. ヒトリンパ球および単球/マクロファージに対する1,25-ジヒドロキシビタミンD3の作用の違い: インターロイキン-2産生の抑制とインターロイキン-1産生の増大。細胞。Immunol. 1986, 98, 311-322. [Google Scholar] [CrossRef].
Chen,S.、Sims,G.P.、Chen,X.X.、Gu,Y.Y.、Chen,S.、Lipsky,P.E. Modulatory Effects of 1,25-Dihydroxyvitamin D3 on Human B Cell Differentiation. J. Immunol. 2007, 179, 1634-1647. [Google Scholar] [CrossRef] [Green Version].
Lemire, J.M.; Adams, J.S.; Sakai, R.; Jordan, S.C. 1α,25-ジヒドロキシビタミンD3は正常ヒト末梢血単核球の増殖と免疫グロブリン産生を抑制する。J. Clin. Investig. 1984, 74, 657-661. [Google Scholar] [CrossRef] [Green Version].
Boonstra、A; Barrat、F.J.; Crain、C.; Heath、V.L.; Savelkoul、H.F.J.; O'Garra、A. 1α,25-ジヒドロキシビタミンD3は、Th2細胞の発達を促進するために、ナイーブCD4+ T細胞に直接的な効果を有する。J. Immunol. 2001, 167, 4974-4980. [Google Scholar] [CrossRef] [Green Version].
Gorman、S; Kuritzky、L.A.; Judge、M.A.; Dixon、K.M.; McGlade、J.P.; Mason、R.S.; Finlay-Jones、J.J.; Hart、P.H. 局所適用1,25-ジヒドロキシビタミンD3は、排出リンパ節におけるCD4+CD25+細胞の抑制活性を増強する。J. Immunol. 2007, 179, 6273-6283. [Google Scholar] [CrossRef] [Green Version].
樹状細胞上の抑制性受容体ILT3の発現は、1,25-ジヒドロキシビタミンD3によるCD4+Foxp3+制御性T細胞の誘導には必須でない。Blood 2005, 106, 3490-3497. [Google Scholar] [CrossRef].
Tang, J.; Zhou, R.; Luger, D.; Zhu, W.; Silver, P.B.; Grajewski, R.S.; Su, S.-B.; Chan, C.-C.; Adorini, L.; Caspi, R.R. Calcitriol Suppresses Antiretinal Autoimmunity through Inhibitory Effects on the Th17 Effector Response. J. Immunol. 2009, 182, 4624-4632. [Google Scholar] [CrossRef].
カルシトリオールによるトリニトロベンゼンスルホン酸大腸炎の免疫調節治療は、Tヘルパー(Th)1/Th17からTh2および制御性T細胞プロファイルへの変化に関連する。J. Pharmacol. Exp. Ther. 2008, 324, 23-33. [Google Scholar] [CrossRef] [Green Version].
Liu、W.; Chen、Y.; Golan、M.A.; Annunziata、M.L.; Du、J.; Dougherty、U.; Kong、J.; Musch、M.; Huang、Y.; Pekow、J.; et al. 腸管上皮ビタミンD受容体シグナルは実験的大腸炎を抑制する。J. Clin. Investig. 2013, 123, 3983-3996. [Google Scholar] [CrossRef] [Green Version].
Gubatan、J.; Mitsuhashi、S.; Zenlea、T.; Rosenberg、L.; Robson、S.; Moss、A.C. 寛解期の低血清ビタミンDは潰瘍性大腸炎患者の臨床的再発リスクを増加させる。Clin. Gastroenterol. Hepatol. 2016, 15, 240-246.e1. [Google Scholar] [CrossRef] [Green Version].
Zator, Z.A.; Cantu, S.M.; Konijeti, G.G.; Nguyen, D.D.; Sauk, J.; Yajnik, V.; Ananthakrishnan, A.N. 炎症性腸疾患における治療前の25-ヒドロキシビタミンDレベルと抗腫瘍壊死因子-α療法の耐久性。J. Parenter. Enter. Nutr.2013, 38, 385-391。[Google Scholar] [CrossRef].
Xue, L.-N.; Xu, K.-Q.; Zhang, W.; Wang, Q.; Wu, J.; Wang, X.-Y. Vitamin D Receptor Polymorphisms Between Vitamin D Receptor Polymorphisms and Associations Between Susceptibility to Ulcerative Colitis and Crohnʼs Disease. Inflamm. Bowel Dis. 2013, 19, 54-60. [Google Scholar] [CrossRef].
Hofmann, A.F.; Hagey, L.R. Bile Acids: Chemistry, Pathochemistry, Biology, Pathobiology, and Therapeutics. Cell. Mol. 生命科学, 2008, 65, 2461-2483. [Google Scholar] [CrossRef].
Camilleri, M. 胆汁酸性下痢症: 有病率、病態、治療。Gut Liver 2015, 9, 332-339. [Google Scholar] [CrossRef] [PubMed].
Oduyebo, I.; Camilleri, M. 胆汁酸疾患。Curr. Opin. Gastroenterol. 2017, 33, 189-195. [Google Scholar] [CrossRef] [PubMed] [Green Version].
胆汁酸の吸収不良は大腸炎急性期の下痢と関連する。Can. J. Physiol. Pharmacol. 2018, 96, 1328-1336. [Google Scholar] [CrossRef].
Bampton, P.A.; Dinning, P.; Kennedy, M.L.; Lubowski, D.Z.; Cook, I.J. The proximal colonic motor response to rectal mechanical and chemical stimulation. Am. J. Physiol. Liver Physiol. [Google Scholar] [CrossRef][Green Version].
タウロイルソデオキシコール酸は炎症条件下で胆汁酸ホメオスタシスを保護し、クローン病様回腸炎を抑制する。研究室 Investig. 2017, 97, 519-529. [Google Scholar] [CrossRef] [PubMed].
Giaretta、P.R.;Rech、R.R.;Guard、B.C.;Blake、A.B.;Blick、A.K.;Steiner、J.M.;Lidbury、J.A.;Cook、A.K.;Hanifeh、M.;Spillmann、T.;ら。 慢性炎症性腸症の犬とそうでない犬との間の頂部ナトリウム依存性胆汁酸トランスポーターの腸管発現の比較。J. Veter.-Intern. Med. 2018, 32, 1918-1926. [Google Scholar] [CrossRef] [PubMed] [Green Version].
Wang, S.; Martins, R.; Sullivan, M.C.; Friedman, E.S.; Misic, A.M.; El-Fahmawi, A.; De Martinis, E.C.P.; O'Brien, K.; Chen, Y.; Bradley, C.; et al. Diet-induced remission in chronic enteropathy is associated with changing microbial community structure and synthesis of secondary bile acids. Microbiome 2019, 7, 126. [Google Scholar] [CrossRef] [PubMed] [Green Version].
Lyutakov, I.; Nakov, R.; Valkov, H.; Vatcheva-Dobrevska, R.; Vladimirov, B.; Penchev, P. Serum Levels of Fibroblast Growth Factor 19 Correlate with the Severity of Diarrhea and Independently from Intestinal Inflammation in Patients with Inflammatory Bowel Disease or Microscopic Colitis. Turk. J. Gastroenterol. 2021, 32, 374-381. [Google Scholar] [CrossRef].
Fisher, M.; Spilias, D.C.; Tong, L.K. 腹腔鏡下胆嚢摘出術後の下痢:発生率と主な要因。ANZ J. Surg. 2008, 78, 482-486. [Google Scholar] [CrossRef].
Sauter、G.H.、Moussavian、A.C.、Meyer、G.、Steitz、H.O.、Parhofer、K.G.、Jüngst、D. 胆嚢摘出術後数ヶ月における腸の習慣と胆汁酸吸収不良。Am. J. Gastroenterol. 2002, 97, 1732-1735. [Google Scholar] [CrossRef].
Oelkers, P.; Kirby, L.C.; Heubi, J.E.; Dawson, P.A. 回腸ナトリウム依存性胆汁酸トランスポーター遺伝子(SLC10A2)の変異による原発性胆汁酸吸収不良。J. Clin. Investig. 1997, 99, 1880-1887. [Google Scholar] [CrossRef] [PubMed][Green Version].
胆汁酸性下痢症および下痢を伴う過敏性腸症候群における生化学的、微生物的および粘膜mRNA発現の比較。Gut 2022. [Google Scholar] [CrossRef] [PubMed].
Lamb, C.A.; Kennedy, N.A.; Raine, T.; Hendy, P.A.; Smith, P.J.; Limdi, J.K.; Hayee, B.; Lomer, M.C.E.; Parkes, G.C.; Selinger, C.; et al. British Society of Gastroenterology consensus guidelines on the Management of inflammatory bowel disease in adults. Gut 2019, 68 (Suppl. S3), s1-s106. [Google Scholar] [CrossRef] [Green Version].
Greco, A.; Caviglia, G.P.; Brignolo, P.; Ribaldone, D.G.; Reggiani, S.; Sguazzini, C.; Smedile, A.; Pellicano, R.; Resegotti, A.; Astegiano, M.; et al. ブドウ糖呼気試験とクローン病: 小腸細菌過剰増殖の診断と治療効果の評価。Scand. J. Gastroenterol. 2015, 50, 1376-1381. [Google Scholar] [CrossRef].
炎症性腸疾患における機能的症状と臨床状態の誤分類における潜在的影響。Aliment. Pharmacol. Ther. 2005, 21, 141-147. [Google Scholar] [CrossRef].
Boschetti、G.; Laidet、M.; Moussata、D.; Stefanescu、C.; Roblin、X.; Phelip、G.; Cotte、E.; Passot、G.; Francois、Y.; Drai、J.; et al. 便中カルプロテクチンのレベルは、無症状のクローン病患者における術後内視鏡再発の重症度と関連している。Am. J. Gastroenterol. 2015, 110, 865-872. [Google Scholar] [CrossRef].
Wright、E.K.;Kamm、M.A.;De Cruz、P.;Hamilton、A.;Ritchie、K.J.;Krejany、E.O.;Leach、S.;Gorelik、A.;Liew、D.;Prideaux、L.;他。 便中カルプロテクチンの測定は、クローン病の手術後のモニタリングと再発の検出を改善する。Gastroenterology 2015, 148, 938-947.e1. [Google Scholar] [CrossRef] [Green Version].
Vijayvargiya, P.; Camilleri, M.; Carlson, P.; Lueke, A.; O'Neill, J.; Burton, D.; Busciglio, I.; Donato, L. IBS-下痢症および機能性下痢症における胆汁酸下痢症の診断を除外するための血清C4およびFGF19測定の性能特性。Aliment. Pharmacol. Ther. 2017, 46, 581-588. [Google Scholar] [CrossRef] [Green Version].
Pattni, S.S.; Brydon, W.G.; Dew, T.; Johnston, I.M.; Nolan, J.D.; Srinivas, M.; Basumani, P.; Bardhan, K.D.; Walters, J.R.F. 胆汁酸性下痢症患者における線維芽細胞増殖因子19: FGF19血清アッセイとSeHCAT保持の前向き比較。Aliment. Pharmacol. Ther. 2013, 38, 967-976. [Google Scholar] [CrossRef].
Battat、R; Duijvestein、M; Casteele、N.V.; Singh、S; Dulai、P.S.; Valasek、M.A.; Mimms、L.; McFarland、J; Hester、K.D.; Renshaw、M; et al. 7α-hydroxy-4-cholesten-3-oneの血清濃度はクローン病患者の胆汁酸下痢と関連している。Clin. Gastroenterol. Hepatol. 2018, 17, 2722-2730.e4. [Google Scholar] [CrossRef].
Fernández-Bañares, F.; Esteve, M.; Salas, A.; Forné, M.; Espinós, J.C.; Martín-Comín, J.; Viver, J.M. Bile Acid Malabsorption in Microscopic Colitis and in Previously Unexplained Functional Chronic Diarrhea. Am. J. Dig. Dis. 2001, 46, 2231-2238. [Google Scholar] [CrossRef].
Lyutakov、I.; Lozanov、V.; Sugareva、P.; Valkov、H.; Penchev、P. 血清7-アルファ-ヒドロキシ-4-コレステン-3-オンおよび線維芽細胞増殖因子-19は、顕微鏡的大腸炎および炎症性腸疾患における胆汁酸吸収不良を診断するバイオマーカーとして。Eur. J. Gastroenterol. Hepatol. 2020, 33, 380-387. [Google Scholar] [CrossRef] [PubMed].
75Se-ホモコール酸タウリンシンチグラフィ(75SeHCAT®)は胆汁酸吸収不良の標準検査か?Rev. Esp. Med. Nucl. Imagen Mol. 2019, 38, 305-311. [Google Scholar] [CrossRef].
Nyhlin, H.; Merrick, M.V.; A Eastwood, M. Bile acid malabsorption in Crohn's disease and indications for its assessment using SeHCAT. Gut 1994, 35, 90-93. [Google Scholar] [CrossRef] [PubMed][Green Version].
膠原病性大腸炎患者における胆汁酸および胆汁酸結合剤の役割。Gut 2000, 46, 170-175. [Google Scholar] [CrossRef] [Green Version].
リンパ球性大腸炎における胆汁酸の役割|Request PDF. Available online: https://www.researchgate.net/publication/11376040_Role_of_bile_acids_in_lymphocytic_colitis (accessed on 23 April 2022).
Murray、I.; Murray、L.K.; Woolson、K.L.; Sherfi、H.; Dixon、I.; Palmer、J.; Sulkin、T. 75SeHCAT検査陽性の発生率と予測因子: 胆汁酸下痢症の診断の改善。Scand. J. Gastroenterol. 2017, 52, 698-703. [Google Scholar] [CrossRef].
Riemsma, R.; Al, M.; Ramos, I.C.; Deshpande, S.N.; Armstrong, N.; Lee, Y.-C.; Ryder, S.; Noake, C.; Krol, M.; Oppe, M.; et al. SeHCAT [tauroselcholic (selenium-75) acid] for investigation of bile acid malabsorption and measurement of bile acid pool loss: システマティックレビューと費用対効果分析。Health Technol. Assess. 2013, 17, 1-236. [Google Scholar] [CrossRef] [Green Version].
Jacobsen、O; Hojgaard、L; Moller、E.H.; O Wielandt、T.; Thale、M.; Jarnum、S.; Krag、E. 回腸切除後の腸習慣に対する腸溶性コレスチラミンの効果: 二重盲検クロスオーバー試験。BMJ 1985、290、1315-1318。[Google Scholar] [CrossRef] [Green Version].
Barkun, A.N.; Love, J.; Gould, M.; Pluta, H.; Steinhart, A.H. 慢性下痢における胆汁酸吸収不良: 病態生理と治療。Can. J. Gastroenterol. 2013, 27, 653-659. [Google Scholar] [CrossRef].
Mottacki, N.; Simrén, M.; Bajor, A. 総説: 胆汁酸下痢症-病因、診断および管理。Aliment. Pharmacol. Ther. 2016, 43, 884-898. [Google Scholar] [CrossRef] [Green Version].
Keely, S.J.; Walters, J. The Farnesoid X Receptor: BADに良い。Cell. Mol. Gastroenterol. Hepatol. 2016, 2, 725-732. [Google Scholar] [CrossRef] [PubMed][Green Version].
Nevens,F.;Andreone,P.;Mazzella,G.;Strasser,S.I.;Bowlus,C.;Invernizzi,P.;Drenth,J.P.;Pockros,P.J.;Regula,J.;Beuers,U.;他。 原発性胆汁性胆管炎におけるオベチコール酸のプラセボ対照試験。N. Engl. J. Med. 2016, 375, 631-643. [Google Scholar] [CrossRef] [PubMed].
Younossi, Z.M.; Ratziu, V.; Loomba, R.; Rinella, M.; Anstee, Q.M.; Goodman, Z.; Bedossa, P.; Geier, A.; Beckebaum, S.; Newsome, P.N.; et al. 非アルコール性脂肪肝炎の治療に対するオベチコール酸: 多施設無作為化プラセボ対照第3相試験の中間解析。Lancet 2019, 394, 2184-2196. [Google Scholar] [CrossRef] [Green Version].
Appleby、R.; Moghul、I.; Khan、S.; Yee、M.; Manousou、P.; Neal、T.D.; Walters、J.R.F. 非アルコール性脂肪肝疾患は胆汁酸合成の調節異常と下痢と関連している: 前向き観察研究。PLoS ONE 2019, 14, e0211348. [Google Scholar] [CrossRef] [Green Version].
Mroz, M.S.; Keating, N.; Ward, J.B.; Sarker, R.; Amu, S.; Aviello, G.; Donowitz, M.; Fallon, P.; Keely, S. Farnesoid X receptor agonists attenuate colonic ephelial secretory function and prevent experimental diarrhoea in vivo. Gut 2013, 63, 808-817. [Google Scholar] [CrossRef] [Green Version].
(注1)下痢を予防するためには、大腸上皮の分泌機能を低下させることが重要である。J. Physiol. [Google Scholar] [CrossRef].
Hvas, C.L.; Ott, P.; Paine, P.; Lal, S.; Jørgensen, S.P.; Dahlerup, J.F. 腸管障害を伴う重症胆汁酸性下痢に対するオベチコール酸: 症例報告と文献レビュー。World J. Gastroenterol. 2018, 24, 2320-2326. [Google Scholar] [CrossRef].
Walters, J.R.F.; Johnston, I.M.; Nolan, J.D.; Vassie, C.; Pruzanski, M.E.; Shapiro, D.A. The response of patients with bile acid diarrhoea to the farnesoid X receptor agonist obeticholic acid. Aliment. Pharmacol. Ther. 2014, 41, 54-64. [Google Scholar] [CrossRef].
ファルネソイドX受容体の強力かつ選択的なアゴニストとしてのトロピフェキサーの構造基盤。Biochem. Biophys. Res. Commun. 2020, 534, 1047-1052. [Google Scholar] [CrossRef].
新規非胆汁酸FXRアゴニストであるトロピフェクサー(LJN452)の健康ボランティアにおける安全性、忍容性、薬物動態、薬力学。Clin. Pharmacol. Drug Dev. 2019, 9, 395-410. [Google Scholar] [CrossRef].
Camilleri, M.; Nord, S.L.; Burton, D.; Oduyebo, I.; Zhang, Y.; Chen, J.; Im, K.; Bhad, P.; Badman, M.K.; Sanders, D.S.; et al. ランダム化臨床試験: 原発性胆汁酸下痢症患者におけるファルネソイドX受容体作動薬トロピフェキソールの有意な生化学的および結腸通過効果。Aliment. Pharmacol. Ther. 2020, 52, 808-820. [Google Scholar] [CrossRef] [PubMed].
Pavlović, N.; Stankov, K.; Mikov, M. Probiotics-Interactions with Bile Acids and Impact on Cholesterol Metabolism. Appl. Biochem. Biotechnol. 2012, 168, 1880-1895. [Google Scholar] [CrossRef] [PubMed].
プロバイオティクスによる微生物叢の改変はマウスにおけるFxr-Fgf15軸のダウンレギュレーションを介して肝胆汁酸合成を誘導する。Cell Rep. [Google Scholar] [CrossRef] [Green Version].
微生物-宿主界面における胆汁酸修飾: 宿主の健康における栄養補助食品および医薬品介入の可能性。Annu. Rev. Food Sci. Technol. 2016, 7, 313-333. [Google Scholar] [CrossRef] [PubMed].
姜 大介(Kang, D.; Chang, D.K.; Min, Y.W.):非便秘性過敏性腸症候群に対する新規乳酸菌プロバイオティクスの有効性と安全性(Efficacy and Safety of New Lactobacilli Probiotics for Unconstipated Irritable Bowel Syndrome): 無作為化二重盲検プラセボ対照試験。Nutrients 2019, 11, 2887. [Google Scholar] [CrossRef] [PubMed] [Green Version].
Buffie, C.G.; Bucci, V.; Stein, R.R.; McKenney, P.T.; Ling, L.; Gobourne, A.; No, D.; Liu, H.; Kinnebrew, M.; Viale, A.; et al. 精密マイクロバイオーム再構成はクロストリジウム・ディフィシルに対する胆汁酸媒介耐性を回復させる。Nature 2015, 517, 205-208. [Google Scholar] [CrossRef] [Green Version].
Seekatz、A.M.、Rao、K.、Santhosh、K.、Young、V.B.再発性および非再発性クロストリジウム・ディフィシル感染患者における糞便マイクロバイオームの動態。Genome Med. 2016, 8, 47. [Google Scholar] [CrossRef] [Green Version].
Weingarden、A.R.;Chen、C.;Bobr、A.;Yao、D.;Lu、Y.;Nelson、V.M.;Sadowsky、M.J.;Khoruts、A.微生物叢移植は、再発性クロストリジウム・ディフィシル感染症において便中胆汁酸組成を正常に回復させる。Am. J. Physiol. Liver Physiol. [Google Scholar] [CrossRef][グリーンバージョン].
出版社注:MDPIは、出版された地図および所属機関の管轄権の主張に関して中立を保ちます。
© 2022 by the authors. ライセンシー MDPI, Basel, Switzerland. 本記事は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条項と条件の下で配布されるオープンアクセス記事です。
共有と引用
MDPIおよびACSスタイル
Di Vincenzo, F.、Puca, P.、Lopetuso, L.R.、Petito, V.、Masi, L.、Bartocci, B.、Murgiano, M.、De Felice, M.、Petronio, L.、Gasbarrini, A.、他 粘膜炎症と腸管運動の胆汁酸関連制御: IBDおよび顕微鏡的大腸炎における病態形成から治療への応用まで。Nutrients 2022, 14, 2664. https://doi.org/10.3390/nu14132664
AMAスタイル
Di Vincenzo F, Puca P, Lopetuso LR, Petito V, Masi L, Bartocci B, Murgiano M, De Felice M, Petronio L, Gasbarrini A, et al. Bile Acid-Related Regulation of Mucosal Inflammation and Intestinal Motility: IBDおよび顕微鏡的大腸炎における病因から治療への応用まで。Nutrients. 2022; 14(13):2664. https://doi.org/10.3390/nu14132664
シカゴ/トゥラビアンスタイル
Di Vincenzo, Federica, Pierluigi Puca, Loris Riccardo Lopetuso, Valentina Petito, Letizia Masi, Bianca Bartocci, Marco Murgiano, Margherita De Felice, Lorenzo Petronio, Antonio Gasbarrini, and et al. 「胆汁酸による粘膜炎症と腸運動の制御: From Pathogenesis to Therapeutic Application in IBD and Microscopic Colitis" Nutrients 14, no. 13: 2664. https://doi.org/10.3390/nu14132664.
なお、2016年創刊号より、本誌はページ番号の代わりに論文番号を使用しています。詳細はこちらをご覧ください。
論文指標
引用
クロスレフ
15
パブコメ
9
PMC
8
スコープス
13
ウェブオブサイエンス
10
グーグル・スカラー
[クリックで表示]
論文アクセス統計
論文アクセス統計論文閲覧数27. 9月28日 9月29日 9月30日 9月1日 10月2日 Oct3. Oct4. Oct5. Oct6. 10月7日 10月8日 10月9日 10月10日 10月11日 10月12日 10月13日 10月14日 10月15日 10月16日 10月17日 10月18日 10月19日 10月20日 10月21日 10月22日 10月23日 10月24日 10月25日 10月26日 10月27日 10月28日 10月29日 10月30日 10月31日 Oct1. Nov2. Nov3. Nov4. 11月5日 Nov6. 11月7日 11月8日 11月9日 11月11日 11月12日 11月13日 11月14日 11月15日 11月16日 11月17日 11月18日 11月19日 11月20日 11月21日 11月22日 11月23日 11月24日 11月25日 11月26日 11月27日 11月28日 11月29日 11月30日 11月1日 12月2日 12月3日 12月4日 12月5日 12月6日 12月7日 12月8日 12月9日 12月10日 12月11日 12月 12月13日 12月14日 12月15日 12月16日 12月17日 12月18日 12月19日 12月20日 12月21日 12月22日 12月23日 12月24日 12月25日 Dec0k1k2k3k4k
ジャーナル統計の詳細については、こちらをクリックしてください。
同一IPアドレスからの複数のリクエストは1ビューとしてカウントされます。
Nutrients, EISSN 2072-6643, MDPI発行
RSSコンテンツアラート
その他の情報
論文処理料金請求書の支払いオープンアクセスポリシーお問い合わせMDPIJobs at MDPI
ガイドライン
著者の方へ査読者の方へ編集者の方へライブラリアンの方へ出版社の方へ学会の方へ学会主催者の方へ
MDPIの取り組み
SciforumMDPI書籍Preprints.orgScilitSciProfilesEncyclopediaJAMSProceedingsシリーズ
MDPIをフォローする
LinkedInFacebookTwitter
MDPIジャーナルからの発行通知やニュースレターを購読する
Acoustics Actuators Administrative Sciences Adolescents Advances in Respiratory Medicine Aerobiology Aerospace Agriculture AgriEngineering Agrochemicals Agronomy AI Air Algorithms Allergies Alloys Analytica Analytics Anatomia Anesthesia Research Animals Antibiotics Antibodies Antioxidants Applied Biosciences Applied Mechanics Applied Microbiology Applied Nano Applied Sciences Applied System Innovation AppliedChem AppliedMath Aquaculture Journal Architecture Arthropoda Arts Astronomy Atmosphere Atoms Audiology Research Automation Axioms Bacteria Batteries Behavioral Sciences Beverages Big Data and Cognitive Computing BioChem Bioengineering Biologics Biology 生物学・生命科学フォーラム Biomass Biomechanics BioMed Biomedicines BioMedInformatics Biomimetics Biomolecules Biophysica Biosensors BioTech Birds Blockchains Brain Sciences Buildings Businesses C Cancers Cardiogenetics Catalysts Cells Ceramics Challenges ChemEngineering Chemistry Proceedings Chemosensors 子どもたち チップ CivilEng クリーンテクノロジー 気候 臨床とトランスレーショナル神経科学 臨床と実践 時計と睡眠 海岸 コーティング コロイドと界面 着色剤 商品 複雑性 化合物 計算 計算機科学と数学 フォーラム コンピューター 物性 保存 建設材料 腐食と材料劣化 化粧品 COVID 作物 暗号化 結晶 分子生物学の最新問題 カレントオンコロジー 酪農データ 歯科学ジャーナル Dermato Dermatopathology Designs Diabetology Diagnostics Dietetics Digital Disabilities Diseases Diversity DNA Drones Drugs and Drug Candidates Dynamics Earth Ecologies Econometrics Economies Education Sciences Electricity Electrochem Electronic Materials Electronics Emergency Care and Medicine Encyclopedia Endocrines Energies Eng Engineering Proceedings Entropy Environmental Sciences Proceedings Environments Epidemiologia Epigenomes European Burn Journal European Journal of Investigation in Health、 Fermentation Fibers FinTech Fire Fishes Fluids Foods Forecasting Forensic Sciences 森林 Fossil Studies Foundations Fractal and Fractional Fuels Future Future Internet Future Pharmacology Future Transportation Galaxies Games Gases Gastroenterology Insights Gastrointestinal Disorders Gastronomy Gels Genealogy Genes Geographies GeoHazards Geomatics Geosciences Geotechnics Geriatrics Gout, Urate、 and Crystal Deposition Disease Grasses ハードウェア ヘルスケア Hearts Hemato Hematology Reports Heritage Histories Horticulturae Hospitals Humanities Humans Hydrobiology Hydrogen Hydrology Hygiene Immuno Infectious Disease Reports Informatics Information Infrastructures Inorganics Insects Instruments International Journal of Environmental Research and Public Health International Journal of Financial Studies International Journal of Molecular Sciences International Journal of Neonatal Screening International Journal of Plant Biology International Journal of Translational Medicine International Journal of Turbomachinery、 国際医学教育発明IoT ISPRS国際地理情報ジャーナル 加齢・長寿ジャーナル 心臓血管の発達と疾患ジャーナル 臨床・トランスレーショナル眼科学ジャーナル 臨床医学ジャーナル 複合材料科学ジャーナル サイバーセキュリティとプライバシージャーナル 発生生物学ジャーナル 実験・理論分析ジャーナル 機能的バイオマテリアルジャーナル 機能形態学・運動学ジャーナル 菌類学ジャーナル イメージングジャーナル 知能ジャーナル 低電力エレクトロニクスと応用ジャーナル 製造・材料加工ジャーナル 海洋科学・工学ジャーナル 分子病理学ジャーナル ナノテラノスティクスジャーナル 原子力工学ジャーナル 耳鼻咽喉科学ジャーナル 個別化医療ジャーナル 呼吸学ジャーナル リスクと財務管理ジャーナル センサとアクチュエータネットワークジャーナル 理論と応用電子商取引研究ジャーナル 血管疾患ジャーナル ゼノバイオティクスジャーナル 動物園・植物園ジャーナリズムとメディア 腎臓と透析 キナーゼとホスファターゼ 知識研究所 土地 言語 法 生命 Limnological Review 液体 文献 肝臓 論理学 物流 潤滑剤 リンパ管 機械学習と知識抽出 機械 マクロモル 磁性 磁気化学 海洋薬物 材料 材料会議 数理・計算応用 数学 医学 医学フォーラム メディシナ メディシン メンブレン メリット メタボライト 金属 気象学 メタン メソッドとプロトコル 計量学 マイクロ微生物学研究 マイクロマシン 微生物 マイクロプラスチック 鉱物 鉱山 モデリング Molbank 分子 マルチモーダル技術と相互作用 筋肉 ナノエネルギー 先端 ナノ製造 ナノ材料 NDTネットワーク 神経膠 神経学 国際神経科学 窒素 非 看護学レポート 栄養補助食品 栄養素 肥満症 海洋 オンコ オプティクス オーラル オルガノイド オステオロジー 酸素 寄生虫学 パーティクル 病原体 病態生理学 小児科レポート 医薬品 薬剤学 薬剤疫学 薬学哲学 フォトケミックス フィコロジー フィケム 物理科学フォーラム 物理学 物理学 植物 プラズマ プラットフォーム 汚染物質 ポリマー 多糖類 家禽 粉末 プロシーディングス プロセス プロテオーム 精神医学 国際精神薬理学 出版物 量子ビーム科学 量子レポート 第四紀放射線反応 不動産 レセプター リサイクル 宗教 リモートセンシング レポート 生殖医療 リソース リューマート リスク ロボット工学 反芻動物 安全科学 サイエンティア・ファーマスーティカ 硬化症 種子 センサー 分離 性別 シグナル 副鼻腔炎 スマートシティ 社会科学 社会 ソフトウェア 土壌システム 太陽固体 分光学 ジャーナル スポーツ 基準 統計 ストレス 表面 手術 手術手技 開発 持続可能性 持続可能な化学 シンメトリー シンバイオ システム 目標 分類技術 電気通信 繊維製品 サラセミア レポート サーモ・トモグラフィ ツーリズムとホスピタリティ トキシックス 毒素 移植学 トラウマケア 高等教育の動向 熱帯医学と感染症 宇宙 都市科学 ウロワクチン 自動車 性病学 獣医科学 振動 仮想世界 ウイルス 視覚 廃棄物 水 風 女性 世界 電気自動車ジャーナル 青少年 人獣共通感染症
オプションを選択
購読申し込み
© 1996-2023 MDPI (スイス、バーゼル) 特に明記されていない限り
免責事項 利用規約 プライバシーポリシー
トップ
この記事が気に入ったらサポートをしてみませんか?
