
COVID-19の失われた微生物。ビフィズス菌、フェカリス菌の枯渇とSARS-CoV-2感染重症度に関連するマイクロバイオーム多様性の減少
COVID-19の失われた微生物。ビフィズス菌、フェカリス菌の枯渇とSARS-CoV-2感染重症度に関連するマイクロバイオーム多様性の減少
Sabine Hazan, Neil Stollman, [...], and Thomas J Borody
論文情報追加
関連データ
補足資料
データ利用許諾書
概要
目的
本研究の目的は、SARS-CoV-2 PCR陽性患者(無症状から重症まで)の腸内細菌の多様性と構成を、PCR陰性の対照群と比較することである。
研究計画
横断的デザインを用いて、2020年3月から2021年10月までにVentura Clinical Trialsに診療に訪れたSARS-CoV-2 PCR感染が確認された患者とSARS-CoV-2 PCR陰性曝露対照の両方において、便サンプルのショットガン次世代シーケンサーを行い、腸内細菌の構成および多様性を評価した。患者は、米国国立衛生研究所の基準に基づき、無症状または軽度、中等度、重度の症状を有する者に分類された。曝露された対照者は、SARS-CoV-2感染患者またはそのサンプルと長期間または繰り返し密接に接触した人、例えば、患者の家庭メンバーや第一線の医療従事者であった。マイクロバイオームの多様性と構成を、すべての分類学的レベルで患者と曝露された対照者の間で比較した。
結果
対照群(20名)と比較して、重症のSARS-CoV-2感染者(28名)は細菌の多様性が著しく低く(Shannon Index, p=0.0499; Simpson Index, p0.0581)、陽性者全体ではBifidobacterium (p<0.0001), Faecalibacterium (p=0.0077), Roseburium (p=0.0327) の相対量が低く、Bacteroides (p=0.0075) は増加していた。興味深いことに、病気の重症度と同じ細菌の量との間には逆相関があった。
結論
SARS-CoV-2感染では、感染前後に細菌の多様性が低く、ビフィドバクテリウム属が枯渇しているため、免疫機能が低下し、症状が出やすくなっているものと考えられる。このような特殊な細菌異常パターンは、SARS-CoV-2感染による症状の重症化に対する感受性マーカーであり、感染前、感染内、感染後の介入が可能である可能性がある。
臨床試験登録番号
NCT04031469 (PCR-)および04359836 (PCR+)。
キーワード 腸内細菌学, 腸内細菌叢, ビフィズス菌, 細菌感染症
サマリーボックス
このテーマについて既に知られていることは?
腸内細菌は宿主の免疫反応(例:炎症、Th1 vs Th2)や感染症への感受性に本質的に関係している。
新しい知見は?
SARS-CoV-2感染者は、SARS-CoV-2感染者と比較して、細菌の多様性が著しく低く、BifidobacteriumとFaecalibacteriumの存在量が少なく、Bacteroidesの存在量が属レベルで増加している。重症度とShannonおよびSimpson多様性指数、BifidobacteriumおよびFaecalibacteriumの現存量との間には逆相関が見られた。また、重症度とバクテロイデスの量との間には直接的な関連性が見られた。
今後、臨床にどのような影響を与える可能性がありますか?
プロバイオティクスの補充や糞便微生物叢の移植によってビフィズス菌やフェカリバクテリウムを増やすことは、急性重症患者や長引く感染症患者の管理において検討する価値がある。もし我々が記録した変化が、最も重症の患者におけるSARS-CoV-2感染に先行するものであれば、この治療法は特に興味深いものになるだろう。逆に、感染後に減少するのであれば、腸内細菌群の再増殖が、SARS-CoV-2感染による腸内細菌群の組成変化に関連した長期的影響を軽減する可能性がある。
はじめに
ビフィズス菌は、年齢および肥満度(BMI)の上昇に伴い減少することが知られており1、ビフィズス菌は多くのプロバイオティクスの活性成分である。In vitroの研究では、これらのグラム陽性菌の利点として、ATP産生の増強、免疫調節および能力、2-8粘膜バリアの完全性、腸管上皮への細菌の付着および侵入の制限、中枢神経系活動の調節が実証されています9 10 さらに、ビフィズス菌は抗炎症作用を有しています。ビフィズス菌には抗炎症作用があります。ビフィドバクテリウム・アニマリス、ビフィズス菌は、「マスタースイッチ」2である炎症性腫瘍壊死因子-α(TNF-α)の機能を低下させ、抗炎症サイトカインIL-10を増加させてTh1の免疫反応を促進するとともにTh2の免疫反応を阻害します8。
SARS-CoV-2感染に関しては、腸と肺の間で免疫学的な調整が行われています。11-13 多くの研究が、健康な腸内細菌叢がSARS-CoV-2関連死亡率の低下14と関連し、プロバイオティクスがSARS-CoV-2とその関連二次感染症の予防15および/または治療に考慮すべきことを示唆しています15。 -17 しかし、2022年2月現在、SARS-CoV-2感染に関する約8000件の研究が発表されているにもかかわらず、進行中の研究(clinicaltrials.gov:NCT04443075およびNCT04486482)は少なく、SARS-CoV-2感染者における腸内細菌の変化についてはこれまでに5件しか発表されていない。それにもかかわらず、腸内細菌叢の状態とこの感染症による転帰との関連が示唆されている。その結果、Streptococcus属、Rothia属、Veilonella属、Actinomyces属の存在量の増加は炎症と関連し18、Collinsella aerofaciens、Collinsella tanakaei、Streptococcus infantis、Morganella morganiiの存在量の増加は、高いSARS-CoV-2感染性を有する糞便試料と関連しており19、LachnospiraceaeおよびEnterobacterioaceae存在量の増加は死亡率および人工換気の必要性と関連していました19。SARS-CoV-2感染に対して潜在的に防御的な種には、Parabacteroides merdae、Bacteroides stercoris、Alistipes onderdonkii、Lachnospiracea bacterium19、F. prausnitziiが含まれ19 20、感染に対する脆弱性と重症化の増加は、B. bifidumの存在量の減少に関連していた20。21 最近の研究では、入院時のF. prausnitziiの減少など、腸内細菌叢の側面が「Long-COVID」と相関している22。つまり、SARS-CoV-2によるヒト腸内細菌叢の変化と臨床結果との関係を解明する必要性が依然として存在するのである。
科学界および一般市民は、プロバイオティクスの治療可能性にますます関心を寄せている。ビフィズス菌は、IBD23からクロストリジョイデスディフィシル感染症に至るまでの臨床症状を改善する可能性があります。23-26 試験管内でビフィズス菌の特定株を投与すると、C. difficileの毒素が減少することが示されています25。ビフィズス菌はいくつかのプロバイオティクス製品の一般的な成分であり、SARS-CoV-2感染と関連しているように見えることから、プロバイオティクスがSARS-CoV-2の治療または予防に役割を持つかどうかを考えることができる。
ここでは、SARS-CoV-2 PCR陽性患者(無症状から重症まで)とSARS-CoV-2 PCR陰性対照者の横断的グループにおいて、腸内細菌群の多様性と構成と臨床転帰との関係を評価する。我々の対照は、PCR陰性で無症状のままSARS-CoV-2に暴露された人たちである。対照群は、同様のウイルス曝露を受けたと考えられるが、感染から保護されているように見えた。我々のデータは、何らかの保護がマイクロバイオームに存在する可能性を示唆している。
研究方法
研究デザインおよび対象者
SARS-CoV-2感染検査において、症状がある、または「症例」に曝露された個人は、検査の翌週に本人または家族のいずれかが陽性であった場合、登録することが可能であった。対照者は、SARS-CoV-2のPCRが陰性で、3-6ヶ月間抗体陰性が続き、6-12ヶ月間無症状であることが登録の条件であった。さらに、対照者は少なくとも1人の症状のあるSARS-CoV-2陽性者と同居しているか、症状のあるSARS-CoV-2陽性患者または多数のSARS-CoV-2陽性サンプルに繰り返し暴露されている医療従事者でなければならなかった。すべての曝露対照者は、SARS-CoV-2に曝露しているにもかかわらず、SARS-CoV-2感染に対する隔離や予防を選択せず、ワクチン接種をまだ受けていない者であった。患者は自宅では個人防護具(PPE)を着用せず、職員はこの世界的大流行時にその希少性からオフィスでは完全なPPEを着用しなかった(すなわち、マスクを着用しなかった)。総非経口栄養法による治療を受けている患者、または重要な消化管手術(例:肥満手術、回腸直腸吻合を伴う大腸全摘術、直腸切除術、術後ストーマ、オストミーまたは回腸肛門パウチ)の既往がある患者は除外した。
本試験は2020年3月1日から2021年10月31日の間に実施され、1名を除くすべての被験者が2021年6月1日より前に募集されました。その間、米国ではアルファ型とイプシロン型が優勢であった28。
アセスメント
自記式質問票により、症状の重症度、既往歴、現在の投薬およびプロバイオティクスの使用、娯楽用医薬品または動物への曝露に関する情報を求めた。SARS-CoV-2感染者はさらに、National Institute of Health, Clinical Spectrum of SARS-CoV-2 Infectionの基準に従って、無症候性キャリアと軽度、中度、重度の症状を持つ者に分類された29 30。無症候性PCR確認SARS-CoV-2陽性患者の世帯員は、無症候性キャリアと分類された。患者および対照者は、疾病対策予防センターのBMI基準に基づいて、低体重、標準体重、過体重、肥満、高度肥満に分類された31。
便サンプルの収集と処理
同一世帯内の患者および対照者は、指標となる症例が陽性になってから1週間以内に便サンプルを採取した。患者は、ベースライン時、治療前、症状発現後48時間以内に便検体を採取した。症状が現れてから便を採取するまでの間に、抗生物質、SARS-CoV-2感染治療薬、市販の治療薬(例:ビタミン剤、解熱剤、鎮痛剤)、酸素補給を開始された被験者はいなかった。被験者には、新鮮な便を1mL採取し、DNA/RNA Shield Fecal Collection Tube (Zymo Research, Tustin, California) に直接入れ、サンプルを十分に混ぜるように指示した(手順と無菌法について教育した)。ここでは、腸内細菌叢を正確かつ安定して捕捉するためには、1 mLの糞便で十分である。この方法は、便全体の混合や分注の必要性をなくすために選択されています。糞便採取チューブの中の溶液は、サンプルを常温(4℃〜25℃)で2年以上、または-20℃以下で無期限に保存できるように設計されています。サンプルは私たちの研究室に到着後、直ちに-20℃で凍結されました。
糞便採取後、Qiagen PowerFecal Pro DNA 抽出キットを用いて個々のサンプルのDNAを抽出・精製した。分離されたDNAは、Quantus FluorometerとQuantFluor ONE dsDNA kitを用いて定量された。DNAの定量後、DNAを正規化した。つまり、全てのサンプルは100 ngの入力DNAでライブラリー調製を開始した(DNA抽出・精製後)。次に、イルミナのNextera Flexキットを用いて、ショットガン手法でライブラリーを調製した。その後、サンプルは、タグ付け、増幅、インデックス付け、精製というショットガンメタゲノム処理手順を経た。このショットガンメタゲノム標準プロトコルの完了後、NextSeq 500/550での次世代シーケンス(NGS)実行中にシーケンス深度を標準化するために精製ライブラリーを再度正規化しました。同じNextSeq High Outputキットを一貫して使用し、シーケンシングランごとに同じ数のサンプルをロードし、サンプルのプーリング濃度(モル濃度)を正規化することにより、シーケンシング深度(すなわちリード数)の一貫性を達成しました。
Illumina NextSeq with 500/550 High-Output Kits V.2.5でのシーケンス完了後(300サイクル)、生データをイルミナのBaseSpaceクラウドにリアルタイムでストリーミングしてFASTQ(Fast Quality、生体配列情報を保存するための標準テキストファイルタイプ)変換を行った。その後、FASTQファイルはOne Codexのバイオインフォマティクスパイプラインに送られ、メタゲノム注釈と、すべての患者と対照者の微生物叢の構成と上位属および種の相対存在比を解明するための解析が行われた。
データ解析
SARS-CoV-2感染患者および曝露対照者の腸内細菌叢間の分類群間の相対存在度の違いを評価し、PythonのJupyter Notebookを用いたOne Codexのバイオインフォマティクス解析パイプラインでシャノンおよびシンプソンアルファ多様性指数を算出しました。具体的には、One Codex Databaseは114Kの完全な微生物ゲノムから構成されています(One Codex, San Francisco, California)。処理中、リードはまずヒトゲノムに対してスクリーニングされ、次にk-merベースの分類を使用して微生物参照データベースにマッピングされました。個々の配列(NGSリードまたはコンティグ)は、k-mer(k=31)を用いた正確なアライメントにより、One Codexデータベース(One Codex)と比較されました。相対頻度に基づいて、ユニークなk-merをフィルタリングし、シーケンシングや参照ゲノムのアーティファクトを制御しました。
シーケンスの深さはProgenaBiomeの標準的な作業手順に従い、本研究では平均8 239 475リードであった。浅いメタゲノムシーケンスは通常0.5百万リードに過ぎないが、それでも分類学上の植物群レベル(最も豊富な細菌については属も)の分析には十分であると考えられることに注意する必要がある。
各微生物分類の相対的な存在量は、利用可能なすべての参照ゲノムにわたるシーケンスの深さとカバー率に基づいて推定されました。ベータ多様性は、One Codexから得られた門レベルの相対的存在量を用いて、距離行列で可視化した加重UniFrac距離として計算された。腸内細菌叢の重要な構成要素に関する我々の経験と知識、および他の研究との類似性に基づいて13の属が選択された18 20 29。
患者をサブグループ間で比較するため、また患者と曝露された対照群を比較するために、GraphPad V.8を用いて、変動分析(ANOVA)、マン-ホイットニーのU、クラスカル-ウォリス検定、χ2検定統計を実施し、p値<0.05は有意とみなした。Kruskal-Wallis検定にはDunnのpost-hocを用い、すべての状況において多重比較のための補正を行った。
すべての著者が研究データにアクセスし、最終原稿を確認・承認した。
結果
患者の特徴
患者(n=50)および対照群(n=20)の人口統計学的および臨床的特徴をオンライン補足表1および2に示し、表1に要約した。患者はすべて米国在住で、州はオンライン補足表1に示した。患者50人中24人(48%)、暴露された対照者20人中7人(35%)が男性であった。平均±SEM年齢(歳)は、患者50.0±2.5歳、曝露対照者44.4±3.6歳であった。患者50人中44人(88%)が非ヒスパニック系白人で、50人中5人(10%)がヒスパニック系、50人中1人(2%)がネイティブアメリカン、曝露された対照者20人中17人(85%)が非ヒスパニック系白人、20人中2人(10%)、20人中1人(5%)黒人が含まれていた。患者のうち、50人中28人(56%)が重症、12人(24%)が中等症、6人(12%)が軽症で、50人中4人(8%)が無症状であった。50人中32人(64%)の患者および20人中12人(60.0%)の曝露対照者は、米国疾病対策センター(CDC)によりSARS-CoV-2感染の重症度上昇の危険因子とみなされる基礎疾患を有していた1。データ入手可能な患者46人の平均±SEM BMIは、曝露対照20人の25.1±0.96に対して27.1±0.98であった。性別、年齢、人種、食欲不振、便通の変化、食事、基礎疾患の有無に有意差はなかった(p>0.2)。
表1
表1
被験者の臨床的および食事的特徴とともに、人口統計学の概要
補足データ
bmjgast-2022-000871supp001.pdf
補足資料
bmjgast-2022-000871supp002.pdf
曝露された対照者のうち、16人は研究に参加したSARS-CoV-2陽性患者の家庭内接触者、2人はSARS-CoV-2陽性患者に広範囲かつ非保護で曝露した医療従事者、2人は数千のSARS-CoV-2サンプルに曝露した実験従事者(医療従事者と実験従事者はその希少性により完全PPE、すなわちフェイスマスクを着用しなかった;「方法」の項を参照)であった。本研究の期間中、患者および対照者のいずれもSARS-CoV-2の予防または治療を受けておらず、ワクチン接種もまだ受けていない。研究前にSARS-CoV-2が陽性であった患者および曝露された対照者はいなかった。
腸内細菌叢の多様性と構成
図1は、被曝対照者の腸内マイクロバイオームの構成を門レベル(図1A)および属レベル(図1B)の円グラフで表したものである。門レベルでは、FirmicutesとBacteroidesが優勢で、それぞれ全門の59.6%(被曝対照)と54.7%(SARS-CoV-2陽性)、29.1%(被曝対照)と40.4%(SARS-CoV-2陽性)で構成されている。属レベルでは、Bacteroidesが12.4%(曝露対照)、21.8%(SARS-CoV-2陽性)、Alistipesが6.4%(曝露対照)、7.2%(SARS-CoV-2陽性)、Bifidobacteriumが7.6

%(曝露対照)、1.5%(SARS-Cov-2陽性)であった。
図1
図1
被曝対照者(n=20、左)とSARS-CoV-2陽性者(n=50、右)の様々な(A)フライヤと(B)属における細菌の相対存在量の分布。
Figure 2は、調査したすべてのサブグループについて、Shannon diversity(図2A)とSimpson diversity index(図2B)という2つの多様性指標を示したものである。シャノン指数(細菌組成の豊かさ)の全体のp値は、重症度の増加とともに多様性が有意に(p=0.0499)減少することを示し、クラスカル・ウォリス検定で分析したところ、被曝対照群と重症対照群の間で有意性が見られた(p=0.0201)。また、Simpson(細菌組成の均一性)指標では、SARS-CoV-2の重症度の上昇に伴い多様性が減少する傾向が見られた(p=0.0581)。
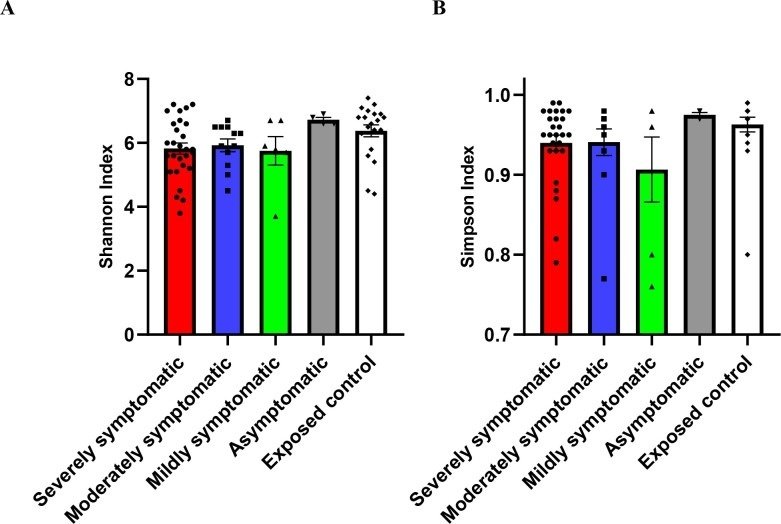
図2
図2
SARS-CoV-2陽性患者(重症:n=28、中等症:n=12、軽症:n=6、無症状:n=4)と曝露対照(n=20)の腸内細菌叢組成の多様性。(A) Shannon index (p=0.0499), (B) Simpson ...
SARS-CoV-2患者と対照者を比較するメタゲノム解析の結果、特定の細菌の相対存在量に有意差があることが明らかになった。SARS-CoV-2陽性(曝露対照)対陰性被験者の相対存在度を、Mann-Whitney U検定による比較p値とともに表2に示している。SARS-CoV-2感染者では、BifidobacteriumとFaecalibacteriumの相対量が有意に減少し、Bacteroidesの相対量が有意に増加した(表2)。
表2
表2
SARS-CoV-2陽性者とSARS-CoV-2陰性者の比較では、Bacteroidesが増加し、Bifidobacterium、Faecalibacterium、Roseburiumが減少している。
表3は、SARS-CoV-2陽性患者対暴露対照の様々な重症度における属・種の相対的存在量(平均±SEM)を示している。クラスカル・ワリス検定で分析し、これらの変化の主効果(つまり全体のp値)を左の列に示した。表3は、多重比較を補正して、感染者対曝露対照群および無症状群における3段階の重症度を比較したものである。特に、重症度の上昇は、Bifidobacterium、Faecalibacterium、F. prausnitizii、Roseburiumの相対量の減少、およびBacteroidesの相対量の上昇と関連していることが示された。
表3
表3
重症度が高くなるにつれて、Bacteroidesの相対量が増加し、Bifidobacterium、Faecalibacterium、Roseburiumの相対量は減少する。
図3は、患者の最も多い12科と12属を、重症度別に分類し、対照群との比較で示したものである。色で区別された棒グラフは、細菌ファミリーと属の相対的な存在比率を表している。B列に示されたSARS-CoV-2陽性患者のマイクロバイオームの多様性が減少していることに注目。
図3

図3
最も一般的な12菌種(A)ファミリーと(B)属の相対的な存在量のグラフ。上段はSARS-CoV-2陽性患者(n=50)を重症度で層別化したもの。下は対照群(n=20)。色のついたボックスは...
図4は、SARS-CoV-2陽性と重症度に応じたマイクロバイオームの変化をまとめたもので、緑色のボックスはSARS-CoV-2に関連する属/種の存在量の有意な上昇を、赤いボックスは有意な枯渇を表している。
図4

図4
SARS-CoV-2患者と曝露された対照者の腸内細菌叢を比較した分類群の図。赤または緑の背景は、SARS-CoV-2陽性...における属または種の有意な枯渇または増加(陽性または重症度による)をそれぞれ示す。
図5A、Bは、SARS-CoV-2感染の重症度別にグループ化した各被験者のビフィズス菌の相対存在量を示す図である。この図は、被験者グループを重症度順に並べたものであり(左側が重症、右側が曝露対照)、重症度が下がるにつれてビフィズス菌の存在量が増加する様子を示している。
図5

図5
SARS-CoV-2陽性患者(n=50)とSARS-CoV-2陰性曝露対照(n=20)におけるビフィズス菌の相対的存在量。データは、(A)平均値と95%信頼区間のエラーバー、(B)SARS-CoV-2陽性患者と陰性患者で相対量を変えたときの個々の点としてプロットされる...
被験者のベータ多様性の解析により、コントロール被験者の多様性は、患者の多様性とは別にクラスタリングされることが示された。図6Aは、本調査の全個人(n=70)のファイラ細菌プロファイルを特徴とするβ多様性重み付け(定量)UniFrac解析である。図6Aから、非類似度の幅はあるものの、SARS-CoV-2陰性者は、SARS-CoV-2陽性者よりも互いに類似していることが明らかになった。また、このマトリックスでは、SARS-CoV-2陽性患者の間で類似しているクラスターと、陽性患者と陰性患者が交差する非類似の暗い象限が強調されている。より細かいレベルでは、図6Bに属性の主成分分析(PC)を用い、軸は分散の割合(%)を示している。PC分析では、より近い点ほど類似している(乖離の方向を軸とした乖離が小さい)。ここでは、PC1が43.16%のバリエーションを占め、PC2が12.78%を占めている。この解析では、SARS-CoV-2陽性患者のサブセットが、X軸に沿って右側に集まっている(PC1)ことが明らかになり、疾患の機能としての微生物相の分岐が浮き彫りになっている。このように、図6では、被曝した対照群とSARS-CoV-2患者とは別々に類似したクラスタリングをしており、つまり、患者は対照群と比べて、マイクロバイオームの点で互いに類似していることがわかる。
図6

図6
SARS-CoV-2陽性患者のマイクロバイオームは、曝露された対照者のマイクロバイオームよりも互いに類似している。(A)門レベルSARS-CoV-2陽性サンプル(n=50)と曝露した陰性コントロールサンプル(n=20)の重み付きUniFrac距離行列。マイクロバイオームの距離...
考察
免疫機能と健康は、細菌量によって強化される可能性がある
宿主と腸内細菌叢の間の相互作用は、複雑で、数が多く、双方向的である。腸内細菌叢は自然免疫系および適応免疫系の発達と機能を調節し32、感染症および感染症の重症化から保護できる可能性がある。本研究の主要な発見は、SARS-CoV-2陽性および感染の重症度が、保護的なBifidobacterium属およびFaecalibacterium属のレベルの低下と、ShannonおよびSimpson指数で示されるように細菌の多様性の低下と関連するというものであった。このことは、細菌の多様性が様々な一般的疾患の存在と逆相関することを示した研究と一致している。33 ユニークなことに、本研究では、SARS-CoV-2 に曝露した SARS-CoV-2 陰性者(すなわち対照)と症状ありおよび症状なしの SARS-CoV-2 陽性患者を比較した。このように、我々はSARS-CoV-2への曝露をコントロールした。
ビフィドバクテリウム属は、重要な免疫機能を持ち、8マイクロバイオームの主要な構成要素であり、プロバイオティクスに頻繁に使用されている34。ビフィドバクテリウムは、TNF-αおよびマクロファージを抑制することによってTreg応答を増加させ、細胞障害を軽減する35。ビフィドバクテリウムは、TNF-α生成に対する影響とは独立して腸の上皮細胞障害から保護することもできる。この保護効果には、一部のビフィズス菌の特徴であるエクソポリサッカライドコートが重要な役割を果たしている36。ビフィズス菌のこれらの免疫機能は、SARS-CoV-2感染予防効果に関連して重要である可能性がある。
ビフィズス菌の数は、SARS-CoV-2感染の主要な危険因子である加齢や肥満によって減少することが示されています37。我々は、ウイルス感染症がより重症化した患者において、ビフィズス菌の存在量が減少していることを実証している。しかし、健康な人のビフィズス菌の正常なベースライン量を構成するものに関する決定的な研究は存在しないことに留意すべきである。
フェカリバクテリウム属およびF. prausnitzii種の存在量もまた、この分析においてSARS-CoV-2陽性およびSARS-CoV-2感染の重症度と逆相関があった。年齢と糖尿病はSARS-CoV-2感染の危険因子であり、F. prausnitziiのレベルは高齢者と糖尿病患者で著しく低下する37。実際、フェカリス菌レベルは人間の健康全般に関する間接的な「指標」と考えられてきた38。F. prausnitziiは「西洋」食事(肉、動物性脂肪、砂糖、加工食品、低繊維質を多く摂取)により減少するが、野菜と果物を多く含む「地中海式」食事、低肉摂取では増強される39。つまり、F. prausnitziiのレベルはSARS-CoV-2感染の重症度と負の相関があり、先行研究はF. prausnitziiの減少が年齢、糖尿病、肥満、おそらく食事などのSARS-CoV-2感染の脆弱性と関連していることを示している。
SARS-CoV-2陽性および重症度は、Roseburiumの減少およびBacteroidesの増加にも関連していた。これらの変化の意味するところはまだ不明である。
自然免疫力は善玉菌の増加によって強化される可能性がある
SARS-CoV-2感染の病理学的影響には、ウイルス侵入による直接的影響と、最も深刻な形である「サイトカインストーム」を含む複雑な免疫学的反応の両方が含まれている。サイトカインストームは、自然免疫反応中に活性化したマクロファージ、マスト細胞、内皮細胞、上皮細胞によって産生される炎症性サイトカインの循環レベルが急激に上昇する結果であり、ビフィドバクテリウムとフェカリス菌の存在量と細菌の多様性に調節されているようである(5, 23, 25)。ステロイド治療は、この自然免疫系の過剰な活性化を抑制することに基づいて、SARS-CoV-2感染において状況に応じて成功を収めている(Tang et al.による総説41)。
Zhaoは、IL-16やIL-17などの炎症性サイトカインの血清レベルの上昇がSARS-CoV-2感染患者の予後不良を予測すると報告している42。また、Taoらは、腸内細菌叢組成の変化がSARS-CoV-2による腸内の炎症性サイトカイン産生に寄与し、サイトカインストームの発生につながるかもしれないことを示した29。両氏は、SARS-CoV-2患者においては腸内細菌叢多様性の著しい低下と日和見病原体の増加の存在を報告した。興味深いことに、日和見病原体の出現は、Th17細胞の数と正の相関があった。BozkurtとQuigleyは、IL-6とIL-17がイノシトール要求酵素1経路を介した細胞のオートファジーによる免疫相互作用によってウイルスの持続性を促進すると報告している16。さらに、ビフィズス菌のいくつかの種は、同じくイノシトール要求酵素1経路を介して小胞体ストレスを軽減することによってコロナウイルスの複製を防ぐと考えられている。さらに、ビフィズス菌の内視鏡的直接投与は、IBDの症状緩和と粘膜治癒に有効であることが示されており、この効果はビフィズス菌の抗Th17作用と関連していると思われる。 (8) 図7は、ビフィズス菌がマスタースイッチであるTNF-αの作用を弱めることによって、免疫反応の亢進を抑制する可能性があることを示しています。
図7

図7
SARS-CoV-2陽性患者におけるサイトカインストームと免疫亢進の潜在的なメカニズム。SARS-CoV-2感染者では、マクロファージが活性化され、これがT細胞、さらなるマクロファージ、好中球を活性化する-。
結論
我々の横断的研究デザインを考慮すると、患者と曝露された対照者の間で観察されたビフィズス菌レベルの違いが、感染に先行するものか後続するものかを決定することは不可能である。もし感染に先行するのであれば、それは感受性のマーカーである可能性があり、ビフィズス菌レベルの増強はSARS-CoV-2感染のリスクまたは重症度を減少させるかもしれない。これらの変化が感染後に生じた場合、ビフィズス菌を増加させるための腸内細菌叢の変化(糞便微生物移植やプロバイオティクス補給など)は、転帰を改善するために調査する価値のある領域である可能性があります。今後の研究で治療成績の改善が確認されれば、「長距離輸送者」や重症患者など、SARS-CoV-2感染の複雑なケースに対して、このような治療法を検討することができるだろう。老人ホームのような閉鎖的なコミュニティでアウトブレイクが発生すれば、感受性を評価するのに適した環境となるであろう。アウトブレイク中に糞便サンプルを採取し、「ケース」と「コントロール」に対して事後的に検査することができる。ベースラインの感染前マイクロバイオームデータを持つ個人を対象とした今後の研究は非常に価値があると思われるが、そのようなベースラインの感染前マイクロバイオームデータを取得するにはまだコストがかかる。
SARS-CoV-2感染発症前の腸内マイクロバイオームに関するデータがないため、疾病がマイクロバイオームに及ぼす交絡効果を完全に排除することはできない。それでも、SARS-CoV-2感染症治療薬の投与前、症状発現後48時間以内にサンプリングを行い、治療による腸内細菌への影響を排除した。具体的には、症状発現またはPCR陽性から採便までの間に、抗生物質、抗ウイルス剤、抗炎症剤、酸素、その他の治療薬を投与された被験者はいない。また、食欲の変化、便の回数の変化、胃腸(GI)症状の有病率は、一般的に、重症度グループと対照群のいずれにも有意差はなかったが(表1)、いくつかのグループのサンプルサイズが小さいことは、これらの統計を評価する際に考慮されるべきであることに留意されたい。
SARS-CoV-2感染症の提示変動は、結腸マイクロバイオームの細菌組成および全体の多様性と相関している。SARS-CoV-2感染によって観察される同じ変化、すなわちビフィドバクテリウムおよび/またはフェーカリバクテリウムの存在量の減少は、高齢、肥満、糖尿病などのSARS-CoV-2感染リスク因子と関連している9 37 39 43 したがって、大腸マイクロバイオームの多様性およびビフィドバクテリウムおよびフェーカリバクテリウムの相対存在量は、SARS-CoV-2感染の重症度を予測できるマーカーとして探究されるべきであると思われる。
要約すると、PCR陽性およびPCR陰性のSARS-CoV-2感染者の研究において、細菌の多様性の低下および様々な属/種のレベルの低下が、SARS-CoV-2陽性およびSARS-CoV-2感染重症度の両方と強く関連していることが証明された。これらの知見は、プロバイオティクスの補充または糞便微生物叢の移植が、SARS-CoV-2患者の潜在的な治療手段として検討されるべきことを示唆するものである。さらに、個々の大腸マイクロバイオームの評価により、重症化しやすいSARS-CoV-2感染症が予測されるかもしれない。最後に、我々のデータは、新たな研究領域を示唆している:SARS-CoV-2の重症度がマイクロバイオームに依存することが判明した場合、マイクロバイオームの違いを考慮することにより、SARS-CoV-2の予後のばらつきを低減できる可能性がある。
謝辞
メディカルライティングの支援は、Sonya Dave, PhD(本書の著者)が行い、ProgenaBiomeの助成を受けた。著者らは、本研究に関与し貢献してくれたすべての臨床医に感謝する。また、Kate Hendricks, MD, MPH, TMの編集上の多くの有益な提案に感謝する。最後に、本論文の著者を含む多くの科学者にマイクロバイオームへの関心を喚起した故Sydney M Finegold, MDの指導に深く感謝する。
脚注
寄稿者 著者全員(SH、NS、HSB、SD、AJP、JD、BDB、EMMQ、TJB)が原稿作成、重要な改訂、最終版の承認に参加した。研究デザインはSHが主導した。SHとAJPはバイオインフォマティクス解析を実施した。SDは統計解析を行い、論文執筆に大きく貢献した。SHは、全著者の貢献のもと、研究結果の解釈について主に責任を負った。EMMQとTJBはシニアオーサーであり、全体的な指示と助言を行った。SHは保証人として、本研究の全責任を負い、すべてのデータにアクセスでき、発表の決定をコントロールした。
資金提供 著者らは、公的、商業的、非営利的ないかなる資金提供機関からも、この研究のために特定の助成を受けることを表明していない。
競合する利益 SHは、COVID-19の予防/治療法の開発を進めているオーストラリアのTopelia Pty Ltdおよび米国のTopelia Pty Ltdと金銭的利害関係があることを宣言している。また、コロナウイルス治療に関連する特許を申請しています。また、マイクロバイオーム研究財団、プロジェナビオーム、ベンチュラ・クリニカル・トライアルの設立者であり、オーナーでもある。TJBは、COVID-19の予防/治療薬を開発しているオーストラリアのTopelia Pty Ltdおよび米国のTopelia Therapeutics Inc.に財政的な利害関係があることを宣言しています。また、COVID-19治療薬に関連する特許を出願している。SDは、McKesson Specialty Health/OntadaおよびNorth End Advisory, LLCと企業提携を結んでいることを表明している。SDはSARS-CoV-2およびマイクロバイオームプロジェクトを知らず、McKessonのCOVID-19関連プロジェクトに直接関与していないが、存在する可能性はある。AJPとBDBは、Progenabiomeと企業提携をしている。EMMQはPrecisionbiotics、Novazymes、Salix、BiocodexおよびAxon Pharmaのコンサルタントを務め、4D Pharmaから研究支援を受けている。
証明と査読。委託されたものではなく、外部専門家による査読を受けています。
補足資料。この内容は、著者から提供されたものです。BMJ Publishing Group Limited (BMJ)の審査は受けておらず、査読を受けていない可能性があります。本コンテンツは、BMJ Publishing Group Limited (BMJ)の審査を受けておらず、査読を受けていない可能性があります。BMJは、コンテンツに依存することから生じるすべての責任および義務を負いません。コンテンツに翻訳物が含まれる場合、BMJは翻訳の正確性と信頼性を保証せず(現地の規制、臨床ガイドライン、用語、薬剤名、薬剤投与量を含むがこれに限らない)、翻訳および翻案から生じるいかなる誤りおよび欠落に対しても責任を負わない。
データの入手に関する声明
データは合理的な要求があれば入手可能である。データは、対応する著者であるDr. Sabine Hazanから入手可能です。
倫理に関する記述
出版に関する患者の同意
該当なし
倫理的承認
本研究は、「ヘルシンキ宣言」、「国際整合化会議 医薬品基準調和三原則」、「倫理・独立審査委員会」の倫理原則に従って実施された。この研究は、ヒトの参加者を含み、「倫理・独立審査委員会」(IRB、IRB00007807)の承認を得ている。参加者は、インフォームドコンセントを得てから研究に参加しました。
記事情報
BMJ Open Gastroenterol. 2022; 9(1): e000871.
オンライン公開 2022 Apr 27. doi: 10.1136/bmjgast-2022-000871
PMCID: PMC9051551
PMID: 35483736
Sabine Hazan,corresponding author1 Neil Stollman,2 Huseyin S Bozkurt,3 Sonya Dave,4,5 Andreas J Papoutsis,1 Jordan Daniels,1 Brad D Barrows,1 Eamonn MM Quigley,6およびThomas J Borody7
1N/A、ProgenaBiome LLC、米国カリフォルニア州ベンチュラ
2消化器内科、アルタベイツ・サミット・メディカルセンター、米国カリフォルニア州バークレー
3トルコ、イスタンブール、イスタンブール・マルテペ大学、消化器科クリニック
4N/A, Microbiome Research, Inc, Ventura, California, USA
5米国ジョージア州スマーナ、ノースエンドアドバイザリー、メディカルライティング&バイオスタティックス
6米国テキサス州ヒューストン、ワイルコーネル医科大学メソジスト病院、消化器・肝臓部門
7N/A、消化器疾患センター、ファイブドック、ニューサウスウェールズ、オーストラリア
corresponding authorCorresponding author.
Dr Sabine Hazan; moc.emoibanegorp@nazaHrD に対応します。
Received 2022 Jan 3; Accepted 2022 Mar 28.
Copyright © Author(s) (or their employer(s)) 2022. CC BY-NCで再利用を許可する。営利目的の再利用は不可。権利と許可をご覧ください。BMJより発行されています。
本論文は、クリエイティブ・コモンズ 表示 非商業的 (CC BY-NC 4.0) ライセンスに従って配布されるオープンアクセス論文であり、原著を適切に引用し、適切なクレジットを与え、変更を示し、使用が非商業的であるという条件で、他の者がこの著作物を非商業的に配布、リミックス、改作、構築し、その派生著作物に異なる条件でライセンスすることを許可しています。参照:http://creativecommons.org/licenses/by-nc/4.0/。
参考文献
De Vuyst L, Moens F, Selak M, et al. サマーミーティング2013:ビフィズス菌の増殖と生理。J Appl Microbiol 2014;116:477-91. 10.1111/jam.12415 [PubMed] [CrossRef] [Google Scholar].
Parameswaran N, Patial S. Tumor necrosis factor-α signaling in macrophage.マクロファージにおける腫瘍壊死因子αのシグナル伝達。Crit Rev Eukaryot Gene Expr 2010;20:87-103. 10.1615/CritRevEukarGeneExpr.v20.i2.10 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 3.
Martins AKS, Martins FS, Gomes DA, et al.(マルティンス・アクス、マルティンス・FS、ゴメス・DA、他)。ビフィドバクテリウム・アニマリス・ヴァーラル・ラクチスの2つのプロバイオティック菌株のin vitro拮抗作用およびin vivo免疫調節と病原実験チャレンジに対する保護作用の評価。Arch Microbiol 2010;192:995-1003. 10.1007/s00203-010-0626-0 [PubMed] [CrossRef] [Google Scholar].
Groeger D, Schiavi E, Grant R, et al. ビフィドバクテリウム・ロンガムの経鼻投与は、マウス致死性インフルエンザ感染モデルにおいて、ウイルス誘発性肺炎および傷害から保護する。EBioMedicine 2020;60:102981. 10.1016/j.ebiom.2020.102981 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Konieczna P, Akdis CA, Quigley EMM, et al.(コニエツナP、アクディスCA、クイグリーEMM、他)。免疫制御性ビフィズス菌の肖像。Gut Microbes 2012;3:261-6. 10.4161/gmic.20358 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Konieczna P, Ferstl R, Ziegler M, et al.・・・。ビフィドバクテリウム・インファンティス35624によるマウス層状膜での免疫調節にはレチノイン酸依存性および独立性のメカニズムが必要である。PLoS One 2013;8:e62617. 10.1371/journal.pone.0062617 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Schiavi E, Plattner S, Rodriguez-Perez N, et al. Bifidobacterium longum subsp. longum 35624™由来のエクソポリサッカライドは、マウスアレルギー性気道反応を調節する。Benef Microbes 2018;9:761-73. 10.3920/BM2017.0180 [PubMed] [CrossRef] [Google Scholar].
Ruiz L, Delgado S, Ruas-Madiedo P, et al.(ルイズ・L、デルガド・S、ルアス・マディエド・P、他). ビフィズス菌とその免疫系との分子コミュニケーション. Front Microbiol 2017;8:2345. 10.3389/fmicb.2017.02345 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Marras L, Caputo M, Bisicchia S, et al.(マラス・L、カプート・M、ビシキア・S、他)。予測・予防医学におけるビフィズス菌の役割:湿疹と高コレステロール血症に着目して.マイクロオーガニズム 2021;9. 10.3390/microorganisms9040836. [Epub ahead of print: 14 04 2021]. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Stavropoulou E, Bezirtzoglou E. Probiotics in medicine: a long debate. Front Immunol 2020;11:2192. 10.3389/fimmu.2020.02192 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Ahlawat S, Sharma KK. SARS-CoV-2感染における腸と肺の免疫学的協調。Virus Res 2020;286:198103. 10.1016/j.virusres.2020.198103 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Follmer C. Viral infection-induced gut dysbiosis, neuroinflammation, and α-synuclein aggregation: Updates and perspectives on COVID-19 and neurodegenerative disorders. ACS Chem Neurosci 2020;11:4012-6. 10.1021/acschemneuro.0c00671 [PubMed] [CrossRef] [Google Scholar].
マーズランドBJ、トロンペットA、ゴルウィッツァーES. 呼吸器疾患におけるGut-Lung軸。Ann Am Thorac Soc 2015;12 Suppl 2:S150-6. 10.1513/AnnalsATS.201503-133AW [PubMed] [CrossRef] [Google Scholar].
Janda L, Mihalčin M, Šťastná M. Is a healthy microbiome responsible for lower mortality in COVID-19? Biologia 2021;76:819-29。10.2478/s11756-020-00614-8 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tiwari SK, Dicks LMT, Popov IV, et al. プロバイオティクスとウイルスとの戦い:絵から何が欠けているのか?Front Microbiol 2020;11:11. 10.3389/fmicb.2020.01877 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ボズクルトHS、クイグリーEM. コロナウイルスの管理におけるプロバイオティクス・ビフィドバクテリウム。理論的根拠。Int J Immunopathol Pharmacol 2020;34:2058738420961304. 10.1177/2058738420961304 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jin X, Lian J-S, Hu J-H, et al. 胃腸症状を呈したコロナウイルス感染症2019(COVID-19)74例の疫学的、臨床的、ウイルス学的特徴。Gut 2020;69:1002-9. 10.1136/gutjnl-2020-320926 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Gu S, Chen Y, Wu Z, et al. コロナウイルス疾患2019またはH1N1インフルエンザ患者における腸内細菌叢の変化。Clin Infect Dis 2020;71:2669-78. 10.1093/cid/ciaa709 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Zuo T, Liu Q, Zhang F, et al. COVID-19患者における腸内細菌叢組成と関連したSARS-CoV-2糞便ウイルス活性の描出。Gut 2021;70:276-84. 10.1136/gutjnl-2020-322294 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Yeoh YK, Zuo T, Lui GC-Y, et al. 腸内細菌叢の組成は、COVID-19患者における疾患の重症度と免疫応答の機能不全を反映している。Gut 2021;70:698-706. 10.1136/gutjnl-2020-323020 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Xu K, Cai H, Shen Y. Management of COVID-19: the Zhejiang experience. Zhejiang Da Xue Xue Bao Yi Xue Ban 2020;49:147-57. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Liu Q, Mak JWY, Su Q, et al.(リウQ、マックJWY、スーQ、他)。急性期後のCOVID-19症候群患者の前向きコホートにおける腸内細菌叢の動態。Gut 2022;71:544-52. 10.1136/gutjnl-2021-325989 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Din AU, Hassan A, Zhu Y, et al. Bifidobacterium bifidum ATCC 29521の大腸炎抑制作用とそのメカニズム. J Nutr Biochem 2020;79:108353. 10.1016/j.jnutbio.2020.108353 [PubMed] [CrossRef] [Google Scholar].
Nitzan O, Elias M, Peretz A, et al. 炎症性腸疾患の治療における抗生物質の役割. World J Gastroenterol 2016;22:1078-87. 10.3748/wjg.v22.i3.1078 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
バルデス-バレラL、エルナンデス-バランコAM、ルアス-マディエドP、ら、。異なるプレバイオティクス基質で共培養した場合のクロストリジウム・ディフィシルの増殖と毒性に対するビフィドバクテリウムの効果(Effect of Bifidobacterium upon Clostridium difficile growth and toxicity in different prebiotic substrates). Front Microbiol 2016;7:738. 10.3389/fmicb.2016.00738 [PMCフリー記事] [PubMed] [Ref] [Google Scholar].
Wei Y, Yang F, Wu Q, et al. トキシジェニック・クロストリジウム・ディフィシルに対するビフィズス菌株の保護効果. Front Microbiol 2018;9:888. 10.3389/fmicb.2018.00888 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Philippe D, Heupel E, Blum-Sperisen S, et al.(フィリップD、ホイペルE、ブルムシュペリセンS、他)。ビフィドバクテリウム・ビフィダム17の投与は、化学的に誘導された大腸炎モデルにおいて、Th1駆動の炎症からマウスを部分的に保護する。Int J Food Microbiol 2011;149:45-9. 10.1016/j.ijfoodmicro.2010.12.020 [PubMed] [CrossRef] [Google Scholar].
各国のバリアントの概要。利用可能: https://covariants.org/per-country
Tao W, Zhang G, Wang X, et al. COVID-19患者における腸内細菌叢の解析と炎症因子IL-18との相関。Med Microecol 2020;5:100023. 10.1016/j.medmic.2020.100023 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
八木澤MFP、花木秀樹、大村聡美:COVID-19におけるイベルメクチンの臨床試験の世界的動向.日本抗生物質学会誌 2021;74:44-94. [Google Scholar].
Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead. Gastroenterology 2014;146:1489–99. 10.1053/j.gastro.2014.02.009 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Negi S, Das DK, Pahari S, et al.,(ネギS、ダスDK、パハリS、他)。自然免疫記憶の誘導と制御における腸内細菌叢の潜在的な役割。Front Immunol 2019;10:2441. 10.3389/fimmu.2019.02441 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Lloyd-Price J, Abu-Ali G, Huttenhower C. The healthy human microbiome.(ロイド・プライスJ、アブ・アリG、ハッテンハワーC)。Genome Med 2016;8:51. 10.1186/s13073-016-0307-y [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Ghouri YA, Richards DM, Rahimi EF, et al.(グーリ・ヤ、リチャーズDM、ラヒミEF)。炎症性腸疾患におけるプロバイオティクス、プレバイオティクス、シンバイオティクスに関する無作為化対照試験の系統的レビュー。Clin Exp Gastroenterol 2014;7:473-87. 10.2147/CEG.S27530 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Hughes KR, Harnisch LC, Alcon-Giner C, et al.・・・。ビフィドバクテリウム・ブレーベは、エクソポリサッカライドおよびMyD88依存的にアポトーシス上皮細胞の脱落を減少させる。Open Biol 2017;7:160155. 10.1098/rsob.160155 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Fanning S, Hall LJ, Cronin M, et al.(ファニング S、ホール LJ、クローニン M、他)。ビフィズス菌表面エキソポリサッカライドは、免疫調節および病原体防御を通じて、常在ホストとの相互作用を促進する。Proc Natl Acad Sci U S A 2012;109:2108-13. 10.1073/pnas.1115621109 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Arboleya S, Watkins C, Stanton C, et al. ヒトの健康と加齢における腸内ビフィズス菌の集団。Front Microbiol 2016;7:1204. 10.3389/fmicb.2016.01204 [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
フェレイラ-ハルダーCV、ファリアAVdeS、アンドラーデSS. Faecalibacterium prausnitziiの健康および疾患における作用と機能。Best Pract Res Clin Gastroenterol 2017;31:643-8. 10.1016/j.bpg.2017.09.011 [PubMed] [CrossRef] [Google Scholar].
Ganesan K, Chung SK, Vanamala J, et al. 食事による腸内細菌叢の変化と糖尿病の因果関係:糖尿病予防におけるFaecalibacterium prausnitziiの移植の新規戦略(Causal relationship between diet-induced gut microbiota changes and diabetes: a novel strategy to transplant Faecalibacterium prausnitzii in preventing diabetes). Int J Mol Sci 2018;19. 10.3390/ijms19123720. [Epub ahead of print: 22 Nov 2018]. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
グリーンMW、ロバーツAP、フリュゲAD. スペインとOECD23カ国における地中海食アドヒアランスとCOVID-19症例および関連死亡の負の関連性:生態学的研究. Front Nutr 2021;8:591964. 10.3389/fnut.2021.591964 [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
Tang L, Yin Z, Hu Y, et al.(タンL、インZ、フーY、他)。COVID-19ではサイトカインストームを制御することが重要である。Front Immunol 2020;11:570993. 10.3389/fimmu.2020.570993 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zhao M. Cytokine storm and immunomodulatory therapy in COVID-19: role of chloroquine and anti-IL-6 monoclonal antibodies. Int J Antimicrob Agents 2020;55:105982. 10.1016/j.ijantimicag.2020.105982 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Biagi E, Nylund L, Candela M, et al. Through ageing, and beyond: gut microbiota and inflammatory status in seniors and centenarians(高齢者と百寿者の腸内細菌叢と炎症状態). PLoS One 2010;5:e10667. 10.1371/journal.pone.0010667 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
米国疾病管理センター. 特定の病状を持つ人々. 利用可能: https://www.cdc.gov/coronavirus/2019-ncov/need-extra-precautions/people-with-medical-conditions.html
あなたの意見を聞かせてください
この記事が気に入ったらサポートをしてみませんか?
