
腸管α-ディフェンシンは食事と比較して小腸内細菌叢組成の調節に微小な役割を果たす
OPEN ACCESS
宿主と微生物の相互作用
研究論文
11 2023年4月
腸管α-ディフェンシンは食事と比較して小腸内細菌叢組成の調節に微小な役割を果たす
https://journals.asm.org/doi/10.1128/spectrum.00567-23#.ZD310eHx22A.twitter
https://journals.asm.org/doi/10.1128/spectrum.00567-23#.ZD310eHx22A.twitter



著者紹介 Fabiola Puértolas-Balint https://orcid.org/0000-0003-4898-5673, Bjoern O. Schroeder https://orcid.org/0000-0002-6716-8284 bjorn.schroder@umu.seAUTHORS INFO & AFFILIATIONS
DOI: https://doi.org/10.1128/spectrum.00567-23
PDF/EPUB
スペクトラム
オンラインファースト
ABSTRACT
イントロダクション
結果
ディスカション
材料と方法
謝辞
補足資料
参考文献
ABSTRACT
腸内細菌叢は、宿主とその環境との接点に位置するため、宿主由来および外部の調節因子に常にさらされている。食事は微生物叢の組成を調節する重要な外部因子と考えられているが、抗菌ペプチドの主要なクラスの一つである腸管ディフェンシンは、腸内細菌コミュニティを形成する重要な宿主エフェクターとして説明されてきた。しかし、食餌性化合物はディフェンシン発現に影響を与え、それによって間接的に腸内細菌叢を調節することができるため、腸内細菌叢の組成を形成する個々の寄与はまだ明らかにされていません。食事、ディフェンシン、小腸内細菌叢の複雑な相互作用を明らかにするため、野生型マウス(WT)およびα-ディフェンシン機能欠損マウス(Mmp7-/-マウス)に、対照食または飽和脂肪と単純炭水化物が豊富で食物繊維が少ない西洋風食事(WSD)を与えた。16S rDNA配列の決定と頑健な統計解析により、細菌組成は食餌に強く影響され、ディフェンシン類の影響は軽微であることが確認されました。これらの知見はサンプルの場所に依存せず、両方の遺伝子型のマウスにおいて、空腸と回腸の内腔と粘膜の間で一貫した結果を示しました。しかし、α-ディフェンシンによって異なる微生物分類も調節され、これは回腸タンパク質抽出物の抗菌活性の違いによって裏付けられた。WSDとディフェンシン欠損の組み合わせはグルコース代謝を悪化させることから、ディフェンシンには小腸内細菌組成を形成する微調整の役割しかなく、むしろ食事誘発性代謝機能障害の発症から宿主を守るために重要である可能性があると結論付けられた。
腸内細菌群集の組成の変化は、多くの疾患と関連している。したがって、恒常的および疾患的な条件下で微生物群集を形成する因子を特定することは、異質な微生物相を修正する戦略の開発に貢献すると考えられる。本研究では、外因的パラメータである欧米型食生活が、内因的パラメータである腸内ディフェンシンよりも小腸細菌組成の形成に強い影響を与えることを明らかにした。これまで、ディフェンシンは幼若マウスにおいて細菌組成を調節することが示されてきたが、本研究では、成熟した微生物群を保有する成体マウスではディフェンシンの重要性が低い可能性を示すことで、これらの知見を補った。しかしながら、我々は、ディフェンシンが成体マウスにおいて、異なる細菌分類群の存在量に影響を与え、食事誘発性グルコース障害の悪化から宿主を保護することを観察した。本研究は、成体マウスの代謝疾患発症における腸管ディフェンシンの役割について、新たな切り口を発見するものである。
はじめに
腸内細菌叢は、宿主の代謝、脳機能、免疫、栄養、発育に影響を与える多様な微生物群から構成されています(1~3)。これらの機能の多くは有益であるが、宿主の上皮に近接する膨大な数の微生物が、腸内感染や炎症のリスクを恒常的にもたらす。その結果、宿主は、腸内の微生物群集を制御し、形成するための部位特異的な防御機構を進化させてきた。このようなメカニズムには、厚い粘液層の存在、免疫グロブリンA(sIgA)の分泌、抗菌ペプチド(AMP)の産生などがあります(4〜7)。
腸管AMPは小さな陽イオン性ペプチドで、細菌膜を透過させたり、凝集して細菌の移動性を制限することにより、細菌が宿主上皮に到達するのを防ぐ(8、9)。マウス腸内で最も多く存在するAMPは、パネス細胞によって産生されるα-ディフェンシン(クリプトジンとも呼ばれる)である(6、10)。マウスはさらに、クリプディン関連配列(CRS)ペプチドと呼ばれる独自のAMPファミリーを産生し、これらはディフェンシンとの配列類似性を持ち、抗菌活性が異なるホモおよびヘテロダイマーを形成する(11)。ディフェンシンやCRSペプチドが活性化するためには、小腸陰窩に放出される前に、マトリックスメタロプロテアーゼ7(Mmp7、マトリライシンとも呼ばれる)によるタンパク質分解処理が必要となる(12、13)。Mmp7によるタンパク質分解の活性化は、ディフェンシン活性の転写後制御であるが、ディフェンシンもまた転写レベルで制御されている。そのため、無菌あるいは抗生物質で処理したマウスモデルを用いることで、AMP発現の完全な誘導には腸内細菌の存在が必要であることが示されており(14、15)、常在する腸内細菌がAMP発現を誘導することが示唆されている。
AMPは、Salmonella typhimuriumやShigella flexneriなどの腸内病原体による致死的な感染から宿主を守るが(13、16)、一般に常在菌に対する抗菌活性がないと考えられている(17、18)。しかし、私たちは、環境条件がディフェンシンの活性スペクトルに影響を与えること、腸に関連する条件下では、常在菌に対するかなりの抗菌活性がin vitroで検出されることを明らかにしてきました(17、19-21)。これらの知見は、機能的なα-ディフェンシンを欠損したマウス(Mmp7-/-欠損マウス)またはヒトα-ディフェンシン5(HD5)の発現をトランスジェニックした2つの補完的なマウスモデルによって裏付けられ、小腸細菌群集の組成はディフェンシンによって調節されていた(22)。しかし、同じMmp7-/-マウスモデルを用いた他の研究では、小腸細菌組成に対するディフェンシンの有意な効果は観察されず(23、24)、腸内細菌叢組成の形成におけるディフェンシンの関連性が疑問視されています。
AMPの他に、食物繊維も腸内細菌叢組成の重要な調節因子である(25)。しかし、現代の食生活は、食物繊維が少なく、糖分や脂肪分が多い食事が多く、この「欧米型食生活」(WSD)の摂取は、潰瘍性大腸炎やクローン病などの炎症性腸疾患(IBD)と関連が指摘されています(26)。回腸クローン病患者ではディフェンシン発現が低下し、潰瘍性大腸炎患者では増加することから(27、28)、AMP発現の変化と食事の組み合わせは、細菌叢の異常を促進する環境を形成し、それによって疾患の進行を助長する可能性があります。
また、WSDは、糖尿病や肥満などの代謝異常の発症に大きく関与しています(29)。興味深いことに、肥満の人はHD5と腸管リゾチームのタンパク質レベルが低下しており、リゾチームレベルは肥満度指数(BMI)と負の相関があります(30)。さらに、いくつかのマウス研究で、WSDの摂取によりAMPの発現が変化し、微生物叢の構成が変化することが観察されていることから(31, 32)、食事もAMPの発現を調節することで間接的に微生物叢を形成している可能性が考えられる。しかし、微生物叢の構成に対するAMPと食事の具体的な寄与は、今のところ不明なままである。
そこで、マウスの微生物叢組成の形成における食事と腸管ディフェンシンの個々の役割を明らかにするために、ディフェンシン欠損Mmp7-/-マウスモデルの使用、WSD介入、強固な統計解析を組み合わせて、小腸の微生物叢組成を解析しました。特に、α-ディフェンシン産生が最も高い小腸の細菌組成を調べ、さらに、WSD食とディフェンシン欠損の組み合わせがマウスの宿主代謝を悪化させるかどうかを評価しました。
結果
食事はディフェンシンよりも小腸内細菌叢の構成に強い影響を与える。
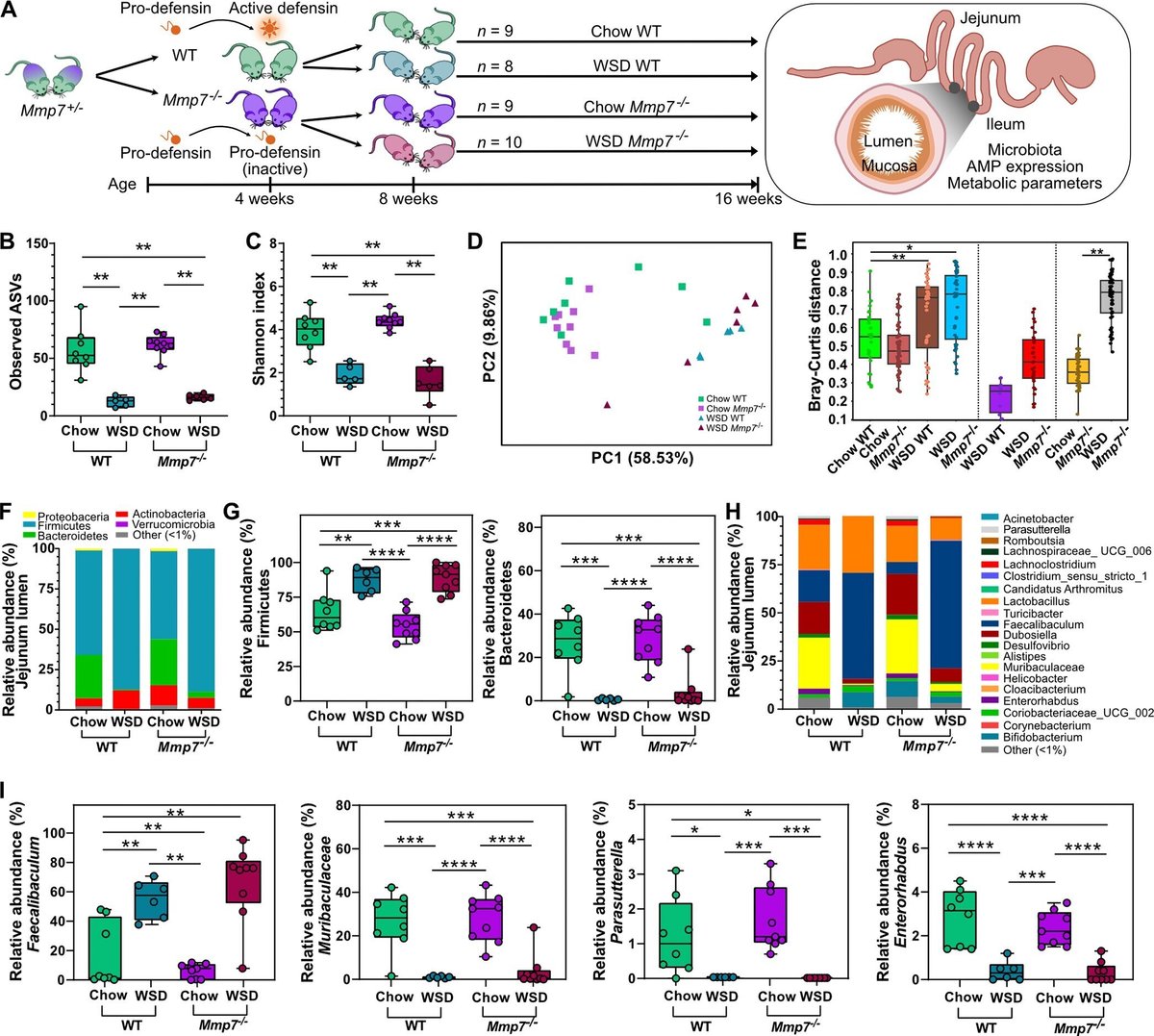
ディフェンシン、食事、微生物叢の複雑な相互依存関係を明らかにするために(33)、野生型(WT)マウスおよびMmp7欠損マウス(補足資料の図S1)にWSDまたは対照のチャウ食を与え(図1A)、空腸および回腸の内腔および粘膜の細菌組成を調査した。
図1
図1 食事は、ディフェンシンよりも空腸の内腔細菌叢組成の強いモジュレーターである。(A) 概略的な実験セットアップ:同腹対照のWTまたはMmp7-/-マウスに、8週間、チャウまたは西洋式食事(WSD)を与えた。(B)観察されたASVと(C)シャノン指数によるα多様性、(D)ブレイ・カーティス非類似度行列と(E)ブレイ・カーティス距離によるβ多様性を空腸内腔で示した。(F)空腸内腔における門の平均相対量と(G)有意に多い門、(H)属の平均相対量と(I)有意に多い属の比較。相対存在量が1%未満の系統または属は "その他(<1%) "として表現した。α-多様性分析にはKruskal-Wallis Pairwise test、β-多様性分析にはPERMANOVA、Bray-Curtis距離にはpairwise PERMANOVA(padjとして表示)、phylaとgeneraにはTukeyの多重比較検定付き二元配置分散分析で計算した統計検定。*, p ≤ 0.05; **, p ≤ 0.01; ***, p ≤ 0.001; ***, < 0.0001.
空腸内腔では、観察されたアンプリコン配列変異体(ASV)の数(P = 0.003, 図1B)およびシャノン多様性指数(P = 0.005, 図1C)を含むα多様性の指標において、2食間で著しく大きな差が認められたが、活性ディフェンシン有無は、chow(P = 0.268; P = 0.210)またはWSD摂食(P = 0.118; P = 0.465 )の間にこれらのα多様性の指標には影響を与えないことが示された。食餌の支配的な効果は、ブレイ・カーティス非類似行列(Padj = 0.004; Padj = 0.003; 図1D、E)および重みなし(Padj = 0.002; Padj = 0.002)を用いたWTおよびMmp7-/-マウスのベータ多様性解析でも確認された。 002;図S2A)または重み付け(Padj=0.002;図S2B)UniFrac距離マトリックスにより、α-ディフェンシンとは無関係に、同じ餌を与えられたマウスグループ間で有意に高い類似性を実証した。しかし、Bray-Curtis非類似度行列では、チョウ飼料給与下での空腸細菌組成に対するディフェンシン類の弱いながらも統計的に有意な役割も確認されたが(P = 0.049, 図1E)、この差異は多重比較補正後に失われた(Padj = 0.058).
空腸における微生物分類群の相対的な存在量を比較すると、WSD給餌では、遺伝子型とは無関係に、門レベルでバクテロイデーテスの存在量が減少し、ファーミキューテスの存在量が増加した(図1F、G)。属レベルでは、WSD摂取によりWTおよびディフェンシン欠損マウスでFaecalibaculumが有意に増加し、Parasutterella、Enterorhabdus、Muribaculaceaeの存在量が両遺伝子型とも減少した(図1H、I)。したがって、食餌と遺伝子型を2つの独立変数として用いた多様性解析と同様に、空腸内腔の微生物量は、食餌によって強く調節されたが、ディフェンシンには調節されなかった(表S1)。ただし、例外として、Actinobacteriaとその属であるBifidobacteriumの存在量は、食事と遺伝子型の相互作用が存在量に有意に影響した(P = 0.011; P = 0.017)(Table S1)。
同様に、回腸内腔において、観察されたASVの数(図2A)およびシャノン指数(図2B)も、WTマウス(P = 0.001; P = 0.001) およびMmp7-/-マウス(P = 0.001; P = 0.007)では食事によって強く影響を受けた。 0007)、しかし、チョウ食(P = 0.267; P = 0.148)でもWSD食(P = 0.330; P = 0.093)でもディフェンシンによる影響はなかったことから、小腸のα多様性にディフェンシンが影響しないことが確認された。さらに、WTマウスとMmp7-/-マウスの両方で、3つの異なるベータ多様性分析の結果、食餌によって有意に異なる微生物クラスターが生じた(Bray-Curtis: Padj = 0.001; Padj = 0.001, 図2C、D;重みなしUniFrac: Padj = 0.003; Padj = 0.002、図S2C;重み付けUniFrac: Padj = 0.001; Padj = 0.001、図S2D)。しかし、空腸の分析を裏付けるように、デフェンシン欠乏は、ブレイ・カーティス非類似度行列を用いた場合(Padj=0.012、図2C、D)、チョウ飼料で摂食するマウスの細菌組成を著しくシフトしたが、非加重または加重UniFrac距離行列を用いた場合(図S2C、D)ではない。
図2
図2 食事は、回腸においてディフェンシンよりも強い管腔細菌叢組成のモジュレーターである。(A)観察されたASVと(B)Shannon指数によるα多様性、(C)Bray-Curtis非類似度行列と(D)Bray-Curtis距離によるβ多様性を回腸内腔で示す。(E)平均的な門の相対的存在量と(F)異なる存在量の門、(G)平均的な属の相対的存在量と(H)異なる存在量の属を回腸内腔で示した。相対的存在量が1%未満の系統または属は "その他(<1%)"として表現した。統計検定は、α-多様性分析にはKruskal-Wallis Pairwise test、β-多様性分析にはPERMANOVA、Bray-Curtis距離にはpairwise PERMANOVA(padjとして表示)、phylaと属にはTukeyの多重比較検定付き二元配置分散分析で計算。, p ≤ 0.05; **, p ≤ 0.01; ***, p ≤ 0.001; ***, p < 0.0001.
空腸の結果と同様に、回腸内腔の分類学的解析でも、どちらの遺伝子型でもWSD摂食下で同様の変化が確認され、ファーミキューテス(図2E、F)とフェカリバクラム(図2G、H)の存在量が増加し、バクテロイデーテスとムリバクラムの存在量は減少しました。活性型ディフェンシンがない場合、WSD飼育マウスでのみCoriobacteriaceae_UCG-002の存在量が増加し(図2H)、食事とディフェンシンの組み合わせがこの分類群の存在量を調節していることが示唆された。回腸の細菌組成に対する食餌の強い影響は、食餌と遺伝子型の影響を二元配置分散分析で比較することで確認された(表S1)。このように、食事は小腸内腔の微生物の多様性と組成に強い影響を与えるが、α-ディフェンシンは小さな役割にとどまる。
腸内細菌叢とAMPの最も近い相互作用は、粘膜表面で直接起こる。そこで、ディフェンシン類が、内腔の細菌と比較して、粘膜に付着した細菌に対してより強い調節的役割を持つかどうかを検証した。しかし、空腸内腔のα多様性と同様に、WTおよびMmp7-/-マウスの空腸粘膜では、食餌のみがASVの観察数(P = 0.017, P = 0.012, 図3A)とShannon diversity indexの減少(P = 0.008, P = 0.012, 図3B)に影響し、ディフェンシン欠損は大きな変化をもたらさなかった。同様に、Bray-Curtis非類似度行列(Padj = 0.003; Padj = 0.012, 図2C、D)および重み付けなし(Padj = 0.010; Padj = 0.010, 図S2E)または重み付け(Padj = 0.006; Padj = 0.006, 図S2F)UniFrac距離行列に従って微生物クラスター形成を支配した食事、活性ディフェンソンの存在または不在はいかなる実質的影響を持っていませんでした。空腸内腔の微生物変化(図1F、G)と同様に、空腸粘膜の分類学的差異は、遺伝子型に依存せず、WSDを摂取したマウスにおいて、堅果類の存在量の増加とバクテロイデーテスの存在量の減少という特徴を示した(図3E、F)。さらに、WSDの摂取により、両遺伝子型ともWTとFaecalibaculumのLactobacillusの存在量が増加し、MuribaculaceaeとParasutterellaの存在量が減少した(図3G、H)。しかし、空腸粘膜の微生物量には食餌が最も大きな影響を与えたが(表S2)、遺伝子型は、二元配置分散分析の変数効果比較で示すように、Actinobacteria、Bifidobacterium、Gastranarophilalesに有意に影響し、この部位でのディフェンシンの個別の影響を示唆した。
図3
図3 食事は、ディフェンシンよりも空腸の粘膜微生物叢組成の強い調節因子である。空腸の粘膜関連細菌(MAB)について観察された、(A)観察されたASVと(B)シャノン指数によるα多様性、および(C)ブレイ・カーティス非類似度行列と(D)ブレイ・カーティス距離による、チョウまたはWSD飼育のWTマウスとMmp7-/-マウス間のβ多様性。(E)空腸MABにおける門の平均相対量と(F)有意に多い門、(G)属の平均相対量と(H)有意に多い属の比較。相対存在量が1%未満の系統または属は "その他(<1%) "として表現した。α-多様性分析にはKruskal-Wallis Pairwise test、β-多様性分析にはPERMANOVA、Bray-Curtis距離にはpairwise PERMANOVA(padjとして表示)、phylaとgeneraにはTukeyの多重比較検定付き二元配置分散分析で統計検定を計算。, p ≤ 0.05; **, p ≤ 0.01; ***, p ≤ 0.001; ****, p < 0.0001; ***, p < 0.0001.
これまでの場所とは対照的に、食餌処理はWTマウスの回腸粘膜で観察されたASVの数(P = 0.008)にのみ影響し、シャノン多様性指数(P = 0.207) (図4A、B)には影響しませんでした。このことから、回腸粘膜の微生物のα多様性は、宿主や環境の調節因子による影響を受けにくく、より弾力的である可能性が示唆された。しかし、WTおよびMmp7-/-マウスの回腸粘膜におけるβ多様性には、食餌が有意に影響した(Bray-Curtis: Padj = 0.001; Padj = 0.001, Fig 4C, D; unweighted UniFrac: Padj = 0.003; Padj = 0.002、図S2G;重み付けUniFrac: 一方、ディフェンシン欠損では、有意なクラスタリングが起こらなかったことから、食事がディフェンシンよりも小腸微生物多様性の強い調節因子であるという我々の前回の結論が裏づけられた。
図4
図4 食事は、ディフェンシンよりも回腸の粘膜微生物叢組成の強い調節因子である。回腸の粘膜関連細菌(MAB)について観察された、(A)観察されたASVと(B)シャノン指数によるα多様性と(C)ブレイ・カーティス非類似度行列と(D)ブレイ・カーティス距離によるβ多様性(WTとMmp7-/-マウスをチョウまたはWSDで飼育した場合)。(E)回腸MABにおける門の平均相対量と(F)有意に多い門、(G)属の平均相対量と(H)有意に多い属の比較。相対存在量が1%未満の系統または属は "その他(<1%) "として表現した。統計検定は、α多様性分析にはKruskal-Wallis Pairwise test、β多様性分析にはPERMANOVA、Bray-Curtis距離にはpairwise PERMANOVA(padjとして表示)、フィラと属にはTukeyの多重比較検定付き二元配置分散分析で計算。, p ≤ 0.05; **, p ≤ 0.01; ***, p ≤ 0.001; ****, p < 0.0001; ***, p < 0.0001.
また、食事は回腸粘膜の系統にも大きな影響を与え(図4E、F)、空腸粘膜で観察されたのと同様の変化が見られた。属レベルで見ると、FaecalibaculumとLactobacillusの存在量は、WSDと比較して、チャウ食マウスの両遺伝子型で低く検出された(図4G、H)。さらに、Muribaculaceae属は、WSDを与えたマウスと比較して、WTおよびMmp7-/-マウスで濃縮されており、強力な粘膜免疫調節因子として知られる分割型糸状菌(SFB)であるCandidatus arthromitusは、WSDを与えたマウスでは存在しなかった(図4H)。空腸と回腸内腔で観察された結果と一致し、飼料は回腸粘膜の選択された分類群の相対存在量にも大きな影響を与えた(表S2)。しかし、変動効果比較では、食事と遺伝子型の交互作用がLachnosclostridium, Marvinbryantia, [Eubacterium]_brachy_group, Lactobacillusの存在量に影響を与えることが確認された(Table S2)。
その結果、WSDは小腸の微生物の多様性と構造に大きな影響を与えるが、ディフェンシンの影響はむしろ控えめであることがわかった。しかし、いくつかの属は、同じ飼料を与えた遺伝子型間で存在量に差があり、ディフェンシン欠乏が空腸と回腸の個々の分類群に個別の影響を与えることが示唆された。
ディフェンシンは、異なる場所で異なる細菌分類を調節する。
食餌は腸内ディフェンシンよりも全体の細菌組成に強い変化をもたらす一方で、遺伝子型間で管腔および粘膜の分類群の存在量に明確な変化も検出された。そこで、直交部分最小二乗判別分析(OPLS-DA)を用いて共分散分析を行い、活性型ディフェンシンの存在によって影響を受ける細菌をより詳細に分離しました。微生物叢の構成に及ぼす食餌の影響が大きいことから、空腸と回腸の両方について、チャウ飼育マウス(図5、図S3)およびWSD飼育マウス(図S4)で別々のOPLS-DAを実施した。
図5
図5 異なる小腸内細菌の存在量はディフェンシンによって調節される。(A) チャウで飼育したWTマウスとMmp7-/-マウスの空腸内腔、空腸粘膜(B)、回腸内腔(C)、回腸粘膜(D)における細菌属の直交部分最小二乗判別分析(OPLS-DA).赤い四角で示した細菌の相対量における統計的に有意な差は、信頼区間が帰無仮説値(0)を含まないときに定義された。
OPLS-DAに基づき、ビフィドバクテリウムは、WTマウスと比較して、Mmp7-/-マウスのチャウ食の空腸内腔および粘膜で有意に濃縮されており(図5A、B)、これは、2遺伝子型間のビフィドバクテリウム存在量の直接比較によって裏付けられた(図 S3A、B)。さらに、Mmp7-/-マウスの空腸粘膜では、Gastranaerophilalesも濃縮されていた(図S3B)。
チャウを与えたマウスの回腸内腔では、共分散(図5C)および相対存在量比較(図S3C)の両方から、WTマウスと比較してディフェンシン欠損マウスではDubosiellaのみが濃縮されていた。回腸粘膜では、Mmp7-/-マウスで濃縮されている細菌の全体数は空腸よりも高く(図5D)、Bifidobacterium、Dubosiella、Lachnoclostridium、Marvinbryantia、 [Eubacterium]_brachy_group, Candidatus saccharimonasおよびLactobacillusで有意だった(図5D、図S3D)。その他、Enterohabdus、Christensenellaceae、Clostridia_UCG_014、Ruminococcus、Lachnospiraceae_UCG-006などの分類群は、OPLS-DAモデルにおいてMmp7-/-マウスで有意に富んでいた(図5D)ものの、相対量を直接比較すると確認することができない。さらに、回腸粘膜で観察された食餌の影響(図4H)とは対照的に、Candidatus arthromitusは、チョウ食下でのディフェンシン欠損に影響を受けなかった(図S3D)。
WSD飼育マウスで同様の細菌組成のOPLS-DAを行ったところ、共分散分析の結果、WTマウスの空腸粘膜だけでなく空腸および回腸内腔で濃縮された単一の属としてLactobacillusが特定されたが、回腸粘膜では認められなかった(図S4AからD)。しかし、これらの知見は、両群間の乳酸菌の相対的な存在量を直接比較した場合には確認されなかった。さらに、WSDを与えたWTマウスの回腸内腔では、Dubosiellaが濃縮されていた(Fig. S4C)。したがって、WSDの摂動は、微生物組成の変化をもたらし、活性型ディフェンシンの欠如は、異なる分類群の相対存在量に大きな追加変化をもたらさないほど強固であった。これらの結果は、小腸内細菌群集の形成において、ディフェンシンよりも食餌が支配的であることをさらに裏付けるものである。さらに、この結果は、通常の食事条件下で回腸粘膜の特定属の存在量を維持するためにディフェンシンが必要である可能性を示唆している。
AMPの発現は、食事と回腸のディフェンシン欠乏症によって調節される。
小腸内細菌組成に対するディフェンシン欠乏の影響が限定的であることに興味を持った我々は、他のAMPの代償的なアップレギュレーションがこの効果を説明できると推論した。そこで、空腸(図6A)と回腸(図7A)において、WSDとディフェンシン欠乏がAMPの発現に与える影響を調べた。AMP転写物の絶対定量を用い、多重比較解析を行ったところ、空腸における試験したAMPの発現には、どのマウス群間でも有意な差は検出されなかった(図6A)。AMP転写物の絶対数を定量化したため、個々の転写物の数を合計することで抗菌力を推定することができた。ディフェンシン機能欠損マウスはWTマウスと同様の発現パターンを示し、両群ともWSD摂食によりAMP発現が増加する傾向が見られた(図6B)。しかし、空腸のAMP発現について主成分分析(PCA)を行ったところ(図6C)、食餌(第1成分)および遺伝子型(第2成分)に基づく明確な分離は検出されなかった。したがって、空腸のAMP発現は、ディフェンシン機能の欠如によって大きな影響を受けず、WSDによってわずかな影響を受けるだけであった。さらに、この解析により、ディフェンシンの欠如は、Reg3g、Pla2A2、またはP-もしくはM-lysozymeなどの他の宿主防御分子の空腸でのアップレギュレーションにつながらないことが判明した。
図6
図6 WSD摂食またはディフェンシン欠乏は、空腸のAMP発現に軽微な影響を及ぼす。(A)空腸における宿主防御分子Defa1、Defa21/22、P-Lysozyme(P-Lys)、CRS1C、Reg3g、およびPla2a2の発現量。(B)異なるマウスグループの空腸で測定されたすべてのAMP転写物の総和。(C) 異なるマウス群の空腸におけるAMP発現の主成分分析(PCA)。統計的有意性は、二元配置分散分析により決定し、, P ≤ 0.05; **, P ≤ 0.01; **, P ≤ 0.001 とした。
図7
図7 食事は回腸におけるAMP発現の実質的なドライバーである。(A)回腸における宿主防御分子Defa1、Defa21/22、P-Lysozyme(P-Lys)、CRS1C、Reg3g、Pla2a2の発現を示す。(B)異なるマウスグループの回腸で測定されたすべてのAMP転写物の総和。(C)異なるマウスグループの回腸におけるAMP発現の主成分分析(PCA)。(D)ラジアル拡散アッセイ(RDA)を用いた、Bifidobacterium longum、Bacteroides thetaiotaomicron、Escherichia coliおよびLactobacillus reuteriに対する回腸タンパク質抽出物の抗菌活性。統計的有意性は、二元配置分散分析により、, P ≤ 0.05; **, P ≤ 0.01; **, P ≤ 0.001で決定した。LOI, limit of inhibition.
しかし,空腸とは対照的に,WSDを与えたMmp7-/-マウスでは,Reg3gやPla2A2ではなく,Defa1,Defa21/22,P-Lys,CRS1Cの回腸での発現が,チョウ飼料を与えたマウスと比較して著しく高く(図7A),WTマウスではこれらのパネス細胞産物の発現増加傾向のみが観察された.回腸における転写物の絶対コピー数を合計すると、Mmp7-/-マウスでは、AMPの発現が全体的に減少し、チャウを与えたマウスに比べて約43%減少した(Fig. 7B)。さらに、WSD処理により、AMPの発現量は、WTマウスでは約52%、ディフェンシン欠損マウスでは約152%増加した(対応するチョウ飼料群に比べ)。したがって、回腸のAMP発現のPCAは、食餌(第1成分)とディフェンシン欠損(第2成分)に基づく強いクラスタリングを示し(図7C)、回腸のAMP発現に食餌と遺伝子型の両方が影響していることが確認された。
AMPの発現量が多いからといって、必ずしも抗菌活性が高いとは限らないため、次に、処理したマウスの回腸タンパク質抽出物を用いて、選択した常在腸内細菌に対する抗菌活性を試験した。WSD摂取により発現量が増加したことと一致し、WSD摂取WTマウスではB. longumに対する抗菌活性が増加した(図7D)。しかし、Mmp7-/-抽出物では活性の上昇は認められず、発現量が増加しても不活性なディフェンシンがB. longumの殺傷力を高めることにはつながらないことが確認された。これらの結果は、遺伝子型、食餌、食餌と遺伝子型の相互作用のすべてがB. longumに対する活性に影響を与えるという変数効果比較試験によってさらに裏付けられた(表S3)。
以前の研究(17)と一致して、Bacteroides thetaiotaomicron(B.テタイオタオミクロン)は宿主の産生するAMPに対してかなり抵抗性があり、全体的に低い活性で示されたが、活性型ディフェンシン不在の場合はさらに低下した(図7D)。注目すべきは、B. longumに対する活性とは対照的に、WSDの摂取によりAMPの発現が増加しても、WTマウスの抗菌活性が高くなることはなかったことで、食事による抗菌活性の調節は、異なる微生物分類群に対して特異的であることが示唆された。このことは、大腸菌およびL. reuteriに対する抗菌活性を調べたところ、WSDの摂取による抗菌活性の上昇は見られなかったことから、食餌による抗菌活性の調節は、微生物群によって異なることが示唆されました。同様に、ディフェンシン非存在下では、抗菌活性が低下する傾向が見られたが、統計的有意差には至らなかった(図7D)。しかし、変数効果比較試験を行ったところ、遺伝子型のみがB. thetaiotaomicron、大腸菌およびL. reuteriに対する活性に有意な影響を与えた(表S3)。
WSD給餌後またはディフェンシン非存在下で、選択された常在菌に対する抗菌活性が変化したことは、粘膜の微生物負荷に影響を与える可能性がある。しかし、空腸や回腸の粘膜や内腔における細菌の総16Sコピー数は、WTとMmp7-/-、あるいは2つの食餌の間で差がなかった(図S5)。これは、ディフェンシン欠乏が回腸の細菌数全体に影響を与えないことを示した以前の研究(22)と一致する。以上のことから、食事とディフェンシン欠損の両方が回腸のAMP発現を調節し、その結果、個々の細菌株で異なる抗菌活性パターンを示すことがわかった。
ディフェンシン欠乏症とWSDの組み合わせは、グルコース代謝を悪化させる。
WSDの摂取は、微生物相に依存した肥満や代謝性疾患の発症と関連しており(36、37)、潜在的には、細菌の代謝物や無傷の細菌が腸管粘膜バリアを通過することに起因している(38、39)。AMPは粘膜での細菌との密接な接触から宿主を保護するため、我々はディフェンシン欠損がWSD摂食によって誘発される代謝障害を悪化させるかどうかを検証した。8週間のWSD飼育後、マウスはチョウ飼料を与えたマウスと比較して、体重(図8A)、体脂肪(図8B)、インスリンレベル(図8C)の増加を示した。これらの増加は遺伝子型に依存せず、ディフェンシン欠損群でより強い影響が観察された。しかし、空腹時血糖値(図8D)およびインスリン抵抗性の恒常性モデル評価(HOMA-IR)値(図8E)は、WSDを与えたMmp7-/-マウスでのみ有意に高く、ディフェンシン欠損とWSD摂食の組み合わせはグルコース代謝を悪化させることが示された(表S4)。これらの知見は、さらに経口ブドウ糖負荷試験(OGTT)により裏付けられ、WSD飼育のMmp7-/-マウスでは耐糖能異常の傾向(図8F)およびインスリン値の上昇(図8G)が示された。このように、ディフェンシン欠損は、対照食を与えた場合には代謝障害を引き起こすには十分ではないが、高カロリーのWSDとの組み合わせでは、代謝パラメータ、特にグルコース代謝が悪化することがわかった。
図8
図8 WSDとディフェンシン欠損の組み合わせは糖代謝を悪化させる。ディフェンシン欠損Mmp7-/-マウスおよびWTマウスに8週間、チャウまたはWSDを与え、その後、(A)体重、(B)体脂肪、(C)空腹時血中インスリン濃度、(D)空腹時血糖濃度、(E)インスリン抵抗性に関する恒常性モデル評価(HOMA-IR)を測定した。犠牲となる2日前に経口ブドウ糖負荷試験(OGTT)を行い、(F)血糖値および(G)インスリン濃度、それぞれの曲線下面積(AUC)を測定した。統計的有意性は、二元配置分散分析により、, P ≤ 0.05; **, P ≤ 0.01; ***, P ≤ 0.001で決定されました。
考察
宿主に関連した環境における微生物相の構成は、さまざまな内在的・外在的なパラメータによって形成されるものである。消化管には、構造的な構造と生理的な機能が異なるいくつかのニッチが存在し、それによってpH、栄養の有無、抗菌薬の有無、酸素濃度が変化する(40)。我々は、空腸と回腸の内腔と粘膜の細菌組成に寄与する因子を明らかにした。このことは、大腸の腸内細菌叢の組成においても、食事が最も強力な調節因子であるとする無数の研究(25、41、42)と一致する。
1980年代、Rolf Freterは栄養ニッチ仮説の中で、微生物が腸内環境に定着する能力は、特定のニッチで利用できる限られた栄養を最も効率的に利用する能力に大きく依存することを明らかにした(43、44)。食物繊維は多くの常在細菌にとって重要な栄養源であり、その結果、WSDの摂取によって内腔にそれらが存在しなくなると、一般的な常在細菌は代わりに炭水化物に富んだ粘液層に移動することになる。さらに、繊維を専門とする常在菌の存在も減少し、その結果、WSDは管腔と粘膜の両方の環境において群集の変化を引き起こすことになる(45)。しかし、Freterのニッチ仮説を拡張すると、食事は基質を提供するだけでなく、生態学的ニッチに直接影響を与えることによって、微生物群集を調節することができる。例えば、我々は最近、空腸小腸粘液が粘膜微生物相にニッチを提供し、それが腸内病原体Citrobacter rodentiumに対するコロニー形成抵抗性を媒介することを示した(46)。重要なことは、WSDの摂取により空腸粘液層の構造と完全性が変化し、常在細菌叢にニッチを提供する能力が失われ、その結果、C. rodentiumによるこのニッチの非定型コロニー形成につながった。したがって、食餌組成と栄養素の利用可能性は、どの微生物が異なる腸内ニッチにコロニー形成し、腸内細菌叢の常在菌となるかを決める重要な要因である。
食事の他に、ディフェンシンは2つの相補的なマウスモデルにおいて小腸の微生物叢の組成を調節することが報告されている(47)。その画期的な研究では、内在するディフェンシンレパートリーに加えてヒトαディフェンシンHD5を発現する5週齢のトランスジェニックマウスは、回腸においてバクテロイデーテスの相対存在量が増加し、堅果類の存在量が減少していた。逆に、若齢のディフェンシン欠損Mmp7-/-マウスでは、Firmicutesが増加し、Bacteroidetesが減少していた(22)。マウスの腸内細菌組成は6週齢以降に安定化するとされており(48)、Salzmanら(22)が述べたように、この生後数週間の小腸細菌組成の形成にディフェンシンが不可欠である可能性がある。しかし、16週齢のマウスを用いた本研究では、Mmp7-/-マウスの小腸において、菌種や属の組成に大きな変化は認められず(22)、同じディフェンシン欠損マウスモデルを用いた先行研究(23、24)と一致した。
年齢差に加えて、内在する腸内細菌叢の組成が、群集の乱れに対する感受性や回復力を決定する可能性がある。そのため、Salzmanら(22)は、我々や他の2つの研究(23、49)とは異なる動物提供者からマウスを入手した。異なる業者から入手したマウスは異なる微生物群集を示すので(35、50)、異なるベースライン微生物相がディフェンシン機能の障害、特に群集が成熟した後に異なる反応を示す可能性がある。最後に、SalzmanらがApplied Biosystemsのキャピラリーシーケンサーで16Sサブクローンシーケンスを行ったのに対し、我々はIllumina MiSeqマシンでV4領域の全16Sシーケンスを行い、最新の参照データベースを用いてアンプリコンを解析した。2010年以降、微生物データベースは継続的に改良され、いくつかの分類が再グループ化されているため、参照データベースの変更も相反する結果に寄与している可能性があります。残念ながら、先行研究のオリジナルサンプルがないため、今回の結果を先行文献の結果と直接比較することは不可能です。ディフェンシンの有無による結果の違いが、技術的なものなのか、生物学的なものなのかを明確にするためには、地理的に異なる場所で、同じ方法論でさらに研究を行う必要がある。しかし、Mastroianni らは、Mmp7-/- マウスにおいて、ヒトおよび細菌のプロテアーゼによる大腸でのディフェンシン活性化の新たなメカニズムを同定している(49)ことに留意すべきである。しかし、この代替活性化は小腸でのディフェンシン成熟に影響を与えず、結腸に限定された。したがって、Mmp7-/-マウスの小腸ではなく、結腸の細菌組成が似ていることが説明される(49)。
門レベルで大きな変化は見られなかったが、空腸と回腸内腔のBray-Curtis距離解析において、チャウ食のWTマウスとMmp7-/-マウスが別々にクラスター化し、チャウ食のMmp7-/-マウスの回腸粘膜でいくつかの属が濃縮されていることがわかった。粘膜におけるこれらの属の存在量の増加は、通常の条件下ではディフェンシンがこれらの微生物を殺すことを示唆している。この解釈は、宿主防御分子Reg3gに関する以前の解析(51)で、Reg3g-/-マウスの回腸粘膜にSFBが豊富に存在したことと一致する。さらに、高脂肪食とReg3gが微生物叢の構成に与える影響を評価した最近の研究では、食事が微生物叢をより強く調節する因子であることが確認されている(52)。一方、このマウスモデルでは、Reg3gがない場合でも、PCA分析に基づいて、チョウ食を与えると細菌のクラスタリングに差が生じることが確認されている。
ディフェンシン欠損マウスの解析では、回腸内腔および粘膜にDubosiellaが多く存在することがわかった。Dubosiellaは、Erysipelotrichaceaeに属するグラム陽性桿菌で、マウスの腸管内腔から初めて分離された(53)。最近、AMPリポカリン-2を欠損し、高脂肪食を12週間与えたマウスは、糞便中のDubosiellaの濃度が高くなることが示された(54)。著者らは、Dubosiellaが肥満に関連した微生物異常症において有害な役割を果たす可能性を示唆したが(54)、他の研究では、総脂肪量や腸管免疫を有益に調節するプロバイオティクス候補であることが示唆された(55、56)。これは、食餌源の違い(高脂肪とWSD)、食餌介入の期間の違い、またはリポカリン-2とディフェンシン群の抗菌活性の違いによって説明できるかもしれない。しかし、Dubosiella、抗菌ペプチド、および代謝表現型の間の関連性は、さらに調査する必要がある。
AMPの転写物を測定したところ、WSDを与えたマウスでは、空腸と回腸において、チョウを与えたマウスと比較して、総AMPの発現量が高いことが確認された。この結果はいくつかの先行研究(57, 58)で支持されているが、他の研究(31, 59)とも矛盾しており、この矛盾を説明するいくつかの側面がある。第一に、AMPの発現制御はまだ完全に解明されておらず、発生過程(60)、mTOR栄養感知経路(61)、リポポリサッカライド(LPS)(24)、短鎖脂肪酸(SCFA)(31、62)を介し、概日周期(52)に影響されているようです。第二に、マウスモデルの年齢、性別、同腹子のマッチングに関する記述は、しばしば文献に報告されておらず、研究を直接比較することが困難である。第三に、異なる動物施設に固有の微生物相は、さらに、どの微生物が食事介入に反応し、結果としてAMP発現に影響を与えるかに影響する。実際、最近の研究では、マウスの小腸Reg3g発現と正の相関を示した3つの異なる分類群のうち、Lactobacillus rhamnosus LGGが生産する代謝物のみが小腸腸管のReg3g発現を誘導できることがわかった(52)。したがって、AMP発現の制御は複雑であり、本試験および他の試験でWSD摂取後に観察されたAMP発現の増加には、異なる微生物因子が寄与している可能性がある。
活性型ディフェンシンを欠損し、WSDを摂取したマウスは、WTマウスと比較して代謝パラメータが低下していた。高脂肪食は、粘膜バリアを介した細菌の移動を増加させ、マウス(38、63-66)および潜在的にヒトでも内毒素血症による肥満関連炎症につながることが示されている(67、68)。さらに、WSD摂取によるAMP発現の増加に関する我々の知見と同様に、Guoらは、マウスに高脂肪食を与えると、いくつかのAMPの発現が全体的に増加し、炎症および小胞体ストレスが増加することを観察した(57)。AMPの発現量の増加は、血漿中のLPSや炎症性メディエーターと正の相関があり(57)、このことから、この発現量の増加は、細菌の移動から保護するための代償機構として生じることが示唆された。このことは、Myd88-/-マウスを用いた研究で、粘膜の抗菌ペプチド反応に欠陥があり、常在菌と病原性細菌の両方の腸内移行が増加したことから、さらに支持されている(15)。本研究では腸内細菌の透過性を測定していないが、WSD飼育のMmp7-/-マウスは、WTおよびchow飼育のマウスと比較して、細菌の移動が増加している可能性がある。その結果、活性型ディフェンシンの不在が、WSDによって誘発された小腸のディスバイオシスと細菌トランスロケーションを悪化させ、代謝障害に寄与した可能性がある。
注目すべきは、Mmp7が大腸炎モデルマウスの大腸でタイトジャンクションタンパク質claudin-7を分解し、細菌の移動を増加させることが最近明らかになったことである(69)。このような場合、Mmp7の欠如はむしろ保護的であるため、大腸におけるMmp7の除去がバリア機能の低下や細菌の移動の増加に関与しているとは考えにくい。さらに、細胞外マトリックスの分解に関与するマトリックスメタロプロテアーゼファミリーのメンバーとして、Mmp7の機能は、組織修復(70、71)、好中球の経上皮流入(72)、尿毒症時の血小板活性化(73)に関連していることが分かっている。したがって、観察された代謝異常において、Mmp7の不在がもたらす可能性のある腸への影響を完全に排除することはできない。しかし、対照食を与えたMmp7-/-マウスでは代謝異常は観察されず、代謝異常はディフェンシン欠乏とWSDの摂取の組み合わせでのみ起こることが強調された。
結論として、我々の結果は、食事が小腸内細菌組成の主要な調節因子であり、腸内ディフェンシンはむしろ小さな役割を果たすことを一貫して示している。しかし、AMPの保護機能は、代謝障害の発症を抑える活発な粘膜防御に貢献するWSDの摂取や、α-ディフェンシンがBacteroides属の回復と粘膜コロニー形成をサポートすることが示された抗生物質介入(23)など、ディスバイオシス誘発性の課題に直面した場合に、より関連性が高くなる。しかし、細菌組成に対するディフェンシンの効果はWSDに匹敵するものではなかったが、我々は、ディフェンシンが小腸粘膜における組成を微調整することを示し、腸内微生物群集の複雑な空間制御を強調している。
材料と方法
マウスの場合
マウスは、12時間の明暗サイクルを持つ特定病原体フリー(SPF)条件下で最大5匹/ケージで同居させ、水と餌に無制限にアクセスさせた。すべてのマウス実験は、スウェーデンのヨーテボリ大学によって承認された。雄のMmp7欠損マウス(B6.129-Mmp7tm1Lmm/J;MMP7-/-)は、もともとJackson Laboratory, USAから購入し、自社飼育の野生型(WT)雌C57BL/6マウスと交差させた。生成されたヘテロ接合体産駒を使用して、Mmp7-/-動物および対応する野生型同腹子を作出した。Mmp7の状態は遺伝子型判定で確認し、離乳後は共食いによる微生物群の交換を防ぐため、遺伝子型ごとにマウスを分けた。8週齢になると、WTおよびMmp7-/-マウスは、洋食(TD.96132 Envigo)に切り替えるか、またはコントロールチャウ食(5021 LabDiet)のままさらに8週間飼育した。マウスはイソフルオランで麻酔した後、頸椎脱臼により犠牲にした。
DNA抽出と16S rRNA配列決定ライブラリーの作成。
小腸(SI)を解剖し、8等分し、近位部から遠位部まで番号を付けた。5番目のセグメントは空腸を表し、8番目のセグメントは回腸を表すと考えられている。解剖後、組織片は直ちに液体窒素でスナップ凍結した。粘膜組織および腸管内腔内容物からゲノムDNAを、先に述べたように、溶解バッファー(4%[wt/vol] SDS、50 mM Tris HCl pH 8、500 mM NaCl、50 mM EDTA)およびLysing Matrix E(MPBio)付き Fast-Prep Systemを用いてビーズビートを繰り返し、抽出した (74).
抽出・精製したDNAは、Illumina MiSeqマシンで16S rRNA配列決定のためのライブラリー調製に使用した。簡単に言うと、16S rRNA遺伝子のV4領域を、デュアルインデックス用に設計された515Fおよび806Rプライマーを用いて増幅し(75)、アンプリコンをMiSeqマシンでV2キット(2×250 bpペアエンドリード)を用いて配列決定した。増幅は、各サンプルに対応する各アンプリコンのノンテンプレートコントロールで純度を制御した。内腔内容物サンプルは二重に増幅し、粘膜関連細菌(MAB)組織サンプルは、100 ngのゲノムDNA、1×Five Prime Hot Master Mix(Quantabio)、各プライマーの最終0.2 μM、0.4 mg/mL Bovine serum albumin(BSA)および5% DMSO(内腔)または0.8 mg/mL BSAおよび10% DMSO(MAB)を含む25 μLの反応容量で三重に増幅された。PCR増幅は以下のように行った:94℃で3分間の初期変性、94℃で45秒間の変性、52℃で60秒間のアニーリング、72℃で90秒間の伸長、72℃で10分間の最終伸長ステップを25サイクル(lumenサンプル)または26サイクル(MABサンプル)。PCR産物をNucleoSpin Gel and PCR Clean-Up kit (Macherey-Nagel) を用いて精製し、定量し (Quant-iT PicoGreen dsDNA kit; Thermo Fisher Scientific) 、等モルの量にプールした。プールした16Sアンプリコンを、Mag-Bind磁気精製ビーズ(Omega Biotek)を用いてさらに精製してから、Illumina MiSeqシステムでの配列決定後にイルミナV2カートリッジにロードするためのライブラリーを変性させた。
16S rRNAシーケンスの解析。
生成されたfastqファイルは、Qiime2(v.2019.10)を用いて処理した(76)。アダプター配列をトリミングし、デマルチプレックスし、品質フィルターをかけた後、DADA2(77)を用いてノイズ除去を行った。SILVA v138-515f-806r分類器(78)を用いて分類学を割り当て、アンプリコンシーケンスバリアント(ASV)を生成した。さらに、ミトコンドリアと葉緑体を除去するためにデータをフィルタリングし、特定のLactococcus lactis ASVはWSDペレットの汚染物質として知られているため除去した(79)。配列の系統樹はMAFFT software v.7.407 (80)で作成し、低存在量配列(相対存在量<0.002%)は除去した。Αα多様性(観察ASV、Shannon index)およびβ多様性(Bray-Curtis距離、重み付けなしUniFrac、重み付けUniFrac)は希薄化後に行った(空腸内腔2,390リード、5サンプル除外;回腸内腔5,600リード、2サンプル除外;空腸MAB 1,900 、6サンプル除外;回腸MAB 2,000 、4サンプル除外). 門・属レベルの相対存在量とα・β多様性解析は、Prism 9.3.1 (GraphPad Software, Inc.)でプロットした。
RNA抽出とcDNA生成。
犠牲の直後に、マウスの空腸と回腸から小さな生検標本を採取し、液体窒素でスナップ凍結し、-800℃で保存した。RNA抽出のため、組織をTissueLyser II(Qiagen)でステンレスビーズ(5mm)(Qiagen)を用いてホモジナイズし、RNeasy minikit(Qiagen)を用いてRNA抽出を行った。RNAの量と質はNanoDrop(Thermo Fisher Scientific)により評価した。合計500 ngのRNAをHigh-Capacity cDNA Reverse Transcription kit(Thermo Fisher Scientific)を用いてcDNAに逆転写し、ヌクレアーゼフリー水で1:7に希釈した。
RT-qPCRによる転写物の定量化。
マウスcDNAを、遺伝子特異的プライマー(表1)(60)およびHotStarTaq Master Mixキット(Qiagen)を用いて増幅した。アンプリコンをpGEM-Tベクター(Promega)にクローニングし、One Shot MAX Efficiency DH10B T1細胞(Invitrogen)に形質転換した。プラスミドを単離し(Qiagen Plasmid minikit)、配列決定(Eurofins Genomics, Ebersberg, Germany)、定量し、10系列で希釈した。腸管および回腸サンプルは、1×iQ SYBR Green Supermix(Bio-Rad)、各プライマー0.2μM、およびテンプレートcDNA 2μLからなる10μL反応ミックスで、CFX Connect Real-Time System(Bio-Rad)上で分析された。標準曲線を作成し、Bio-Rad CFX maestroソフトウェアを使用して各サンプルの転写物コピー数を算出し、コピー数/10 ng RNAとして報告した。
表1
表1 本研究で使用したプライマー配列とqPCRに使用したアニーリング温度
名称製品名プライマー配列アニーリング温度参考αディフェンシン1ファミリーDefa1Fwd (5′-3′)TCAAGAGGCTGCAAAGGAAGAAC63℃60Rvs (5′-) 3′)TGTCTCCATGTTCAGCGACAGCAαディフェンシン21/22Defa21/22Fwd (5′-3′)CCAGGGAAGATGACCAGGCTG63℃60Rvs (5′-3′)TGCAGCGACGATTTCTACAAAGGCCryptdin related sequence (CRS) peptides
グループ1CCRS1CFd (5′-3′)CACCACCCAAGCTCCAAATACAG68℃60Rvs (5′-3′)ATCGTGAGGACCAAAAGCAAATGReg IIIγReg3gFwd (5′-3′)CCTCAGGACATCTTGTCTGTGCTC68℃60Rvs (5′-) 3′)TCCACCTCTGTTGGTTCATAGCCパネス細胞特異的リゾチームP-リゾチームFwd(5′-3′)GCCAAGGTCTACAATCGTTGAGTTG66℃60Rvs (5′-3′)CAGTCAGCCAGCTTGACCACGM マイロイド依存性リゾチームM-リゾチームFwd (5′- 3′)GGCTGGCTACTATGGAGTCAGCCTG65℃60Rvs(5′-3′)GCATTCACAGCTTGGGTTGSecretory phospholipase A2sPLA2aFwd (5′-) 3′)AGGATTCCCAAGGATGCCAC68℃60Rvs (5′-3′)CAGCCGTTTCTGACAGGAGTTCTGGM Matrix metalloproteinase 7Mmp7Fwd (5′-. 3′)TTCAAGAGGGTTAGTTGGGGACTG65℃60Rvs(5′-3′)TTGTCAAAGTGAGCATCTCCGCC16S rDNATotal細菌Eub338F(5′-3′)ACTCCTACGGAGGCAGCAG60℃81Eub518R(5′-3′)ATTACCGCGCTGCTGG
直交部分最小二乗法による判別分析。
直交部分最小二乗判別分析(OPLS-DA、Simca 16.0 [Sartorius Stedim Data Analytics, Sweden]で実行)を適用して、2つの食事または2つの遺伝子型間の個々の細菌分類群の存在量の差異を特定した。
モデル化の前に、直交変動を効果的に除去し、予測変動のみをモデルに残すために、フィルタリングステップを実行した。負荷ベクトルは、WT群とMmp7-/-群を最も大きく弁別する多変量空間における方向と等しく、WT群とMmp7-/-群の違いを解釈するのに適したものであった。正のローディングはMmp7-/-サンプルと正の相関があり、対応する分類群はこのグループでより高い存在度を示していた。ローディング値が大きいほど、モデルへの影響が大きいことを示し、その結果、異なる分類群について、WTとMmp7-/-の差がより顕著になった。OPLS-DAにおいて有意に制御された細菌は、信頼区間が帰無仮説値(0)を含まない場合に検出されました。
腸管タンパク質の抽出。
回腸生検標本を抽出バッファー(60%アセトニトリル、1%トリフルオロ酢酸)と混合し、Tissue Lyser II(Qiagen)でステンレス鋼ビーズ(5mm、Qiagen)を用いて25Hzで30秒間破砕した。同じプログラムを20分ごとに2時間繰り返し、破砕サイクルの間は組織を4℃に保った。サンプルを18,000rcf(相対遠心力)で4℃、20分間遠心分離し、SpeedVacで低温乾燥した。得られた腸管タンパク質粉末を0.01%酢酸に懸濁し、Pierce BCA protein assay kit(ThermoFisher)を用いて、製造者のプロトコールに従ってタンパク質濃度を測定した。
ラジアルディフュージョンアッセイ
Escherichia coli DSM 301、Lactobacillus reuteri DSM 20016、Bifidobacterium longum NCC 2705(Nestec)、Bacteroides thetaiotaomicron DSM 2079をTrypticase soy broth(TSB)30g/L(BD);De Man, Rogosa, and Sharpe(MRS)51g/L(Sigma-Aldrich);強化クロストリジウム(RCM) 37. 5g/L(VWR);および酵母エキス5g/L、ヘミン0.5mg/L、NaHCO3 0.2g/L、システイン1g/L(BHI-S)をそれぞれ補充した脳心筋梗塞を37℃にて投与した。大腸菌とL. reuteriは好気的に、B. longumとB. thetaiotaomicronは嫌気的条件下(0% O2、5% CO2、10% H2、85% N2)、嫌気チャンバー(Don Whitley Scientific, UK)で指数相になるまで培養された。その後,細菌を洗浄し,滅菌した氷冷10mMリン酸ナトリウム緩衝液(pH7.4)に再懸濁し,約1×107CFUを0.1%EEO-Agarose(Sigma),0.1%TSB,MRS,RCMまたはBHI-Sブロス,pH7.4に調整した10mMリン酸ナトリウム緩衝液からなるぬるい下層ゲルの10 mLに加え,空のシャーレの上に注ぎ入れた.ゲルが固化した後、寒天に直径2mmの穴を開け、1-μg/μLの腸管ペプチド抽出液4μLを穴の中に加えた。下敷きゲルを3時間インキュベートし、腸管エキスをゲル内に拡散させた。3時間のインキュベーション後、3% TSB、MRS、RCM、BHI-Sブロス粉末、0.1% EEO-Agarose(Sigma)、pH7.4に調整した10mMリン酸ナトリウムバッファからなるオーバーレイゲルを10mL、アンダーレイゲルの上に添加した。このゲルを好気性または嫌気性条件下で37℃、24時間培養した後、各抽出物の阻害帯の直径を測定した。抗菌活性は阻害面積で表し、阻害の二乗半径にπを乗じて算出した。実験は各菌について二重に実施した。
RT-qPCRによる総菌数の定量化。
大腸菌DSM301の16S遺伝子アンプリコンを含む特注プラスミドを用いて、絶対的な細菌の16S遺伝子コピー数を定量化した。16S遺伝子は、LB寒天中で増殖した大腸菌のコロニーから、10μL HotStartTaqマスターミックス(Qiagen)を含む反応混合物、0. 2 μMユニバーサルプライマー(Eub338FおよびEub518R、表1)、および100 ngのテンプレートDNAを含む最終20 μL反応容量で、以下のPCRプログラム:95℃での変性5分間、94℃での変性30秒間、55℃でのアニール30秒間、72℃での延長60秒間および72℃での延長10分間の35サイクルを行った。アンプリコンをE.Z.N.A Cycle Pure kit(Omega)で精製し、pGEM-T vector(Promega)にクローニングし、大腸菌DHα electrocompetent cellにトランスフォームした。プラスミドをPlasmid minikit(Qiagen)で分離し、塩基配列を決定し(Eurofins Genomics, Ebersberg, Germany)、16S遺伝子コピーに基づく標準曲線を作成した。
マウスサンプル中の16S遺伝子コピー数は、CFX Connect Real-Time System(Bio-Rad)上での16S rRNA遺伝子の増幅により決定した。反応ミックスは、1×SYBR Green Master Mix(Bio-Rad)、0.2μMユニバーサルプライマーEub338FおよびEub518R、および2ngのDNAテンプレートからなり、以下のRT-qPCRプログラム:95℃で3分間の変性、続いて95℃で15秒間変性、60℃で30秒間アニール、72℃で30秒間延長の35サイクルを行った。各サンプル中の絶対的な細菌16Sコピー数は、特注プラスミドで作成した10倍連続希釈の標準曲線を用いて定量した。
代謝の測定
マウスを4時間絶食させ、尾静脈全血中のグルコース濃度を市販の血糖値ストリップ(Contour Next、Bayer)を用いて測定した。血清中のインスリン濃度は、Ultra Sensitive Mouse Insulin ELISA kit (Crystal Chem)により測定した。体脂肪は、全身磁気共鳴画像法(EchoMRI、Echo Medical Systems)により測定した。恒常性モデル評価インスリン抵抗性指数(HOMA-IR)は、HOMA-IR = (insulin (mU/L) * glucose (mM))/22.5 という式で求めた。経口ブドウ糖負荷試験(OGTT)は、絶食させたマウスにブドウ糖溶液(2mg/g体重)をガバメントすることにより行った。0、15、30、60、90、120分後に尾静脈から血液を採取し、血糖値およびインスリン濃度を上記のように測定した。
統計解析。
2群以上のノンパラメトリックデータの比較には、Prism 9.3.1 (GraphPad Software, Inc.)を用いて二元配置分散分析試験を行った。グラフ中のエラーバーは標準偏差を表す。図1G、I;2F、H;3F、H;4F、H;7D;および8A〜Gでは、独立変数である食餌、遺伝子型、またはそれらの相互作用が対応する従属変数に対して説明する分散の割合を決定するために二元配置分散分析試験を行い、表S1〜S4に要約し、Tukeyの多重比較検定に従いました。微生物多様性解析における統計的群間差は、α多様性解析についてはペアワイズ・クラスカル・ワリス検定で、β多様性解析については999通りの並べ替えによる順列分散分析(PERMANOVA)検定で検定した。
データの入手
アンプリコン配列は、European Nucleotide Archive (https://www.ebi.ac.uk/ena/) にアクセッション番号PRJEB59609で寄託されています。
謝辞
動物実験を行うためのスペースとリソースを提供してくれたFredrik Bäckhed、経口ブドウ糖負荷試験を手伝ってくれたAnna Hallén、動物飼育をしてくれたZakarias GulicとCaroline Wennberg(いずれもスウェーデン、ヨーテボリ大学)に感謝します。さらに、David Nilsson (Computational Analytics support platform, Umeå University)とVishnu Prasoodananのバイオインフォマティクス解析への協力、Paul Asare, Lotte Zandbergen, Karin van der Walの技術支援(すべてUmeå University)にも感謝します。Bacteroides thetaiotaomicron株はDavid Cisneros(ウメオ大学)から、Bifidobacterium longum株はNestec(ネスレ・リサーチセンター、スイス)から親切に提供された。
本研究は、スウェーデン研究評議会(Vetenskapsrådet, VR Starting grant [number 2018-02095] to B.O.S. and VR grant number 2021-06602 to MIMS)、Human Frontier Science Program Long-Term Fellowship (LT000109/2014-L) およびUmeå UniversityのBasic Science-Oriented Biotechnology Research grantにより支援を受けた。
補足資料
File (spectrum.00567-23-s0001.pdf)
DOWNLOAD
1.32 MB
ASMは、論文にリンクされている、あるいは論文を通じてアクセスできる補足資料の著作権を所有しません。著者はASMに対して、Supplemental Materialファイルを公開するための非独占的かつ世界的なライセンスを付与しています。再利用する場合は、対応する著者に直接連絡してください。
参考文献
1.
Schroeder BO, Bäckhed F. 2016. 生理学と疾患における腸内細菌叢から遠くの臓器へのシグナル。Nat Med 22:1079-1089.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
グーグルシュラー
2.
Sommer F, Bäckhed F. 2013. 腸内細菌叢-宿主の発生と生理の支配者。Nat Rev Microbiol 11:227-238.
クロスレフ
パブコメ
符号間干渉
グーグルシュラー
3.
Zheng D, Liwinski T, Elinav E. 2020年。健康と病気における微生物叢と免疫の相互作用。Cell Res 30:492-506.
クロスレフ
パブコメ
符号間干渉
グーグルシュラー
4.
Pabst O、Slack E. 2020年。IgAと腸内細菌叢:特異的であることの重要性。Mucosal Immunol 13:12-21.
クロスレフ
パブコメ
Google Scholar
5.
Allaire JM, Crowley SM, Law HT, Chang S-Y, Ko H-J, Vallance BA. 2018. 腸管上皮:粘膜免疫の中心的調整役。Trends Immunol 39:677-696.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
6.
ベビンズCL、サルツマンNH. 2011. パネス細胞、抗菌ペプチド、腸のホメオスタシスの維持。Nat Rev Microbiol 9:356-368.
クロスレビュー
パブコメ
符号間干渉
Google Scholar
7.
シュローダー BO. 2019. Fight them or feed them: How the intestinal mucus layer manages the gut microbiota. Gastroenterol Rep (Oxf) 7:3-12.
クロスレフ
パブコメ
符号間干渉
Google Scholar
8.
Mukherjee S, Zheng H, Derebe M, Callenberg K, Partch CL, Rollins D, Propheter DC, Rizo J, Grabe M, Jiang Q-X, Hooper LV. 2014. 孔を形成する腸管C型レクチンによる抗菌性膜攻撃。ネイチャー505:103-107.
クロスレフ
パブコメ
符号間干渉
Google Scholar
9.
ムカルジー・S、フーパー・LV. 2015. 腸の抗菌防御。Immunity 42:28-39.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
10.
Gulati AS, Shanahan MT, Arthur JC, Grossniklaus E, von Furstenberg RJ, Kreuk L, Henning SJ, Jobin C, Sartor RB. 2012. マウス背景系統はパネス細胞機能と腸内微生物組成に深く影響する。PLoS One 7:e32403.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
11.
Hornef MW, Pütsep K, Karlsson J, Refai E, Andersson M. 2004. 共有結合の二量体形成による腸内抗菌ペプチドの多様性の増大。Nat Immunol 5:836-843.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
12.
綾部哲也、Satchell DP、Pesendorfer P、Tanabe H、Wilson CL、Hagen SJ、Ouellette AJ. 2002. マウス小腸におけるパネス細胞α-ディフェンシンの活性化。J Biol Chem 277:5219-5228.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
13.
ウィルソンCL、オイエルレットAJ、サッチェルDP、アヤベT、ロペス-ボアドYS、ストラットマンJL、ハルトグレンSJ、マトリシアンLM、パークスWC。1999. 自然宿主防御におけるメタロプロテアーゼ・マトリライシンによる腸管α-ディフェンシン活性化の制御(Regulation of intestinal alpha-defensin activation by the metalloproteinase matrilysin in innate host defense). Science 286:113-117.
クロスレフ
パブコメ
符号間干渉
Google Scholar
14.
Reikvam DH, Erofeev A, Sandvik A, Grcic V, Jahnsen FL, Gaustad P, McCoy KD, Macpherson AJ, Meza-Zepeda LA, Johansen F-E. 2011. マウス腸内細菌叢の枯渇:腸粘膜と上皮の遺伝子発現への影響。PLoS One 6:e17996.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
15.
Vaishnava S, Behrendt CL, Ismail AS, Eckmann L, Hooper LV. 2008. パネス細胞は腸内常在菌を直接感知し、腸内宿主-微生物界面のホメオスタシスを維持する。Proc Natl Acad Sci USA 105:20858-20863.
クロスレビュー
パブコメ
符号間干渉
Google Scholar
16.
Shim D-H, Ryu S, Kweon M-N. 2010. Defensins play a crucial role in protecting mice against oral Shigella flexneri infection. Biochem Biophys Res Commun 401:554-560.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
17.
カレンTW、スコフィールドWB、バリーNA、パットナムEE、ランデルEA、トレントMS、デグナンPH、ブースCJ、ユーH、グッドマンAL.2015. Antimicrobial peptide resistance mediates resilience of prominent gut commensals during inflammation. Science 347:170-175.
クロスレフ
パブコメ
符号間干渉
Google Scholar
18.
増田和彦、酒井直樹、中村和彦、吉岡聖恵、綾部哲也、2011.マウスα-ディフェンシンcryptdin-4の殺菌活性は、非共通性細菌に優位に作用する。J Innate Immun 3:315-326.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
19.
マストロヤンニ JR、ルー W、セルステッド ME、オイエルレット AJ. 2014. 嫌気性条件下におけるマウスパネス細胞αディフェンシンに対する細菌の感受性の違い。Antibiot Basel Switz 3:493-508.
引用文献へ移動する
パブコメ
Google Scholar
20.
Schroeder BO, Ehmann D, Precht JC, Castillo PA, Küchler R, Berger J, Schaller M, Stange EF, Wehkamp J. 2015年. パネス細胞α-ディフェンシン6(HD-6)は、抗菌ペプチドである。Mucosal Immunol 8:661-671.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
21.
Schroeder BO, Wu Z, Nuding S, Groscurth S, Marcinowski M, Beisner J, Buchner J, Schaller M, Stange EF, Wehkamp J. 2011. ジスルフィド結合の還元により、ヒトβ-ディフェンシン1の強力な抗菌活性が明らかになった。 Nature 469:419-423.
引用文献へ
クロスリファレンス
パブコメ
符号間干渉
グーグルシュラー
22.
Salzman NH, Hung K, Haribhai D, Chu H, Karlsson-Sjöberg J, Amir E, Teggatz P, Barman M, Hayward M, Eastwood D, Stoel M, Zhou Y, Sodergren E, Weinstock GM, Bevins CL, Williams CB, Bos NA. 2010. 腸管ディフェンシンは、腸内微生物の生態系を制御する必須因子である。Nat Immunol 11:76-82.
クロスレフ
パブコメ
符号間干渉
グーグルシュラー
23.
Ou J, Liang S, Guo X-K, Hu X. 2020. α-ディフェンシンは粘膜リザーバー上のバクテロイデスのコロニー形成を促進し、抗生物質誘発性ディスバイオシスを予防する。Front Immunol 11:2065.
クロスレフ
パブコメ
Google Scholar
24.
Vandenbroucke RE, Vanlaere I, Van Hauwermeiren F, Van Wonterghem E, Wilson C, Libert C. 2014. 急性炎症におけるマトリックスメタロプロテアーゼ7の炎症促進作用(Pro-inflammatory effects of matrix metalloproteinase 7 in acute inflammation). Mucosal Immunol 7:579-588.
クロスレフ
パブコメ
Google Scholar
25.
Makki K, Deehan EC, Walter J, Bäckhed F. 2018. 宿主の健康と病気における食物繊維の腸内細菌叢への影響。Cell Host Microbe 23:705-715.
クロスレフ
パブコメ
符号間干渉
Google Scholar
26.
Ananthakrishnan AN. 2015. IBDの疫学とリスクファクター。Nat Rev Gastroenterol Hepatol 12:205-217.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
27.
Nonnecke EB, Castillo PA, Johansson MEV, Hollox EJ, Shen B, Lönnerdal B, Bevins CL. 2022. Human intelectin-2 (ITLN2)は分泌性パネス細胞で選択的に発現している。FASEB J 36:e22200.
引用文献に移動する
クロスリファレンス
パブコメ
Google Scholar
28.
Wehkamp J, Harder J, Weichenthal M, Mueller O, Herrlinger KR, Fellermann K, Schroeder JM, Stange EF. 2003. クローン病と潰瘍性大腸炎では、誘導性β-ディフェンシンと構成性β-ディフェンシンが異なって発現している。Inflamm Bowel Dis 9:215-223.
引用文献に移動する
クロスリファレンス
パブコメ
Google Scholar
29.
Christ A, Lauterbach M, Latz E. 2019. 西洋の食事と免疫システム:炎症性のつながり。Immunity 51:794-811.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
30.
Hodin CM, Verdam FJ, Grootjans J, Rensen SS, Verheyen FK, Dejong CHC, Buurman WA, Greve JW, Lenaerts K. 2011. パネス細胞抗菌タンパク質レベルの低下は、肥満者の腸内におけるunfolded protein responseの活性化と相関している。J Pathol 225:276-284.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
31.
バイスナーJ、フィリペ・ロサL、カデン=ヴォリネッツV、シュトルザーI、ギュンターC、ビショフSC. 2021. プレバイオティクスであるイヌリンと酪酸ナトリウムは、抗菌ペプチドの誘導により、肥満による腸管バリア機能不全を減衰させる。Front Immunol 12:678360.
クロスレフ
パブコメ
Google Scholar
32.
Everard A, Lazarevic V, Gaïa N, Johansson M, Ståhlman M, Backhed F, Delzenne NM, Schrenzel J, François P, Cani PD. 2014. プレバイオティクスを投与したマウスのマイクロバイオームから、肥満時の宿主反応に関わる新規ターゲットが明らかになった。ISME J 8:2116-2130.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
33.
Puértolas-Balint F, Schroeder BO. 2020. 1日1個のリンゴは微生物も遠ざけるのか?腸管粘膜バリアにおける食事、微生物叢、宿主防御ペプチドの相互作用。Front Immunol 11:1164.
引用文献に移動する
クロスリファレンス
パブコメ
Google Scholar
34.
Ivanov II, Frutos R de L, Manel N, Yoshinaga K, Rifkin DB, Sartor RB, Finlay BB, Littman DR. 2008. 小腸粘膜におけるIL-17産生T-ヘルパー細胞の分化は、特異的な微生物相に指令される。Cell Host Microbe 4:337-349.
引用文献へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
35.
Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, Wei D, Goldfarb KC, Santee CA, Lynch SV, Tanoue T, Imaoka A, Itoh K, Takeda K, Umesaki Y, Honda K, Littman DR. 2009. 分節化した糸状菌による腸管Th17細胞の誘導。Cell 139:485-498.
クロスレフ
パブコメ
符号間干渉
Google Scholar
36.
Ding S, Lund PK. 2011. 肥満とインスリン抵抗性の初期イベントとしての腸内炎症の役割。Curr Opin Clin Nutr Metab Care 14:328-333.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
37.
Musso G, Gambino R, Cassader M. 2011. 肥満と糖尿病の素因となる腸内細菌叢と宿主代謝の相互作用。Annu Rev Med 62:361-380.
引用文献に移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
38.
Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti J-F, Gibson GR, Casteilla L, Delzenne NM, Alessi MC, Burcelin R. 2007. 代謝性内毒素血症は、肥満とインスリン抵抗性を引き起こす。Diabetes 56:1761-1772.
クロスレビュー
パブコメ
符号間干渉
Google Scholar
39.
Burcelin R, Serino M, Chabo C, Garidou L, Pomié C, Courtney M, Amar J, Bouloumié A. 2013年。メタゲノムと代謝:組織微生物叢仮説。Diabetes Obes Metab 15(Suppl 3):61-70.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
40.
Pereira FC, Berry D. 2017. 腸内の微生物栄養ニッチ。Environ Microbiol 19:1366-1378.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
41.
Tomova A, Bukovsky I, Rembert E, Yonas W, Alwarith J, Barnard ND, Kahleova H. 2019年. ベジタリアンとビーガンの食事が腸内細菌叢に及ぼす影響。Front Nutr 6:47.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
42.
Singh RK, Chang H-W, Yan D, Lee KM, Ucmak D, Wong K, Abrouk M, Farahnik B, Nakamura M, Zhu TH, Bhutani T, Liao W. 2017年. 食事が腸内細菌叢に与える影響とヒトの健康への影響。J Transl Med 15:73.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
43.
Freter R, Brickner H, Botney M, Cleven D, Aranki A. 1983. マウス大腸内細菌叢の連続流培養モデルにおける細菌集団を制御するメカニズム。Infect Immun 39:676-685.
引用文献へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
44.
フレターR、ブリックナーH、フェケテJ、ヴィッカーマンMM、キャリーKE.1983. Escherichia coliの腸管における生存と着床。Infect Immun 39:686-703.
引用文献へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
45.
Desai MS, Seekatz AM, Koropatkin NM, Kamada N, Hickey CA, Wolter M, Pudlo NA, Kitamoto S, Terrapon N, Muller A, Young VB, Henrissat B, Wilmes P, Stappenbeck TS, Núñez G, Martens EC. 2016. 食物繊維を欠乏させた腸内細菌叢は、大腸粘液バリアを劣化させ、病原体感受性を高める。Cell 167:1339-1353.e21.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
46.
Birchenough GMH, Schroeder BO, Sharba S, Arike L, Recktenwald CV, Puértolas-Balint F, Subramani MV, Hansson KT, Yilmaz B, Lindén SK, Bäckhed F, Hansson GC. 2023. 空腸粘液層のMuc2依存的な微生物コロニー形成は、食事に敏感で、腸内病原体感染に対する局所抵抗性を付与する。Cell Rep 42:112084.
引用文献に移動する
クロスリファレンス
パブコメ
Google Scholar
47.
ベビンズCL、サルツマンNH. 2011. The potter's wheel: the host's role in sculpting its microbiota. Cell Mol Life Sci 68:3675-3685.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
48.
Li X, Ren Y, Zhang J, Ouyang C, Wang C, Lu F, Yin Y. 2022. 抗生物質存在下での早生消化管微生物群の発達は、マウスのDSS誘発急性大腸炎の重症度を変化させる。Microbiol Spectr 10:e02692-21.
引用文献に移動する
クロスリファレンス
パブコメ
Google Scholar
49.
Mastroianni JR, Costales JK, Zaksheske J, Selsted ME, Salzman NH, Ouellette AJ. 2012. パネス細胞αディフェンシンの代替的な内腔活性化メカニズム。J Biol Chem 287:11205-11212.
クロスレフ
パブコメ
Google Scholar
50.
Caruso R, Ono M, Bunker ME, Núñez G, Inohara N. 2019年. 実験用マウスの同居後の微生物群集の動的かつ非対称的な変化. セルレップ27:3401-3412.e3.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
51.
Vaishnava S, Yamamoto M, Severson KM, Ruhn KA, Yu X, Koren O, Ley R, Wakeland EK, Hooper LV. 2011. 抗菌レクチンRegIIIγは、腸内における微生物と宿主の空間的分離を促進する。Science 334:255-258.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
52.
Frazier K, Kambal A, Zale EA, Pierre JF, Hubert N, Miyoshi S, Miyoshi J, Ringus DL, Harris D, Yang K, Carroll K, Hermanson JB, Chlystek JS, Overmyer KA, Cham CM, Musch MW, Coon JJ, Chang EB, Leone VA. 2022. 高脂肪食はREG3γと腸内細菌のリズムを乱し、代謝機能不全を促進する。Cell Host Microbe 30:809-823.e6.
クロスレフ
パブコメ
Google Scholar
53.
Cox LM, Sohn J, Tyrrell KL, Citron DM, Lawson PA, Patel NB, Iizumi T, Perez-Perez GI, Goldstein EJC, Blaser MJ. 2017. ネズミの腸から得られたErysipelotrichaceae科の2つの新規メンバー:Ileibacterium valens gen., nov.とDubosiella newyorkensis gen., nov.の記述、およびFaecalibaculum rodentiumの記述へのemendation。Int J Syst Evol Microbiol 67:1247-1254.
引用文献へ
クロスリファレンス
パブコメ
Google Scholar
54.
Qiu X, Macchietto MG, Liu X, Lu Y, Ma Y, Guo H, Saqui-Salces M, Bernlohr DA, Chen C, Shen S, Chen X. 2021. 高脂肪食誘発性肥満における抗菌ペプチド・リポカリン2によって制御される腸内細菌叢と微生物代謝産物の同定。Int J Obes 45:143-154. 2005.
クロスレビュー
Google Scholar
55.
コックスLM、ブレイザーMJ。2018年5月号 代謝及び免疫を改善するためのプロバイオティクス組成物。米国特許 US20180125900A1.
引用文献に移動する
Google Scholar
56.
Rodríguez-Daza M-C, Roquim M, Dudonné S, Pilon G, Levy E, Marette A, Roy D, Desjardins Y. 2020年。ベリーポリフェノールと繊維は、肥満マウスにおいて、異なる微生物の代謝機能と腸内細菌叢の腸型様クラスタリングを調節する。Front Microbiol 11:2032.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
57.
Guo X, Tang R, Yang S, Lu Y, Luo J, Liu Z. 2018. ルチンおよびイヌリンとの併用は、高脂肪食で誘発された肥満マウスのパネス細胞における腸内細菌異常、炎症状態および小胞体ストレスを減衰させる。Front Microbiol 9:2651.
クロスレフ
パブコメ
Google Scholar
58.
Andres SF, Santoro MA, Mah AT, Keku JA, Bortvedt AE, Blue RE, Lund PK. 2015. Deletion of intestinal epithelial insulin receptor will attenuates high-fat diet-induced elevations in cholesterol and stem, enteroendocrine, and Paneth cell mRNAs. Am J Physiol Gastrointest Liver Physiol 308:G100-G111.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
59.
Tomas J, Mulet C, Saffarian A, Cavin J-B, Ducroc R, Regnault B, Kun Tan C, Duszka K, Burcelin R, Wahli W, Sansonetti PJ, Pédron T. 2016年. 高脂肪食は、マウス小腸の微生物および生理的生態系の崩壊をもたらすPPAR-γ経路を修正する。Proc Natl Acad Sci USA 113:E5934-E5943.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
60.
Karlsson J, Pütsep K, Chu H, Kays RJ, Bevins CL, Andersson M. 2008. マウス腸管に沿ったパネス細胞抗菌ペプチド発現の地域差。BMC Immunol 9:37.
クロスレフ
パブコメ
符号間干渉
Google Scholar
61.
Liang S, Guo X-K, Ou J, Huang R, Xue Q, Zhang B, Chung Y, Wu W, Dong C, Yang X, Hu X. 2019年. 腸管上皮による栄養センシングは、Hes1の翻訳制御を介して粘膜抗菌防御をオーケストレートする。Cell Host Microbe 25:706-718.e7.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
62.
Schauber J, Svanholm C, Termén S, Iffland K, Menzel T, Scheppach W, Melcher R, Agerberth B, Lührs H, Gudmundsson GH. 2003. カテリシジンLL-37の発現は、結腸細胞の短鎖脂肪酸によって調節される:シグナル伝達経路の関連性。Gut 52:735-741.
引用文献へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
63.
カニPD、デルゼンヌNM. 2007. エネルギーと代謝のホメオスタシスのターゲットとしての腸内細菌叢。Curr Opin Clin Nutr Metab Care 10:729-734.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
64.
Amar J, Burcelin R, Ruidavets JB, Cani PD, Fauvel J, Alessi MC, Chamontin B, Ferriéres J. 2008. 見かけ上健康な男性において、エネルギー摂取量は内毒素血症と関連している。Am J Clin Nutr 87:1219-1223.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
65.
Al-Attas OS, Al-Daghri NM, Al-Rubeaan K, da Silva NF, Sabico SL, Kumar S, McTernan PG, Harte AL. 2009. 抗糖尿病治療中のT2DM被験者におけるエンドトキシンレベルの変化。Cardiovasc Diabetol 8:20.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
66.
Pussinen PJ, Havulinna AS, Lehto M, Sundvall J, Salomaa V. 2011. 内毒素血症は、糖尿病の発症リスクの上昇と関連している。Diabetes Care 34:392-397.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
67.
Gummesson A, Carlsson LMS, Storlien LH, Bäckhed F, Lundin P, Löfgren L, Stenlöf K, Lam YY, Fagerberg B, Carlsson B. 2011年. 腸管透過性は健康な女性の内臓脂肪率に関連している。Obes Silver Spring Md 19:2280-2282.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
68.
Chassaing B, Raja SM, Lewis JD, Srinivasan S, Gewirtz AT. 2017. 大腸内細菌叢の侵食は、ヒトの血糖値異常と相関している。Cell Mol Gastroenterol Hepatol 4:205-221.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
69.
Xiao Y, Lian H, Zhong XS, Krishnachaitanya SS, Cong Y, Dashwood RH, Savidge TC, Powell DW, Liu X, Li Q. 2022年。マトリックスメタロプロテアーゼ7は、タイトジャンクションタンパク質クローディン-7を分解することで腸管バリア機能障害に寄与している。Front Immunol 13:1020902.
引用文献に移動する
クロスリファレンス
グーグルシュラー
70.
Fu H, Zhou D, Zhu H, Liao J, Lin L, Hong X, Hou FF, Liu Y. 2019年。マトリックスメタロプロテアーゼ-7は、生存と再生のために腎尿細管をプライミングすることにより、急性腎障害から保護します。Kidney Int 95:1167-1180.
引用文献へ移動する
クロスリファレンス
パブコメ
グーグルシュラー
71.
ギル SE、パークス WC. 2008. Metalloproteinases and their inhibitors: regulators of wound healing. Int J Biochem Cell Biol 40:1334-1347.
引用文献へ移動
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
72.
Swee M, Wilson CL, Wang Y, McGuire JK, Parks WC. 2008. マトリックスメタロプロテアーゼ-7(マトリライシン)は、ケモカイン勾配を生成することにより好中球の退出を制御する。J Leukoc Biol 83:1404-1412.
引用文献へ
クロスリファレンス
パブコメ
Google Scholar
73.
ヤン・Y、マー・L、ワン・C、ソン・M、リー・C、チェン・M、ズー・J、メイ・C.2020. 血小板活性化マクロファージにおけるマトリックスメタロプロテアーゼ-7は、尿毒症マウスの心臓リモデリングを説明する。Basic Res Cardiol 115:30.
引用元へ
クロスリファレンス
パブコメ
Google Scholar
74.
Salonen A, Nikkilä J, Jalanka-Tuovinen J, Immonen O, Rajilić-Stojanović M, Kekkonen RA, Palva A, de Vos WM. 2010. 系統樹マイクロアレイによる糞便DNA抽出法の比較分析:機械的細胞溶解を用いた細菌および古細菌DNAの効果的な回収。J Microbiol Methods 81:127-134.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
75.
Kozich JJ, Westcott SL, Baxter NT, Highlander SK, Schloss PD. 2013. MiSeq Illuminaシーケンスプラットフォームにおけるアンプリコン配列データ解析のためのデュアルインデックスシーケンス戦略およびキュレーションパイプラインの開発。Appl Environ Microbiol 79:5112-5120.
引用文献に移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
76.
Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA, Alexander H, Alm EJ, Arumugam M, Asnicar F, Bai Y, Bisanz JE, Bittinger K, Brejnrod A, Brislawn CJ, Brown CT, Callahan BJ, Caraballo-Rodríguez AM, Chase J, Cope EK, Da Silva R, Diener C, Dorrestein PC, Douglas GM、 Durall DM, Duvallet C, Edwardson CF, Ernst M, Estaki M, Fouquier J, Gauglitz JM, Gibbons SM, Gibson DL, Gonzalez A, Gorlick K, Guo J, Hillmann B, Holmes S, Holste H, Huttenhower C, Huttley GA, Janssen S, Jarmusch AK, Jiang L, Kaehler BD, Kang KB, Keefe CR, Keim P, Kelley ST, Knights D, et al. 2019. QIIME 2を用いた再現性、インタラクティブ性、スケーラブル性、拡張性のあるマイクロバイオームデータサイエンス Nat Biotechnol 37:852-857.
引用文献へ移動する
クロスリファレンス
パブコメ
Google Scholar
77.
キャラハン BJ、マクマーディ PJ、ローゼン MJ、ハン AW、ジョンソン AJA、ホームズ SP. 2016. DADA2:イルミナのアンプリコンデータからの高解像度サンプル推論。Nat Methods 13:581-583.
引用文献に移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
78.
Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P, Peplies J, Glöckner FO. 2013. SILVAリボソームRNA遺伝子データベースプロジェクト:データ処理とウェブベースツールの改善。Nucleic Acids Res 41:D590-D596.
引用文献に移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
79.
Bisanz JE, Upadhyay V, Turnbaugh JA, Ly K, Turnbaugh PJ. 2019. メタアナリシスにより、高脂肪食に反応して再現性のある腸内細菌叢の変化が明らかになった。Cell Host Microbe 26:265-272.e4.
引用文献へ移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
80.
Katoh K, Standley DM. 2013. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Mol Biol Evol 30:772-780.
引用文献に移動する
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
81.
Guo X, Xia X, Tang R, Zhou J, Zhao H, Wang K. 2008. 糞便中のFirmicutesとBacteroidetesのリアルタイムPCR法の開発と、肥満豚と痩せ豚の腸内集団の定量化への応用。Lett Appl Microbiol 47:367-373.
引用元へ
クロスリファレンス
パブコメ
符号間干渉
Google Scholar
全文を見るPDFをダウンロードする
ジャーナル(JOURNALS
抗菌剤と化学療法
応用・環境微生物学
臨床免疫学・ワクチン免疫学
臨床微生物学レビュー
エコサルプラス
真核細胞
感染と免疫
ジャーナル・オブ・バクテリオロジー
ジャーナル・オブ・クリニカル・マイクロバイオロジー
微生物学・生物学教育ジャーナル
ジャーナル・オブ・ヴァイロロジー
mBio
微生物学と分子生物学のレビュー
マイクロバイオロジー・リソース・アナウンスメント
マイクロバイオロジースペクトラム
分子生物学・細胞生物学
エムスフェア
エムズシステムズ
リソース
会社概要
著者センター
パーミッション
Spectrum Reviewing Editors
ASMジャーナルコレクション
出版倫理
マイグレーション情報
広告
ASMメンバーシップ
個人情報保護方針
ご利用条件
所有権に関する注意事項
非商用TDMライセンス
STAY CONNECTED
アラート
RSSフィード
お問い合わせ
ASMコミュニティ
ニュース
プレスリリース
ポリシーステートメント
Copyright © 2023 American Society for Microbiology (アメリカ微生物学会)
この記事が気に入ったらサポートをしてみませんか?
