食餌性乳化剤の摂取はNODマウスにおける1型糖尿病の発症を促進する
本文へスキップ
バイオフィルムとマイクロバイオーム
検索
ログイン
コンテンツ
について
掲載
記事
PDFダウンロード
記事
オープンアクセス
掲載:2024年1月6日
食餌性乳化剤の摂取はNODマウスにおける1型糖尿病の発症を促進する
https://www.nature.com/articles/s41522-023-00475-4

クララ・デラロック & ブノワ・シャサング
バイオフィルムとマイクロバイオーム第10巻、論文番号:1(2024) この記事を引用する
164 アクセス
3 Altmetric
指標詳細
要旨
1型糖尿病(T1D)の有病率が急速に増加していることから、T1D発症の環境(すなわち非遺伝的)決定因子の役割が強調されている。そのような因子には、工業化された食事や、それらが相互作用する腸内細菌叢が含まれる。腸内細菌叢に有害な影響を与える工業化食の構成要素のひとつに食事性乳化剤があり、これは腸内細菌叢を擾乱して宿主を侵食し、慢性的な低悪性度腸炎とメタボリックシンドロームを促進する。そこで我々は、カルボキシメチルセルロース(CMC)とポリソルベート-80(P80)という2種類の食餌性乳化剤が、T1Dを自然発症するNODマウスのT1D発症に影響を及ぼすかどうかを調べた。我々は、乳化剤の慢性暴露がNODマウスのT1D発症を促進し、インスリン自己抗体レベルの上昇と関連していることを観察した。このようなT1D発症の促進は、腸内細菌叢の組成的・機能的変化や低悪性度の腸炎を伴っていた。さらに、機械学習により、乳化剤による腸内細菌叢の崩壊の程度が、その後の疾患発症を予測するのに部分的に有効であることがわかった。このことは、宿主、食事因子、腸内細菌叢の間で複雑な相互作用が起こっていることを示唆している。したがって、食事性乳化剤による宿主-微生物叢の恒常性の乱れが、20世紀半ば以降のT1Dの増加に寄与している可能性がある。
他の人が見ている類似コンテンツ
トランスジェニックマウスを用いたマルチゲノム解析により、オメガ6/オメガ3脂肪酸の不均衡が慢性疾患のリスク因子として関与していることが示唆される
論文オープンアクセス 2019年7月26日
カナカラジュ・カリナナン, 李 祥永, ... 姜 靖X.
パラバクテロイデス・ディスタソニスは、その代謝物ペンタデカン酸を介してNASHを抑制するために食事イヌリンを使用する
論文公開 2023年6月29日
魏文超, 王志春, ... 于俊
完全非経口栄養は腸内細菌叢を変化させることでグルコース代謝を障害する
論文 13 February 2023
王 鵬, 孫 海峰, ... 王 信英
はじめに
1型糖尿病(T1D)は、遺伝的素因のある人の膵β細胞の自己免疫破壊によって引き起こされ、重度のインスリン欠乏と高血糖を引き起こし、外因性インスリンによる生涯にわたる治療を必要とする。有病率は250人に1人に達し1、T1Dは小児に最も多くみられる自己免疫疾患の一つである。T1Dは、環境因子、マイクロバイオーム、ゲノム、代謝、免疫系1,2間の個人特有の複雑な相互作用から生じる。遺伝学がT1Dにおいて中心的な役割を果たすことはよく知られており、HLAと非HLAの両方に関連する遺伝子座が明らかにされている3が、T1Dの発症に影響を及ぼす環境因子の理解は不十分である。例えば、'The Environmental Determinants of Diabetes in the Young'(TEDDY)研究では、T1Dとエンテロウイルス感染4、初期代謝5、特異的微生物叢シグネチャー6,7,8との関連が示された。T1D発症における腸内細菌叢の役割は、ヒト9,10およびマウスモデル11,12,13の両方で実証されており、T1D発症を支配するメカニズムにおける重要な因子である。
腸内細菌叢には、組成レベルでも機能レベルでも様々な因子が影響を及ぼし、腸内細菌叢異常症を引き起こす可能性がある。例えば、我々は以前、超加工食品によく添加されている添加物である食餌性乳化剤が、マウスとヒトの両方で腸内細菌叢に有害な影響を与えていることを報告した14,15,16。具体的には、食餌性乳化剤の摂取は、炎症を促進する可能性を高める形で微生物叢の組成と遺伝子発現を変化させる。さらに、乳化剤を摂取すると、通常は無菌である内側の粘液層を透過して、特定の微生物叢メンバーが宿主に侵入するようになる14,15,16。重要なことは、このような変化は、慢性的な腸の炎症と、代謝の調節不全や大腸炎感受性の亢進といった下流の有害な結果を引き起こすのに必要かつ十分であるということである14,15,16。一般的に超加工食品、特に乳化剤は、過去数十年の間に世界中で大人から子供までますます摂取されるようになっている17。この観察は、T1Dの罹患率と有病率が全体的に年間約2〜3%増加していることと一致している1。さらに、北アメリカとヨーロッパは、T1Dの年間症例数で世界の上位に位置しており1,18、これらの地域も乳化剤の消費量が多いという観察結果19と相関している。そこでわれわれは、食餌性乳化剤の摂取がマウスのT1D発症に影響を及ぼすかどうか、またそのような現象において腸内細菌叢が果たす役割について調べた。
本研究では、自然発症T1D20のモデルである非肥満性糖尿病(NOD)マウスに、4週齢から食餌性乳化剤であるカルボキシメチルセルロース(CMC)またはポリソルベート-80(P80)を投与した。その結果、CMCの摂取により、T1D発症が促進され、4週齢になるとすぐに循環インスリン自己抗体レベルが上昇することが観察された。乳化剤を投与したマウスは、糖尿病発症の早さと正の相関を示す低グレードの腸炎を示した。さらに、乳化剤の摂取により、微生物叢の組成、豊富さ、局在性、炎症誘発能が著しく変化した。興味深いことに、微生物叢の組成および機能的な量的特徴は、T1D発症を確実に予測するには不十分であり、宿主、食事因子、腸内細菌叢の間で複雑な相互作用が起こり、T1Dを促進することが示唆された。
研究結果
乳化剤の摂取はNODマウスにおける1型糖尿病の発症を促進した。
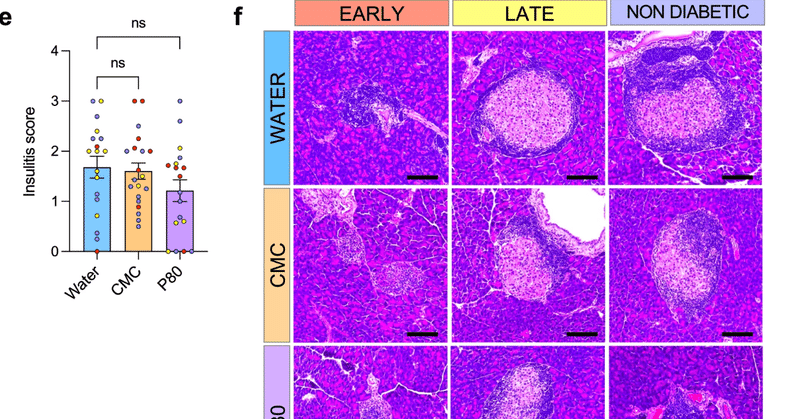
乳化剤の摂取がT1D発症に及ぼす影響を調べるため、NODマウス(n = 20)を4週齢から1%CMCまたはP80を飲料水に曝露し、その後も維持した。投与量は、微生物叢の変化とそれに伴う低グレードの炎症および代謝異常の誘発における、様々な濃度のCMCおよびP80の効果を調べた過去の研究に基づいて決定した14。血糖値は毎週測定し、説明したように72時間間隔で200mg dL-1以上の血糖値を2回測定した後にT1Dと診断した(補足図1a)。CMC投与マウスは水投与マウスと比較してT1D発症の促進を示し(図1a, b)、CMC群では11週齢で糖尿病個体が生じたのに対し、水投与群では16週齢で最初の糖尿病個体が診断された(図1b)。P80投与マウスでも同様の傾向が見られ、最初の糖尿病マウスは12週齢で診断されたが、後者の差は統計学的有意差には達しなかった(図1a, b)。CMC投与マウスにおけるこのようなT1D発症の促進は、異なるケージに収容されたマウスで観察され、投与開始後4週までに明らかな血清インスリン自己抗体レベルの早期の上昇を伴っていた(図1c)。このような血清陽性はT1D発症の初期イベントである1。次に、試験開始時にT1Dと診断されたマウスを、それ以降に診断されたマウスや糖尿病でないマウスと区別するために、補足図1b21,22に記載したように、診断時の年齢に基づいて3群(早期T1D、後期T1D、T1Dなし)に分けた。このアプローチにより、T1D診断の早さとインスリン自己抗体レベルとの間に相関がないことが明らかになった。同様に、すべての糖尿病マウスが200mg dL-1以上の血糖値を示したが、その値はT1D後期診断マウスに比べて早期診断マウスで高い傾向があり(ANOVA血糖値T1D早期vs.T1D後期 p = 0.055)、特にP80投与マウスで高かった(図1d、補足図2)。最後に、膵臓の炎症について調べたところ、食餌性乳化剤の摂取や早期T1D発症は、いずれも不感症とは関連していなかった(図1e、f)。これらの結果を総合すると、一般的に使用されている食餌性乳化剤は、マウスにおいて、膵臓の炎症とは無関係と思われる方法で、インスリン自己抗体の産生を増加させ、T1D発症を促進することが示唆される。
図1:食餌性乳化剤の摂取はNODマウスにおいて1型糖尿病の発症を促進する。
図1
NODマウスにCMCまたはP80(1%)を28週間飲水させ、糖尿病の発症を血糖値測定により毎週評価した。 a 時間経過に伴う1型糖尿病の発症率 b 診断時の年齢。太字の濃い赤のパーセンテージは各群の早期糖尿病マウスの割合を示す。c 8週目に採取した血清で測定したインスリン自己抗体レベル d 診断時の血糖値 e ヘマトキシリン・エオジン染色した膵切片で測定した膵炎個体スコア f HE染色した膵島の代表画像。スケールバー: 100 μm。データは平均値±s.e.m.であり、点は個々のマウス(N = 20)を表す。有意差は**p ≤ 0,01、***p ≤ 0,001、n.s.は有意でないことを示す。
フルサイズ画像
NODマウスにおける食餌性乳化剤摂取後の腸内細菌叢組成の変化
腸内細菌叢はT1Dの病因の決定因子であることが知られており9,23、さらに乳化剤によって有害な変化を受けることが知られている14。そこで、16S rRNA配列決定によってNODマウスの微生物叢がCMCおよびP80によってどのような影響を受けるかを解析することにした。投与前の微生物叢組成は、水、CMCおよびP80投与マウス間で差はなく(図2a、PERMANOVA水対CMC p = 0.075、PERMANOVA水対P80 p = 0.114)、将来の早期/後期糖尿病マウスと糖尿病フリーマウス間でも差はなかった(図2b)。しかし、投与6週間後、CMC投与マウスとP80投与マウスの微生物叢は、図2cの有意なクラスタリングから明らかなように、組成の変化を示した(PERMANOVA水対CMC p = 0.045、PERMANOVA水対P80 p = 0.011)。注目すべきことに、CMC処理マウスの微生物叢組成は、P80に曝露したマウスと比較して有意に異なっており(PERMANOVA CMC vs. P80 p = 0.011)、このことはさらに、これら2つの添加物が腸内細菌叢に異なる作用を及ぼすことを示唆している16。このような微生物叢組成の変化は、糖尿病状態とは関連しておらず、したがって糖尿病状態の結果でもなかった(図2d)。水投与マウスとCMC投与マウスの間で測定されたBray-Curtis距離は、18週間の投与後、水投与群内で測定された個体間の距離と有意に異なっていた(図2e)。一方、P80投与は、シャノン多様性指数で示されるように、微生物叢の豊かさを著しく減少させた(図2f)。このような観察結果は、CMCとP80が腸内細菌叢に及ぼす影響の根底にある異なるメカニズムをさらに裏付けている。これらの結果は、食餌性乳化剤への慢性的な曝露が腸内細菌叢の様々な組成的側面を変化させることを示すこれまでの知見と一致していた。次に、Microbiome Multivariable Associations with Linear Models(MaAsLin2)解析を行い、6週間の乳化剤摂取後に存在量が有意に変化した微生物叢メンバーを同定した(図2g)。最も有意な影響を受けたと同定された10種類の微生物叢メンバーのうち、ラクノクロストリジウムはCMCおよびP80投与マウスで増加し、CMC摂取によりルミノコッカスが特異的に減少した(図2g)。これらの乳化剤の影響を受けた微生物叢メンバーの相対的存在量は、糖尿病の状態やT1Dの早さとは相関しなかった。同様のMaAsLin2解析を行い、10週目における存在量が糖尿病発症に有意に影響される微生物叢メンバーを同定したが、糖尿病に関連する微生物叢メンバーを同定することはできなかった。これらの結果から、乳化剤の摂取は、糖尿病の有無にかかわらず、NODマウスにおける微生物叢の全体的な組成、豊富さ、および特定の微生物叢メンバーの存在量に変化をもたらすことが明らかになった。
図2:乳化剤の摂取は腸内細菌叢組成の変化を引き起こす。
図2
NODマウスにCMCまたはP80(1%)を28週間飲水させ、糖尿病の発症を血糖測定により毎週評価した。aおよびb 4週目におけるブレイカーチス距離の主座標分析(a)または糖尿病の状態(b)。g MaAsLin2に基づく微生物叢メンバーの同定は、10週目のCMC/P80処理によって、水処理対照群と比較して有意に変化した。列は個々のマウスを表す。データは平均値±s.e.m.(N = 20)。有意差は**p ≤ 0,01、***p ≤ 0,001で示した。
フルサイズ画像
食餌性乳化剤の摂取はNODマウスにおける微生物叢の炎症潜在性を増加させた
腸内細菌叢が粘膜免疫系を刺激する可能性は、リポ多糖(LPS)やフラジェリンなどの微生物叢由来の炎症性分子を定量することで評価できる。このような微生物叢由来分子は、T1D23,24,25の病因に重要な役割を果たしていることが以前に証明されており、乳化剤の摂取により増加する14,26。そこで次に、TLR5、TLR4、TLR2レポーター細胞を用いて、それぞれ糞便中のフラジェリン、LPS、TLR-2リガンドの機能的レベルを測定した(図3a-i)。フラジェリン、LPS、およびTLR2リガンドの糞便中濃度は、CMCおよびP80のいずれに対しても、曝露4週後までに有意な増加が観察され、乳化剤曝露が腸内細菌叢の炎症誘発能に速やかに影響を及ぼすことが示された(図3a-c)。これらの影響のほとんどは、暴露期間が長くなると消失したことから、宿主の応答が微生物叢の炎症誘発能を弱めていることが示唆された(図3a-c)27,28。このような炎症性ポテンシャルの上昇は、糖尿病マウスと糖尿病非発症マウスの両方で観察され、糖尿病の状態とは関連していなかった(図3d-i)。生後10週目、16週目、22週目に採取した糞便から得た糞便細菌懸濁液をサイトメトリーで解析したところ、図3jに示したように、水投与マウス(0.44×106±0.23×106)と比較して、CMC投与マウスおよびP80投与マウスでは、10週目に細菌量が一過性に2倍増加した(それぞれ0.91×106±0.26×106および0.96×106±0.39×106)。このことは、観察された微生物叢の炎症誘発能の増加は、少なくとも部分的には、細菌負荷の増加によって引き起こされている可能性を示唆している。しかしながら、食餌性乳化剤処理によってフラジェリンおよびTLR2リガンドも4~16倍増加したことから、微生物叢組成の変化および/または微生物叢の転写活性調節も、観察された微生物叢の炎症誘発能増加に寄与している可能性が示唆された。さらに、糞便中のTLRリガンドレベルの増加は、特定の微生物叢メンバーとは相関していなかったことから(データは示さず)、このような増加は微生物叢の遺伝子発現の変化によって引き起こされていることがさらに裏付けられた。従って、これらのデータは、食餌性乳化剤が腸内細菌叢の炎症誘発能を高める能力を持つことを示唆している。
図3:食事性乳化剤の摂取は、糞便中の微生物叢由来の炎症性分子の増加と関連している。
図3
a-c生物活性フラジェリン(a)、LPS(b)、TLR-2リガンド(c)の糞便中レベルをHEKレポーター細胞で評価し、データは水処理マウスおよび4週目(処理前)の時点で正規化した。eとfでは、水投与群とCMC投与群のみを示し、CMC投与マウスは糖尿病の状態によって分けている。j 10週目、16週目、22週目の糞便細菌量はフローサイトメトリー法により求め、106個/mgの糞便細菌量で表した。データは平均値±s.e.m.であり、ポイントは個々のマウス(N = 20)を表す。有意性は*p ≤ 0,05, **p ≤ 0,01; ***p ≤ 0,001で示した。
フルサイズ画像
食餌性乳化剤の摂取は、NODマウスにおいて微生物叢の侵入と微生物叢標的抗体産生の増加を誘導した。
上述のフラジェリン、LPS、TLR2リガンドの増加は、食餌性乳化剤の摂取に伴う腸内細菌叢の免疫刺激能の増加を示唆している。このような現象は以前、微生物叢のメンバーと腸上皮を隔てる距離の減少を特徴とする粘液層への微生物叢の侵入と関連していた14。このような侵入は、微生物叢が基礎にある免疫系を刺激する能力を高め、最終的に炎症を引き起こすと考えられている。そこで次に、このような微生物叢と上皮の距離を測定したところ、CMC投与マウスとP80投与マウスでは微生物叢の侵食が著しく(図4a、b)、細菌と上皮の平均距離は、水投与マウスでは17.69±1.16μmであったが、CMC投与マウスでは7.33±0.99μm、P80投与マウスでは9.86±1.20μmに減少していた。さらに、このような微生物叢の侵食はT1D早発症とは関連していなかったことから、このような乳化剤誘発現象は、これらの食品添加物によって誘発されるT1D促進を超えた唯一の作用因子ではないことが示唆された(補足図3a)。
図4:食餌性乳化剤の摂取は、微生物叢の侵襲と微生物叢由来抗原を標的とする抗体の循環レベルの上昇を誘導する。
図4
NODマウスにCMCまたはP80(1%)を28週間飲水させ、糖尿病の発症を血糖測定により毎週評価した。 a マウス1匹につき5つの高倍率視野における腸管上皮細胞(IEC)に最も近い細菌の距離: MUC2(緑)、アクチン(紫)、細菌(赤)、DNA(青)。スケールバーは50mm。d-g 8週目(dとe)または安楽死時(fとg)に採取した血清中の抗フラジェリン抗体(dとf)および抗LPS抗体(eとg)をELISA法で測定した。データは平均値±s.e.m.であり、ポイントは個々のマウス(N = 20)を表す。有意性は**p≦0,01; ***p≦0,001; n.s.は有意でないことを示す。
フルサイズ画像
以上の観察から、食餌性乳化剤への暴露は、腸内細菌叢の炎症誘発能を高めるだけでなく、微生物叢の侵入を促進するのに十分であることが明らかになった。このことは、このような乳化剤形状の微生物叢が、基礎となる粘膜免疫系を刺激する能力を高めていることを示唆している。この概念によく一致するように、CMCを投与したマウスでは、10週目に糞便中のIgAコート細菌のレベルが上昇し(図4c)、抗フラジェリン抗体および抗LPS抗体の血清レベルが上昇した(図4d-g)。ここでも、T1Dの早発症は糞便中あるいは循環中の抗体レベルの最高値とは関連していなかった(図4c-g)。腔内および循環中の細菌標的IgAのこのような増加は、CMCマウスに限定された。このことは、このような宿主媒介性の防御反応の実行が、CMCによる変化に特異的であることを示唆している。従って、食餌性乳化剤の摂取は、NODマウスにおいて、微生物叢の組成、豊富さ、炎症誘発性、ならびにT1D有病率の上昇に関連するような適応免疫系による局在化および標的化の変化を誘導するのに十分である。さらに、これらの表現型がT1D発症の早さとは無関係に観察されたことから、糖尿病の成立には他の要因が関与していることが示唆された。
食餌性乳化剤の摂取はNODマウスにおいて上皮障害と低悪性度腸炎を誘発する。
食餌性乳化剤は低グレードの炎症を誘発し、微生物叢依存的に宿主の健康に悪影響を及ぼす14。このことがT1D発症のどの程度までNODマウスにも当てはまるのか、また腸の炎症とT1Dの早発症との潜在的関係を調べるために、次に大腸組織学的スコアリングによって上皮の炎症を定量化した。CMC投与マウスとP80投与マウスでは、結腸組織学的スコアが有意に上昇した(図5a, b)。さらに、腸管炎症レベルとT1D早期発症との間に強い関連性が観察され、3つの実験群すべてにおいて早期糖尿病マウスのスコアが最も高かった(図5b, c)。さらに、便中リポカリン-2(Lcn2)マーカー(Lcn2)29を用いて腸の炎症を縦断的に調べたところ、P80投与は8週目および16週目のLcn2の増加と関連していることが明らかになり(図5d)、P80乳化剤が腸の炎症に一過性で不安定な影響を与えていることが示唆された。乳化剤が腸に与える影響をさらに理解するために、次にqRT-PCR法を用いて上皮恒常性に関与する大腸遺伝子の発現を定量した。このようなアプローチにより、CMCおよびP80投与マウスでは、水投与マウスと比較して、Muc2(粘液バリア形成に寄与する主要な腸管ムチン)とKlf4(ゴブレット細胞の恒常性に関与するジンクフィンガー転写因子)の発現が増加した(図5e, f)。この反応は、CMCまたはP80処理後のLgr5の大腸発現変化とは関連していなかったことから、乳化剤への曝露が上皮の増殖状態に影響を与えていないことが示唆された(図5g)。
図5:食餌性乳化剤の摂取はNODマウスにおいて低グレードの腸炎を誘発する。
図5
NODマウスにCMCまたはP80(1%)を28週間飲水投与し、血糖値測定により糖尿病の発症を毎週評価した。d 炎症性宿主由来リポカリン-2の経時的糞便レベル。データは水投与マウスおよび4週目(投与前)の時点で正規化した。 hおよびj 脾臓重量(h)、盲腸重量(i)、結腸長(j)は安楽死時に測定した。データは平均値±s.e.m.であり、点は個々のマウス(N = 20)を表す。有意性は*p≦0,05, **p≦0,01; ***p≦0,001; n.s.は有意でないことを示す。
フルサイズ画像
組織学的に明らかな慢性腸炎症の促進と一致して、食餌性乳化剤の摂取は肉眼的な形態学的変化にも影響を及ぼし、P80投与マウスでは脾臓重量の増加(図5h)、盲腸重量の増加(図5i)、CMC投与マウスとP80投与マウスの両方で結腸短縮(図5j)がみられた。このような形態学的変化は、補足図3b-dに示したように、T1D発症の早さとは関連していなかった。興味深いことに、このような腸の炎症はCMCとP80の間で区別して観察され、脾臓重量とリポカリン-2レベルに対する影響も異なっていた。注目すべきは、CMCとP80を投与したマウスのいずれも、経時的に体重が有意に増加したことである(補足図4)。したがって、食餌性乳化剤の摂取は、低悪性度の炎症を誘発することにより、腸管コンパートメントに有害な影響を与えた。重要なことに、組織学的スコアの増加は、実験的処置にかかわらず、NODマウスにおける早期T1D発症と関連していた。
腸内細菌叢の機能評価により、T1Dの状態を部分的に予測することができる。
上に示したデータは、乳化剤の摂取が慢性的な腸の低悪性度炎症、微生物叢の変化、T1D発症の促進という表現型を引き起こしたことを示唆している。しかし、個々に解析した場合、微生物に関連する表現型とT1D発症の早さとの間には相関は認められなかった。そこで、統合的な微生物叢組成および機能解析がT1D糖尿病発症を予測できるかどうかを評価するために、治療開始0、4、6週間後の微生物叢組成評価に基づく転帰の予測に受信者動作特性(ROC)曲線を用いた、 また、微生物叢の機能的特徴(生後8週目および10週目のフラジェリン、LPS、TLR2リガンドの糞便レベル、微生物叢-IEC距離、10週目の糞便IgAコーティング細菌、生後8週目および安楽死時のフラジェリン/LPS特異的抗体の循環レベルを含む)に基づいても予測した。予想通り、生後4週目(治療前)の微生物叢組成データは、将来の治療、将来の糖尿病の状態および早期の予測を可能にしなかった(図6a-d)。生後8週目および10週目(それぞれ4週間および6週間の治療後)の微生物叢組成データは、治療の予測には十分であったが(図5e、f、i、j)、糖尿病の状態や糖尿病発症の早さを予測することはできなかった(図5g、h、k、l)。さらに重要なことは、微生物叢変化のマーカーは正確な治療予測を可能にし(図5m、n)、さらに糖尿病の状態(図5o)と糖尿病発症の早さ(図5p)の予測成功率を高めたことである。CMCマウスはT1D有病率を増加させるのではなく、T1D発症を加速させたため、定量的転帰(T1D発症の早さ)を予測できるモデルを用いて同様のアプローチを行った。このようなアプローチでは、診断時の年齢をうまく予測することはできなかった(データは示していない)。これらのことから、乳化剤による微生物叢変化の重症度と糖尿病の状態およびT1D発症の早さとの関連は部分的であり、宿主、食事因子、腸内細菌叢の間の複雑な相互作用がT1Dを促進することが示唆される。
図6:微生物叢の組成と機能により、NODマウスにおける治療と早期の糖尿病の状態予測が可能になる。
図6
NODマウスにCMCまたはP80(1%)を28週間飲水させ、血糖測定により糖尿病の発症を毎週評価した。ROC曲線に基づくCMC処理(結果CMCまたはWATER、a、e、i、m)、P80処理(結果P80またはWATER、b、f、j、m)、糖尿病状態(結果TRUEまたはFALSE、c、g、k、o)または早期糖尿病状態(結果EARLYまたはLATE-OR-NO、d、h、l、p)の予測。予測は、4週目(a-d)、8週目(e-h)、10週目(i-l)に種レベルで同定された微生物叢メンバーの稀薄な存在量、または定量的微生物叢変化マーカー(8週目および10週目のフラジェリン、LPS、TLR2リガンドの糞便レベル、腸管上皮細胞からの距離、10週目のIgAコート細菌の糞便割合、生後8週目および安楽死時のフラジェリン/LPS特異的抗体レベル、m-p)に基づいて行った。曲線は、独立した訓練/検証コホートサンプリングによる20回の予測反復後に得られた曲線座標の平均±s.d.。平均曲線下面積±s.d.をグラフ上に示す。
フルサイズ画像
考察
T1DがQOLと医療経済にもたらす甚大な負担は、疾患発症を促進する修正可能な因子の精査された理解を必要とする。しかしながら、前臨床疾患モデルやヒト疫学的アプローチを用いた多大な努力にもかかわらず、T1D発症に影響を及ぼす環境因子は依然として不明な点が多い。腸内細菌叢は、免疫経路と代謝経路の両方において中心的な役割を果たしており、特に食事因子によるその調節が、T1D発症に関与していることが示唆されており、その影響は予防的なもの30,31,32,33と有害なもの34,35,36の両方がある。食餌性乳化剤の摂取が、微生物叢の組成や侵入の点で変化を引き起こし、宿主の健康に有害な結果をもたらすという私たち自身や他の研究者の観察14,15,37,38から、食餌性乳化剤の摂取がT1D発症に影響を及ぼすかどうかを調べることが求められた。
NODマウスモデルを用いて、我々はCMCの摂取がT1D発症を有意に促進することを証明した。このような糖尿病の早発症は、T1D早期発症のマーカーであるインスリン自己抗体の血清レベルの上昇と関連している。また、食餌性乳化剤が微生物叢の組成と局在に及ぼす影響は、他のマウスモデルにおける過去の報告と同様に、低グレードの腸内炎症の促進を引き起こすことが明らかとなった14。これらの変化した表現型は、糖尿病の状態や糖尿病発症の早さとは密接に相関していなかった。むしろ、組織学的に評価された腸の炎症とT1D発症の早さとの間に強い関連が観察された。さらに、機械学習による評価では、乳化剤による微生物叢変化の重症度が糖尿病の状態やT1D発症の早さと部分的に関連していることが強調され、宿主、食事因子、腸内細菌叢の間で複雑な相互作用が起こり、T1Dを促進することが示唆された。したがって、乳化剤の摂取がT1D発症に及ぼす影響の根底にある微生物叢に依存する機序と独立した機序を同定するためには、さらなる研究が必要である。
微生物叢の変化がT1Dを促進する可能性のある機序は数多くあり、これまでの機序研究では、腸内細菌叢とT1D発症との相互作用を媒介する微生物叢由来のSCFA30,32,39、TLR受容体23、エンテロウイルス40、宿主由来の抗微生物ペプチド41,42の役割が明らかにされている。このようなメカニズム上のギャップはともかく、今回の研究は、これまでに報告されているヒトにおける微生物叢の侵食と血糖異常との相関について、メカニズム的な手がかりを与えるものである43。実際、我々は以前、微生物叢の侵食の程度がヒトの2型糖尿病(T2D)の重症度と相関することを観察したが、その因果関係は不明なままであった。実際、微生物叢の侵入は、慢性的な低悪性度腸炎症の促進およびその下流でのT2D発症の中心的な特徴である可能性がある一方で、血糖値の上昇によってグルコース漏れが生じ、腸管上皮から腸管内腔に向かってグルコース勾配が形成され、最終的に細菌がIECに引き寄せられ、侵入が誘導される可能性もある。しかし、本研究で観察された血糖値と微生物叢浸潤との間に相関がないことは、グルコースリークの仮説に疑問を投げかけるものであり、むしろ微生物叢浸潤はグルコースホメオスタシス異常の結果ではなく、原因であることを示唆している。
本研究は、乳化剤がT1D発症に及ぼす影響について新たな知見をもたらすものであり、T1D発症率の急速な上昇と加工食品製造における乳化剤の広範な使用を考慮すると、非常に重要である。われわれは、このような添加物がT1D発症に及ぼす有害な影響を明らかにしたが、超加工食品は、乳化剤を含む多数の添加物の使用だけでなく、多量の糖質44や低量の繊維質30を含む他の栄養学的特性も特徴としており、これらはT1D発症や他の自己免疫疾患に相乗的に作用する可能性がある。さらに、本研究で使用したNODマウスモデルは、T1D発症が比較的迅速かつ浸透的で、診断が生後10~30週齢の間に起こるという大きな限界がある。一方、ヒトでは、T1D発症は主に小児で診断されるにもかかわらず、発症には数年かかり、その間、T1D発症に有害に作用する可能性のある乳化剤が慢性的に摂取されることになる。
結論として、乳化剤の摂取がT1D発症を促進することをここに報告する。乳化剤による微生物叢崩壊の重症度は、その後の疾患発症を予測する力を部分的に有しており、宿主、食事因子、腸内細菌叢の間で複雑な相互作用が起こり、T1Dを促進することが示唆された。食餌性乳化剤がNODマウスのT1D発症に影響を及ぼす正確な機序を明らかにするためには、さらなる研究が必要であると思われる。なぜなら、T1D発症を予防する方法で微生物叢に有益な影響を与える治療的アプローチが開けるかもしれないからである。
方法
マウス
4週齢の雌性NOD/ShiLtJマウスをJackson Laboratoriesから購入した。マウスは5匹ずつのケージに入れられ、12時間の明暗サイクルで飼育され、標準的なチャウ食と水(水処理群、4匹)、または1%CMC添加水(CMC処理群、4匹)、または1%P80添加水(P80処理群、4匹)を自由に摂取できた。ケージは全群とも1週間おきに交換した。体重を測定し、1週間おきに糞便を採取した。生後8週目からは2週間ごとに、生後12週目からは1週間ごとに血糖値をチェックした。血清は生後8週目に採取された。72時間間隔で200mg dL-1以上の血糖値を2回測定した後、1型糖尿病と診断した。糖尿病と診断された時点、あるいは28週齢以降、マウスはイソフルランと頚椎脱臼により安楽死させた。大腸長、大腸重量、脾臓重量、脂肪重量を測定し、下流分析のために臓器を採取した。動物福祉および実験プロトコールはARRIVEガイドライン(動物研究:生体内実験の報告)に従った。動物が関与するすべての手順は、フランス高等教育・研究・技術革新省(APAFIS#24788-2019102806256593 v8)の承認を得た。
ELISAによる血清インスリン自己抗体の定量
インスリン特異的血清IgGレベルはELISAにより定量した。マイクロタイタープレートに精製マウスインスリン(1ウェルあたり100ng)を一晩コートした。その後、1:40に希釈した血清サンプルを塗布した。インキュベーションおよび洗浄後、ウェルをHRP結合抗マウスIgG(1:1000、SouthernBiotech、1015-05)とインキュベートした。定量は比色ペルオキシダーゼ基質テトラメチルベンジジンを用いて行い、光学密度は450nmで読み取った(Versamaxマイクロプレートリーダー)。データは、バックグラウンド(血清のないサンプルの読み取り値で決定)を差し引くことにより補正した光学密度として報告されている。
ELISAによる血清フラジェリンまたはLPS特異的IgGの定量
フラジェリンおよびLPS特異的血清IgGレベルはELISAにより定量した。マイクロタイタープレートに、Salmonella Typhimurium由来の精製フラジェリン(Sigma、1ウェルあたり100 ng)またはLPS(E. coli 0128: B12由来、Sigma、1ウェルあたり2 μg)を炭酸-炭酸水素緩衝液で希釈したものを一晩コートした。その後、1:200に希釈した血清サンプルを添加した。インキュベーションと洗浄後、ウェルをHRP結合抗マウスIgG(1:1000、SouthernBiotech、1015-05)とインキュベートした。定量は比色ペルオキシダーゼ基質テトラメチルベンジジンを用いて行い、光学密度は450nmで読み取った(Versamaxマイクロプレートリーダー)。データは、バックグラウン ド(血清欠乏検体での測定値)を差し引いて補正した光学密度として報告されている。
ELISAによる糞便中LCN2の定量
ELISAによる糞便中LCN2の定量には、凍結した糞便サンプルを0.1%Tween 20を含むPBSで最終濃度100 mg ml-1に再構成し、20分間ボルテックスして均一な糞便懸濁液を作製した29。これらのサンプルを14,000×g、4℃で10分間遠心した。透明な上清を回収し、分析まで-20℃で保存した。発色ペルオキシダーゼ基質テトラメチルベンジジンを用いたDuosetマウスLCN2 ELISAキット(R&D Systems, Minneapolis, MN, USA)を用いて、上清中のLCN2レベルを推定し、450 nmで光学濃度を読み取った(Versamaxマイクロプレートリーダー)。
インスリン炎のスコアリング
安楽死後、膵臓を摘出し、4%パラホルムアルデヒドで固定し、パラフィンに包埋して切片化し、ヘマトキシリン・エオジンで染色した。膵臓炎は盲検下で、既述の方法で評価した24。簡単に言えば、スライド上のすべての膵島を分析し、それぞれに0~3のスコアをつけた。0=膵島炎なし、1=膵島周囲炎、2=膵島の50%未満浸潤、3=膵島の50%以上浸潤。
ヘマトキシリン・エオジン染色と病理組織学的分析
安楽死後、大腸(近位結腸、盲腸から最初の2cm)をCarnoyの固定液(60%メタノール、30%クロロホルム、10%氷酢酸)に入れた。その後、組織をメタノール2×30分、エタノール2×15分、エタノール/キシレン(1:1)15分、キシレン2×15分で洗浄し、縦方向にパラフィンに包埋した。組織は5μmの厚さで切り出し、標準的なプロトコルを用いてヘマトキシリン・エオジン(H&E)で染色した。H&E染色されたスライドは、粘膜、粘膜下層、筋層/漿膜における上皮障害と炎症浸潤の程度に基づいて4つのスコアが付けられた。4つのスコアはそれぞれ、既述のように、変化が限局性であれば1、斑状であれば2、びまん性であれば3を乗じたものである29。結腸ごとの 4 つのスコアを加算し、マウス 1 匹あたりのスコアの合計を 0-36 とした。
16S rRNA 遺伝子配列決定による微生物叢解析
16S rRNA遺伝子の増幅と塩基配列決定は、Earth Microbiome Projectのプロトコールに従い、MOBIO PowerSoil DNA Isolation KitのDNA抽出手順(www.earthmicrobiome.org/emp-standard-protocols)を修正したIllumina MiSeqテクノロジーを用いて行った。バルクDNAは、MoBio Laboratories(米国カリフォルニア州カールスバッド)のPowerSoil-htpキットを用いて、凍結押出し糞便から機械的破砕(ビーズビート)で抽出した。16S rRNA遺伝子のV4領域は、複合フォワードプライマーと、Golayエラー訂正スキームを用いて設計されたユニークな12塩基のバーコードを含むリバースプライマーを用いて、各サンプルからPCR増幅した。フォワードプライマー515F 5'- AATGATACGGCACCGAGATCTACGCTXXXXXXXXXXXXXTATGGTAATTGTGYCAGCMGCCGCGTAA-3'を使用した:斜体配列は5'イルミナアダプター、12 X配列はゴレイバーコード、太字配列はプライマーパッド、斜体および太字配列はプライマーリンカー、下線配列は保存された細菌プライマー515Fである。使用したリバースプライマー806Rは5'-CAAGCAGAAGACGGCATACGAGATAGTCAGCCAGCC GGACTACNVGGGTWTCTAAT-3':斜体配列はイルミナアダプターの3'逆相補配列、太字配列はプライマーパッド、斜体および太字配列はプライマーリンカー、下線配列は保存された細菌プライマー806Rである。PCR反応はHot Master PCR mix (Quantabio, Beverly, MA, USA)、0.2μMの各プライマー、10-100ngの鋳型からなり、反応条件はBioradサーモサイクラーで95℃で3分、95℃で45秒、50℃で60秒、72℃で90秒を30サイクル行った。産物をゲル電気泳動で可視化し、Quant-iT PicoGreen dsDNA assay(Clariostar Fluorescence Spectrophotometer)を用いて定量した。マスターDNAプールを等モル比で作製し、その後Ampure磁気精製ビーズ(Agencourt, Brea, CA, USA)で精製し、Genom'ICプラットフォーム(INSERM U1016, Paris, France)でIllumina MiSeqシーケンサー(ペアエンドリード、2×250 bp)を用いて塩基配列を決定した。
16S rRNA遺伝子配列解析
16S rRNA配列はQIIME2-version 201946を用いて解析した。イルミナアンプリコン配列データを検出および補正するために、QIIME2デフォルトパラメーターを用いてDada2メソッド47を用いて配列をデマルチプレックスおよびクオリティフィルターし、以下のdada2コマンドを用いてQIIME2アーチファクトの表を作成した:qiime dada2 denoise-paired --i-demultiplexed-seqs demux. qza --p-trim-left-f 0 --p-trim-left-r 0 --p-trunc-len-f 180 --p-trunc-len-r 180 --o-representative-sequences rep-seqs-dada2.qza --o-table table-dada2.qza --o-denoising-stats stats-dada2.qza --p-n-threads 6. 次に、align-to-tree- mafft-fasttreeコマンドを用いて系統多様性解析用の木を作成し、core-metrics-phylogeneticコマンドを用いてアルファ多様性解析とベータ多様性解析を行った。主座標分析(PCoA)プロットは、実験グループ間のばらつき(β多様性)を評価するために用いられた。分類学的解析では、SILVA参照データベース48とのペアワイズ同一性が99%の閾値を持つ操作的分類単位(OTU)に特徴を割り当てた。
糞便中フラジェリン、LPS、TLR2リガンド負荷量の定量化
糞便中の生理活性フラジェリン、LPS、およびTLR2リガンドのレベルは、それぞれヒト胚性腎臓(HEK)-blue-mTLR5、HEK-blue-mTLR4、およびHEK-blue-mTLR2細胞(Invivogen社、カリフォルニア州サンディエゴ)を用いて、既述の方法で定量した49。糞便を最終濃度100 mg mL-1になるようにPBSに懸濁し、ボルテックスを用いて15分間ホモジナイズした。その後、サンプルを8000×gで15分間遠心し、得られた上清を連続希釈して哺乳動物細胞に適用した。精製大腸菌フラジェリン、LPS(Sigma, St. 24時間の刺激後、細胞培養上清をQUANTI-Blue培地(Invivogen, San Diego, CA, USA)にアプライし、30分後にアルカリホスファターゼ活性を620nmで測定した。
ムチンの免疫染色と蛍光in situハイブリダイゼーションによる細菌の局在化
ムチンの免疫染色と蛍光in situハイブリダイゼーション(FISH)を組み合わせて、腸管粘膜表面における細菌の局在を解析した。簡単に説明すると、糞便を含む大腸組織(近位結腸、盲腸から2cm目)をメタノール-カルノイ固定液(60%メタノール、30%クロロホルム、10%氷酢酸)中に室温で最低3時間置いた。その後、組織をメタノール2×30分、エタノール2×15分、エタノール/キシレン(1:1)15分、キシレン2×15分で洗浄し、縦方向にパラフィンに包埋した。5μm切片を切り出し、60℃で10分間予熱した後、60℃のキシレン中で10分間、室温のキシレン中で10分間、99.5%エタノール中で10分間処理して脱脂した。ハイブリダイゼーションバッファー(20 mM Tris-HCl、pH 7.4、0.9 M NaCl、0.1% SDS、20%ホルムアミド)で最終濃度10 mg mL-1に希釈したEUB338プローブ(59-GCTGCCTCCCGTAGGAGT-39、59 Alexa 647標識)を用いて、50 °Cで一晩ハイブリダイゼーションステップを行った。洗浄バッファー(20 mM Tris-HCl, pH 7.4, 0.9 M NaCl)で10分間、PBSで3×10分間洗浄後、PAPペン(Sigma, St. Mucin-2一次抗体(ウサギH-300, [C3], C-term, Genetex, GTX100664)をブロック液で1:100に希釈し、4℃で一晩塗布した。PBSで3×10分洗浄後、1:300に希釈した抗ウサギAlexa 488二次抗体、PhalloidinTetramethylrhodamine B isothiocyanate (Sigma-Aldrich) 1 mg ml-1、Hoechst 33258 (Sigma-Aldrich) 10 mg ml-1を含むブロック溶液を切片に2時間塗布した。細菌と上皮細胞単層との距離の観察および測定は、Spinning Disk IXploreを用い、Olympus cellSens imaging software 421 (V2.3)を用いて、フレームサイズ2048 × 2048、深度16ビットで行った。405 nmのレーザーでHoechst染色(上皮DNA)、488 nmのAlexa Fluor 488(粘液)、488 nmのPhalloidin(アクチン)、423 nmのAlexa Fluor 647(細菌)を励起した。サンプルは20倍の対物レンズで撮影した。
糞便中のIgAコート細菌および細菌量の定量
IgAでコートされた細菌は、以前に記載された方法で定量した28。簡単に説明すると、凍結した糞便サンプルをPBS中で最終濃度20 mg/mlまで十分にホモジナイズした。糞便懸濁液を40μmの滅菌ナイロンメッシュで濾過し、50×g、4℃で15分間遠心分離した。200μlの上清を1mlのPBSで洗浄し、8000×g、4℃で5分間遠心した。得られた細菌ペレットを100μlのブロッキングバッファー(20% Normal Rat Serumを含む染色バッファー)に懸濁し、氷上で20分間インキュベートした後、PE標識抗マウスIgA(1:12.5; eBioscience, 12-4204-82)を含む100μlの染色バッファーで、暗所、氷上で30分間染色した。染色バッファーで2回洗浄した後、ペレットを200μlのFACSバッファー(PBS、1% Normal Rat Serum)に懸濁した。データ取得はBeckman Coulter Galliosフローサイトメーターで行った。各サンプルについて50,000イベントを記録し、FlowJoソフトウェアv.10.8.2を用いてデータを解析した。細菌負荷は、サイズと粒度に基づいて細菌集団をゲーティングすることにより定量化した。
大腸RNA抽出およびq-RT-PCR解析
安楽死の際に遠位結腸を採取し、RNAlaterに入れた。TRIzol(Invitrogen, Carlsbad, CA)を用いて、製造業者の説明書に従い、既 に記載された方法で大腸組織から全 mRNA を単離した29。定量的 RT-PCR は、Qiagen のキット QuantiFast® SYBR® Green RT-PCR を用い、LigthCycler® 480 装置(Roche Molecular Systems, Inc. 遺伝子発現は、Gapdhハウスキーピング遺伝子を用いたCt法による相対値で示した。
微生物叢組成に基づく治療と糖尿病状態の予測
微生物叢組成と治療または糖尿病状態との関連を、微生物叢組成またはCMC治療(アウトカムCMCまたはWATER、Fig. 図6a、e、i、m)、P80治療(結果P80またはWATER、図6b、f、j、m)、糖尿病状態(結果TRUEまたはFALSE、図6c、g、k、o)、または早期糖尿病状態(結果EARLYまたはLATE-OR-NO、図6d、h、l、p)のいずれかの微生物叢組成または炎症性電位データに基づく予測を用いて評価した。ROC曲線は、トレーニングデータセットおよび検証データセット(それぞれ80%および20%のマウスがランダムに罹患している)を用いて計算した(Rバージョン4.1.2、randomForest 4.7-1.1パッケージ、ROCRパッケージ)。データセットには、4週目(図6a-d)、8週目(図6e-h)、10週目(図6i-l)に種レベルで同定された微生物叢メンバーの相対存在量データ、または定量的微生物叢データが含まれていた。6i-l)、あるいは定量的な微生物叢の機能的特徴(8週目と10週目のフラジェリン、LPS、TLR2リガンドの糞便レベル、腸管上皮細胞からの距離、10週目の糞便中のIgAコート細菌の割合、生後8週目と安楽死時のフラジェリン/LPS特異的抗体レベル、図6m-p)。ROC計算は、訓練データと検証データをランダムにサンプリングして20回繰り返し、各反復ごとに曲線下面積(AUC)を測定した。平均AUCと標準偏差を各グラフに示した。
相対存在量が有意に変化した微生物叢メンバーの同定
6週間のCMCまたはP80治療後に存在量に有意な変化を示す微生物叢メンバーを、MaAsLin2(Microbiome Multivariable Associations with Linear Models、バージョン2)51を用いて同定した。MaAsLin2解析(Rバージョン4.1.2、Maaslin2バージョン1.12.0パッケージ)は、10週目に種レベルで同定された微生物叢メンバーの相対存在量データを用いて実施した。補正p値<0.05の場合、微生物叢メンバーの相対存在量が有意に変化したと報告した。得られたデータは、水処理群で観察された平均存在量と比較した相対存在量のLog2倍変化として報告した。
統計解析
図1aのlog-rank Mandel-Cox検定を用いて有意性を判定した。正規性と余剰分散性の仮定が有効な場合は、一元配置分散分析(ANOVA)とシダックの多重比較検定を用いて有意性を検定した(図1c-e; 3j; 4c, d, g; 5a, b, e, j; 補足図2, 3)。正規性とホモ分散性の仮定に従わないデータの有意性は、それぞれダン検定による多重比較で補正したKruskal-Wallis(図1b; 4a, f; 5d, f-i)、またはDunnett検定による多重比較で補正したBrown-Forsythe and Welch ANOVA(図4e)を用いて検定した。縦断的に測定されたデータの有意性は、Sidakの検定で多重比較補正した二元配置分散分析を用いて評価した(図2e, f; 3a-i; 補足図4)。図2a-dにおけるクラスタリングの有意性は、Permutational multivariate analysis of variance (PERMANOVA)を用いて決定し、補正したp値をプロット上に示した。有意差は *p ≤ 0,05; **p ≤ 0,01; ***p ≤ 0,001; ****p ≤ 0,0001; n.s.は有意でないことを示す。
報告概要
研究デザインに関する詳細は、本論文にリンクされているNature Research Reporting Summaryを参照されたい。
データの入手可能性
未処理のシーケンスデータは、European Nucleotide Archiveにアクセッション番号PRJEB67708で寄託されている。
参考文献
DiMeglio, L. A., Evans-Molina, C. & Oram, R. A. 1型糖尿病。Lancet 391, 2449-2462 (2018).
論文
PubMed
PubMed Central
Google Scholar
Quinn, L. M., Wong, F. S. & Narendran, P. 1型糖尿病の環境決定因子:関連から因果関係の証明へ。Front. Immunol. 12, 737964 (2021).
論文
PubMed
パブメッドセントラル
Google Scholar
1型糖尿病の免疫遺伝学:包括的レビュー。J. Autoimmun. 64, 101-112 (2015).
論文
PubMed
Google Scholar
Vehik, K. et al. 1型糖尿病の遺伝的リスクが高い幼児におけるプロスペクティブ・ビローム解析。Nat. Med. 25, 1865-1872 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Liu, X. et al.1型糖尿病リスクと関連する生後早期の特徴的な成長段階:TEDDY研究。Diabetes Care 43, 556-562 (2020).
論文
PubMed
PubMed Central
Google Scholar
Stewart, C. J. et al. TEDDY研究による幼児期における腸内細菌叢の時間的発達。Nature 562, 583-588 (2018).
論文
PubMed
パブメドセントラル
Google Scholar
Vatanen, T. et al. TEDDY研究から得られた早期発症1型糖尿病におけるヒト腸内細菌叢。Nature 562, 589-594 (2018).
論文
PubMed
パブメドセントラル
Google Scholar
Dedrick, S. et al. 1型糖尿病発症における腸内細菌叢と環境因子の役割。Front. Endocrinol. 11, 78 (2020).
論文
Google Scholar
Alkanani, A. K. et al. 腸内細菌叢の変化は1型への罹患と相関する。Diabetes 64, 11 (2015).
論文
Google Scholar
Mokhtari, P., Metos, J. & Anandh Babu, P. V. 1型糖尿病が小児および青年における腸内細菌叢の組成および機能的潜在性に及ぼす影響:考えられるメカニズム、現在の知見、および課題。Gut Microbes 13, 1926841 (2021).
論文
PubMed
パブメドセントラル
Google Scholar
Huang, J. et al. 腸内微生物の代謝産物が1型糖尿病におけるIgA免疫を変化させる。JCI Insight 5, e135718 (2020).
論文
PubMed
パブメッドセントラル
Google Scholar
NODマウスにおける1型糖尿病の発症率は、無菌状態ではなく制限された細菌叢によって調節される。PLoS ONE 6, e17049 (2011).
論文
PubMed
PubMed Central
Google Scholar
Mariño, E. et al. 腸内微生物の代謝産物は自己免疫T細胞の頻度を制限し、1型糖尿病を予防する。Nat. Immunol. 18, 552-562 (2017).
論文
PubMed
グーグル奨学生
Chassaing, B. et al. 食餌性乳化剤はマウスの腸内細菌叢に影響を与え、大腸炎とメタボリックシンドロームを促進する。Nature 519, 92-96 (2015).
論文
PubMed
パブメドセントラル
グーグル奨学生
Chassaing, B. et al. 食用乳化剤カルボキシメチルセルロースのランダム化比較摂食試験により、腸内細菌叢とメタボロームへの有害な影響が明らかになった。Gastroenterol. 162, 743-756 (2022).
論文
Google Scholar
Chassaing, B., Van de Wiele, T., De Bodt, J., Marzorati, M. & Gewirtz, A. T. 食餌性乳化剤は、生体外でヒトの微生物叢組成と遺伝子発現を直接変化させ、腸の炎症を増強する。Gut 66, 1414-1427 (2017).
論文
PubMed
Google Scholar
Srour, B. et al. 超加工食品とヒトの健康:疫学的エビデンスからメカニズム的洞察まで。Lancet Gastroenterol. Hepatol. 7, 1128-1140 (2022).
論文
PubMed
Google Scholar
Patterson, C. C. et al. 小児および青年における1型糖尿病の罹患率、有病率および死亡率の世界的推計:国際糖尿病連合糖尿病アトラス第9版の結果。Diabetes Res. Pract. 157, 107842 (2019).
論文
PubMed
グーグルスカラー
Marino, M. et al. 超加工食品の世界的消費に関する系統的レビュー:所見と批判。Nutrients 13, 2778 (2021).
論文
PubMed
パブメドセントラル
Google Scholar
Aldrich、V. R., Hernandez-Rovira, B. B., Chandwani, A. & Abdulreda, M. H. NODマウスはT1Dの良いモデルであるが、限界がある。Cell Transplant 29, 963689720939127 (2020).
論文
PubMed
Google Scholar
Mathews, C. E. et al. NODマウスにおける糖尿病の急性発症と進行性発症:1型糖尿病の治療介入への潜在的意味合い。Diabetes 64, 3885-3890 (2015).
論文
PubMed
PubMed Central
Google Scholar
Karacay, C. et al. NODマウスにおける自己免疫とβ細胞機能に対するスペルミジンの効果。Sci. Rep. 12, 4502 (2022).
論文
PubMed
パブメドセントラル
Google Scholar
微生物叢はToll様受容体を介して1型糖尿病を制御する。Proc. Natl Acad. Sci. USA 112, 9973-9977 (2015).
論文
PubMed
パブメドセントラル
Google Scholar
Alibashe-Ahmed, M., Brioudes, E., Reith, W., Bosco, D. & Berney, T. Toll様受容体4阻害はNODマウスの自己免疫性糖尿病を予防する。Sci. Rep. 9, 19350 (2019).
論文
PubMed
PubMed Central
Google Scholar
Gülden, E. et al. Toll様受容体4の欠損は非肥満性糖尿病マウスのインスリン欠乏性糖尿病の発症を促進する。PLoS ONE 8, e75385 (2013).
論文
PubMed
PubMed Central
グーグル奨学生
Naimi, S., Viennois, E., Gewirtz, A. T. & Chassaing, B. ヒト腸内細菌叢に対する一般的に使用される食用乳化剤の直接的影響。Microbiome 9, 66 (2021).
論文
PubMed
パブメドセントラル
Google Scholar
Cullender, T. C. et al. 自然免疫と適応免疫が相互作用して腸内の微生物鞭毛運動を抑制する。Cell Host Microbe 14, 571-581 (2013).
論文
PubMed
パブコメ
Google Scholar
フラジェリン誘導性適応免疫は鞭毛状微生物叢を抑制し、慢性炎症性疾患に対するワクチンとなる。Nat. Commun. 10, 5650 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Chassaing, B. et al.便中リポカリン2、高感度で広範に動的な腸炎症の非侵襲性バイオマーカー。PLoS ONE 7, e44328 (2012).
論文
PubMed
PubMed Central
Google Scholar
Zou, J. et al. イヌリン発酵性食物繊維は実験モデルにおいてIL22と短鎖脂肪酸を介してI型糖尿病を改善する。Cell. Mol. Gastroenterol. Hepatol. 12, 983-1000 (2021).
論文
PubMed
パブメドセントラル
Google Scholar
Hänninen, A. et al. Akkermansia muciniphilaは腸内細菌叢のリモデリングを誘導し、NODマウスにおける膵島自己免疫を制御する。Gut 67, 1445-1453 (2018).
論文
PubMed
Google Scholar
Jacob, N. et al. 酪酸誘導TregsはGALTから膵臓へ移行し、1型糖尿病の免疫寛容を回復させる。Sci. Rep. 10, 19120 (2020).
論文
PubMed
PubMed Central
Google Scholar
Kim, T. K., Lee, J.-C., Im, S.-H. & Lee, M.-S. 免疫調節プロバイオティクスによるNODマウスの自己免疫性糖尿病の改善。Front. Immunol. 11, 1832 (2020).
論文
PubMed
パブメッドセントラル
Google Scholar
Candon, S. et al. 幼少期の抗生物質は腸内細菌叢を変化させ、自己免疫性インスリン依存性糖尿病の自然発症モデルマウスにおける疾患発症率を増加させる。PLOS ONE 10, e0125448 (2015).
論文
PubMed
パブメドセントラル
Google Scholar
Neuman, V. et al. 無菌NODマウスに移植されたヒト腸内細菌叢は、ドナーのβ細胞機能喪失のペースに関係なく、1型糖尿病への進行を調節する。Diabetologia 62, 1291-1296 (2019).
論文
PubMed
グーグル奨学生
Zhang, X.-S. et al. 抗生物質による1型糖尿病の加速は、自然腸管免疫の成熟を変化させる。
論文
PubMed
PubMed Central
Google Scholar
Viennois、E., Merlin、D., Gewirtz、A. T. & Chassaing、B. 食餌性乳化剤による低悪性度炎症は大腸発癌を促進する。Cancer Res. 77, 27-40 (2017).
論文
PubMed
Google Scholar
Viennois、E. et al.食事性乳化剤は、付着侵入性大腸菌の遺伝子発現に直接影響を与え、慢性腸炎を促進する。Cell Rep. 33, 108229 (2020).
論文
PubMed
パブメドセントラル
Google Scholar
Simon、M.-C.ら、非肥満性糖尿病マウスにおける糖尿病発症の促進を特徴づける腸の形態と微生物叢の特異的変化。J. Biol. Chem. 295, 969-980 (2020).
論文
PubMed
グーグル奨学生
Pane, J. A. et al. ロタウイルスによる非肥満性糖尿病マウスの1型糖尿病の促進は、I型インターフェロンシグナルに依存する。Sci. Rep. 6, 29697 (2016).
論文
PubMed
PubMed Central
Google Scholar
Kilkkinen, A. et al. 集団ベースの母子コホートにおける抗菌薬の使用と1型糖尿病のリスク。Diabetologia 49, 66-70 (2006).
論文
PubMed
Google Scholar
腸内カテリシジン抗菌ペプチドは膵臓の自己免疫に対して保護的な新生児腸内細菌叢を形成する。Gastroenterology 162, 1288-1302.e16 (2022).
論文
PubMed
グーグル奨学生
大腸内細菌叢の侵入はヒトにおける血糖異常と相関する。Cell. Mol. Gastroenterol. Hepatol. 4, 205-221 (2017).
論文
PubMed
パブメドセントラル
グーグル奨学生
自己免疫傾向マウスの腸管上皮およびリンパ系臓器における細胞増殖の慢性的なエネルギー摂取制限による減少。Proc. Natl Acad. Sci. USA 86, 5918-5922 (1989).
論文
PubMed
パブメッドセントラル
Google Scholar
Caporaso, J. G. et al. イルミナHiSeqおよびMiSeqプラットフォームにおける超高スループット微生物群集解析。ISME J. 6, 1621-1624 (2012).
論文
PubMed
PubMed Central
Google Scholar
Bolyen, E. et al. QIIME 2を用いた再現性、対話性、拡張性のあるマイクロバイオームデータサイエンス。Biotechnol. 37, 852-857 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Callahan, B. J. et al. DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。Nat. Methods 13, 581-583 (2016).
論文
PubMed
PubMed Central
Google Scholar
SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール。Nucleic Acids Res. 41, D590-D596 (2012).
論文
PubMed
パブメドセントラル
Google Scholar
AIEC病原体は微生物叢組成を変化させることにより、感受性の高い宿主において慢性大腸炎を誘発する。Gut 63, 1069-1080 (2014).
論文
PubMed
Google Scholar
Johansson, M. E. V. & Hansson, G. C. 組織切片における粘液の保存、固定組織におけるムチンの免疫染色、およびFISHによる細菌の局在。Methods Mol. Biol. 842, 229-235 (2012).
論文
PubMed
Google Scholar
集団規模のメタオミクス研究における多変量関連発見。PLoS Comput. Biol. 17, e1009442 (2021).
論文
論文
パブメドセントラル
Google Scholar
参考文献のダウンロード
謝辞
著者らはHist'IMおよびGenom'ICプラットフォーム(INSERM U1016、パリ、フランス)の協力に感謝する。Andrew T. Gewirtz (Georgia State University, Atlanta, USA)の建設的なフィードバックに感謝する。本研究は、欧州連合(EU)の研究・イノベーションプログラム「Horizon 2020」の下、欧州研究会議(ERC)のスターティンググラント(助成金契約No. ERC-2018-StG-804135)、IdEx University de ParisのChaire d'Excellence(ANR-18-IDEX-0001)、Kenneth Rainin財団のInnovator Award、Fondation de l'avenir(AP-RM-21-032)、ANRの助成金DREAM(ANR-20-PAMR-0002)およびEMULBIONT(ANR-21-CE15-0042-01)、INSERMの国家プログラム「Microbiote」の支援を受けている。クララ・デラロックは、フランス高等教育・研究・技術革新省(Ministère de la l'enseignement supérieur, de la recherche et de l'innovation)および医学研究財団(Fondation pour la Recherche Medicale:FRM)の博士研究員の支援を受けている。研究計画、データ収集、分析、解釈、原稿執筆において、資金提供者は一切関与していない。
著者情報
著者および所属
INSERM U1016、チーム「慢性炎症性疾患における粘膜微生物叢」、CNRS UMR 8104、Université Paris Cité、フランス、パリ
クララ・デラロック & ブノワ・シャサン
貢献
C.D.とB.C.は研究の構想とデザインに責任を持ち、方法論を開発した。C.D.はデータを取得し、C.D.とB.C.はデータの分析と解釈を行い、原稿の執筆、校閲、修正を行った。C.D.とB.C.は完成版を承認し、研究の正確性や完全性に関する疑問が適切に調査され解決されるよう、研究の全側面を説明した。
責任著者
Benoit Chassaing宛。
倫理申告
競合利益
著者らは、競合する利益はないと宣言している。
追加情報
出版社注:シュプリンガー・ネイチャーは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
補足情報
補足資料(図および表)
報告概要
権利と許可
オープンアクセス この記事は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされています。このライセンスは、原著者および出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合にその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものです。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、または許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
アップデートの確認 CrossMarkを経由して通貨と真正性を確認する
この記事の引用
Delaroque, C., Chassaing, B. 食餌性乳化剤の摂取がNODマウスの1型糖尿病発症を促進する. npj Biofilms Microbiomes 10, 1 (2024). https://doi.org/10.1038/s41522-023-00475-4
引用文献のダウンロード
受領
2023年6月15日
受理
2023年12月15日
発行
2024年01月06日
DOI
https://doi.org/10.1038/s41522-023-00475-4
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアチブSpringer Nature SharedItにより提供されています。
テーマ
マイクロバイオーム
微生物叢
バイオフィルムとマイクロバイオーム (npj Biofilms Microbiomes) ISSN 2055-5008 (online)
サイトマップ
Natureポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
プロフェッショナル育成
ネイチャー・キャリア
ネイチャーコンファレンス
地域ウェブサイト
ネイチャー・アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー・イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー クッキーの使用 お客様のプライバシーに関する選択/クッキーの管理 法的通知 アクセシビリティに関する声明 利用規約 お客様の米国におけるプライバシー権
シュプリンガー・ネイチャー
© 2024 シュプリンガー・ネイチャー
この記事が気に入ったらサポートをしてみませんか?
