
レチノイン酸とLymphotoxinシグナルはヒト腸管M細胞の分化を促進する
レチノイン酸とLymphotoxinシグナルはヒト腸管M細胞の分化を促進する
https://pubmed.ncbi.nlm.nih.gov/32247021/
Siyuan Ding, Yanhua Song, [...], and Harry B. Greenberg
論文追加情報
関連データ
補足資料
要旨
背景と目的
腸管微小葉(M)細胞は、パイエル板に存在する腸管上皮細胞のユニークなサブセットで、粘膜免疫を制御し、内腔抗原のサンプリングと取り込みのポータルとして機能する。ヒトM細胞は細胞培養で効率的に発生させることができないため、腸管免疫系の研究の妨げになっている。我々は、ヒトM細胞の分化に必要なシグナル伝達経路を同定し、ヒト回腸腸管を用いた強固な培養系を確立することを目指した。
方法
マウスパイエルパッチのトランスクリプトームデータを解析し、M細胞に近接した細胞集団を同定した。ヒト腸管を用い、どのサイトカインがM細胞の分化を誘導するのに必要なのかを明らかにした。トランスクリプトーム、免疫蛍光、走査型電子顕微鏡、トランスサイトーシス実験を行い、表現型的・機能的なヒトM細胞の発生を検証した。
結果
レチノイン酸とリンパ毒素の併用により、頂部微絨毛構造を持たない糖タンパク質2陽性のヒトM細胞の分化が誘導された。ロタウイルス感染後、M細胞内の自然免疫関連遺伝子の発現が上昇し、ウイルス抗原の欠失と相関していた。エンテロイド系で発達したヒトM細胞は、ロタウイルスやレオウイルスなどの腸管上皮のバリアを越えて、エンテロイドに内在化し輸送することがわかった。
結論
腸管M細胞の分化に必要なシグナル伝達経路を同定し、この情報をもとに、ウイルスを内在化し輸送する能力を持つヒトM細胞を開発するための強固な培養法を構築した。このモデルの研究により、ヒト腸管における抗原提示と腸管病原体の全身への侵入に関する理解が深まることが期待される。
キーワード:粘膜免疫、腸管エンテロイド、ロタウイルス

グラフィカルアブストラクト
画像やイラストなどを保持する外部ファイル。
オブジェクト名は nihms-1581364-f0008.jpg です。
はじめに
パイエル板(PP)は、小腸の特殊な腸管関連リンパ組織(GALT)であり、上皮の恒常性、炎症、多くの微生物病原体に対する粘膜防御に重要な役割を担っている1。マイクロフォールドあるいは膜状(M)細胞は、腸管上皮細胞(IEC)のユニークなサブセットであり、PPのドーム状構造の最上部に位置しています2。M細胞は高い貪食性を示し、頻繁に腸管内腔内の抗原を採取し、濾胞上皮(FAE)の下にある抗原提示細胞へ運び、T細胞の活性化とIgA産生を刺激する3。M細胞は、細胞内抗原の取り込みと細胞間結合能により、サルモネラ、赤痢、エルシニアなどの細菌性病原体や、ポリオウイルス、レオウイルスなどの腸管ウイルスが、感染、増殖、全身への拡散を目的として固有層へ到達するためのポータルとなる4-7。
現在の知見は、遺伝子ノックアウトマウスを用いた研究から得られたものが非常に大きい。核因子κB受容体活性化因子(RANK)リガンド(RANKL)の遺伝子欠損、および抗RANKL中和抗体の投与は、いずれもマウスのM細胞の発生を阻害し8、M細胞の分化に必須な最初の分子となった。RANKLに加え、Spi-Bをノックアウトすると生体内のM細胞数が減少し9、マウスの腸管上皮におけるTRAF6、SOX8、S100A4の条件付き欠失も生体内のM細胞の減少につながる10-12。このような進展にもかかわらず、ヒトM細胞発生の分子メカニズムは、適切な細胞培養系がないことが主な原因で、完全には解明されていない。ヒトM細胞培養系の作製に焦点を当てた唯一の報告は、完全なトランスサイトーシス能力を示さず、新鮮な生検試料を用いてのみ行われた13。ごく最近、Ranganathan らは、マウスのM細胞ベースの誘導プロトコルを用いて、ヒト腸管における赤痢菌のトランスサイトーシスを研究している14。
腸管小胞は、IECの系統分化を研究する上で非常に貴重なツールとなっている15, 16。Wnt-3A, R-spondin, Noggin の非存在下で、LGR5+ 幹細胞は、栄養摂取を担う成熟した柱状腸細胞、ムチン分泌性杯細胞、抗菌ペプチド産生パネス細胞、腸神経系へのクロストークを媒介する腸内分泌細胞へ分化する15. WntとR-spondinを除去し、リコンビナントRANKLを添加するとM細胞の分化が誘導されるマウス腸管と比較して9、Wnt/R-spondin除去ヒト腸管へのRANKL添加だけでは、GP2陽性だが機能的に不完全なM細胞の発生を促すようだった13 (後述)、ヒトM細胞のin vitro育成と機能維持にはさらなる要因が必要である可能性を示唆する。本論文では、ヒト腸管培養において機能的なヒトM細胞の分化を促進する、新規で頑健な細胞培養系を説明する。我々のデータは、レチノイン酸(RA)経路とリンパ毒素(LT)を介した非カノニカルNF-κB経路の両方が、表現型および完全機能型ヒト腸管M細胞の発生に重要なシグナル伝達カスケードであることを示唆している。
材料と方法
サイトカインと試薬
リコンビナントヒトIFN-γは、R&Dシステムズから購入した。組換えヒトLT-α2β1(#679-TX-010)、マウスLT-α2β1(#1008-LY-010)、ヒトIL-1β、ヒトIL-22、ヒトWnt-3aおよび抗LT-β受容体抗体(#AF629)もR&Dシステムズから購入した。組換えヒトRANKリガンドはPeproTechから購入した(#310-01)。レチノイン酸(#695)およびRAR阻害剤ER50891、LE135、MM11253、BMS-493は、Tocrisから購入した。レチノールとタモキシフェンはSigma-Aldrichから、RARαアゴニストAM580はWako(Alpha Laboratories)から入手した。赤色蛍光標識カルボキシレート修飾ポリスチレンラテックスビーズ(直径0.5μm)はSigma-Aldrich社から購入した。RelBクロマチン免疫沈降に用いた抗体(sc-226)は、Santa Cruz Biotechnology社から購入した。
ウイルス
ヒトおよび動物のRV株、DLPは既報の通り増殖・調製した。レオウイルスはFrank Ramig(Baylor College of Medicine)博士から贈られた。ヒトRVに対する中和抗体は、我々の研究室で以前に単離され、特徴づけられている17。ヒトRV WI61株VP8に対するヒトモノクローナル抗体(#11)を、以前に特徴づけられたように37℃で1時間、ウイルスとインキュベートした17。アフリカミドリザルMA104腎臓上皮細胞株を用いて、レオウイルスとRVの標準プラークアッセイを既述のように実施した18。ヒトRV WI61株は、ChromaProbe社によりカルボキサミドを介してCy5-SE(mono NHS)で化学標識されたものである。
ヒト腸管エンテロイド
本研究で使用した2種類のヒト回腸由来腸管片(#0881、#14-75)は、スタンフォード大学で結腸鏡検査を受け、インフォームドコンセントを提供した健康な非IBD被験者の非識別組織から得られたものである。すべての実験プロトコルは、「Development of a New Method for Culturing and Growing Human Solid Tumors and Normal Tissues in vitro」と題するeProtocolに基づき、ヒト被験者規制に従い、スタンフォード大学施設審査委員会(IRB #28908)により承認されたものであった。簡単に説明すると、腸管は維持培地(Wnt-3a, R-spondin 3, Noggin を含む L-WRN 調整培地を添加した上級 DMEM/F12 培地)で、24 ウェルプレートの 3D Matrigel 中で培養した18。腸管通過には Y27632 と CHIR99021 を添加した。分化のために、調整培地は組換えタンパク質の形で50% Nogginに置換した。必要な場合は腸管をTrypLEを用いて単細胞に消化し、ROCK Inhibitor Y-27632添加維持培地中でコラーゲンコートしたトランスウェル(0.33cm2、孔径0.4μm、Polycarbonate、Fisher #07-200-147)に24ウェルプレートで播種した。M細胞分化のために、100 ng/ml RANKL、100 nM RA、100 ng/ml LT-α2β1 を通常のDIFF培地に添加した。培地は頂膜側、底膜側ともに1日ごとに交換した。TEERの測定はMillicell ERS Volt-Ohm Meter (Thermo Fisher)を用いて行った。播種後2日目に目視でコンフルエントになり、TEERが300Ω・cm2以上であれば、単層での腸球をM細胞分化に使用した。TEERは、M細胞分化の終了時(播種後5日目)およびウイルス感染後に再度測定した。ビーズ取り込み実験では、各単層に対して100μl中の1X105ビーズを使用し、3時間後に腸管を洗浄・固定した。
明視野および免疫蛍光顕微鏡観察
明視野画像は、腸管を24ウェルプレートで培養し、ECHO REVOLVE4顕微鏡で10倍の対物レンズを使用して撮影した。免疫蛍光法では、腸管を 8 ウェル Nunc チャンバースライド (Thermo Fisher) に播種し、一定の条件下で分化させ、既 に述べたように 4%パラフォルムアルデヒドで固定した19。マウス実験では、129svバックグラウンドの乳飲み子に対し、BMS-493(1μl/g)を1日1回、5日間(生後3日目から7日目まで)i.p. 投与した。BMS-493のストックはDMSOで調製し、注入前にオリーブオイルで希釈した。小腸組織は、凍結切片と染色のためにOCTで採取した。次に、試料を以下の一次抗体または蛍光色素で染色した。DAPI(P36962、Thermo Fisher)、GP2(ヒト用#D277-3およびマウス用#D278-A48、MBL International)、MHC-II(FAB4869P、R&D)およびファロディン(Alexa 647コンジュゲート、Thermo Fisher)であった。染色した細胞はPBSで洗浄し、Antifade Mountantで全体をマウントし、Zeiss LSM 710 Confocal Microscopeでイメージングを行った。ヒト腸管の3次元イメージングには、Z-stackを適用した。ウイルスの可視化実験では、Cy5蛍光標識したヒトRV WI61株(4.58 X108 PFU/ml)を用意した。50μlの標識ウイルスと50μlの無血清DMEM/F12培地を混合し、腸管単層の頂膜側に2時間添加し、PBSで3回洗浄後、ZスタックとYZ平面切片を画像化した。画像はVolocity v6.3 (PerkinElmer)で解析し、CellProfiler (Broad Institute)で定量を行った。
走査型電子顕微鏡による観察
単層で分化したヒト回腸腸管を60mMカコジル酸緩衝液中の2%グルタルアルデヒドで固定し、Bard-Parker Surgical Blades #15で膜を切り取った。その後、サンプルはStanford Cell Sciences Imaging Facilityで処理され、画像化された。簡単に言うと、サンプルは15mmのアルミニウムスタブ(Electron Microscopy Sciences)に導電性銅テープでマウントし、Denton DeskIISputter Coater(Denton Vacuum)を用いて50〜100Åの金-パラジウムでスパッタコーティングを施した。可視化は,Zeiss Sigma FE-SEM (Carl Zeiss Microscopy) を用いて EHT=2.00 kV, Signal A=SE2, Signal B=InLens, WD=10.5 mm, Mag=5,000X で操作し,InLens と SE2 SE 検出を用いて作業距離約9mmで実施した.TIFF画像は2,048×1,536画素の解像度で取り込み、線積分ノイズ低減アルゴリズムで処理した。
統計解析
すべての棒グラフは、平均値±SEMで表示した。図3B, ,4A4A-B, ,7A,7A, ,7E,7E, S7A-B, S7E-Fの統計的有意性は、Prism 8 (GraphPad) を用いてStudentのt検定により算出した。データ Fig.2A-D, ,3A,3A, ,3D,3D, ,3E,3E, ,6C,6C, ,7C,7C, ,7D,7D, S1, S2B, S3, S4, S5A, S5B, および S7C-D における統計的有意性は Prism 8 による一対比較 ANOVA によって算出された。すべてのデータはアスタリスクで示した(*p≦0.05; **p≦0.01; ***p≦0.001).Fig. 1B, ,3E,3E, ,4C,4C, ,5,5, ,6A,6A, ,7A,7A, および S5C 以外のすべての実験は少なくとも3回繰り返されたものである。トランスクリプトーム解析(図1B, ,5,5, and6A)6A)は1回ずつ重複して実施した。

図1.
図1.
パイエルパッチのBst1-Tcf21+線維芽細胞網状細胞はレチノイン酸合成酵素を発現している。
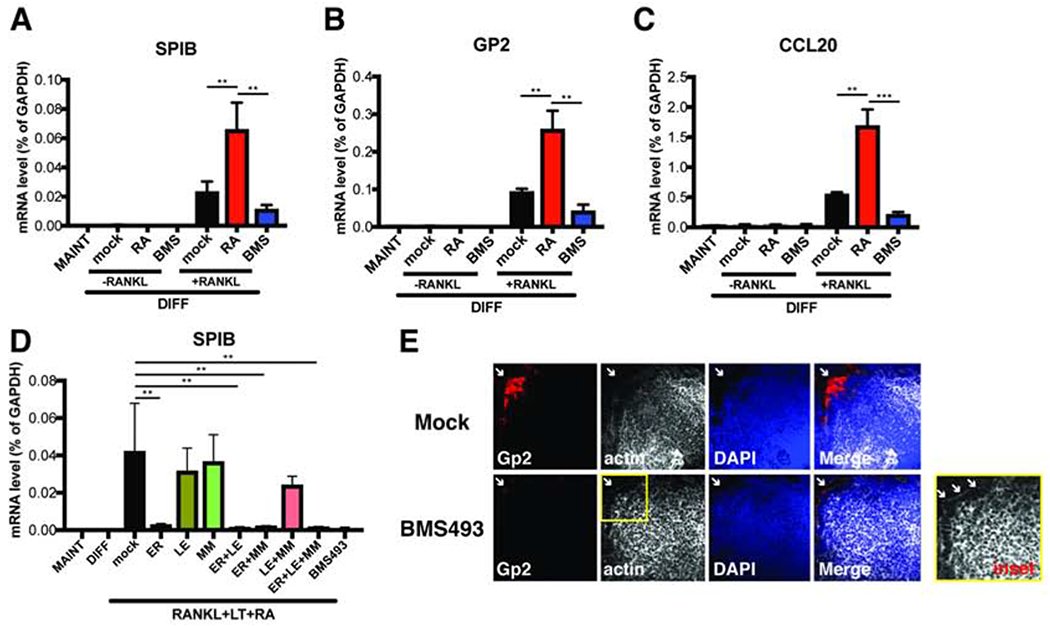
図2.
図2.
レチノイン酸シグナルはヒト腸管におけるM細胞の発生に寄与している

図3.
図3.
NF-κBシグナルはRAシグナルと相乗して、M細胞関連転写産物の発現を促進する

図4.
図4.
ヒトM細胞は、強いGP2染色と微絨毛の消失が特徴である。

図5.
図5.
RNA配列解析により、新規のヒトM細胞マーカーが明らかになった。

図6.
図6.
ヒトM細胞は抗ウイルス状態が上昇している

図7.
図7.
ヒトM細胞は微小粒子を取り込み、腸管ウイルスをトランスシトースする。
研究成果
我々は、細胞培養におけるヒトM細胞の分化を助けるには、PPに存在する追加の細胞関連因子または分泌因子が必要であろうと推論した。この細胞は、Lin、CD31、NCAM、CD35、Bst1(CD157)の染色が陰性であることが特徴であった(図1A)。トランスクリプトーム解析の結果、これらの新たに同定されたBst1-FRCは、RAを産生するための完全な機構を持っていることがわかった(Fig.1B)。ビタミンAは食物から吸収され、生理活性物質であるレチノールとRAに変換される。我々は、RA合成の律速酵素であるAldh1a1、Aldh1a2、Aldh1a3がこれらの細胞で高発現しているが、PPのBst1+FRCや皮膚、腸間膜、膝窩リンパ節などの他の組織の線維芽細胞では発現していないことを発見した(Fig. 1B)。この新しく同定されたBst1-Tcf21+ FRC集団はRankl-Tgrb3+Cxcl13+であり、上皮下ドームのRankl+Tgrb3-Cxcl13-M細胞誘導細胞とは異なる20。PPの深部に位置するCD35+濾胞樹状細胞とは異なり、Bst1-Tcf21+FRCはFAEに物理的に近接している(Fig. 1C)。そこで、FRC由来のRAがM細胞の分化を媒介する可能性があると仮定した。この仮説を検証するために、ヒトの腸管腸管系を利用した。M細胞は小腸の回腸末端に最も多く存在することから21、我々は2人の健常者から得たヒト回腸由来の腸管小胞を用いて、M細胞の分化を研究した。
我々はまず、他の分化したIECサブセットと同様に、幹細胞成長因子の取り込みがM細胞の分化に重要であることを明らかにした。腸管を維持培地や通常の分化培地で培養した場合、M細胞特異的な転写物SPIBは発現しなかった(Fig. 2A)。また、マウス腸管を用いた先行研究9 と同様に、リコンビナント RANKL を補充すると SPIB が発現することから (Fig. 2A)、M 細胞の発生に必須であることが示唆された。脂質欠乏培地を使用しなかったため、適度なレベルのレチノイドが存在した。重要なことは、RANKL処理した腸管にRAを追加するとSPIBレベルが有意に増加することがわかり、RAがM細胞の分化を促進することが示唆された(図2A)。また、RAの前駆体であるレチノールの添加も、より少ない程度ではあるが、SPIBの発現を補助した(図S1A)。一方、汎RA受容体(RAR)22 の低分子アンタゴニストであるBMS-493で腸管を処理すると、SPIBの発現が強く抑制された(Fig. 2A)。RAによる増加とBMS-493による減少は、他の2つのM細胞マーカーGP2とCCL20のレベルでも観察されたことを確認した(図2BおよびC).C)。BMS-493はまた、外因性RAによって誘導されたSPIBの発現を抑制した(図S1B)。SPIB発現の増強は、RA用量依存的に起こり、RA処理の長さとともに増加した(図S1CおよびD)。これらのデータは、RA-RARシグナルが一連のM細胞特異的な転写産物の発現に寄与していることを示唆している。
GP2は、一般にヒトおよびマウスのM細胞の普遍的なマーカーとみなされている23。mRNAの発現と同様に、RANKL処理した腸管ではGP2の染色がまばらで、維持培地や模擬処理した分化培地ではシグナルが見られなかった (Fig. S2A)。驚くべきことに、RANKLとRAで刺激した腸管ではGP2が強く染色され、BMS-493はGP2+ M細胞を強力に抑制した(Fig. S2A)。M細胞の定量は、M細胞関連転写産物のmRNAレベルと並行して行われた(Fig. 2A-C)。RA添加とRA阻害を比較すると、M細胞数に6倍の差があり(図S2B)、M細胞の発生を促進するRAシグナルの役割がさらに支持された。
RAに対するIECの反応にどの特異的RARが関与しているかを明らかにするために、腸管と不死化ヒト細胞株における3つのRAR発現レベルすべてを測定した。RARαとRARβの両方がヒト腸管で高発現していた(図S3A)。また、RARα特異的阻害剤ER50891は、汎RAR阻害剤BMS-493と同様にSPIBの発現を有意に抑制した(図2D)。逆に、RARβ阻害剤LE135およびRARγ阻害剤MM11253は、M細胞の発生を阻止することができなかった(図2D)。一貫して、RARαアゴニストAM580は、かなりの程度、RAと同じ効果を再現し、SPIB発現を促進した(図S3B)。これは、RARαが、ヒトM細胞分化をサポートするためにIECsにおけるRAシグナルの下流の優勢な形式であることを示唆する。マウスM細胞の発生におけるRA-RARAシグナルの役割を調べるために、我々はマウス腸管培養系に目を向けた。C57Bl/6回腸腸管では、RAはSPIBの発現を中程度に増強する効果があった(Fig.S3C)。薬理学的阻害剤を補完するために、ROSA26遺伝子座のドミナントネガティブRARAタンパク質をコードするR26RAR403マウスを、タモキシフェン誘導性でCreリコンビナーゼを発現するNestin-Cre/ET2トランスジェニックマウスと交配させた。遺伝子型を確認した後(図S3D)、これらの回腸腸管で、M細胞前駆細胞であるNestin+腸管幹細胞(データは示していない)にCreの発現を誘導した。タモキシフェンに代わるアプローチとして、腸管にCreをコードしたレンチウイルスを直接導入した。重要なことは、いずれの場合も、RA-RARAシグナルを特異的に阻害するRAR403の発現が、SPIBの発現を著しく低下させたことである(図S3E)。これは、RAR、特にRARAシグナルが、ヒトおよびマウス小腸のM細胞発生に重要であることをさらに裏付けるものであった。マウスにおけるin vivoでの関連性を検証するために、BMS-493の腹腔内感染を用いてRAシグナルを遮断したところ、PPにおけるM細胞数の強い減少に気付いた(図2E)。
腸の発生過程において、PPの形成は、構造的な支持とサイトカインを提供する下層の間質細胞ネットワークに依存している。腸管におけるM細胞誘導を最大化する試みとして、インターロイキン(IL)-1β、LT、腫瘍壊死因子(TNF)-α24を含むPPにおけるサイトカインの幅広い配列をスクリーニングした。LT-α2β1は、IL-1βとは異なり、分化培地でM細胞の発達を促進した(図3A)。TNF-αは、LT-α2β1と同様の効果を示したが、他の炎症性ケモカインの活性化のため、さらなる実験には使用されなかった。SPIB mRNAレベルは、LT-α2β1による刺激後、モックと比較して約8倍アップレギュレートされた(図3A)。LTはRAと同等の効果を示し、2つのシグナル伝達経路は相乗的であった(Fig.) SPIBと同様に、RANKL、RAとLT-α2β1の複合処理では、GP2 mRNAレベルの有意な増強が認められたが、IL-1βは認められなかった(Fig. S4A)。これらの知見に基づき、我々はRANKL、RA、LT-α2β1をM細胞分化レシピとして用いて、残りの実験を実施した。LT-αβヘテロ三量体は、ユニークなレセプターLT-βR25を介してシグナルを送る。我々は、アゴニスティックな抗LTβR抗体がM細胞の分化を促進する能力をテストした。LT-βR抗体は、GP2の発現も誘導した(図S4B)。LTが介在する非カノニカルNF-κBシグナルがM細胞の発生を助けるというメカニズムの役割をさらに解明するために、ヒト腸管でNF-κB誘導キナーゼ(NIK、MAP3K14によってコード化)を標的とするレンチウイルスを使用した。NIKが腸管リンパ濾胞形成に関与しているという最近の報告26と同様に、MAP3K14の遺伝子欠損は染色によるM細胞数の減少をもたらし(図3B)、LT-NIK-RelBシグナルがM細胞の効率的分化に不可欠であることが示唆された。
インシリコ解析により、SPIBの発現を促進するMAP3K14下流の重要な非正規NF-κB転写因子であるRelBの近位プロモーター内に高度に保存されたRA response element (RARE) が存在することが明らかになった(図 3C)27. 実際、LT-α2β1と同様に、程度は低いものの、RAもRelBの発現を増強することができた(図3D)。さらに、クロマチン免疫沈降法を用いると、LT-α2β1との併用により、RelBのSPIBプロモーターへの結合が劇的に増強されることが確認された(図3E)。これらの結果は、RAとNF-κBシグナルがどのように同期して作用し、M細胞の分化を促進するのかについて、新たな分子的洞察を与えるものである。このサイトカインの組み合わせを用いると、腸管幹細胞の特徴であるLGR5のmRNAレベルが有意に上昇することにも注目した(図S4C)。この培養条件は、幹細胞性を促進し、他のIECサブセットの分化を抑制していることが示唆された。実際、3D M細胞含有腸管は、形態学的に未分化腸管に類似している(図S4D)。これらの知見は、M細胞を含むFAEについてin vivoで観察されるもの28を彷彿とさせるものである。これらの類似性にもかかわらず、M細胞の発生は、Wnt-3aによって効果的にブロックされる(図S1B)。一貫して、BMS-493およびER50891がLGR5の発現を阻害し、AM580がLGR5の発現を増強することがわかり、RARαがLGR5の発現を調節している可能性が高いことが示唆された(図S4E-F)。
次に、M細胞の機能的側面を調べるために、IECをコラーゲンコートしたトランスウェルに直接播種する偏光腸管単層培養系に着目した29。単層を維持培地で2日間培養した後、通常の分化培地またはM細胞分化培地に切り替えてさらに3日間培養してから、さらに解析を行った。M細胞の発生は、単層膜の経上皮電気抵抗(TEER)に変化を与えず(図S5A)、タイトジャンクションは無傷のままであることが示唆された。また、エバンスブルー色素を用いたアッセイにより、単層膜の完全性を確認した(Fig. S5B)。重要なことは、M細胞培地刺激IECにおいて、SPIB(1000倍)、GP2(500倍)、およびCCL20(20倍)のレベルが、通常の分化条件と比較して著しく増加することを見出したことである(Fig. 4A)。免疫蛍光法では、単層培養物内に高い割合(〜15%)のGP2+ M細胞が観察された(図4B、上段)。GP2染色は非常に特異的で、アクチン豊富なブラシボーダーを持たない細胞の頂膜に局在していた(図4B、下図および図S5C)。この観察は、M細胞が成熟した吸収性腸管細胞で通常見られる組織化された頂部微絨毛のブラシボーダーを欠いていることを示したin vivoでの先行研究結果を再現するものである30。M細胞の形態が非M細胞IECとは異なることを確実に確認するために、我々は走査型電子顕微鏡(EM)を用いて、成熟腸細胞の頂膜表面を通常覆う微絨毛を可視化した。その結果、通常の分化条件下で発生したIECでは、明確な境界と正常な微絨毛が観察された(図4C、左図)。一方、M細胞は、細胞表面からの密な突起ではなく、中空で隆起した網目構造を特徴とし、顕著な形態的差異を示した(図4C、左図)。同様の表現型の違いは、別のドナーの回腸腸管を用いた分化したM細胞でも検出された(図4C、右図)。転写、免疫蛍光、走査型EM解析を含むこれらの多面的アプローチにより、我々の培養系がヒトIECの真正ヒトM細胞への分化をex vivoでサポートすることが明確に証明された。
M細胞は、抗原提示細胞に直接抗原を提示すると推測される。小腸の病的状態および感染状態を模倣するために31、M細胞濃縮回腸腸をヒトインターフェロン-γ(IFN-γ)で処理した。非M細胞含有ヒト腸管32と同様に、強い主要組織適合性複合体(MHC)クラスII(MHC-II)染色を観察し、重要なことに、GP2とMHC-IIの共局在化を検出しました(図S5D)。これらの結果は、ヒト M 細胞が小腸における MHC-II 制限抗原提示に貢献できるという考えや、ヒト PP の M 細胞における MHC-II 染色の以前の発見と一致する33。
ヒトM細胞のユニークな特性をさらに明らかにするために、我々は3Dマトリゲル中の未分化腸管、分化腸管、M細胞を含む腸管のグローバルなトランスクリプトームを測定するために、バイアスのないRNA配列決定(RNA-seq)を実施しました。Volcanoプロットにより、M細胞を含む腸管で発現が増加している数多くの遺伝子が明らかになった(図5A)。予想通り、M細胞マーカーであるSPIB、GP2、CCL20は、他の2つの集団と比較して、M細胞増強腸管で発現が増加した(図5A)。また、NCF4 (320倍) やGFI1B (31倍) などの既知のマーカーも増加していた9 (Fig. 5B and Dataset S1).一方、ANXA5、SH3KBP19、PGLYRP134など、他のマウスM細胞特異的遺伝子の転写は顕著な増加を示さなかった。この相違は、ヒトとマウスの違いに起因している可能性がある。驚くべきことに、私たちのトランスクリプトーム解析は、UBD、CCL23、IL23A、そして最近発表されたSOX811など、M細胞分化中に少なくとも100倍も増加し、ヒトM細胞特異的であると考えられる新しいマーカーを明らかにした(図5BおよびデータセットS1参照)。これらの結果は、M細胞を含む単層膜のRNA-seq解析の個々のセットで確認した(図5C)。これらの新規M細胞マーカー、特にUBDとCCL23の転写物は、ヒトM細胞含有単層で強くアップレギュレートされていた(図5DおよびデータセットS2)。
驚くことではないが、3Dマトリゲルおよび単層におけるM細胞含有腸管のRNA-seqデータセットは、一緒にクラスタ化された(図S6A)。同様のパターンは、3D Matrigelおよび単層における通常の分化腸管にも観察され、未分化3D腸管は他とは異なるプロファイルを示した(図S6Aおよび図B)。詳細なgene ontology pathway解析により、M細胞含有腸管では免疫反応関連遺伝子が濃縮されていることが明らかになった(図S6C)。その結果、宿主インターフェロン(IFN)発現の重要な制御因子であるSTING(TMEM173によってコードされる)のmRNAレベルが、M細胞分化単層でモックと比較して約240倍増加することがわかった35(図6A)。さらに、IFI6やIFITM1などのいくつかのIFN刺激遺伝子(ISG)も、M細胞状態で発現が上昇した(図6A)。これらの抗ウイルス転写産物が機能的に活性化し、M細胞を生産的なウイルス感染から保護しているという仮説を検証するために、我々は、幼い子供たちに急性胃腸炎と下痢を引き起こす医学的に重要な小腸腸管ウイルスであるロタウイルス(RV)を対照およびM細胞を含む腸管に感染させた36。通常のIECは効率的にRVに感染したが、GP2陽性M細胞と腸管内のRV抗原VP6染色の間には顕著な逆相関が見られた(図6B)。M細胞ではVP6シグナルは観察されず、M細胞ではRVの複製が全くあるいはほとんど行われていないことが示された。M細胞を含む腸管は、全体として、M細胞を含まない腸管に比べてRV感染に対する抵抗性が高くなかった(図6C)。このことは、ヒトM細胞は、サンプリング中にウイルス感染から身を守るために細胞内在性の抗ウイルス防御を増強し、主に免疫細胞への無傷のウイルスまたは他の抗原の導管として機能していると思われることを示唆している。
最後に、M細胞が内腔抗原と相互作用する能力を調べるために、蛍光標識ラテックスビーズが、同じ単層内の非M細胞に比べてGP2+ M細胞に優先的に取り込まれるかどうかを調べた(図7A、左図)。29個のM細胞のうち、15個が少なくとも1個のビーズに陽性であり、GP2陽性のM細胞には、非M細胞に比べて50倍以上の微粒子が局在していることが観察された(図7A、右図)。次に、RVのような生理学的に重要な基質がヒトM細胞にエンドサイトーシスされることを、より視覚的に証明することを目指した。この目標に向けて、Cy5標識RV粒子とGP2共染色を用い、z軸積層ベースの3D再構成とYZ平面切片化により、単層内のGP2+M細胞内の標識ウイルス粒子を直接可視化できた(図7B、下・右パネル、ビデオS1参照)。アクティブなRVの複製は、Cy5で化学的に標識された外側キャプシドタンパク質37の被覆を取り除く必要があるので、これらのデータは、M細胞内の入力RV複製の欠如を示唆している(図6Bに示す)。トランスサイトーシス可能性をさらに調べるために、in vivoでのマウスM細胞輸送の既知の基質であるレオウイルスを、単層膜の頂膜側に添加した7。感染後4時間(hpi)に、新たに合成されたレオウイルス38が放出されるずっと前に、基部側からの培地を採取し、通過する感染性粒子の量を調べるために、プラークアッセイで調べた。その結果、底部チャンバーから約200個の感染性ウイルスが容易に検出された(図7C)。このことから、我々のヒトM細胞は、4時間後の透過性を変化させずに(図S7A)、上皮単層を介してレオウイルスを輸送していることが示唆された。一方、非M細胞分化条件下で培養したIEC単層は、検出可能なレオウイルストランスサイトーシスを全く支持しなかった(図7C)。このことから、RANKL添加腸管13で観察されるGP2陽性細胞は、マイクロビーズを取り込むことはできても、ウイルス粒子のような生理学的に適切な基質をトランスサイトーシスする能力はないことが示唆され、完全に機能するヒトM細胞の発生には、RAとLTの添加が必要であるようである。次に、これらの研究をRVsに拡張した。ロタウイルスのRNAと抗原は感染児の血清中に容易に観察されることから、RVがM細胞を通じて腸管関門を通過する可能性が出てきた39。レオウイルスと同様に、我々はシミリアンRV RRV株がバリア機能に影響を与えることなく、4 hpiでM細胞を含む単層を基底側に効率的に通過することだけを見出した(図7D)(図S7B)。これらの知見は、ヒトM細胞の高度に機能的でエンドサイトーシス的な性質をさらに確認するものである。IL-22がタイトジャンクションタンパク質レベルを変化させ、Il22ra2-/-マウスではPPへの細胞内細菌取り込みがブロックされるという以前の報告40にもかかわらず、我々の腸管培養系では、IL-22はTEERおよびヒトM細胞によるRV輸送速度に変化をもたらさなかった(図S7Cおよび図D)。
驚くべきことに、ヒトRV WI61株を中和ヒトモノクローナル抗体17とインキュベートしたとき、RVは依然として腸管単層を通過した(図7E)、ウイルスRNAコピーで測定すると、このことはトランスサイトーシス過程が、M細胞表面への特定の受容体を介したウイルス結合を必要としない可能性を示唆している。この考えと一致して、我々はさらにRV二重層粒子(DLP)を試験した。DLPは、2つの外側キャプシドウイルスタンパク質を持たないため、腸細胞に結合したり感染したりすることができない41。DLPもまた腸管単層膜のバリアを越えて効率的に輸送されることが確認された(図S7E)。注目すべきは、RVスパイクタンパク質VP4は、ビリオンが完全に感染性を持つようにトリプシン切断を必要とすることである37。我々は、非トリプシン活性化RVのヒトM細胞による効率的な取り込みを観察し、側底室に放出されたウイルスは非開裂型のままであった(図S7F)。これらの知見は、ヒトM細胞の多彩なエンドサイトーシス特性と、ヒトM細胞がウイルスの物理的・化学的性質を明らかに変えることなくウイルスを取り込む可能性があることを強調するものであった。
考察
本研究では、ヒト腸管を操作して、腸管幹細胞を表現型および機能的に有能なM細胞へと分化させた。その結果、ヒトM細胞は直径500 nmの人工微小球を取り込み、レオウイルスやロタウイルスを含む腸管ウイルスを腸管上皮に輸送することができることを報告した(図7)。他のヒト腸管ウイルス(例:アストロウイルス、ノロウイルス)および細菌性病原体(例:赤痢菌、サルモネラ菌)については、まだ検証していない。M細胞基質の非差別的特徴(Fig. 7EおよびS7D)を考えると、これらの他の微生物もヒトM細胞によってエンドサイトーシスされる可能性がある。特に、STINGとISGの発現がM細胞で上昇し(図6A)、RV(図6BおよびC)およびおそらく他の細胞内病原体に対して寛容でなくなっていることは、興味深い。進化の観点から、小腸の重要な出入り口であるM細胞は、腸内環境の監視役として機能しながら、細胞固有の抗ウイルス機構を恒常的に活性化していると推測することは魅力的である。
ヒトとマウスの違いから、私たちのヒトM細胞からマウスのin vivoでの関連性を断定的に導くことは困難である。今後、M細胞欠損マウスを用い、RVの複製や病原性、ウイルス血症や全身への拡がりを直接評価する予定である42, 43。RVに感染したIECはアポトーシスやパイロプトーシスなどの様々な細胞死を起こすが44、このRVに伴う細胞死が上皮のバリアを破り、全身循環にウイルスが侵入する可能性も考えられる。一方、M細胞もまた、生体内でRVが全身に広がるための重要な入り口である可能性があり、この仮説は現在、M細胞欠損動物で検証することができる3。ビタミンAはすべてのトランス型RAの前駆体であることから、我々は今後の研究で、ヒトにおけるビタミンAの欠乏がM細胞数の減少につながるかどうか、また、そのような患者で観察される粘膜免疫のよく知られた欠陥や経口ワクチンに対する反応の弱化に貢献するかどうかを調べたいと考えている45。
より一般的には、ここで述べた我々のM細胞分化システムは、健常者や様々な腸疾患患者に由来するものを含む、事実上すべてのヒト腸管に容易に適用できることが期待される。例えば、セリアック病や大腸炎におけるM細胞の役割については議論のあるところである46。私たちのM細胞誘導性サイトカインの組み合わせは、コントロール、炎症性腸疾患、セリアック病患者からのM細胞を含む腸管を区別し、単一細胞分析を容易にする手段を提供する。M細胞は、特定の誘導条件下で肺や結腸に存在することが知られている23。これらの初代組織オルガノイドから、今回の誘導法を用いてM細胞を培養できるのか、あるいは別の可溶性因子を必要とするのかは、まだ検証されていない。
知っておくべきこと
背景と事情
腸管微小管(M)細胞は、パイエル板の腸管上皮細胞のサブセットであり、粘膜免疫を制御し、内腔抗原の取り込みを媒介する。細胞培養でヒトのM細胞を効率的に発生させることができないため、腸管免疫系の研究が妨げられてきた。
新たな発見
腸管M細胞の分化に必要なシグナル伝達経路を明らかにし、この情報をもとに、トランスサイトーシス能力を持つヒトM細胞の強固な培養方法を開発した。
制限事項
これは、ヒトの消化管におけるウイルスに対する免疫応答のモデルである。このモデルを他の非感染性ヒト腸管疾患の研究に拡張できるかどうかについては、さらなる研究が必要である。
インパクト
このモデルの研究により、抗原提示と病原体のヒト腸管内への侵入に関する理解が深まるかもしれない。
レイ・サマリー
著者らは、珍しい腸管上皮細胞群を培養する新しいシステムを開発し、これを用いてヒト腸管における免疫反応を研究することができる。
補足資料
1
こちらをご覧ください(11M, mov)
2
閲覧はこちら(3.2M, pdf)
3
クリックすると拡大します(16K, docx)
謝辞
助成金による支援
本研究は,米国国立衛生研究所(NIH)よりR01 AI125249,U19 AI116484,およびVA Merit grant GRH0022(H.B.G. に授与)によって支援されている.S.D.はThrasher Research FundのEarly Career Award、Stanford Maternal & Child Health Research InstituteのInstructor Award Program、NIH grants K99/R00 AI135031 and R01 AI150796の助成を受けている。
略号
EM 電子顕微鏡
FAE 濾胞関連上皮
FRC 線維芽細胞網状細胞
GALT 腸管関連リンパ組織
IEC 腸管上皮細胞
IFN-γ インターフェロンガンマ
IL インターロイキン
LT リンパ毒素
M マイクロフォールドまたは膜状
MCi M細胞誘導因子
MHC主要組織適合性複合体(MHC major histocompatibility complex
PP パイエル板
RANK 核因子κBの受容体活性化因子
RA レチノイン酸
RAR レチノイン酸受容体
RARE レチノイン酸レスポンスエレメント
RNA-seq RNA-シークエンス
RV ロタウイルス
TEER 経上皮電気抵抗値
腫瘍壊死因子-α TNF-α
脚注
出版社からの免責事項:この原稿は、出版が承認された未編集の原稿のPDFファイルです。お客様に対するサービスとして、この原稿の初期バージョンを提供しています。この原稿は、コピー編集、組版、校正を経て、最終的な形として出版されます。また、本ジャーナルに適用されるすべての法的免責事項が適用されることをご了承ください。
情報公開
Harry B. Greenbergは現在、以下の企業のコンサルタントをしています。サノフィ、ファイザー、フルジェン、アリディス。その他の著者は利害関係を明らかにしていない。本論文の結果は、NIH、退役軍人省または米国政府の見解を示すものではありません。
記事情報
Gastroenterology誌。著者原稿;PMC 2021 Jul 1で入手可能。
最終編集版として掲載
Gastroenterology. 2020 Jul; 159(1): 214-226.e1.
オンライン公開 2020 Apr 1. doi: 10.1053/j.gastro.2020.03.053
pmcid: pmc7569531
NIHMSID: NIHMS1581364
PMID: 32247021
Siyuan Ding,1,§ Yanhua Song,2,3,4,5, Kevin F. Brulois,2,6 Junliang Pan,2,6 Julia Y. Co,4,7 Lili Ren,8 Ningguo Feng,2,3,4 Linda L. Yasukawa,2,3,4 Liliana Sánchez-Tacuba、2,3,4 Jonathan E. Wosen,7 Elizabeth D. Mellins,7 Denise M. Monack,4 Manuel R. Amieva,4,7 Calvin J. Kuo,9 Eugene C. Butcher,2,6 and Harry B. Greenberg2,3,4,§ 1.
1ワシントン大学セントルイス校分子微生物学教室、ミズーリ州セントルイス、63110
2パロアルト退役軍人研究所,VAパロアルト・ヘルスケア・システム,パロアルト,カリフォルニア州94304,米国
3スタンフォード大学医学部消化器・肝臓学科、スタンフォード、カリフォルニア州94305、米国
4スタンフォード大学微生物・免疫学部、スタンフォード、カリフォルニア州94305、米国
5江蘇省農業科学院獣医学研究所、中国、南京、210014
6スタンフォード大学病理学教室(米国カリフォルニア州スタンフォード、94305
7スタンフォード大学小児科(米国カリフォルニア州スタンフォード、94305
8南京理工大学薬学院 〒211816 中国南京市楠町1-1-1
9スタンフォード大学医学部血液学科、スタンフォード、カリフォルニア州94305、米国
*筆頭著者を共有
§著者らは共同して筆頭著者となる。
著者の貢献
S.D.、K.F.B.、J.P.、E.C.B.、H.B.G.は本研究を構想した。S.D.、Y.S.、L.R.はエンテロイド実験の大部分を実施した。L.S.T.はいくつかのフォーカスフォーミングユニットのアッセイを実施した。K.F.B.、J.P.、E.C.B.はTcf21とFRC関連のFACS、染色、マイクロアレイの実験を行った。N.F.、L.L.Y、C.J.K.はヒト腸管サンプルを提供し、単層実験に協力した。J.E.W. と E.D.M. は MHC-II 抗体を提供し、IFN-γ刺激実験に協力した。J.Y.C.、D.M.M.、M.R.A.は共焦点顕微鏡実験の技術支援を行った。S.D.とH.B.G.は、全著者の貢献と意見により原著論文を執筆し、改訂した。
通信欄 Harry B. Greenberg, M.D., Stanford School of Medicine, Joseph D. Grant Professor of Medicine, Division of Gastroenterology and Hepatology, Professor of Microbiology and Immunology, 291 Campus Dr., LKSC Bldg., Rm LK300F, Stanford University, CA 94305, ude.drofnats@neergbh, 650-725-9722 (phone), 650-725-7368 (fax); Siyuan Ding, Ph.D.., Siyuan Ding, Ph.D., Assistant Professor, Department of Molecular Microbiology, Washington University in St. Louis, 660 S. Euclid Ave., Rm 9220, McDonnell Pediatric Research Building, St. Louis, MO 63110, ude.ltsuw@gnid.nauyis, 314-273-3963 (phone).
著作権表示
出版社の免責事項
この論文の出版社による最終編集版は、Gastroenterologyに掲載されています。
参考文献
Jung C, Hugot JP, Barreau F. Peyer's Patches(パイエル板)。腸の免疫センサー。Int J Inflam 2010;2010:823710. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Jang MH, Kweon MN, Iwatani K, et al. 腸絨毛 M 細胞:粘膜上皮における抗原侵入部位. このような場合、「臓器移植」を行う必要があります。[PMC フリーアーティクル] [PubMed] [Google Scholar] 3.
Rios D, Wood MB, Li J, et al. 腸管M細胞による抗原サンプリングは、常在腸菌に対する粘膜IgA産生を開始する主要な経路である。Mucosal Immunol 2016;9:907-16. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Grutzkau A, Hanski C, Hahn H, et al. Involvement of M cells in the bacterial invasion of Peyer's patches: a common mechanism shared by Yersinia Enterocolitica and other enteroinvasive bacteria(パイエル板への細菌侵入におけるM細胞の関与:エルシニア腸管侵入菌と他の腸管侵入菌に共通のメカニズム). Gut 1990;31:1011-5. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Jepson MA, Clark MA. サルモネラ感染症におけるM細胞の役割。Microbes Infect 2001;3:1183-90. [PubMed] [Google Scholar] 5.
Sicinski P, Rowinski J, Warchol JB, et al. Poliovirus type 1 は腸の M 細胞を通してヒトの宿主に侵入する。Gastroenterology 1990;98:56-8. [PubMed][Google Scholar].
Wolf JL, Rubin DH, Finberg R, et al. Intestinal M cells: a pathway for entry of reovirus into the host.(腸管 M 細胞:レオウイルスの宿主への侵入経路). サイエンス 1981;212:471-2. [PubMed] [Google Scholar].
RANKL は、腸管上皮における抗原サンプリング M 細胞の発生を開始するのに必要かつ十分である。J Immunol 2009;183:5738-47. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lgr5(+)幹細胞由来のパイエル板M細胞は、SpiBを必要とし、培養「ミニガット」中のRankLによって誘導される。Mol Cell Biol 2012;32:3639-47. [PMC フリーアーティクル] [PubMed] [Google Scholar].Kanaya T, Sakakibara S, Jinnohara T, et al. 腸管M細胞および濾胞関連上皮の発生は、TRAF6を介したNFkappaBシグナルによって制御される. J Exp Med 2018;215:501-519. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Kimura S, Kobayashi N, Nakamura Y, et al. Sox8 is essential for M cell maturation to accelerate IgA response after the early stage in the weaning in mice. J Exp Med 2019;216:831-846. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kunimura K, Sakata D, Tun X, et al. S100A4 Protein Is Essential for the Development of Mature Microfold Cells in Peyer's Patches. Cell Rep 2019;29:2823-2834 e7. [PubMed][Google Scholar].
Rouch JD, Scott A, Lei NY, et al. Primary Human Enteroidsにおける腸管幹細胞からの機能的マイクロフォールド(M)細胞の発生. PLoS One 2016;11:e0148216. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ranganathan S, Doucet M, Grassel CL, et al. Evaluating Shigella flexneri Pathogenesis in the Human Enteroid Model.(ヒト腸管モデルにおけるシゲラ菌の病原性の評価). Infect Immun 2019;87. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 2009;459:262-5. [PubMed] [Google Scholar].
Wnt依存性幹細胞ニッチ内でのin vitro腸管上皮の持続的な培養。Nat Med 2009;15:701-6. [PMC free article] [PubMed] [Google Scholar].
Nair N, Feng N, Blum LK, et al. VP4- and VP7-specific antibodies mediate heterotypic immunity to rotavirus in human. Sci Transl Med 2017;9. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Saxena K, Blutt SE, Ettayebi K, et al. Human Intestinal Enteroids: a New Model To Study Human Rotavirus Infection, Host Restriction, and Pathophysiology. J Virol 2015;90:43-56. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ding S, Diep J, Feng N, et al. STAG2欠損はcGAS-STING経路を介してインターフェロン応答を誘導し、ウイルス感染を制限する。Nat Commun 2018;9:1485. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Nagashima K, Sawa S, Nitta T, et al. IgAを誘導し腸内細菌叢を多様化させる上皮下間葉系細胞の同定. Nat Immunol 2017;18:675-682. [PubMed][Google Scholar].
Miller H, Zhang J, Kuolee R, et al. Intestinal M cells: the fallible sentinels? 世界J Gastroenterol 2007;13:1477-86。[PMC無料記事] [PubMed][Googleスカラー]。
レチノイン酸はセルトリ細胞のパラクリンシグナルを誘導し、精原細胞を分化させるが、精母細胞の減数分裂は細胞が自律的に駆動する。教授Natl Acad Sci U S A 2012;109:16582-7。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Lo DD. Vigilance or Subversion? 粘膜組織における恒常性M細胞と誘導性M細胞。Trends Immunol 2018;39:185-195。[PubMed】【Google Scholar】。
Wood MB, Rios D, Williams IR. TNF-αは腸管培養物におけるRANKL依存性の腸管M細胞分化を増強する。Am J Physiol Cell Physiol 2016;311:C498-507. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Crowe PD, VanArsdale TL, Walter BN, et al. A lymphotoxin-beta-specific receptor(リンパ毒素β特異的受容体). サイエンス 1994;264:707-10. [PubMed][Google Scholar].
Ramakrishnan SK, Zhang H, Ma X, et al. Intestinal non-canonical NFkappaB signaling shapes the local and systemic immune response.腸の非正規NFkappaBシグナルは、局所および全身免疫反応を形成する。Nat Commun 2019;10:660. [PMC無料論文] [PubMed] [Google Scholar].
木村聡、山上・木村美樹、小畑裕之、他 マウスM細胞の分化過程全体の可視化:セカールパッチにおける成熟抑制. Mucosal Immunol 2015;8:650-60. [PubMed][Google Scholar].
Nakamura Y, Kimura S, Hase K. M cell-dependent antigen uptake on follicle-associated epithelium for mucosal immune surveillance.粘膜免疫監視のためのM細胞依存的抗原取り込み.粘膜免疫監視のためのM細胞依存的抗原取り込み. Inflamm Regen 2018;38:15. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ettayebi K, Crawford SE, Murakami K, et al. 幹細胞由来ヒト腸管におけるヒトノロウイルスの複製. サイエンス2016;353:1387-1393. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ベネットKM、ウォーカーSL、ローDD. 上皮微絨毛は、微生物付着に対する静電バリアを確立する。Infect Immun 2014;82:2860-71. [PMC無料記事] [PubMed] [Google Scholar].
Thelemann C, Eren RO, Coutaz M, et al. Interferon-gamma induce the expression of MHC class II on intestinal epithelial cells and protects mice from colitis. PLoS One 2014;9:e86844. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wosen JE, Ilstad-Minnihan A, Co JY, et al. Human Intestinal Enteroids Model MHC-II in the Gut Epithelium.(ヒト腸管上皮のMHC-IIモデル)。Front Immunol 2019;10:1970. [PMCフリーアーティクル] [PubMed] [Google Scholar].
名倉 浩、大谷 浩、増田 孝、他:パイエル板上のM細胞におけるHLA-DR発現はヒト小腸の共通の特徴である。Acta Pathol Jpn 1991;41:818-23. [PubMed] [Google Scholar].
Wang J, Gusti V, Saraswati A, et al. マウス粘膜上皮におけるM細胞系譜の収束と発散。J Immunol 2011;187:5277-85. [PMC フリーアーティクル] [PubMed] [Google Scholar].
石川秀樹, バーバーGN. STINGは小胞体アダプターであり、自然免疫シグナルを促進する。Nature 2008;455:674-8. [このような場合、「痒いところに手が届く」状態でなければならない。
Estes MKG, H. B Rotaviruses In: Knipe DM, Howley PM, et al.編。フィールズ・バイロロジー、第6版、1347-1401頁。Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2013. [Google Scholar].
Dormitzer PR, Nason EB, Prasad BV, et al. Non-envelopedウイルスの膜貫通タンパク質における構造的再編成。Nature 2004;430:1053-8. [PMC フリーアーティクル] [PubMed] [Google Scholar].
このような場合、「痒い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」。Annu Rev Biochem 1976;45:375-408. [PubMed][Google Scholar] 38.
Blutt SE, Kirkwood CD, Parreno V, et al. Rotavirus antigenaemia and viraemia: a common event? Lancet 2003;362:1445-9. [PubMed][Google Scholar].
Jinnohara T, Kanaya T, Hase K, et al. IL-22BP dictates characteristics of Peyer's patch follicle-associated epithelium for antigen uptake. J Exp Med 2017;214:1607-1618. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bass DM, Baylor MR, Chen C, et al. Liposome-mediated transfection of intact viral particles reveals that plasma membrane penetration determines permissivity of tissue culture cells to rotavirus.リポソームを介した無傷のウイルス粒子のトランスフェクションは、ロタウイルスに対する組織培養細胞の透過性を決定していることを明らかにした。J Clin Invest 1992;90:2313-20. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ramig RF. 腸管および全身性ロタウイルス感染症の病原体。J Virol 2004;78:10213-20. [PMC フリーアーティクル] [PubMed] [Google Scholar] 42.
Fenaux M, Cuadras MA, Feng N, et al. BALB/c マウスにおける相同 EC ロタウイルス株および異種アカゲロウイルス株の腸管外拡散および複製。J Virol 2006;80:5219-32. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhu S, Ding S, Wang P, et al. Nlrp9b inflammasome restricts rotavirus infection in intestinal epithelial cells. ネイチャー 2017;546:667-670. [PMC フリーアーティクル] [PubMed] [Google Scholar].
モーラJR、岩田真一、フォン・アンドリアンUH. 免疫系におけるビタミン効果:ビタミンAとDが主役。Nat Rev Immunol 2008;8:685-98。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Bennett KM, Parnell EA, Sanscartier C, et al. Induction of Colonic M Cells during Intestinal Inflammation(腸管炎症における大腸M細胞の誘導). Am J Pathol 2016;186:1166-79. [PMC free article] [PubMed] [Google Scholar].
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
