カルスγδT細胞および微生物誘導腸管Th17細胞はマウスの骨折治癒を改善する
カルスγδT細胞および微生物誘導腸管Th17細胞はマウスの骨折治癒を改善する
https://www.jci.org/articles/view/166577
Hamid Y. Dar,1,2 Daniel S. Perrien,1,2 Subhashis Pal,1,2 Andreea Stoica,1,2 Sasidhar Uppuganti,3 Jeffry S. Nyman,3,4 Rheinallt M. Jones,2,5 M. Neale Weitzmann,1,2,6 および Roberto Pacifici1,2,7
2023年3月7日発行 - 詳細はこちら
PDFを見る
関連記事
T細胞は腸内細菌叢の助けを借りて骨折を治す
ラジーヴ・アウロラ、マシュー・J・シルヴァ
解説
アブストラクト
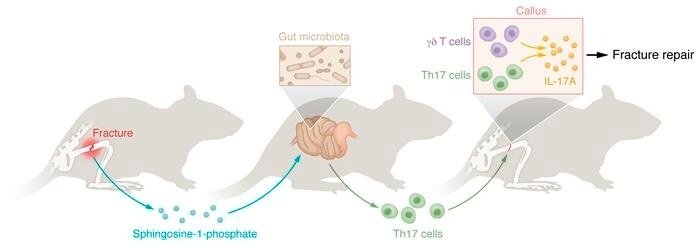
骨折修復の炎症期のドライバーであるIL-17A(IL-17)は、γδT細胞やTh17細胞を含むいくつかの細胞系によって局所的に産生される。しかし、これらのT細胞の起源や骨折修復との関連性は不明である。ここでは、骨折によってカルスγδT細胞が急速に拡大し、全身的な炎症が促進されることで腸管透過性が亢進することが示された。また、微生物叢にTh17細胞誘導タクソンのsegmented filamentous bacteria(SFB)が含まれている場合、γδT細胞の活性化に続いて、腸内Th17細胞の拡大、カルスへの移動、そして骨折修復の改善が見られた。骨折は、S1P受容体1を介したTh17細胞の腸からの排出を増加させ、CCL20を介したメカニズムでカルスへのホーミングを促進させることがメカニズム的にわかった。骨折の修復は、γδT細胞の欠失、抗生物質(Abx)によるマイクロバイオームの枯渇、腸からのTh17細胞の退出の遮断、またはAbによるTh17細胞のカルスへの流入の中和によって損なわれた。これらの知見は、骨折の修復にマイクロバイオームとT細胞輸送が関連することを示すものである。Th17細胞誘導細菌療法によるマイクロバイオーム組成の改変と、広域スペクトルAbxの回避は、骨折治癒を最適化する新規治療戦略である可能性がある。

図版の概要
はじめに
骨折の治癒は、いくつかの連続した段階を含む複雑なプロセスである(1)。まず、損傷部付近の血管が破裂して血腫が形成され、そこに免疫細胞(1)が急速に浸潤してサイトカインを放出し、局所および全身性の炎症が惹起される(2)。炎症性局所微小環境は、破片の除去を促進し、間葉系前駆細胞をリクルートするケモカインを活性化し、炎症を解決し、修復期を開始する(3, 4)。
IL-17は、骨損傷直後に高発現するサイトカインである。骨折治癒の初期段階において、骨前駆細胞数を増加させることで骨再生を促進する(5, 6)。また、IL-17は、TNF-α(TNF)、IL-1、IL-6などの骨折修復過程に関与する他の因子の分泌を誘導する(7-9)。ドリルホール損傷モデルを用いた研究では、IL-17を欠損したマウスでは治癒が損なわれており(6)、骨折治癒におけるIL-17の関連性を支持する所見である。しかし、軟骨内骨形成(骨欠損部内に軟骨が形成され、その後骨に置換される過程)によって修復される骨折におけるIL-17の役割については、まだ明らかにされていない。
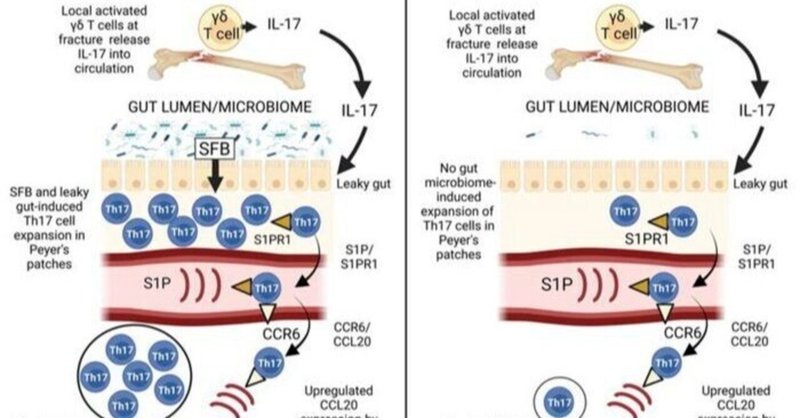
IL-17の供給源はγδT細胞であるが、これらの細胞の骨折修復における正確な役割は、有益な効果と好ましくない効果の両方が報告されているため、まだ定義されていない(6、10)。骨折治癒に関係するγδT細胞の起源も不明である。γδT細胞は筋骨格系組織に存在し、骨折部位で放出される損傷関連分子やストレス誘発性の自己抗原によって速やかに活性化される(6)。しかし、γδT細胞は腸管上皮組織にも多く存在し、上皮バリアの維持に貢献している(11, 12)。腸管γδT細胞は、腸内細菌叢によって活性化・極性化され(13、14)、また、前庭に移動する能力を有している(15)。腸管γδT細胞がカルスに移動し、骨折修復の炎症期に寄与するかどうかは今のところ不明である。
Th17細胞は、IL-17を放出する能力によって定義されるCD4+T細胞の一系統であり、炎症時のIL-17の主要な供給源である(16-18)。しかし、骨折修復に対するTh17細胞の寄与は未だ不明である。マウスでは、Th17細胞は、微生物叢の特定の要素に応答して、ほとんどが腸のラミナプロプリアで産生される(19-21)。健康なマウスでは、芽胞形成性のグラム陽性常在菌である分生糸状菌(SFB)(19)によって、腸内Th17細胞の分化が誘導されることがある(20、21)。さらに、Candida albicansやCitrobacter rodentiumなどの細胞外病原体の感染も、腸組織におけるTh17細胞の拡大を活性化する。ヒトでは、約20種類の非ウイルス性腸内細菌株がTh17細胞の分化を誘導することが知られているが、健常人におけるその頻度はまちまちである(22、23)。動物およびヒトの研究から、骨折などの炎症状態が腸の透過性を高め(24-28)、その結果、腸管上皮を越えて細菌が移動し、T細胞が活性化する(29、30)ことが分かっている。腸管透過性の増加は、さらに腸管Th17細胞(31)やγδT細胞(13、14)の膨張を促進する。Th17細胞はスフィンゴシン1リン酸(S1P)受容体1(S1PR1)を発現し、循環するS1PR1リガンドS1Pに引き寄せられて腸管関連リンパ組織から排出される(32)。循環系に入ると、Th17細胞は遠くの末梢の炎症部位に帰巣する。例えば、卵巣摘出術(31)や副甲状腺ホルモン(PTH)に反応して、腸のTh17細胞は骨髄(BM)へ移動する(33)。同様に、自己免疫疾患における研究では、Th17細胞が腸から肺、腎臓、関節に移動することが示されている(34-36)。Th17細胞の炎症末梢部へのホーミングは、炎症部位でTNFによって誘導されるTh17細胞受容体CCR6のリガンドであるCCL20によって推進される(37-39)。
Th17細胞が骨折修復に不可欠なIL-17の供給源となるかどうかは、現在のところ不明である。また、骨折修復に関与するTh17細胞が骨折部位に由来するのか、それともまず腸管で産生され、その後カルスに帰巣するのかについても不明である。そこで我々は、腸内γδT細胞やTh17細胞の生成、カルスへのホーミング、骨折修復における役割について、腸内細菌叢と腸管透過性の役割を検討した。我々は、骨折が最初にカルスγδT細胞を活性化することを示した。一部のカルスγδT細胞は腸に由来するが、骨折によって腸のγδT細胞のBMへのホーミングが増加することはなかった。骨折による腸管透過性の亢進によって引き起こされた全身性の炎症は、微生物に依存したプロセスで腸管Th17細胞の拡大をもたらし、その後、カルス炎症によって誘導されたケモカイン勾配に沿ってカルスへの移動が起こったと考えられる。さらに、腸からのTh17細胞の排出を遮断すること、あるいはカルスへのTh17細胞の流入を遮断することで、カルスTh17細胞の拡大が妨げられ、骨折の修復が損なわれることが示された。以上のことから、γδT細胞と腸管Th17細胞から産生されるIL-17が、骨折修復の最適化に極めて重要な役割を果たすことが示された。
研究成果
SFBを含むマイクロバイオームは、骨折によって誘導されるカルスおよび腸管サイトカインの産生を増強する。骨折修復の炎症段階におけるTh17細胞誘導菌SFBの寄与を明らかにするため、SFBを欠損した雌のC57BL/6マウスをThe Jackson Laboratoryから購入した(以下、SFB- JAXマウスと称する)。次に、既述のようにSFBモノクロナイズマウスから採取した糞便ペレットの液体懸濁液をSFB- JAXマウスに経口投与することによりSFB+ JAXマウスを作製した(31、33)。SFB+マウスは腸のTh17細胞が多く発生するが、SFB-マウスは腸のTh17細胞が少ない(31, 33)。一部のマウスは、骨折誘発の7日前から実験期間中、吸収性広域抗生物質(Abx)(1 mg/mL ampicillin, 0.5 mg/mL vancomycin, 1 mg/mL neomycin sulfate, and 1 mg/mL metronidazole dissolved in water)で処置して腸内細菌叢を破壊した(31,33)。対照マウスには滅菌水を投与した(Abxは投与しない)。Abx処理により、SFB+マウスとSFB-マウスの両方で腸内細菌叢の99%以上が消失し(補足図1A;本論文とともにオンラインで入手できる補足資料;https://doi.org/10.1172/JCI166577DS1)、以前の報告(33、40)の結果が確認された。
大腿骨骨折は、12週齢の雌マウスで大腿骨を3点曲げすることで誘発した。骨折の安定化は、骨折時に軸方向のアライメントを維持し、大きな変位を避けるために、骨折前に髄内ピンを挿入することで達成した。次に、骨折後7日目(PF)までの摘出カルス組織におけるサイトカイン転写レベルを測定した。Abxを投与していないSFB+ JAXマウスでは、PF3日目にIl17a、Tnf、Il1b、Il6の転写レベルの上昇が確認された(図1A)。Abx処理は、測定されたすべてのサイトカイン転写物の骨折誘発性増加を鈍化させ、マイクロバイオームが骨折に対する初期炎症反応を増加させたことを示している。一方、SFB-マウスでは、骨折によって3日目にTnfとIl1bの発現がより小さく増加したが、Abxによって鈍化しなかったことから(図1A)、骨折がSFB依存的なメカニズムによってカルスのサイトカインを大きく変化させていることが示唆された。これらのデータは、Th17細胞を誘導することができる腸内細菌集団が存在すると、骨折カルスにおける炎症性サイトカインの産生が促進されることを示唆している。骨折によって誘発されるカルスサイトカインレベルの変化は、小腸(SI)におけるサイトカイン発現の同様の変化によって反映された。SFB+マウスでは、骨折の後、PF3日目にSIのIl17a、Tnf、Il1b、Il6転写物の発現が増加し、これはAbxによってブロックされた(図1B)。SFB-マウスでは、骨折によってSI Tnf転写物の発現レベルのみが上昇し、このような上昇はAbxによって阻止されなかった(Figure 1B)。
図1
カルスおよび腸の炎症性サイトカイン転写物、ならびにカルスおよび腸のγδT細胞およびTh17細胞の相対数に対する骨折およびAbx誘発微生物叢枯渇の影響。(A)SFB+およびSFB-JAXマウスのカルスにおけるIl17a、Tnf、Il1b、およびIl6の転写物のレベルに対する骨折の影響。(B)SFB+およびSFB-JAXマウスのSIにおけるIl17a、Tnf、Il1b、およびIl6転写物のレベルに対する骨折の影響。(C)SFB+およびSFB-JAXマウスのカルスおよびPPにおけるγδT細胞(CD3ε+CD45+TCRγδ+)およびTh17細胞(TCRβ+CD45+CD4+IL-17A+)の相対頻度に及ぼす骨折の影響。12週齢の雌性SFB+ JAXマウスおよびSFB- JAXマウスで大腿骨骨折を誘発した。骨折手術の1週間前から広域抗菌薬による治療または非治療を行った。骨折手術後3日間、毎日PPとカルス細胞を回収し、フローサイトメトリーで解析した。時間0は無傷の骨を示す。n = 5マウス/グループ。データは、平均値±SEMで表される。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布し、多重比較のためのポストホックボンフェローニ補正を伴う2ウェイANOVAによって分析した。表示されたグループと比較して、*P < 0.05, **P < 0.01, ***P < 0.001, および ****P < 0.0001. 有意でない比較は示していない。
SFB+マウスの追加系統におけるAbxの効果を調べ、サイトカイン発現に対する吸収性Abxの効果が、Abxのオフターゲット効果ではなく、腸内細菌に対する直接効果から生じることを確認するために、Taconic社からSFB+マウス(以下、TACマウスと称する)を購入した。TACマウスには、骨折誘発の1週間前から、実験期間中、2種類の非吸収性Abxの還元カクテル(2mg/mL硫酸ネオマイシン、2mg/mLバシトラシンを飲料水に溶解したもの)を投与しました。糞便細菌特異的DNAの解析から、非吸収性Abxは、コントロールと比較して99%以上腸内細菌叢を消失させるため、ブロードスペクトラムAbxと同等の効果があることがわかった(補足図1B)。マウスに骨折をさせ、PF3日目と7日目にカルスとSIでサイトカイン転写量を測定した。非Abx処理TAC SFB+コントロールマウスでは、カルスおよびSIのIl17a、Tnf、Il1b、およびIl6の転写物発現レベルは3日目のPFで増加した(補足図2、AおよびB)。非吸収性Abxによる処置は、測定されたすべてのサイトカイン転写レベルの骨折誘発性の増加を鈍化させた。非吸収性Abxと広域Abxはともにサイトカイン発現を変化させる効果があったため、Abxの活性がこれらの薬剤の標的外効果によるものであるとは考えにくかった。
フローサイトメトリーによる細胞内サイトカイン産生のさらなる解析により、骨折はPF3日目にSFB+マウスのPPおよびカルス細胞においてIL-17、TNF、IL-1β、IL-6タンパク質の細胞内産生を増加したが、SFB-マウスではそうではなかった(補足図3、A-D)。
骨折は、微生物に依存しないγδT細胞の膨張と微生物に依存するTh17細胞の膨張を誘導した。骨折による炎症性サイトカインの産生に対するT細胞の寄与を調べるため、カルス組織とPPから細胞を採取し(PPではマウス1匹あたりのT細胞収量が高いため、固有層とは異なる)、フローサイトメトリーで分析した。これらの研究から、骨折によってカルスγδT細胞(CD3ε+CD45+TCRγδ+細胞)が増加し、PF1日目から始まることが判明した。カルスγδT細胞の拡大は、SFB+マウスとSFB-マウスの両方で起こり、PPγδT細胞の頻度の変化とは関連しなかった(図1C)。カルスγδT細胞の拡大には、PPおよびカルスTh17細胞(TCRβ+CD45+CD4+IL-17A+細胞)の増加が続いていた。これらの細胞の増加は、3日目のPFで起こり、SFB+マウスにのみ見られた(図1C)。これらの知見は、γδT細胞が組織損傷に応答して局所的に拡大し、骨折修復のごく初期段階に寄与するのに対し、カルスTh17細胞は離れた部位で発生し、その後カルスに移動するという概念と一致する。
さらに研究を進めると、骨折によってSFB+マウスとSFB-マウスのPPではなくカルスでγδT細胞が増加することが確認された(図2、AおよびB)。さらに、AbxはPPのγδT細胞の頻度を減少させたが(図2B)、骨折によって誘発されるカルスγδT細胞の変化には影響を与えなかった(図2A)。これらの結果から、腸管γδT細胞の分化は、少なくとも部分的には微生物叢に依存しているのに対し、カルスγδT細胞の頻度は微生物叢に依存しないことが示されました。これらのデータを総合すると、カルスγδT細胞の大部分は腸に由来しないことが示唆された。さらに、SFB+マウスでは、骨折するとカルスとPP Th17細胞が増加し、これはPF3日目にピークに達し、Abx処理により鈍化した(図2、CおよびD)。一方、SFB-マウスでは、骨折の後、PPやカルスTh17細胞の増加は見られなかった(図2、CおよびD)。PPおよびBMのTh17細胞(CD45+CD3+CD4+IL-17A+細胞)をさらに解析したところ、骨折の後には、カルスおよびPPのエフェクターメモリー(CD44+CD62L-CD127+)、組織常駐メモリー(CD44+CD62L-CD69+)、セントラルメモリー(CD44+CD62L-CD127+)およびエフェクター(CD44+CD62L-CD127-)Th17細胞が比較的増加して、増加は3日目にピークは来た(補足図4と5)。これらのデータを総合すると、骨折が腸管およびカルスTh17細胞を拡大するためには、SFBを含むマイクロバイオームが必要であることが示された。
図2
WTおよびγδT細胞-/-マウスのカルスおよび腸管γδT細胞、Th17細胞、腸管透過性に対する骨折およびAbxによる微生物叢の枯渇の影響。12週齢の雌性SFB+ JAXマウス、SFB- JAXマウス、およびγδT細胞欠損株であるSFB+ Tcrd-/-マウスで大腿骨骨折を誘発した。SFB+ JAXマウスとSFB- JAXマウスは、骨折手術の1週間前から広域Abxで治療するかしないかを決定した。A)カルスγδT細胞(CD3ε+CD45+TCRγδ+細胞)、(B)PPγδT細胞、(C)カルスTh17細胞(TCRβ+CD45+CD4+IL-17A+細胞)、および(D)PP Th17細胞の頻度.(E)Tcrd-/-マウスのカルスとPPのTh17細胞。(F)SFB+WTマウスとSFB+Tcrd-/-マウスの腸管透過性。腸管透過性は、血清LPS濃度およびFITC-デキストラン吸収量により評価した。データは、平均値±SEMで表される。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布し、2ウェイANOVAおよび多重比較のためのポストホックボンフェローニ補正によって分析された。**P<0.01、***P<0.001、***P<0.0001は、指示したグループ(A-E)または無傷の骨(F)と比較した。有意でない比較は示していない。
γδT細胞とTh17細胞の時間的関係をさらに調べるために、SFB+ Tcrd-/-マウスとSFB+ WTコントロールマウスで試験を実施した。Tcrd-/-マウスは、γδT細胞が全く存在しない。これらのマウスでは、骨折によってカルスとPP Th17細胞の頻度が拡大せず(図2E)、その後のTh17細胞の拡大にγδT細胞が必要であることが示された。カルスにおけるγδT細胞の活性化と拡大、およびその結果生じるIL-17のγδT細胞産生は、骨折修復の初期段階における全身性炎症の極めて重要なドライバーである(10)。さらに、全身的な炎症の結果として、腸管透過性の増大が挙げられる(24-27)。そこで、腸管透過性の2つの確立されたマーカーである血清LPSとFITC-デキストラン吸収量を測定したところ(41, 42)、骨折によって腸管透過性が増加し、WTマウスではPF3日目にピークを迎えた(図2F)。リーキーガット表現型の誘導におけるγδT細胞の極めて重要な役割を確認するために、Tcrd-/-マウスでは骨折が腸透過性を増加させることはなかった(図2F)。WTマウスでは、腸管透過性は腸管Th17細胞の最大膨張に対応する時間にピークを示し、腸管透過性の増加がSFBのTh17細胞産生誘導能を増強するという以前の報告(31)を確認する所見であった。
そこで、SFB+TACマウスに非吸収性Abxを投与し、確認試験を実施した。Abx非投与のコントロールでは、骨折は3日目にカルスでγδT細胞が増加していたが、PPでは増加していなかった(補足図2C)。非吸収性AbxはPPのγδT細胞の頻度を減少させたが、骨折によって誘発されたカルスγδT細胞の変化を変化させなかった(補足図2C)。さらに、骨折はPF3日目にカルスとPPのTh17細胞の増加をもたらし、これは非吸収性Abxによる処理によって鈍化した(補足図2D)。これらの知見を総合すると、AbxがγδT細胞およびTh17細胞の頻度に影響を与える能力は、これらの薬剤のオフターゲット効果によるものではないことが示された。
骨折は、SIからカルスへのTh17細胞の輸送を増加させる。SFBは、抗原特異性を重視したTh17細胞を誘導することが知られている。その結果、SFB+マウスのlamina propriaで産生されるTh17細胞のほとんどは、そのTCRレセプターにVβ14鎖を含んでいる(43)。フローサイトメトリー分析により、骨折はSFB+マウスのカルス組織においてVβ14+Th17細胞の数を増加させ、この効果はブロードスペクトラムAbxにより消失した(補足図6A)。対照的に、骨折はSFB-マウスのカルス組織でVβ14+Th17細胞を拡大することができなかった(補足図6B)。カルスに腸由来のTh17細胞が存在することは、Th17細胞が腸からカルスに移動するという仮説を支持するものである。T細胞輸送に対する骨折の影響を直接調べるために、C57BL/6 Kaedeマウスを使用した(44)。この系統は、表面表示マーカーや細胞内マーカーで定義できるあらゆる白血球細胞タイプの、腸から解剖学的に離れた部位への移動を追跡するための高感度な手段を提供するものである。Kaedeマウスは、近紫外線(350-410nm)で光活性化すると、蛍光発光が緑(518nm)から赤(582nm)に永久的に変化する光変換タンパク質Kaedeをユビキタスに発現しています。腸内で光変換された赤色蛍光細胞は、他の臓器でもフローサイトメトリーで検出・計数することが可能です。細胞内楓の光変換は、細胞機能やT細胞のホーミング能力に影響を及ぼさない(45)。以下、光変換された細胞をKaedeR細胞と呼ぶことにする。私たちの動物園に設置された楓マウスのオリジナルコロニーは、SFB-であった。Th17細胞が腸内で増殖するモデルを利用するため、定法により、あらかじめSFBでモノクロナイズしたマウスの便の液体懸濁液をマウスにガバージュしてSFB+Kaedeマウスを作製した(33)。
骨折がカルスへの腸管T細胞移動に及ぼす影響を調べるため、12週齢の雄SFB+Kaedeマウスに大腿骨の閉鎖骨折を誘発した。2日後、4個のPPを外科的に露出させ、390nmの光を2分間ずつ照射して光電変換させた。他の細胞が光電変換されないことを確認するため、マウス全体をアルミホイルで覆った。24時間後、PPとカルスT細胞を回収し、先行研究で確立された方法(31)を用いて、KaedeR αβ T細胞、Th17細胞、γδ T細胞の頻度をフローサイトメトリーで測定した。光変換した腸管細胞のみが赤く蛍光を発するため、この方法では、前24時間にカルスに移動した腸管T細胞の数を測定することができる。光電変換したPPは4個だけであったため、カルス中のKaedeR T細胞の割合は低かったが、すべてのPPと他の腸管リンパ組織からのT細胞はカルスに移動する。採取したPP組織の大きさは様々であるため、PP細胞の絶対数の計算は不正確であったため、PP KaedeR T細胞は全細胞に対する割合としてのみ定量化した。骨折は、PPのKaedeR αβ T細胞およびTh17細胞の数を減少させた(図3、AおよびB、ならびに補足図7)。対照的に、骨折はカルスにおけるこれらの細胞系列の頻度を増加させ(図3、AおよびB、ならびに補足図7)、骨折の後に、カルス組織への腸管αβT細胞およびTh17細胞のホーミングが増加することが示された。光活性化から24時間後、無傷のコントロールマウスのPPとBMにKaedeR γδ T細胞を発見した。しかし、骨折は、PPsまたはカルス中のKaedeR γδ T細胞の頻度に影響を与えなかった(図3C)。したがって、一部の腸管γδT細胞は腸からBMに移動したが、骨折はカルスへのγδT細胞の移動を増加させることはなかった。
図3
骨折は、腸管αβT細胞やTh17細胞のカルスへのホーミングを増加させるが、γδT細胞は増加しない。12週齢の雄SFB+Kaedeマウスに大腿骨骨折を誘発した。2日後、4個のPPを外科的に露出させ、近紫外線ライトを2分間照射した。1日後、マウスを犠牲にし、PPとカルスが赤く蛍光するαβT細胞、Th17細胞、γδT細胞の頻度をフローサイトメトリーで測定した。PP赤色蛍光T細胞は、骨折したマウスのPPと無傷のコントロールマウスのPPでカウントされた。カルス赤色蛍光T細胞は、骨折した大腿骨のカルス組織、対側の無傷の大腿骨からのBM、および無傷のマウスのBMで計数した。(A)PPαβT細胞の相対頻度、カルスαβT細胞の相対頻度および絶対頻度。(B)PPのTh17細胞の相対頻度、およびカルスTh17細胞の相対頻度および絶対頻度。(C)PPγδT細胞の相対頻度、およびカルスγδT細胞の相対頻度および絶対頻度。データは、平均値±SEMで表される。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布し、多重比較のためのポストホックボンフェローニ補正を伴う2ウェイANOVA(カルスパネル)、または対にならない両側t検定(PPパネル)によって分析した。*P < 0.05、***P < 0.001、***P < 0.0001は、表示されたグループと比較したものである。有意でない比較は示していない。
炎症部位へのTh17細胞のホーミングは、炎症部位の細胞に発現するケモカインリガンドCCL20(37-39)とTh17細胞に発現するケモカイン受容体CCR6(46)により駆動されることから、CCL20/CCR6シグナルが腸内Th17細胞のカルスへのホーミングを駆動する可能性がある。この仮説を裏付けるように、骨折によってSFB+マウスのカルス細胞におけるCCL20の転写レベルが増加し、3日目にピークを迎えることがわかった(図4A)。精製した細胞を分析したところ、骨折はカルス内の間質細胞(SC)によるCCL20の産生をアップレギュレートすることがわかった(図4B)。CCL20はTNFによって誘導されるため(31, 33)、カルスTNFがTh17細胞のカルスへのホーミングに必要なのではないかという仮説を検討した。この仮説を裏付けるように、骨折はSFB+ JAX WTマウスではカルスCCL20の転写レベルを上昇させたが、SFB+ JAX Tnf-/-マウスではそうではなかった(図4C)。腸管Th17細胞のカルスへのホーミングにおけるTNFの役割をさらに探るため、IL17a-EGFPマウスを用いた。この系統は、IL17a遺伝子の停止コドン後にIRES-EGFP配列を有するため、EGFP発現がIL-17A発現細胞に限られ、フローサイトメトリによるEGFP測定によりTh17細胞の検出が可能になった。EGFP-である脾臓ナイーブCD4+細胞(CD4+CD44loCD62Lhi細胞)をIl17a-EGFPマウスから精製し、Th17細胞偏在条件で4日間培養した。その後、Th17細胞(CD4+EGFP+細胞)をFACSソートし、2日前に骨折したWTマウスとTnf-/-マウスに移植した。T細胞移植の1日後、レシピエントマウスを犠牲にし、カルスTh17細胞(CD4+EGFP+細胞)をフローサイトメトリーにより列挙した。骨折を受けたWTマウスは、骨折していないWTコントロールと比較して、カルス中のEGFP+ Th17細胞の相対数および絶対数が高かった(図4、DおよびE)。一方、Tnf-/-マウスでは、骨折によってカルスEGFP+ Th17細胞の頻度は増加しなかった(図4、D、E)。さらに、骨折は、WTマウスではカルスTh17細胞およびカルスVβ14+ Th17細胞の頻度を増加させたが、Tnf-/-マウスでは増加しなかった(図4、F、G)。これらの知見とTNFのカルスレベルの上昇を示すデータ(図1A)は、骨折がTNF依存的なメカニズムで腸管Th17細胞のカルスへの動員を増加させることを実証した。
図4
骨折はTNF依存的なメカニズムでTh17細胞のカルスへのトロピズムを増加させる。(A) SFB+ TACマウスのPF3日目および7日目におけるカルスCcl20転写レベル。(B)3日目PFの精製カルス細胞におけるCcl20転写物レベル。(C)SFB+WTマウスおよびTnf-/-マウスの3日目PFにおけるカルスCcl20転写物レベル。(DおよびE)IL-17A-EGFP+細胞の養子移入の2日前に骨折させたSFB+ WTおよびTnf-/-マウスのカルスにおけるEGFP+ Th17細胞の相対的および絶対的頻度。(F) SFB+ WTマウスとTnf-/-マウスのカルスTh17細胞の相対頻度および絶対頻度。(G) SFB+ WTマウスおよびTnf-/-マウスにおけるカルスVβ14+ Th17細胞の相対的頻度 n = 5-6マウス/グループ。データは平均値±SEMで表される。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布し、多重比較のためのポストホックボンフェローニ補正を伴う2way ANOVAによって分析された。表示されたグループと比較して、**P < 0.01, ***P < 0.001, ****P < 0.0001。3日目のPF SCと比較して、#P < 0.001。有意でない比較は示していない。
γδT細胞およびTh17細胞は骨折治癒を改善する。骨折部位を囲むカルス組織をin vitro micro-CT(μCT)により解析した。カルスブリッジングと結合を示す指標は、カルス体積が最も大きくなる骨折後14日目と、カルス体積の減少につながるカルスの連結とリモデリングが行われる21日目に測定された。14日目、SFB+ Tcrd-/-マウスは、WTコントロールと比較して、中央カルスでのカルス総量(TVc)は同等であったが、骨量(BVc)およびカルス骨量割合(BVc/TVc)は低下していた(図5A)。PF21日目には、すべてのμCT指標がTcrd-/-マウスとWTコントロールで同様であり(図5A)、γδT細胞の欠失が骨折治癒の初期段階を損なうことが示された。中央カルス全体の代表的なμCT画像は、14日目にWTコントロールと比較して、Tcrd-/-マウスの治癒が損なわれていることを確認した(図5B)。WT JAXマウスを用いた追加研究により、14日目にはSFB+マウスとSFB-マウスのTVcが同程度であることが判明した。しかし、SFB+マウスは、SFB-マウスよりも高いBVcおよび高いBVc/TVcを有した(図5C)。21日目のPFでは、すべてのμCT指標がSFB+マウスとSFB-マウスで同様であった(図5C)。中央カルス全体の代表的なμCT画像は、14日目のPFでSFB-マウスの治癒障害をさらに示している(図5D)。μCT解析と一致して、治癒した骨折カルスを損傷または破壊するのに必要な力の指標であるねじり剛性、降伏トルク、および極限トルクは、35日目のPFでSFB-マウスよりもSFB+マウスの方が高かった(図5E)。これらのことから、初期炎症期におけるSFBによるTh17細胞の拡大は、カルス結合が起こった後のカルスリモデリング時に治癒骨折の力学的完全性の向上につながることが示唆された。
図5
γδT細胞およびTh17細胞は骨折治癒を促進する。12週齢の雌性SFB+およびSFB-JAXマウス、ならびにγδT細胞欠損株であるSFB+Tcrd-/-マウスで大腿骨骨折を誘発した。(A)WTマウスおよびTcrd-/-マウスのPF14日目および21日目のカルスμCT測定値。(B)WTマウスとTcrd-/-マウスの骨折カルスを3D μCTで再構成した代表画像。(C)SFB+およびSFB- JAXマウスの14日目および21日目のカルスμCT測定値。(D)14日目および21日目のSFB+およびSFB- JAXマウスの骨折カルス3D μCT再構成の代表画像。 E)PF35日目のねじり剛性、降伏トルク、および究極トルクは、摘出大腿骨の静的ねじり-破壊試験により決定した。データは、平均値±SEMで表される。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布し、対にならないt検定で分析した。指示したグループと比較して、*P < 0.05、**P < 0.01、**P < 0.001。有意でない比較は示していない。
腸からのTh17細胞脱出の遮断またはカルスへのTh17細胞ホーミングの阻害は、骨折治癒を障害する。T細胞に発現するケモカイン受容体であるS1PR1は、循環するS1Pの感知に応答して、腸管リンパ組織からのT細胞の退出を促進する(32)。骨折がS1PR1を介したメカニズムでTh17細胞の腸からの脱出を促進するかどうか、また、骨折治癒における腸内T細胞のカルスへの移動の関連性を確認するために、TAC SFB+マウスに、T細胞の機能に影響を与えずに腸からのT細胞の脱出を阻止するSIP1R1モジュレーターであるFTY720を投与しました(47、48)。FTY720投与は骨折誘発の1週間前に開始し、PF7日目まで継続した。その結果、FTY720投与は、腸内Th17細胞の頻度を変化させないことがわかった(図6A)。しかし、FTY720は、末梢血とカルスにおける骨折誘発性のTh17細胞の増加を防止した(図6A)。さらに、FTY720はSI Il17a転写レベルに影響を与えなかったが、PF3日目のカルスにおけるIl17a転写レベルは減少した(図6B)。T細胞輸送の機能的関連性を証明するために、FTY720は、14日目のPFでBVcおよびBVc/TVcを減少させた(図6C)。中央カルス全体の代表的なμCT画像は、14日目のPFにおいて、コントロールと比較してFTY720で処理したマウスで治癒が損なわれていることを確認した(図6D)。腸から出たTh17細胞は、CCR6/CCL20軸に導かれて炎症部位に移動する(49)。CCL20によるTh17細胞のカルスへの流入の役割を明らかにするために、TAC SFB+マウスを骨折させ、骨折誘発の1日前から8日間、中和抗CCL20 Abまたはアイソタイプマッチの無関係Abで処理した。抗CCL20 Abは、PPまたは末梢血のTh17細胞の頻度を変化させなかったが、骨折によって誘発されるカルスTh17細胞の増加を阻止した(図7A)。抗CCL20 Abによる処置は、SIおよびカルスにおけるIl17aサイトカイン転写レベルの骨折誘発性増加を鈍化させた(図7B)。骨折修復におけるTh17細胞のカルスへのCCL20依存的な移動の関連性を実証するために、抗CCL20 Abによる処理は、14日目のカルスBVcおよびBVc/TVcを減少させた(図7C)。中央カルス全体の代表的なμCT画像は、14日目にコントロールと比較して、抗CCL20 Abで処理したマウスで治癒が損なわれたことを確認した(図7D)。これらのデータを総合すると、腸からのTh17細胞の退出の遮断またはカルスへのTh17細胞のホーミングの阻害は、骨折の治癒を損なうという結論が裏付けられる。
図6
腸からのTh17細胞の排出を遮断することで、骨折に起因する末梢血とカルスTh17細胞の増加を防ぎ、骨折治癒を障害する。(A)S1PR1遮断薬FTY720を投与したマウスのPF3日目と7日目のPP、末梢血(PB)、カルスのTh17細胞の相対頻度。(B)FTY720で処理したマウスのSIおよびカルスにおけるIl17aの転写レベルに対する骨折の影響。(CおよびD)PF14日目のカルスμCT測定。マウスは骨折手術の1週間前から2週間FTY720で処置した。n = 5-6マウス/グループ。データは、平均値±SEMとして表される。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布し、多重比較のためのポストホックボンフェローニ補正を伴う2ウェイANOVA、または対にならない2尾のt検定によって分析した。表示されたグループと比較して、P < 0.05、P < 0.001、およびP < 0.0001。有意でない比較は示していない。
図7
抗CCL20 Ab投与によるカルスへのTh17細胞流入の遮断は、骨折による末梢血およびカルスTh17細胞の増加を防ぎ、骨折の治癒を損なう。(A)抗CCL20 Abを投与したマウスのPF3日目と7日目のPP、末梢血、カルスTh17細胞の相対頻度(B)抗CCL20 Abを投与したマウスのSIとカルスにおけるIl17aの転写レベルに対する骨折の影響(CおよびD)PF14日目のカルスμCT測定。マウスを抗CCL20 Abまたは無関係な(Irr.)Abで手術の1日前および7日間隔日で処理した。 n=5〜6マウス/グループ。データは、平均±SEMとして表される。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布し、多重比較のためのポストホックボンフェローニ補正を伴う2ウェイANOVAによって分析された。表示されたグループと比較して、P < 0.05、P < 0.001、およびP < 0.0001。有意でない比較は示していない。
ディスカッション
大腿骨骨折の最適な修復にはγδT細胞とTh17細胞が必要であること、骨折修復に関与するTh17細胞は腸で発生し、その後カルスにホーミングすることを報告した。また、骨折によって増加することのない腸管γδT細胞のBMへのトラフィッキングの証拠も得られた。骨折によって誘発されたカルスでのγδT細胞の拡大は、腸のγδT細胞の量的変化とは関連せず、腸とカルスでのTh17細胞の拡大に先行していた。γδT細胞は腸の透過性を高めるのに必要であり、SFBを含むマイクロバイオームと協働して腸のTh17細胞の拡大を促進した。さらに、Th17細胞はS1PR1依存的なメカニズムで腸から排出され、カルスSCが発現するケモカインリガンドであるCCL20によってカルスに誘導されることを報告した。
T細胞は、修復の初期段階で骨折部位に選択的に集められ(50)、治癒過程の後期段階まで損傷部位に留まることが報告されている(51)。従って、T細胞の数は骨折部位では非骨折部位と比較して不釣り合いなほど増加する。T細胞の有益な役割を証明するように、免疫抑制剤による治療を受けた患者では骨折の治癒が遅れ、HIV患者では健常者よりも非結合の発生率が高い(52-54)。動物実験ではT細胞が骨折治癒に寄与することが確認されているが(55, 56)、T細胞とB細胞の両方を欠く動物を用いた調査では、骨折治癒に対するリンパ球の効果は正負を示した(5, 57)。この食い違いの理由は、まだ解明されていない。しかし、B細胞は抗原提示とCD40/CD40Lシステムを介してT細胞を制御するので、B細胞が存在する場合にのみT細胞が骨折治癒に利益をもたらす可能性がある。骨折治癒におけるT細胞の特定集団の効果を分析した研究はほとんどない。エフェクターメモリーCD8+ T細胞は、ヒトの骨折治癒に負の影響を与えるが(58)、対照的に、養子縁組Treg療法によって骨折治癒は改善される(59)。
本研究では、骨折修復の炎症期に重要なサイトカインであるIL-17の2つの主要供給源であるγδT細胞とTh17細胞の役割について解析した。γδT細胞は、腸(11, 12)および筋骨格系組織(6)内の主要なT細胞集団である。腸管γδT細胞の二次リンパ系臓器への移動は、これまでの研究では観察されていなかった(60)。Kaedeマウス(44)を用いて、腸管γδT細胞のBMへのホーミングを示す証拠を発見した。しかし、γδT細胞の移動は骨折によって増加しなかったことから、骨折の修復に関与するγδT細胞の大部分は局所的に発生することが示唆された。γδT細胞は、以前、ドリルで穴を開けた骨折の修復を促進することが判明しており(6)、この観察は、軟骨内骨形成によって修復された骨折を調べた本研究によって拡張された。その結果、γδT細胞はIL-17を分泌することで、組織損傷に対して迅速な免疫応答を行うことが確認された(6)。このサイトカインは、自然リンパ系細胞、NK細胞、NKT細胞、好中球、好酸球からも低レベルで分泌されるが(61-63)、これらの細胞集団の骨折修復への寄与はまだ不明である。
T細胞による抗原認識の直接作用は、抗原保有部位におけるT細胞のリクルート、保持、拡大に寄与する(64, 65)。したがって、Abxは細菌抗原-細胞相互作用を阻害することにより、特定のT細胞集団の制御に寄与する可能性がある。したがって、αβT細胞の多くの集団は、腸で分化・増殖した後、二次リンパ器官や炎症部位に移動する。その中の一つがTh17細胞である。恒常的な条件下では、Th17細胞は腸に最も多く存在し、SFBの存在によってその誘導と蓄積は最大化される。無菌マウス、SFBを欠損させた従来型マウス、Abx処理マウスでは、腸のTh17細胞の数が少なく、腸管外自己免疫疾患の発症傾向も低い(34, 66)。Th17細胞は、乾癬、関節リウマチ、歯周病、炎症性腸疾患などの病的状態から生じる骨量減少に極めて重要な役割を担っている(17、67)。さらに、Th17細胞は、PTH(33、68)やエストロゲン欠乏症(69-73)によって誘発される骨喪失に関与していることが分かっている。本研究では、骨折が腸管およびカルスTh17細胞の一過性の初期膨張を引き起こすことを見いだした。関与したTh17細胞の多くはメモリーT細胞であったが、骨折はエフェクターTh17細胞の増加も引き起こした。
Th17細胞の輸送に対する骨折の影響を直接調べるために、Kaedeマウスを使用した(44)。このマウスと同様の系統は、腸管Th17細胞のBM(31)、腎臓(35)、腸間膜リンパ節(74)、および脳(75)への移動を追跡するのに成功したことがある。EGFP-Th17細胞をi.v.注入し、カルスへのホーミングを測定することにより、裏付けとなる情報を得た。これらの実験から、骨折はTNF依存的にTh17細胞のカルスへの向性能を高めることが明らかになった。これは、TNFが損傷後早期の骨折部位で発現し、骨折の修復を促進するもう一つのサイトカインであることから関連性がある(76、77)。
本研究のメカニズム的な発見は、SIからのTh17細胞の脱出がS1PR1に依存していたことである。この知見は、腸から全身循環へのすべてのリンパ球の退出を阻止するS1PR1モジュレーターであるFTY720を用いて得られた(47、48)。この薬剤は、多発性硬化症の治療薬としてFDAの認可を受けている。Th17細胞のカルスへの流入は、Th17細胞が発現するCCR6受容体に結合するケモカインリガンドCCL20によって媒介された(37、46)。CCR6/CCL20軸は、炎症を起こした腎臓組織への腸管Th17細胞の動員も促進し(35)、腸管Th17細胞のBMへの移動は、エストロゲン欠乏(31)やPTH(33)によって誘導される(33)。
この研究の強みは、BonnarensとEinhornがラットで開発し、後にマウスに適応した、臨床的に適切で広く使われている高エネルギー大腿骨骨折法を用いたことである(78-80)。これらの実験的骨折は、ヒトの骨折修復と同じ軟骨内骨化過程を経て治癒する(78)。この方法で作られた骨折は、解剖学的部位、病因、固定方法において、外傷に起因する一般的なヒトの閉鎖性長骨骨折と類似している(79)。このような類似性により、マウスで得られた知見のトランスレーショナルリレバンスを向上させることができる。また、この方法は、ねじりによる骨折の誘発よりも再現性が高く、外科的に誘発された骨折モデルにおける軟部組織の外傷による交絡効果を回避することができる(79)。骨折の安定化は、骨折時に軸方向のアライメントを維持し、大きな変位を避けるために、骨折前に髄内ピンを挿入することで達成された。釘やネジなどの安定化器具は軸方向や回転方向の安定性が高いが、髄内ピンを使用することで、骨折部位の修復に影響を及ぼす可能性のある外固定に伴う隣接骨組織の追加欠損を生じることなく、安定した治癒結果を得るのに十分な安定化が得られる。
我々は、カルスTh17細胞の増殖が骨折の修復を促進し、機械的強度を向上させることを発見した。注目すべきは、14日目に限ってSFB-マウスよりもSFB+マウスの方がBVcおよびBVc/TVcが有意に高かった(図5)ことである。これは、ブリッジングにつながる軟性カルス肥大、軟骨形成、軟骨無機化に直前で必要な無菌性炎症過程におけるTh17細胞の極めて重要な効果と一致する。興味深いことに、微生物群の効果は炎症期から時間的に離れるにつれて消失し、ラメラ骨形成が支配的で炎症組織から空間的・時間的に隔離された圧密・リモデリングの後期段階では、BVcは群間で差がなかった。しかし、35日目のSFB+マウスの降伏トルクと極限トルクが大きいという結果は、体積的、幾何学的、材料的な多くの特性の影響を受ける橋渡しカルスの力学的特性が、以前の遅延の影響をまだ若干残していることを示唆しており、これは骨折修復プロセスのカスケード特性と一致する。
外傷後や外科的骨折修復後の感染症予防のために、Abxが投与されることが多い。骨折修復に対するAbxの効果について、いくつかの報告がなされている(81-84)。これらの研究では、一部のAbxが骨折修復に及ぼす悪影響について述べられているが、腸内細菌叢を変化させることによって骨折修復を妨げるかどうかについては調査されていない。我々の調査では、広域スペクトル型Abxは、Th17細胞の生成に関連するマイクロバイオームの構成要素を切除することによって、骨折修復に悪影響を及ぼす可能性があることが示唆された。健康なマウスでは、腸内Th17細胞の拡大はSFBによって特異的に誘導されるが(19)、ヒトでは約20種類の非病原性腸内細菌株がTh17細胞の分化を誘導することが知られている(22、23)。したがって、広域スペクトルAbxによる治療は、ヒトの骨折修復を妨害する可能性がある。
腸内細菌の多様性と構成は、性別、年齢、閉経、食事、生活環境、薬剤など様々な要因によって変化する(85)。しかし、腸内細菌叢の組成とヒトの骨折修復の効率との関係は、まだ明らかにされていない。以上のことから、局所的に活性化されたγδT細胞とカルスに移動するマイクロバイオーム依存性腸管T細胞が、最適な骨折修復に不可欠であることが判明した。Th17細胞を調節する細菌療法と広域抗生物質の使用を避けることによってマイクロバイオーム組成を変更することは、骨折治癒を改善する新しい治療戦略である可能性がある。
研究方法
マウス。SFB+ C57BL/6 (B6NTac) マウスはTaconic Biosciences社から購入した。SFB- C57BL/6マウス(JAX:000664)、Tnf-/-マウス(B6.129S-Tnf<tm1Gkl>/J、MGI:JAX 005540)、IL17a-EGFP-knockinマウス(C57BL/6-IL17a tm1Bcgen/J、MGI:AX:018472)およびTcrd-/-マウス(B6. 129P2-Tcrd<tm1Mom/J, MGI:JAX 002120)は、The Jackson Laboratoryから購入した。Kaedeマウス [B6.Cg-c/c Tg(CAG-tdKaede)15Utr, MGI:5444247] は、理研バイオリソース研究センターから購入した。SFB+ JAXマウス、SFB+ Tcrd-/-マウス、SFB+ Tnf-/-マウス、およびSFB+ Kaedeマウスは、以前に記載したように(43)、SFB単縁マウスから収集した糞便ペレットの液体懸濁液をSFB-マウスに経口投与することにより作成した。SFB陽性は、QIAamp DNA Stool Mini Kit(QIAGEN)を用いた糞便DNA抽出と、その後のSFB 16S rRNA遺伝子に特異的なプライマーを含むプロトコルを用いた定量PCR(qPCR)により確認された: 5′-GACGCTGAGGCATGAGCAT-3′(フォワード)および5′-GACGGCACGATTGTTATTCA-3′(リバース)および全菌16S rRNA:5′-GTGCCAGCMGCCGCGTAA-3′(フォワード)および5′-GGACTACHVGGTWTCTAAT-3′(リバース)。(86). すべての実験は雌マウスを用いて行った。エモリー大学に入るすべてのマウスは、ホワイトヘッド生物医学研究棟の同じビバリウム内の同じ部屋に出荷された。すべてのマウスは、特定の病原体を含まない条件下で飼育され、γ線照射した5V5Rマウスチャウ(Purina Mills)とオートクレーブした水を自由摂取で与えた。動物施設は、23℃(±1℃)、相対湿度50%、12時間明暗サイクルに保たれていた。すべてのマウスは、実験の前に少なくとも3日間、施設内で順応させた。
骨折の手術 確立された大腿骨閉鎖骨折モデル(78、80、87)を我々の研究に使用した。簡単に説明すると、マウスの皮膚と膝関節を開いた後、膝蓋骨を顆の内側までスライドさせ、膝を屈曲させて顆を露出させた。25ゲージの針を髄内管に挿入して初期開口部を形成し、針を抜いた。25ゲージの脊髄針(EXEL Int)を開口部に挿入し、大腿骨近位部の大転子の皮質骨に出会うまで髄内管の長さを下降させた。その後、ピンの先端を顆の表面下に埋没させた。ピンの長さは、ワイヤーカッターでさらに切り詰めた。その後、切開した部分を5-0吸収性縫合糸で閉じた。手術後、手術した四肢に錘を落として骨折を発生させた。PF直後、動物が麻酔から覚める前に、Kubtec DIGImusデジタルキャビネットでX線撮影を行い、髄内ピンの配置が適切であること、骨折が粉砕せずに骨端中位にあることをチェックした。骨折の位置がずれている、粉砕が激しい、縮小が不十分である、またはX線画像やμCT画像でピンが曲がって見える場合、動物は試験から除外された。
腸内常在細菌叢の枯渇。Rakoff-Nahoumらによって記載されたように、広域スペクトルAbx(1mg/mLアンピシリン、0.5mg/mLバンコマイシン、1mg/mL硫酸ネオマイシン、および1mg/mLメトロニダゾール安息香酸/メトロニダゾール)のカクテルが準備された。(88)、または非吸収性Abx(2 mg/mL bacitracinおよび2 mg/mL neomycin sulfate)を骨折開始1週間前よりマウスの飲料水に含ませた。Abx水は新鮮なものを用意し、犠牲になるまで週に2回交換した。糞便マイクロバイオームの枯渇は、QIAamp DNA Stool Mini Kit(QIAGEN)を用いた糞便DNA抽出と、その後のqPCRによって確認され、すべての細菌に存在する16S rRNA遺伝子の検出に特異的なプライマー(5′-GTGCCAGCMGCCGCGTAA-3′、フォワード.5′-GGACTACHVGGGTWTCTAAT-3′、リバース)を用いて、既述(33、89)のように行った。
Kaedeマウスの細胞の光電変換 Kaedeマウスは、近紫外線(350-410nm)の光にさらされると緑(518nm)から赤(582nm)に変化する光変換性蛍光タンパク質を発現する。12週齢の雄SFB+Kaedeマウスを骨折手術に供した。手術の2日後、すべての動物が外科的開腹手術を受け、その間に盲腸と遠位SIを切除し、盲腸に最も近接した4つのSI PPを同定して波長390nmの光で各2分間照射した。盲腸と遠位SIを腹腔内に再挿入し、腹壁を閉じた。露光中、ターゲットPP以外の組織を光から保護するため、アルミホイルを使用した。光変換から24時間後、マウスを犠牲にし、PP細胞を回収した。単細胞懸濁液を調製し、フローサイトメトリーで解析した。カルス細胞も犠牲時に採取し、単一細胞懸濁液を調製した。カルスKaedeR総T細胞は、カルス細胞全体を分析することにより、フローサイトメトリーで列挙された。カルスTh17細胞の数は少ないので、マウスCD3ε MicroBeads(Miltenyi Biotec)またはマウスCD4(L3T4)MicroBeads(Miltenyi Biotec)を用いた陽性免疫磁気選別により、カルス細胞をT細胞またはCD4+T細胞に対して濃縮した。次に、これらの濃縮された細胞集団を、カルスTh17細胞の細胞内染色およびフローサイトメトリーによる列挙のために使用した。
EGFP+Th17細胞の移植。IL17a-EGFP-ノックインマウス(C57BL/6-IL17atm1Bcgen/J)は、IL-17A活性のマーカーとしてEGFPを発現する。ナイーブCD4+ T細胞(CD4+CD44loCD62Lhi細胞)は、EasySep Mouse Naive CD4+ T Cell Isolation Kit(STEMCELL Technologies)を用いて、Il17a-EGFPマウスの脾臓から単離した。EGFP-ナイーブCD4+ T細胞を、Mouse Th17 Cell Differentiation Kit(R&D Systems)を用いてTh17極化条件下で4日間培養し、EGFP+CD4+ Th17細胞を作製した。EGFP+CD4+生Th17細胞をFACSAria II(BD Biosciences社製)でFACS選別し、T細胞移植の2日前に骨折させたSFB- JAX WTおよびTnf-/-レシピエントマウスに i.v. (1×106細胞/マウス)注入した。移植1日後、レシピエントマウスのカルスにおけるEGFP+CD4+T細胞の相対頻度および絶対頻度をフローサイトメトリーにより測定した。
PPおよびカルス組織単細胞懸濁液の調製。PP細胞の単離のために、SIを除去し、糞便を流した。PPを摘出し、1mLの冷却したRPMI1640に回収した。PP は 2.5 mL シリンジのプランジャーで解離させ、50 mL チューブの上に置かれた 70 μm のセルストレーナーを通して静かに押し出した。フローサイトメトリー解析には、単細胞懸濁液を使用した。カルス細胞の単離のために、カルス組織を数個の小片に切り分け、RPMI培地(Gibco、Thermo Fisher Scientific)に溶解した1mg/mLの濃度のコラゲナーゼ/ディスパーゼ溶液(MilliporeSigma)で37℃、1時間消化した。70μmのストレーナー(BD Bioscience)を用いた滅菌濾過により破片を除去し、その後、赤血球溶解バッファー(BioLegend)を加えて赤血球を除去した。得られた単細胞懸濁液をフローサイトメトリー解析に使用した。
FTY720処理。S1PR1機能性拮抗薬FTY720(2-アミノ-2-[2-(4-オクチルフェニル)エチル]プロパン-1,3-ジオール)(MilliporeSigma)をKrebsら(36)の記載に従って5μg/mLで飲料水に添加した。FTY720の投与は骨折手術の1週間前に開始し、手術後1週間継続した。FTY720を含む水は毎週交換した。
In vivo抗CCL20 Ab処理。マウス抗CCL20 Abs(clone 114908, R&D Systems)またはアイソタイプコントロール(clone 43414, R&D Systems)を、骨折手術の1日前およびその後1日おきに7日間、マウスあたり50μgをi.p.注入した。
μCTによる測定。骨折部位を中心としたカルス体積全体またはカルス周囲の「シェル」の骨量および構造を、既報のようにScanco μCT50を用いたμCTにより生体外で評価した(90〜93)。カルス全体の横断断層画像を取得した。中央のカルス全体を解析するために、半自動アルゴリズム(91)を用いて、骨折線を中心とした100スライス(1.6mm)でカルス外周のタイトな輪郭を作成し、手動輪郭作成により宿主皮質骨を除外した。外側のカルス「シェル」を解析するために、周囲輪郭からボクセルを剥離して厚さ160μmのドーナツを作成した。最適化された閾値とノイズフィルター(MilliporeSigma 1.0、サポート1、閾値76mmHA/cm3)を用いて軟組織から鉱化組織を分割し、既報の方法(94)で中央カルスの総量(TVc)、骨量(BVc)およびBVc/TVcを測定した。この方法の結果は、生体力学的強度およびカルスブリッジングと高い相関がある(91)。
機械的試験。治癒した大腿骨の機械的完全性を評価するために、静的ねじり試験を実施した。簡単に説明すると、骨を軟組織で洗浄し、ポリメチルメタクリレート(PMMA)(Ortho-Jet、Lang Dental社製)で銅製はんだキャップ金具(Mueller Streamline 1/2インチ径、品番652243)の両端をポッティングする前に髄内ピンを慎重に取り外した。ねじり試験は、ロータリーアクチュエータを備えたサーボ油圧式材料試験システム(Dynamight、Instron)で実施した。ねじり剛性または剛性(直線領域の傾き)および究極トルク(破壊前の最大トルク値)は、カスタムMATLABスクリプト(MathWorks)を用いてT対θ曲線から決定した。
フローサイトメトリー。フローサイトメトリーは、Auroraシステム(Cytek)およびBD FACSymphony A5(BD Biosciences)で実施し、データはFlowJoソフトウェア(Tree Star)を用いて分析した。細胞表面の染色については、細胞を、抗マウス精製CD16/-32 Ab(クローン93)、抗BV 510-CD45 Ab(クローン30-F11)、抗BV 421-TCRβ Ab(クローンH57-597)、抗PerCP/Cy5.5-CD4 Ab(Clone RM4-5), 抗BV 711-CD8 Ab(Clone 53-6. 7)、Alexa Fluor 700-CD3 Ab(クローン17A2)、抗PE/Cy7-CD3ε Ab(クローンKT3・1・1)、抗FITC-TCR γ/δ Ab(Clone GL3)、抗BV 421-CD44 Ab(IM7)、抗APC-CD62L Ab(MEL-14), 抗PE-Cy7-CD69 Ab(H1. 2F3)、抗BV605-CD127 Ab(A7R34)、抗APC-ラットIgG1 Ab、抗κアイソタイプコントロールAb(RTK2071)、抗PE-ラットIgG1 Ab、κアイソタイプコントロールAb(RTK2071)、抗FITC-ラットIgG1、κアイソタイプコントロールAb(eBRG1)、APC-eFlour780-ラットIgG1、κアイソタイプコントロールAb(eBRG1)、抗PERCP-Cy5. 5-F4/80 Ab(クローンBM8)(いずれもBioLegend社製)、および抗FITC-Vβ T細胞受容体Ab(クローン38397)(BD Biosciences社製)。生細胞の判別は、Zombie NIR Fixable Viability KitまたはZombie Aqua Fixable Viability Kit(BioLegend社)を用いて行った。細胞内染色には、モネンシン溶液の存在下、細胞活性化カクテル(BioLegend)を用いて、37℃で12時間インキュベートした。抗マウスPE-IL-17A Ab(クローンeBio17B7)、抗PE-IL-6 Ab(MP5-20F3)、抗APC-eFlour 780-IL-1β Ab(NJTEN3)、抗FITC-TNF-α Ab(MP6-XT22) 及び抗APC-IL-17 Ab(TC11-18H10. 1)(すべてThermo Fisher Scientific社製)を、Intracellular Fixation & Permeabilization Buffer Set(Thermo Fisher Scientific社製)で細胞固定および透過化した後に添加した。
qPCRとプライマー RNeasy kit(QIAGEN)を用いて全RNAを分離し、Superscript II(Invitrogen, Thermo Fisher Scientific)を用いて、製造者の指示に従ってランダムヘキサマーでcDNAを合成した。cDNAの相対的な存在量は、ABI StepOnePlus Real-Time PCRシステム(Applied Biosystems)を用いたqPCR分析によって計算された。マウスIl-1b、Il6、Il17a、およびTnfの発現レベルは、qPCRによりカルス細胞で測定された。無傷群と骨折群との間の相対的な遺伝子発現の変化は、18S rRNAに正規化した2-ΔΔCt法を用いて計算した。使用したプライマーは、補足表1に記載されている。
SIからのRNA単離。各マウスから10mmの腸管片を犠牲時に採取し、-80℃で保存した。組織は、Bullet Blender Strom 24ブレンダー(Next Advance)においてRNase-Freeステンレス鋼ビーズを用いて破壊し、ホモジナイズした。TRIzol試薬(Thermo Fisher Scientific)およびDNase Maxキット(QIAGEN)を用いて、RNAを抽出した。マウスIl-1b、Il6、Il17a、およびTnfの発現レベルは、qPCRによってSI細胞で測定された。
統計学。すべてのデータは、Shapiro-Wilk正規性検定に従って正規分布していた。データは、適切なように、対にならない、両側t検定、または1ウェイもしくは2ウェイANOVAを用いて分析された。この分析には、動物系統と処置の主効果に加えて、動物系統と処置の間の統計的交互作用が含まれる。統計的交互作用が統計的に有意(P < 0.05)または重要な交互作用を示唆する場合、多重比較のためのボンフェローニ補正を適用して、各動物系統の治療平均間の差を比較するためにt検定が使用されました。
著者の貢献
RPが研究をデザインした。HYD、SP、AS、SU、JSNが研究を実施し、データを分析した。RP、DSP、MNW、RMJ、原稿を執筆した。
補足資料
補足データを見る
補足表1を見る
謝辞
本研究は、NIHからの助成金(DK112946, DK119229, DK124821, and RR028009, to RP; DK098391, to RMJ; AG062334, AR068157, AR070091, and AR079298, to MNW; AR073874 and AR080750, to DSP)により支援されました。SU、JSN、MNWは、VA Office of Research and DevelopmentのBiomedical Laboratory Research & Development Serviceからの助成金(I01BX005062、SUとJSNに、5I01BX000105と1I01BX005852、MNWに)からも支援を受けている。Graphical AbstractはBioRenderで作成しました。
宛先は以下の通り: Roberto Pacifici, Division of Endocrinology, Metabolism and Lipids, Emory University School of Medicine, 101 Woodruff Circle, Room 1309, Atlanta, Georgia 30322, USA. 電話番号 404.712.8420; Email: roberto.pacifici@emory.edu.
脚注
利益相反がある: 著者らは、利益相反が存在しないことを宣言している。
著作権:©2023, Dar et al. これは、Creative Commons Attribution 4.0 International Licenseの条件の下で公開されたオープンアクセス記事です。
参考情報です: J Clin Invest. 2023;133(8):e166577.https://doi.org/10.1172/JCI166577.
関連する解説は、T細胞が腸内細菌叢の助けを借りて骨折を治すでご覧ください。
参考文献
Baht GS, et al. 骨折治癒における免疫細胞の役割. Curr Osteoporos Rep. 2018;16(2):138-145.
この記事を経由して見る: CrossRef PubMed Google Scholar
Einhorn TA, Gerstenfeld LC. 骨折の治癒:メカニズムと介入。Nat Rev Rheumatol. 2015;11(1):45-54.
この記事を経由して見る: CrossRef PubMed Google Scholar
Marsell R, Einhorn TA. 骨折治癒の生物学。Injury. 2011;42(6):551-555.
この記事を経由して見る: CrossRef Google Scholar
Colnot C, et al. 骨髄移植を用いた骨折治癒に対する骨髄の細胞寄与をマウスで解析する。Biochem Biophys Res Commun. 2006;350(3):557-561.
この記事を経由して見る: CrossRef PubMed Google Scholar
Nam D, et al. Tリンパ球は、骨折修復の初期段階においてIL-17Fを介して骨芽細胞の成熟を可能にする。PLoS One. 2012;7(6):e40044.
この記事を経由して見る: CrossRef PubMed Google Scholar
小野哲也、他 IL-17産生γδT細胞は骨再生を促進する。Nat Commun. 2016;7:10928.
この記事を経由して見る: CrossRef PubMed Google Scholar
小松直樹、高柳裕之.自己免疫性関節炎:免疫系と関節の接点. Adv Immunol. 2012;115:45-71.
この記事を経由して見る: CrossRef PubMed Google Scholar
Waisman A. Tヘルパー細胞集団:皮膚のように柔軟か?Eur J Immunol. 2011;41(9):2539–2543.
この記事を経由して見る: CrossRef PubMed Google Scholar
Jovanovic DV, et al. IL-17はヒトマクロファージによる炎症性サイトカイン、IL-βおよびTNF-αの生産と発現を刺激する。J Immunol. 1998;160(7):3513–3521.
この記事を経由して見る: CrossRef PubMed Google Scholar
Colburn NT, et al. 骨折治癒のマウスモデルにおけるガンマ/デルタT細胞の役割。Arthritis Rheum. 2009;60(6):1694–1703.
この記事を経由して見る: CrossRef PubMed Google Scholar
Chen Y, et al. 上皮内ガンマデルタT細胞による腸管粘膜の保護. Proc Natl Acad Sci U S A. 2002;99(22):14338-14343.
この記事を経由して見る: CrossRef PubMed Google Scholar
Nielsen MM, et al. 上皮バリア組織のホメオスタシスと宿主防御におけるγδT細胞. Nat Rev Immunol. 2017;17(12):733-745.
この記事を経由して見る: CrossRef PubMed Google Scholar
Yang Y, et al. γδ T細胞:微生物叢、慢性炎症、大腸がん間のクロストーク。Front Immunol. 2018;9:1483.
この記事を経由して見る: CrossRef PubMed Google Scholar
コンスタンチニデスMG. 微生物叢と生得的リンパ球および生得的様リンパ球の相互作用。J Leukoc Biol. 2018;103(3):409-419.
この記事を経由して見る: CrossRef PubMed Google Scholar
Edelblum KL, et al. γδ上皮内リンパ球のダイナミックな移動にはオクルディンが必要です。Proc Natl Acad Sci U S A. 2012;109(18):7097-7102.
この記事を経由して見る: CrossRef PubMed Google Scholar
Th17は、T細胞の活性化と骨破壊を結びつける破骨細胞形成性ヘルパーT細胞サブセットとして機能する。J Exp Med. 2006;203(12):2673–2682.
この記事を経由して見る: CrossRef PubMed Google Scholar
Miossec P, et al. インターロイキン-17と17型ヘルパーT細胞。N Engl J Med. 2009;361(9):888-898.
この記事を経由して見る: CrossRef Google Scholar
Basu R, et al. Th17ファミリー:柔軟性は機能に従う。Immunol Rev. 2013;252(1):89-103.
この記事を経由して見る: CrossRef PubMed Google Scholar
Ivanov II, et al. セグメント化した糸状菌による腸管Th17細胞の誘導。Cell. 2009;139(3):485-498.
この記事を経由して見る: CrossRef Google Scholar
Ivanov II, et al. 小腸粘膜におけるIL-17産生T-helper細胞の分化を指示する特異的微生物叢. Cell Host Microbe. 2008;4(4):337-349.
この記事を経由して見る: CrossRef PubMed Google Scholar
Gaboriau-Routhiau V, et al. 腸管ヘルパーT細胞応答の協調的成熟におけるセグメント化された糸状菌の重要な役割。Immunity. 2009;31(4):677-689.
この記事を経由して見る: CrossRef PubMed Google Scholar
腸管上皮細胞への微生物の付着によるTh17細胞の誘導。Cell. 2015;163(2):367-380.
この記事を経由して見る: CrossRef PubMed Google Scholar
Tan TG, et al. 単独でマウスの腸管Th17細胞を誘導できるヒト腸管からの共生菌の種を特定する。Proc Natl Acad Sci U S A. 2016;113(50):E8141-E8150.
この記事を経由して見る: PubMed Google Scholar
Han X, et al. 炎症性サイトカインは、腸管上皮細胞におけるタイトジャンクションタンパク質の発現と局在をNO依存的および非依存的に変化させます。Shock. 2003;19(3):229-237.
この記事を経由して見る: CrossRef PubMed Google Scholar
Hietbrink F, et al. 実験的ヒト内毒素血症において、全身性の炎症が腸の透過性を高める。Shock. 2009;32(4):374-378.
この記事を経由して見る: CrossRef PubMed Google Scholar
Napolitano LM, et al. 関連する軟部組織損傷を伴う大腿骨骨折が免疫機能および腸管透過性に与える影響。Shock. 1996;5(3):202-207.
この記事を経由して見る: CrossRef PubMed Google Scholar
Roberts JL, et al. Bifidobacterium adolescentis supplementation attenuates fracture-induced systemic sequelae. Biomed Pharmacother. 2020;132:110831.
この記事を経由して見る: CrossRef PubMed Google Scholar
Bastian O, et al.全身性炎症と骨折の治癒。J Leukoc Biol. 2011;89(5):669-673.
この記事を経由して見る: CrossRef Google Scholar
Swank GM, Deitch EA. 多臓器不全における腸の役割:細菌の転位と透過性の変化。World J Surg. 1996;20(4):411-417.
この記事を経由して表示します: CrossRef PubMed Google Scholar
Deitch EA, Berg R. Bacterial translocation from gut: a mechanism of infection. J Burn Care Rehabil. 1987;8(6):475-482.
この記事を経由して見る: CrossRef PubMed Google Scholar
Yu M, et al. Ovariectomy induces bone loss via microbial-dependent trafficking of intestinal TNF+ T cells and Th17 cells. J Clin Invest. 2021;131(4):e143137.
この記事を経由して見る: JCI CrossRef PubMed Googleスカラー
Baeyens A, et al. 出口の戦略: S1PシグナルとT細胞遊走。Trends Immunol. 2015;36(12):778-787.
この記事を経由して見る: CrossRef PubMed Google Scholar
Yu M, et al. PTHは、微生物依存的に腸管TNF+ T細胞およびTh17細胞の拡大を介して骨損失を誘導する。Nat Commun. 2020;11(1):468.
この記事を経由して見る: CrossRef PubMed Google Scholar
Wu HJ, et al. 腸に常駐する分節型糸状菌は、Tヘルパー17細胞を介して自己免疫性関節炎を引き起こす。Immunity. 2010;32(6):815-827.
この記事を経由して見る: CrossRef PubMed Google Scholar
Krebs CF, et al. 自己免疫性腎疾患は、S1P-receptor-1依存性の腸管Th17細胞の腎臓への移動によって悪化する。Immunity. 2016;45(5):1078–1092.
この記事を経由して見る: CrossRef PubMed Google Scholar
Bradley CP, et al. セグメント化された糸状菌は、デュアルTCRを発現する腸-肺軸Th17細胞を誘導することにより、肺自己免疫を誘発する。Cell Host Microbe. 2017;22(5):697-704.
この記事を経由して見る: CrossRef PubMed Google Scholar
Schutyser E, et al. CCケモカインCCL20とその受容体CCR6. Cytokine Growth Factor Rev. 2003;14(5):409-426.
この記事を経由して見る: CrossRef Google Scholar
関節リウマチおよびその動物モデルにおいて、CCL20を介してCCR6を発現するTh17細胞が炎症関節に優先的に動員されること。J Exp Med. 2007;204(12):2803–2812.
この記事を経由して見る: CrossRef PubMed Google Scholar
Reboldi A, et al. CC chemokine receptor 6が制御するTH-17細胞の脈絡叢を介したCNSへの進入は、EAEの開始に必要である。Nat Immunol. 2009;10(5):514-523.
この記事を経由して見る: CrossRef PubMed Google Scholar
Li JY, et al.PTHの骨同化活性には、微生物叢に依存した酪酸の産生が必要である。J Clin Invest. 2020;130(4):1767–1781.
この記事を経由して見る JCI CrossRef Google Scholar
Gonzalez-Gonzalez M, et al. 疾患の動物モデルにおける腸の透過性を調査する。Front Physiol. 2018;9:1962.
この記事を経由して見る: PubMed Google Scholar
Schoultz I, Keita AV. 腸管バリアと腸管透過性評価のための現在の技術。Cells. 2020;9(8):1909.
この記事を経由して見る: CrossRef PubMed Google Scholar
Guo J, et al. Dkk1によるWntシグナルの抑制は、PTHを介した間質細胞応答と新生骨形成を減弱させる。Cell Metab. 2010;11(2):161-171.
この記事を経由して見る: CrossRef PubMed Google Scholar
マウスの皮膚免疫反応において、活性化制御性T細胞は皮膚から遊離する主要なT細胞タイプである。J Clin Invest. 2010;120(3):883-893.
この記事を経由して見る: JCI CrossRef PubMed Google Scholar
光変換蛍光タンパク質「かえで」トランスジェニックマウスによる生体内細胞移動のモニタリング. Proc Natl Acad Sci U S A. 2008;105(31):10871-10876.
この記事を経由して見る: CrossRef PubMed Google Scholar
Acosta-Rodriguez EV, et al. ヒトインターロイキン17産生Tヘルパーメモリー細胞の表面表現型と抗原特異性. Nat Immunol. 2007;8(6):639-646.
この記事を経由して見る: CrossRef PubMed Google Scholar
Brinkmann V, et al. FTY720 はリンパ球のホーミングを変化させ、一般的な免疫抑制を引き起こすことなく同種移植片を保護する。Transplant Proc. 2001;33(1-2):530-531.
この記事を経由して表示します: CrossRef PubMed Google Scholar
Chun J, Hartung HP. 多発性硬化症における経口フィンゴリモド(FTY720)の作用機序。Clin Neuropharmacol. 2010;33(2):91-101.
この記事を経由して見る: CrossRef Google Scholar
Turner JE, et al. CCR6 recruits regulatory T cells and Th17 cells to kidney in glomerulonephritis. J Am Soc Nephrol. 2010;21(6):974-985.
この記事を経由して見る: CrossRef PubMed Google Scholar
Hauser CJ, et al. ヒト骨折・軟部組織血腫の免疫微小環境と全身性免疫との関連性.J Trauma. 1997;42(5):895-903.
この記事を経由して表示します: CrossRef PubMed Google Scholar
Konnecke I, et al. T細胞およびB細胞は、骨折カルスに2波状に浸潤することで骨修復に関与する。Bone. 2014;64:155-165.
この記事を経由して見る CrossRef PubMed Google Scholar
Bissinger O, et al.ジクロフェナクとプレドニゾロンが生体内の骨折治癒に及ぼす影響に関するバイオメカニクス、マイクロコンピュータトモグラフィーおよび組織学的解析。BMC Musculoskelet Disord. 2016;17(1):383.
この記事を経由して見る CrossRef PubMed Google Scholar
Holstein JH, et al. Rapamycin affects early fracture healing in mice(ラパマイシンはマウスの初期骨折治癒に影響を与える。Br J Pharmacol. 2008;154(5):1055–1062.
この記事を経由して見る: CrossRef PubMed Google Scholar
Richardson J, et al. HIV陽性者における骨折の治癒。J Bone Joint Surg Br. 2008;90(8):988-994.
この記事を経由して見る: PubMed Google Scholar
Askalonov AA, et al. 動物における骨組織の修復再生におけるTシステム免疫の役割. J Hyg Epidemiol Microbiol Immunol. 1987;31(2):219-224.
この記事を経由して見る: PubMed Google Scholar
Santavirta S, et al. 非結合骨折の免疫学的研究。Acta Orthop Scand. 1992;63(6):579-586.
この記事を経由して表示します: CrossRef PubMed Google Scholar
Toben D, et al. 適応免疫系がない場合、骨折治癒は促進される。J Bone Miner Res. 2011;26(1):113-124.
この記事を経由して見る: CrossRef PubMed Google Scholar
Reinke S, et al. 終末分化したCD8+ T細胞は、ヒトの骨再生に悪影響を与える。Sci Transl Med. 2013;5(177):177ra36.
この記事を経由して見る: PubMed Google Scholar
Schlundt C, et al. 個々のエフェクター/レギュレーターT細胞比率は骨再生に影響を与える。Front Immunol. 2019;10:1954.
この記事を経由して見る: CrossRef PubMed Google Scholar
腸管上皮内および末梢のガンマデルタT細胞は、異なる移動特性を持つ、重複しない排他的な集団である。J Immunol. 2010;185(9):5160–5168.
この記事を経由して見る: CrossRef PubMed Google Scholar
Korn T, et al. IL-17とTh17細胞。Annu Rev Immunol. 2009;27:485-517.
この記事を経由して見る: CrossRef Google Scholar
Lockhart E, et al. 結核菌感染時のIL-17産生はCD4 T細胞よりもむしろgammadelta T細胞によって支配される。J Immunol. 2006;177(7):4662–4669.
この記事を経由して見る: CrossRef PubMed Google Scholar
インターロイキン-1およびIL-23は、gammadelta T細胞からの自然IL-17産生を誘導し、Th17応答および自己免疫を増幅させる。Immunity. 2009;31(2):331-341.
この記事を経由して見る: CrossRef PubMed Google Scholar
Fu H, et al. T細胞オルゴナイトのメカニズム. Cell Mol Life Sci. 2016;73(16):3009-3033.
この記事を経由して見る: CrossRef PubMed Google Scholar
Henrickson SE, et al. In vivo imaging of T cell priming. Sci Signal. 2008;1(12):pt2.
この記事を経由して見る: PubMed Google Scholar
Lee YK, et al. 腸内細菌に対する炎症性T細胞応答が実験的自己免疫性脳脊髄炎を促進する。Proc Natl Acad Sci U S A. 2011;108(suppl 1):4615-4622.
この記事を経由して見る: PubMed Google Scholar
Martinez GJ, et al. 炎症性TH17細胞の制御と機能. Ann N Y Acad Sci. 2008;1143:188-211.
この記事を経由して見る: CrossRef PubMed Google Scholar
Li JY, et al. IL-17Aはヒトの原発性副甲状腺機能亢進症で増加し、マウスのPTH誘発性骨喪失を媒介する。Cell Metab. 2015;22(5):799-810.
この記事を経由して見る: CrossRef PubMed Google Scholar
Tyagi AM, et al. エストロゲン欠乏はIL-17分泌Th17細胞の分化を誘導する:骨粗鬆症の病態における新たな候補。PLoS One. 2012;7(9):e44552.
この記事を経由して見る: CrossRef PubMed Google Scholar
Li JY, et al. 性ステロイド欠乏症に伴う骨損失は、マイクロバイオータに依存し、プロバイオティクスで予防される。J Clin Invest. 2016;126(6):249–2063.
この記事を経由して見る JCI PubMed Google Scholar
Tyagi AM, et al. 抗IL-17抗体による免疫保護効果の向上は、抗RANKL抗体および抗TNF-α抗体と比較して、エストロゲン欠乏下での骨格パラメータの改善につながる。J Bone Miner Res. 2014;29(9):1981-1992.
この記事を経由して見る: CrossRef PubMed Google Scholar
DeSelm CJ, et al. IL-17 mediates estrogen-deficient osteoporosis in the Act1-dependent manner. J Cell Biochem. 2012;113(9):2895–2902.
この記事を経由して見る: CrossRef PubMed Google Scholar
Scheffler JM, et al. Interleukin 17A: a Janus-faced regulator of osteoporosis. Sci Rep. 2020;10(1):5692.
この記事を経由して見る: CrossRef PubMed Google Scholar
Morton AM, et al. Endoscopic photoconversion reveals unexpectedly broad leukocyte trafficking to and from the gut. Proc Natl Acad Sci U S A. 2014;111(18):6696-6701.
この記事を経由して見る: CrossRef PubMed Google Scholar
Benakis C, et al. 腸内γδT細胞を制御することにより虚血性脳卒中の転帰に影響を与える腸内細菌叢。Nat Med. 2016;22(5):516-523.
この記事を経由して見る: CrossRef PubMed Google Scholar
Gerstenfeld LC, et al. TNF-αシグナルがない場合の骨折治癒の障害:軟骨内軟骨再吸収におけるTNF-αの役割。J Bone Miner Res. 2003;18(9):1584-1592.
この記事を経由して見る: CrossRef PubMed Google Scholar
Glass GE, et al. TNF-αは、筋肉由来の間質細胞の採用と分化を増強することにより、骨折の修復を促進する。Proc Natl Acad Sci U S A. 2011;108(4):1585-1590.
この記事を経由して見る: CrossRef PubMed Google Scholar
Bonnarens F, Einhorn TA. 実験動物の骨における標準的な閉鎖骨折の作製。J Orthop Res. 1984;2(1):97-101.
この記事を経由して見る: CrossRef PubMed Google Scholar
De Giacomo A, et al. 小動物における閉鎖性横骨折の発生. Methods Mol Biol. 2014;1130:35-44.
この記事を経由して見る: CrossRef Google Scholar
Lybrand K, et al. Mouse models of bone healing: fracture, marrow ablation, and distraction osteogenesis. Curr Protoc Mouse Biol. 2015;5(1):35-49.
この記事を経由して見る: CrossRef PubMed Google Scholar
Vestergaard P. 抗生物質の使用に伴う骨折のリスク。Curr Drug Saf. 2018;13(1):26-31.
この記事を経由して見る CrossRef PubMed Google Scholar
レボフロキサシンおよびトロバフロキサシンによる実験的骨折治癒の阻害。Clin Orthop Relat Res. 2003(414):95-100.
この記事を経由して表示します: PubMed Google Scholar
Kallala R, et al. 骨細胞代謝と骨折治癒に対する抗生物質のin vitroおよびin vivoでの影響。Expert Opin Drug Saf. 2012;11(1):15-32.
この記事を経由して見る: CrossRef PubMed Google Scholar
Huddleston PM, et al. Ciprofloxacin inhibition of experimental fracture healing. J Bone Joint Surg Am. 2000;82(2):161-173.
この記事を経由して見る: CrossRef PubMed Google Scholar
腸内細菌叢の構成に影響を与える因子とその調節。PeerJ. 2019;7:e7502.
この記事を経由して見る: CrossRef PubMed Google Scholar
Farkas AM, et al. マウス腸内における分割された糸状菌によるTh17細胞の誘導. J Immunol Methods. 2015;421:104-111.
この記事を経由して見る: CrossRef PubMed Google Scholar
De Giacomo A, et al. 小動物における閉鎖性横骨折の発生. Methods Mol Biol. 2014;1130:35-44.
この記事を経由して見る: CrossRef Google Scholar
Rakoff-Nahoum S, et al. 通常性微生物叢のtoll様受容体による認識は、腸のホメオスタシスに必要である。Cell. 2004;118(2):229-241.
この記事を経由して見る: CrossRef PubMed Google Scholar
Li JY, et al. 副甲状腺ホルモン依存性骨形成には、腸内細菌叢による酪酸産生が必要である。J Clin Invest. 2020;130(4):1767–1781.
この記事を経由して見る JCI CrossRef PubMed Googleスカラー
Wang W, et al. Local low-dose lovastatin delivery is improved the bone-healing defect caused by Nf1 loss of function in osteoblasts. J Bone Miner Res. 2010;25(7):1658-1667.
この記事を経由して見る: CrossRef PubMed Google Scholar
Nyman JS, et al. マイクロコンピュータ断層撮影により得られたラットの大腿骨骨折修復の定量的指標。J Biomech. 2009;42(7):891-897.
この記事を経由して見る: CrossRef PubMed Google Scholar
de la Croix Ndong J, et al. MEK阻害とBMP2投与の併用はNf1Osx -/-マウスの骨芽細胞分化と骨治癒を促進する。J Bone Miner Res. 2015;30(1):55-63.
この記事を経由して見る: CrossRef Google Scholar
Perrien DS, et al. IL-1およびTNFアンタゴニストは、ラットのエタノールによる骨折治癒の阻害を防ぐ。Toxicol Sci. 2004;82(2):656-660.
この記事を経由して見る: CrossRef PubMed Google Scholar
Bouxsein ML, et al. マイクロコンピューテッドトモグラフィーを用いたげっ歯類の骨微細構造評価のためのガイドライン。J Bone Miner Res. 2010;25(7):1468-1486.
この記事を経由して見る: CrossRef PubMed Google Scholar
バージョン履歴
バージョン1(2023年3月7日)です: インプレスプレビュー
バージョン2(2023年4月17日): 電子出版
をお勧めします。
卵巣摘出術は、微生物に依存した腸管TNF+ T細胞およびTh17細胞の輸送を介して骨損失を誘発する
Mingcan Yuら、J Clin Invest、2021年。
T細胞は腸内細菌叢の助けを借りて骨折を治す
Rajeev Auroraら、J Clin Invest、2023年
マイクロバイオームは腸管NK細胞およびTh1細胞の骨へのホーミングを促進することにより、メラノーマの骨増殖を抑制する
スバシス・パルら、J Clin Invest、2022年
健康とがんにおける乳房と腸内細菌叢
Jilei Zhangら、Genes & Diseases、2021年。
一酸化炭素放出分子-2は心肺蘇生を受けたラットの上皮タイトジャンクション損傷を抑制し腸粘膜バリア機能を保護する
Qingsheng Niuら、Journal of Intensive Medicine、2022年。
糖尿病性腎症における腸管クロストークと腸内細菌叢を標的とした新規治療法の検討
Yinhua Niら、Acta Biochimica et Biophysica Sinica、2022年。
Powered by
Copyright © 2023 American Society for Clinical Investigation(米国臨床試験学会).
ISSN: 0021-9738(プリント), 1558-8238(オンライン)
アラートメールを登録する
この記事が気に入ったらサポートをしてみませんか?
