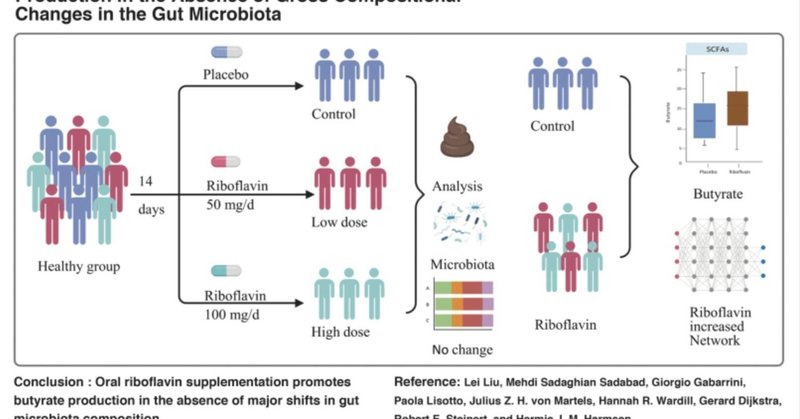
リボフラビン補給は腸内細菌叢の総組成変化を伴わずに酪酸産生を促進する
抗酸化物質と酸化還元シグナル
抗酸化レドックスシグナル 2023年2月; 38(4): 282-297.
オンライン公開 2023年2月14日.
PMCID: PMC9986023
PMID: 35943883
リボフラビン補給は腸内細菌叢の総組成変化を伴わずに酪酸産生を促進する
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9986023/

Lei Liu, 1 Mehdi Sadaghian Sadabad, 1 Giorgio Gabarrini, 1 Paola Lisotto, 1 Julius Z. H. von Martels, 2 Hannah R. Wardill, 3 , 4 Gerard Dijkstra, 2 Robert E. Steinert, 5 , 6 and Hermie J. M. Harmsen 1
著者情報 論文ノート 著作権およびライセンス情報 免責事項
関連データ
補足資料
データ利用声明
戻る
要旨
目的
リボフラビン50mg/日または100mg/日の2週間の補給が、(i)Faecalibacterium prausnitziiの存在量、(ii)腸内細菌叢組成、(iii)短鎖脂肪酸(SCFA)プロファイル、(iv)満腹感および腸内ホルモンに及ぼす影響を検討するために、無作為化プラセボ対照試験RIBOGUTを実施した。
結果
リボフラビンの投与量を個別に分析したところ、いずれもF. prausnitziiの存在量には影響を与えず、SCFA濃度にはわずかな差しか認められなかった。しかし、50mg/d群と100mg/d群の結果を組み合わせると、酪酸産生が有意に増加した。腸内細菌の多様性はリボフラビンの補給によって影響を受けなかったが、細菌ネットワークの複雑性と安定性は向上した。経口ブドウ糖負荷試験では、100mg/日の補給で血漿インスリン濃度とGLP-1の増加傾向が示された。
イノベーション
ビタミンなどの栄養補助食品は、宿主の生理機能を直接標的とするか、腸内細菌叢の調節を介して間接的に健康を促進する。ここで我々は、リボフラビンの介入によって微生物叢の活性が変化することを初めて示した。介入後に酪酸産生が増加し、組成は有意に変化しなかったが、微生物相互作用のネットワークが強化された。
結論
このRIBOGUT試験は、腸内細菌叢の組成に大きな変化がないにもかかわらず、経口リボフラビン補給が酪酸産生を促進することを示唆している。ClinicalTrials.gov Identifier: NCT02929459。
キーワード:リボフラビン、Faecalibacterium prausnitzii、微生物叢、酪酸(短鎖脂肪酸)、インスリン、細菌ネットワーク
戻る
はじめに
ヒトの腸内細菌叢は健康との関連性が高まっている(Zheng et al, 2020)。特に、多様性が高く、厳格な嫌気性短鎖脂肪酸(SCFA)産生菌が豊富な組成は有益であるようだ(Deleu et al, 2021)。ヒト成人の腸内に最も豊富に存在する細菌のひとつがFaecalibacterium prausnitzii(Barcenilla et al, 2000; Duncan et al, 2002)であり、炎症性腸疾患(IBD)や肥満などの腸関連疾患ではその数が減少する酪酸産生菌である(Sokol et al, 2008)。この減少は、腸細胞のエネルギー源であり、抗炎症作用を持つSCFAである腸内の酪酸産生の低下につながる(Correa-Oliveira et al, 2016; Donohoe et al, 2011)。
これらの患者に対する治療法としては、栄養、プロバイオティクス、プレバイオティクスによって、これらのSCFA産生菌(Parada Venegas et al, 2019)、特にF. prausnitziiを増強することが考えられる。抗酸化作用と酸化還元作用を有するビタミンは、腸内細菌叢とそれに関連するメタボロームを調節するための簡単で非常に利用しやすい方法を提供し、そのため、微生物操作を通じて健康を促進することが示唆されている(Steinertら、2020;Steinertら、2016)。
イノベーション
酪酸産生菌であるFaecalibacterium prausnitziiは腸内健康のバイオマーカーであり、リボフラビンはこれらの細菌が電子を酸素にシャトルする酸化還元メディエーターとして利用し、その増殖を改善することが判明した。従って、リボフラビンを食事から補給することで、その量が増加し、健康上の利点が得られるという仮説を立てた。この臨床試験により、リボフラビンが酪酸産生を増加させることが初めて証明されたが、F. prausnitziiの存在量と微生物叢の組成は変化しなかった。さらに、短鎖脂肪酸代謝活性の亢進が引き金となったと思われる、分泌される腸内ホルモンの増加傾向も観察された。このように、微生物活性と食欲・満腹感の腸内ホルモンに影響を与えるビタミンは、肥満や代謝性疾患を管理する新しい方法を提供する可能性がある。さらに、リボフラビン補給後の細菌ネットワークはより多くの相互作用を反映し、微生物叢のさらなる改善を示した。本研究で見出された証拠は、リボフラビンの補給がヒトの腸における代謝機能不全の治療法となり得ることを示唆しており、代謝機能不全コホートにおける調査の正当性を示している。
リボフラビンはビタミンB2としても知られ、様々な細胞プロセスに必要であり、ヒトの健康維持に重要な役割を担っている(Powers, 2003)。この水溶性ビタミンは、微生物とヒト宿主のエネルギー代謝と酸化還元代謝において重要な役割を果たしている(Suwannasom et al, 2020)。さらに、動物モデルを用いた研究では、リボフラビンが抗炎症作用と抗酸化作用を発揮し、腸内の炎症性疾患を改善することが示されている(Biagi et al, 2020; Wu et al, 2021)。リボフラビンは、吸収と全身への取り込みを通じて直接的に、また腸内細菌叢の調節を通じて間接的に、宿主に有益な作用を及ぼす(Pham et al, 2021a)。後者は、リボフラビンの酸化還元特性によって達成され、厳格な嫌気性細菌を非常に支持する、酸化還元電位の低い管腔環境を作り出す。具体的には、リボフラビンはF. prausnitziiの電子メディエーターとして機能し、シスチンや酸素などの外部電子受容体を利用した嫌気性呼吸を可能にする。これにより、低酸素レベルでのF. prausnitziiの増殖が試験管内で促進され(Khan et al, 2012a)、その結果、無酸素状態の内腔から酸素の豊富な粘膜界面へと急峻な酸素勾配が存在する、生体内の腸粘膜の状況を模倣することができる(Khan et al, 2012b; Wang et al, 2012)。リボフラビンを用いた細胞外電子伝達は、特定の細菌種に特異的であるようで、F. prausnitziiでは示されているが、Roseburiaのような他の嫌気性酪酸産生菌では示されていない(Khan et al, 2012b)。このように、リボフラビンを利用して電子シャトルを行い、粘膜界面での増殖を促進するF. prausnitziiの能力から、この経路を標的とした介入を行うことで、腸内におけるF. prausnitziiの存在量を増加させる可能性があることが明らかになった。
F. prausnitziiの抗炎症作用(Flint et al, 2012)とSCFA産生におけるその役割を考慮すると、この細菌の存在量を増加させることは、健康な腸と代謝を維持するために有益であると考えられる。同様に肥満においても、増加したSCFAは遊離脂肪酸受容体FFAR2およびFFAR3のリガンドとして作用し(Kimura et al, 2020)、この受容体が活性化されると、レプチン、グルカゴン様ペプチド-1(GLP-1)、グルカゴン様ペプチド-2(GLP-2)、ペプチドYY(PYY)、コレシストキニン(CCK)などの食欲・体重調節ホルモンの分泌が誘発される。そのため、F. prausnitziiの存在量を増加させることは、肥満と関連する罹患率を抑制するための代替方法となり得る(Brubaker, 2018; Cani et al, 2009; Everard and Cani, 2014; Steinert et al, 2017)。
健康なボランティアを対象とした試験的介入では、100mg/日のリボフラビンを2週間補充することで、11人中8人のボランティアの糞便中のF. prausnitziiの数が増加し、酪酸の産生も増加することがわかった(Steinert et al, 2016)。さらに、リボフラビンの補給は、同じボランティアグループの腸内細菌科細菌(主に大腸菌)の数を減少させたことから、リボフラビンは腸内細菌叢に影響を与える有益な調節能力を持つという仮説が導かれた(Steinert et al, 2016)。
通常、食事から摂取されたリボフラビンは小腸に取り込まれる。しかし、本研究で用いた高濃度のリボフラビンは、推定最大小腸取り込み量である27mg/日(Zempleni et al, 1996)をオーバーシュートするはずであり、したがってリボフラビンは大腸に到達する。その後、70人のIBD患者を対象に、100mg/日のリボフラビンを3週間補充した研究が行われた(von Martels et al, 2020)。その結果、全身の酸化ストレスの軽減、混合抗炎症作用、臨床症状の軽減が認められた。蛍光in situハイブリダイゼーション(FISH)解析では、便中カルプロテクチン濃度が低いクローン病(CD)患者において腸内細菌が減少していることが示されたが、メタゲノムシークエンシング解析では観察されなかった。さらに、このコンセプトは家畜の健康と感染症に対する抵抗力を向上させる実験でも試みられており、ブロイラーに42日間にわたって50mg/kgまたは100mg/kgのリボフラビンを補充すると、家畜の微生物叢が有意に変化した。高用量の方がより効果的で、ビフィドバクテリウムやフェーカリバクテリウムなど、健康を促進する細菌群が特に刺激され、酪酸産生が増加した(Biagi et al, 2020)。さらに、ホルスタイン種雄牛にリボフラビンを補給すると、その成績と腸内細菌叢が改善した(Wu et al, 2021)。
本研究では、これまでのデータを基に、無作為化プラセボ対照試験デザインと2種類の介入量を用いて、健康な個体におけるリボフラビン補給の効果を調べた。RIBOGUT試験では、105人を3群に無作為に割り付け、2週間のリボフラビン経口補給(50および100mg/日)が、プラセボと比較して糞便中のF. prausnitziiの数に及ぼす影響を調べることを主要目的とした。副次的な目的は、(i)微生物叢の組成と腸内細菌科(大腸菌を含む)の豊富さ、(ii)糞便中のSCFAの産生、(iii)有効なvisual analog scale(VAS)アンケートを用いた胃腸(GI)の快適さ(膨満感、鼓腸)、(iv)糞便の乾燥重量、(v)糞便および血漿中のリボフラビン濃度に対する、プラセボと比較したリボフラビン介入の効果に関するものであった。さらに、参加者のサブグループにおいて、血糖、血漿インスリン、GLP-1、GLP-2、グレリン、および経口ブドウ糖負荷試験(oGTT)中のVASを用いた食欲感を測定し、プラセボと比較した。
こちらへ
結果
インフォームド・コンセントを行った157人のボランティアのうち、52人が健康上の問題、定義されたカットオフ値以上の肥満度(BMI)、または試験脱落のいずれかの理由で除外された。残りの105人が3群に無作為に割り付けられた(図1)。ベースラインのコホート特性を表1に示す。プラセボ群は介入群より若く、年齢を除いて群間に差はなかった。
別ウィンドウで開く
図1.
N=105人の参加者に対するリボフラビン介入の研究デザイン(A)、36人の参加者に対するoGTTサブスタディ(B)、および参加者組み入れのフローチャート(C)。 oGTT、経口ブドウ糖負荷試験。
表1.
試験集団のベースライン特性
特徴全体プラセボリボ50リボ100p値N105363633年齢(歳)31.1[11.8]27.2[9.4]33.3[13.0]33.0[11.8]0.04*性別(男性)26(24.8%)9(25.0%)9(25.0%)8(24.2%)0.99身長(cm)170. 73[10.26]168.81[12.37]171.49[9.68]172.00[8.12]0.38体重(kg)63.80[9.55]64.23[8.55]63.60[10.41]63.56[9.89]0.95BMI(kg/m2)21.82 [2.03]22.57 [2.17]21.61 [1.84]21.37 [1.93]0.07
別ウィンドウで開く
有意性を示す。
データは数値[平均[SD]、割合n(%)]で示した。群間の差は、独立標本ANOVA検定または正規分布しない連続変数に対するクラスカル・ワリス検定を適宜用いて検定した。両側p値<0.05を統計的に有意とみなした。
リボフラビン補給がF. prausnitziiおよび他の腸内嫌気性菌の存在量に及ぼす影響
リボフラビンの補充は、FISHによって決定されたFaecalibacteriumの相対量を増加させなかった(図2A、B)。より具体的には、F. prausnitziiの量と割合はリボフラビンの影響を受けなかった。全サンプル中のFaecalibacteriumの相対量は図2Cに描かれており、すべての時点において、すべての群で属レベルでのFaecalibacteriumの数に有意な変化がなかったことを示している。厳密な無作為化にもかかわらず、ベースラインの糞便性細菌の存在量に差が観察されたため、グループ間の比較結果は有意ではないと解釈した。さらに、FISHプローブFprau645の標的部位を含む16S rRNA遺伝子配列決定からASVの相対存在量を算出し(図2D)、リボフラビンがプラセボと比較してF. prausnitziiの存在量に影響を及ぼさないことを示すFISH結果を確認した。
別ウィンドウで開く
図2.
プローブFprau645を用いたFISHおよび16S rRNA遺伝子配列決定に基づくFaecalibacteriumの定量結果。(A-C)FISHによるF. prausnitziiの存在量(A)、相対存在量(B)、および16S rRNA遺伝子配列決定(C)は、3群間ですべての時点にわたって変化しなかった(すべての群についてp>0.05、クラスカル・ワリス検定)。(D)プローブFprau645に対応する16S rRNA遺伝子配列決定によるASVの相対量に変化はなかった。ASV, Amplicon Sequence Variant; FISH, fluorescence in situ hybridization。
さらに、リボフラビンの補充は、プラセボと比較して、Clostridium group XIVa(現在はLachnospiraceae科と呼ばれる)とRoseburiaの相対存在量に、いずれの用量でも影響を及ぼさなかった(補足図S1A-D)。さらに、糞便の乾燥重量に有意な変化は認められず、乾燥重量1gあたりの前述の細菌数も介入によって変化しなかった。
大腸菌を含む病原性の可能性のある腸内細菌科細菌の相対量(補足図S1E、F)も、すべての時点において、すべての群で腸内細菌科細菌とフェカリバクテリウムの比率(補足図S1G、H)と同様に、補充後も変化を示さなかった。参加者とサンプルの特徴、およびFISHデータを補足表S1に示す。
腸内細菌叢の多様性に対するリボフラビン補給の効果
各試験来院時に採取したサンプルの16S rRNA遺伝子配列決定に基づいて、微生物群集構造を特徴付け、微生物多様性によって定量化した。α多様性(シャノン指数および系統的多様性(PD_whole_tree))を算出し、補足表S2に示した。リボフラビンの介入は、腸内細菌叢のα多様性に有意な変化を誘導しなかった。
Bray-Curtis距離およびweighted-Unifrac距離に基づいて、すべてのデータセットについて主座標分析(PCoA)を計算したが(図3)、明確な分離は見られなかった。各群におけるリボフラビン補給前後の参加者間の分類学的組成に有意差は認められなかった(p = 1.00、全群について;図4A-C)。さらに、各群のペアサンプルの分類学的組成を評価したところ、介入とは無関係に、個々のサンプルの違いが分類学的組成の分散に有意に寄与していた(p = 0.001、全群;図4D-F)。
別ウィンドウで開く
図3.
Bray-Curtis(A)およびweighted-Unifrac(B)に基づく分類学的構成間の距離のPCoA(全3群の全時点にわたって)。各ドットは凡例に示すようにカラーコードと形状で区切られたサンプルを表す。PCoA、主座標分析。
別ウィンドウで開く
図4.
T2とT3の間のBray-Curtis距離に基づく個体の分類学的構成のPCoA。(A-C)は、T2とT3の間で比較した各グループのサンプルの分類学的構成、(D-F)は、T2とT3の間で比較した各グループのペアサンプルの分類学的構成。各点はサンプルを表し、破線は同一個体からの糞便サンプルを示す。
T1では重み付けなしのユニフラック距離のPCoAから2つのクラスターに分離が観察され(補足図S2A)、2週間のリボフラビン補給後も、ボランティアごとのサンプルはそれぞれのクラスターに留まった(補足図S2B)。発見された2つのクラスターは、PD_whole_tree指数およびMethanobrevibacterの相対存在量と相関していた。この2つのクラスターへの分割は、Methanobrevibacterの存在と量に基づいており、1つのグループはこの古細菌の数が少なく、もう1つのグループはこの古細菌の数が多かった(補足図S2C)。クラスター2のPD_whole_tree指数とメタノブレ ビバクターの存在量は、クラスター1より有意に高かった(いずれもp < 0.001;ANOVA検定;補足図S2D)。2つのクラスターに基づくと、Bray-Curtis距離とweighted-Unifrac距離に基づいて、それぞれp < 0.001で有意にサンプルが分離した(補足図S3)。
リボフラビン補給は糞便SCFAs濃度を増加させた
リボフラビンの補給は、酪酸、プロピオン酸、酢酸SCFAの糞便濃度を変化させた。T2とT3を比較すると、リボ100群では酪酸の濃度が有意に増加し、リボ50群では酢酸の濃度が有意に増加した(それぞれp=0.05、p=0.02;Wilcoxon符号順位検定;図5)。Ribo50群では、酪酸とプロピオン酸の濃度が増加する傾向が認められたが、有意ではなかった(それぞれp = 0.11, p = 0.10; Wilcoxon signed-rank検定)。
別ウィンドウで開く
図5.
対の糞便サンプルのSCFAs濃度を箱ひげ図にすると、リボフラビン補給2週間後に有意に増加した。(A)酪酸濃度はリボ100群で有意に増加した(p = 0.05、Wilcoxon signed-rank検定);(B)酢酸濃度はリボ50群で有意に増加した(p = 0.02、Wilcoxon signed-rank検定);(C)プロピオン酸濃度には有意な変化は観察されなかった。各点はサンプルを表し、横棒は有意差を示す。SCFAは短鎖脂肪酸。
わずかな有意な効果しか得られなかった3群でのオリジナル解析のほかに、リボコム群のSCFAデータについてアドホック解析が行われた:両リボフラビン介入群の組み合わせ。この併用群では、介入前と介入後のサンプル数の比較が可能となり、実質的に検出力が向上した。この比較では、リボフラビン介入後の酪酸濃度の有意な増加が、Mann-Whitney U検定(T3 vs. T2、p = 0.042、T3 vs. T1、p = 0.03、図6A)およびWilcoxon符号順位検定(p = 0.013、図6B)を用いた一対比較の両方で示された。
別ウィンドウで開く
図6.
糞便中酪酸濃度は、リボフラビン2用量介入群のデータを組み合わせることにより増加した。(A)プラセボ群とリボコム群内での比較(Mann-Whitney U検定)。(B)プラセボ群とリボコム群におけるT2とT3の一対比較(Wilcoxon signed-rank検定)。横棒は調整p値を示す。
さらに、全サンプルのSCFAレベルを細菌組成と相関させたところ、酪酸とFaecalibacteriumの相対存在量との間に有意な相関が観察された(R = 0.26、p < 0.001;補足図S4A)。酪酸と上位30菌属とのピアソン相関は、酪酸を産生することが知られている様々なファーミキューテス(Firmicutes)と正の相関を示し、他のSCFAを産生することが知られている細菌(Streptococcusなど)とも正の相関を示し、相互摂食の相関が示唆された。
さらに、酪酸はバクテロイデス、アリスティペス、パラバクテロイデス、そして驚くべきことに、Faecalibacteriumが属するオシロスピラ科のClostridium_IV、フラボニフラクター、オシリバクターとも負の相関を示した(補足図S4B)(Tindall, 2019)。注目すべきは、Faecalibacteriumのような酪酸産生菌は、他のSCFAレベルおよび総SCFAレベルとも相関していたことである。しかし、各群における全時点でのFaecalibacteriumの相対的存在量には、上述のような差は見られず、T2とT3の間の同一個体からのサンプルのペアワイズ分析でも差は見られなかった(補足図S4C)。注目すべきことに、酪酸レベルと最も有意に相関するすべての属を分析したところ、介入群単独でもリボコム併用群でも、リボフラビン介入に対する反応は認められなかった(補足図S4D)。
リボフラビン介入は細菌ネットワークを強化した
リボコム群における酪酸濃度の上昇の説明を見つけるために、微生物分類群間の相互作用の可能性について細菌ネットワークを解析した。この生態ネットワークツールにより、微生物叢の経時的構造を読み解くことができる(Shi et al, 2022)。図7および補足図S5に示すように、腸内細菌ネットワーク相関の主要なトポロジー的特徴を、個々のグループおよびRiboComグループから算出した。ノード、リンク、密度で示されるネットワークの複雑さは、リボフラビン介入によりT3においてリボ100群とリボコム群で増加し、プラセボ群およびリボ50群とは異なっていた。
別ウィンドウで開く
図7.
全時点にわたる腸内細菌ネットワーク。(A)T1からT4までのプラセボ群(上)とリボコム群(下)の構築されたMENの可視化。上位5つの大きなモジュールは異なる色で示され、小さなモジュールは灰色で示されている。各ネットワークは、プラセボ36サンプルとリボコム69サンプルの細菌ASVの存在量間のピアソン相関(RMTしきい値0.67、FDR調整p<0.05)に基づいて示されている。Nはノード、Lはリンク。(B-E)、リンク(B)、ノード(C)、平均次数(avgK)(D)、平均経路距離(GD)(E)は、腸内微生物ネットワークのトポロジー的特徴である。T1およびT2のベースラインは平均値±SEで計算し、T3およびT4ネットワークの値は点で示した。MENは分子生態ネットワーク、RMTはランダム行列理論。
すべての経験的ネットワークの平均クラスタリング係数(avgCC)は、対応するランダムネットワークよりも高く、経験的ネットワークにおける特異的な相互作用を示した。モジュール性の値は0.4以上であり、構築されたネットワークはavgCCと一致するモジュール構造を持っていた。加えて、リボフラビン補給後のネットワークの安定性は、平均次数(avgK)の増加と平均経路距離(GD)の減少によって改善された。
ネットワークのシードノードと接続についてクラスターを解析し、相互の相関を調べた。RiboComグループの最初のクラスターは、酪酸を産生するAnaerostipes属を種として構成され、介入前は他の属と連結していた。しかし介入後は、最初のクラスターは酪酸産生Roseburia属の種子で構成され、酢酸産生属を含む他の属とつながっていた。介入前後の上位5つのネットワーク・クラスターの情報は補足表S3に掲載されている。
リボフラビン濃度は糞便中および血漿中で上昇した。
リボフラビン濃度は糞便と血漿の両方で測定された。リボフラビン補充2週間後の便中リボフラビンの増加は、oGTT群の血漿中と同様に、リボ50群とリボ100群の両方で観察された(図8)。プラセボ群のリボフラビン濃度は、糞便および血漿のいずれにおいても経時的に変化しなかった。
別ウィンドウで開く
図8.
糞便および血漿サンプル中のリボフラビン濃度の箱ひげ図。(A)糞便サンプル中のリボフラビン濃度は、T3での介入後に有意に増加した(p<0.05、クラスカル・ワリス検定)。(B)oGTT群のリボフラビン血漿濃度は、リボフラビン補充群ともにT3で有意に上昇した(p<0.05、Mann-Whitney U検定)。プラセボ群では、糞便サンプル、血漿サンプルのいずれにおいても差は認められなかった。
oGTT中のグルコースホメオスタシスおよび食欲知覚に対するリボフラビンの効果
興味深いことに、リボフラビンは、100mg/日を投与された参加者のサブグループ(リボ100群)において、食後の血漿インスリン反応に影響を及ぼすようであった。より具体的には、プラセボ群およびリボ50群と比較すると、15分から90分の間に血漿インスリン濃度が上昇する傾向がみられた(図9)。しかし、この傾向は統計学的有意差には達しなかった。さらに、曲線下面積を算出したが、治療法間に有意差は認められなかった。血漿グルコース濃度については、介入に対する変化はなく、影響は認められなかった。また、プラセボ群およびリボ50群と比較した場合、15~120分の間に血漿中のGLP-1が増加する傾向がみられたが、GLP-2やグレリンは増加しなかった(補足図S6)。oGTT中の食欲知覚に対するリボフラビンの影響はなかった(データは示さず)。
別ウィンドウで開く
図9.
リボフラビン補充前のT2(A、C)およびリボフラビン補充後のT3(B、D)における血漿グルコース(A、B)およびインスリン濃度(C、D)の経口ブドウ糖負荷試験結果。
次へ
考察
F. prausnitziiは一貫して健康と関連しており、その存在量または機能性を増加させる方法の研究が必要である(Gacesaら、2022年)。我々のグループや他のグループによるこれまでのデータから、リボフラビンはF. prausnitziiの成長をサポートするのに適した位置にあることが示されている(Khan et al, 2012b; Steinert et al, 2016; von Martels et al, 2020)。そのため、50mg/日と100mg/日のリボフラビンを2週間補充した場合の腸内細菌叢について、プラセボ対照無作為化試験で調査しようとした。本試験の主要目的であるF. prausnitzii量の増加には至らなかった。この酪酸産生菌の細菌量は、FISH分析および16S rRNA遺伝子配列決定によって測定したところ、リボフラビン介入群では有意に増加しなかった。さらに、2週間の介入期間中、すべての試験群で微生物叢の多様性に差は認められなかった。しかし、アドホック解析の結果、リボフラビン併用群では酪酸レベルが上昇し、リボフラビン介入後には細菌ネットワークが強化されることがわかった。さらに、100mg/d群ではインスリンとGLP-1濃度の増加傾向が観察された。ボランティアの健康状態は、臨床血液パラメータを測定することによってアクセスされ(補足表S4)、胃腸の健康を含む有害事象は報告されなかった。
我々の以前のin vitro研究では、リボフラビンは細胞外電子伝達を介して、酸素添加条件下でF. prausnitziiの増殖を刺激した(Khan et al, 2012b)。この結果と、11人中8人のボランティアでF. prausnitziiの増加が認められたパイロット試験の結果から、我々は健康な被験者における高用量リボフラビン補給の効果を包括的に評価するための無作為化臨床試験を実施することにした(Steinert et al, 2016)。
さらに、IBD患者におけるリボフラビン介入の効果を検討する試験(RISE-UP)を開始し、リボフラビン介入による多くの有益性が確認された(von Martels et al, 2020)。健常人集団でこの研究を拡大する必要性は、IBD患者と比較して(低グレードの)炎症や下痢の影響を受けにくい腸内細菌叢が比較的安定していることにある(Gacesa et al, 2022; Sipponen and Kolho, 2015)。さらに、特定の疾患を持つ人々におけるビタミンの効果を研究する根拠は明らかであるが、健康な人々の微生物叢を安定化または改善することで得られる潜在的な利益もある。例えば、微生物の安定性を高めることで、腸に関連した疾患や、例えばウイルスによる感染に対する宿主の抵抗力が高まる可能性がある(Sarkar et al, 2021)。
リボフラビンの主な供給源は食事であり、特に欧米では乳製品から摂取することが多い。しかし、腸内細菌自体もリボフラビンを供給できるようであり(Soto-Martin et al, 2020)、特に非リボフラビン産生のF. prausnitzii A2-165株にとっては重要である。リボフラビンを豊富に含む食品は多種多様にあるが、欧米諸国ではリボフラビンの摂取不足が懸念されている(Powers, 2003)。
ここでは、吸収能(Zempleni et al, 1996)よりも高いリボフラビンを高用量投与し、系を飽和させ、投与不足を回避しようと試みた。しかし、健常人のFaecalibacteriumはすでに十分なリボフラビンを有しており、腸内でさらに飽和させても相対的な存在量は変わらなかった可能性がある。さらに、この2週間の介入(RISE-UPでは3週間)は、腸内細菌叢の組成を変化させるには十分な期間ではなかった可能性がある。組成の変化は観察されなかったが、微生物叢はSCFA産生、特に酪酸産生に変化が観察され、より機能的に活性化しているようであった。Phamらによる以前の研究(2021b)では、ビタミンの投与がin vitroで腸内細菌叢の代謝活性の変化を誘導することを示し、75mg/dのリボフラビンが対照試料と比較して酪酸濃度を増加させることを見出した。
さらに、介入によって微生物ネットワークの複雑性と安定性が向上したことが観察され、代謝の変化と相互摂食の相互作用の増加が示唆された。このことは、総体的な組成の変化がないにもかかわらず酪酸産生が増加した根拠を与えていると考えられる(Flint et al, 2008)。特筆すべきは、酢酸生産菌(Blautiaなど)と酪酸生産菌との相互作用の増加が観察されたことである。というのも、ほとんどの酪酸生産菌は酢酸の利用者であり、通常、酢酸は嫌気性発酵の最終産物と考えられているからである(Duncan et al, 2004)。
これまでのデータでは、微生物の変化には短い介入時間で十分であることが示唆されているが(Walker et al, 2011)、動物実験での介入は、より長い介入時間が必要である可能性を示唆している。例えば、100 mg/kgのリボフラビンを6週間摂取させたブロイラーのヒナでは、ビフィズス菌の増加と酪酸濃度の上昇により、糞便内細菌叢に有意な変化が見られたことが報告されている(Biagi et al, 2020)。ホルスタイン種雄牛を用いた試験では、リボフラビンを雄牛 1 頭当たり 900 mg/d を 24 日間、4 期間に わたって給与したところ、栄養素の消化、ルーメンの総揮発性脂肪酸産生、微生物の増殖、酵素活性に好影響を もたらしたが、成績にはそれ以上の影響は認められなかった(Wu et a., 2021)。これは、より集中的な介入を反映しているのかもしれないが、これらの人体実験と動物実験の結果の違いは、後者の方がよりコントロールされているという事実に起因している可能性もある。
我々の知見を考察する際には、リボフラビンの取り込みと生体内分布を評価することも重要である。リボフラビンの大部分は小腸に取り込まれるが、われわれの高用量投与により、確実に大腸に到達する(Zempleni et al, 1996)。ここでリボフラビンは、大腸に多く存在するため、理論的には腸内細菌叢により大きな影響を及ぼすことができる。本研究コホートの糞便サンプルを分析した結果、リボフラビンはプラセボと比較して介入群で確かに多く含まれていることが確認された。リボフラビンは大腸に到達するが、腸管保護カプセルによってより標的を絞った大腸への送達を行うことで、宿主による小腸への取り込みの妨害効果を回避し、より低濃度でより良い反応が得られる可能性がある(Brosder et al, 2020)。
注目すべきは、この研究データの微生物叢PCoAでは、リボフラビンの介入とは無関係に、非加重ユニフラック距離に基づいて参加者が顕著に分割されたことである。この区分は参加者の微生物叢に基づいており、宿主にメタン産生菌が存在することを示す特徴的な組成を示していた。この結果は、メタン産生が非常に個別的であり、ある個体ではメタンが産生されるが、ある個体ではメタンの存在が検出されないという、以前の報告を裏付けるものである。
ここでは、メタン生成菌の存在は経時的に安定しており、リボフラビンの影響を受けないことを示す。さらに、ペアサンプルのPCoAから、個体レベルではT2とT3の間で分類学的組成にばらつきがあることが示された。しかし、研究対象個体の組成は介入とは無関係にランダムに変化しており、これは個人の日々の食生活の変化に起因している可能性が高い。
有意な変化は個体レベルでのみ検出され、3つのグループ全体にランダムに広がっているように見えたが、ネットワーク解析の結果、T1と比較してT2では細菌ネットワークに軽微な変化が見られた。これは、参加者が試験条件に適応し、モニターされているという意識が高まったためと推測される。このランダムな変動は、図7および補足図S5に、時点T1からT2におけるネットワークの変動として示されている。
T3におけるリボフラビン大量投与の効果は、この変動を明らかに上回った。これはネットワークの複雑性と安定性が強化されたことを示唆しており、ひいては生態学的相互作用が強化されたことを示している(Chen et al, 2022; Shi et al, 2022)。他の群集に相互供給する細菌も、供給されたリボフラビンの恩恵を受け、他の群集との相互作用が強くなる。細菌ネットワークは微生物間の相互作用を反映することになり(Shi et al, 2022)、リボフラビンが微生物叢にどのような影響を与えるかについて新たな知見が得られる。したがって、さらなる研究は、改善されたネットワークの機能的な意味を理解することを目指すべきである。
遊離脂肪酸受容体FFAR2およびFFAR3のリガンドとして作用するSCFAの産生が増加すると、GLP-1やPYYなどの食欲・体重調節ホルモンの分泌が誘発されることが示されている(Everard and Cani, 2014; Steinert et al, 2017)。Mahalleら(2014)の論文によると、リボフラビンやミネラルを含むビタミンの摂取量は、HOMA(恒常性モデル評価)、インスリン抵抗性、炎症マーカーと負の相関があった。しかし、我々の解析では、リボフラビンが腸管ホルモンに有意な影響を及ぼすことはなく、経口耐糖能や食欲知覚には影響を及ぼさなかったが、100mg/dの補充後にインスリン産生やGLP-1の増加傾向が認められた。研究の規模と期間を拡大すれば、この効果を示す統計的検出力をもっと高めることができたであろう。
我々のデータを解釈する上で、多くの限界について考慮する必要がある。上述したように、2週間の介入は短すぎたかもしれず、参加者はすでに変化に強い最適な微生物叢組成を持っていたかもしれない。このことは、FISHと16S rRNA遺伝子配列決定の両方で検出された腸内細菌科細菌の数が少ないことにも反映されている。したがって、腸内細菌科とフェカリバクテリウムの比率はすでに非常に低く、改善されない可能性は低い(天井効果)。これは、IBD患者を対象としたRISE-UP試験でリボフラビンが患者に改善をもたらしたのとは対照的である。さらに、ベースラインの腸内細菌叢組成にはかなりのばらつきがあり、これがこの試験の結果を制限した。対象とした個体数は、我々のパイロット試験(Steinert et al, 2016)に基づくものであるが、より大規模な試験の方が、群の均等化に効果的かもしれない。
さらに、技術的および臨床的な問題により、oGTTボランティアについて意図したすべての解析を実施することができなかったため、このグループは確固とした結論を導き出すには力不足であった。さらに、GLP-1分泌を刺激するために標準的なoGTTを用いた。oGTTは、GLP-1分泌を調査するために様々な試験条件下で様々な集団で使用されているが(Steinert et al, 2017)、調査に対する食欲への影響を調査するためには、標準化された混合食試験がより良かったかもしれない。
この無作為化プラセボ対照試験は、健康なボランティアにおけるリボフラビンのF. prausnitziiの存在量に対する効果を示すために計画されたもので、2つの濃度のどちらを2週間介入しても増加しないことが明確に示された。今回作成されたデータセットでは、リボフラビンの介入により4週間にわたって微生物叢が安定することが示され、さらに重要なことに、腸内細菌叢はより多くのSCFAを産生し活性化されるようであった。この臨床試験の結果から、最大100mg/日の経口リボフラビン補給は、2週間の使用において安全であり、重篤な副作用は報告されていないことが確認された。
結論として、RIBOGUT試験は、高用量の経口リボフラビンによる2週間の介入は、腸内細菌叢の構成には影響を及ぼさなかったが、糞便サンプル中の酪酸濃度の上昇によって示されるように、その活性を増加させることを示した。
次へ
材料と方法
研究対象者
18~60歳の健康体重範囲(BMI 18~25kg/m2)の男女105名を対象とし、無作為に3群に割り付けた。研究参加者が研究に参加する資格があるかどうかを確認するために、研究前の医学的検査が行われた。主な除外基準は以下の通り:胃腸障害、臨床化学および血液学的異常、精神疾患、妊娠中または授乳中、試験期間中の抗生物質、プロバイオティクス、複数のビタミンサプリメントおよび微量栄養素の使用、特定の低カロリーまたは高カロリー食の摂取、がんまたは薬物乱用の既往、試験製品の成分に対するアレルギーまたは過敏症。
データ収集と試験デザイン
本介入試験(ClinicalTrials.gov Identifier: NCT02929459、2016年10月11日登録、https://clinicaltrials.gov/ct2/show/NCT02929459。)は、METc-UMCG2015.510番でUniversity Medical Center Groningenの施設審査委員会により承認された。無作為化プラセボ対照二重盲検並行群間比較試験で、7日間のランイン期間が設けられた。その後、第1群はプラセボを2週間摂取し(「プラセボ」と定義)、第2群はリボフラビン50mgを1日1回朝食時に2週間摂取し(「リボ50」と定義)、第3群はリボフラビン100mgを1日1回朝食時に2週間摂取した(「リボ100」と定義)。
我々は動力計算を行い、用量は100mg/日を14日間使用した我々のパイロット研究(Steinert et al, 2016)に基づいていた。すべての用量は経口カプセルであり、互いに区別できなかった。介入期間の後、7日間のウォッシュアウト期間を設けた。総試験期間は28日間であった。
電子症例報告書(eCRF)データ収集システムが作成され(KOEHLER eClinical GmbH、ドイツ)、参加者ごとのすべてのデータは、微生物叢配列決定データを除き、eCRFに記録された。ここで報告する統計解析には、エクスポートされたeCRFデータを使用した。
参加者には、糞便サンプル採取用の便キットが配布された。便サンプルは参加者が採取し、排便直後に自宅の冷凍庫に保存した。介入前のベースライン(1日目、T1)と7日間の慣らし運転後(7日目、T2)のサンプルが採取された。リボフラビン/プラセボを2週間補給した後(21日目、T3)、7日間洗浄した後(28日目、T4)、図1に詳細を示すように、追加の糞便サンプルを採取した。すべての凍結糞便サンプルは、アイスパックでUniversity Medical Center Groningen(UMCG;オランダ、フローニンゲン)に運ばれ、内部輸送のためにドライアイスに入れられ、その後、凍結保存せずに-80℃で保存された。すべてのサンプルは、シーケンス解析の前に-80℃で1年±4ヶ月間保存された。胃腸の快適さは、Rome III基準の質問票を用いて評価し、血液サンプルは、臨床化学および血液学測定のために、リボフラビン/プラセボ補充前(T0)および補充後(T3)に採取し、-80℃で保存した。
被験者のサブグループ(各グループからn = 15を含むことを意図)は、T2およびT3において標準的な手順(Choi et al, 2013; Ma et al, 2005)に従って実施されたoGTTに参加した。これらの参加者は、一晩絶食(≥10時間)し、前夜午後6時から7時の間に標準化された夕食を摂取した後、午前9時に試験会場に到着した。参加者は自由に水を摂取することができたが、試験日前日の午後12時までとした。試験会場到着の24時間前からアルコール摂取は禁止した。参加者は、試験地に到着する24時間前から激しい運動(例えば、長時間のランニングや負荷のかかるランニングなど)を避けるよう指示された。試験当日、通常のバイタルサインのチェックと腸内健康のバイオマーカー評価のための採血の後、参加者は75gを300mLの水に溶かした経口ブドウ糖負荷を受けた。
ブドウ糖負荷摂取の15分前と摂取直後、および15分後、30分後、60分後、90分後、120分後、150分後に静脈採血(5mL)を行った。サンプルは直ちに遠心分離(800g、10分、4℃)し、-80℃で凍結保存した。そこで、血漿中のGLP-1、GLP-2、グレリン、リボフラビン(空腹時のみ)、インスリンおよび血糖を測定するために、図1に概略を示したように、oGTTに応じて空腹時および食後採血(8×5mL)を一定時間間隔で行った。さらに、食欲知覚(空腹感、満腹感、満腹感など)は、最も肯定的な評価と最も否定的な評価を表す単語を両端に固定した100mmのVASを用いて評価した。
治験製品
リボフラビン/プラセボサプリメントはDSM Nutritional Products社によって製造され、試験7日目に各参加者に届けられるまでUMCG微生物学部門の倉庫に保管された。参加者は2週間、通常の食事にリボフラビン/プラセボサプリメントを毎日摂取した。カプセルに関する追加情報は補足データに記載されている。
SCFAs分析
糞便サンプル中のSCFAs濃度はGC-MS(Gas Chromatography-Mass Spectrometry)で分析した。方法の詳細については前述した(von Martels et al, 2020)。
FISH分析
FISHは自動装置(Biotrack analyzer; Biotrack B.V.; Leeuwarden, Netherlands)を用いて行った。リボフラビン介入の効果を測定するために、F. prausnitzii(Fprau645)、Clostridium group XIVa(Erec482)、Roseburia(Rint623)、Enterobacteriaceae(EC1535)、および総細菌(EUB338)用の蛍光プローブを使用した(Benus et al, 2010; Manichanh et al, 2006)。プローブの配列はSupplementary Dataに掲載されている。
血液分析
血液は標準化されたプロトコール(Supplementary Data)を用いて、資格を有する研究補助者によって採取された。化学および血液学的測定用の血液はUMCGによって分析された。血漿グルコース濃度はYSI 2300 Stat glucose/lactate analyzer(YSI, Inc.) 血清インスリン濃度はラジオイムノアッセイ(Diagnostic Laboratories, Los Angeles, CA)を用いて測定した(Cree et al, 2008)。総GLP-1、GLP-2、およびグレリンは、スイスのDSM Nutritional Products社で、市販のELISAキット(Millipore Corp)を用いて分析した。
DNA 抽出、PCR、16S rRNA 遺伝子配列決定
QIAamp DNA Stool Mini Kit (Qiagen, Hilden, Germany)を用いて0.25 gの糞便サンプルからDNAを抽出した。16S rRNA遺伝子のV3-V4領域を増幅するために、修飾されたバーコード付き341Fおよび806Rプライマー(補足データ)を使用した。PCR、バーコード化プライマー、シークエンシングライブラリー調製の詳細については、以前に記載した(Heida et al, 2016)。アンプリコンはMiSeq Illuminaシーケンスプラットフォームでシーケンスした。
バーコードに基づいてデマルチプレックスしたペアエンドリードをイルミナプラットフォームから取得し、ソフトウェアQIIME(バージョン1.9.1)(Caporaso et al, 2010)で結合した。品質スコア<20のリードはQIIMEによって破棄され、プライマー配列はCutadapt(バージョン3.3)(Martin, 2011)によってカットされた。ノイズ除去(キメラ配列の除去、シングルトンの除去、重複除去)は、USEARCH(バージョン11.0.667)(Edgar et al, 2011)およびVSEARCH(バージョン2.15.0)(Rognes et al, 2016)を用いて行った。リードカウント<3000のサンプルは破棄した。Amplicon Sequence Variants (ASV)は、RDP classifier (Cole et al, 2014)を用いて、Ribosomal Database Project (RDP) set 16に基づいて割り当てた。
統計解析
研究集団の特性は、パーセンテージ、平均値[SD(標準偏差)]、または四分位範囲(IQR)を伴う中央値で示した。平均値±SE(標準誤差)として報告されたoGTTのデータは、時間と群を因子とする二元配置反復測定ANOVAによって解析された。非正規分布の連続変数についてはANOVA検定またはKruskal-Wallis検定(または検定の仮定が満たされない場合はMann-Whitney U検定)を用いて独立標本で群間差を検定した。グループ内分析は、サンプルサイズが異なるため、Kruskal-Wallis検定またはMann-Whitney U検定(適切な場合)、または一対比較のためのWilcoxon符号順位検定を用いて行った。アドホック解析として、Ribo50群とRibo100群の組み合わせも解析し、「RiboCom」群と定義した。
16S rRNA遺伝子配列データは、多変量解析のために累積和スケーリングを使って正規化した。アルファ多様性の計算はQIIMEを用いて行った。β多様性は、主座標分析(PCoA)で表されるさまざまな距離によって計算し、Rパッケージ "phyloseq"(バージョン1.34.0)と "vegan "パッケージのADONIS関数を用いて、999通りの並べ替えでグループ間の有意性を検定した。線形回帰およびピアソンまたはスピアマンの相関分析は、Rパッケージ "base"、"psych"(バージョン2.1.3)および "corrplot"(バージョン0.87)を用いて行った。
分子生態ネットワーク(MEN)は、対数変換したASV存在量のピアソン相関に基づいて構築し、続いてランダム行列理論に基づくアプローチにより、相関カットオフ閾値を自動計算した(Carr et al, 2019; Goberna et al, 2019; Zhou et al, 2010)。手法と統計ツールは、現在オープンアクセス可能なMolecular Ecological Network Analysis Pipeline(http://ieg2.ou.edu/MENA)(Deng et al, 2012)が示す設定を用いて適用した。ネットワークのクラスタリングには、Cytoscape(バージョン3.9.0)のMolecular Complex Detection (MCODE) アルゴリズム(Bader and Hogue, 2003)をデフォルト設定で使用した。
p値<0.05を統計的に有意とみなした。p値はBenjamini-Hochberg法を用いて多重検定用に調整した。
次へ
補足資料
補足資料:
表示するにはここをクリック(874K, docx)
補足データ:
こちらをクリック(161K, docx)
補足データ:
こちらをクリック(13K, docx)
補足データです:
閲覧はこちらから(212K, docx)
補足データです:
閲覧はこちらから(154K, docx)
補足データです:
閲覧はこちらから(403K, docx)
補足データです:
こちらをクリック(940K, docx)
補足データです:
閲覧はこちらから(39K, docx)
補足データです:
閲覧はこちらから(368K, docx)
補足データです:
閲覧はこちらから(18K, docx)
補足データです:
閲覧はこちらから(29K, docx)
こちらへ
謝辞
本研究に参加されたすべての方々、およびすべての技術的サポートに感謝する: Juliana Seip, Nesrine Hasnaoui, Carien Bus-Spoor, Rudi Tonk, Hermi Kingma, Rebecca Heiner-Fokkema, Gijs Jansen (Biotrack), Nienke Verheij-Jansen, Danielle Noordhuis, Roelof Bekkema, Annemieke Visser, Jackie Dekens, Jan Sikkema, Birgit Warning (Koehler-eclinical), Jonas Wittwer-Schegg (DSM).
こちらへ
使用された略語
ASVAmplicon Sequence VariantBMIbody mass indexCCKcholecystokininCDCrohn's diseaseeCRFelectronic case report formFISHfluorescence in situ hybridizationGC-MSgas chromatography-mass spectrometryGLP-1glucagon-like peptide-1GLP-2glucagon-like peptide 2IBDinflammatory bowel diseasesIQRinterquartile rangesMCODEmolecular complex detectionMENsmolecular ecological networksNCBINational Center for Biotechnology InformationoGTToral glucose tolerance testPCoAprincipal coordinate analysisPYYpeptide YYRDPribosomal database projectRMTrandom matrix theorySCFA短鎖脂肪酸SDstandard deviationSEstandard errorSRAsequence read archiveUMCGUniversity Medical Center GroningenVASvisual analog scale
このページのトップへ
著者の貢献
M.S.S.、H.J.M.H.、G.D.、R.E.S.は、概念化、方法論、医療倫理承認に貢献した。G.D.とH.J.M.H.は資金を獲得した。M.S.S.、G.G.、J.Z.H.v.M.が臨床試験を実施し、H.J.M.H.とR.E.S.が試験監督を行った。M.S.S.、G.G.、P.L.、L.L.がデータキュレーションと解析を行い、R.E.S.とH.J.M.H.が解析を監修した。P.L.とL.L.がデータの可視化を行い、L.L.とH.J.M.H.が論文を執筆し、R.E.S.、H.R.W.、G.D.、H.J.M.H.が論文の校閲と編集を行った。すべての著者が最終論文に同意した。
次へ
データの利用
シーケンス生データは、BioProject PRJNA791950のアクセッション番号でNational Center for Biotechnology Information (NCBI) Sequence Read Archive (SRA)に提出された。この研究で生成または解析されたすべてのデータは、この論文(およびその補足ファイル)またはSRAに含まれており、自由にアクセスできる。
こちらへ
著者開示声明
本臨床RIBOGUT試験は、DSM Nutritional Products AGのスポンサーによるものである。H.J.M.H.とG.D.はDSM社から研究助成を受けた。
研究助成金
資金提供情報
本研究はDSM Nutritional Products社から資金提供を受けた。さらに、L.L.はChina Scholarship Council (CSC19908320432)から資金援助を受けており、University Medical Center Groningenからも一部支援を受けている。P.L.はMarie Skłodowska-Curie Actions(助成金契約番号:713660-PRONKJEWAIL-H2020-MSCA-COFUND-2015)の支援を受けている。H.R.W.はNHMRC CJ Martin Biomedical Research Fellowshipの奨学生である。
次へ
補足資料
補足データ
補足図S1
補足図S2
補足図S3
補足図S4
補足図S5
補足図S6
補足表S1
補足表S2
補足表S3
補足表S4
に進む:
参考文献
Bader GD, Hogue CW. 大規模タンパク質相互作用ネットワークにおける分子複合体の自動探索法。このような研究は、日本ではほとんど行われていません。[このような研究は、日本ではほとんど行われていない。
酪酸菌の系統関係. ヒト腸内酪酸産生菌の系統関係。酪酸産生菌の系統関係, Appl Environ Microbiol 2000;66(4):1654-1661; doi: 10.1128/AEM.66.4.1654-1661.2000. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Benus RF、Harmsen HJ、Welling GW、ら。ICU患者における消化管および口腔咽頭の除染が腸内細菌叢に及ぼす影響。Intensive Care Med 2010;36(8):1394-1402; doi: 10.1007/s00134-010-1826-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Biagi E、Mengucci C、バローネM、ら。ブロイラーの微生物叢とメタボロームにおけるビタミンB2補給の効果。Microorganisms 2020;8(8):1134; doi: 10.3390/microorganisms8081134. [この論文では、ブロイラーの微生物叢とメタボロームについて研究している。
pH依存性回腸薬物送達、パートII:新規薬剤と新規賦形剤の前臨床評価。Drug Discov Today 2020;25(8):1374-1388; doi: 10.1016/j.drudis.2020.06.012. [PubMed] [CrossRef] [Google Scholar].
Brubaker PL. グルカゴン様ペプチド-2と腸の成長と機能の調節。Compr Physiol 2018;8(3):1185-1210; doi: 10.1002/cphy.c170055. [PubMed] [CrossRef] [Google Scholar].
Cani PD, Lecourt E, Dewulf EM, et al. プレバイオティクスの腸内細菌叢発酵は、食欲感覚と食後のグルコース反応に影響を及ぼす満腹感とインクレチン腸ペプチド産生を増加させる。Am J Clin Nutr 2009;90(5):1236-1243; doi: 10.3945/ajcn.2009.28095. [PubMed】【CrossRef】【Googleスカラー
Caporaso JG, Kuczynski J, Stombaugh J, et al. QIIMEは高スループットコミュニティシーケンスデータの解析を可能にする。この論文では、QIIMEを利用した高スループットコミュニティシーケンスデータの解析を紹介する。[PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
微生物学における相関分析の使用と乱用。微生物生態学における相関分析の使用と乱用。ISME J 2019;13(11):2647-2655; doi: 10.1038/s41396-019-0459-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
陳Q-L、胡H-W、孫A-Q、他。土壌原生生物ネットワークの複雑性と安定性を低下させる乾燥。Soil Biol Biochem 2022;166:108575; doi: 10.1016/j.soilbio.2022.108575. [CrossRef] [Google Scholar].
Choi HJ, Jeon SY, Hong WK, et al. 炎症と酸化ストレスの血漿マーカーにおけるブドウ糖摂取の影響: 健常者と糖尿病患者の経口ブドウ糖負荷試験サンプルから得られた16種類の血漿マーカーの分析。Diabetes Res Clin Pract 2013;99(2):e27-e31; doi: 10.1016/j.diabres.2012.01.005. [PubMed] [CrossRef] [Google Scholar].
(1)遺伝子発現、(2)遺伝子発現、(3)遺伝子発現、(4)遺伝子発現 リボソームデータベースプロジェクト: 高スループットrRNA解析のためのデータとツール。Nucleic Acids Res 2014;42(Database issue):D633-D642; doi: 10.1093/nar/gkt1244. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Correa-Oliveira R、Fachi JL、Vieira A、ら。短鎖脂肪酸による免疫細胞機能の制御。Clin Transl Immunol 2016;5(4):e73; doi: 10.1038/cti.2016.17. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cree MG, Zwetsloot JJ, Herndon DN, et al. インスリン感受性は、急性熱傷の小児における脂肪酸化およびプロテインキナーゼC活性と関連している。J Burn Care Res 2008;29(4):585-594; doi: 10.1097/BCR.0b013e31817db88f. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
デリューS、Machiels K、Raes J、ら。短鎖脂肪酸とその産生生物: IBDの見落とされた治療法?EBioMedicine 2021;66:103293; doi: 10.1016/j.ebiom.2021.103293. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
鄧Y、江YH、楊Y、他。分子生態ネットワーク解析。(注1)本論文は、本論文の一部である。[このような研究は、日本ではほとんど行われていない。
DonohoeDR、Garge N、Zhang X、他。微生物と酪酸は哺乳類大腸のエネルギー代謝とオートファジーを制御する。哺乳類大腸におけるマイクロバイオームと酪酸のエネルギー代謝およびオートファジー制御. Cell Metab 2011;13(5):517-526; doi: 10.1016/j.cmet.2011.02.018. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
ダンカンSH、ホールドGL、ハームセンHJM、他。また、このような病原性細菌は、その増殖に必要な菌種を特定することが困難であることから、病原性細菌をFaecalibacterium prausnitzii gen. [このような研究は、日本ではほとんど行われていない。
Duncan SH, Holtrop G, Lobley GE, et al. ヒト糞便細菌による酪酸生成への酢酸の寄与。Br J Nutr 2004;91(6):915-923; doi: 10.1079/BJN20041150. [PubMed] [CrossRef] [Google Scholar].
Edgar RC, Haas BJ, Clemente JC, et al. UCHIMEはキメラ検出の感度と速度を向上させた。Bioinformatics 2011;27(16):2194-2200; doi: 10.1093/bioinformatics/btr381. [この論文では、キメラを検出する方法について解説している。
Everard A, Cani PD. 腸内細菌叢とGLP-1。Rev Endocr Metab Disord 2014;15(3):189-196; doi: 10.1007/s11154-014-9288-6. [PubMed] [CrossRef] [Google Scholar].
Flint HJ, Bayer EA, Rincon MT, et al. 腸内細菌による多糖利用: ゲノム解析による新たな知見の可能性。(2):121-131;doi:10.1038/nrmicro1817。[PubMed][CrossRef][Googleスカラー]。
フリントHJ、スコットKP、ダンカンSH、他。腸内における複合糖質の微生物分解。腸内細菌2012;3(4):289〜306; doi:10.4161/gmic.19897. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Gacesa R, Kurilshikov A, Vich Vila A, et al. オランダの集団における腸内細菌叢を形成する環境要因。ネイチャー2022;604(7907):732-739; doi:10.1038/s41586-022-04567-7. [PubMed】【CrossRef】【Google Scholar
Ghoshal U、Shukla R、Srivastava D、ら。過敏性腸症候群、特に便秘優勢型は、より高いメタン産生に関連するメタノブレビバクター・スミティーの増加を伴う。Gut Liver 2016;10(6):932-938; doi: 10.5009/gnl15588. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
ゴベルナM、モンテシノス-ナバロA、ヴァリエンテ-バヌエットA、ら。アンプリコン配列に基づく微生物共起ネットワークに系統学的指標を組み込み、群集形成プロセスを識別する。Mol Ecol Resour 2019;19(6):1552-1564; doi: 10.1111/1755-0998.13079. [PubMed] [CrossRef] [Google Scholar].
Heida FH, van Zoonen A, Hulscher JBF, et al. 壊死性腸炎に関連した腸内細菌叢がメコニーに存在する: 前向き研究の結果。Clin Infect Dis 2016;62(7):863-870; doi: 10.1093/cid/ciw016. [PubMed] [CrossRef] [Google Scholar].
Khan MT, Browne WR, van Dijl JM, et al. Faecalibacterium prausnitziiは細胞外電子伝達にリボフラビンをどのように利用できるのか?(注1)本論文は、(1)本論文の一部であり、(2)本論文の一部ではありません。[PubMed] [CrossRef] [Google Scholar].
Khan MT, Duncan SH, Stams AJ, et al. 腸内嫌気性細菌Faecalibacterium prausnitziiは、細胞外電子シャトルを用いて酸化-無酸素間相で増殖する。(1):1578-1585、(2):1578-1585、(3):1578-1585、(4):1578-1585; doi: 10.1038/ismej.2012.5. [PMCフリーペーパー] [PubMed] [CrossRef] [Google Scholar].
木村一彦、市村明宏、大植北野玲、他。健康と疾患における遊離脂肪酸受容体. Physiol Rev 2020;100(1):171-210; doi: 10.1152/physrev.00041.2018. [PubMed] [CrossRef] [Google Scholar].
Knobbe TJ, Douwes RM, Kremer D, et al. 腎移植レシピエントにおける腸内微生物発酵の変化とMethanobrevibacter smithiiによるコロニー形成。J Clin Med 2020;9(2):518; doi: 10.3390/jcm9020518. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Ma SW, Tomlinson B, Benzie IF. 血漿酸化物質に対する経口グルコース負荷の影響に関する研究: 正常被験者における抗酸化バランス。Eur J Nutr 2005;44(4):250-254; doi: 10.1007/s00394-004-0518-7. [PubMed】【CrossRef】【Googleスカラー
マハレN、クルカルニMV、ナイクSS、ら。インド人の糖尿病と冠動脈疾患を持つ被験者のインスリン抵抗性と炎症マーカーと食事要因の関連性。J Diabetes Complications 2014;28(4):536-541; doi: 10.1016/j.jdiacomp.2012.09.008. [PubMed] [CrossRef] [Google Scholar].
Manichanh C, Rigottier-Gois L, Bonnaud E, et al. クローン病における糞便微生物叢の多様性の減少がメタゲノムアプローチによって明らかになった。Gut 2006;55(2):205-211; doi: 10.1136/gut.2005.073817. [PMCフリー記事] [PubMed] [クロスリーフ] [Google Scholar] 。
遺伝子発現を解析するために必要な遺伝子発現の情報を収集したデータベース。EMBnetjournal 2011;17(1):3; doi: 10.14806/ej.17.1.200. [CrossRef] [Google Scholar].
Parada Venegas D, De la Fuente MK, Landskron G, et al. 短鎖脂肪酸(SCFAs)を介した腸上皮および免疫制御と炎症性腸疾患との関連性。Front Immunol 2019;10:277; doi: 10.3389/fimmu.2019.00277. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Pham VT, Dold S, Rehman A, et al. ビタミン、腸内細菌叢とヒトの胃腸の健康。Nutr Res 2021a;95:35-53; doi: 10.1016/j.nutres.2021.09.001. [PubMed] [CrossRef] [Google Scholar].
Pham VT, Fehlbaum S, Seifert N, et al. ヒト腸内細菌叢の組成と代謝活性に対する大腸標的ビタミンの効果-パイロット研究。腸内細菌2021b;13(1):1-20; doi:10.1080/19490976.2021.1875774. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
パワーズHJ。リボフラビン(ビタミンB-2)と健康。Am J Clin Nutr 2003;77(6):1352-1360; doi:10.1093/ajcn/77.6.1352. [PubMed】【CrossRef】【Googleスカラー
Rognes T、Flouri T、ニコルズB、ら。VSEARCH: メタゲノミクスのための汎用性の高いオープンソースツール。論文名:PeerJ2016;4:e2584; doi: 10.7717/peerj.2584. [PMCフリー論文] [PubMed] [CrossRef] [Google Scholar].
Sarkar A, Harty S, Moeller AH, et al. SARS-CoV-2に対する感受性の差のバイオマーカーとしての腸内細菌叢。(1)SARS-CoV-2感染症に対する腸内細菌叢(Microbiome)の役割,(2)SARS-CoV-2感染症に対する腸内細菌叢(Microbiome)の役割. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Shi J, Sun Y, Wang X, et al. マイクロプラスチックは土壌微生物ネットワークの複雑性と生態学的決定論的選択を減少させる。Environ Microbiol 2022;24(4):2157-2169; doi: 10.1111/1462-2920.15955. [このような研究は、日本ではほとんど行われていない。
Sipponen T, Kolho KL. 炎症性腸疾患の診断と臨床評価における糞便カルプロテクチン。Scand J Gastroenterol 2015;50(1):74-80; doi: 10.3109/00365521.2014.987809. [PubMed] [CrossRef] [Google Scholar].
Sokol H, Pigneur B, Watterlot L, et al. クローン病患者の腸内細菌叢解析により同定されたFaecalibacterium prausnitziiは抗炎症性常在菌である。この論文では、クローン病患者の腸内細菌叢を解析した結果、Faecalibacterium prausnitziiが抗炎症性常在菌であることを明らかにした。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
ヒトのビタミン生合成機構を明らかにした。ヒト腸内酪酸産生菌によるビタミン生合成と合成微生物群集におけるクロスフィーディング. mBio 2020;11(4):e00886-20; doi: 10.1128/mBio.00886-20. [このような研究は、バイオインフォマティクスの研究者であるSteinert RE.
スタイナーRE、ファインレ-ビセットC、アサリアンL、ら。グレリン、CCK、GLP-1、およびPYY(3-36): 健康、肥満、およびRYGB後の摂食と血糖における分泌制御と生理的役割。Physiol Rev 2017;97(1):411-463; doi: 10.1152/physrev.00031.2014. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
腸内細菌叢のためのビタミン。Trends Mol Med 2020;26(2):137-140; doi: 10.1016/j.molmed.2019.11.005. [PubMed] [CrossRef] [Google Scholar].
スタイナーRE、Sadaghian Sadabad M、Harmsen HJ、ら。プレバイオティクスの概念と人間の健康: 新たなプレバイオティクス候補としてのリボフラビンの変化?Eur J Clin Nutr 2016;70(12):1348-1353; doi: 10.1038/ejcn.2016.119. [PubMed] [CrossRef] [Google Scholar].
Suwannasom N, Kao I, Pruss A, et al. リボフラビン:忘れられた天然ビタミンの健康上の利点。Int J Mol Sci 2020;21(3):950; doi: 10.3390/ijms21030950. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Tindall BJ. Hungateiclostridium Zhang et al. 2018、Hungateiclostridium thermocellum (Viljoen et al. 1926) Zhang et al. 2018、Hungateiclostridium cellulolyticum (Patel et al. 1980) Zhang et al. 2018、Hungateiclostridium aldrichii (Yang et al. 1990) Zhang et al. 2018、Hungateiclostridium alkalicellulosi (Zhilina et al. 2006) Zhang et al. 2018、Hungateiclostridium clariflavum (Shiratori et al. 2009) Zhang et al. 2018、Hungateiclostridium straminisolvens (Kato et al. 2004) Zhang et al. 2018およびHungateiclostridium saccincola (Koeck et al. 2016) Zhang et al. 2018は、原核生物の命名法の国際規約51bに違反し、Acetivibrio属のPatel et al. 1980の代替名を必要とする。Int J Syst Evol Microbiol 2019;69(12):3927-3932; doi: 10.1099/ijsem.0.003685. [PubMed] [CrossRef] [Google Scholar].
von Martels JZH, Bourgonje AR, Klaassen MAY, et al. クローン病患者におけるリボフラビン補充[RISE-UP試験]。J Crohns Colitis 2020;14(5):595-607; doi: 10.1093/ecco-jcc/jjz208. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ウォーカーAW、インスJ、ダンカンSH、ら。ヒト大腸内細菌叢における優性および食事反応性細菌群。(2):220-230;doi:10.1038/Ismej.2010.118。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Wang HB, Wang PY, Wang X, et al. 酪酸は、タイトジャンクションタンパク質クローディン-1の転写のアップレギュレーションを介して腸上皮バリア機能を高める。この論文では、酪酸が腸管上皮のバリア機能を高めることを明らかにした。[PubMed] [CrossRef] [Google Scholar].
Wu HM, Zhang J, Wang C, et al. 畜牛の成績、栄養消化、ルーメン微生物叢組成および活性に及ぼすリボフラビン補給の影響。Br J Nutr 2021;126(9):1288-1295; doi: 10.1017/S0007114520005243. [PubMed][CrossRef][Googleスカラー]。
Zempleni J, Galloway JR, McCormick DB. 健康なヒトにおける経口および静脈内投与リボフラビンの薬物動態。Am J Clin Nutr 1996;63(1):54-66; doi: 10.1093/ajcn/63.1.54. [PubMed] [CrossRef] [Google Scholar] 。
健康と病気における微生物叢と免疫の相互作用。Cell Res 2020;30(6):492-506; doi: 10.1038/s41422-020-0332-7. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
(注1)この論文では、「生物多様性」をキーワードに、「生物多様性」と「生物多様性」の関係性を明らかにすることを目的としている。(1):e00169-10;doi:10.1128/mBio.00169-10。[PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
Antioxidants & Redox Signalingの記事はMary Ann Liebert, Inc.の好意によりここに提供されています。
アマ アパ ムラ NLM
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ、メリーランド州20894
ウェブポリシー
情報公開
HHS脆弱性情報公開
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
保健省
USA.gov
この記事が気に入ったらサポートをしてみませんか?
