
ケトン体はエピジェネティクスを介してミトコンドリアを維持する
本文へスキップ記事へスキップ
エルゼビアのロゴ
JACC 基礎からトランスレーショナルサイエンス
第8巻、第9号、2023年9月、1138-1140ページ
オリジナル研究 - 前臨床
論説コメント
ケトン体はエピジェネティクスを介してミトコンドリアを維持する
https://www.sciencedirect.com/science/article/pii/S2452302X23002346
著者リンク オーバーレイパネルを開く向井理沙博士、佐渡島順一医学博士
もっと見る
論文概要
共有
引用
https://doi.org/10.1016/j.jacbts.2023.05.013
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
参考文献
ケトン体はエピジェネティックなリモデリングを介してミトコンドリア機能不全を救う
JACC: ベーシックからトランスレーショナルサイエンス、第8巻、第9号、2023年9月、1123-1137ページ
ジェシカ・ガンバルデラ, スタニスロヴァス・S・ヤンカウスカス, ウルナ・カンサカー, ファヒメ・ヴァルジデ, ロベルタ・アヴィサト, ネラ・プレヴェーテ, シモーネ・シドリ, パスクアーレ・モーネ, 王秀軍, アンジェラ・ロンバルディ, ガエタノ・サントゥッリ
PDFを見る
執筆者情報
ダウンロード: 高解像度画像のダウンロード(277KB)
ダウンロード フルサイズ画像のダウンロード
前の記事次の記事
キーワード
エピジェネティクス心不全ヒストンメチル化ケトン体PGC-1α
ケトン体は、脂肪酸の利用が低下したときの代替燃料源として機能するだけでなく、酸化とは無関係にシグナル伝達分子として働き、心臓を保護することから、心不全研究の多くの研究者の注目を集めている1。β-ヒドロキシ酪酸(BHB)、アセト酢酸、アセトンなどのケトン体は、肝ケトジェネシス経路で産生された後、肝外臓器で酸化され、ミトコンドリアでケト分解を受けてアセチルコエンザイムAを産生し、これがトリカルボン酸サイクルに入り、酸化的リン酸化を介してアデノシン三リン酸を産生する。ケトン体の利用は、マウスでもヒトでも、心肥大や心不全の際に増加し、それによって不全心臓において有益な役割を果たす。しかし、ケトン体の分子作用、特に酸化とは無関係に作用するケトン体の分子作用についての理解はまだ限られている。
BHBが複数のメカニズムを通じてエピジェネティクスに影響を与えることを示唆する証拠が増えてきている: Gambardellaら3は、偏りのない質量分析を行い、2つのリジン残基におけるヒストン3の同時メチル化、すなわちヒストン3のリジン27のジメチル化とヒストン3のリジン36のモノメチル化(H3_K27me2K36me1)が、マウスおよびヒトの虚血後心不全で誘導されることを観察した。研究グループは、H3_K27me2K36me1がBHBによって負に制御されることを発見した。さらに、ミトコンドリアの機能と生合成のマスターレギュレーターであるPPARGコアクチベーター1α(PGC-1α)は、H3_K27me2K36me1によって負の制御を受けている。心不全の間のPGC-1αのダウンレギュレーションは、BHBの存在下で緩和され、ミトコンドリア機能障害と心不全の逆転を伴った(図1)。
ダウンロード 高解像度画像ダウンロード(485KB)
ダウンロード フルサイズ画像のダウンロード
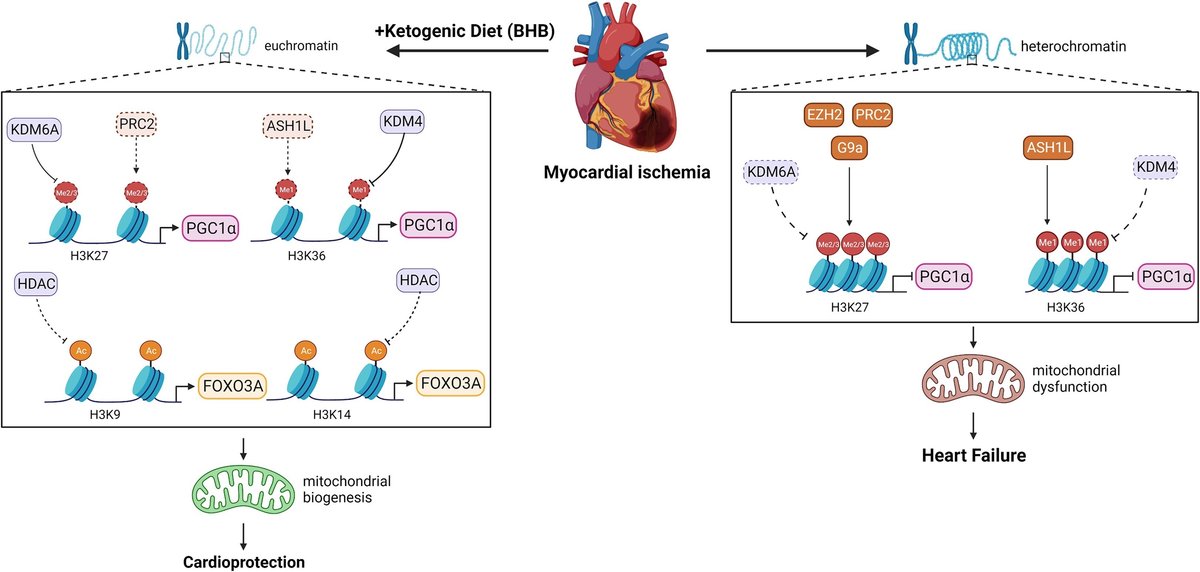
図1. BHBを補充したケトジェニック食が心筋虚血中のマウス心臓の保護効果を媒介する潜在的分子メカニズム
虚血と心不全は、ヒストン3のリジン27のジメチル化(H3K27me2)とヒストン3のリジン36のモノメチル化(H3K36me1)を増加させ、それによってヘテロクロマチンを誘導し、PPARGコアクチベーター1α(PGC-1α)の転写を抑制する。β-ヒドロキシ酪酸(BHB)を添加したケトン食は、ポリコンブ抑制複合体2(PRC2)やabsent, small, or homeotic discs 1-like(ASH1L)などのメチル基転移酵素を阻害することによって、おそらくH3K27me2とH3K36me1を阻害し、ユークロマチンとPGC-1αの転写を回復させる。PGC-1αの発現が回復すると、ミトコンドリア機能が維持され、心機能が維持される。BHBはまた、ヒストン脱アセチル化酵素1(HDAC1)を阻害することにより、H3K9とH3K14のアセチル化を介して細胞保護メカニズムをアップレギュレートする可能性がある。EZH2 = enhancer of zeste homolog 2; FOXO3A = forkhead box O3-A; G9a = H3K27を標的とするメチルトランスフェラーゼ; KDM = histone demethylase。
Gambardellaらによる報告3は、BHBのシグナル伝達作用に関する新しい知見を提供するものである。BHBは、ヒストン脱アセチル化酵素1(HDAC1)の阻害を介してヒストンK9およびK14のアセチル化を促進するが、これはBHBが短鎖脂肪酸である酪酸と構造的に類似しており、HDAC1の酵素活性に直接影響を与えるためと考えられる。このアセチル化によって、フォークヘッドボックスO3-A(FOXO3A)を介した遺伝子転写が促進され、マウス腎臓のストレスに対する保護がもたらされる。BHBはまた、リジンアセチルトランスフェラーゼのEP300ファミリーの活性を促進し、それによって神経細胞を酸化ストレスから保護する。さらに、BHBはヒストン脱メチル化酵素であるKDM6aを阻害することによってH3K4me3を促進し、ヒストンのPTMである非酵素的に促進されるヒストンリジンβ-ヒドロキシブチル化を誘導する。BHBによるヒストンのPTMは、一般に様々な器官においてストレス耐性を与える。Gambardellaら3は、BHBがH3_K27me2K36me1を阻害することで、ヘテロクロマチンを緩和し、ミトコンドリア機能改善のための遺伝子発現プログラムを再活性化する可能性が高いことを示している。H3_K27me2K36me1は、ストレスや心不全が存在する心臓で増加し、ミトコンドリア機能の抑制と相関しているようであった。Gambardellaら3人の研究は、H3_K27me2K36me1という新規のH3 PTMが心不全の病態に果たす役割に光を当てただけでなく、それがBHBによってどのように制御されるかも示唆した。
Gambardellaら3は、H3_K27me2K36me1の効果は主にPGC-1αの抑制を介して媒介されると提唱している。PGC-1αは心不全患者や動物モデルにおいて一様に発現低下しているわけではないが、PGC-1αの持続的な発現低下が心不全の進行を促進する可能性がある。Gambardellaら3は、ストレス時にH3_K27me2K36me1とPGC-1αプロモーターとの会合が増加し、H3K27を標的とするメチル化酵素であるG9aの阻害剤BIX01294によってPGC-1αのダウンレギュレーションが緩和されることを示した。このように、H3_K27me2K36me1は、PGC-1αのダウンレギュレーションを通してミトコンドリアの機能不全を促進するようである。ストレス下の生後心臓におけるH3K27me2/3の機能的意義は、最近解明され始めたばかりである。もう一つのメチル基転移酵素でありポリコンブ抑制複合体2の構成要素であるエンハンサー・オブ・ゼステ・ホモログ2によって触媒されるH3K27のジおよびトリメチル化は、虚血性心筋症で増加しており、遺伝子のリプログラミングに寄与している可能性がある。H3K27メチル化の機能的役割は文脈に依存する可能性がある。圧力過負荷から心臓を保護する可能性がある一方で、イオンチャネルをダウンレギュレートすることによって有害に働く可能性もある。さらに、H3_K27me2K36me1の機能は、H3K27me2単独の機能とは異なるかもしれない。したがって、心筋ストレス時のH3_K27me2K36me1の増加が、クロマチン構造、転写因子に対するゲノムDNAのアクセシビリティ、および下流の遺伝子セットの発現にどのように影響するかを明らかにするためには、さらなる研究が必要である。例えば、トランスポザーゼアクセス可能なクロマチン配列決定アッセイにより、エピジェネティクスへの影響を通してBHBにより発現が制御されるPGC-1α以外の因子を同定できるかもしれない。
H3K36meのメチル化はユークロマチンと関連し、活発に転写される遺伝子に沿って濃縮される。しかしながら、菌類における以前の研究では、欠失、小またはホメオティックディスク1様メチルトランスフェラーゼによって触媒されるH3K36me1/H3K36me2が遺伝子の抑制を駆動し、H3K27me2/3マークを増加させることが示されている5。さらに、H3K36me1がどのようにH3K27meと協調して心臓のヘテロクロマチンを達成するのかも不明である。
Gambardellaら3は、BHBがヒストンメチルトランスフェラーゼの阻害剤であるS-アデノシルホモシステインのレベルを増加させることを示した。S-アデノシルホモシステインは、ほとんどのS-アデノシルメチオニン依存性メチルトランスフェラーゼの触媒領域に高い親和性で結合し、強力な生成物阻害剤として作用する。したがって、BHBはヒストンメチル化酵素の活性を広く阻害する可能性がある。この観察結果は、BHBが独立したシグナル伝達分子として働くかもしれないという仮説を補強するが、BHBがG9aや、存在しない、小さい、あるいはホメオティックディスク1ホモログを選択的に標的とするさらなるメカニズムを明らかにする必要がある。重要なことは、BHBは複数のメカニズムで心臓を保護するため、H3_K27me2K36me1に対するBHBの抑制作用が、in vivoでの心機能の改善という二次的なものである可能性を完全に排除することはできないということである。
Gambardellaら3は、BHB投与が虚血および心不全時のPGC-1αの発現低下を抑制することにより、PGC-1αの発現を維持することを示している。PGC-1αは心筋細胞で高発現し、ミトコンドリアの呼吸機能と脂肪酸酸化率を維持している。したがって、心不全時にPGC-1αの機能が維持されるメカニズムを理解することは不可欠である。PGC-1αの発現は複数の転写因子とエピジェネティックなメカニズムによって制御されており、後者にはH3K4me3、H3K9me3、H3K9アセチル化が含まれる。したがって、PGC-1αの発現を制御する上で、H3_K27me2K36me1が他のメカニズムよりも相対的に重要であるかどうかは、まだ解明されていない。一つの注意点は、PGC-1αの機能は、それ自体のPTMやエピジェネティクスによっても制御されているということである。したがって、PGC-1αの全体的な活性がBHB存在下での心不全の間にどのように制御されるかを明らかにするためには、さらなる調査が必要である。
まとめると、Gambardellaら3人の研究は、心不全におけるケトン体の有用な作用に関する知識を拡大するものである。特に、この研究は、HDAC1阻害剤としてのその確立された機能に加えて、BHBがシグナル伝達分子としての効果を通じてH3メチル化に影響を及ぼす可能性を示唆している。この研究は、BHBが心不全治療に必要な基本的特徴であるミトコンドリア機能を維持する能力を持つことを示している。エピジェネティクスへの影響は、持続的に複数の遺伝子部位に広く影響する可能性があるため、心臓のクロマチン修飾に対するBHBの有益な効果を、広範かつ偏りのない方法で明らかにすることは興味深い。さらに、ヒトの心臓におけるケトジェニック食のエピジェネティック効果を調べることも重要であろう。
資金援助および著者開示
本研究の一部は、米国公衆衛生局の補助金HL67724、HL91469、HL102738、HL112330、HL138720、HL144626、HL150881およびAG23039(佐渡島博士へ)、米国心臓協会18POST34060247(向井博士へ)および20 Merit 35120374(佐渡島博士へ)、Fondation Leducq Transatlantic Network of Excellence 15CVD04(佐渡島博士へ)の助成を受けた。
謝辞
原稿を批評的に読んでくださったDaniela Zablocki氏に感謝する。
参考文献
1
T.R. Matsuura、P. Puchalska、P.A. Crawford、D.P. Kelly
ケトン体と心臓:代謝原理と治療的意義
Circ Res, 132 (7) (2023), pp.
CrossRefScopusで見るGoogle Scholarで見る
2
H.B.ルアン、P.A.クロフォード
エピジェネティック修飾因子としてのケトン体
Curr Opin Clin Nutr Metab Care, 21 (4) (2018), 260-266頁
CrossRefScopusで見るGoogle Scholarで見る
3
J. Gambardella, S.S. Jankauskas, U. Kansakar, et al.
ケトン体はエピジェネティックなリモデリングを介してミトコンドリア機能障害をレスキューする
J Am Coll Cardiol Basic Trans Science, 8 (9) (2023), pp.1123-1137
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
4
R. Papait, S. Serio, G. Condorelli
心不全におけるエピゲノムの役割
Physiol Rev, 100 (4) (2020), pp.
CrossRefScopusで見るGoogle Scholarで見る
5
V.T.ビコッカ、T.オームズビー、K.K.アドヴァリュ、本田聡、E.U.セルカー
ASH1触媒によるH3K36メチル化は遺伝子抑制を駆動し、H3K27me2/3コンピテントクロマチンをマークする
eLife, 7 (2018), Article e41497
ScopusGoogle Scholarで見る
引用者 (0)
著者らは、著者らの所属機関のヒト研究委員会および動物福祉規則、ならびに適切な場合には患者の同意を含む食品医薬品局ガイドラインを遵守していることを証明する。詳しくはAuthor Centerをご覧ください。
∗
JACC: JACC: Basic to Translational Scienceに掲載された論説は著者の見解を反映したものであり、必ずしもJACC: Basic to Translational ScienceまたはAmerican College of Cardiologyの見解を代表するものではありません。
© 2023 The Authors. 米国心臓病学会財団の委託によりエルゼビアが発行。
エルゼビアのロゴとワードマーク
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はElsevier B.V.に帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
