皮膚感染症における難治性病変を引き起こす orf ウイルスと黄色ブドウ球菌の協力関係
本文へスキップ
トップバーナビゲーション
細胞・感染微生物学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
52
総閲覧数
6
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
ミニレビュー記事
フロント Cell. Infect. 微生物学, 08 January 2024
Sec.ウイルスと宿主
第13巻 - 2023年|https://doi.org/10.3389/fcimb.2023.1213694
この論文は次の研究テーマの一部です
ウイルス疾患: 出現と免疫のメカニズム
全3記事を見る
皮膚感染症における難治性病変を引き起こす orf ウイルスと黄色ブドウ球菌の協力関係
https://www.frontiersin.org/articles/10.3389/fcimb.2023.1213694/full?utm_source=dlvr.it&utm_medium=twitter

Yongzhong Yu1* Yudong Cui1 Baifen Song2*
1中国、大慶市、黒龍江省八一農業大学生物科学技術学院
2中国農業大学獣医学部、北京、中国
さまざまな種類の微生物が、細胞宿主を含む環境圧力に共同で対処できることを示す証拠は数多くある。例えば、ORFV(上皮親和性パラポックスウイルス)と細菌(黄色ブドウ球菌やレンサ球菌など)による動物の二次感染や混合感染では、間接的に病気の悪化につながる相互扶助モードが見られることが多い。しかし、病的微小環境における細胞宿主の乗っ取りや破壊の仕方など、共病原性メカニズムに関する研究が不足しているため、この複雑な感染症の発症過程や結果についての深い理解や臨床的治療法の開発が妨げられている。ここでは、先に定義したORFV-宿主(O-H)システムに基づき、細胞宿主を共に捕捉する現在の戦略をまとめた。黄色ブドウ球菌の日和見侵入は、O-Hの微妙なダイナミックバランスを破壊し、その結果、(Agrを介した)細菌産物による組織障害を悪化させ、敗血症を引き起こしたり、サイトカインストームを誘発したりさえした。実際、適応制御システム(VARS)からのウイルス産物は免疫攻撃を弱め、分子経路をブロックするため、黄色ブドウ球菌はよりスムーズにそこに定着し、毒素はより迅速に局所組織に浸透することができる。本論文では、混合感染に対処する際に細胞宿主が直面する主な課題に焦点を当て、将来この病気に対処するための出発点を提供する。
O-H系の確立は二次感染を引き起こしやすい
Orfは主にヒツジやヤギなどの小型反芻動物、時には野生動物に感染している(Hosamani et al.) ORFVはウイルス分類学上、ポックスウイルス科パラポックスウイルス属(PPV)の代表的なメンバーであり(Matthews, 1982)、ヒトに対する人獣共通感染症の重要性を持つ。PPVはラクダやシカなど他の種にも感染することがある。ORFVに感染すると、傷ついた皮膚に伝染性の紅斑が生じるが(Mercerら、2006年)、二次感染や混合感染を起こさない限り、全身感染を起こすことはまれである(Robinson and Lyttle、1992年)。
以前、私たちはORFV-宿主(O-H)系、すなわちO-Hを定義し、両者間の潜在的な動的関係と相互適応について説明した(Yu et al.、2022)。感染中、ORFVは主に自然免疫応答(IIR)と適応免疫応答(AIR)を逆に調節することにより、宿主細胞に干渉してウイルス工場を免疫排除から守ろうとする(図1)。ウイルス工場は、宿主環境に適応するための計画におけるO-Hの重要な要素である。したがって、このシステムは排除と反排除の関係を反映する装置であると思われる。生存戦略により、O-Hはウイルスによって注意深く管理され、IIRやAIRを経験する際に多くの相互作用を指示する。この目的のために、ウイルスは主に細胞内で2'-5'オリゴアデニル酸合成酵素(OAS)/RNase Lなどのシグナル経路の効果的な作動を妨害する(Yuら、2022)。しかし、細胞外サイトカインはウイルス回避機構の主な標的である(Hernaez and Alcam, 2020)。そのため、ポックスウイルスは、vIL-18BP、vIFN-IBP、CrmDなどのような、サイトカインIL-1-β、TNF、および/またはIFN-Iを隔離または中和するための、細胞対応物のいくつかのデコイ受容体を発現している(Hernaez and Alcam, 2020)。上述したように、増殖・拡散するためには、ウイルスは宿主の自然免疫に対抗しなければならない(Silverman, 2015)。ホメオスタシスに戻るためには、宿主細胞は緊急メカニズムを活性化し、感染を抑制するために局所細胞を動員しなければならない。多くのウイルス遺伝子が発現し、感染細胞内で作用して、IIRとAIRの効果から抗ウイルス宿主応答を逆に阻害している。回避を容易にするために、ウイルスは必要に応じて宿主細胞のストレス応答を不活性化しようとする。
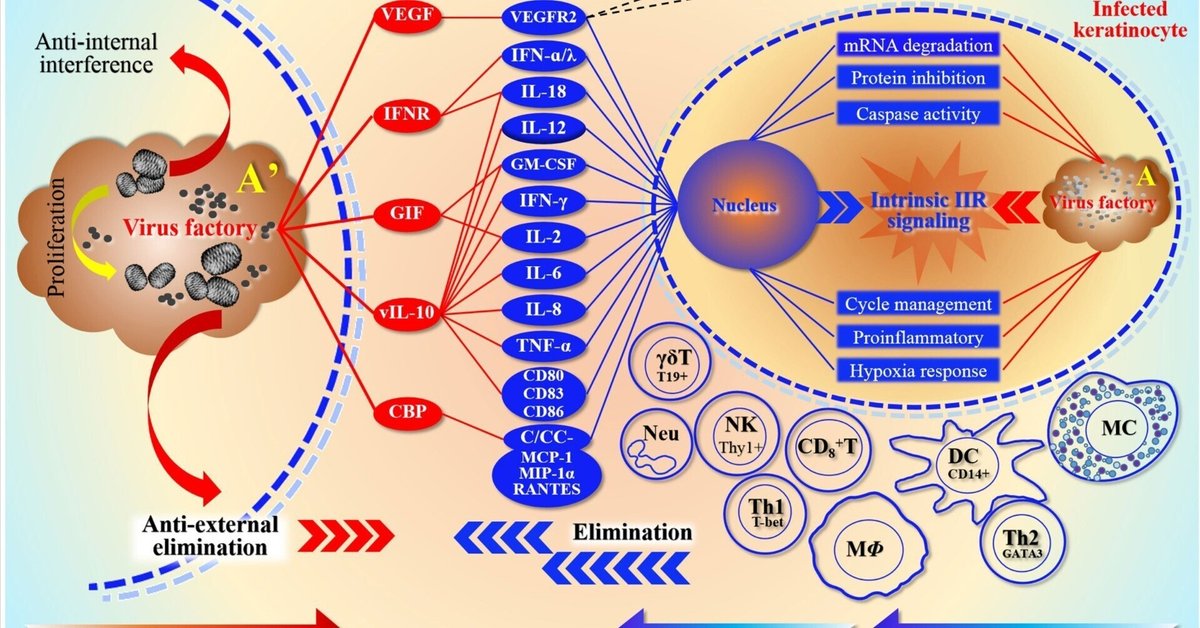
図1
www.frontiersin.org
図1 O-Hシステムの深さ分解能の模式図 O-HシステムにおけるORFVの宿主拮抗作用と競合の関係を詳しく説明する。この図は双方が代表する陣営メンバーの配列の形を示している。これは両者がそれぞれの「エフェクター」を動員する能力を反映しており、またこれらのストレスエフェクターに対する両者の依存性も反映している。ORFVの場合、感染による免疫排除からウイルス工場を守るために、主にIIRとAIRを調節することによって、宿主の複数のストレスレベルに干渉しようとする。図の左上は、細胞外細胞に対するORFVの抗ウイルス効果を表している。赤い楕円形のカラーブロックはウイルス成分を表すが、VEGFは別に宿主細胞から分泌されるエフェクター分子と拮抗し、それによって免疫細胞の活性化を阻害し、その結果、自然免疫と適応免疫のレベルを弱める。VEGFの主な機能は、その細胞受容体VEGFR2と結合することであり、その結果、細胞増殖と新生血管形成を促進する。図の右上は、ウイルスと宿主の細胞内競争の焦点である。実際には、核内の核酸によってコード化された遺伝情報とウイルス工場内の遺伝情報との間の決闘である。右図の中段と下段にある様々な活性化された免疫細胞は、主に防御に関与する細胞であり、自然免疫細胞やリンパ球など、ウイルスに感染したKCによって誘導される。図下部の赤と青の矢印は、それぞれウイルスと宿主の免疫応答の中和関係を表している。このうち、自然免疫はより活性が高い(符号は+++)。一方、特異的免疫の段階では、Th1細胞のみがより活性が高い(符号は+)。抗原提示細胞(マクロファージや樹状細胞など)がウイルスによって阻害されると、抗体の分泌や機能に大きな影響が出るためである。プラス記号の数は効果の大きさの強さを表す。ここで、Arsquo;はAの拡大プロットであり、感染KCにおける右側の拡大ウイルス工場マップを表している。
構成的構造遺伝子に加えて、ウイルス免疫調節因子は、O-H恒常性の維持を前提に、免疫刺激を弱め、感染の進展を維持する役割を担っている。もちろん、宿主の圧力に打ち勝つウイルスの制御能力は、これらの側面をはるかに超えている(Yu et al.) 免疫調節因子は、オルソポックスウイルスとは異なるウイルスの明確な属種特性を支えている。一般に、これらの遺伝子は宿主環境に適応するためにウイルスに選択的に取り込まれ(Fleming et al. 今日、私たちはこれらの遺伝子の構成を人工的に改変することで、外来遺伝子を導入し、ウイルスを用いた治療用ワクチンの設計など、いくつかの動的遺伝子導入施設(代替ベクターの可能性)を開発することができる(Rzihaら、2000;Amannら、2013;Schneiderら、2020)。残念なことに、O-Hのホメオスタシスは、黄色ブドウ球菌やレンサ球菌のような日和見感染者によって容易に乱される可能性がある。二次感染という事態は、病状を非常に複雑化させ、全身病変を引き起こすことさえある。
黄色ブドウ球菌はO-Hを破壊し、Orfの二次感染における宿主の微小環境を悪化させる。
ここ数十年、ヒトおよび動物患者における細菌の二次感染の病原性は急速に増加している(Pastor et al.) このことは、牛群の健康と福祉、環境、生物学的安全性に対する人々の懸念を喚起している。Orfはそのような皮膚に影響を及ぼす疾患であり、S. aureusにとって大きなギャップを生み出し、またそのO-Hプログラムを混乱させる(Chi et al.) このことは、二次感染における黄色ブドウ球菌の高い検出率によって強調されている(Pastorら、2020)。従って、orfは黄色ブドウ球菌の二次感染に大きな利便性をもたらす可能性がある。
これまで、orfの二次感染に関する報告や文献は数多くあるが、体系的な研究はほとんどない。最近、二次感染する細菌の種類と量について詳細な分析を行った研究者がいる(Pastor et al.) その統計データによると、二次感染率は42%であり、二次感染症例における黄色ブドウ球菌の検出率は58%と高かった。また、二次感染の30%からは2種類以上の菌が検出された(Pastor et al.) 生物学的材料はルーマニアの5つの羊の群れからしか採取されていないが、世界的な有病率を非常によく表している。
病理学的検査により、二次感染病変は自己修復が困難であり、重篤な潰瘍や壊疽がいつでも出現することが判明した。単純な感染に比べ、環境感染による微生物の繁殖は前例がない。個体の免疫レベルの違いから、死の危険が近づいているのかもしれない(図2の瀕死のボーアヤギの子供を参照)。最終的な分析によれば、これらはすべて、ウイルスと細菌の組み合わせが宿主を "ハメた "結果である。同じようなウイルスとバクテリアの協力関係が見つかるかもしれない。例えば、単純ヘルペスウイルス(HSV)1型感染は、黄色ブドウ球菌の上皮組織への侵入を促進する(Wang et al.) ここで、黄色ブドウ球菌はO-Hを乱すだけでなく、自己限定的なorfに基づくより複雑な疾患の形成を促進することがわかる。
図2
www.frontiersin.org
図2 混合感染におけるORFV(VARS)と黄色ブドウ球菌(Agr)の相乗効果 この図は、宿主の免疫クリアランス効果(緑色の部分)に対処するために、ORFV(VARS)と黄色ブドウ球菌(Agr)が共感染中に細胞内外を協力している様子を詳細に描写している。現在のところ、ORFVとブドウ球菌およびレンサ球菌との共感染の臨床例から、相互利益の関連証拠を発見することができる。ORFVは様々な細胞(IKKおよびNF-κBシグナル伝達;様々な病原性因子および免疫制御分子を通して)の活性を制限し(赤茶色の部分)、細菌の拡大と侵入を促進する。(Chanら, 2006; Chenら, 2016; Couñagoら, 2015; Dielら, 2010; Dielら, 2011; Flemingら, 2015; Haig, 2006; Imlachら, 2002; Khatiwadaら, 2017; Lateefら, 2003; Liuら, 2021; Nagendraprabhuら、 2017; Nardo et al., 2008; Ning et al., 2013; Pastor et al, 2020; Shi et al., 2015; Wang et al., 2010; Westphal et al., 2009; Wise et al., 2012; Yu et al., 2020; Zecconi and Scali, 2013; Zhao et al., 2016)。
混合感染の過程では、局所病変におけるサイトカインの量と活性が著しく増加する。一般に、サイトカインの過剰分泌により、病変部位の血管透過性が(免疫細胞をリクルートするために)上昇し、細菌が血管内に侵入しやすくなると同時に、血管内の体液の滲出が促進され、組織が破壊される。黄色ブドウ球菌のあらゆる種類の病原因子は、宿主によって頻繁に対処される(図2参照)。表皮バリアの破壊を放置しておくと、タンパク質の損失を招き、角膜デスモソーム接合部の切断が促進され(Gomesら、2021))、体液や電解質のバランスが崩れ、局所感染や全身感染のリスクが高まる。したがって、黄色ブドウ球菌は宿主上皮の微小環境を破壊し、敗血症とサイトカインストームを引き起こす危険性が高い。
orfウイルスと黄色ブドウ球菌の相乗作用の分子メカニズム
黄色ブドウ球菌がORFウイルスと協力してIIRやAIRを含む宿主免疫クリアランスに対処する分子機構を研究する過程で、我々は主な戦略をまとめ、細胞内および細胞外の抗宿主免疫効果の主要な方法を示した(詳細は図2を参照)。実際、これらの効果は、病原体のよく発達した制御機構に基づいている。一つはORFVの適応制御システム(VARS)と呼ばれるもので、もう一つは主に黄色ブドウ球菌のAgrシステムに由来するものである。Agrによって制御される黄色ブドウ球菌の細胞外酵素には、セリンプロテアーゼ、システインプロテアーゼ、メタロプロテアーゼファミリーが含まれ(Dubin, 2002)、組織損傷に重要な役割を果たすとともに、宿主の免疫攻撃に抵抗することができる。中でも、プロテアーゼV8としても知られるグルタミン酸エンドペプチダーゼは、免疫グロブリン(IgM、IgG、IgD、IgE)を分解することができ(Miedzobrodzkiら、1987;Takai and Ikeda、2011;Burchackaら、2013)、ウイルスの休息と生産性の回復に有益である。一方、黄色ブドウ球菌はガスデルミンタンパク質ファミリーの1つであるGSDMDをアップレギュレートし、CXCL1-CXCR2軸を阻害することで、好中球の動員を阻害することもできる(Liuら、2021年)。さらに、ブドウ球菌α-毒素は、IIRとAIRからのウイルス回避を促進するために導入された(Binら、2012年)。その見返りとして、ORFVは黄色ブドウ球菌によるサイトカイン活性化を部分的に緩和する。例えば、ORFVのCKBPは、CCL2、CCL3、CCL5、CXCL1、CXCL2、XCL1などのケモカインを阻害し、好中球、単球、樹状細胞(DC)、マスト細胞、Tリンパ球などの免疫細胞が病変部位に集まるのを効果的に防ぐことができる(Couñagoら、2015;Sharifら、2019)。
ORFVと黄色ブドウ球菌が宿主上皮に共存することは、異常な警告であると私たちは考えている。また、アポトーシスとIKK複合体経路を阻害することによる、ORFVの黄色ブドウ球菌に対する保護効果も無視できない。もう一つの顕著な役割は、IL-6(Wang and Luo, 2018)とメタロプロテアーゼ(MMP2、MMP9)の分泌を共同で促進し、さらにケモカインを阻害することである。IL-6はケラチノサイトの異常分化を誘導し、ケラチンK1、K10、フィラグリン(FLG)、ロリクリン(Son et al. さらに、IL-6は細胞骨格の変化と表皮バリア機能障害を引き起こす。この協力関係は、黄色ブドウ球菌の局所組織コロニー形成に有益であるだけでなく、ORFVの免疫回避にも有益であると推察できる。
議論に値するその他の側面
最近、ゲノムの系統学的解析により、PPVのORFVインターフェロン抵抗性タンパク質(VIR)のN末端およびC末端ドメインに高度に保存されたアミノ酸残基が存在し、これがZ-DNAおよびdsRNA結合を担っていることが判明した。通過位置、すなわちN37、Y41、P57、W59(Z-DNA結合用)およびE116、F127、F141、K160(dsRNA結合用)は、ORFV VIRに対応した(Karki et al.) この状況は、ORFVの宿主特異的な適応性を反映している。さらに、黄色ブドウ球菌やレンサ球菌などの病原性細菌が同じ宿主に持ち込まれることは避けられない。このような混合感染では、両者の結託は完全な一致と言うことができ、両者は共通の目的である免疫回避のために最善を尽くす。宿主からの回避については、ORFV感染の後期には、ウイルスが誘導するアポトーシスが、感染細胞の崩壊によって子孫ウイルスの拡散に有利に働く可能性がある(Castanier and Arnoult, 2011)。黄色ブドウ球菌が関与している場合、アポトーシスの誘発は細菌の放出にも有益であるため、より決定的なものになると考えられる。
一方、ORFVの害だけを一方的に強調し、混合感染プロットがORFVの利用価値を圧倒するようなことはできない。不活化ORFVを投与すると、選択されたIIR機構が一過性に刺激され、これが生体内でのウイルス・細菌感染に対する免疫増強効果に寄与すると考えられる(Anzilieroら、2014年)。この防御効果は、宿主の様々なメカニズムによって媒介されると考えられている(Weber et al.) これは、感染誘発免疫抑制の追加的なメカニズムによって均衡が保たれており、単一サイトカイン療法と比較して調節能力を示している(Friebeら、2011年)。宿主にとって、自然免疫記憶の手順、すなわち訓練された免疫は、新たな感染に対する免疫応答における宿主の防御の基本的な特性である(Neteaら、2016)。Gillardらは、VACVをプライミングしたマウスのThy1+ NK細胞は、適応免疫細胞の非存在下でもVACVチャレンジに対する防御力を低下させなかったと報告している(Gillardら、2011)。同様に、非許容性の宿主イヌでは、イヌの血液中の食細胞やTリンパ球が不活化ORFVによって活性化される可能性がある(Schützeら、2009年)。これらの効果が持続的で、特異的で、予測可能で、臨床的に有意であることが証明されれば、ORFVの免疫訓練は慰めの可能性を解放することができる(Song and Colonna, 2018)。したがって、不活化ORFVは、様々な抗感染療法における使用の可能性についてさらに研究されるべきである(Paulsenら、2013;Anzilieroら、2014;Wang and Luo、2018)。現在までに、不活化ORFVが抗ウイルス活性を有することを示す報告もある(Weberら、2003;Linら、2015)。ORFVは、ギニアにおける性器ヘルペスの再発を予防することができる(Onsら、2014)。Friebeらは、in vivo動物モデルでの所見と一致して、不活化ORFVがヒト免疫細胞に作用し、その結果、Th1およびTh2のサイトカインの放出が制御されることを実証した(Friebeら、2004)。このことは、単回治療試験後に動物やヒトに重篤な副作用がなかったことからも裏付けられている(Friebeら、2011年)。
腫瘍溶解効果を持つVACVとして、キメラORFV CF189は、103 PFUという低用量で、in vitroでの効果的な細胞毒性およびin vivoでの抗腫瘍効果が証明されている。これらのデータは、トリプルネガティブ乳がんに対するこの非常に有効な薬剤の臨床開発を後押ししている(Choi et al.) オンコリティックORFVおよびVACVの周術期投与は、NK細胞の阻害を逆転させることができることは注目に値する(Tai et al.) さらに、ORFVは組換えワクチンを製造するためのキャリアとして使用することができる(Tanら、2012;Wassieら、2019;Tiwariら、2020)。
結論と展望
結論として、ORFVはパラポックスウイルスの典型的な代表として、宿主との共進化戦略に関与するO-Hの構築と安定性を維持することで、種の伝播という目的を達成することを目指している。しかし、それは往々にして希望的観測である。O-Hが確立されると、病原体によってはORFVを仲介者あるいは共犯者として侵入する機会を得る。ここでは、ORFVとS. aureusの一時的な協力関係を説明し、宿主のIIRとAIRに反応する彼らの共病原性様式と分子メカニズムについて深く述べる。さらに、二次感染や混合感染がORF動物の重要な死因となっていることを示唆し、研究者や一般の人々に注意を喚起する。
ORFVと細菌の混合感染については長い歴史があるが、現場では十分な注目と深い研究がなされてこなかった。現在では、この疾病の頻発は、動物群の福祉や環境の安全性と密接に関係していると思われる。そのため、効果的な疾病予防・管理システムを確立する必要がある。良好な飼養管理はもちろんのこと、オーエフ病の早期発見も非常に重要である。特に、二次感染を防ぐためには、慎重な治療が重要である。さらに、遺伝子工学技術を用いた混合ワクチンの開発も、こうした病気の蔓延を防ぐ有効な手段である。極めて有利な条件は、ORFV自身の免疫増強能と遺伝子導入ビヒクルである。従って、ORFVを用いた組換え核酸ワクチンや二次感染治療用生物製剤の臨床応用が可能である。
著者貢献
YY、YC.は原稿の構想およびデザインを行った。BSはデータ解析を行った。YY.とBS.はリソースを提供した。著者全員が最終原稿を読み、承認した。
資金提供
黒龍江省自然科学基金会一般プログラム(No.c2017052)、黒龍江省八一農業大学博士研究スタートアップ資金プロジェクト(B2010-09)、NSFC(中国国家自然科学基金)プロジェクト(No.31172353、No.32272991)に感謝する。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
参考文献
Amann, R., Rohde, J., Wulle, U., Conlee, D., Raue, R., Martinon, O., et al. 狂犬病ウイルス糖タンパク質を発現する組み換えorfウイルス(パラポックスウイルス)に基づく新しい狂犬病ワクチン。J. Virol. 87 (3), 1618-1630. doi: 10.1128/JVI.02470-12.
パブコメ要旨|全文|Google Scholar
Anziliero, D., Weiblen, R., Kreutz, L. C., Spilki, F., Flores, E. F. (2014). Inactivated Parapoxvirus ovis induces a transient increase in the expression of proinflammatory, Th1-related, and autoregulatory cytokines in mice. Braz. J. Med.Biol. ブラジルJ.Med.Biol.Res. 47, 110-118.
パブコメ要旨|全文|Google Scholar
Bin, L., Kim, B. E., Brauweiler, A., Goleva, E., Streib, J., Ji, Y., et al. 黄色ブドウ球菌α-毒素は、ウイルス感染に対する皮膚宿主反応を調節する。J. Allergy Clin. Immunol. 130 (3), 683-691.e2. doi: 10.1016/j.jaci.2012.06.019.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Burchacka, E., Skoreński, M., Sieńczyk, M., Oleksyszyn, J. (2013). 黄色ブドウ球菌エンドプロテアーゼglucの不可逆的阻害剤としてのグルタミン酸のホスホン類似体:効率的な合成とヒトigg分解の阻害。Bioorganic Medicinal Chem. バイオオーガニック・メディシナル・ケミストリー 23 (5), 1412-1415.
クロスレフ・フルテキスト|Google Scholar
Castanier, C., Arnoult, D. (2011). 宿主防御を覆す手段としてのウイルスタンパク質のミトコンドリア局在化。Biochim. Biophys. Doi: 10.1016/j.bbamcr.2010.08.009.
パブコメ抄録|全文|Google Scholar
Chan, A., Baird, M., Mercer, A. A., Fleming, S. B. (2006). ヒト樹状細胞の成熟と機能は、orfウイルスにコードされたインターロイキン-10によって阻害される。J. Gen. Virol. 87, 3177-3181. doi: 10.1099/vir.0.82238-0.
パブコメ要旨|全文|Google Scholar
Chen, D., Zheng, Z., Xiao, B., Li, W., Long, M., Chen, H., et al. Orf virus 002 protein targets ovine protein S100A4 and inhibits NF-κB signalaling. Front. Microbiol. 7, 1389. doi: 10.3389/fmicb.2016.01389.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chi, X., Zeng, X., Luo, S. (2017). 中国福建省のヤギで発生した細菌混合感染を伴う多巣性皮膚orfウイルスの診断と系統解析。Arch. Virology. Arch. Virol. 162 (10), 2997-3006. doi: 10.1007/s00705-017-3424-z
クロスレフ・フルテキスト|Google Scholar
Choi, A. H., O'Leary, M. P., Chaurasiya, S., Lu, J., Kim, S. I., Fong, Y., et al. トリプルネガティブ乳癌におけるオンコリティック免疫療法としての新規キメラパラポックスウイルスCF189。doi: 10.1016/j.surg.2017.09.030.
PubMed Abstract|クロスリファレンス全文|Google Scholar
クニャーゴ、R.M.、ナップ、K.M.、中谷、Y.、フレミング、S.B.、クラウス、K.L.(2015)。orf ウイルスケモカイン結合タンパク質と宿主ケモカインとの複合体の構造から、幅広い結合特異性の手がかりが明らかになった。Structure 23 (7), 1199-1213.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Diel, D. G., Delhon, G., Luo, S., Flores, E. F., Rocket, D. L. (2010). パラポックスウイルスorfウイルスがコードするNF-κBシグナル伝達経路の新規阻害剤。J. Virol. 84, 3962-3973. doi: 10.1128/JVI.02291-09
パブコメ要旨|全文|Google Scholar
Diel, D. G., Luo, S., Delhon, G., Peng, Y., Flores, E. F., Rock, D. L. (2011). OrfウイルスORFV121は、ウイルスの病原性に寄与するNF-κBの新規阻害因子をコードする。J. Virol. 85, 2037-2049. doi: 10.1128/JVI.02236-10
パブコメ要旨|全文|Google Scholar
Dubin, G. (2002). ブドウ球菌の細胞外プロテアーゼ Biol. Chem. 383 (7-8), 1075-1086.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Fleming, S. B., Wise, L. M., Mercer, A. A. (2015). orfウイルスの分子遺伝学的解析: 皮膚に適応したポックスウイルス。ウイルス 7, 1505-1539.
パブコメ要旨|全文|Google Scholar
Friebe, A., Friederichs, S., Scholz, K., Janssen, U., Scholz, C., Schlapp, T., et al. orf virus (parapoxvirus ovis)の免疫刺激性成分の特性。J. Gen. Virol. 92, 1571-1584. doi: 10.1099/vir.0.028894-0.
パブコメ抄録|全文|Google Scholar
Friebe, A., Siegling, A., Friederichs, S., Volk, H. D., Weber, O. (2004). ヒト末梢免疫細胞に対する不活化パラポックスウイルスOVIS(ORFウイルス)の免疫調節効果:単球およびTh1様細胞におけるサイトカイン分泌誘導。J. Virol. 78, 9400-9411.
パブコメ要旨|全文|Google Scholar
Gillard, G. O., Bivas-Benita, M., Hovav, A. H., Grandpre, L. E., Panas, M. W., Seaman, M. S., et al. ワクシニアウイルスプライミングマウス由来のThy1+ Nk細胞は、適応リンパ球が存在しない場合、ワクシニアウイルスチャレンジに対する防御をもたらす。PloS Pathog. 7, e1002141. doi: 10.1371/journal.ppat.1002141
PubMed要旨|全文|Google Scholar
Gomes, T. F., Calado, R., Gonalo, M. (2021). アトピー性皮膚炎における表皮バリア機能障害。Portuguese Soc. Dermatol. 79 (3), 207-216. doi: 10.29021/spdv.79.3.1405
CrossRef 全文|Google Scholar
Haig, D. M. (2006). Orfウイルス感染と宿主免疫。Curr. Opin. Infect. Infect. 19 (2), 127-131. doi: 10.1097/01.qco.0000216622.75326.ef
パブコメ抄録|全文|Google Scholar
Hernaez, B., Alcam, A. (2020). Virus-encoded cytokine and chemokine decoy receptors. Curr. Opin. Immunol. 66, 50-56. doi: 10.1016/j.coi.2020.04.008.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hosamani, M., Scagliarini, A., Bhanuprakash, V., Mcinnes, C. J., Singh, R. K. (2009). Orf:現在の研究の最新情報と将来の展望。Expert. Rev. Anti Infect. Ther. 7, 879-893. doi: 10.1586/eri.09.64
パブコメ要旨|全文|Google Scholar
Imlach, W., McCaughan, C. A., Mercer, A. A., Haig, D., Fleming, S. B. (2002). Orfウイルスがコードするインターロイキン-10はマウス肥満細胞の増殖を刺激し、マウス腹膜マクロファージにおけるサイトカイン合成を阻害する。J. Gen. Virol. 83, 1049-1058.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Karki, M., Kumar, A., Arya, S., Ramakrishnan, M. A., Venkatesan, G. (2019). ヒツジとヤギのorfウイルスのポックスウイルスE3Lオルソログ(ウイルスインターフェロン耐性遺伝子)は、パラポックスウイルス間の異質性を伴う種特異的クラスタリングを示す。Cytokine 120, 15-21. doi: 10.1016/j.cyto.2019.04.001.
PubMed Abstract | CrossRef Full Text | Google Scholar
Khatiwada, S., Delhon, G., Nagendraprabhu, P., Chaulagain, S., Luo, S., Diel, D. G., et al. パラポックスウイルスのビリオンタンパク質は、感染初期にNF-κBシグナル伝達を阻害する。PloS Pathog. 13, e1006561. doi: 10.1371/journal.ppat.1006561.
PubMed要旨|全文|Google Scholar
Lin, F. Y., Tseng, Y. Y., Chan, K. W., Kuo, S. T., Yang, C. H., Wang, C. Y., et al. 台湾で分離されたorfウイルスによるインフルエンザウイルス感染の抑制。J. Vet. Med. 論文概要|岩波書店|2007年10月刊。
パブコメ抄録|クロスリファレンス全文|Google Scholar
劉瑞Z.、楊Y.J.、周F.H.、馬K.、陳W.(2021)。Gsdmdは、cxcl1-cxcr2軸を抑制することにより、黄色ブドウ球菌皮膚感染に対する宿主防御に寄与する。Veterinary Res. 52 (1), 71. doi: 10.1186/s13567-021-00937-7.
クロスレフ・フルテキスト|Google Scholar
Matthews, R. E. F. (1982). ウイルスの分類と命名法。ウイルスの分類学に関する国際委員会の第4回報告書。Intervirology 17, l-200. doi: 10.1159/000149278.
CrossRef 全文|Google Scholar
Mercer, A. A., Ueda, N., Friederichs, S. M., Hofmann, K., Fraser, K. M., Bateman, T., et al. Orfウイルスの3つの分離株のゲノム配列の比較解析により、予想外の配列変異が明らかになった。ウイルス研究 116, 146-158.
パブコメ抄録|全文|Google Scholar
Miedzobrodzki, J., Tadeusiewicz, R., Porwit-Bóbr., Z. (1987). ブドウ球菌のセリンプロテイナーゼが貪食に及ぼす影響の評価。Archivum Immunologiae Et Therapiae Experimentalis 35 (6), 877.
PubMed Abstract|Google Scholar
Nagendraprabhu, P., Khatiwada, S., Chaulagain, S., Delhon, G., Rock, D. L. (2017). パラポックスウイルスのビリオンタンパク質は、NF-κBシグナル伝達を阻害するためにレチノブラストーマタンパク質を標的とする。PloS Pathog. 13, e1006779. doi: 10.1371/journal.ppat.1006779.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nardo, A. D., Yamasaki, K., Dorschner, R. A., Lai, Y., Gallo, R. L. (2008). マスト細胞カテリシジン抗菌ペプチドは、侵襲性A群レンサ球菌の皮膚感染を予防する。J. Immunol. 180 (11), 7565-7573. doi: 10.4049/jimmunol.180.11.7565
PubMedアブストラクト|全文|Google Scholar
Netea, M. G., Joosten, L. A. B., Latz, E., Mills, K. H. G., Natoli, G., Stunnenberg, H. G., et al. 訓練された免疫: 健康と疾患における自然免疫記憶のプログラム。科学 352, aaf1098.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ning, Z., Zheng, Z., Hao, W., Duan, C., Li, W. (2013). orfウイルスコードタンパク質002のN末端は、ser276リン酸化を阻害することにより、NF-κB p65のアセチル化を阻害する。この論文では、NF-κB p65のアセチル化を阻害することで、NF-κB p65のセリン276リン酸化を抑制することを明らかにした。
PubMedアブストラクト|クロスリファレンス|Google Scholar
Ons, E., Van Brussel, L., Lane, S., King, V., Cullinane, A., Kenna, R., et al. ウマにおけるウマヘルペスウイルス1型およびウマ連鎖球菌感染症に対するパラポックスウイルス・オビスベースの免疫調節剤の有効性。Vet. Microbiol. 173, 232-240. doi: 10.1016/j.vetmic.2014.07.015
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pastor, E., Pojar, P., Mestesanu, C., Spnu, M. (2020). Orf virusに罹患した羊の二次感染に関与する細菌の調査と動態。Bull. UASVM Veterinary Med. 77 (2), 91-100. doi: 10.15835/buasvmcn-vm:2020.0024.
CrossRef 全文|Google Scholar
Paulsen, D., Urban, A., Knorr, A., Hirth-Dietrich, C., Siegling, A., Volk, H. D., et al. 不活化orfウイルスは抗線維化活性を示し、前臨床モデルにおいてヒトB型肝炎ウイルス(HBV)およびC型肝炎ウイルス(HCV)の複製を阻害する。論文タイトル: 「肝炎ウイルスの抗線維化活性と前臨床モデルにおける肝炎ウイルスおよびC型肝炎ウイルスの複製阻害作用」.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Robinson, A. J., Lyttle, D. J. (1992). 「パラポックスウイルス:その生物学と組換えワクチンとしての可能性」Recombinant poxviruses. Binns, M., Smith. Binns, M., Smith, G. L. (Boca. Raton: CRC Press), 285-327.
Google Scholar
Rziha, H. J., Henkel, M., Cottone, R., Bauer, B., Auge, U., GöTz, F., et al. 組換えパラポックスウイルスの作製:外来遺伝子の挿入および発現に適した非必須遺伝子。J. Biotechnol. 83 (1-2), 137-145. doi: 10.1016/S0168-1656(00)00307-2
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Schneider, M., Müller, M., Yigitliler, A., Xi, J., Amann, R. (2020). パピローマウイルス誘発腫瘍の治療のためのorfウイルスベースの治療ワクチン。J. Virol. 94 (15), e00398-e00320. doi: 10.1128/JVI.00398-20
パブコメ抄録|クロスリファレンス全文|Google Scholar
Schütze, N., Raue, R., Büttner, M., Alber, G. (2009). 不活化パラポックスウイルスOVISはイヌの血液中の食細胞およびTリンパ球を活性化する。Vet. Microbiol. 137,260-267.doi:10.1016/j.vetmic.2009.01.035。
PubMed Abstract|全文|Google Scholar
Sharif, S., Ueda, N., Nakatani, Y., Wise, L. M., Clifton, S., Lateef, Z., et al. ニュージーランドのアカシカのパラポックスウイルスがコードするケモカイン結合タンパク質は、遺伝子重複とリガンド特異性の分岐の証拠を示す。Front. Microbiol. 10, 1421. doi: 10.3389/fmicb.2019.01421
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shi, J., Zhao, Y., Wang, K., Shi, X., Wang, Y., Huang, H., et al. 炎症性カスパーゼによるGSDMDの切断は、焦性細胞死を決定する。Nature 526 (7575), 660-665.
パブコメ要旨|全文|Google Scholar
Silverman, R. H. (2015). ポックスウイルスへのキャップオフ。細胞宿主微生物17, 287-289.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Son, S. J., Harris, P. W. R., Squire, C. J., Baker, E. N., Kent, S. B. H., Brimble, M. A. (2014). マスター遺伝子制御因子NF-κBの阻害剤であるORFウイルスタンパク質ORFV002の全化学合成。バイオポリマー 102, 137-144.
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Song, W. M., Colonna, M. (2018). Immune training unlocks innate potential. 細胞 172, 3-5. doi: 10.1016/j.cell.2017.12.034
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Tai, L. H., de Souza, C. T., Bélanger, S., Ly, L., Alkayyal, A. A., Zhang, J., et al. ナチュラルキラー細胞の手術誘発性機能不全を抑制することで、術後の転移性疾患を予防する。Cancer Res. 73, 97-107. doi: 10.1158/0008-5472.CAN-12-1993.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
高井崇、池田聡(2011)。アレルギー疾患発症における環境プロテアーゼによるバリア機能障害. Allergol Int. 60 (1), 25-35. doi: 10.2332/allergolint.10-RAI-0273.
パブコメ抄録|全文|Google Scholar
Tan, J. L., Ueda, N., Heath, D., Mercer, A. A., Fleming, S. B. (2012). 二機能性組換えワクチンとしてのorfウイルスの開発: エキノコックス・グラニュロサス抗原EG95の膜構造タンパク質への融合による表面ディスプレイ。ワクチン 30, 398-406.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Tiwari, A., Gautam, A., Bhat, S., Malik, Y. S. (2020). 動物疾患におけるベクターワクチンの進歩と応用。Genomics Biotechnol. Adv. Veterinary Poultry Fisheries, 361-380.
CrossRef 全文|Google Scholar
Wang, J. H., Kwon, H. J., Jang, Y. J. (2010). 黄色ブドウ球菌は、慢性鼻副鼻腔炎および鼻ポリープ患者の鼻粘膜においてサイトカインおよびマトリックスメタロプロテアーゼの発現を増加させる。Am. J. Rhinology Allergy 24 (6), 422-427.
CrossRef 全文|Google Scholar
Wang, R., Luo, S. (2018). Orfウイルス: 免疫療法薬の新しいクラス。Syst. doi: 10.5772/intechopen.81535.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, X. D., Zhang, N., Glorieux, S., Holtappels, G., Vaneechoutte, M., Krysko, O., et al. 単純ヘルペスウイルス1型感染は、黄色ブドウ球菌の鼻粘膜および鼻ポリープ組織への浸潤を促進する。この論文では、鼻粘膜および鼻ポリープ組織への黄色ブドウ球菌の浸潤を促進する単純ヘルペスウイルス1型の感染について検討した。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wassie, T., Fanmei, Z., Jiang, X., Liu, G., Girmay, S., Min, Z., et al. 組み換えB2Lおよびkisspeptin-54 DNAワクチンは、orfウイルスに対する免疫を誘導し、ラットの精子形成を阻害する。論文番号: 9, 16262.
パブコメ要旨|Ref 全文|Google Scholar
Weber, O., Siegling, A., Friebe, A., Limmer, A., Schlapp, T., Knolle, P., et al. 不活化パラポックスウイルスOvis(Orfウイルス)は、B型肝炎ウイルスおよび単純ヘルペスウイルスに対して抗ウイルス活性を有する。J. Gen. Virol. 84, 1843-1852. doi: 10.1099/vir.0.19138-0
PubMedアブストラクト|Ref全文|Google Scholar
Weber, O., Tennagels, S. M., Siegling, A., Schlapp, T., Mercer, A. A., Fleming, S. B., et al. parapdxvirus ovisの組換えタンパク質およびそれからの医薬組成物。米国特許9714272、US8357363 B2.
Google Scholar
Westphal, D., Ledgerwood, E. C., Tyndall, J. D. A., Hibma, M. H., Ueda, N., Fleming, S. B., et al. orfウイルスのアポトーシス抑制因子は、Bcl-2様様式で機能し、一連のBH3タンパク質と活性型Baxに結合して中和する。アポトーシス 14, 1317-1330.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wise, L. M., Inder, M. K., Real, N. C., Stuart, G. S., Fleming, S. B., Mercer, A. A. (2012). orfウイルスがコードする血管内皮増殖因子(VEGF)-Eは、ケラチノサイトの増殖と遊走を制御し、表皮再生を促進する。Cell Microbiol. 14 (9), 1376-1390. doi: 10.1111/j.1462-5822.2012.01802.x
PubMed Abstract|クロスリファレンス全文|Google Scholar
Yu, Y., Duan, X., Liu, Y., Ma, J., Song, B., Lian, Z., et al. nz7様orfウイルス感染症の実験室診断と病原体遺伝学的特徴、特にvegfg遺伝子における特徴。Doi: 10.3389/fvets.2020.00538.
CrossRef 全文|Google Scholar
Yu, Y. Y., Lian, Z. X., Cui, Y. D. (2022). O-Hシステム: PPV-宿主相互作用のパノラマビュー。Infection Genet. 10.1016/j.megid.2022.105220。
クロスレフ・フルテキスト|Google Scholar
Zecconi, A., Scali, F. (2013). ヒトおよび動物の疾患における自然免疫防御からの回避における黄色ブドウ球菌の病原性因子。Immunol. Lett. 150 (1-2), 12-22. doi: 10.1016/j.imlet.2013.01.004.
パブコメ要旨|全文|Google Scholar
Zhao, G., Wu, H., Jiang, K., Chen, X., Wang, X., Qiu, C., et al. 黄色ブドウ球菌で刺激したマクロファージにおけるNF-κB/MMP9の抑制によるインターフェロンタウの抗炎症作用。J. Interferon Cytokine Res. 36 (8), 516-524. doi: 10.1089/jir.2015.0170.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード Orfウイルス, 黄色ブドウ球菌, 二次感染, 損傷の重ね合わせ, 病態機序
引用 Yu Y, Cui Y and Song B (2024) orfウイルスと黄色ブドウ球菌の協力が皮膚感染症における難治性病変を引き起こす。Front. Cell. Infect. Microbiol. doi: 10.3389/fcimb.2023.1213694.
受理:2023年4月28日 2023年4月28日;受理された: 受理:2023年4月28日;
発行:2024年01月08日
編集:Jordi Serra-Cobo
ジョルディ・セラ=コボ、バルセロナ大学、スペイン
査読者
ティモシー・J・フォスター(トリニティ・カレッジ・ダブリン、アイルランド
Copyright © 2024 Yu, Cui and Song. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*連絡先 Yongzhong Yu, yyz1968@126.com; Baifen Song, 53915848@qq.com
免責事項:本論文で表明されたすべての主張は、あくまで著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人も見ています
微生物の世界におけるヒトパピローマウイルスと子宮頸がん:膣のミクロ生態学を探る
張哲梅、馬清梅、張磊、馬黎、王丹尼、楊永慶、賈鵬霞、呉楊、王芳
イムノインフォマティクスを用いたヤギ痘ウイルスに対するマルチエピトープワクチンの設計
秦琴龍,魏敏,王玉廷,馮龐
エプスタイン・バーウイルスの迅速かつ高感度検出のための多重交差置換増幅とナノ粒子ベースのラテラルフローバイオセンサーとの組み合わせ
賈欣北、周娟、蕭飛、黄小蘭、何文強、胡文、孔烈、厳偉亨、季潔、斉玉偉、王毅、戴俊
青色発光ダイオードの慢性暴露はコレステロール調節障害に関連する腸内不健全細菌症を誘発する
ホアン・チェンシー、ユー・セバスチャン、ユー・シューシェン、トゥー・フンピン、イエ・ヤオツォン、ユー・シンスー
銅代謝と微生物の相互作用:宿主銅依存性ATPアーゼATP7A/Bの観点から
周怡萱,張磊良
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
