管理下および放し飼いのLoxodonta africanaゾウにおける保存された中核微生物叢
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
400
総閲覧数
25
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは4
オリジナル研究論文
Front. 微生物学、2023年10月04日
脊椎動物の消化器系における微生物の役割
第14巻-2023年|https://doi.org/10.3389/fmicb.2023.1247719
管理下および放し飼いのLoxodonta africanaゾウにおける保存された中核微生物叢
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1247719/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit

Dasiel Obregon2 Baptiste Mulot1 Apolline Maitre3 Lourdes Mateos-Hernandez3 Pierre-Yves Moalic4 Alejandra Wu-Chuang3 Alejandro Cabezas-Cruz3‡ Antoine Leclerc1‡.
1ZooParc de Beauval and Beauval Nature, Saint-Aignan、フランス
2カナダ、オンタリオ州ゲルフ、ゲルフ大学、環境科学部
3フランス国立アルフォール動物衛生研究所、INRAE、Anses
4Labofarm Finalab Veterinary Laboratory Group、Loudéac、フランス
腸内細菌叢は、動物の健康と恒常性、特に絶滅危惧種の保全において重要な役割を果たしている。本研究では、フランスの動物園で飼育されているヨーロッパの飼育下アフリカサバンナゾウ(Loxodonta africana)の糞便微生物叢組成を調査し、野生のアフリカサバンナゾウと比較した。糞便サンプルを採取し、DNA抽出と16S rRNA遺伝子のアンプリコンシークエンシングを行った。αおよびβの多様性を解析した結果、食餌、日常活動、施設などの要因が微生物叢組成に有意な影響を及ぼすことが明らかになった。特に、食餌の一部として枝を与えることは、微生物叢の多様性にプラスの影響を与えた。比較分析により、飼育下と野生のゾウのマイクロバイオームには明確な違いがあることが示され、飼育下個体群では細菌の多様性が低く、共起パターンが変化していることが特徴的であった。特に、特定の分類群では、飼育下と野生のゾウで存在量が異なっており、微生物叢の構成に環境が影響していることが示唆された。さらに、本研究では、飼育下と野生のゾウの両方に共通する中核的な関連ネットワークを同定し、微生物の相互作用を維持する上で特定の分類群が重要であることを強調した。これらの知見は、ゾウの腸内細菌叢に環境と飼育要因が与える影響を強調するものであり、マイクロバイオームの多様性と健康を促進するための動物園における食事エンリッチメント戦略の利点を強調するものである。本研究は、宿主と微生物叢の相互作用に関するより広範な理解に貢献し、保全医療や飼育動物管理に応用可能な知見を提供するものである。
はじめに
何兆もの微生物を含む腸内細菌叢(GM)と生物の健康との複雑な関係は、生物学における新たなフロンティアであり、その重要性は絶滅危惧種の保全医療の領域にまで及んでいる(Bahrndorff et al. 保全活動は、生息地の保護、繁殖プログラム、疾病管理といった外的要因に焦点を当てることが多い。しかし、動物内部、特に消化管に存在する微生物群集は、これらの種の全体的な健康と幸福において極めて重要な役割を果たすものとして認識されつつある(Bahrndorff et al.) 絶滅危惧種はしばしば、自然環境を破壊し、食餌を変化させ、新たな病原体にさらすような課題に直面する。こうした混乱は遺伝子組換え体のバランスに影響を与え、健康問題や繁殖成功率の低下につながる可能性がある(Lee and Hase, 2014; Shreiner et al.) GMは消化や栄養摂取、免疫、生殖など多くの生理的プロセスにおいて主要な役割を担っており、ディスバイオシス(すなわちバランスのとれた微生物叢からの逸脱)は多くの病理学的プロセスにつながる可能性がある(Kau et al.) したがって、絶滅危惧種の遺伝子組み換えを研究することで、研究者はこれらの微生物が動物の全体的な健康と適応性にどのように寄与しているかについての洞察を得ることができる。この理解は、食餌の推奨、疾病管理戦略、さらには生殖補助技術の指針となり、保護活動に役立つ(Keady et al.)
ゾウは非反芻動物の単胃草食動物で、後腸発酵動物である(Van Hoven and Lankhorst, 1981; Dumonceaux, 2006)。野生では、アフリカサバンナゾウ(Loxodonta africana)は植物の種類や部位に嗜好性があり、食餌の選択はエネルギー、成長または繁殖のために最適化される(Biru and Bekele, 2012; Pretorius et al.) そのため、動物園で飼育されているゾウには、エネルギー係数や消化係数の異なる様々な種類の乾草やブラウズを与えるべきである(Bolechovaら、2020)。食餌はアフリカの草食動物の腸内細菌叢に直接的な影響を与えるため(Kartzinel et al. ゾウの発酵は主に結腸で起こるが、盲腸にも発酵菌は存在する(Van Hoven and Lankhorst, 1981; Clauss et al.) その結果、見かけの消化率が最も高いのはゾウの結腸上部であり(Clemens and Maloiy, 1983)、エネルギー供給は繊維質飼料の結腸発酵に由来する短鎖脂肪酸に基づいている(Greene et al.)
ゾウの糞は採取が容易で非侵襲的なサンプルであり、その組成は後腸の健康状態を予測するのに適しているため、糞/後腸のマイクロバイオームはしばしば遺伝子組換えマイクロバイオームの代理として使用される(Buddら、2020;Kandelら、2020;Keadyら、2021;Moustafaら、2021)。似たような消化生理を持つ他の大腸発酵動物として、ウマはしばしばトビムシ科の消化のモデルとして用いられ、その遺伝子組み換えについてはすでに記述されている(Kauter et al.) とはいえ、いくつかの相違点も存在する(Clauss et al., 2003; Greene et al.) 特に、ゾウは摂取物の通過速度が速く、栄養消化係数が低くなる(Hackenberger, 1987; Clauss et al., 2003)。エネルギー摂取量を最適化するために、ゾウは摂食物の通過速度を劇的に上げることなく、摂食量を増やすことができる(Clauss et al., 2007)。このようなウマとの違いは、ゾウのGMを正確に記述する必要性を高めている。野生のアフリカゾウについてはいくつかのデータがあり(Budd et al., 2020)、最近の研究では米国の施設に収容されているアフリカサバンナゾウの臨床所見とホルモン所見の影響を評価したものがある(Keady et al., 2021)が、動物園で管理されているアフリカサバンナゾウの糞便微生物叢に対する飼育環境と個体因子の影響については、筆者らの知る限りでは入手不可能であり、飼育下と野生のゾウの比較も行われていない。
コアマイクロバイオームの追求は微生物生態学で注目されており、微生物群集と宿主または環境との相互作用に光を当てている(Neuら、2021年)。基本的に、コアマイクロバイオームとは、共有される微生物分類群とそれに関連するゲノムまたは機能的属性を包含し、特定の宿主または生態系を特徴づけるものである(Turnbaugh et al.) この試みは、様々な環境における微生物群集に共通する遺伝子(Turnbaughら、2009年)、機能的経路(Jiangら、2016年)、代謝プロファイル(Stefaniniら、2017年)の調査を促している。通常、コアマイクロバイオームの解明には、与えられた宿主種や環境内の複数の微生物群集に共通する分類群を同定することが含まれ、これらの共通する分類群は、研究された条件下で宿主や環境に不可欠な微生物の仲間であるという仮説が立てられる(Shade and Handelsman, 2012)。これらのコアメンバーは生態学的および機能的に重要であると想定され、その潜在的な意味はヒトの健康(Zaura et al., 2009; Bäckhed et al. しかし、コアマイクロバイオーム解析は、コアを定義する基準が異なる。このプロセスでは通常、微生物分類群のセットを共有するサンプルの割合、それらの相対的存在量、またはその両方の組み合わせが決定される。この定量化は、アンプリコン配列バリアント(ASV)からフィラまで、さまざまな分類学的レベルにまたがり、さまざまな空間的・時間的スケールにわたって行われる(Neuら、2021)。さらに最近では、コアマイクロバイオームの概念を検討する新しいアプローチとして、コアアソシエーションネットワーク(CAN)が提唱された(Röttjers et al. これらのネットワークは、個々の分類群間の関連や共起を調査することで、微生物の相互作用の理解を個々の分類群を超えて拡張するものである。コアアソシエーションネットワークは、異なるサンプルや環境にわたって保存されている微生物相互作用のサブセットを表し、コア微生物群集の根底にあるかもしれない共有微生物パートナーシップに関する洞察を提供する(Röttjers et al.)
本研究の目的は、(1)糞サンプルのアンプリコンシークエンス(16S rRNA)に基づき、ヨーロッパ飼育アフリカサバンナゾウの糞便微生物叢の特徴を明らかにすること、(2)いくつかの要因(年齢、性別、1日の活動量、居住動物園、枝の提供を含む食餌の種類、出生地、社会的地位)の影響を測定すること、(3)その組成と多様性を、放し飼いのアフリカサバンナゾウにおける既報データと比較することである。我々は、(a)同じ種の動物であっても、飼育下と野生では環境が異なるためにマイクロバイオームが異なる、(b)個体因子と環境因子がマイクロバイオームの構成に影響を与える、(c)適切な食事と運動がより健康的なマイクロバイオームに対応する、という仮説を立てた。これらの仮説が正しいとすれば、(a)飼育下で飼育されたアフリカサバンナゾウのマイクロバイオータは野生ゾウのそれとは異なること、(b)違いは影響因子の関数として観察されること、(c)枝の摂取量と多様性、運動の増加が健康へのポジティブな適応につながること、が観察されるはずである。
材料と方法
2.1. 動物と研究デザイン
フランスの動物園施設に生息し、動物園情報管理システム(ZIMS, Species360, Bloomington, MN 55425, United States)に登録されているすべてのアフリカサバンナゾウを対象とした(n = 21)。すべてのゾウ(オス8頭、メス13頭)が屋内と屋外の囲いに入ることができた。2頭のゾウは単独で、残りの19頭は2頭以上の群れで生活していた。表1に動物園別の対象者の内訳を示す。飼育要因はそれぞれの施設に特有のものであった(食餌、動物飼育、囲いの大きさ、繁殖戦略、訓練)。収集したデータには、施設(居住地の動物園)、性別、年齢、出生地(飼育下か野生か)、1日の活動量(1日あたり約キロメートル)、食事(枝の有無を含む)、社会的地位(群れか単独か)が含まれる。各ゾウに年齢階級を設定した(幼齢: <青年期:[5-10]年、サブアダルト:[10-20]年、アダルト:[20-30]年、成熟アダルト:[30-40]年、老齢: [40~50歳;老年:50~60歳)。1日の活動量は低値(1日5km未満)と高値(5km以上)に分類した。食事は、乾草(牧草とアルファルファ)に次いでゾウに提供される特定の食物によって6つのグループに分類された: V-S(野菜+種子)、C-B(ニンジン+パン)、H-C(馬と牛用のペレット)、E-C(ゾウと牛用のペレット)、F-S(果物と種子)、F-V(果物と野菜)。野菜には青菜、果物にはリンゴやバナナ、種子には主にヒマワリの種やピーナッツ、ペレットには馬、牛、象に特化したブランドフォーミュラが含まれていた。また、枝(ホーンビーム、竹、柳、白樺、オーク、栗を含む)の提供も別に記録した。
表1
www.frontiersin.org
表1. 動物園のアフリカサバンナゾウの調査集団。
2.2. 糞便サンプルの採取とサンプル保存プロトコルの最適化
本試験のために、最も信頼性が高く簡便なサンプリングおよび保存方法を選択するための予備調査を行った(補足図1)。4頭の飼育下メスアフリカサバンナゾウから6個の糞便サンプルを無菌的に採取した。6つのサンプルはそれぞれ、(1)無菌チューブで新鮮なまま(+4℃)、(2)RNAlaterを含む無菌チューブで(+20℃)、(3)FTAカード(タンパク質を変性させ、細胞を溶解し、核酸を保護する化学物質を含むろ紙、+20℃)、(4)シリカゲル上で乾燥させる(+20℃)、という4つの方法で保存した。簡単に説明すると、乾燥プロトコールは、10.1gの滅菌した糞便を70%エタノールに入れることから成る。24時間後、エタノールを除去し、糞便を滅菌ガーゼに回収し、それをシリカビーズを含む滅菌チューブに入れた。サンプルは採取後48時間後に+4℃で研究室に送られ、DNA抽出と塩基配列決定は後述のように行われた。FTAカードまたはRNAlaterに保存した糞便サンプルからは、新鮮な糞便や乾燥法と比較して、より多くの細菌分類群が配列決定された(門レベル、補足図1a)。PCoA分析では、他の3つの方法(新鮮な糞便、RNAlater、乾燥法;補足図1b)と比較して、FTAカードを用いた方法(表面の大きな楕円)で、より良好な細菌の分化が見られた。シャノン指数はサンプリング方法間で有意差があり(p = 0.019)、シャノン指数とシンプソン指数が最も高かったのはFTAカードであった(補足図1c)。したがって、FTAカードが主な研究のサンプリング方法として選ばれた。
各ゾウについて、新鮮な糞ボーラスを確認し、清潔な消毒済み(塩素系漂白剤)手袋で内部を汚さないようにそっと開封した。各糞ボーラスの中心部は、以前に記述したように無菌サンプリングした(Zhangら、2023)。今回は滅菌綿棒を中心に置き、糞便にしっかりと押し付けた。この綿棒は、取りやすく、無菌で、汚染されていないサンプルを提供し、ゾウの糞の含水率は以前49%以上と推定されていたため(Stępień et al.) 完全に濡れたら、綿棒をFTAカードの中央に落とし、その場で静かに転がし、あぶらとり紙をよく含浸させた。すべてのサンプルは2020年6月から2020年10月初旬の間に採取された。FTAカードは室温(最高+20℃)で保存され、DNA抽出と塩基配列決定のために研究室に送られた。
2.3. DNA抽出
ゲノムDNAは、MoBIO PowerSoil DNA単離キット(Qiagen GmbH, Hilden, Germany)を用い、製造元の指示に従ってFTAカードから抽出した。簡単に説明すると、スポットを切り取り、穏やかに攪拌しながら15分間生理水に浸した。その後、200μLの懸濁液をDNA抽出に用いた。DNA の量と質は、Qubit 2.0 Fluorometer™(Thermo Fisher Scientific, Waltham, United States)を用いて、製造元の指示に従って調べた。DNA抽出液は分析まで-20℃で保存した。
2.4. ライブラリー調製と塩基配列決定
Ion 16S Metagenomics Kit (Thermo Fisher Scientific, Waltham, United States)を用いて、原核生物の16S rRNA遺伝子のV2、V3、V4、V6-7、V8、V9超可変領域を増幅し、それぞれV2-4-8領域とV3-6、7-9領域をターゲットとする2種類のプライマープールを用いて2回の増幅反応を行った。Ion Plus Fragment Library Kit(Thermo Fisher Scientific, Waltham, United States)を用いて、生成したアンプリコンにバーコード付きアダプターをライゲーションし、バーコード付きライブラリーを作成した。作成されたアンプリコンライブラリーのテンプレート調製は、Ion 520TM/530TM Kit-Chef(Thermo Fisher Scientific, Waltham, United States)を用いて、自動化されたIon Chef System上で製造者の指示に従って行われた。シーケンシングは、Ion S5プラットフォーム(Thermo Fisher Scientific, Waltham, United States)を用いて、Ion 530チップ上で行った。データ(bamファイル)はIon Reporter software 5.2(Workflow version: 1.1; Thermo Fisher Scientific)にエクスポートした。
2.5. アフリカサバンナ野生ゾウの外部データセット
アフリカゾウの16 s rRNA配列データは、以前の研究(Budd et al.、2020)によりすでに記述されており、NCBI-SRA(Sequence Read Archive、accession: PRJNA587772)でオンライン公開されている。簡単に説明すると、このデータセットにはケニア南西部のトランスマラ地区とナロック地区から35頭のサバンナゾウ(Loxodonta africana)とガボンのロペ国立公園から13頭の森林ゾウ(Loxodonta cyclotis)の雌雄48頭のアフリカゾウが含まれていた。ただし、本研究ではサバンナゾウの標本のみを用いた。この標本は雌雄それぞれ18頭、17頭からなり、年齢層は幼象(n = 4;雌2頭、雄2頭)、亜成象(n = 13;雄7頭、雄6頭)、成象(n = 18;各性9頭)であった。このデータセットはIllumina MiSeqテクノロジーを用い、ユニバーサルプライマー515F(5′-GTG CCA GCM GCC GCG GTA-A3')/806R(5′-GGA CTA CHV GGG TWT CTA AT-3′)を用いて可変領域V4をターゲットとして作成した。
2.6. 16S rRNA配列のデータ処理
本研究におけるすべての配列処理は、QIIME 2パイプライン(Bolyen et al.) 配列は、各アンプリコン配列バリアント(ASV)を解決するDADA2アプローチ(Callahan et al.、2016)を用いてノイズ除去し、分類学的割り当ては16S rRNA SILVAデータベースv.138(Quast et al.、2013)に基づいて行った。しかし、2つのデータセットが異なるシーケンス技術によって作成されたため、それぞれのデータセットに対して異なるバイオインフォマティック・パイプライン(ステップ)が使用された。具体的には、動物園ゾウの16SアンプリコンシークエンスはIon Torrentテクノロジーで作成され、野生のゾウのサンプルはIlluminaテクノロジーでシーケンスされた。このため、各技術のユニークな特徴に対応するために、異なる処理アプローチが必要となった。
複数の領域(V2、V3、V4、V6-7、V8、およびV9)からのショートリードアンプリコン配列を含む動物園のシーケンスデータ(動物園データ)は、個別に処理され、その後、実装されたQIIME2プラグインq2-sidle(Debeliusら、2021)として使用されたShort Multiple Reads Framework(SMURF)アルゴリズム(Fuksら、2018)を使用して、ほぼ全長の16Sマーカー遺伝子の再構築で結合された。簡単に説明すると、q2-cutadaptプラグインを使用して、生配列を各V領域のセットに分離した。各アンプリコン領域の順方向配列と逆方向配列の重複が確認されたため、順方向配列のみを使用した。各V領域(配列パッケージ)はq2-dada2プラグインを用いてノイズ除去した。その後、RESCRIPt (Robeson et al., 2021)を用いてキュレーションしたSilvaデータベースを使用した。SIlVA配列からqiime2 feature-classifier (extract-reads)プラグインを用いて正確な配列断片(領域ごと)を抽出した。q2-sidleを使用して、ASVの各セットとそれぞれのSIlVAフラグメント配列がkmerを形成してアライメントされ、次にkmerが全長SILVA参照配列とマッピングされて分類学的プロファイルが再構築された。
野生配列データ(wild data)はQIIME2のq2-fondue plugingを用いてSRA用にダウロードした。ペアエンド配列はq2-dada2を用いて解析し、ペアリードのノイズ除去およびマージを行った。ASVのアラインメントはq2-alignmentプラグインでMAFFT (Katoh et al., 2002)を用いて行い、そのアラインメントを用いてq2-phylogenyに実装されているFastTree2法(Price et al., 2010)に従って系統樹を構築した。ASVの分類学的分類は、SILVAデータベースv.138 (Quast et al., 2013)に基づき、q2-feature-classifierプラグインを介してClassify-Sklearn Naive Bayes法を用いて行った。
2.7. 統計解析
糞便微生物相の比較は、(i)動物園ゾウのグループ間(影響因子による)、および(ii)動物園ゾウのグループ全体と野生ゾウとの間で行った。α多様性指標(観察特徴量、Pielou均等性指数、シャノンエントロピー)とβ多様性(Bray Curtisの距離)を、希薄化された表に基づいて、それぞれKruskal-Wallis検定とPermanova検定を用いて比較した。
さらに、動物園ゾウと野生ゾウの「コア微生物叢」を決定した。コア微生物叢とは、対象となる宿主または環境に特徴的な微生物分類群、またはそれらの分類群に関連する機能的属性を指す(Neu et al.) 我々は、両データセットのほぼすべてのサンプルに偏在する分類群を同定することを目的とし、そのためにChongら(2020)が記載した方法を用いた。この方法は、野生ゾウと動物園ゾウの全サンプルを含むデータセット全体における有病率を考慮することで、特定の分類群を同定するものである。さらに、この方法では、共有される分類群の相対的な存在量を分析することで、データセット全体でいつ多く存在するかを決定することもできる。我々の研究では、少なくとも70%のサンプルに存在する属をコア分類群とみなした。これらの解析は、https://www.microbiomeanalyst.ca (Chong et al., 2020)からアクセス可能なウェブツールMicrobiomeAnalystを用いて行った。
グループ間の分類学的組成の違いは、R studio(R Foundation for Statistical Computing)のALDEx2法(Fernandes et al.) ALDEx2法は、各サンプルのリード数の不確実性を考慮してディリクレ分布のモンテカルロ標本を作成し、centered log ratio(clr)変換(Aitchison、1986)を用いてデータを変換し、標準的な統計手法を使用できるようにする。検出された差次豊度分類群は、R studio(R Foundation for Statistical Computing)でヒートマップを作成するために使用した。
2.7.1. 細菌共起ネットワークとコアアソシエーションネットワーク
共起ネットワークは、データセット中の細菌属間の関係を視覚的に表現する。これらのネットワークでは、「ノード」は個々の属を表し、「エッジ」はそれらの間の関係を象徴し、正の相関(重み > 0.50)または負の相関(重み < -0.50)を示す。本研究におけるこれらの相関の有意性は、R studio (R Foundation for Statistical Computing)のSparse Correlations for Compositional data (SparCC) method (Friedman and Alm, 2012)を用いて決定した。ネットワークのトポロジー的特徴は、微生物群集の構造と接続性をさらに捉えたものである。これらの特徴には、ネットワークの複雑さを表すノードとエッジの数、ネットワークが別々のコミュニティや相互作用する属のクラスターに分けられる度合いを示す「モジュール性」、ノードあたりの平均接続数を示す「平均次数」、接続の強さを表す「重み付き次数」などが含まれる。これらの側面を分析することで、微生物群集の生態学的ダイナミクスや安定性に関する洞察を得ることができる。これらのトポロジー的特徴の可視化と解析は、Gephi v0.9.2 (Bastian et al., 2009)を用いて行った。
その結果得られたネットワークを解析し、動物園ゾウ個体群と野生ゾウ個体群の両方で保存されている微生物会合のパターンを特定した。これらの保存されたパターンは、コアアソシエーションネットワーク(CAN)と呼ばれる。CANは、異なるサンプルや条件下で観察される安定した一貫性のある関係を表す(Röttjers et al.) CANを検出するために、我々は "Anuran "法を採用し、そのデフォルトパラメーター(完全なスタンドアロン)を使用した。Anuran法はヌルモデル技法を利用し、分類群間のリンクがランダムに割り当てられたランダムネットワークを作成する。実際のデータをこれらのランダムモデルと比較することで、アヌランは様々なネットワークで保存されている非ランダムな関連パターンを特定することができる(Röttjers et al.) CAN分析では、飼育下および野生のアフリカサバンナゾウ間で、特定の微生物の関連性が一貫して持続するかどうかを調べることを目的とした。これらの相関はランダムに起こるとは予想されないため、その存在は、生活環境の違いにもかかわらず、意味のある微生物の関連性を示唆している。
2.7.2. ネットワークの頑健性のモデリング
ネットワークの頑健性を検証するために、3つの方法[すなわち、ランダムな除去、高次数の除去を最初に行う方法、カスケード除去(高次数の間中心性、各除去を最初に再計算)]によるノードの除去に応じて、ネットワークの接続性の損失を計算した。Rstudio(Lhomme, 2015)で実装された "Network Strengths and Weaknesses Analysis"("NetSwan")スクリプトを使用した。
分析結果
3.1. 食事は動物園のアフリカサバンナゾウの微生物叢に主に影響する
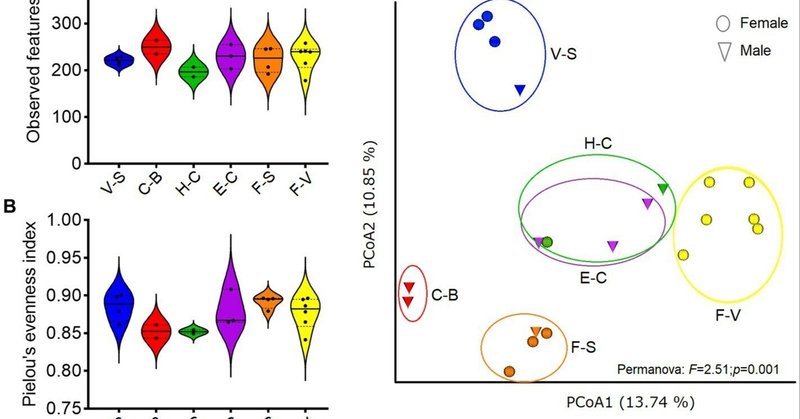
各要因(食餌、性別、年齢など)を個別に分析(クラスカル・ワリス検定)しても、α多様性指標(ASVレベル)に有意差は検出されなかった(補足表1)。食餌間の差は認められなかった(観察された特徴: H = 5.2; p = 0.38、またはPielou指数: H = 8.5; p = 0.12;図1A,B)。年齢が高くなるほど(20歳以上)、より高いα多様性が見られたが、これは有意ではなかった(p = 0.85、Kruskall-Wallis検定)。しかし、β多様性を飼料群間で比較すると違いが観察された(Permanova, p = 0.001;図1C)。ペレットベースの飼料(H-CおよびE-C)は、ペレットの銘柄(ウマ、ウシ、ゾウ用)に関係なく同じグループに分類され、細菌分類群の相対的な存在量は同じであった。ニンジンとパンのみで構成された飼料(「C-B」、乾草を除く)は、最も低い細菌量を示した。果物や野菜については、種子(ヒマワリ、ピーナッツ)との関連性の有無によって、細菌分類群の存在量に顕著な違いが観察された。
図1
www.frontiersin.org
図1. 異なる食餌を摂取した動物園ゾウの微生物叢の多様性。微生物リッチネス(A)と均等性(B)について群間比較を行ったが、有意差はなかった(Kruskal-Wallis, p > 0.05)。(C)Bray Curtis距離を用いて、食餌に基づく群間の微生物叢組成の差異を検定した(Permanova、p < 0.05)。解析はASVsレベルの希薄化特徴表で行った。
動物園におけるゾウの微生物叢の多様性に影響を与える要因をさらに識別するために、α(シャノンエクストロピー)とβ(ブレイ・カーティス)の多様性指標を用いた多因子解析を行った。その結果、施設(p < 0.001)、食餌(p < 0.001、特に枝の供給(p < 0.001))、1日の活動量(p = 0.037)が有意に影響するが、性別(p = 0.271)と年齢(p = 0.745)は影響しないことが明らかになった(表2)。同様に、食事(p = 0.001)、1日の活動量(p = 0.006)、施設(p = 0.048)は、ブレイ・カーチスの距離(β多様性、表2)で測定した群集構成に影響を与える要因であることがわかった。性別(p = 0.065)と年齢(p = 0.089)にも傾向が見られた。属レベルでは、合計144の分類群が検出された。差分存在量分析(Aldex法、Kruskal-Wallisに基づく)により、提供された食餌に基づきグループ間で有意差があった12分類群が明らかになった(図2)。また、枝を持たないゾウでは、FibrobacteresからSpirochaetesへのシフトが見られた。1日の活動量、性別、枝の有無によって、いくつかの細菌分類群比に有意差が見られた(補足図2)。具体的には、1日の活動量が多い(5 km以上)ほど、Lentisphaerae(p = 0.004、Kruskall-Wallis)およびVictivallaceae(p = 0.013)が多く、Synergistetes(p = 0.05)、Verrucomicrobia(p = 0.04)およびRuminococcaceae(p = 0.01)の割合は低かった。男性では、スピロヘータ目(p = 0.07)とシナジスティテス目(p = 0.035)の細菌が有意に多かった。ブラウズを日常的に与えられていないゾウでは、Verrucomicrobiaceae(p = 0.001)、Acholeplasmataceae(p = 0.006)、Paenibacillaceae(p = 0.012)が過剰発現していた(補足図2)。
表2
www.frontiersin.org
表2. 動物園ゾウのマイクロバイオームの多様性に寄与する複数の要因の解析。
図2
www.frontiersin.org
図2. 食餌に基づいて動物園ゾウの間で検出された差異のある豊富な微生物(属レベル)。有意差のある上位12分類群のみがヒートマップに含まれた(Aldex、Welch検定:padj < 0.05)。存在量プロファイルは中央対数比変換を用いて正規化した。
3.2. 動物園のアフリカサバンナゾウと野生のゾウのマイクロバイオームは異なるが、コアは共有している。
16S rRNA遺伝子の塩基配列を決定した結果、動物園ゾウではサンプルあたり平均493,218.5リード(Buddら、2020年)対847,760.6リード。フランスの動物園で飼育されているアフリカサバンナゾウとケニアで放し飼いにされているゾウの微生物叢組成(属レベル)を比較したところ、シャノンエントロピー(p = 0.7、図3B)に差はなかったものの、Permanova(p < 0.001)およびAnosim(p < 0.01)のBray Curtis距離検定(図3A)により、分類学的構造に有意差があることが確認された。飼育下と放し飼いの間で共通する分類群は99種で、検出された全分類群の33%を占めた(図3C)。これらの動物では、Rikenellaceae_RC9_gut group、Prevotella、Ruminococcusなど、どのような生活環境(動物園または原野)であっても、核となる分類群が共有されていた(図3D)。さらに、動物園ゾウと野生ゾウの間で存在量が有意に異なる46の細菌属(Aldex, Welch test with Benjamini Hochberg correction: p < 0.001)が検出された(図4)。特に、動物園ゾウではRuminococcaeとLachnospiraceaeの発現量が少なかった(図4)。野生ゾウと動物園ゾウにおける優勢な細菌科および属の詳細な相対的存在量は、それぞれ補足図3、4に掲載されている。
図3
www.frontiersin.org
図3. 動物園で生活するアフリカサバンナゾウと野生で生活するアフリカサバンナゾウの属レベルでのマイクロバイオーム組成の比較。(A) Bray Curtis距離の主座標分析(PCoA)、PermanovaおよびANOSIM検定との比較。(B) Kruskal-Wallis(KW)検定によるシャノン・エントロピーの比較(p > 0.05)。(C)ベン図は、野生ゾウと動物園ゾウの間でユニークな細菌属と共有される細菌属の割合を示す。(D)ゾウの微生物群(野生ゾウと飼育ゾウの両方に存在する)の中核となる分類群の検出。
図4
www.frontiersin.org
図4. ヒートマップは、動物園に生息するアフリカゾウのマイクロバイオームから検出された、野生のゾウと異なる豊富な細菌属を示す。検出にはAldex法を用いた(Benjamini Hochberg補正を用いたWelch検定)。有意な上位分類群(p < 0.001)のみを示す。
微生物共起ネットワークの解析では、野生ゾウ(図5A)と飼育ゾウ(図5B)の間で明確な違いが検出された。特に、放し飼いゾウではノードの数が多く、ノードの連結度も高かった。この差とは無関係に、2つのゾウのグループ(飼育ゾウと野生ゾウ)内でコアアソシエーションネットワーク(CAN)が検出され、17分類群(ノード)のうち9つの接続(エッジ)で表された(図5C)。CANで表現されたノードは、野生ゾウと動物園ゾウの微生物ネットワークにおいて、それぞれ中央値から低い関連性を持ち、これらのネットワークにおいてハブ分類群を構成するものはなかった。接続性の最大損失に達するまでに削除する必要があるノードの数が少ないことから、動物園ゾウのネットワークは、野生ゾウのネットワークに比べてロバスト性(摂動に直面してもネットワークの機能と構造を維持する能力)が低いことが示された。この観察結果は、ランダム(図6A)、度数ベース(図6B)、カスケード(図6C)のノード除去法など、さまざまなロバストネス手法で一貫していた。
図5
www.frontiersin.org
図 5. アフリカゾウのマイクロバイオームから得られた微生物共起ネットワーク。ネットワークは(A)野生のゾウと(B)動物園のゾウから推定した。共起ネットワークはSparCC法を用いて構築され、有意な負の相関(赤のエッジ)と正の相関(緑のエッジ)の両方を含む(SparCC = 0.50)。ノードのサイズはノードの固有中心性を示した。(C)コアアソシエーションネットワークは、野生ゾウと動物園ゾウのマイクロバイオーム全体に存在する共通の関連を示す。
図6
www.frontiersin.org
図6. ゾウの生活条件による微生物ネットワークの頑健性の比較。野生のゾウ(緑)と動物園のゾウ(オレンジ)において、(A)ランダム法、(B)次数法、(C)カスケード法で測定したノードの除去率に依存するネットワーク上の連結性の損失。
考察
本研究は、管理されたアフリカサバンナゾウのGMに関する洞察を提供し、臨床比較、プロバイオティクスの使用、およびトランスフューネーション(Coverdale, 2016; Greene et al., 2019b)、特に飼育と人為的活動による変化に直面しているゾウ(Moustafa et al.) しかし、遺伝子組換え組成は種や環境、食餌によって異なるため(Budd et al., 2020; Keady et al., 2021)、本研究の調査範囲は管理されたアフリカサバンナゾウに限定される。
本研究の限界は、サンプル数が少ない(n = 21)ことと、フランスゾウ(FTAカードによる新鮮な糞の無菌採取)と放し飼いの先行データ(20 gの糞サンプルを煮沸後、-20℃で保存;Budd et al.) サンプル収集者はさまざまであるため、シンプルで迅速かつ一貫性のある方法が必要であった。FTAカードは繊維状のサンプルを保存する際の課題を軽減し、凍結ロジスティックスによるバイアスを排除した(補足図1)。80℃での即時凍結が理想的と考えられているが、FTAカードは凍結と比較してα-およびβ-多様性に関して高いクラス内相関係数を示した(Wang et al.) 使いやすさ、再現性、水分保持のために選ばれた(Stępień et al., 2019)が、FTAカードの主な限界は、凍結糞ボーラスと比較して読み取り回数が少ないことであった(Budd et al.) さらなる限界は、動物園ゾウと野生ゾウでそれぞれIon TorrentとIlluminaという異なるシーケンス技術が使用されたことにある。私たちの研究では、Ion Torrent法は16S遺伝子の7領域を対象とした。一般的にIon TorrentはIlluminaに比べてシーケンス深度が浅く、塩基コールエラーも独特であるが、複数の領域をターゲットにすることで、このような技術的差異を部分的に相殺することができる。さらに比較解析の厳密性と妥当性を確保するため、両データセットに対して一貫したバイオインフォマティクスパイプラインを導入し、例えば(i)DADA2アプローチによるノイズの最小化、(ii)SILVA v138データベースを用いた分類学的割り当ての標準化、(iii)データを対称にする中心対数比変換(Aitchison, 1986)に基づくネットワークおよび統計解析を行った。
施設(居住動物園)はβ多様性の差に有意な影響を及ぼし(表2)、これはアメリカのアフリカサバンナゾウの調査結果(Keady et al.、2021)と同じである。その研究(Keady et al., 2021)では異なるサンプリング方法が採用されたが、食事、訓練、エンリッチメントを含む飼育方法がアフリカサバンナゾウのGMを独自に形成した(表2;図1C、2)。注目すべきは、ペレットのブランド(ウマ、ウシ、ゾウのデザイン)に関係なく、β多様性は類似しており、ペレットの影響が限定的であることを示唆していることである(図1C)。地理的に近接した動物園ゾウの腸内細菌叢が類似していることから(Kartzinel et al., 2019; Keady et al., 2021)、乾草の種類など、GMにおける環境および栄養因子の影響が示唆される(Keady et al.) 我々の研究では、乾草の分析成分を分析したのは1つの動物園のみであったため、このパラメータは統計分析に含めなかった。しかし、果物、緑黄色野菜、種子のバリエーションはβ多様性の違いにつながり、多様な食餌の重要性を浮き彫りにした(図1C)。
食餌と1日の活動量には相互関係があり、枝が利用できると採食と探索が増加する(Laskyら、2021年)。本研究では、食餌、特に枝の供給がアフリカサバンナのゾウのGMに大きな影響を与えた。1日の活動量が多いゾウは、ヒトのより良い睡眠に関連するパターンであるレンティスファエラの割合が高いことを示した(Anderson et al.) 活動量の増加は、屋外の囲いで木の枝に触れる機会を増やすことで、管理されているゾウの睡眠を改善する可能性がある。睡眠行動はゾウの健康状態の主要な指標として認識されているため(Schiffmann et al.) 囲いの設計の複雑さや、ブラウズを含む餌と含まない餌のNDFの違いといった要因も、毎日の活動やGMに影響を与えるかもしれない(Clauss and Dierenfeld, 2008; Katole et al., 2014; Scott and LaDue, 2019; Wood et al.) 心強いことに、多様な枝の種類を用いて野生の食餌を模倣することで、樹木種の利用可能性に応じて年間を通じて調整しながら、GM組成を高めることができる(表2)(Wood et al.) さらに、枝やブラウズはゾウにミネラルを供給し、ビタミンの摂取を促進するが、ペレットはビタミ ンDやEを含む栄養要求量を満たす役割があるため、ペレットを除外することは勧められない(Dierenfeld, 2006; Wood et al.) 枝の利点にもかかわらず、ペレットは飼育下のゾウのバランスのとれた食事において重要な役割を果た している(Wood et al.) 枝を与えることはガイドラインに合致しており、採食と運動の機会を改善することで福祉を向上させる(Bolechovaら、2020;Laskyら、2021)。
選択した細菌門では性別の影響が見られ、スピロヘータ類とシナジステス類はオスに多く見られた。筆者らの知る限り、アフリカゾウの成体ではこれまで評価されておらず、オスとメスのホルモンの違いがこの違いを説明しているのかもしれない。乾草のみを食べている馬ではスピロヘータ類が過剰発現していることから(Fernandes et al. ヒトのような他の哺乳類では、腸内細菌叢の組成は男女間で経時的に異なっており(Valeri and Endres, 2021)、近縁種のアジアゾウ(Elephas maximus)では、代謝可能なエネルギー摂取量は季節を問わず食事から維持され、性特異的な生理的欲求を満たすのに十分な必要量に達している(Koirala et al.) さらに、飼育下のゾウでは、ホルモン(プロラクチンを含む)と腸内細菌叢の構造との間に関連性がある(Keady et al.、2021)。このような違いから、アフリカサバンナゾウにおける後腸内細菌叢の性特異的研究が正当化される。
管理下のゾウのGMは野生個体とは異なっており、その分類学的構造には動物園ゾウと野生のアフリカサバンナゾウの間で有意な違いが見られ(図3A)、99の細菌分類群のみが共通しており(図3C)、46の細菌属で存在量が有意に異なっていた(図4)。消化器疾患は動物園ゾウでより頻繁である可能性があり(Dumonceaux, 2006; Miller et al., 2015; Greene et al., 2019a; Scharling et al., 2021)、RuminococcaeおよびLachnospiraceaeの相対存在量が低いことは、消化器疾患を有するウマで一貫して報告されており(Costa et al., 2012; Schoster et al., 2017)、これらの細菌ファミリーは動物園ゾウでは存在量が少なかった(図4)。これらのファーミキューテス門のメンバーは、セルロースを分解してエネルギーを供給する短鎖脂肪酸を産生するセルロース分解菌である(Kauter et al.) このような細菌は、ゾウの大腸発酵に関与する特定の酵素の産生を担っている可能性が高い(Sthitmatee et al.) 動物園ゾウにおけるバクテリアの出現率の低さは、野生と比較して食餌項目の多様性が低いこと(Biru and Bekele, 2012; Pretorius et al., 2012; Mwambola et al., 2014; Sach et al., 2019)や、飼育ゾウの1年間にわたる均質なペレットベースの食餌では劇的に減少する食餌の季節変化と関連している可能性がある(Codron et al., 2006; Dierenfeld, 2006; Clauss and Dierenfeld, 2008; Wood et al.) このことは、図5で明らかなように、飼育個体では細菌発生ネットワークが著しく減少しており、ネットワークの頑健性が著しく低下している(図6)ことを説明できるかもしれない。動物工学的および栄養学的な改良により、動物園ゾウの微生物叢ネットワークの頑健性を向上させれば、野生ゾウの微生物叢ネットワークに近づけることができ、その結果、より回復力のある微生物叢が形成され、外乱に耐えることができるようになり、変化する状況への適応能力、ストレス要因への対応能力、最適な健康状態を維持する能力が向上すると考えられる。
興味深いことに、動物園ゾウはその環境の違いにもかかわらず、野生のゾウとコアとなる分類群を共有していることが明らかになった。動物園ゾウと野生のアフリカサバンナゾウの間で「コア微生物叢」が共有されていることは、異なる環境に生息する特定の微生物分類群に驚くべき一貫性があることを示している。この発見は、飼育下のゾウと野生のゾウが対照的な食餌や生活環境を経験する一方で、特定の微生物群集を維持する根本的な要因が存在することを示唆している。Rikenellaceae、Prevotellaceae、Lachnospiraceae、およびRuminococcaceaeを含むこれらのコア分類群は、宿主系統によってのみ決定されるのではなく、ウマ、サイ、および小型の家畜種のような草食動物に共通する後腸発酵戦略によっても決定される(Bian et al.、2013;Dougal et al.、2013;O'Donnell et al.、2017)。このことは、後腸発酵菌の進化的遺産がこれらの中核微生物群集の確立に寄与していることを示唆しており、草食動物の消化におけるこれらの微生物の機能的重要性を強調している。
コア・アソシエーション・ネットワーク(CAN)の発見は、微生物の相互作用の一貫したパターンを明らかにすることで、「コア微生物叢」の概念を構築するものである。これらのCANは、動物園や野生のゾウが経験する様々な食餌や環境の状況にかかわらず、様々な条件下で持続する安定した関係を表している(Röttjers et al. 飼育下個体群と野生個体群の両方において、このような非ランダムな関連性が存在することは、宿主の健康と機能に寄与する有意義な微生物間相互作用を意味する。CANは腸内生態系における微生物種の共存と協力に関する洞察を提供し、後腸発酵と栄養処理の複雑な動態に寄与している。共有されるコア分類群とCANsの相関関係は特に興味深い。コア微生物群に特定の微生物群が存在することが、CANs内の特定の微生物群の形成に影響を与える可能性がある。例えば、コア分類群に含まれるルミノコッカス科(Froidurot and Julliand, 2022)のメンバーのセルロース分解能力は、複雑な植物材料の分解に影響を与えることで、CANs内の相互作用を形成する可能性がある。このような相互作用は、宿主の栄養供給に影響を与え(Froidurot and Julliand, 2022)、観察された消化戦略の適応に寄与する可能性がある。
結論
本研究は、絶滅危惧種であるアフリカサバンナゾウ(Loxodonta africana)の腸内細菌叢(GM)に及ぼす生活環境の影響を理解する上で重要な意味を持つ。この研究結果は、動物園におけるこれらの動物の管理を強化するための重要な知見を提供するだけでなく、宿主関連微生物叢によって構成される複雑な生態系という、比較的新しい知識分野にも貢献するものである。
この研究から明らかなように、アフリカサバンナゾウは生息地に関係なく、腸内細菌叢の基本的なコア組成を共有しており、特にリケネラ科、プレボテラ科、ラクノスピラ科、ルミノコックス科など、後腸発酵菌によく関連する細菌型が多いことが特徴である。しかし、動物園に棲息するゾウは、後腸内細菌叢の構造における細菌の多様性と複雑な相互作用の両方が、野生のゾウに比べて明らかに減少していることが明らかになった。
動物園ゾウの微生物叢の組成を形成する極めて重要な決定要因として、動物園の飼育要因が浮上した。これらの要因の中でも、食餌と毎日の活動が際立っている。これらの要因の影響、特に食事とその季節変動は、飼育下個体と野生個体との間に観察された違いを解明することができる。動物園ゾウの腸内健康を最適化し、ゾウの自然な食事パターンを反映させるためには、ゾウの囲いの中で採食できる多様な枝を提供することが不可欠である。このような食餌の充実は、微生物叢の組成と多様性にプラスの影響を与える可能性がある。
データの利用可能性に関する声明
本研究で発表したデータセットはオンラインリポジトリで見ることができる。リポジトリ名とアクセッション番号はhttps://www.ncbi.nlm.nih. gov/、PRJNA939400(SRX19520099, SRX19520098, SRX19520097, SRX19520096, SRX19520095, SRX19520094, SRX19520093, SRX19520092, SRX19520091, SRX19520090、 SRX19520089, SRX19520088, SRX19520087, SRX19520086, SRX19520085, SRX19520084, SRX19520083, SRX19520082, SRX19520081, SRX19520080, SRX19520079) https: https://www. ncbi.nlm.nih.gov/, PRJNA587772。
倫理声明
本研究では、ゾウの糞の新鮮なボーラスを採取するだけであったため、現地の法律および施設の要件に従い、動物を用いた研究に倫理的承認は必要なかった。これらのサンプルは、動物が排泄した直後に、まったく非侵襲的な方法(地面)で採取された。これらのサンプルを採取するために動物を扱ったり、研究のために動物の日常生活を変えたりすることはなかった。
著者の貢献
MT、BM、P-YM、AC-C、ALが本研究を発案した。P-YMはデータを取得した。DO、AM、AW-Cはバイオインフォマティクスおよび統計学的マイクロバイオーム解析を行い、結果を可視化した。LM-Hはデータのキュレーションを行った。MT、DO、AC-Cは原稿の第一版を起草した。AW-Cは原稿を編集・修正した。著者全員が最終版を修正し、受諾した。
資金提供
本研究はBeauval Nature協会の助成を受けた。UMR BIPARは、フランス政府のInvestissement d'Avenirプログラム、Laboratoire d'Excellence "Integrative Biology of Emerging Infectious Diseases"(助成金番号ANR-10-LABX-62-IBEID)の支援を受けている。AW-Cは、Programa Nacional de Becas de Postgrado en el Exterior "Don Carlos Antonio López"(助成金番号205/2018)の支援を受けた。AMは「Collectivité de Corse」の助成金「Formations superieures」(SGCE - RAPPORT N° 0300)の支援を受けている。
謝辞
サンプルを処理し、動物園ゾウのDNAライブラリーを作成したMarion CourseauxとEmeline Rouxelに感謝する。特に、ゾウの糞を採取してくれた獣医師全員に感謝する: Vanessa Alerte、Margaux Chandenier、Sylvie Clavel、Maxime Collin、Cyril Hue、Alexis Maillot、Tristan Ningler、Hanae Pouillevet、Elodie Trunet、Estelle Woessner。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない中で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fmicb.2023.1247719/full#supplementary-material。
参考文献
Ainsworth, T. D., and Gates, R. D. (2016). 海洋生物学。サンゴの微生物センチネル。Science 352, 1518-1519. doi: 10.1126/science.aad9957.
PubMed Abstract|全文|Google Scholar
Aitchison, J. (1986). 組成データの統計分析。London: Chapman and Hall. 416.
Google Scholar
Anderson, J. R., Carroll, I., Azcarate-Peril, M. A., Rochette, A. D., Heinberg, L. J., Peat, C., et al. 健康な高齢者における腸内細菌叢、睡眠、認知柔軟性の予備的検討。Sleep Med. 38, 104-107. doi: 10.1016/j.sleep.2017.07.018.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bäckhed, F., Fraser, C. M., Ringel, Y., Sanders, M. E., Sartor, R. B., Sherman, P. M., et al. 健康なヒト腸内細菌叢の定義:現在の概念、今後の方向性、臨床応用。細胞宿主微生物12, 611-622.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Bahrndorff, S., Alemu, T., Alemneh, T., and Lund Nielsen, J. (2016). 動物のマイクロバイオーム:保全生物学への示唆。Int. J. Genom. 2016:e5304028。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bastian, M., Heymann, S., and Jacomy, M. (2009). Gephi: ネットワークを探索・操作するためのオープンソースソフトウェア。Int. AAAI Conf. Webblogs. Soc. Med. 3, 361-362. doi: 10.1609/icwsm.v3i1.13937
CrossRef 全文|Google Scholar
Bian, G., Ma, L., Su, Y., and Zhu, W. (2013). 白サイ(Ceratotherium simum)の糞便中の微生物群集をバーコード化パイロシーケンス解析により明らかにした。PLoS One 8:e70103. doi: 10.1371/journal.pone.0070103.
パブコメ抄録|全文|Google Scholar
Biru, Y., and Bekele, A. (2012). Biru, Y, and Bekele, A (2012). Babile elephant sanctuaryにおけるアフリカゾウ(Loxodonta africana)の食性。Ethiopia. Trop. Trop. Ecol. 53, 43-52.
Google Scholar
Bolechova, P., Clauss, M., de Man, D., Galeffi, C., Hofman, S., Kappelhof, J., et al. EAZA のゾウに関するベストプラクティスガイドライン第 2 版。Available at: https://www.eaza.net/assets/Uploads/CCC/BPG-2020/Elephant-TAG-BPG-2020.pdf (Accessed March 15, 2022).
Google Scholar
Bolyen, E., Rideout, J. R., Dillon, M. R., Bokulich, N. A., Abnet, C. A., Al-Ghalith, G. A., et al. QIIME 2を用いた再現可能、インタラクティブ、スケーラブル、拡張可能なマイクロバイオームデータサイエンス Nat. Biotechnol. 37, 852-857. doi: 10.1038/s41587-019-0209-9
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Budd、K., Gunn, J. C., Finch, T., Klymus, K., Sitati, N., and Eggert, L. S. (2020). 野生アフリカサバンナゾウ(Loxodonta africana)と森林ゾウ(L. cyclotis)の糞便マイクロバイオームに対する食餌、生息地、系統の影響。Ecol. 本論文では、アフリカゾウの糞便微生物群の系統樹を明らかにした。
抄録|全文|Google Scholar
Callahan, B. J., McMurdie, P. J., Rosen, M. J., Han, A. W., Johnson, A. J. A., and Holmes, S. P. (2016). DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。Nat. Doi: 10.1038/nmeth.3869.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chong, J., Liu, P., Zhou, G., and Xia, J. (2020). Microbiome Analystを用いたマイクロバイオームデータの包括的統計解析、機能解析、メタ解析。Nat. Protoc. 15, 799-821. doi: 10.1038/s41596-019-0264-1
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Clauss, M., and Dierenfeld, E. S. (2008). 「The nutrition of 'browsers' in Zoo and wild animal medicine. Eds. Fowler, M. E., and Miller, R. E. (Amsterdam: Elsevier), 444-454.
Google Scholar
Clauss, M., Loehlein, W., Kienzle, E., and Wiesner, H. (2003). 飼育下のアジアゾウ(Elephas maximus)における飼料消化率に関する研究。J. Anim. Physiol. Anim. Physiol. を用いた飼料消化率に関する研究。
パブコメ要旨|全文|Google Scholar
Clauss, M., Streich, W. J., Schwarm, A., Ortmann, S., and Hummel, J. (2007). 食物の摂取量と摂取物の通過量の関係は、2つの異なるメガ草食動物群における摂食生態を予測する。doi: 10.1111/j.0030-1299.2007.15461.x.
クロスレフ・フルテキスト|Google Scholar
Clemens, E., and Maloiy, G. (1983). ゾウとサイにおける栄養消化率と消化管電解質フラックス。Comp. 生物化学・生理学 75, 653-658.
クロスレフ・フルテキスト|Google Scholar
Codron, J., Lee-Thorp, J. A., Sponheimer, M., Codron, D., Grant, R. C., and de Ruiter, D. J. (2006). 南アフリカ、クルーガー国立公園におけるゾウ(Loxodonta africana)の食性:空間的および景観的差異。J. Mammal. 87, 27-34. doi: 10.1644/05-MAMM-A-017R1.1.
パブコメ要旨|全文|Google Scholar
Costa, M. C., Arroyo, L. G., Allen-Vercoe, E., Stämpfli, H. R., Kim, P. T., Sturgeon, A., et al. 16S rRNA遺伝子のV3-V5領域のハイスループットシークエンシングによる、健康な馬と大腸炎の馬の糞便微生物叢の比較。この論文では、大腸炎を発症した馬と健常な馬の糞便微生物相の比較について、16S rRNA遺伝子のV3-V5領域のハイパットシークエンシングにより明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Coverdale, J. (2016). ウマ種シンポジウム:ウマのマイクロバイオームを改変して消化を改善できるか?J. Anim. 科学 94, 2275-2281.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Debelius, J. W., Robeson, M., Hugerth, L. W., Boulung, F., Ye, W., and Engstrand, L. (2021). 16S rRNA遺伝子に沿った複数の領域をスキャフォールディングし、分解能を向上させるアプローチの比較。Bio Rxiv. doi: 10.1101/2021.03.23.436606.
CrossRef 全文|Google Scholar
Dierenfeld, E. S. (2006). 「Nutrition" in Biology, Medicine, and Surgery of Elephants. Eds. Fowler, M. E., and Mikota, M. K. (Oxford: Blackwell), 57-65.
Google Scholar
Dougal, K., de la Fuente, G., Harris, P. A., Girdwood, S. E., Pinloche, E., and Newbold, C. J. (2013). ウマの大腸内における中核細菌群集の同定。PLoS One 8:e77660.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dumonceaux, G. A. (2006). ゾウの生物学、医学、外科学における「消化器系」。Eds. Fowler, M. E., Mikota, M. K. (Oxford: Blackwell), 299-307.
Google Scholar
Fabbiano, S., Suárez-Zamorano, N., and Trajkovski, M. (2017). 代謝性疾患における宿主と微生物叢の相互作用。Front. Endocrinol. 8:e00267. doi: 10.3389/fendo.2017.00267.
PubMedアブストラクト|クロス全文|Google Scholar
Fernandes, A. D., Macklaim, J. M., Linn, T. G., and Reid, G. (2013). 混合集団RNA-seqのためのANOVA-like differential expression (ALDEx)解析。論文番号:10.1371/journal.pone.0067019.
PubMedアブストラクト|クロステキスト|Google Scholar
Fernandes, K. A., Rogers, C. W., Gee, E. K., Kittelmann, S., Bolwell, C. F., Bermingham, E. N., et al. 厩舎のサラブレッドウマにおける糞便微生物叢の回復力(resilience of faecal microbiota in stabled thoroughbred horses after abrupt dietary transition between freshly cut pasture and three forage-based diet)。Anim. オープンアクセスJ. MDPI 11:2611.
CrossRef 全文|Google Scholar
Friedman, J., and Alm, E. J. (2012). ゲノム調査データから相関ネットワークを推測する。PLoS Comput. 生物学 8:e1002687. doi: 10.1371/journal.pcbi.1002687.
ゲノム調査データから得られたネットワーク。
Froidurot, A., and Julliand, V. (2022). 哺乳類の大腸におけるセルロース分解菌。Gut Microbes 14:2031694.
クロスレフ・フルテキスト|Google Scholar
Fuks, G., Elgar, M., Amir, A., Zeisel, A., Turnbaugh, P. J., Soen, Y., et al. 16S rRNA遺伝子の可変領域を組み合わせることで、高分解能の微生物群集プロファイリングが可能になる。doi: 10.1186/s40168-017-0396-x
CrossRef 全文|Google Scholar
Greene, W., Dierenfeld, E. S., and Mikota, S. (2019a). アジアゾウとアフリカゾウの消化管の解剖学、生理学、薬理学の総説。J. Zoo Aquar. 7, 1-14. doi: 10.19227/jzar.v7i1.329.
クロスレフ・フルテキスト|Google Scholar
Greene, W., Mikota, S., Pitcairn, J., and Ryer, M. (2019b). 老齢の雌のアジアゾウ(Elephas maximus)における完全な消化管閉塞とイレウスの臨床管理。J. Zoo Biol. 2, 01-04. doi: 10.33687/zoobiol.002.01.2217.
CrossRef 全文|Google Scholar
Hackenberger, M. (1987). 飼育下のアジアゾウ(Elephas maximus)とアフリカゾウ(Loxodonta africana)の食事消化率と摂取通過時間。University Guelph MSc Diss. Available at: https://ci.nii.ac.jp/naid/10019629279/ (Accessed March 15, 2022).
Google Scholar
Hamady, M., and Knight, R. (2009). ヒトマイクロバイオームプロジェクトのための微生物群集プロファイリング:ツール、技術、および課題。ゲノム研究 19, 1141-1152.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Hutchins, D. A., Jansson, J. K., Remais, J. V., Rich, V. I., Singh, B. K., and Trivedi, P. (2019). Climate change microbiology - problems and perspectives. Nat. Rev. Microbiol. 17, 391-396. doi: 10.1038/s41579-019-0178-5
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Jiang, Y., Xiong, X., Danska, J., and Parkinson, J. (2016). 多様な微生物群集のメタトランスクリプトーム解析により、コア代謝経路と微生物群固有の機能性が明らかになった。doi: 10.1186/s40168-015-0146-x
CrossRef 全文|Google Scholar
Kandel, S., Sripiboon, S., Jenjaroenpun, P., Ussery, D. W., Nookaew, I., Robeson, M. S., et al. タイの子ゾウと成体飼育ゾウの16S rRNA遺伝子アンプリコンプロファイリング。Microbiol. Resour. Announc. 9:e00248-20. doi: 10.1128/MRA.00248-20.
クロスレフ・フルテキスト|Google Scholar
Kartzinel, T. R., Hsing, J. C., Musili, P. M., Brown, B. R., and Pringle, R. M. (2019). Covariation of diet and gut microbiome in African megafauna. Proc. Natl. Acad. Sci. U. S. A. 116, 23588-23593. doi: 10.1073/pnas.1905666116.
パブコメ抄録|全文|Google Scholar
加藤和彦、三澤和彦、久間健一郎、宮田達男 (2002). MAFFT:高速フーリエ変換に基づく迅速な多重配列アライメントのための新規手法。このような解析の結果、MAFFTを用いることで、より効率的なアライメントが可能になることが示された。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Katole, S., Das, A., Agarwal, N., Prakash, B., Saha, S. K., Saini, M., et al. Impluence of work on nutrient utilisation in semicaptive Asian elephants (Elephas maximus). J. Appl. Anim. doi: 10.1080/09712119.2013.875904.
クロスレフ・フルテキスト|Google Scholar
Kau, A. L., Ahern, P. P., Griffin, N. W., Goodman, A. L., and Gordon, J. I. (2011). ヒトの栄養、腸内マイクロバイオームと免疫系。Nature 474, 327-336.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kauter, A., Epping, L., Semmler, T., Antao, E.-M., Kannapin, D., Stoeckle, S. D., et al. 馬の腸内細菌叢:馬の腸内細菌叢に関する現在の研究と将来の展望。Anim. マイクロバイオーム 1:14.
クロスレフ・フルテキスト|Google Scholar
Keady, M. M., Prado, N., Lim, H. C., Brown, J., Paris, S., and Muletz-Wolz, C. R. (2021). アフリカゾウとアジアゾウにおける腸内細菌叢構造と関連した臨床的健康問題、生殖ホルモン、代謝ホルモン。Anim. Microb. 3:85. doi: 10.1186/s42523-021-00146-9
CrossRef 全文|Google Scholar
Koirala, R. K., Ji, W., Paudel, P., Coogan, S. C. P., Rothman, J. M., and Raubenheimer, D. (2019). 家畜アジアゾウの食餌の多量栄養素組成に及ぼす年齢、性別、季節の影響。Journ. Appl. Anim. 47, 5-16. doi: 10.1080/09712119.2018.1552589.
クロスレフ・フルテキスト|Google Scholar
Lasky, M., Campbell, J., Osborne, J. A., Ivory, E. L., Lasky, J., and Kendall, C. J. (2021). ブラウズと社会的複雑性の増大は動物園ゾウの福祉を改善できる。動物園生物学 40, 9-19.
PubMed Abstract|RefRef Full Text|Google Scholar
Lee, W.-J., and Hase, K. (2014). 動物の健康と病気における腸内細菌叢生成代謝産物。Nat. Chem. doi: 10.1038/nchembio.1535.
パブコメ抄録|全文|Google Scholar
Lhomme, S. (2015). リスクコンテクストにおける技術ネットワーク構造の空間分析。Cybergeo Eur. 地理学 711.
クロスレフ・フルテキスト|Google Scholar
Miller, D., Jackson, B., Riddle, H. S., Stremme, C., Schmitt, D., and Miller, T. (2015). アジアにおけるゾウ(Elephas maximus)の健康と管理:獣医学的観点のバリエーション。Vet. Med. 2015:614690。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Moustafa, M. A. M., Chel, H. M., Thu, M. J., Bawm, S., Htun, L. L., Win, M. M., et al. 人為的干渉はアジアゾウの腸内マイクロバイオーム異常につながり、周辺環境への適応プロセスを変化させる可能性がある。Sci. Rep. 11:741. doi: 10.1038/s41598-020-80537-1.
クロスリファレンス全文|Google Scholar
Mwambola, S., Ijumba, J., Kibasa, W., Masenga, E., Eblate, E., and Kayombo, C. J. (2014). Rubondo Island National Park (RINP) Tanzaniaにおけるアフリカゾウ(Loxodanta africana)の木本植物種に対する摂食嗜好性。Am. J. Res. Commun. 2, 102-113.
Google Scholar
Neu, A. T., Allen, E. E., and Roy, K. (2021). コアマイクロバイオームの定義と定量化:課題と展望。Proc. Natl. Acad. 米国)118:e2104429118. doi: 10.1073/pnas.2104429118.
パブコメ抄録|クロスリファレンス全文|Google Scholar
O'Donnell, M. M., Harris, H. M. B., Ross, R. P., and O'Toole, P. W. (2017). 家畜化された草食反芻動物、後腸発酵動物、および単胃動物のコア糞便微生物叢。Microbiol. Open. 2017:e509. doi: 10.1002/mbo3.509
クロス・リーフ・フルテキスト|Google Scholar
Pretorius, Y., Stigter, J. D., de Boer, W. F., van Wieren, S. E., de Jong, C. B., de Knegt, H. J., et al. アフリカゾウの経時的な食餌選択は、最適化通貨の変化を示している。doi: 10.1111/j.1600-0706.2012.19680.x.
クロスレフ・フルテキスト|Google Scholar
Price, M. N., Dehal, P. S., and Arkin, A. P. (2010). FastTree 2 - ラージアラインメントのための近似最尤ツリー。この論文では、「ゲノム解析のための樹木構造解析」と題して、樹木構造解析のための樹木構造解析の基礎となる、樹木構造解析のための樹木構造解析を行った。
クロスレフ・フルテキスト|Google Scholar
Quast, C., Presse, E., Yilmaz, P., Gerken, J., Schweer, T., Yarza, P., et al. SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール。Nucel. (2013)SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール。
CrossRef 全文|Google Scholar
Risely, A. (2020). 宿主-微生物系を理解するためのコアマイクロバイオームの応用。J. Anim. Ecol. 89, 1549-1558.
パブコメ抄録|RefRef全文|Google Scholar
Robeson, M. S., O'Rourke, D. R., Kaehler, B. D., Ziemski, M., Dillon, M. R., Foster, J. T., et al. RESCRIPt:再現可能な配列分類学参照データベース管理。PLoS Comput. 生物多様性保全のための生物多様性データベース。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Röttjers, L., Vandeputte, D., Raes, J., and Faust, K. (2021). ヌルモデルに基づくネットワーク比較により、核となる関連性が明らかになった。ISME Commun. 1:36. doi: 10.1038/s43705-021-00036-w
クロスレフ・フルテキスト|Google Scholar
Sach, F., Dierenfeld, E. S., Langley-Evans, S. C., Watts, M. J., and Yon, L. (2019). 栄養の必要性に基づいて移動の選択を行う草食動物の例としてのアフリカサバンナゾウ(Loxodonta africana)。PeerJ 7:e6260. doi: 10.7717/peerj.6260.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Scharling, F. S., Bertelsen, M. F., Sós, E., and Bojesen, A. M. (2021). ヨーロッパにおけるヘラジカゾウ(Loxodonta species and Elephas maximus)の糞便中のサルモネラ属菌、クロストリジウム・パーフリンゲンス、クロストリジウム・ディフィシルの有病率。J. Zoo Wildl. Med. 51, 752-760.
PubMed Abstract|RefRef Full Text|Google Scholar
Schiffmann, C., Hoby, S., Wenker, C., Hård, T., Scholz, R., Clauss, M., et al. When elephants fall asleep: a literature review on elephant rest with case studies on elephant falling bouts, and practical solutions for zoo elephants. doi: 10.1002/zoo.21406.
パブコメ抄録|全文|Google Scholar
Schoster, A., Staempfli, H. R., Guardabassi, L. G., Jalali, M., and Weese, J. S. (2017). 生後2週目と4週目の健康な子馬と下痢性子馬の糞便細菌叢の比較。BMC Vet. doi: 10.1186/s12917-017-1064-x
クロステキスト|Google Scholar
Scott, N. L., and LaDue, C. A. (2019). アフリカゾウにおける展示サイズ対複雑さの行動効果:小さなスペースに対する潜在的な解決策。動物園生物 38, 448-457.
パブコメ要旨|全文|Google Scholar
Shade, A., and Handelsman, J. (2012). ベン図を超えて:コアマイクロバイオームの探索。Environ. Microbiol. 14, 4-12. doi: 10.1111/j.1462-2920.2011.02585.x
パブコメ抄録|全文|Google Scholar
Shreiner, A. B., Kao, J. Y., and Young, V. B. (2015). 健康状態と疾患における腸内細菌叢。Curr. Opin. Gastroenterol. 31, 69-75. doi: 10.1097/MOG.000000000139
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Stefanini, I., Carlin, S., Tocci, N., Albanese, D., Donati, C., Franceschi, P., et al. Vitis vinifera L. cv. Corvinaのブドウとマストのコア微生物叢とメタボローム。Front. Microbiol. 8:457. doi: 10.3389/fmicb.2017.00457.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Stępień, P., Świechowski, K., Hnat, M., Kugler, S., Stegenta-Dąbrowska, S., Koziel, J. A., et al. 廃棄物から炭素へ:新しい調理用燃料としての象の糞からのバイオコール。doi: 10.3390/en12224344.
CrossRef 全文|Google Scholar
Sthitmatee, N., Mahatnirunkul, P., Keawmong, P., Sirimalaisuwan, A., Boontong, P., Rojanasthien, S., et al. 飼育下のアジアゾウ(Elephas maximus)におけるルミノコッカス株の観察。Thai J. Vet. Med. 41, 267-272.
CrossRef Full Text|Google Scholar
Turnbaugh, P. J., Hamady, M., Yatsunenko, T., Cantarel, B. L., Duncan, A., Ley, R. E., et al. 肥満と痩身の双生児におけるコア腸内細菌叢。ネイチャー457, 480-484.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Turnbaugh, P. J., Ley, R. E., Hamady, M., Fraser-Liggett, C. M., Knight, R., and Gordon, J. I. (2007). ヒトマイクロバイオームプロジェクト。Nature 449, 804-810.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Valeri, F., and Endres, K. (2021). 宿主の生物学的性別が腸内細菌叢をどのように形成するか。Front. Neuroendocrinol. doi: 10.1016/j.yfrne.2021.100912.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Van Hoven, W., and Lankhorst, A. (1981). アフリカゾウの発酵消化。South Afr. J. Wildl. doi: 10.10520/AJA03794369_2385.
CrossRef 全文|Google Scholar
Wang, Z., Zolnik, C. P., Qiu, Y., Usyk, M., Wang, T., Strickler, H. D., et al. マイクロバイオームおよびメタボロミクス研究のための糞便採取法の比較。Front. Cell. Infect. Microbiol. 8:e00301. doi: 10.3389/fcimb.2018.00301.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
West, A. G., Waite, D. W., Deines, P., Bourne, D. G., Digby, A., McKenzie, V. J., et al. 絶滅危惧種の保全におけるマイクロバイオーム。Biol. Conserv. 229, 85-98. doi: 10.1016/j.biocon.2018.11.016
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wood, J., Koutsos, E., Kendall, C. J., Minter, L. J., Tollefson, T. N., and Heugten, K. A. (2020). アフリカゾウ(Loxodonta africana)の様々なブラウズおよびペレット含有量を用いた食餌の分析。動物園生物学 39, 37-50.
パブコメ抄録|全文|Google Scholar
Zaura, E., Keijser, B. J., Huse, S. M., and Crielaard, W. (2009). 口腔微生物群集の健康的な「コアマイクロバイオーム」の定義。BMC Microbiol. 9:259.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang,C.,Lian,Z.,Xu,B.,Shen,Q.,Bao,M.,Huang,Z.,他(2023)。ライフスタイル勾配に沿った腸内細菌叢の変異から、アジアゾウが直面する脅威が明らかになった。Gen. Prot. Gen. Prot. 21, 150-163.
パブコメ要旨|全文|Google Scholar
キーワード:ゾウ、動物園、Loxodonta africana、マイクロバイオーム組成、微生物叢、Proboscidae
引用 動物園で飼育されているゾウ(Loxodonta africana)と放し飼いにされているゾウ(Loxodonta africana)において、保存されているコアマイクロバイオータ。Front. Microbiol. 14:1247719.
受理された: 26 June 2023; Accepted: 2023年8月30日;
発行:2023年10月04日
編集者
David C. B. Taras, ベーリンガーインゲルハイム(ドイツ), ドイツ
査読者
Jenna Parker, 米国国立科学財団(NSF), 米国
Errol Duncan Cason, フリーステート大学(南アフリカ
Copyright © 2023 Thorel, Obregon, Mulot, Maitre, Mateos-Hernandez, Moalic, Wu-Chuang, Cabezas-Cruz and Leclerc. 本記事は、クリエイティブ・コモンズ 表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事である。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Milan Thorel, milan.thorel591@gmail.com
現住所: Milan Thorel, Ménagerie du jardin des plantes, Museum National d'Histoire Naturelle, Paris, France.
‡これらの著者はこの研究に等しく貢献している。
免責事項:本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
飼育下のフンボルトペンギン(Spheniscus humboldti)におけるアスペルギルス感染に対する経口プロバイオティクスベースのワクチンの安全性と有効性の評価
Milan Thorel, Lourdes Mateos-Hernandez, Baptiste Mulot, Mouna Naila Azzouni, Adnan Hodžić, Hugues Gaillot, Yannick Ruel, Guillaume Desoubeaux, Jean-Baptiste Delaye, Dasiel Obregon, Alejandra Wu-Chuang, José de la Fuente, Luis G. Bermúdez-Humarán, Veronica Risco-Castillo, Antoine Leclerc, Alejandro Cabezas-Cruz
生態学的に異なるミミズ種が、葉菜類Brassica campestrisによる鉛の取り込みに影響を及ぼす微生物ホットスポットの原動力となっている。
Cevin Tibihenda、Hesen Zhong、Kexue Liu、Jun Dai、Xiaoqin Lin、Mikael Motelica-Heino、Shuyu Hou、Menghao Zhang、Ying Lu、Ling Xiao、Chi Zhang
植物性食肉類似物の官能品質向上のための発酵利用の可能性と課題
ホサム・エルハリス、シン・イー・シー、ラファエル・オーセン、シン・ホイ・チン、イボンヌ・チョウ
市民科学はサンゴ礁にも地域住民にも利益をもたらす
ダルトン・ヘズリー、マデリン・カウフマン、ディエゴ・リルマン
抗微生物生物ワクチンはマダニのマイクロバイオームを分類群特異的に調節する
Lourdes Mateos-Hernández、Dasiel Obregón、Alejandra Wu-Chuang、Jennifer Maye、Jeremie Bornères、Nicolas Versillé、José de la Fuente、Sandra Díaz-Sánchez、Luis G. Bermúdez-Humarán、Edgar Torres-Maravilla、Agustín Estrada-Peña、Adnan Hodžić、Ladislav Šimo、Alejandro Cabezas-Cruz
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
