小児てんかんに対するケトン食療法はヒト腸内細菌叢の変化と関連し、マウスに発作抵抗性をもたらす
本文へスキップ記事へスキップ
エルゼビアロゴ
セル・レポート
42巻 12号 2023年12月26日 113521号
論文
小児てんかんに対するケトン食療法はヒト腸内細菌叢の変化と関連し、マウスに発作抵抗性をもたらす
https://www.sciencedirect.com/science/article/pii/S2211124723015334
著者リンク オーバーレイパネルを開くGregory R. Lum 1, Sung Min Ha 1, Christine A. Olson 1, Montgomery Blencowe 1, Jorge Paramo 2, Beck Reyes 3, Joyce H. Matsumoto 3, Xia Yang 1, Elaine Y. Hsiao 1 2 4
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.celrep.2023.113521
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
KDに関連したヒト腸内細菌をマウスにコロニー形成させると発作抵抗性が高まる
ヒトの腸内細菌とマウスの腸内細菌は、メタゲノムおよびメタボロミクスにおいて共通の特徴を持つ
KD関連腸内微生物でコロニー形成されたマウスは脳のトランスクリプトームに変化を示す
マルチオミクス解析により、発作予防の鍵となる微生物の候補が示される
要約
動物モデルにおいて、腸内細菌叢はてんかん発作感受性とケトジェニック食(KD)の抗てんかん効果を調節しているが、これらの関係がヒトてんかんのKD療法につながるかどうかは不明である。我々は、難治性てんかんの小児において、臨床的KDが腸内微生物の機能を変化させることを見出した。KDに関連した微生物をマウスにコロニー形成させると、治療前の対照群と比較して発作抵抗性が促進される。アナプレロシス、脂肪酸β酸化、アミノ酸代謝に関連するメタゲノムおよびメタボロミクス上の特徴として、ヒトのKD治療で認められ、マウスへのマイクロバイオーム移植でも維持された。KDに関連した腸内微生物でコロニー形成されたマウスは、ATP合成、グルタチオン代謝、酸化的リン酸化に関連する経路を含む海馬トランスクリプトームの変化を示し、ヒトてんかんにおいて同定された感受性遺伝子と関連している。我々の発見は、小児てんかんのKD療法によって変化する主要な微生物機能を明らかにし、微生物が誘発する脳遺伝子発現の変化とマウスの発作予防との関連を明らかにした。
グラフィカル抄録
ダウンロード 高解像度画像ダウンロード(155KB)
ダウンロード フルサイズ画像のダウンロード
前へ次へ
キーワード
マイクロバイオーム・ケトジェニック・ダイエット発作てんかん
研究テーマ
CP: 微生物学CP: 神経科学
はじめに
低炭水化物・高脂肪ケトジェニック食(KD)は、難治性てんかん、特に既存の抗てんかん薬に反応しない小児てんかんに対する主要な治療法である。KDの有効性は複数のレトロスペクティブおよびプロスペクティブ研究によって裏付けられており、小児患者の約30%が発作を起こさなくなり、約60%が発作を50%以上減少させるという実質的な効果を経験していると推定されている。発作の減少に成功しても、治療開始3年目までのKD継続率は13%と報告されている6。中止の主な理由としては、反応性の低さに加え、食事制限や食事の副作用が挙げられる。KDがどのようにしててんかんを予防するのか、その正確なメカニズムはいまだ不明であり、KDに対する患者の反応性の生物学的決定因子は十分に理解されていない。
腸内細菌叢は、宿主の代謝、神経活動、行動に対する食事の影響を媒介する上で不可欠な役割を果たしている7,8。現在までに、てんかん患者におけるKDレジメンと微生物叢の変化との関連を報告した臨床研究は数少ないが、関与する特定の微生物分類群や遺伝子経路については報告間でほとんど一貫性がない9,10,11。我々は以前、難治性てんかんの6Hz発作モデルおよびKcna1欠損マウスモデルにおいて、KDによって誘発された腸内細菌叢の変化がKD食の発作予防効果を媒介することを報告した12。同様に、小児けいれんのラット傷害モデルでは、KDによって誘導された腸内細菌叢を対照食(CD)を与えたナイーブ動物に移植すると、けいれんが抑制された13。さらに、Dravet症候群のScn1a欠損モデルでは、腸内細菌叢の分類学的差異がKDによる発作保護と相関していた14。齧歯類研究から得られたこれらの結果が、ヒトてんかん、ヒト腸内細菌叢、および臨床的なKDレジメンに当てはまるかどうかは依然として不明であり、発作感受性に影響を及ぼす中核的な微生物機能も不明である。
我々は、難治性てんかんの小児におけるKD介入に関する前向き研究を行い、臨床KDレジメン開始前後のヒト腸内細菌叢が発作感受性に及ぼす因果関係をマウスで検証した。KD治療に伴う微生物の機能的変化を評価する。その結果、臨床的KDに関連する腸内細菌叢の共通した特徴がレシピエントマウスで維持され、微生物依存的な発作予防と相関することを明らかにした。最後に、KDに関連するヒト腸内細菌叢の発作予防効果に寄与すると考えられる、腸内細菌叢、代謝産物、脳のトランスクリプトーム間の重要なネットワーク相互作用を同定した。
研究結果
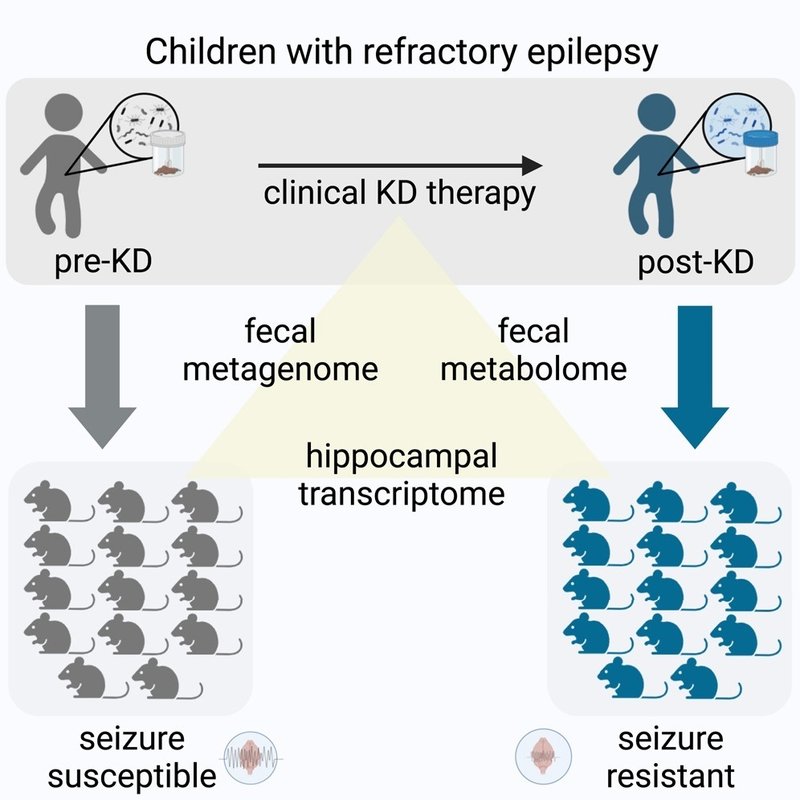
難治性てんかんの小児コホートにおいて、臨床的KDレジメンが腸内細菌叢の共通の機能的特徴を引き出す
KDは小児の難治性てんかんに対して一般的に処方され、小児は臨床医や登録栄養士の指導のもと、市販のケトジェニックフォーミュラおよび/または脂肪が多く炭水化物が制限された食事を摂取する5。さらに、KD療法として摂取されるマクロおよびミクロ栄養素は、さまざまな食物源によって決定される。さらに、治療集団は、遺伝的リスク、発作の病型、薬剤の使用など、他の要因の中でもさまざまである。そこで、難治性てんかんに対する臨床的に意義のあるKD治療が腸内細菌叢に及ぼす影響を評価するために、UCLA Mattel小児病院のケトジェニックダイエットプログラムに新規登録された小児難治性てんかん患者10人を対象に前向き研究を行った(表S1A)。各患者から、KD療法を開始する1日前(pre-KD)および臨床的に指導されたKDを遵守した約1ヵ月後(post-KD)に便サンプルを採取した。
16S rRNA遺伝子配列決定により、KD後の糞便微生物叢の細菌α多様性には、マッチさせたKD前の対照と比較して有意差はないことが示された(図S1A;表S2A)。ベースラインの微生物叢組成には個人差がかなりあった(図S1B)。さらに、臨床的KDは、KD前の対照と比較して、KD後のサンプル間で細菌β多様性に差のあるシフトを誘発したが、これは年齢、性別、および抗けいれん薬の服用歴などの人口統計学的または臨床的指標とは有意に関連しなかった(図S1B;表S1AおよびS1B)。微生物分類学的プロフィールにおける個体間変動と一致して、マイクロバイオームの組成分析(ANCOM)およびANOVA分析では、KD前の対照群に対するKD後の全サンプルを考慮しても有意差は認められなかった(図S1C)。これらの結果は、この特定のコホート内では、難治性てんかん患者の腸内細菌叢の微生物組成に対する臨床的KDの共有効果はないことを示している。
ベースライン時および食事療法に対する反応時の細菌分類学的プロファイルが多様であったことから、次に、臨床的KDが腸内細菌叢の機能的潜在能力における共通の変化と関連しているかどうかを検討した。KD前の対照と比較して、KD後のサンプルは、検出されたパスウェイの多様性の94%以上を構成する、最も豊富な上位26の機能パスウェイに属する微生物遺伝子の発現が有意に減少していた(図S1DおよびS1E;表S3A)。観察された全パスウェイに変化は見られなかった(図S1F)。このことは、臨床的KDによって、一般的な機能に関連する遺伝子を保有する微生物分類群のメンバーが制限されること、および/または、以前は十分に代表されていなかった機能に関連する遺伝子を保有する微生物分類群がエンリッチされることを示唆している。KD後のサンプルは、ホルムアルデヒド同化、グアノシンヌクレオチド分解、およびL-プロリン生合成に関連する遺伝子の有意な濃縮を示し、エアロバクチン生合成に関連する遺伝子の発現は減少した(図S1G;表S3B、「考察」のセクション参照)。また、GDP-マンノース生合成、2-メチルシトレートサイクル、グリコール代謝および分解に関連する遺伝子は緩やかに増加し、ポリアミン生合成およびビオチン生合成に関連する遺伝子は減少した(図S1G)。これらのデータは、比率や特定の栄養組成が異なるKDレジメンが、様々なサブタイプの難治性てんかんを有する小児に共通する腸内細菌叢の機能的潜在能力の幅広い変化を引き起こすことを示唆している。
KD治療を受けた小児てんかん患者の糞便微生物叢をマウスに移植すると発作抵抗性が付与される
臨床サンプル中の微生物をマイクロバイオーム欠損マウスに移植することにより、ヒトのマイクロバイオームの因果的影響を研究することができる。KDに関連する腸内微生物が発作感受性に影響を及ぼすかどうかを評価するために、我々は無菌(GF)マウスの個々のコホートにKD前およびKD後の便サンプルを接種し、標準飼料(CD)で飼育した。各ヒトドナー検体(生物学的複製として10個体のKD前およびKD後)を13~15匹のGFマウス(技術的複製として)に接種し、6-Hz発作に対する感受性をコホートレベルで試験した(図1A)。難治性てんかんと一致して、6-Hzモデルはいくつかの抗てんかん薬に抵抗性であるが、KDチョウを投与すると、げっ歯類のてんかん発作が抑制され18、試験した被験者の50%で発作を誘発するのに必要な電流強度(CC50、発作閾値)が上昇する。4日という時点は、CDを与えたマウスでKD誘発微生物叢を維持できる最大期間として選ばれた12。
ダウンロード 高解像度画像ダウンロード(864KB)
ダウンロード フルサイズ画像のダウンロード
図1. 小児てんかん患者から臨床KD関連腸内細菌叢をマウスに移植すると、6Hz発作に対する抵抗性が付与される。
(AおよびB)(A)KD前およびKD後のヒト微生物叢を接種したマウスの実験概略図および(B)6-Hz発作閾値(Tukey'sを用いた一元配置分散分析、n=13-15マウス/患者サンプル)。
(C) 患者サンプルごとのレシピエントマウスの平均発作閾値(両側、対になっていないWelchのt検定、n = 10患者/群)。
(D)KD前(n = 140)とKD後(n = 141)のすべてのレシピエントマウスの探索までの潜時。
(E)寛解発作の平均電流(両側、対になっていないWelchのt検定。) データは平均値±SEMで表示。∗∗∗p<0.001、*****p<0.0001、##p<0.0001(マウスレシピエント内)。
KD後の微生物叢の微生物でコロニー形成されたGFマウスは、KD前の微生物叢でコロニー形成されたコントロールと比較して、6Hzの発作を誘発するためにより強い電流を必要とすることが観察された(図1B;表S4)。この効果は、患者ごとの個々の技術的複製についてKD後とKD前の微生物叢の移入を比較した場合(図1B)、およびデータを全患者で平均した場合(図1Cおよび1D)に認められた。無作為に選択したKD後サンプルを、微生物叢を枯渇させるために広域抗生物質で前処理したマウスに移植しても同様の増加が見られたことから(図S2A-S2C)、発作抵抗性の増加はレシピエントマウスのGFバックグラウンドに依存しないことが示唆された。KD前の対照と比較して、KD後の微生物叢の微生物でコロニー形成されたマウスは、最初の刺激誘発発作の後に観察された1回以上の再発発作を誘発するために、電流の強度を増加させる必要もあった(図1E)。これは、KD後のヒト微生物叢の移入が、一次誘発発作と寛解発作の両方に対する抵抗性を促進することを示している。平均して、KD後のサンプルは、マッチさせたKD前の対照に対して発作閾値を22.4%±6.4%上昇させた(図1Cおよび1D)。これは、野生型マウスに対するKD食の平均的な効果(24.5%、12)、およびCDを与えた対照と比較して、従来の成体マウス微生物叢(GF-conv)をコロニー形成し、KD食を与えたGFマウスで観察された24.0%の増加(図1B)と一致している。患者間の効果の大きさの不一致は、KD前の状態におけるベースラインの違いによるところが大きく(図1B)、宿主間の種間移行によって生じる微生物の多様性が比較的低いことが発作感受性を高めることを示唆している。これと一致して、抗生物質治療によって微生物の多様性を低下させると、6Hzの発作閾値が低下することが以前観察された。全体として、これらの結果は、臨床的KDに関連したヒト腸内細菌叢をマウスに接種すると、6-Hz発作閾値が実験的KDチャウを直接摂取した場合と同様のレベルまで上昇することを示している。
ヒト腸内細菌叢をマウスに移植するには、ヒトの便懸濁液を経口接種する必要があるが、この懸濁液は、微生物バイオマスだけでなく、未消化の食物や宿主および腸内細菌叢から分泌された分子で構成されている。そのため、移植手順に反応して見られる効果は、KDに関連した腸内細菌叢、あるいは微生物叢に依存しない食餌因子や宿主因子に起因する可能性がある。ヒトのKD後の微生物叢をマウスに接種することによって見られた発作防御の増加を媒介するために、腸内細菌叢の細菌が必要であるかどうかについての洞察を得るために、無作為に選択したKD後のドナーサンプルを接種したGFマウスを、微生物叢を枯渇させるために抗生物質で後処理するか、陰性対照としてビヒクルで後処理した(図S2DおよびS2E)。KD後のサンプルを接種し、ビヒクルで処理したマウスは、ビヒクルを添加しないレシピエントマウスで以前に見られたものと同等の発作閾値を示した(図S2F、S2G、1B;表S4)。このことは、KD後の微生物によって誘発された発作抵抗性の増加は、最初の移植実験(図1Bおよび1C)で用いた4日後の時点以降も維持され、CDを与えたビヒクル処理マウスでは接種後12日まで延長したことを示唆している(図S2FおよびS2G)。対照的に、KD後の微生物叢をコロニー形成させたマウスでは、腸内細菌を枯渇させると、発作閾値は、KDコロニー形成前の対照マウスで見られた以前のレベルよりも低いレベルまで低下した(図S2F、S2G、および1B)。これらの結果は、KD後の微生物叢の細菌メンバーが、小児てんかん患者からの臨床的KD関連微生物叢のマウスへの移植に応答して見られる発作閾値の上昇を媒介するのに必要であることを示している。
生きている微生物叢の代わりに微生物の代謝産物や微生物叢依存性分子を投与すると、再発性クロストリジウム・ディフィシル感染症、炎症性腸疾患、多発性硬化症などの症状が改善することが報告されている19,20,21。臨床的KDに関連した腸内小分子の投与が、マウスの発作予防に十分であるかどうかを知るために、KD後のドナーサンプルを無菌濾過し、GFレシピエントマウスのコホート(図S3A)に、ヒト微生物叢の接種で以前に行ったように、濾過していないKD後の懸濁液を投与したコントロールと並べて投与した(図S3Aおよび1B)。接種後4日目に、KD後濾液を投与されたマウスは、対応する未濾過のKD後懸濁液を投与された対照と比較して、より低い発作閾値を示した(図S3BおよびS3C;表S4)。これらのデータは、小児てんかん患者のKD後糞便サンプル中の臨床的KD関連小分子は、マウスに持続的な発作防御を与えるには十分ではないことを示している。
微生物代謝産物を含む臨床的KD関連腸内小分子が発作感受性を急性に調節するかどうかをさらに評価するため、マウスに無菌ろ過したKD後サンプルを経口投与し、前回の実験のように4日後ではなく、2時間後に6Hzの発作閾値を評価した(図S3D)。KD後濾液で処置したマウスは、KD前濾液で処置した対照と比較して有意に増加した発作防御を示し(図S3EおよびS3F;表S4)、発作閾値はKD後懸濁液の接種後に見られたものに近づいた(図S3E、S3Gおよび1B)。これらのデータは、臨床的KD関連腸小分子の投与が、短い時間スケール(すなわち、2時間;図S3D-S3G)でマウスに発作防御を急性的に付与し、それが投与後4日までに減少することを示している(図S3A-S3C)。以上の結果から、小児難治性てんかんの臨床的KDは、マウスの発作抵抗性を促進する腸内細菌叢の代謝活性の変化と関連していることが示唆された。
臨床便サンプルからの微生物叢でマウスを「ヒト化」することは、トランスレーショナルなマイクロバイオーム研究のための強力なツールであるが24、このアプローチには慎重な検討が必要な技術的・生物学的限界がある25。ドナーインキュラムの分類学的・機能的多様性の多くはレシピエントマウスで再現可能であるが26、発育の影響や宿主特異的選択27などの要因により、ヒト腸内細菌叢をGFマウスに完全に「移植」することはできない25。小児てんかん患者からGFマウスへの糞便微生物叢移植の忠実性を評価するために、ドナーのKD前およびKD後の便サンプルと、対応するレシピエントマウスの接種4日後(発作検査日)に採取した糞便ペレットの両方を16S rRNA遺伝子配列決定に供した(図1AおよびS4A-S4E;表S2AおよびS2B)。α多様性の有意な減少が観察され、すべてのヒトドナー微生物叢に対するすべてのマウスレシピエント微生物叢の平均減少率は38%であった(図S4C)。これらの結果は、ヒト微生物叢を接種したマウスにおける細菌α多様性の減少に関する過去の報告と一致しており、その減少率は35%、38%、50%と推定された28,29,30。しかし、小児てんかん患者から採取したヒト腸内細菌叢の分類学的多様性をマウスで完全に再現できなかったことから、KD後の微生物叢を接種したマウスでみられた発作抵抗性の増加が実際の臨床状態に関連しているかどうかが疑問視されている。そこで我々は、KDに関連したヒト腸内細菌叢の機能的特徴のうち、レシピエントマウスで再現されるサブセットの同定と評価、およびマウスにおける発作防御に対応する宿主生理における微生物叢依存的変化の同定と評価に、その後の実験の焦点を絞った。
臨床的なKD関連ヒト微生物叢の機能的特徴の一部は、コロニー形成されたレシピエントマウスで再現され、発作防御と相関する。
臨床的KDによって腸内細菌叢の活性がどのように変化するかを明らかにすることで、KDの生理学的効果に関する重要な知見が得られる可能性がある。臨床的KDとマイクロバイオームとの関連性を同定し、関連性があるとすればそのうちのどれが発作リスクを修飾する可能性があるのかをさらに明らかにするために、臨床的KDによる治療前後の小児てんかん患者の腸内細菌叢、および患者サンプルを接種したgnotobioticマウスの腸内細菌叢を機能的に特徴付け、発作感受性との因果関係を検証した。メタゲノム配列決定と解析の結果、KD前の対照と比較してKD後のサンプルで発現量が異なり、ヒトのドナーサンプルとマウスのレシピエントサンプルの両方で共有される微生物遺伝子パスウェイが明らかになった(図2A;表S3A、S3C、S3D)。脂肪酸β酸化、グリコール代謝および分解、メチルシトレートサイクルI/II、およびプロリン生合成に関連する微生物遺伝子は、KD前の対照と比較して、KD後のヒトサンプルおよびKD接種後のマウスで同様に上昇した(図2Aおよび2B;表S3D)。これらの所見は、脂肪酸酸化に対するKDの影響31、グリオキシル酸サイクルの促進に対する糖質制限の影響32、およびメチルシトレートサイクルの開始に対する脂肪酸β酸化の影響33が報告されていることと一致している。プロリン代謝にはグルタミン、グルタミン酸、オルニチン、アルギニンとの反応が関与しており、KDがアミノ酸代謝、特にグルタミンとグルタミン酸の代謝に及ぼす影響が報告されていることと関連している可能性がある34。さらに、KD後のヒトドナーおよびマウスレシピエントサンプルはいずれも、ポリアミン生合成およびエアロバクチン生合成に関連する微生物遺伝子の減少を示した(図2Aおよび2B;表S3D)。ポリアミン生合成は、糖原性アミノ酸であるL-アルギニンを介してプトレシンを生成するが、KD中は消費量が減少する。アエロバクチンの生合成には、ケトン原性アミノ酸であるL-リジンが使われるが、これはケトーシス中のアセチル-コエンザイムA(CoA)合成とエネルギー産生にも必須である。これらのデータは、難治性てんかんの小児が臨床的KDを摂取することで、食事性脂肪を代謝し、食事性炭水化物が制限されたときにアナプレロティック反応を行う機能的能力を有する腸内微生物が豊富になることを示唆している。この知見は、KDに関連したヒト腸内細菌叢のこれらの一般的特徴が、6-Hz発作に対して微生物群依存的な防御を示すレシピエントマウスにおいて表現されることを示している。
ダウンロード 高解像度画像ダウンロード(2MB)
ダウンロード フルサイズ画像のダウンロード
図2. 臨床的KDに関連したヒト微生物叢は、発作を防御したレシピエントマウスで表現される機能的変化を示す。
(A)KD後とKD前(n = 10/condition;各レシピエントnはドナーサンプルあたり5匹のマウスの平均を表す)で異なるメタゲノム経路(p < 0.10、ここで∗p < 0.05)。赤文字はKD後のドナーとレシピエントにおける同じ方向の変化を示す。
(B) KD後のドナーとレシピエントで同じ方向に異なるメタゲノム経路。
(C) ドナーおよびレシピエントの糞便と血清中のβ-ヒドロキシ酪酸とグルコース(両側Wilcoxon;n = 10/条件、各レシピエントnはドナーサンプルあたり5匹のマウスの平均を示す)。
(D)糞便中代謝物の濃縮度上位25化学サブクラス(p < 0.05、マッチドペアStudentのt検定、n = 10/条件)。赤文字はヒトとマウスに共通する差のある化学サブクラスを示す。オレンジのアスタリスクは、文献に基づくKDに関連する追加の化学物質サブクラスを示す。
(E) Small Molecule Pathway Databaseの上位25パスウェイで、糞便中の代謝物量が有意に多いパスウェイ(p < 0.05、マッチドペアStudentのt検定、n = 10/condition)。データは平均値±SEMで表示。∗p<0.05;***p<0.001;n.s.は統計的に有意でない。
観察されたメタゲノムシグネチャーは、臨床的KDに関連した腸内細菌叢の機能的可能性の変化を明らかにし、それはGFマウスに移植しても維持された。腸内細菌叢の機能的活性における臨床的KD誘発性の変化を同定するために、我々はドナーの糞便サンプルおよびレシピエントマウスの糞便および血清サンプルの代謝プロファイルを調べた(表S5A-S5C)。ヒト血液サンプルの臨床検査結果から、小児難治性てんかん患者において、1ヵ月間の臨床KDレジメンは血清β-ヒドロキシ酪酸(BHBA)レベルを上昇させ、血清グルコースレベルを低下させることが確認された(図2C)。便中ではBHBAではなくグルコースの減少が同様に認められた(図2C)。このことは、食事による糖質制限とKDによる肝臓でのBHBA合成が、便中ではなく全身のBHBAレベルを上昇させたことと一致している35。KD後のヒト微生物叢をマウスに移植すると、KD前のレシピエント対照と比較して、血清BHBAおよびグルコースに有意差は認められなかった(図2C)ことから、臨床的KDに関連した微生物叢は、標準的なCDを与えたマウスではケトーシスの主要な特徴を促進しないことが示された。しかしながら、KD後のヒト微生物叢を接種してCDを与えたマウスは、マッチさせたKD前のレシピエント対照と比較して、糞便中のBHBAレベルが統計的に有意に増加した(図2C)。これは、BHBA36の腸内合成における変化、および/または実験デザインのアーチファクトとして起こる宿主由来BHBA37の微生物利用における変化を反映している可能性がある。これらの結果から、臨床的KDに関連したヒト腸内細菌叢をマウスに移植すると、ケトーシスとは無関係に作用する機序により、6-Hz発作(図1)に対する抵抗性が促進されることが示唆された。
さらに、非標的メタボロームプロファイリングを行い、ヒトのドナーサンプルとマウスのレシピエントサンプルに共通する代謝パターンを同定した(図2D、2E、S5、表S5A、S5B、S6A)。患者集団および特定の臨床的KDレジメンにおける不均一性にもかかわらず、79の代謝物が、マッチさせたKD前の対照と比較して、KD後のヒトの糞便サンプルにおいて有意に豊富であった(図S5A;表S5A)。より広範には、我々のグループ12が以前に発表したように、336の同じ代謝物がヒトの糞便サンプルおよび6:1のKD食対ビタミン・ミネラル適合対照食を2週間与えたマウスで検出された(表S5D)。これらの代謝物のうち、ヒトの糞便サンプルでは35種類、マウスの糞便サンプルでは169種類の代謝物が異なっていた(図S5B)。20種類はヒトとマウスのサンプル間で同じ方向に変化することがわかった(図S5BおよびS5C)。これらには、パルミトレオイルカルニチン(C16:1)やオレオイルカルニチン(C18:1)などの脂肪酸β酸化に関連する代謝物のKDによる増加や、以前から発作感受性と関連しているキヌレニンの減少が含まれていた38。この統計的に有意な重複は、小児てんかんの臨床的KD治療とKDのマウスモデルに共通する生化学的変化が存在すること、およびKD治療を受けたてんかん患者で観察された糞便メタボローム変化の一部は、食事介入の(相関ではなく)直接的な結果であることを示唆している。ヒトとマウスで共通して有意に高濃度であった20種類の代謝物のうち、14種類(約70%)は、KD食餌マウスの腸内細菌を枯渇させる抗生物質投与によってさらに有意に変化した12(図S5B~S5D;表S6B)。これらのデータを総合すると、臨床的KDレジメンは難治性てんかんの小児の糞便代謝物を変化させ、その一部はマイクロバイオームに依存する可能性があることが示された。
微生物叢の構成にはかなりのばらつきがあったが(図S1およびS4)、マウスレシピエントコホートの糞便サンプルは、KD前の対照と比較してKD後の全サンプルを考慮した場合に共有される45代謝物において統計的に有意な変化を示した(図S5A;表S5B)。これは、宿主特異的な代謝物の利用や、レシピエントマウスにはCDが与えられていたのに対し、ヒトドナーにはサンプル採取時に臨床的KDが与えられていたことを反映している可能性があります。アミノ酸、ヒドロキシ脂肪酸、糖酸、フェニルプロパン酸、単糖関連の代謝物を含む選択的な化学クラスは、ヒトのドナーとマウスのレシピエントの両方で同様に濃縮された(図2D、表S6A)。ヒトのKD後糞便検体から得られた代謝物では、胆汁酸およびその他の脂肪酸誘導体の濃縮がみられ、これはKDおよび/または微生物による脂質代謝の変化を反映している可能性がある40。
代謝経路については、ヒトドナーおよびマウスレシピエントの両条件のKD後サンプルで、メチオニン代謝、グリシンおよびセリン代謝、ベタイン代謝に関連する代謝物の存在量に差が認められた(図2E;表S6C)。これらの経路は、KDが1炭素(1C)代謝に及ぼす既知の影響を反映している可能性があり、この代謝は栄養素の利用可能性と細胞の栄養状態を統合している41。マウスKD後レシピエントから得られた糞便代謝産物のうち、α-リノレン酸およびリノール酸代謝、脂肪酸生合成、超長鎖脂肪酸のβ-酸化に関連する経路にマップされたもの(図2E、右)は、脂肪酸代謝に関連する微生物遺伝子のメタゲノム濃縮が観察されたことと一致している(図2Aおよび2B)。特に、アミノ酸、ヒドロキシ脂肪酸、不飽和脂肪酸のサブクラスを表し、α-リノレン酸およびリノール酸代謝、ベタイン代謝、脂肪酸のβ-酸化に関連する代謝物が、KD前の対照サンプルと比較して、KD後のサンプルを摂取したマウスの糞便および血清の両方で変化していた(図S5E;表S6D)。これらの結果を総合すると、臨床的KDは小児てんかん患者の腸内細菌叢の機能に変化を引き起こし、これらの機能的特徴のサブセットは、6-Hz発作に対する微生物依存的耐性を発現するマウスへの微生物移入によって表現コピーされる可能性が示唆される。
KD治療を受けた小児てんかん患者の糞便微生物叢をマウスに移植すると、脳の遺伝子発現に変化が生じる
てんかん発作は、電気信号の放出やこれらの信号の広がりを抑制できないことに関連した、非典型的な神経機能に起因する。KDを受けた個体の糞便微生物叢に由来する微生物によるコロニー形成が、どのように脳機能を変化させ、発作感受性を変化させるかを知るために、我々はレシピエントマウスの脳組織のトランスクリプトームプロファイリングを行った。ヒトてんかんとの関連性、6-Hz発作アッセイにおける精神運動発作の誘発への関与、マイクロバイオームがこれらの脳領域における遺伝子発現や代謝産物を変化させるというエビデンスに基づいて、海馬と前頭皮質に焦点を当てた42,43。海馬組織のRNA配列決定により、KD前の対照群と比較してKD後のサンプルで見られた発現差のある遺伝子(DEG)が明らかになった(表S7A)。その中には、RNAプロセシング、翻訳、細胞ストレス応答、TORC1シグナル伝達、長期シナプス増強の制御、神経細胞の発達、栄養レベルに対する応答に関する中核的な細胞生物学的プロセスに関連するものが含まれていた(図3A)。最も劇的な変化は、Dusp12、Bmpr1b、Cmya5のアップレギュレーションと、Abcc9、Ufsp1、Tbx2のダウンレギュレーションであった(図3B)。Dusp12は二重特異性ホスファターゼ44であり、Bmpr1bは神経細胞の運命に影響するセリン/スレオニンキナーゼ45であり、Cmya5は神経形成期の構造的完全性に不可欠なミオスピルンをコードしている46。Abcc9はカリウムチャネルのスルホニル尿素受容体2サブユニットをコードするATP結合カセット輸送体であり47、Ufsp1はユビキチン様結合を制御するUfm1特異的プロテアーゼであり、発作との関連が指摘されている48、Tbx2は神経細胞周期制御と神経炎症に関連する転写因子である49。さらに、相互作用遺伝子/タンパク質検索ツール(STRING)ネットワーク解析の結果、RNAプロセシング、酸化的リン酸化、細胞周期制御を含む必須生物学的プロセスに濃縮されたタンパク質相互作用クラスターが上位を占め、ジーンオントロジー(GO)濃縮解析の結果(図3A、3C、3D)、エンドサイトーシスとグルタチオン代謝(図3D)と一致した。
ダウンロード 高解像度画像ダウンロード(1022KB)
ダウンロード フルサイズ画像のダウンロード
図3. KD後の微生物叢を接種したマウスの発作抵抗性は脳のトランスクリプトームの変化と関連している
(A)KD後マウス海馬とKD前マウス海馬の生物学的過程ジーンオントロジー(GO)の発現差遺伝子(DEG)(p < 0.05)(n = 10/条件、各nはドナーサンプルあたり6匹のマウスからプールされたもの)。
(B)最小log2倍変化(log2FC)>2でp値によってランク付けされた上位25のDEG。log2FCは列によって正規化されたzスコアである。
(C) GOおよびSTRINGネットワーク解析の両方に現れたDEGのタンパク質相互作用ネットワーク(濃縮スコア>0.7)。
(D) トップサブネットワーククラスターの機能的濃縮。log2FC > 3 または < -3 の場合、その値はノード名の横に記載されている。
KD後のレシピエントの前頭皮質組織でも、KD前の対照と比較していくつかのDEGが同定され(表S7B)、海馬と同様に、RNA監視と異化、細胞ストレス応答、TORC1シグナル伝達の中核的な細胞生物学的プロセスに関連するものが含まれ、さらにカリウムイオン輸送と中核的な糖質代謝に関連する遺伝子も含まれていた(図S6A)。最も劇的な変化は、Serpinb1a、Nqo1、Slc6a12転写産物のアップレギュレーションと、Aldh3b1、Setmar、Tfb1m転写産物のダウンレギュレーションであった(図S6B)。Serpinb1aはセリン/システインプロテアーゼ阻害剤であり50、Nqo1は主にキノンの還元を触媒する抗酸化酵素をコードし51、Slc6a12はベタイン-γ-アミノ酪酸(GABA)トランスポーターをコードする52。Aldh3b1は酸化ストレス軽減に関係するアルデヒド脱水素酵素であり53、Setmarはヒストン-リジンN-メチルトランスフェラーゼをコードし54、Tfb1mはメチルトランスフェラーゼとして機能することが示されている55。STRING解析ではさらに、前頭皮質のGO濃縮解析や海馬のSTRINGネットワークでも見られた、転写制御、翻訳、酸化的リン酸化に濃縮されたタンパク質相互作用クラスターや、カルシウムシグナル伝達、転写制御、翻訳に濃縮されたクラスターが明らかになった(図S6CとS6D)。海馬と前頭皮質の両方から得られたDEGセットは、GO濃縮とSTRINGクラスタリングにより、TORC1シグナル伝達、ストレスに対する細胞応答、および酸化的リン酸化に濃縮され、これらはすべて発作感受性に影響することが示されている56,57。全体として、これらの結果は、KD後のヒト腸内細菌叢の微生物によるコロニー形成に応答して発作抵抗性を獲得したマウスは、KD前のレシピエント対照と比較して、海馬と前頭皮質の遺伝子発現に変化を示すことを示している。
マルチオミクス解析により、微生物のゲノム経路と代謝産物と、てんかんに関連する海馬の転写産物とをつなぐネットワークのつながりが明らかになった。
特定の脳遺伝子発現シグネチャーを駆動する可能性のある主要な腸内微生物機能をさらに同定するために、微生物-代謝産物ベクター(MMVEC)58を利用して、レシピエントマウスから得られた糞便メタゲノミクス、糞便メタボロミクス、血清メタボロミクス、海馬トランスクリプトミクス、前頭皮質トランスクリプトミクスデータセットの統合ネットワークを構築した(表S8AおよびS8B)。ヒトドナーからの糞便メタゲノミックデータセットと糞便メタボロームデータセットからなる並列ネットワークを作成し、ヒトとマウスの両ネットワークで同様に強調された特徴を同定し、それらの臨床的関連性を示唆した。ヒトのドナーとマウスのレシピエントのネットワークは、6つの共通ノードで結ばれていた: すなわち、アデニンとアデノシンのサルベージ(PWY-6609)、dTDP-L-ラムノース生合成(DTDPRHAMSYN-PWY)、葉酸変換(PWY-3841)、L-バリン生合成(VALSYN-PWY)、プレQ0生合成(PWY-6703)、および硫酸化分解(PWY-7446)である(図4A、中央のグレーのノード)。dTDP-L-ラムノース生合成経路の共有は、ヒトのドナーネットワークとマウスのレシピエントネットワークの両方で重み付けキードライバー解析により同定され、ヒトドナーネットワークのアデニンとアデノシンのサルベージ、葉酸変換、L-バリン生合成、および硫酸分解ノードは、さらに重み付けキードライバー解析により、オミックスデータセット間で高度に相互接続され、ネットワークの必須レギュレーターノードとして同定された59(図4A、グレーのダイヤモンド)。ヒトドナーネットワークには、ブタン酸IIへのアセチル-CoA発酵(PWY-5676、共有ノードVALSYN-PWY、PWY6609、およびDTDPRHAMSYN-PWYに接続)、酢酸および乳酸IIへのピルビン酸発酵(PWY-5100、共有ノードPWY-7446に接続)を含む、さらなるキードライバーのメタゲノムノードも含まれていた、 分岐鎖アミノ酸(BCAA)生合成(BRANCHED-CHAIN-AA-SYN-PWY、共有ノードPWY-6609に接続)、および脂肪酸生合成のスーパー経路(FASYN-INITIAL-PWY、共有ノードPWY-6609に接続)は、それぞれ以前にマイクロバイオーム、KD、および/または神経伝達と関連していた。 60,61,62 さらに、マウスのレシピエントネットワークにはL-イソロイシン生合成(PWY-5101)が含まれており、これはBCAA生合成に関連するヒトのドナーのメタゲノムノードと一致している。ヒトの糞便メタボロームモジュールには、バリン、ロイシン、イソロイシン(BCAA)の生合成とフェニルアラニン、チロシン、トリプトファンの生合成に関連するノードも濃縮されていた(図4A、サーモンノード)。マウスネットワークでは、糞便メタボロームモジュールに糞便代謝産物のグリセロリン脂質代謝に関連するノードがいくつか含まれていた(図4A、紫色のノード)。糞便中の1-(1-enyl-palmitoyl)-2-linoleoyl-GPC (P-16:0/18:2)∗、1-(1-enyl-palmitoyl)-2-palmitoyl-GPC (P-16:0/16:0)∗、1-(1-enyl-palmitoyl)-2-arachidonoyl-GPC (P-16:0/20: およびミオイノシトール(図4A、赤文字)も同様に、KD後のレシピエントの糞便サンプルの個々のメタボローム解析において、KD前の対照と比較して異なる発現量として同定された(表S5B)。マウスのメタゲノミクスモジュールは、海馬遺伝子の8つのトランスクリプトームモジュールに直接リンクされ、1つの前頭皮質モジュールに間接的にリンクされた(図4A下、「トランスクリプトーム」セクション)。海馬のトランスクリプトームモジュールは、神経成長因子刺激に対する細胞応答、Wntシグナル伝達経路とミトコンドリア分裂の制御、ニューロンの移動と生成、アミノ酸飢餓に対する細胞応答に関連するノードに富んでいた、 長鎖脂肪アシル-CoA代謝過程、グリコシルホスファチジルイノシトール(GPI)アンカー生合成過程、GPIアンカー代謝過程と糖脂質生合成過程、テロメラーゼRNAのカハール体への局在制御。前頭皮質の転写産物は、ノッチ受容体標的の転写の正の制御に関連するノードに富んでいた(図4A、右下)。このことは、これらの特定の生物学的プロセスが、ネットワークで同定された微生物の機能的特徴と最も密接に関連していることを示唆している。転写産物ノードには、KD前の対照マウスと比較してKD後のレシピエントマウスで発現が異なるとして、個々のトランスクリプトーム解析で同様に同定された38の海馬遺伝子が含まれていた(図4A、赤文字)。メタゲノムモジュールと海馬の転写産物間の直接的なつながりの数が多いことから、KD後のレシピエントマウスでは、KD前の対照マウスと比較して、腸内マイクロバイオームが前頭皮質よりも海馬に対してより大きな調節的役割を示す可能性が示唆される。特に興味深いのは、マイクロバイオームによって制御されているグリセロリン脂質代謝に関連する糞便代謝産物63と、神経成長因子刺激に対する細胞応答、Wntシグナル伝達、ニューロン移動に濃縮された海馬転写モジュールとの間接的な関連である、 神経成長因子刺激に対する細胞応答、Wntシグナル伝達、ニューロン移動、アミノ酸飢餓に対する細胞応答、発作感受性に関与するGPIアンカー生合成および代謝過程、64,65,66,67,68、同じく発作感受性に関与するNotch受容体標的経路の転写に富んでいる前頭皮質の転写モジュール。 67,68
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図4. マルチオミクスネットワーク解析により、海馬転写産物の差次的発現に関連する主要な微生物ゲノム経路と微生物によって調節された代謝産物が同定された。
(A)ヒトのドナーの糞便メタゲノミクスとメタボロミクス(上)とマウスのレシピエントの糞便メタゲノミクス、糞便メタボロミクス、血清メタボロミクス、海馬トランスクリプトミクス、前頭皮質トランスクリプトミクスのデータセット(下)から構築された共起ネットワークと重み付けされたキードライバー。赤文字は、KD後とKD前とで制御が異なる(p < 0.05)パスウェイ、代謝物、遺伝子を示す(n = 10/条件、各レシピエントnは5~6匹のマウスの平均)。
(B)マウスの海馬および前頭皮質DEGにマップされるてんかんGWAS遺伝子トップ。
微生物メタゲノムおよびメタボロミクスの特徴と共起する海馬および前頭皮質の転写産物がヒトてんかんに関与しているかどうかについての洞察を得るために、てんかんゲノムワイド関連研究(GWAS)から同定された一塩基多型を、てんかん関連遺伝子を表す海馬および前頭皮質スプライシング量的形質座位および発現量的形質座位を用いて遺伝子にマップした。次に、これらのヒト遺伝子のマウスオルソログを海馬および前頭皮質のトランスクリプトーム結果と比較し、ヒトてんかんの遺伝的リスクに関与しているKD後レシピエントとKD前レシピエントのDEGを同定した。てんかんGWASでは海馬のDEGが統計学的に有意に濃縮された(p = 0.003)が、前頭皮質のDEGはてんかんGWASでは有意に濃縮されなかった(p = 0.26)(図4B)。これらの結果は、海馬遺伝子発現における微生物の変化が、KD前の対照マウスと比較してKD後のレシピエントマウスで見られた、微生物に依存した発作抵抗性の増加に寄与している可能性を示唆している。共起ネットワークから、7つの海馬DEGがてんかんGWASの結果と関連していた: cAMP応答エレメント結合タンパク質をコードするAtf4、TFIID転写開始因子の9bサブユニットをコードするTaf9b、脳のNa-ATPaseとK-ATPaseに結合することでシナプス伝達を制御するセリン・スレオニンキナーゼをコードするPxk、転写抑制因子をコードするRprd2; イオン平衡を制御するGタンパク質αサブユニットをコードするGnaz、細胞分裂に重要なクロマチンリモデリング複合体のサブユニットをコードするCfdp1、神経系での機能が未知の核小体タンパク質をコードするMro。全体として、海馬および前頭皮質DEGsにマッピングされたてんかんGWASとともに、ヒトドナーおよびマウスレシピエントデータセットのマルチオミクス解析により、6-Hz発作に対する微生物誘導性防御を示すマウスにおいて、特定の海馬遺伝子の発現変化に寄与すると考えられる主要な微生物ゲノム経路および微生物によって調節された代謝産物が同定された。
考察
本研究は、難治性てんかんの小児を対象とした治療研究と、gnotobioticマウスを用いた機能試験から、臨床的KDレジメンが腸内細菌叢の機能を変化させ、発作予防に寄与する可能性があることを証明するものである。われわれは、難治性てんかんの小児10人を対象に、古典的なKDレジメンを開始する直前と開始後約1ヵ月に、マイクロバイオームの組成と機能を評価した。この患者コホートは、難治性てんかんのタイプや基礎原因、炭水化物やタンパク質に対する脂肪の割合、摂取したKDの具体的な栄養組成において、臨床実践に準じた不均一なものであった(表S1A)。このことは、現在の抗てんかん薬に抵抗するてんかんの多様性と、小児の難治性てんかんを治療するために行われるKDの介入の幅の広さを浮き彫りにしている。この異質性と一致して、参加者はベースライン時およびKD治療に対する反応において糞便微生物叢の組成が大きく異なることが観察された。これは、てんかんのKD治療に関する先行研究で、KDに反応して腸内細菌叢が変化することが報告されているのとは対照的である。しかし、今回の結果は、影響を受ける特定の微生物分類群には研究間でほとんど一貫性がないという知見を支持するものである69。
組成にばらつきがあるにもかかわらず、KD治療によって腸内細菌叢の機能的特徴が研究参加者間で共有された証拠が観察された。このことは、系統的に関連性のない種が遺伝学的にコードされた同じ生物学的活性を示すことがあるという、微生物の機能的冗長性と一致する16。脂肪酸β酸化、2-メチルシトレートサイクル、グリコール代謝、およびプロリン生合成に関連する微生物遺伝子は、KD治療後のてんかん患者の腸内細菌叢において、治療前の対照群と比較して、より高度に発現していた。嫌気性環境における選択的な微生物によるβ-酸化は、飽和および不飽和脂肪酸がアセチル-CoAに酸化されることにより、食事からの脂肪酸をエネルギー源として利用することを可能にする70。β-食餌性奇数鎖脂肪酸の酸化は、さらにプロピオン酸-CoAを生成するが、これは細胞にとって有毒であるため、メチルシトレートサイクルによって、微生物はプロピオン酸-CoAをさらにピルビン酸とコハク酸に異化することができる71。グリコール(グリコール酸およびグリオキシル酸を含む)代謝によって、微生物は脂肪酸酸化からの生成物を糖新生の燃料として利用することができる72。KD後のサンプルにおいてこれらの経路に関連する遺伝子の発現が高いことから、KDによって腸内細菌叢が形成され、脂肪が豊富で糖質が制限された条件下で脂肪を消化し、糖質を合成する微生物が豊富になることが示唆される。これらのメタゲノム学的特徴は、標準食を与えたGFマウスに移植しても維持されたことから、非ケト原性食餌条件下でも原始微生物が維持されていることが示唆された。
KD療法は、アミノ酸、糖酸、ヒドロキシ脂肪酸、胆汁酸、その他の脂肪酸誘導体のサブセットを含む脂質およびアミノ酸代謝の変化を誘発した。特に、プロリンの前駆体であるグルタミン酸とオルニチンが有意に減少しており、これはプロリン生合成経路において観察されたメタゲノム上の変化と一致している可能性がある。これらの変化は、KDを摂取させたマウスでも同様にみられ、微生物叢の枯渇によって変化したことから、ヒトのコホートでは、臨床的KDに対する反応が腸内細菌叢に依存していることが示唆された。パルミトオレイルカルニチン(C16:1)の増加も、KD食餌マウスおよびKD後のヒト試料で、他の数種の脂質とともに、微生物によって調節された。
注目すべきは、ヒトドナーでみられた個々の代謝物の変化は、標準的な餌を与えたGFマウスにマイクロバイオームを移植しても再現されなかったことである。しかし、いくつかの経路レベルのメタボローム変化は、ヒトドナーとマウスレシピエントの間で一致していた。すなわち、メチオニン、グリシン、セリン、およびベタインの代謝に関連する代謝物が、ヒトドナーおよび微生物レシピエントマウスのKD後の条件下で変化した。メチオニン代謝では、ホモシステイン、アデノシン、システイン、α-ケト酪酸が産生され、これらはプロピオニル-CoAおよびスクシニル-CoAに変換されることで糖新生経路に導かれる。グリセリンから合成されたセリンは、ホモシステインサイクルを介してグリシン(およびシステイン)を生成するために使用され、微生物によってピルビン酸またはグリオキシル酸に変換される。ベタインは、食事由来またはコリンから合成され、腸内細菌叢によって代謝され74、メチオニン代謝に関与するものを含むトランスメチル化反応においてメチル供与体として機能する。KDと発作予防との関連性は不明であるが、末梢および中枢のアミノ酸代謝の変化が、KDの抗けいれん作用の媒介に広く関与している75。このことは、非ケトン原性条件下で維持されたマウスに、臨床的KD誘発腸内細菌を移植することで、ドナーであるヒトのサンプルで見られたものとは異なるが、機能的には類似した分子出力が得られる可能性を示唆している。
KD治療後に採取したヒト糞便サンプルをマウスに接種すると、KD治療前のベースライン微生物叢を投与した対照群と比較して、KD治療後のすべてのドナー条件下で6-Hz発作に対する抵抗性が付与されることが観察された。臨床的KDの実施1ヵ月後の臨床医のメモに示された、食事療法に対する患者の反応性との相関は認められなかった。これは、KD治療に反応するまでの期間や患者のピークKD比に個人差があることから、親の報告に基づくこの評価基準の信頼性が低いことや、評価の横断的な性質によるものと考えられる。この結果は、KD反応性の宿主決定因子の重要性を強調するものであり、その一部はKD関連微生物叢の有益な影響を覆い隠したり、ブロックしたりする可能性がある。本研究に含まれる多くの患者は難治性てんかんの遺伝的基盤を示しており、その一部はKD関連腸内細菌叢の機能的ゲノム変化にエピスタティックである可能性がある。KDに対する反応性を修飾または予測する腸内細菌叢の潜在的役割を研究するためには、異なるタイプのてんかんや発作の病型を細分化し、健常対照群との比較を行う大規模なヒト研究が必要である。
ヒトのKDに関連したマイクロバイオームをマウスに移植したところ、マイクロバイオーム依存的に発作防御能が上昇し、脳のトランスクリプトーム変化と関連していることが明らかになった。海馬と前頭皮質では、KD前の微生物でコロニー形成されたマウスと比較して、(1)RNAプロセシング、転写制御、翻訳、(2)TORC1シグナル伝達と細胞周期、(3)酸化的リン酸化と細胞ストレス応答に関連する転写産物の濃縮が認められた。TORC1は、栄養とエネルギーを感知する主要なセリン・スレオニンキナーゼ複合体で、転写、翻訳、オートファジーのコアプロセスを調整することにより、細胞の成長と分化を制御している。TORC1シグナリングの異常な制御は、多くのてんかんに関与しており、治療の標的となっている。酸化的リン酸化は、副産物として活性酸素種を生成し、逆行性グルタミン酸作動性神経伝達物質である一酸化窒素によって制御される、栄養素からの細胞エネルギー代謝の中心的プロセスである79。動物モデルでは、酸化的ストレスに関連した神経細胞死80のために発作活動中に上昇し、てんかん発生にさらに寄与する可能性がある57。KDは抗酸化酵素活性を促進することで酸化ストレスを軽減すると報告されている81。全体として、これらの結果は、KDに関連するヒト腸内細菌叢が脳の転写経路を変化させ、マウスの6Hz発作からの保護に寄与する可能性を示唆している。
ドナーであるヒトとレシピエントであるマウスのマルチオミクスデータセットの統合により、メタゲノム経路、糞便代謝産物、海馬転写産物間のネットワーク関連性が明らかになり、これらが微生物群に依存した発作防御の増加に寄与している可能性が示唆された。ヒトとマウスの共起ネットワークは、アデニンとアデノシンのサルベージ、dTDP-L-ラムノース生合成、葉酸変換、L-バリン生合成、preQ0生合成、および硫酸化分解に関連する共有メタゲノム経路ノードによって連結されていた。dTDP-L-ラムノース生合成のキードライバーとL-バリン生合成、アデニンとアデノシンのサルベージのノードが共有され、ニューロンの生成と移動、アミノ酸飢餓に対する細胞応答、Wntシグナル伝達とミトコンドリア分裂の制御に関連する海馬の転写モジュールとリンクしていた。L-ラムノースの異化は、好気的条件下ではL-ラクトアルデヒドを、嫌気的条件下ではジヒドロキシアセトンリン酸を産生する。両者はさらに、BCAA合成の主要な前駆体であり、トリカルボン酸(TCA)サイクルのインプットであるピルビン酸に異化される82,83。さらに、ヒトのドナーネットワークでは、アデニンとアデノシンのサルベージに関連する共有ノードがBCAA生合成に関連し、糞便メタボロームモジュールはBCAA生合成に富んでいた。BCAAは、モノアミン伝達物質の合成に必要な前駆体の脳内輸入を調節している62,84,85。BCAAはまた、グルタミン酸対GABAの合成のための窒素供与体としても機能し、発作感受性の重要な決定因子である興奮と抑制のシナプスバランスを調節している61。さらに、てんかんリスク遺伝子を共起ネットワークにマッピングしたところ、7つの海馬ノードがてんかんと関連していることが同定された。BCAA誘導体はGタンパク質のリン酸化を促進することが報告されており、GPCRを介した神経細胞シグナル伝達の異常はてんかん感受性に関与する可能性がある88,89。以上のことから、小児難治性てんかんの治療に用いられる臨床的KDレジメンは、小児マイクロバイオームの機能変化と関連しており、マウスへの移植により脳機能とてんかん発作感受性が変化することが明らかになった。ヒトのKDに関連するマイクロバイオームが腸-脳軸を介してシグナルを伝達し、発作リスクを修飾するメカニズムを明らかにし、KD治療の有効性を高め、食事の副作用を軽減し、臨床導入を容易にするマイクロバイオームに基づく介入を同定する可能性をさらに評価するために、さらなる研究が必要である。
研究の限界
我々の研究デザインは、患者サンプルサイズ(てんかん患児10例)よりも実験再現性(患者サンプルあたりマウス13~15匹)を優先した。各患者の微生物叢を内部制御することで、難治性てんかんに典型的にみられる病因病理のばらつきを反映した、小規模で不均一な患者コホートにおけるKD反応を評価できると考えた。このことが、KDに対する腸内細菌叢の分類学的応答が、機能的特徴は共通であるにもかかわらず、共有されていないという我々の発見につながったと思われる。
25,26,90しかし、レシピエントとドナーの微生物叢の不一致は、ヒトの状態に対するgnotobioticマウスでの知見の関連性に疑問を投げかけるものである。この問題を軽減するために、我々はKD後とKD前の条件下で差があり、ヒトのドナーとマウスのレシピエント間で共通する特徴に焦点を絞った。しかしながら、微生物叢移植の手法のアーチファクトが、マウス実験で観察された違いに寄与している可能性があることは認める。それにもかかわらず、観察された結果は、腸内細菌叢の機能の違いが発作感受性を制御するという原理を証明する重要なものとなった。
われわれは、KD前の対照群と比較してKD後のすべてのマウスレシピエント集団に共通する、発作閾値を上昇させる特異的な微生物群依存性メカニズムが存在するという主要な仮定を立てた。我々の解析では、微生物に依存したメカニズムが複数存在し、それぞれが6Hzの発作に対する抵抗性をもたらすという可能性は考慮されていない。ヒト被験者および/またはマウスレシピエントの亜分類を含む拡大研究が、この可能性に対処するのに役立つであろう。
患者の不均一性、サンプルサイズの小ささ、様々なKDレジメン、微生物叢移植アプローチの限界、異種間および食餌比較(すなわち、ヒトはKD、マウスは標準食)、およびデータ解析の仮定を考慮し、我々のオミックス解析は、パスウェイレベルのシグネチャーに焦点を当て、有意差の統計的閾値(非調整p<0.05)を甘くして実施した。その結果、食事療法を受けているてんかん児の微生物遺伝子と代謝産物において、一貫したKD依存性の変化が検出され、これらのパラメータを使用した場合、ヒトのドナーマウスと微生物受容マウスに共通するKD依存性および微生物依存性の変化が観察された。この結果は、既存の前臨床研究を拡張し、臨床的なKD治療が難治性てんかん児の腸内細菌叢の機能を形成し、発作感受性を因果的に修飾する可能性があるという証拠を提供するものである。
STAR★方法
主要リソース表
試薬またはリソースソースの識別子
生物学的サンプル
ヒト被験者の便サンプル この研究は該当しない
化学物質、ペプチド、組換えタンパク質
塩酸バンコマイシン Chem-Impex International 00315
ネオマイシン三硫酸塩水和物 Sigma-Aldrich N1876
メトロニダゾール Sigma-Aldrich M1547
アンピシリンナトリウム塩 Sigma-Aldrich A9518
TURBO DNase インビトロジェン AM2238
超純水 ThermoFisher 10977015
1x PBS ThermoFisher 10010023
SYBR Green ThermoFisher 4344463
塩酸テトラカイン点眼液 USP 0.5% Oceanside Pharmaceuticals 68682-920-64
重要な市販アッセイ
DNeasy PowerSoilキット Qiagen 12888-50
QIAamp Fast DNA Stool Mini Kit(図 S2E 参照) Qiagen 51604
Qiaquick PCR 精製キット Qiagen 28104
PureLink RNA Mini Kit Invitrogen 12183018A
QuantSeq FWD' mRNA-Seq ライブラリー調製キット Lexogen N/A
寄託データ
16S rRNA遺伝子シーケンス NCBI Sequence Read Archive (SRA) PRJNA1032744
メタゲノムシーケンス NCBI Sequence Read Archive (SRA) PRJNA1032744
非標的メタボロミクス https://data.mendeley.com/ https://doi.org/10.17632/djzyzdbz3z.1
海馬トランスクリプトミクス Gene Expression Omnibus (GEO) GSE225682
前頭皮質トランスクリプトミクス Gene Expression Omnibus (GEO) GSE225682
マルチオミクス統合 WGCNA モジュール GitHub https://github.com/smha118/keto_diet_pediatric_epilepsy
マルチオミクス統合 WGCNA モジュール Zenodo https://doi.org/10.5281/zenodo.10059754
補足生データ https://data.mendeley.com/ https://doi.org/10.17632/5jnk32tfbc.1
実験モデル 生物/株
スイス・ウェブスター タコニック・ファーム TAC-SW
オリゴヌクレオチド
デジタルPCR用フォワードプライマー: UN00F2, 5′- CAGCMGCCGCGGTAA-3 Integrated DNA Technologies N/A
qPCR用フォワードプライマー UniF340、5'-ACTCCTACGGGGAGCAGCAGT-3'(図S2E参照)Integrated DNA Technologies N/A
qPCR用リバースプライマー UniR514、5'-ATTACCGCGGCTGCTGGC-3'(図S2E参照) Integrated DNA Technologies N/A
デジタルPCR用リバースプライマー UN00R0, 5′-GGACTACHVGGGTWTCTAAT-3′ [1, 3]) Integrated DNA Technologies N/A
ソフトウェアとアルゴリズム
Deblur https://github.com/biocore/deblur Amir et al.91
QIIME2-2022.2 https://qiime2.org/ Bolyen et al.92
FastQC v. 0.11.9 https://github.com/s-andrews/FastQC/releases/tag/v0.11.9 Andrews93
ANCOM https://github.com/FrederickHuangLin/ANCOM-Code-Archive Mandal et al.94
Trimmomatic https://github.com/timflutre/trimmomatic Bolger et al.95
HISAT2 http://daehwankimlab.github.io/hisat2/ Kim et al.96
HTSeq-count https://github.com/htseq/htseq Anders et al.97
DESeq2 https://bioconductor.org/packages/release/bioc/html/DESeq2.html Love et al.98
RStudio 2022.07.2 https://www.r-project.org/ RStudio Team99
bioBakery https://github.com/biobakery/biobakery McIver et al.100
HUMAnN 3.0 https://github.com/biobakery/humann Beghini et al.101
MetaPhlAn 3.0 https://github.com/biobakery/MetaPhlAn Beghini et al.101
MaAsLin 2.0 https://github.com/biobakery/biobakery/wiki/maaslin2 Mallick et al.102
file2meco https://github.com/ChiLiubio/file2meco Liu et al.103
MetaboAnalyst 5.0 https://www.metaboanalyst.ca/home.xhtml Pang et al.39
Cytoscape https://cytoscape.org/ Shannon et al.104
EnrichR https://maayanlab.cloud/Enrichr/ Chenら; KuleshovらおよびXieら105,106,107
STRING https://string-db.org/ Szklarczykら.108
WGCNA https://horvath.genetics.ucla.edu/html/CoexpressionNetwork/Rpackages/WGCNA/ Langfelder and Horvath109
MMVEC https://github.com/biocore/mmvec Morton et al.58
wKDA http://mergeomics.research.idre.ucla.edu/ Ding et al.59
BlueBee Lexogen 1864011
Prism ソフトウェア GraphPad v 8.2.1
その他
「ブリーダーチャウ ラボダイエット 5K52
コントロール飼料 Harlan Teklad TD.150300
4200 タペステーションシステム Agilent G2991AA
QX200 ドロップレットジェネレーター Bio-Rad Laboratories 1864002
ECT ユニット Ugo Basile 57800
リソースの有無
連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、リード・コンタクトの Elaine Hsiao (ehsiao@g.ucla.edu)までご連絡ください。
材料の入手可能性
本試験では新規の試薬は使用していない。
データおよびコードの利用可能性
16S rRNA 遺伝子配列決定、メタゲノムプロファイリング、および関連メタデータのデータは表 S2A、S2B、S3A、S3C に示し、NCBI Sequence Read Archive (SRA) リポジトリ(SRA: PRJNA1032744)からオンラインで入手可能である。メタボロームデータは表S5A-S5Dに示し、Mendeley data: https://doi.org/10.17632/djzyzdbz3z.1 からオンラインで入手できる。トランスクリプトームデータは表S7AおよびS7Bに示し、Gene Expression Omnibus(GEO)リポジトリを通じてオンラインで入手可能であり、識別番号はGEO: GSE225682。図1、2、3、4、およびS1-S6の補足生データは、Mendeley Data: https://doi.org/10.17632/5jnk32tfbc.1。
DOIは主要リソース表に記載されており、すべてのオリジナルコードは以下に寄託されている: GitHub:https://github.com/smha118/keto_diet_pediatric_epilepsy、Zenodo:https://doi.org/10.5281/zenodo.10059754。
本論文で報告されたデータを再分析するために必要な追加情報は、要求があれば主担当者から入手可能である。
実験モデルと研究参加者の詳細
被験者
本研究はUCLAのInstitutional Review Board(IRBプロトコル#15-000453)の承認を得た。
UCLAマテル小児病院のケトジェニックダイエットプログラムと共同で、小児難治性てんかん患者をスクリーニングし、登録した。研究基準を満たした前向き参加者には、食事療法開始前の来院の1~2週間前に、本研究の詳細に関する情報が電話と電子メールで提供された。登録に先立ち、すべての参加者とその保護者から、インフォームド・コンセントの署名が、ダイエット開始前の予約時にプログラムの臨床コーディネーターに提出された。対象者は、発作の病型や既往歴が多様であった。包含基準:UCLAの古典的4:1 KDプログラムに登録されている、難治性てんかんを有する1~10歳の小児、性別、民族、AEDへの曝露歴、発作病型を問わない。除外基準:登録前4週間以内の抗生物質またはプロバイオティクスの使用、消化器疾患、免疫疾患、代謝疾患の既往。10名の参加者からそれぞれ2検体の便を採取した。最初のサンプルはKD治療開始前1日以内に採取され(pre-KD)、2番目のサンプルは臨床的KDを1ヵ月間継続した後に採取された(post-KD)。医療記録からの臨床メタデータは、共有される前にコード化され、識別子が除去された。このデータには、参加者の人口統計データ、病歴、AED曝露歴、本研究中に服用した追加薬物、検査室での血糖値および血中ケトン体濃度、発作の重症度、発作頻度、発作の病型、および食事療法が含まれた(表S1A)。
ヒトの便サンプル採取
入院患者の便サンプル採取については、試験参加者がダイエット開始前の診察時に入院すると、コード化された便採取キットと滅菌検体容器が渡された。便サンプルは、臨床的KD治療を開始する前(pre-KD)1日以内に新鮮な状態で採取された。新鮮な検便は、短期保存と輸送のために直ちにドライアイスに置かれ、長期保存のために-80℃で新鮮凍結された。KD後の便サンプルは、研究参加者が1ヵ月後の追跡調査のために再来院した際に、上記と同様の方法で採取された。KD後の便サンプルの外来採取については、病院のパンデミック政策により必要であったため、非特定便サンプル採取キットと滅菌検体カップが、あらかじめラベルを貼った返送用箱とともに患者と保護者に提供された。KD治療1ヵ月後、便サンプルは滅菌検体カップに採取され、直ちに自宅の冷凍庫に入れられ、翌日、(1)ドライアイスでUCLAに一晩かけて返送されるか、(2)1ヵ月後のフォローアップ予約時に患者と一緒に持参された。新鮮な凍結糞便サンプルは液体窒素下でホモジナイズされ、移植、メタゲノム、およびメタボローム研究に使用するため、嫌気性バルチ管で滅菌保存してサンプルあたり3-500mgのアリコートを作成した。
マウス
6-8週齢の野生型無菌スイス・ウェブスター雌マウス(Taconic Farms)をUCLAのCenter for Health Sciences Barrier Facilityで飼育した。飼育動物には''ブリーダー''チョウ(Lab Diets 5K52)を与えた。実験動物にはビタミン・ミネラル適合対照飼料(Harlan Teklad TD.150300)を与えた。幼若マウスは、ヒトドナー集団の年齢範囲(10歳未満)を模倣するために使用された。すべての動物実験はUCLA動物飼育使用委員会の承認を得た。
方法の詳細
16S rRNA遺伝子の配列決定と解析
Qiagen PowerSoil Kitを用いてヒトまたはマウスの糞便サンプルから細菌ゲノムDNAを抽出した。ヒトサンプルの場合、nは1人のドナーサンプルを示す。マウスサンプルの場合、nは、微生物叢組成への同居の影響を排除するため、1ケージあたり2~3匹のマウスを含む独立したケージを反映する。シークエンシングライブラリーは、Caproso et al., 2011.に従って作成された110。16S rRNA遺伝子のV4領域のPCR増幅は、個別にバーコード化されたユニバーサルプライマーと30 ngの抽出ゲノムDNAを用いて、3連で実行された。PCR産物の3倍体をプールし、Qiaquick PCR purification kit(Qiagen)を用いて精製した。サンプルはLaragen社でIllumina MiSeqプラットフォームとペアエンドシーケンス用2 x 250bp reagent kitを用いてシーケンスした。アンプリコン配列バリアント(ASV)は、SILVA138データベースとの99%の配列類似性に基づくクローズド・リファレンス・クラスタリングによって選択した。QIIME2 2022.2.92,94を使用して、分類の割り当て、希少化、および存在量の差の検定を行った。ANCOM解析は、QIIME2から生成されたフィーチャーテーブル出力を使用して行った。フィーチャーテーブルは、標準的な ANCOM 解析の前に、すべてのゼロ値に対応するために add-pseudocount imputation を実施し、その後対数変換を行うという、QIIME2 が推奨する標準的な方法を用いて作成した。
糞便ショットガンメタゲノミクス
ヒトまたはマウスの糞便サンプルから、Qiagen PowerSoil Kitを用いて細菌ゲノムDNAを抽出した。1ngのDNAをNextera XT DNA Library Preparation Kit(Illumina)を用いてDNAライブラリーを調製し、ゲノムDNAをIllumina Nextera XT断片化酵素で断片化した。12サイクルのPCR増幅の前に、IDT Unique Dual Indexesを各サンプルに添加した。AMpure magnetic Beads(Beckman Coulter)を用いてDNAライブラリーを精製し、QIAGEN EBバッファーで溶出した。Qubit 4蛍光光度計とQubit dsDNA HS Assay KitをDNAライブラリーの定量に使用した。ライブラリーは、CosmosIDを用いて、Illumina HiSeq 4000プラットフォームで2x150bp、6Mリードデプスでシーケンスした。HUMAnN 3.0101とMetaCycデータベースを用いてメタゲノムデータを解析し、遺伝子ファミリーとパスウェイのアバンダンスをプロファイリングした。MaAsLin 2.0102を使用して、KD前とKD後の有意なパスウェイの関連を非調整p値0.1のカットオフで評価した。ヒートマップはR用のpheatmap v1.0.12パッケージを用いて作成した。
ヒトドナーの糞便微生物叢の移植
採取したヒト便サンプルを移植研究用に調製するために、凍結便サンプルを滅菌した頑丈なホイルで覆われた乳鉢と乳棒で液体窒素気流下で粉末に粉砕し、チューブあたり500mgずつ2mLスクリューキャップチューブに分注し、-80℃で凍結した。
500mgのヒト便サンプルをコイ嫌気チャンバーに入れ、あらかじめ還元した1xPBS+0.05%L-システインに懸濁した。サンプルは滅菌ホウケイ酸ガラスビーズを用いてホモジナイズし、100μmのフィルターに通した。GFスイス・ウェブスターマウスに200uLの糞便懸濁液を経口投与した。余剰の糞便懸濁液は再懸濁し、あらかじめ減菌した1xPBS+0.05%L-システイン+15%グリセロール中に-80℃で保存した。糞便濾液の投与は、200uLの糞便濾液を経口投与する前に、糞便懸濁液を滅菌した0.2μmのフィルターに通した。
6-Hz精神運動発作アッセイ
6-Hz精神運動発作アッセイ試験はSamalaら111 に従って行った。刺激の15分前に0.5%塩酸テトラカイン点眼液を各マウスの角膜に1滴(約50μl)滴下した。電極ゲル(Parker Signagel)を角膜電極に直接薄く塗布し、各試行前に再塗布した。定電流電流装置(ECT Unit 57800, Ugo Basile)を用いて、持続時間3秒、パルス幅0.2ミリ秒、周波数6パルス/秒で角膜電極に電流を流した。発作感受性の指標として、CC50(マウス集団の50%に発作を誘発するのに必要な電流のミリアンペア強度)を測定した。パイロット実験では、6~8週齢のSPF野生型スイス・ウェブスターマウスのCC50として28mAを同定した。各マウスは1回のみ発作試験を行ったため、各コホートで十分な検出力を得るためには、少なくともn > 13匹のマウスを使用した。各被験コホートのCC50を決定するために、コホートごとに最初のマウスに28mAの電流を投与し、その後2mA間隔で段階的に固定的に増減させた。刺激中はマウスを手動で拘束し、行動観察のために新しいケージに放した。転倒、尾背屈(Straub tail)、前肢クローヌス、眼球・口輪筋の痙攣、行動寛解の定量的測定は手動でスコア化した。各行動パラメータについて、KD前とKD後の微生物叢の状態間で、28mA以上の発作中の発生率に相関は認められなかったことから、発作の発現や形態よりも、発作発生率に対する微生物叢の主な影響が示唆された。探索までの潜時(実験マウスが観察ケージに放たれた時(角膜刺激後)から最初の側方移動までの経過時間)は、電子タイマーを用いて手動でスコア化した。発作閾値(CC50)は、実験群ごとの電流ステップの平均対数間隔を用いて、既述のように決定した。CC50の算出に使用したデータは、各電流強度に対する探索までの潜時としても表示され、nは発作の結果にかかわらず、群ごとの生物学的複製数の合計を表す。
抗生物質投与
バンコマイシン(50mg/kg)、ネオマイシン(100mg/kg)、およびメトロニダゾール(100mg/kg)の溶液を、抗生物質治療期間中、毎日12時間ごとに移植マウスに経口投与した。アンピシリン(1 mg/mL)は飲水で自由摂取させた。模擬治療では、同量の1x PBS(ビヒクル)を5日間、毎日12時間ごとにマウスに与えた。抗生物質投与マウスは無菌ケージに入れ、無菌の餌と水を与え、無菌的に扱った。糞便は毎日滅菌チューブに採取し、QIAamp Fast DNA Stool Mini Kitを用いてDNAを単離した。定量的リアルタイムPCR解析は、QuantStudio5装置(Applied Biosystems)を用い、SYBR GreenとフォワードプライマーUniF340およびリバースプライマーUniR514を用いて、以下のPCRプロトコルのもと、20uLの反応を3連で行った: 95℃で10分間、95℃で10秒間、62℃で45秒間を40サイクル。メルトカーブとCt値を評価した。図S2Eも参照。
糞便および血清メタボロミクス
以前に採取したヒトドナーの糞便サンプルは、「ヒトドナーの糞便微生物叢の移入」のセクションで説明したように分注した。マウスの糞便サンプルは、3匹のマウスを収容するケージが4つ、2匹のマウスを収容するケージが1つの、独立したケージにまたがって収容されたマウスから採取した。マウスの血清サンプルは心臓穿刺で採取し、SSTバキュテナーチューブで分離した後、-80℃で凍結した。サンプルは自動化されたMicroLab STARシステム(Hamilton Company)を用いて調製し、Metabolon, Inc.のGC/MS、LC/MS、LC/MS/MSプラットフォームで分析した。タンパク質画分は、有機水性溶媒による連続抽出で除去し、TurboVapシステム(Zymark社)を用いて濃縮し、真空乾燥した。LC/MSおよびLC-MS/MSの場合、サンプルは11種類以上の注入標準物質を含む酸性または塩基性LC適合溶媒で再構成し、Waters ACQUITY UPLCおよびThermo-Finnigan LTQ質量分析計(リニアイオントラップフロントエンドおよびフーリエ変換イオンサイクロトロン共鳴質量分析計バックエンド)で分析した。GC/MSでは、サンプルを乾燥窒素下でビストリメチルシリル-トリフルオロアセトアミドを用いて誘導体化し、電子衝撃イオン化を用いたThermo-Finnigan Trace DSQ高速走査型単一四重極質量分析計で分析した。化学物質の同定は、精製標準物質のメタボロームライブラリエントリとの比較によって行いました。各化合物について対数変換と最小観測値によるインピュテーションを行った後、ヒトの糞便、およびマウスの血清と糞便のデータについて、KD後とKD前の比較をペアのt検定で分析した。KD対CDチャウを与えたSPFまたは抗生物質処理マウスのメタボロームデータは、各化合物について対数変換し、最小観察値でインピュテーションしたものとして、Olsonら、2018から取得した。データは二元配置分散分析を用いて解析し、群間効果を検定した。P値およびq値は、二元配置分散分析の対比に基づいて計算した。主成分分析を用いて分散分布を可視化した。教師ありランダムフォレスト分析を実施し、メタボロミクス予測精度を同定しました。Metaboanalyst 5.0プラットフォーム39を使用した代謝物セット濃縮分析(MSEA)を、KD前と比較してKD後で統計的に有意に変化したヒト糞便、マウス糞便、およびマウス血清代謝物について実施した(非調整p値<0.05)。代謝物セットは、The Small Molecule Pathway Database (SMPDB)を使用して、化学サブクラスの濃縮および代謝物パスウェイの濃縮について解析された。
トランスクリプトーム解析
レシピエントマウスはコロニー形成後4日目に犠牲にした。KD前およびKD後のレシピエントマウス(コホートあたりn = 6)から海馬と前頭皮質を解剖し、直ちにTrizolに入れた。ターボDNAse処理したPureLink RNA Miniキットを用いてRNAを抽出した。RNAはTruSeq RNA Library Prep kitを用いて調製し、UCLA Neuroscience Genomics CoreによりIllumina HiSeq 4000プラットフォームを用いて2Å∼69bpペアエンドシーケンスが行われた。品質フィルタリング、トリミング、マッピングにはFastQC v0.11.5、bbduk v35.92、RSeQC v2.6.4を使用。リードはSTAR v2.5.2aを用いてUCSC Genome BrowserのアセンブリID: mm10にアライメントし、samtools v1.3を用いてインデックスを作成し、HTSeq-count v0.6.0を用いてアライメントした。差分発現解析はDESeq2 v1.24.041を用いて行った。ヒートマップはR用pheatmap v1.0.12パッケージを用いて作成した。非アジュゲートp値<0.05の差次的発現遺伝子のGOターム濃縮解析はenrichR v3.1を用いて行った。タンパク質相互作用ネットワークはSTRING v10.5を用いて作成した。ネットワークノードの機能的濃縮は、GO:生物学的プロセス、分子機能、細胞構成要素によって分類された。
マルチオミクスの統合
ヒトドナーおよびマウスレシピエントのメタボロミクスと、マウスレシピエント(海馬および前頭皮質)のRNA-seqは、各データセット内のWGCNAモジュールを構築するために使用された。メタボロミクスデータについては、まず goodSamplesGenes 関数をデフォルトパラメータで使用し、ネットワークを構築する前にサンプル間の疎な代謝物をフィルタリングした。次に、フィルタリングされたメタボロミクスおよび RNAseq データに対して標準的な WGCNA ステップが実行されました。各モジュールからモジュール固有遺伝子(ME)、または主成分の第 1 軸が計算されました。次にMEをメタデータとの相関解析の対象とした(KD前とKD後、レスポンダーと非レスポンダー)。メタデータと有意な相関(p-val <0.05)を示したモジュールは、その後の統合解析のために選択された。
すべてのオミックスデータを統合した系統的ネットワークは、異なるオミックスデータの分子間の共起確率(POC)に基づいて推論された。POCを計算するために、デフォルトのパラメータを持つMMVEC v1.0.6と呼ばれるニューラルネットベースのツールを活用した58。WGCNA解析から選択されたモジュール成分を含む生データのサブセットは、対数正規化され、サンプルIDに基づいて結合された。この結合されたデータマトリックスは、次にMMVECの入力として使用された。例えば、ドナー側では、糞便メタゲノムとメタボロミクスのモジュールが足し合わされ、レシピエント側では、メタゲノム、メタボロミクス、RNAseqの生データが結合されたマトリックスとなった。MMVECから生成されたネットワーク全体の密度が高いため、社内のpythonスクリプト(https://github.com/smha118/keto_diet_pediatric_epilepsy)を使用して、ドナーおよびレシピエント両方のネットワークの全体的な複雑さを最小化するために、POC接続の上位10%を取得した。
KD前(n=10)およびKD後(n=10)のドナーのメタゲノムおよびメタボロームサンプルと、レシピエントのKD前(n=10、各nはドナー患者サンプルあたり5匹のテクニカルレプリケートレシピエントマウスの平均を反映する])およびKD後(n=10、各nはドナー患者サンプルあたり5匹のテクニカルレプリケートレシピエントマウスの平均を反映する])のメタゲノム、KD前(n=10、 メタボローム、KD前(n = 10、各サンプルはドナー患者サンプルあたり5匹のレシピエントマウスからプール)およびKD後(n = 10、各サンプルはドナー患者サンプルあたり5匹のレシピエントマウスからプール)メタボローム、KD前(n = 10、各サンプルはドナー患者サンプルあたり6匹のレシピエントマウスからプール)およびKD後RNAseq(n = 10、各サンプルはドナー患者サンプルあたり6匹のレシピエントマウスからプール)、ならびに差次的に発現/存在する分子をMergeomics v3にシードした。 16のパイプラインとMMVECで生成された統合ネットワークを用いて、ネットワークのキードライバーを同定するための重み付けキードライバー解析(wKDA)を行った59。wKDAはχ2統計量を用いて、ランダムな偶然から予想されるよりも有意に大きなモジュール構成要素に接続されている分子を特定する。解析はヒトとマウスのネットワークを別々に行った。ケトジェニックダイエットとてんかんに関連するネットワークをさらに調べるために、i) キードライバーが関連するモジュールの数、ii) ケトジェニックダイエットまたはてんかんとの関連に基づいて、キードライバー(KD)を選択した。KDに接続された各モジュールのノードのサブセットを収集した。これらのノードは以下の優先順位で検索された。 i) それらは差次的に制御される分子の一部である ii) KDsとのPOC値。最後に、Cytoscapeを用いてネットワークを可視化した。104 ネットワークの全体的な密度を最小化するために、Mergeomicsから、それぞれのMEで最も出現率が高く、5度以上の連結性を持つ主要なドライバーを表示することにした。
海馬と前頭前野のDEGをてんかんGWASと結びつけるマーカーセット濃縮解析(MSEA)
てんかんにおける海馬と前頭皮質のDEGの潜在的な役割を評価するために、最新のてんかんGWASの要約統計量を収集した。てんかんGWASのSNPを遺伝子にマップするために、GTExバージョン8のeQTLとsQTLのデータを脳海馬と脳前頭皮質について使用した。次に、Mergeomicsパッケージ59のMSEA機能を用いて、DEGs(海馬または前頭皮質)を代表するSNPsのてんかん疾患関連p値をランダム遺伝子にマッピングされたSNPsのp値と比較し、DEGsにランダム遺伝子よりも強いてんかん関連性を示すSNPsが含まれているかどうかをχ2様統計量を用いて評価した。
定量化と統計解析
統計解析はPrism8ソフトウェアv8.2.1(GraphPad)を用いて行った。統計解析の前に、使用する適切な統計検定を決定するために、データの分布を評価した。データは平均値±SEMとして図にプロットした。図については 1B, S2B, S2F, S3B, S3E n = テクニカルレプリケート数。その他の図については、n = 生物学的複製数。データ解析から除外した試料や動物はない。パラメトリックデータセットの2つのサンプル条件間の差は、両側対のStudentのt検定を用いて解析した。ノンパラメトリックデータセットからの2つのサンプル条件間の差は、両側Wilcoxonマッチドペア符号付き順位検定を用いて解析した。1つの変数を分析する際の2群間以上の差については、Tukeyのpost hoc検定を伴う一元配置分散分析を用いた。2変数で2群以上の差については、シダックのポストホック検定を伴う二元配置分散分析を用いた。患者内解析のテクニカルレプリケート(図:1B、S2B、S2F、S3B、S3E)については、上記の検定による差を#p < 0.05、#p < 0.05、#p < 0.05、#p < 0.05、#p < 0.05、#p < 0.05 #p < 0.05; ##p < 0.01; ###p < 0.001; ####p < 0.0001。生物学的複製(他のすべての図)では、上記の検定からの差は次のように示される: ∗p<0.05;****p<0.01;****p<0.001;*****p<0.0001。有意でない差は、図中 "n.s "で示す。
謝辞
UCLA Goodman-Luskin Microbiome Center Gnotobiotics Core Facilityの技術サポートに感謝する。本研究は、UCLA Whitcome Fellowship(G.R.L.)およびNINDS grant #R01NS115537 (E.Y.H.)の支援を受けた。脳内RNA配列決定およびメタゲノム配列決定の一部は、Bloom Science社からの資金援助を受けた。いずれの資金源も、データ解析や解釈に影響を与えたり、意見を提供したりはしていない。
著者貢献
G.R.L.、S.M.H.、C.A.O.、M.B.、J.P.が実験を行い、データを解析した。B.R.とJ.H.M.が臨床研究を主導した。G.R.L.、C.A.O.、J.H.M.、X.Y.、E.Y.H.が研究をデザインした。原稿はG.R.L.とE.Y.H.が執筆した。
利益申告
本研究成果は、UCLA仮特許出願US 63/285,267の対象である。E.Y.H.はブルーム・サイエンス社と利害関係がある。
補足情報
すべての補足ファイルをダウンロードする
これは何ですか?
ダウンロード アクロバットPDFファイルのダウンロード(2MB)
資料S1. 図S1-S6
ダウンロード スプレッドシートのダウンロード(18KB)
表S1. 被験者の人口統計学的情報、臨床情報、および臨床メタデータの多変量関連。(A)本研究に参加した小児てんかん患者(n=10人)から収集した人口統計学的情報と臨床情報。KD比は摂取した炭水化物グラムに対する脂肪グラムの比を示す。KDに対する患者の反応は、KD開始1ヵ月後の親の報告と医師のメモに基づき、発作が50%以上減少した反応者を示す。Fは女性、Mは男性、ASMは抗痙攣薬、ACTHは副腎皮質刺激ホルモン、CBDはカンナビジオール、THCaはテトラヒドロカンナビノール。過去4週間以内の抗生物質投与は、KD前サンプル採取からKD後サンプル採取までの4週間以内に経腸または静脈内(i.v.)で抗生物質を投与したかどうかを示す。過去4週間以内のプロバイオティクス摂取は、KD前検体採取からKD後検体採取までの4週間以内に経口プロバイオティクスを摂取したか否かを示す。(B)収集された臨床メタデータの多変量関連検定データ
ダウンロード: スプレッドシートのダウンロード(113KB)
表S2. ヒトドナーおよびマウスレシピエント糞便サンプルの16S rRNA遺伝子配列決定OTU表。(A)ヒトドナーのKD前およびKD後の糞便サンプルのSILVA138データベースを用いた16S rRNA遺伝子シーケンス操作分類学的単位(OTU)数表を示す。(B)マウスレシピエントのKD前およびKD後の糞便サンプルについて、SILVA138データベースを用いた16s rRNA遺伝子シーケンスOTU数表を示す。
ダウンロード スプレッドシートのダウンロード(422KB)
表S3. ヒトドナーおよびマウスレシピエント糞便サンプルのメタゲノム経路相対存在量。(A)表情報は、ヒトドナーのKD前およびKD後の糞便サンプルで見つかったMetaCycメタゲノム経路の100万個あたりの数(CPM)を表示する。(B)ドナーのメタゲノム経路の統計結果(図S1Gに関連)。(C)表情報は、マウスレシピエントのKD前およびKD後の糞便サンプルで見つかったMetaCycメタゲノムパスウェイのCPMを表示する。(D)ドナーとレシピエントのメタゲノムパスウェイ統計結果(図2A関連)
ダウンロード: スプレッドシートをダウンロード(36KB)
表S4. 全マウスコホートの6-Hz精神運動発作試験データ。表は、すべての6-Hz発作試験から得られた生の試験データを表示する。各行は1匹のマウスを表す。
ダウンロード スプレッドシートダウンロード (578KB)
表S5. KD前後のヒトドナー糞便およびマウスレシピエント糞便・血清サンプルからの非標的メタボロミクス。(A)ヒトドナーのKD前およびKD後の糞便サンプルから得られた、この非標的メタボロミクス研究でプロファイリングされた統計的に有意な生化学物質のヒートマップ。赤と緑の網掛けはp≤0.05を示す(赤はその比較において平均値が有意に高いことを示し、緑は有意に低いことを示す)。薄い赤と薄い緑の網掛けセルは、0.05 < p < 0.10(薄い赤はその比較で平均値が高い傾向を示し、薄い緑は低い傾向を示す)を示す。(B)マウスレシピエントのKD前およびKD後の糞便サンプルから得られた、このアンターゲットメタボロミクス研究でプロファイリングされた統計的に有意な生化学物質のヒートマップ。赤と緑の網掛けはp≤0.05を示す(赤はその比較において平均値が有意に高いことを示し、緑は有意に低いことを示す)。薄い赤と薄い緑の網掛けセルは、0.05 < p < 0.10(薄い赤はその比較で平均値が高い傾向を示し、薄い緑は低い傾向を示す)を示す。(C)マウスレシピエントのKD前およびKD後の血清サンプルから得られた、このアンターゲットメタボロミクス研究でプロファイリングされた統計的に有意な生化学物質のヒートマップ。赤と緑の網掛けはp≤0.05を示す(赤はその比較において平均値が有意に高いことを示し、緑は有意に低いことを示す)。薄い赤と薄い緑の網掛けは、0.05<p<0.10(薄い赤はその比較において平均値が高い傾向を示し、薄い緑は低い傾向を示す)を示す。(D) Olsonら12がプロファイリングした生化学物質のうち、本研究でプロファイリングしたヒト糞便生化学データセットにも含まれる統計的に有意な物質のヒートマップ。オレンジ色は、KDマウスとKDヒトの両方で同じ方向に有意であることを意味する。濃いオレンジは抗生物質投与によって変化し、マイクロバイオーム依存性を示す。赤と緑の網掛けはp≦0.05を示す(赤はその比較において平均値が有意に高いことを示し、緑は有意に低いことを示す)。薄い赤と薄い緑の網掛けは0.05 < p < 0.10(薄い赤はその比較において平均値が高い傾向にあることを示し、薄い緑は低い傾向にあることを示す)。Abx、抗生物質
ダウンロード: スプレッドシートのダウンロード(23KB)
表S6. ヒトとマウスの糞便および血清メタボロミクスのMSEA化学サブクラスおよび代謝物パスウェイ解析。(A)ヒトとマウスの糞便メタボロミクスのMSEA化学サブクラス解析(図2Dに関連)。(B)ヒト糞便とマウス糞便に共通する差次量代謝物のMSEA化学サブクラスおよび代謝物パスウェイ解析(図S5D関連)。(C) ヒトおよびマウス糞便メタボロミクスの MSEA 代謝経路解析(図 2E に関連)。(D)マウス血清メタボロミクスのMSEA化学サブクラスおよび代謝物パスウェイ解析(図S5E関連)
ダウンロード スプレッドシートのダウンロード(345KB)
表S7. KD後およびKD前レシピエントマウスからの海馬および前頭皮質相対遺伝子発現。(A)KD前(n = 10)およびKD後(n = 10)の海馬サンプルについて、Deseq2から得られた平均遺伝子数をZスコアで正規化したもの。(B)KD前(n = 10)とKD後(n = 10)の前頭皮質サンプルのDeseq2によるZスコア正規化平均遺伝子数
ダウンロード スプレッドシートのダウンロード(38KB)
表S8. WCGNAモジュールデータとヒトのドナーとマウスのレシピエントのネットワーク接続。(A)ヒトドナーネットワークとマウスレシピエントネットワークのノードのメタデータ。(B)すべてのヒトのドナーとマウスのレシピエントのノードのネットワーク接続のリスト(図4Aに関連)。
ダウンロード: アクロバットPDFファイルのダウンロード(7MB)
ドキュメントS2. 論文と補足情報。
参考文献
1
G. Coppola, P. Veggiotti, R. Cusmai, S. Bertoli, S. Cardinali, C. Dionisi-Vici, M. Elia, M.L. Lispi, C. Sarnelli, A. Tagliabue, et al.
難治性てんかんの小児、青年、若年成人におけるケトン食: イタリアの多施設共同研究
てんかん研究, 48 (2002), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
2
J.M. Freeman、E.P. Vining、D.J. Pillas、P.L. Pyzik、J.C. Casey、L.M. Kelly
ケトジェニック食の有効性-1998年: 150人の小児における介入の前向き評価
小児科、102(1998)、1358-1363頁
スコープで見るGoogle Scholar
3
H.C. Kang、Y.J. Kim、D.W. Kim、H.D. Kim
難治性小児てんかんに対するケトジェニック食の有効性と安全性: 韓国の多施設共同経験
Epilepsia, 46 (2005), pp.272-279
CrossRefGoogle Scholar
4
E.G.ニール、H.チャフ、R.H.シュワルツ、M.S.ローソン、N.エドワーズ、G.フィッツシモンズ、A.ホイットニー、J.H.クロス
小児てんかん治療のためのケトジェニック食:無作為化比較試験
Lancet Neurol, 7 (2008), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
5
E.H. Kossoff, B.A. Zupec-Kania, S. Auvin, K.R. Ballaban-Gil, A.G. Christina Bergqvist, R. Blackford, J.R. Buchhalter, R.H. Caraballo, J.H. Cross, M.G. Dahlin, et al.
てんかんの食事療法を受けている小児の最適な臨床管理: 国際ケトジェニック・ダイエット研究グループによる最新の勧告
エピレプシア・オープン, 3 (2018), 175-192頁
CrossRefScopusで見るGoogle Scholarで見る
6
C. ヘミングウェイ、J.M.フリーマン、D.J.ピラス、P.L.ピジック
ケトン食: 前向きに登録された150人の小児の3〜6年間の追跡調査
小児科, 108 (2001), 898-905頁
スコープで見るGoogle Scholar
7
R.K. Singh, H.W. Chang, D. Yan, K.M. Lee, D. Ucmak, K. Wong, M. Abrouk, B. Farahnik, M. Nakamura, T.H. Zhu, et al.
食事が腸内細菌叢に及ぼす影響とヒトの健康への影響
J. Transl. Med., 15 (2017), Article 73
グーグル・スカラー
8
J.L.ソネンブルグ、F.ベッケド
ヒト代謝の調節因子としての食事-微生物叢相互作用
ネイチャー, 535 (2016), 56-64頁
CrossRefScopusで表示Google Scholar
9
M. リンデフェルト、A.エング、H.ダルバン、A.ビャークナー、C.K.ゼッターストレム、T.アランダー、B.アンダーソン、E.ボーレンスタイン、M.ダーリン、S.プラスト-ニールセン
ケトン食は重症てんかん児の腸内細菌叢の分類学的および機能的組成に影響を及ぼす
NPJ Biofilms Microbiomes, 5 (2019), p. 5
Scopusで見るGoogle Scholar
10
G. Xie, Q. Zhou, C.Z. Qiu, W.K. Dai, H.P. Wang, Y.H. Li, J.X. Liao, X.G. Lu, S.F. Lin, J.H. Ye, et al.
ケトン食は難治性てんかん乳児の腸内細菌叢のアンバランスに有意な影響を及ぼす。
世界消化器病学会、23(2017)、6164-6171頁
CrossRefView in ScopusGoogle Scholar
11
Y. Zhang、S. Zhou、Y. Zhou、L. Yu、L. Zhang、Y. Wang
難治性てんかん小児におけるケトジェニック食後の腸内細菌叢組成の変化
Epilepsy Res., 145 (2018), 163-168頁
PDFを見る記事を見るCrossRefGoogle Scholar
12
C.A.オルソン、H.E.ヴオン、J.M.矢野、Q.Y.リャン、D.J.ナスバウム、E.Y.シャオ
腸内細菌叢はケトジェニックダイエットの抗発作効果を媒介する
Cell, 173 (2018), pp.1728-1741.e13
PDFで記事を見るScopusで記事を見るGoogle Scholar
13
C. Mu、A. Choudhary、S. Mayengbam、K.T. Barrett、J.M. Rho、J. Shearer、M.H. Scantlebury
小児けいれんの動物モデルにおける腸内細菌叢とトリプトファン・キヌレニン代謝による発作の変調
EBioMedicine, 76 (2022), p. 103833
PDFで記事を見るScopusで記事を見るGoogle Scholar
14
N. ミルヤノヴィッチ、H. ポツカ
Scn1a欠損とケトジェニック食が腸内細菌叢に及ぼす影響: 遺伝的Dravetマウスモデルにおける研究
Epilepsy Res., 178 (2021), p. 106826
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
15
L.A. David、C.F. Maurice、R.N. Carmody、D.B. Gootenberg、J.E. Button、B.E. Wolfe、A.V. Ling、A.S. Devlin、Y. Varma、M.A. Fischbach、他。
食事はヒト腸内細菌叢を迅速かつ再現性よく変化させる
ネイチャー, 505 (2014), pp.
CrossRefScopusで見るGoogle Scholarで見る
16
L. ティエン、X.W.ワン、A.K.ウー、Y.ファン、J.フリードマン、A.ダーリン、M.K.ワルダー、G.M.ワインストック、S.T.ワイス、Y.Y.リュー
ヒトマイクロバイオームにおける機能的冗長性の解読
Nat. Commun., 11 (2020), p. 6217
スコープで見るGoogle Scholar
17
M.E.バートン、B.D.クライン、H.H.ウルフ、H.S.ホワイト
部分てんかんの6Hz精神運動発作モデルの薬理学的特徴づけ
Epilepsy Res., 47 (2001), 217-227ページ
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
18
A.L.ハートマン、M.ライル、M.A.ロガウスキー、M.ガシオール
6Hz発作試験におけるケトジェニック食の有効性
Epilepsia, 49 (2008), pp.334-339
CrossRefView in ScopusGoogle Scholar
19
S.J. Ott, G.H. Waetzig, A. Rehman, J. Moltzau-Anderson, R. Bharti, J.A. Grasis, L. Cassidy, A. Tholey, H. Fickenscher, D. Seegert, et al.
クロストリジウム・ディフィシル感染症患者の治療における無菌糞便濾液移植の有効性
Gastroenterology, 152 (2017), pp.799-811.e7
PDFで記事を見るScopusで記事を見るGoogle Scholar
20
M. Levy, C.A. Thaiss, D. Zeevi, L. Dohnalová, G. Zilberman-Schapira, J.A. Mahdi, E. David, A. Savidor, T. Korem, Y. Herzig, et al.
微生物叢が調節する代謝産物は、NLRP6インフラムマソームシグナル伝達を制御することによって腸内微小環境を形成する
Cell, 163 (2015), pp.1428-1443
PDFで記事を見るScopusで記事を見るGoogle Scholar
21
E. Cekanaviciute, B.B. Yoo, T.F. Runia, J.W. Debelius, S. Singh, C.A. Nelson, R. Kanner, Y. Bencosme, Y.K. Lee, S.L. Hauser, et al.
多発性硬化症患者の腸内細菌はヒトT細胞を修飾し、マウスモデルにおいて症状を悪化させる。
Proc. Natl. Acad. Sci. USAUSA, 114 (2017), 10713-10718頁
CrossRefScopusで見るGoogle Scholarで見る
22
H.C.ウィリアムズ、M.A.パイロン、G.K.ネーション、A.E.ウォルシュ、L.E.A.ヤング、R.C.サン、L.A.ジョンソン
安定同位体トレーサーの経口投与によるin vivoメタボロミクス
Metabolites, 10 (2020), Article 501
CrossRefGoogle Scholar
23
G.D.エイブラムス、J.E.ビショップ
正常微生物叢が消化管運動に及ぼす影響
Proc. Soc. Exp. Biol. Med., 126 (1967), pp.
CrossRefScopusで見るGoogle Scholarで見る
24
P.J.ターンボー、V.K.リダウラ、J.J.フェイス、F.E.レイ、R.ナイト、J.I.ゴードン
ヒト腸内細菌叢に対する食事の影響: ヒト化グノトビオティックマウスにおけるメタゲノム解析
Sci. Transl. Med., 1 (2009), p. 6ra14
スコープで見るGoogle Scholar
25
J. ウォルター、A.M.アーメット、B.B.フィンレイ、F.シャナハン
腸内細菌叢の因果関係の確立または誇張: ヒト微生物叢関連げっ歯類からの教訓
細胞, 180 (2020), 221-232頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
26
S.C.ボコリヤ、Y.ドーセット、H.パニエ、Y.周
マウスマイクロバイオーム研究における糞便微生物叢移植の手順
Front. Cell. Infect. Microbiol. (2021), p. 868
Google Scholar
27
J.F.ロールズ、M.A.マホワルド、R.E.レイ、J.I.ゴードン
ゼブラフィッシュとマウスから無菌レシピエントへの腸内細菌叢の相互移植は宿主の生息地選択を明らかにする
細胞, 127 (2006), 423-433頁
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
28
G. Sharon、N.J. Cruz、D.W. Kang、M.J. Gandal、B. Wang、Y.M. Kim、E.M. Zink、C.P. Casey、B.C. Taylor、C.J. Lane、他。
自閉症スペクトラム障害のヒト腸内細菌叢はマウスの行動症状を促進する
Cell, 177 (2019), 1600-1618頁
Scopusで見るGoogle Scholar
29
C. Staley, T. Kaiser, L.K. Beura, M.J. Hamilton, A.R. Weingarden, A. Bobr, J. Kang, D. Masopust, M.J. Sadowsky, A. Khoruts
抗生物質によるコンディショニング後の単回経口投与によるマウスへのヒト微生物叢の安定した生着
Microbiome, 5 (2017), p. 87
スコープで見るGoogle Scholar
30
L.v. Blanton, M.R. Charbonneau, T. Salih, M.J. Barratt, S. Venkatesh, O. Ilkaveya, S. Subramanian, M.J. Manary, I. Trehan, J.M. Jorgensen, et al.
栄養失調児の微生物叢から伝わる成長障害を予防する腸内細菌
Science, 351 (2016), Article eaad3311
グーグル・スカラー
31
A.R. Kennedy, P. Pissios, H. Otu, R. Roberson, B. Xue, K. Asakura, N. Furukawa, F.E. Marino, F.F. Liu, B.B. Kahn, et al.
高脂肪ケトジェニック食はマウスにユニークな代謝状態を誘導する。
Am. J. Physiol. Metab., 292 (2007), E1724-E1739頁
CrossRefView in ScopusGoogle Scholar
32
S. Puckett, C. Trujillo, Z. Wang, H. Eoh, T.R. Ioerger, I. Krieger, J. Sacchettini, D. Schnappinger, K.Y. Rhee, S. Ehrt
グリオキシル酸解毒は、結核菌の炭素同化に必要なリンゴ酸合成酵素の必須機能である。
Proc. Natl. Acad. Sci. USAUSA, 114 (2017), pp.E2225-E2232
スコープで見るGoogle Scholar
33
D.P.クラーク、J.E.クローナン
炭素源としての2炭素化合物と脂肪酸
エコサルプラス, 1 (2005), pp.
ScopusGoogle Scholarで見る
34
M. ユドコフ、Y.ダイキン、T.M.メロ、I.ニシム、U.ソンネワルド、I.ニシム
ケトジェニック食とアミノ酸の脳内代謝: 抗けいれん作用との関係
Annu. Rev. Nutr., 27 (2007), pp.
CrossRefScopusで見るGoogle Scholarで見る
35
E.C. Westman、R.D. Feinman、J.C. Mavropoulos、M.C. Vernon、J.S. Volek、J.A. Wortman、W.S. Yancy、S.D. Phinney
低炭水化物栄養と代謝
Am. J. Clin. Nutr., 86 (2007), 276-284頁
PDFを見る記事を見るクロスリファレンスで見るScopusGoogle Scholar
36
J. Mierziak, M. Burgberger, W. Wojtasik
代謝産物としての3-ヒドロキシ酪酸、および生物のプロセスを制御するシグナル分子としての3-ヒドロキシ酪酸
バイオモレキュールズ, 11 (2021), p. 402
CrossRefGoogle Scholar
37
Q.Y. Ang, M. Alexander, J.C. Newman, Y. Tian, J. Cai, V. Upadhyay, J.A. Turnbaugh, E. Verdin, K.D. Hall, R.L. Leibel, et al.
ケトン食は腸内細菌叢を変化させ、その結果腸管Th17細胞を減少させる
Cell, 181 (2020), pp.1263-1275.e16
PDFで記事を見るScopusで記事を見るGoogle Scholar
38
I. Żarnowska、D. Wróbel-Dudzińska、M. Tulidowicz-Bielak、T. Kocki、K. Mitosek-Szewczyk、M. Gasior、W.A. Turski
難治性てんかんに対してケトジェニック食を投与した小児の血中トリプトファンとキヌレニン経路代謝産物の変化
Seizure, 69 (2019), pp.265-272
PDFで記事を見るScopusで記事を見るGoogle Scholar
39
Z. Pang、J. Chong、G. Zhou、D.A. de Lima Morais、L. Chang、M. Barrette、C. Gauthier、P.É. Jacques, S. Li, J. Xia
MetaboAnalyst 5.0: 生のスペクトルと機能的洞察のギャップを縮める
Nucleic Acids Res., 49 (2021), W388-W396頁
CrossRefScopusで見るGoogle Scholarで見る
40
S.A.ジョイス、J.マクシャリー、P.G.ケーシー、M.キンセラ、E.F.マーフィー、F.シャナハン、C.ヒル、C.G.M.ガーン
腸内細菌の胆汁酸修飾による宿主の体重増加と脂質代謝の制御
Proc. Natl. Acad. Sci. USAUSA, 111 (2014), 7421-7426頁
CrossRefスコープで見るGoogle Scholar
41
G.S.ダッカー、J.D.ラビノウィッツ
健康と疾患における一炭素代謝
Cell Metabol., 25 (2017), pp.27-42
PDFを見る記事を見るScopusGoogle Scholarで見る
42
P. チャウハン、S.E.フィリップ、G.チャウハン、S.メーラ
てんかん発作の解剖学的基盤
てんかん (2022)
Google Scholar
43
A.N. Suarez、T.M. Hsu、C.M. Liu、E.E. Noble、A.M. Cortella、E.M. Nakamoto、J.D. Hahn、G. de Lartigue、S.E. Kanoski
腸迷走神経感覚シグナルは多次経路を介して海馬の機能を制御する
Nat. Commun., 9 (2018), p. 2181
Scopusで見るGoogle Scholar
44
M. ムダ、E.R.マニング、K.オルト、J.E.ディクソン
ヒトYVH1タンパク質チロシンホスファターゼオルソログの同定により、生体内機能に不可欠な新規亜鉛結合ドメインが明らかになった
J. Biol. Chem., 274 (1999), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
45
A.K.Venugopal、G.S.Sameer Kumar、A.Mahadevan、L.D.N.Selvan、A.Marimuthu、J.B.Dikshit、P.Tata、Y.L.Ramachandra、R.Chaerkady、S.Sinha、他。
内側側頭葉てんかんのトランスクリプトームプロファイリング
J. プロテオノミクス・バイオインフォ, 5 (2012), Article 1000210
Google Scholar
46
A. Hsiung, F.J. Naya, X. Chen, R. Shiang
統合失調症に関連するCMYA5対立遺伝子はデスミンとの結合に差異を示す
J. Psychiatr. Res., 111 (2019), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
47
P.T.ネルソン、G.A.ジチャ、W.X.ワン、E.イゴダロ、S.アルティウシン、C.G.ニコルズ、D.W.ファルド
脳におけるABCC9/SUR2: 加齢に伴う海馬硬化の意義と治療標的の可能性
Ageing Res. Rev., 24 (2015), 111-125頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
48
D. ミルライン、T.カミングス、S.P.マシューズ、J.J.ピーター、H.M.マグヌッセン、S.M.ランゲ、T.マッカートニー、F.ラモリアッテ、A.クネベル、Y.クラトゥ
ヒトUFSP1はUFM1の成熟とUFMylationを制御する活性型プロテアーゼである
Cell Rep., 40 (2022), Article 111168
PDFで記事を見るScopusで記事を見るGoogle Scholar
49
S. ラインハルト、F.シュック、N.ストイエ、T.ハートマン、M.O.W.グリム、G.プフルッグフェルダー、K.エンドレス
TBX2によるエクトドメインシダーゼADAM10の転写抑制とアルツハイマー病への潜在的関与
細胞 Mol. Life Sci., 76 (2019), 1005-1025頁
CrossRefScopusで見るGoogle Scholarで見る
50
G. Huasong、D. Zongmei、H. Jianfeng、Q. Xiaojun、G. Jun、G. Sun、W. Donglin、Z. Jianhong
セリンプロテアーゼ阻害剤(SERPIN)B1は神経膠腫細胞の遊走と浸潤を抑制する
Brain Res., 1600 (2015), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
51
D. ロス、D. シーゲル
NQO1の多様な機能性と酸化還元制御における役割
レドックスバイオロジー, 41 (2021), Article 101950
PDFで記事を見るScopusで記事を見るGoogle Scholar
52
Y. Zhou、S. Holmseth、R. Hua、A.C. Lehre、A.M. Olofsson、I. Poblete-Naredo、S.A. Kempson、N.C. Danbolt
ベタイン-GABAトランスポーター(BGT1、slc6a12)は肝臓で主に発現し、腎臓と脳表面では発現レベルが低い。
Am. J. Physiol. Ren. Physiol., 302 (2012), pp.
CrossRefScopusで見るGoogle Scholarで見る
53
S.A. Marchitti、D.J. Orlicky、V. Vasiliou
ヒトALDH3B1の発現と初期特性評価
Biochem. Biophys. Res. Commun., 356 (2007), pp.
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
54
R. コルドー、S.ウディット、M.A.バッツァー、C.フェショット
移動性エレメントからのトランスポザーゼ遺伝子の捕獲による霊長類キメラ遺伝子の誕生
Proc. Natl. Acad. Sci. USAUSA, 103 (2006), pp.
CrossRefScopusで見るGoogle Scholarで見る
55
M.D. Metodiev、N. Lesko、C.B. Park、Y. Cámara、Y. Shi、R. Wibom、K. Hultenby、C.M. Gustafsson、N.G. Larsson
哺乳類ミトコンドリアリボソームの小サブユニットの生体内安定性には12S rRNAのメチル化が必要である
細胞代謝, 9 (2009), 386-397頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
56
L.H.グエン、A.ボーデイ
mTOR病態におけるてんかん発症の収束的メカニズムと相違的メカニズム
Front. Neuroanat., 15 (2021), Article 664695
スコープで見るGoogle Scholar
57
P.H.チャン
虚血脳におけるシグナル伝達と損傷における活性酸素ラジカル
J. 大脳血流代謝, 21 (2001), pp.
スコープで見るGoogle Scholar
58
J.T. Morton, A.A. Aksenov, L.F. Nothias, J.R. Foulds, R.A. Quinn, M.H. Badri, T.L. Swenson, M.W. Van Goethem, T.R. Northen, Y. Vazquez-Baeza, et al.
微生物と代謝物の相互作用の学習表現
Nat. Methods, 16 (2019), pp.1306-1314
CrossRefスコープで見るGoogle Scholar
59
J. Ding、M. Blencowe、T. Nghiem、S.M. Ha、Y.W. Chen、G. Li、X. Yang
Mergeomics 2.0: 疾患ネットワークの解明と治療法予測のためのマルチオミクスデータ統合用ウェブサーバー
核酸研究, 49 (2021), W375-W387頁
CrossRefScopusで見るGoogle Scholarで見る
60
B. ダリール、L.ヴァン・オーデンホーフ、B.ヴァーヴリート、K.フェルベーク
微生物叢-腸-脳のコミュニケーションにおける短鎖脂肪酸の役割
Nat. Rev. Gastroenterol. Hepatol., 16 (2019), 461-478頁
CrossRefスコープで見るGoogle Scholar
61
M.C.マッケンナ、P.F.シュック、G.C.フェレイラ
ライソゾーム貯蔵病における中枢神経系エネルギー代謝の基礎と変化
J. Neurochem., 148 (2019), pp.
CrossRefScopusで見るGoogle Scholarで見る
62
S.C.ラーション、H.S.マーカス
分岐鎖アミノ酸とアルツハイマー病: メンデルランダム化解析
Sci. Rep., 7 (2017), p. 13604
スコープで見るGoogle Scholar
63
P. P. Zheng, J. Wu, H. Zhang, S.W. Perry, B. Yin, X. Tan, T. Chai, W. Liang, Y. Huang, Y. Li, et al.
ヒト以外の霊長類のうつ病モデルにおいて、腸内細菌叢が腸脳軸のグリセロリン脂質代謝を領域特異的に調節すること
Mol. 精神医学, 26 (2021), 2380-2392頁
CrossRefScopusで見るGoogle Scholarで見る
64
R. 秦、曹、リュウ、チー、チャン、ワン
CDYL欠損は神経細胞の移動を阻害し、てんかん感受性を増加させる
Cell Rep., 18 (2017), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
65
F. 竹内, 西方直樹, 西村雅彦, 長尾和久, 川村雅彦
ロイシン強化必須アミノ酸はラットにおけるケトジェニックダイエットの抗けいれん効果を増強する
Front. 神経科学, 15 (2021), p. 637288
スコープで見るGoogle Scholar
66
C. ガル、K.マレー、P.J.イサクソン
カイニン酸誘発発作はラット海馬における神経成長因子mRNAの発現増加を刺激する。
Brain Res. Brain Res., 9 (1991), 113-123ページ
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
67
S.L.ホッジス、J.N.ルーゴ
新規てんかん治療の潜在的標的としてのWnt/β-カテニンシグナル伝達
Epilepsy Res., 146 (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
68
T. 呉、F. 殷、S. 光、F. 何、L. 楊、J. 彭
ヒト疾患におけるグリコシルホスファチジルイノシトール生合成経路
Orphanet J. Rare Dis., 15 (2020), Article 129
CrossRefGoogleスカラー
69
E. エズカン、G.R.ラム、E.Y.シャオ
難治性てんかんにおける腸内細菌叢とケトジェニック食の相互作用
Int. Rev. Neurobiol., 167 (2022), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
70
J. ヤオ、C.O.ロック
細菌における外因性脂肪酸代謝
Biochimie, 141 (2017), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
71
S.K.ドラン、A.ウィジャヤ、S.M.ゲディス、D.R.スプリング、R.シルバ-ロシャ、M.ウェルチ
毒を愛すること: メチルシトレートサイクルと細菌の病原性
微生物学, 164 (2018), 251-259頁
CrossRefScopusで見るGoogle Scholarで見る
72
S. アン、ジョン、I.A.ジャン、E.L.マドセン、W.パーク
酸化ストレス応答におけるグリオキシル酸シャントの役割
J. Biol. Chem., 291 (2016), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
73
D. シュテッカー、T.ホフマン、H.リンク、F.M.コミカウ、E.ブレーマー
枯草菌のL-プロリン合成変異体は、L-アルギニン代謝を遺伝的に適応させることにより、浸透圧感受性を克服する。
Front. 微生物学, 13 (2022), Article 908304
スコープで見るGoogle Scholar
74
V.M. Koistinen, O. Kärkkäinen, K. Borewicz, I. Zarei, J. Jokkala, V. Micard, N. Rosa-Sibakov, S. Auriola, A.M. Aura, H. Smidt, K. Hanhineva
マウスにおける食事性グリシンベタインの代謝とin vitro大腸発酵に対する腸内細菌叢の寄与
Microbiome, 7 (2019), p. 103
Scopusで見るGoogle Scholar
75
M. ユドコフ、Y.ダイキン、I.ニシム、A.ラザロー、I.ニシム
ケトン食、アミノ酸代謝、発作制御
J. Neurosci. Res., 66 (2001), pp.
スコープで見るGoogle Scholar
76
T.J.マローン、L.K.カッツマレク
知的障害とてんかんにおける翻訳変化の役割
Prog. Neurobiol., 213 (2022), Article 102267
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
77
S.S.マクダニエル、N.R.レンシング、L.L.ティオ、K.A.山田、M.ウォン
ケトン食は哺乳類ラパマイシン標的(mTOR)経路を阻害する
てんかん, 52 (2011)
e7-11
Google Scholar
78
E.C. Warren、S. Dooves、E. Lugarà、J. Damstra-Oddy、J. Schaf、V.M. Heine、M.C. Walker、R.S.B. Williams
デカン酸は、グルコースおよびインスリンシグナルとは無関係にmTORC1活性を阻害する。
Proc. Natl. Acad. Sci. USAUSA, 117 (2020), pp.
CrossRefScopusで見るGoogle Scholarで見る
79
S. ローリー、M.パテル
側頭葉てんかんにおけるミトコンドリアの関与と酸化ストレス
Free Radic. Biol. Med., 62 (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
80
X. 朱, 董, 韓, 黄, 張, 夏, 張赫, チャオ, 姚赫
PTZキンドリングてんかん誘発海馬小胞体ストレスと酸化損傷に神経細胞内一酸化窒素合成酵素が関与している。
Front. Cell. Neurosci., 11 (2017), p. 377
CrossRefGoogle Scholar
81
T. グレコ、T.C.グレン、D.A.ホフダ、M.L.プリンズ
ケトジェニックダイエットは酸化ストレスを減少させ、ミトコンドリア呼吸複合体活性を改善する
J. 大脳血流代謝, 36 (2016), 1603-1613頁
スコープで見るGoogle Scholar
82
D.A.フォスター、D.サルーム、D.メノン、M.A.フリアス
ホスホリパーゼDと哺乳類ラパマイシン標的(mTOR)制御のためのホスファチジン酸レベルの維持
J. Biol. Chem., 289 (2014), 22583-22588頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
83
A.J.A. van Maris, D.A. Abbott, E. Bellissimi, J. van den Brink, M. Kuyper, M.A.H. Luttik, H.W. Wisselink, W.A. Scheffers, J.P. van Dijken, J.T. Pronk
Saccharomyces cerevisiaeによるバイオマス加水分解物中の炭素源のアルコール発酵: 現状
アントニー・レーウェンフック, 90 (2006), pp.391-418
CrossRefScopusで見るGoogle Scholarで見る
84
C. サルセド、J.V.アンデルセン、K.T.ヴィンテン、L.H.ピンボルグ、H.S.ワーゲペテルセン、K.K.フロイデ、B.I.アルダナ
機能的代謝マッピングにより、ヒトのアストロサイトにおける高活性の分岐鎖アミノ酸代謝が明らかになった。
Front. 加齢神経科学, 13 (2021), p. 736580
スコープで見るGoogle Scholar
85
N.N. Song、Y. Huang、X. Yu、B. Lang、Y.Q. Ding、L. Zhang
成体海馬の神経新生における中枢性セロトニンの多様な役割
Front. Cell. Neurosci., 11 (2017), p. 185
PDFを見る記事を見るGoogle Scholar
86
Y. Jang, J. Moon, S.T. Lee, J.S. Jun, T.J. Kim, J.A. Lim, B.S. Park, J.S. Yu, D.K. Park, A.R. Yang, et al.
側頭葉てんかんモデルマウスにおける調節異常ロングノンコーディングRNA
Seizure, 58 (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
87
V. リンドグレン、A.マクレー、R.ディニーン、A.ソールズベリー、G.ホーガンソン、M.シュリフト
遠位22q11.2微小欠失および微小重複を有する患者では、行動異常が一般的かつ重篤である。
Mol. Genet. Genomic Med.
Google Scholar
88
J.P. Shellhammer、E. Morin-Kensicki、J.P. Matson、G. Yin、D.G. Isom、S.L. Campbell、R.P. Mohney、H.G. Dohlman
浸透圧ストレス時のGタンパク質シグナル伝達を制御するアミノ酸代謝産物
PLoS Genet., 13 (2017), p. e1006829
CrossRefスコープで見るGoogle Scholar
89
Y. Yu, D.T. Nguyen, J. Jiang
後天性てんかんにおけるGタンパク質共役受容体: 後天性てんかんにおけるGタンパク質共役型受容体:薬剤性と翻訳性
Prog. Neurobiol., 183 (2019), Article 101682
PDFで記事を見るScopusで記事を見るGoogle Scholar
90
E.A.ケネディ、K.Y.キング、M.T.ボールドリッジ
マウス微生物叢モデル: 腸内細菌を改変するためのツールとして、無菌マウスと抗生物質治療を比較する。
Front. Physiol., 9 (2018), p. 1534
スコープで見るGoogle Scholar
91
A. Amir, D. McDonald, J.A. Navas-Molina, E. Kopylova, J.T. Morton, Z. Zech Xu, E.P. Kightley, L.R. Thompson, E.R. Hyde, A. Gonzalez, et al.
Deblurが一塩基コミュニティ配列パターンを迅速に解明
mSystems, 2 (2017), Article 10-1128
グーグル・スカラー
92
E. Bolyen, J.R. Rideout, M.R. Dillon, N.A. Bokulich, C.C. Abnet, G.A. Al-Ghalith, H. Alexander, E.J. Alm, M. Arumugam, F. Asnicar, et al.
QIIMEを用いた再現可能、インタラクティブ、スケーラブル、拡張可能なマイクロバイオームデータサイエンス 2
Nat. Biotechnol., 37 (2019), pp.852-857
CrossRefScopusで見るGoogle Scholarで見る
93
S. アンドリュース
FastQC - ハイスループット配列データの品質管理ツール
バブラハムバイオインフォマティクス (2010)
http://www.bioinformatics.babraham.ac.uk/projects/fastqc/
Google Scholar
94
S. マンダル、W.ヴァン・トレウレン、R.A.ホワイト、M.エッゲスボ、R.ナイト、S.D.ペッダダ
マイクロバイオームの組成分析:微生物組成研究のための新しい手法
Microb. Ecol. Health Dis., 26 (2015), p. 27663
Google Scholar
95
A.M.ボルジャー、M.ローゼ、B.ウサデル
Trimmomatic: イルミナ配列データのための柔軟なトリマー
バイオインフォマティクス, 30 (2014), pp.
CrossRefスコープで見るGoogle Scholar
96
D. キム、J.M.パッジ、C.パーク、C.ベネット、S.L.サルツバーグ
HISAT2とHISAT-genotypeを用いたグラフベースのゲノムアライメントと遺伝子型決定
Nat. Biotechnol., 37 (2019), pp.
クロスリーフScopusで表示Google Scholar
97
S. アンダース、P.T.ピル、W.フーバー
HTSeq-ハイスループットシーケンスデータを扱うためのPythonフレームワーク
バイオインフォマティクス, 31 (2015), pp.
CrossRefスコープで見るGoogle Scholar
98
M.I.ラブ、W.フーバー、S.アンダース
DESeq2によるRNA-seqデータのフォルドチェンジと分散のモデレート推定
ゲノム生物学, 15 (2014), p. 550
スコープで見るGoogle Scholar
99
RStudioチーム
RStudio: Rの統合開発
(2021)
プレプリント
Google Scholar
100
L.J. McIver, G. Abu-Ali, E.A. Franzosa, R. Schwager, X.C. Morgan, L. Waldron, N. Segata, C. Huttenhower
バイオベーカリー: メタオミクス解析環境
バイオインフォマティクス, 34 (2018), 1235-1237頁
CrossRefScopusで見るGoogle Scholarで見る
101
F. ベギーニ、L.J.マクアイバー、A.ブランコ-ミゲス、L.デュボワ、F.アスニカー、S.マハルジャン、A.メイリアン、P.マンギ、M.ショルツ、A.M.トーマス、他。
多様な微生物群集の分類学的、機能的、株レベルのプロファイリングをバイオベーカリーで統合 3
Elife, 10 (2021), Article e65088
スコープで見るGoogle Scholar
102
H. マリック、A.ラーナバード、L.J.マカイバー、S.マー、Y.チャン、L.H.グエン、T.L.ティックル、G.ワインガート、B.レン、E.H.シュワッガー、他。
集団規模のメタオミクス研究における多変量関連発見
PLoS Comput. Biol., 17 (2021), p. e1009442
CrossRefScopusで見るGoogle Scholarで見る
103
C. リウ、リ・X、F.R.マンソルド、アン・J、コウ・Y、チャン・X、ワン・J、ツェン・J、バーメーリョ・A.B.、ヤオ・M.
微生物の生息域特異性は、湿地土壌における微生物の共起パターンと機能プロファイルに大きく影響する
Geoderma, 418 (2022), Article 115866
PDFで記事を見るScopusで記事を見るGoogle Scholar
104
P. シャノン、A.マルキエル、O.オジエ、N.S.バリガ、J.T.ワン、D.ラメイジ、N.アミン、B.シュビコフスキー、T.イデッカー
サイトスケープ: 生体分子相互作用ネットワークの統合モデルのためのソフトウェア環境
ゲノム研究, 13 (2003), 2498-2504頁
CrossRefScopusで見るGoogle Scholarで見る
105
E.Y. Chen、C.M. Tan、Y. Kou、Q. Duan、Z. Wang、G.v. Meirelles、N.R. Clark、A. Ma'ayan
Enrichr: 対話的かつ協調的なHTML5遺伝子リスト濃縮解析ツール
BMC Bioinf.
スコープで見るGoogle Scholar
106
M.v. Kuleshov, M.R. Jones, A.D. Rouillard, N.F. Fernandez, Q. Duan, Z. Wang, S. Koplev, S.L. Jenkins, K.M. Jagodnik, A. Lachmann, et al.
Enrichr: 包括的遺伝子セット濃縮解析ウェブサーバー 2016 update
Nucleic Acids Res., 44 (2016), pp.
CrossRefスコープで見るGoogle Scholar
107
Z. Xie, A. Bailey, M.v. Kuleshov, D.J.B. Clarke, J.E. Evangelista, S.L. Jenkins, A. Lachmann, M.L. Wojciechowicz, E. Kropiwnicki, K.M. Jagodnik, et al.
Enrichrによる遺伝子セット知識発見
Curr. Protoc., 1 (2021), p. e90
スコープで見るGoogle Scholar
108
D. Szklarczyk, A.L. Gable, D. Lyon, A. Junge, S. Wyder, J. Huerta-Cepas, M. Simonovic, N.T. Doncheva, J.H. Morris, P. Bork, et al.
STRING v11:ゲノムワイドな実験データセットにおける機能的発見をサポートする、カバレッジを向上させたタンパク質間関連ネットワーク
Nucleic Acids Res., 47 (2019), D607-D613ページ
CrossRefスコープで見るGoogle Scholar
109
P. ラングフェルダー、S. ホーヴァス
WGCNA: 重み付け相関ネットワーク分析のためのRパッケージ
BMC Bioinf.
スコープで見るGoogle Scholar
110
J.G. Caporaso、C.L. Lauber、W.A. Walters、D. Berg-Lyons、C.A. Lozupone、P.J. Turnbaugh、N. Fierer、R. Knight
サンプルあたり数百万配列の深さにおける16S rRNA多様性のグローバルパターン
Proc. Natl. Acad. USAUSA, 108 (2011), 4516-4522頁
CrossRefScopusで表示Google Scholarで表示
111
R. サマラ、S.ウィリス、K.ボルヘス
マウス急性発作モデルにおけるバランスのとれたケトジェニック食の抗けいれん性プロファイル
てんかん研究, 81 (2008), pp.119-127
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
112
A.W.キンボール、W.T.バーネット、D.G.ドハーティ
電離放射線に対する化学的防護: マウスを用いた放射線防護試験における化合物スクリーニングのためのサンプリング法
Radiat. Res., 7 (1957), pp.
CrossRefScopusで見るGoogle Scholarで見る
113
D.H. Reikvam、A. Erofeev、A. Sandvik、V. Grcic、F.L. Jahnsen、P. Gaustad、K.D. McCoy、A.J. Macpherson、L.A. Meza-Zepeda、F.E. Johansen
マウス腸内細菌叢の枯渇: 腸粘膜および上皮遺伝子発現への影響
PLoS One, 6 (2011), p. e17996
CrossRefScopusで見るGoogle Scholarで見る
114
国際複合てんかん連合、P. Auce、A. Avbersek、M. Bahlo、D.J. Balding、T. Bast、L. Baum、A.J. Becker、F. Becker、B. Berghuis、他。
ゲノムワイドなメガアナリシスにより16の遺伝子座が同定され、一般的なてんかんにおける多様な生物学的メカニズムが明らかになった。
Nat. Commun., 9 (2018), p. 5269
Google Scholar
115
F. Aguet、A.N. Barbeira、R. Bonazzola、A. Brown、S.E. Castel、B. Jo、S. Kasela、S. Kim-Hellmuth、Y. Liang、M. Oliva、et al.
GTEx Consortium atlas of genetic regulatory effects across human tissues(ヒト組織における遺伝子制御効果のGTExコンソーシアムアトラス
サイエンス, 369 (2020), pp.
スコープで見るGoogle Scholar
引用 (0)
4
リードコンタクト
© 2023 The Author(s).
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
