
炎症とバクテリオファージが腸内細菌叢のDNA逆転状態と機能性に影響する
メインコンテンツへスキップ
広告
細胞宿主微生物
ログイン
検索...
論文|オンライン公開中
炎症とバクテリオファージが腸内細菌叢のDNA逆転状態と機能性に影響する
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(24)00042-8
シャケド・カラッソ 14
ラワン・ザートリー 14
ハイサム・ハッジョ 14
ローリー・E・コムストック
イタイ・シャロン
ナーマ・ゲバ=ザトルスキー 15
すべての著者を表示
脚注を表示オープンアクセス掲載:2024年2月28日DOI:https://doi.org/10.1016/j.chom.2024.02.003
ハイライト
健常人とIBD患者におけるバクテロイデス属細菌のDNA逆転パターンの違い
炎症腸管はB. fragilisの免疫調節PSAのDNA逆転を誘導する
バクテリオファージレベルは患者における細菌のDNA逆位と相関する。
単離バクテリオファージはPSAの相変化とTregレベルに影響する
まとめ
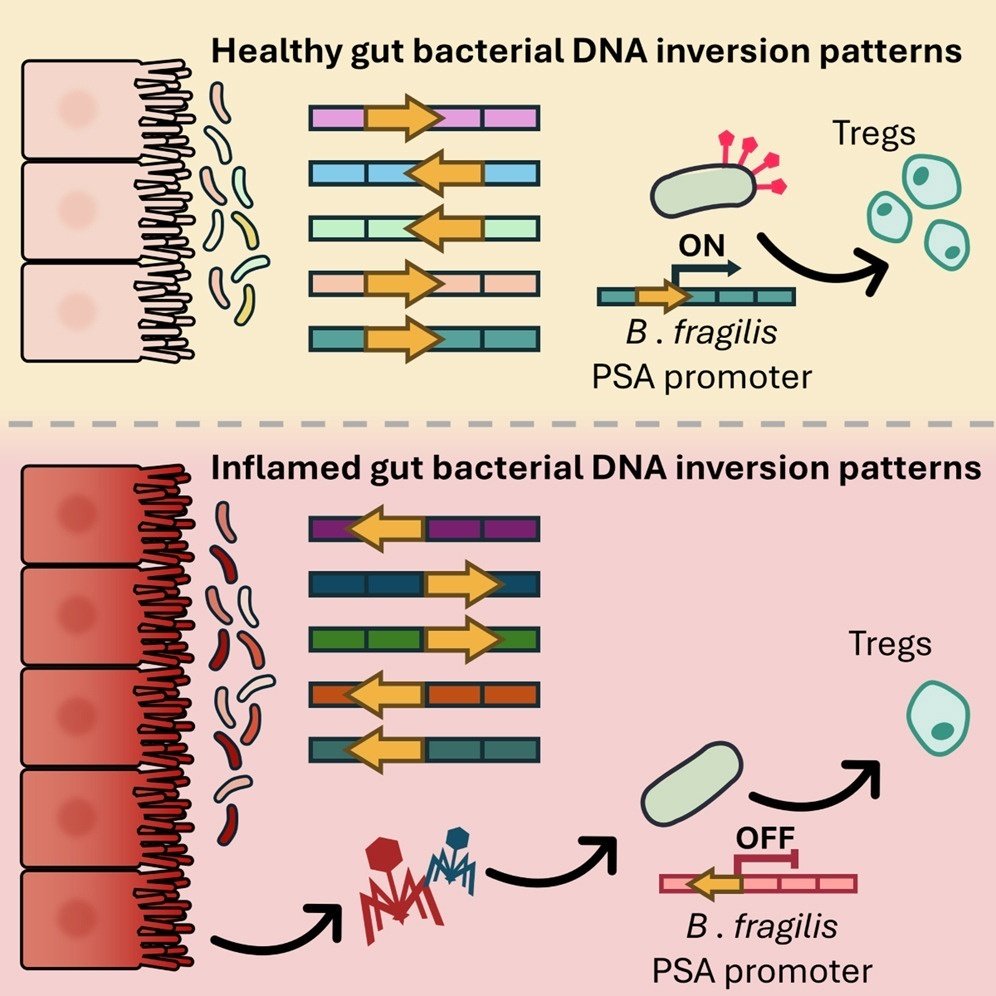
可逆的なゲノムDNAの逆転は、多数の腸内細菌分子の発現を制御しているが、これが疾患にどのように影響するかは不明である。炎症性腸疾患(IBD)コホートのメタゲノムサンプルを解析することにより、特定の方向性が疾患と相関する複数の逆位領域を同定した。その中には、制御性T細胞(Treg)を誘導し、実験的大腸炎を改善するBacteroides fragilisの多糖類A(PSA)のプロモーターも含まれていた。IBD患者では、PSAプロモーターはほとんど "OFF "を向いており、これはB. fragilis関連バクテリオファージの増加と相関していた。同様に、健康なヒト微生物叢とB. fragilisをコロニー形成させたマウスでは、大腸炎を誘発するとPSAは "ON "方向に低下し、炎症が治まると逆転した。B.fragilisをマウスに単コロニー化すると、バクテリオファージの感染によってPSAの「OFF」方向の頻度が増加し、PSAの発現低下とTreg細胞の減少が引き起こされた。以上のことから、バクテリオファージと宿主の炎症によって引き起こされるダイナミックな細菌の位相変動が明らかになり、疾患における細菌の機能的可塑性が示唆された。
図解抄録
図サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
DNA逆位
相変化
腸内細菌叢
バクテリオファージ
炎症性腸疾患
クローン病
潰瘍性大腸炎
バクテロイデス
免疫調節
機能的可塑性
はじめに
バクテロイデス目(Bacteroidales)とは、ヒトの腸内で優勢な細菌目であり、相変化は非常に一般的で、その大部分は反転反復(IR)間のDNAセグメントの逆位を介する。これらの逆位は、しばしば遺伝子やオペロンの転写開始を指示するプロモーター領域に関与し、「ON」「OFF」スイッチとして機能する5。さらに、DNAの逆位は、ゲノム「シャフロン」(再配列を促進する可動性遺伝要素)の再配向や組み換えによって、新しい遺伝子が不活性部位から転写活性部位に導入されるように起こることがあり、発現遺伝子を変化させる動的なツールとして機能する6,7,8。様々な宿主の疾患状態における細菌のインバーティブル領域の向きを解析することで、細菌の適応や疾患発症やその解決への機能的貢献に関する新たな知見を得ることができる。腸内バクテロイデス類における相変化は、しばしば細菌表面に提示される成分の産生を調節し9、例えば、どの表面分子が近隣の微生物(細菌やバクテリオファージなど)や宿主と相互作用するかを決定する。
ヒトの腸の常在菌であるバクテロイデス・フラジリスは、莢膜多糖(PS、PSA-PSHと表記)の相変化合成によってその表面を調節している。その8つの多糖のうち7つの生合成遺伝子座は、下流のPS生合成オペロンに対して "ON "または "OFF "のどちらかを示す反転可能なプロモーターを持つ5。研究により、B. fragilis多糖体A(PSA)は、制御性T細胞(Treg)を誘導し、抗炎症性サイトカインであるインターロイキン(IL)-10を分泌することにより、宿主の免疫系を調節することが示されている10,11。
バクテリオファージは、細菌を特異的に標的として感染するウイルスであり、細菌集団の構成に影響を与え、その機能性に影響を及ぼす可能性がある。バクテロイデス類とファージとの間のダイナミックな関係については、いくつかの研究で強調されている。Campbellら15は、バクテロイデス属細菌に温帯バクテリオファージBV01を感染させると、胆汁酸ヒドロラーゼ活性が抑制されることを発見した。Porterら(8)とHryckowianら(16)は、莢膜PSやその他の外表面分子が、バクテロイデス・テタイオタミクロンの特定のファージに対する感受性に影響を与えることを示した。Shkoporov et al.17は、Bacteroides intestinalisの莢膜PSの相変化がCrAss様ファージの感染に影響を及ぼし、腸内で長期間共存するための動的平衡が確立されていることを明らかにした。これらの研究は、ファージとバクテロイデス間の相互作用が、細菌の機能性の変化を通じて宿主に影響を与える可能性を示唆している。
潰瘍性大腸炎(UC)とクローン病(CD)は、多因子性の炎症性腸疾患(IBD)であり、粘膜バリアーの低下、不適切な免疫活性化、腸内細菌叢の誤局在化を特徴とする18,19,20,21。そのため、IBDは最も研究されている微生物叢関連疾患22の一つとして浮上しており、腸内細菌の機能、宿主への潜在的な影響、細菌とファージの相互作用を研究するための興味深い環境を提供している。
ここでは、複数のコホートから得られたIBD患者の腸内細菌叢におけるDNAの逆向きの解析を紹介し、炎症とバクテリオファージがこれらの逆向きを媒介するという仮説を検証する。IBD患者メタゲノムと実験マウスモデルを組み合わせた解析から、バクテロイデス属細菌に焦点を当て、宿主免疫系を調節する可能性のある腸内炎症時に、複数のDNA反転領域の向きが変化することが明らかになった。重要なことは、IBD患者の糞便抽出物がB. fragilisのPSAプロモーターの向きを変えることである。バクテリオファージがPSAの「OFF」状態と相関していること、B. fragilisの特定の溶菌性バクテリオファージが、宿主の大腸Treg細胞の減少と同時にPSAプロモーターの「OFF」集団を増加させることを示す。これらの知見から、腸の炎症、バクテリオファージ、細菌相の変動がダイナミックに相互作用していることが明らかになり、IBDの診断と治療に示唆を与える可能性がある。
研究結果
IBDは、健常対照と比較して、複数のバクテロイデス属のインバーティブルDNA領域の向きの量的差異と相関する
バクテロイデス属の相変化性分子がIBD患者において対照群と比較して産生される量が異なるかどうかを調べる手段として、PhaseFinder9ソフトウェアを用いて、IBD患者と対照群のコホートの腸内メタゲノムにおけるDNAの逆位相の相対的な向きを同定・解析した(表1)。簡単に説明すると、まずIRを同定することによってBacteroidalesゲノム中の推定される逆位領域を検出し、次にそれらの順方向と逆方向を含むデータベースを作成した(提出されたゲノム配列と比較)。次に、公開されているデータセットからメタゲノム配列をデータベースにアライメントし、その結果、各インバーティブル領域の向きを、公開されているゲノム配列の向きと比較した。ヒト腸内細菌Bacteroidales属36種を含む39の配列決定済みゲノムを対象とした最初の解析で、311のインバーティブル領域が同定された。これらの311の反転可能領域のうち、健常対照と比較してIBD患者でその向きが統計的に異なる領域が147あった。これらの領域には、25の参照細菌ゲノムの反転領域が含まれていた(表S1)。これらの領域には、制御遺伝子から外表面分子の産生遺伝子をコードするものまで、多様な遺伝子の反転性プロモーターと遺伝子内領域の両方が含まれていた。表S1は、IR配列の位置と、反転可能領域(図1A)を挟む遺伝子の詳細である。IBD患者とコントロールの間で最も有意に向きが異なっていた領域は、SusC/SusD様外膜輸送系23およびupxY遺伝子内またはその近傍であり、ほとんどの場合、莢膜PSの生合成遺伝子座の最初の遺伝子に相当する(図1B)。B. thetaiotaomicronの5つの可逆的莢膜PSプロモーターのうち4つがグループ間で異なる配向を示し、B. fragilisの7つの可逆的PSプロモーターのうち3つが異なる配向を示し、そのうちの抗炎症性PSAプロモーターは健常人とUC患者で異なる配向を示した。PSAプロモーターは、健常対照群では56.2%であったのに対し、IBD患者では71%と高い割合で逆向きリードを示した(図1C)。B. fragilis NCTC 9343の参照ゲノムでは、PSAプロモーターは "ON "配向であるため、IBD患者に見られる逆配向はPSAプロモーターの "OFF "配向に相当する。さらに、B. thetaiotaomicron VPI-5482のPULsおよびPSsプロモーター(図1D)、および健常人24,25に存在し、UC26の疾患活動性と相関することが示されている細菌であるPhocaeicola dorei(図1E)についても、健常人とIBDコホートでプロモーターの向きが異なることを同定した。
表1本研究に含まれるメタゲノミックデータセット
データセット N(サンプル) CD UC 非IBD 国名 備考
IBDMDB 1,283 574 349 360 米国 Longitudinal Proctor et al.27
HMP (3 phase) 320 320 米国 Turnbaugh et al.28
MetaHit 122 4 21 97 デンマーク、スペイン Qin et al.29
1000IBD 331 205 126 オランダ Imhann et al.30
GeversD_2014 50 36 14 米国およびカナダ Gevers et al.31
LewisJD_2015 303 303 米国およびカナダ クローン病の小児、縦断的、治療 Lewis et al.32
合計 2,409 1,122 496 791
新しいタブで表を開く
図サムネイルgr1
図1バクテロイデス属は健康時と疾患時で反転領域の向きが異なる
キャプション
大きな画像を見るダウンロード 高解像度画像
異なるプロモーター配向状態は、炎症によって動的かつ可逆的に誘導される。
炎症条件下でのB. fragilis PSAプロモーターの配向の動態を評価するため、縦断的な実験マウスモデルをデザインし、PSAプロモーターの配向を経時的に解析した。無菌(GF)マウスに健康なヒトの腸内細菌叢をコロニー形成させ、その後B. fragilis NCTC 9343をスパイクし、「ヒト化」マウスとした。これらのマウスの子孫を実験に使用した(各実験群につきn = 8-12マウス、デキストラン硫酸ナトリウム[DSS]対コントロール)。実験的大腸炎は、飲料水に3%のDSS33を9日間添加することで誘発され、その後14日目までDSSを水に置換した(図2A)。炎症は、炎症のバイオマーカーとして一般的に用いられている便中カルプロテクチン濃度(図2B)とマウスの体重減少(図2C)によってモニターした。PSAプロモーターの状態を観察するため、定量的PCR(qPCR)を用いて、特定のインバーティブルDNA領域の配向を解析するために、DSS処理前、処理中、処理後の便を採取した(図S1A-S1C)。B. fragilis PSAプロモーターの配向は、コントロールマウスとDSS処理マウスの両方である程度変化しており、DSS処理マウスでは炎症状態とともに9日目に有意に変化した(図2B-2D)。実験開始時には、集団の約45%がプロモーターを "ON "方向に有していた(図2D)。これらの割合は、DSS導入6日後に有意な減少が観察され(平均約26%まで減少)、9日目には平均約24%にとどまった。マウスが体重を増やし始め、カルプロテクチンレベルが低下した14日目には(図2Bおよび2C)、細菌集団は実験開始時と同様の平均40%の「ON」に戻り、DSSを投与しなかった対照群(B. fragilis集団の平均58%が「ON」)にも戻った(図2D)。
図サムネイルgr2
図2B. fragilisのPSAプロモーターの相対的配向は炎症に影響される
キャプション
大きな画像を見るダウンロード 高解像度画像
PSAプロモーターが "ON "を向いているB. fragilisの頻度が、DSS処理マウスの大部分で減少したことから(図S1D)、他のBacteroidales属の種およびゲノム領域における反転可能領域の向きを解析するために、0日目と6日目に採取した便からメタゲノムシークエンシングを行った(表S2)。
この解析により、B. fragilis PSAプロモーターの "ON "配向の頻度が減少していることが検証され(図2E)、qPCRの結果(図S1E)と一致し、ヒトのメタゲノム解析(図1C)と一致した。さらに、B. thetaiotaomicronのCPS3プロモーターの "ON "配向の頻度がマウスの炎症時に低下することが確認され(図2F)、IBD対健常人のメタゲノム解析の結果と一致した。IBD患者では、参照ゲノムと比較して、"ON "配向の比率が低く、逆配向のリードに相当することが示された(図1D)。
コントロールマウスの腸内細菌叢の細菌組成は実験を通して安定していたが、DSS投与マウスでは変化した。細菌の豊かさ(α多様性、観察された種)は炎症条件下で減少したが(図2G)、均一性(α多様性、シャノン指数)は一定であった(図2H)。β多様性(Aitchison distance)は有意に変化したが(図2I)、β分散性(Aitchison distance)は有意に変化しなかった(図2J)。
炎症マウスでは、Blautia属細菌とEubacterium ventriosumの相対量が減少し、それに伴ってBarnesiella intestinihominisとAlistipes disparが増加した(図2K;表S2)。DNAの反転領域の向きが異なるB. fragilisの相対量は、炎症中も有意に変化しなかった(図2K)。
炎症がB. fragilis PSAプロモーターの配向に果たす役割をより正確に評価するため、B. fragilis NCTC 9343を単コロニー化したgnotobioticマウス(各実験群n = 8-12マウス、DSS対コントロール)を用いて、変化した微生物叢の影響を除いた実験を繰り返した(図2AおよびS1F)。PSAプロモーターの方向性は、実験期間中(DSSの有無にかかわらず)、細菌量(図S1G)とともに、モノコロナイズマウスでは変化しなかった(図2L)ことから、炎症時にPSAプロモーターの「OFF」方向性を駆動する微生物叢の役割が示唆された。
複雑なヒト微生物叢の炎症環境は、PSAプロモーターの "OFF "配向をもたらす。
次に、炎症時にPSAプロモーターが "ON "を示すB. fragilis集団の割合が減少する複雑な微生物叢の要因を調べようとした。そのために、B. fragilis NCTC 9343をIBD患者の糞便濾過液に曝露した。CDおよびUC患者はRambam Health Care Campus(RHCC)から募集した。糞便サンプルは治療(インフリキシマブ[HR]またはヒュミラ[HuR]治療、それぞれ4人と7人)の前後に採取された。両治療とも、IBD患者で増加する炎症性サイトカインである腫瘍壊死因子α(TNF-α)を標的とした抗体である。B. fragilis NCTC 9343を糞便濾液中で対数期中期まで培養し、その時点でPSAプロモーター配向のqPCR解析のためにDNAを抽出した(図3A)。治療前の患者の糞便濾液に暴露されたB. fragilisは、PSAプロモーターが「OFF」を向いている集団の比率が高かったが、治療後の糞便濾液に暴露されたB. fragilisは、PSAプロモーターが「ON」を向いている集団の比率が高かった(図3B)。この観察は、処理前に高く、処理後に低下した糞便カルプロテクチン濃度と一致しており、PSAプロモーターの「ON」配向と逆相関していた(図3C)。これらの結果から、PSAプロモーターを各指向性に持つ細菌集団は、炎症がある腸と炎症がない腸とで異なり、炎症がある状態では「OFF」指向性の集団の割合が高くなり、炎症が軽減すると「ON」指向性にシフトすることが示された(図3Bおよび3C)。特に、治療反応者は非反応者と比較して、PSA「ON」とカルプロテクチン値の低下に有意な相関が認められた(図S2A)。この変化は、これらの条件下での逆転の誘導、あるいは好ましいプロモーター状態の選択によるものと考えられる。
図サムネイルgr3
図3B. fragilis多糖体Aプロモーターの方向性とファージとの相関の証拠
キャプション
大きな画像を見るダウンロード 高解像度画像
ファージとPSAプロモーター配向との関連を調べる
糞便濾液には、細菌および宿主の代謝産物、サイトカイン、抗体、ウイルス、バクテリオファージ、その他の成分が混在している。バクテリオファージは、IBDMDBメタゲノミクスデータベースで温帯バクテリオファージとその宿主細菌の特徴を明らかにしたNishiyamaら34を含むいくつかの研究35,36,37,38,39で、腸の炎症やIBDに関連していることが示されている。ここでは、IBDMDBデータベースのファージ配列を用いて、PSAプロモーター「ON」配向の比率が低い(40%未満)サンプルと高い(60%以上)サンプル間で、これらのファージの相対存在量を比較した。相対存在量の差分析により、偽発見率(FDR)補正後、PSAプロモーター "ON "配向の比率が低い患者では108のウイルスOTUが濃縮されていたのに対し、"ON "配向の比率が高い患者では24のウイルスOTUが濃縮されていた(図3D;表S3)。PSAプロモーター "ON "配向の比率が低い方に濃縮されたバクテリオファージのうち3つは、B. fragilis34-viral OTUs 0791、0820、および1202に感染すると予測された。バクテリオファージの相対存在量がB. fragilisの相対存在量の低下に伴っているかどうかを評価するために、各ファージ-B. fragilisペアについてファージ-宿主存在量比を計算した。相対存在量がPSAプロモーターの "OFF "方向と相関していた2つのOTU、ウイルスOTU 0791と0820も、ファージ対宿主の存在量比が高かった(図3EとS2)。興味深いことに、これら2つのウイルスOTUは、活動性のCDとUCでより豊富であることが判明した34。
B. thetaiotaomicronのCPS3プロモーターの "ON "配向比が高い(60%以上)サンプルと低い(40%未満)サンプルを比較して、同様の解析を行った。これらのグループ間でビロームの構成に違いが見られたが、CPS3プロモーターの「OFF」配向(すなわち、疾患と関連すると同定された配向)と相関するB.-thetaiotaomicron関連バクテリオファージはなかった(図3F;表S3)。我々は、ウイルスOTUs-0165、1130、1490に関連する3つのB. thetaiotaomicronが、CPS3プロモーターの "ON "方向(我々が健常対照と関連すると同定した方向)とわずかに関連していることを見出した(図3GおよびS2)。さらに、これらのバクテリオファージはファージ対宿主比が低かった(図3G)。なお、これらのOTUは以前には疾患とは関連していなかった34。
バクテリオファージへの曝露とB. fragilis PSAプロモーター「OFF」状態との相関性
バクテリオファージがより多く存在することは、PSAプロモーターが「OFF」配向であることと相関していたことから、我々はバクテリオファージとの遭遇がB. fragilisにおけるPSAプロモーターの配向変化に関連するかどうかを研究しようとした。この目的のため、下水からB. fragilis NCTC 9343特異的溶菌性バクテリオファージであるBarc2635を単離し(図S3A)、そのゲノムの塩基配列を決定し(GenBankに寄託、アクセッション:MN078104)、電子顕微鏡でその形態を観察した(図S3B)。
Barc2635は45,990bp、GC含量38.9%の溶菌性二本鎖DNAバクテリオファージで、67の推定CDSを含み、Caudoviricete(旧Caudovirales)クラスに統一される尾状ファージに属する(図S3C)。興味深いことに、このクラスからのバクテリオファージの存在量の増加は、IBD患者(UCおよびCD)と相関することが見出された23。我々は、IBDMDB34および他の研究40,41,42で同定されたB. fragilis関連バクテリオファージとBarc2635の配列類似性を解析し、Barc2635が、活動性疾患34と関連するウイルスOTU 0791および0820を含むバクテリオファージのクラスターと最も類似していることを見出した(図4AおよびS3D)。
サムネイルgr4
図4ファージ暴露はPSA遺伝子座と表面PSAの発現を変化させる
キャプションの全文を表示
大きな画像を見るダウンロード 高解像度画像
このバクテリオファージへの曝露がB. fragilis集団のPSAプロモーターの相対的な向きの変化につながるかどうかを調べるため、Barc2635の存在下または非存在下でB. fragilis NCTC 9343をGFマウスにモノクローナル投与し、PSAプロモーターDNAの逆転状態を解析した(図4B)。バクテリオファージに応答して、集団の高い割合でPSAプロモーターが「OFF」状態であった(図4C)。PSAプロモーター逆転の結果をさらに分析するため、PSA生合成遺伝子座の最初の遺伝子であるupaY43のmRNA発現を測定した。図4Dは、細菌を単独で投与したマウスと比較して、Barc2635を含むマウスではupaY発現が有意に減少していることを示している。B. fragilis集団の表面上のPSAレベルを直接測定するため、特異的抗体を用い、フローサイトメトリーで表面PSAをモニターした。バクテリオファージBarc2635を投与したマウスのPSAを合成する細菌細胞の割合は、バクテリオファージを投与していないマウスの細菌細胞と比較して有意に低く(図4E)、upaY発現レベルおよびPSAプロモーターの配向と一致した。マウスの2つのグループ(すなわち、B. fragilis単独とB. fragilisにBarc2635を加えたもの)において、B. fragilisのCFUレベルは0.5 a logの差があり(図S4A)、B. fragilis単独(すなわち、バクテリオファージなし)グループではファージは検出されなかった(図S4B)。
Barc2635はΔPSAと構成的に発現するPSA変異体の両方に感染する
バクテリオファージへの曝露によって生じたPSAプロモーター「OFF」状態が誘導によるものか選択によるものかを区別するために、B. fragilisの2つの変異体、Δpsa44およびΔmpiM44とBarc2635の相互作用を調べた43。In vitroのファージ感染アッセイでは、感染効力は同等であり(図S4C)、バクテリオファージに曝されている間、いずれの変異体も競争上の優位性はなかった(図S4D-S4F)。in vitroの結果と一致し、2つの変異体が等しい比率で最初にコロニー形成されたマウスでは、どちらの変異体に対してもバクテリオファージの選択性は見られなかった(図4Fと4G)。注目すべきことに、Δpsa変異体はGFマウスをコロニー形成する際に高い体力を示したが、この優位性はBarc2635への曝露にかかわらず変わらなかった(図S4GおよびS4H)。このことは、10日目のΔpsa/ΔmpiM44の比率を、処理群と対照群の0日目の比率と比較することでさらに確認された(図4G)。これらのデータは、PSAを欠く変異体はBarc2635に暴露されてもフィットネス上の優位性を持たないことを示している。
バクテリオファージによるB. fragilisの相変化はTreg細胞の減少をもたらす
B. fragilis NCTC 9343のPSAが、マウスの結腸前膜にTreg(CD4+Foxp3+RORgt+)を誘導することはよく知られている13,45,46,47。CD4+Foxp3+RORgt+ Tregs集団に対するB. fragilisコロニー形成中のBarc2635の効果をモニターするために、結腸前膜から細胞を抽出し、フローサイトメトリーで免疫表現型を決定した(図5A)。その結果、Barc2635の存在下では、CD4+Foxp3+RORgt+ Tregs集団は、upaY転写の減少と同時に減少し、免疫調節PSAの表面産生の減少と一致することがわかった(図5Bおよび5C)。
図のサムネイルgr5
図5バクテリオファージによるB. fragilisの相変異は、Tregの減少をもたらす。
キャプション
大きな画像を見るダウンロード 高解像度画像
考察
宿主関連種、特に腸内バクテロイデス属に広く見られる相変異9は、変化する生態系における細菌のフィットネスに寄与している。可逆的なDNAの反転は、多くの分子(例えば、表面分子、制御分子、その他の分子)の相変化合成をもたらし、その結果、機能的可塑性を付与する。われわれの研究は、特定の分子の相変化状態が腸の炎症と相関し、宿主の生理機能に影響を及ぼす可能性があることを明らかにした。IBD患者と健常人から採取した6つの異なるヒト腸内メタゲノミックデータセットを解析し、マウスを用いた対照実験を行うことで、疾患時と健常時で異なる方向性を示す25種類のバクテロイデス属細菌にマップされる複数の反転ゲノム領域を同定した。特に、遺伝子間領域(例えばプロモーター)と遺伝子内領域(例えばゲノムの「シャフロン」)の両方が、腸の炎症状態において、遺伝子発現に影響を及ぼす方向性の変化を示すことがわかった。
炎症時と健康時で異なる方向性を示すゲノム領域は、PSプロモーターとsusC/susDホモログ近傍に最も多く見られた。SusC様タンパク質は、バクテロイデスの栄養獲得に関与する豊富なβ-バレル外膜タンパク質である。最近、SusCタンパク質のエピトープが、IBD患者と健常対照者においてT細胞応答を引き起こすことが示された48。このことは、SusCホモログを含むオペロンが細菌に免疫調節特性を与える可能性を示唆している。相変化型PSのうち、B. fragilisの抗炎症性PSAプロモーターは、健常対照と比較して、IBD患者において逆向きのリードの割合が高かった。これらの結果は、生検サンプルのPCR消化を用いてIBD患者のB. fragilisのPSAプロモーターに注目した先行研究49と一致している。さらに私たちは、B. fragilisのPSAプロモーターのように、DNAの逆位状態の一部は動的であり、特に炎症時の局所環境の変化に対応できることを発見した。
興味深いことに、B. fragilisのPSAプロモーターが優先的に "OFF "になることは、ヒト微生物叢をコロニー形成した炎症マウスや、細菌が患者の糞便濾液に暴露された炎症マウスと同じ程度には起こらなかった。これらの結果は、炎症マウスやIBD患者における環境因子がこの効果に必要であることを示唆している。IBDMDBコホートにおけるファージOTUの解析から、PSAプロモーターが "OFF "方向に存在するサンプルにおいて、B. fragilis関連ファージOTUが濃縮されることが明らかになった。さらに、B. fragilisを単離されたバクテリオファージBarc2635に暴露すると、PSAプロモーターが "OFF "になる頻度が高くなり、腸内バクテリオファージが細菌の位相変動に関与していることが示唆された。
我々の解析では、炎症およびファージ暴露時にDNAの向きが変化する原因を区別することはできなかった。これらの条件が "OFF "方向への反転を誘導する可能性はあるが、PSAを発現していない細菌が選択された結果である可能性もある。PSAを合成できない変異体、あるいはPSAを合成する変異体を比較したところ、Barc2635感染に対する感受性はほぼ同じであったことから、観察されたPSA発現の低下は、淘汰圧よりもむしろ逆位誘導の結果である可能性が示唆された。もしそうであれば、この領域は今後のメカニズム解明が待たれるところである。
PSAの抗炎症作用は、誘導されたTreg(Foxp3+RORgt+)のアップレギュレーションと、それに続くIL-10分泌の誘導によって媒介される12,13。私たちは、Barc2635に感染したB. fragilisモノコロニーマウスでTregの集団が減少していることを発見し、PSAプロモーターが「OFF」の向きにある細菌の増加が宿主免疫系に関係していることを示唆した。同じ解析をB. thetaiotaomicronのCPS3にも適用したところ、CPS3「ON」配向プロモーターの比率が高いサンプルでは、バクテリオファージがより多く存在することが観察されたが、B. thetaiotaomicronバクテリオファージがCPS3合成を変化させる集団につながると結論するには、サンプルあたりのバクテリオファージ/宿主存在量の比率が低すぎた。
以上より、ヒトIBDにおけるバクテロイデス属のインバーティブル領域の相異なる方向性が示され、バクテリオファージがその引き金となる可能性が示唆された。これらの位相差は、宿主免疫系に影響を及ぼす細菌の機能的可塑性をもたらし、炎症と相関する。バクテリオファージは細菌の相変化状態を変化させる要因の一つである。しかし、炎症を起こしている腸内では、バクテロイデス属細菌集団の可逆的な状態を変化させる可能性のある因子が数多く存在する。これらにはマイクロバイオーム34,36,50,51,52(近隣の微生物など)、腸内メタボローム50、免疫系の変化53、異常なpH濃度54、浸透圧55,56、酸化ストレス57,58などの腸内の物理的変化が含まれる。例えば、Tropiniら59は、PEG誘導性の浸透圧擾乱により、B. thetaiotaomicronのCPS4とCPS5の比率が増加することを示した。
この研究により、IBDの腸内細菌において、反転可能なゲノム領域の変化、ひいては分子相の変化が、宿主の免疫系と炎症状態に影響を及ぼすことが明らかになった。これらの相変化は、バクテリオファージに限定されるものではないが、炎症時の腸内環境因子の変化に応答して起こる可能性がある。今後、細菌のDNA逆位と相変化解析を統合した研究が進めば、微生物-宿主相互作用の変化を促す可能性のある異なる環境因子に起因する、さらなる生理的状態における細菌の機能的可塑性の役割が明らかになるかもしれない。
研究の限界
本研究で解析した6つのデータセットには、成人と小児、健常対照者、炎症患者(治療前と治療後)および縦断的サンプルが含まれていた。これらの各要因の影響、および食事と生活習慣の影響については、さらなる研究が必要である。我々が適用したPhaseFinder9アルゴリズムは、短いリードのDNAインバージョンを識別する。そのため、我々の解析には、重複や挿入のような他の相変化メカニズムは含まれていない。また、メタゲノミクスシーケンスデータの短いリードの解析は、長い構造的ゲノム変化に起因する逆位を見落とす可能性がある3,7,60。さらに、メタゲノミクスシーケンスデータは、サンプルの全細菌集団を平均化したものであり、存在量の少ない細菌の希釈係数を示唆している。さらに、ゲノムの逆位部位は、ゲノム配列アセンブリーに干渉し、不完全なゲノムにつながる可能性があるため、参照ゲノムで逆位を検索するツールを適用する際に見落とされる可能性がある。また、西山ら34に基づく我々のバクテリオファージ計算機解析は、温帯ファージとして予測されたMAGの事前解析に依存しているため、患者のバクテリオファージの一部を見落とした可能性がある。本研究では、B. fragilisに対して同定・単離された溶菌性バクテリオファージを用いたが、IBDに関連する溶菌性バクテリオファージと温和性バクテリオファージの機能的効果を解明するためには、さらなる研究が必要である。これらの限界はあるにせよ、本研究は、IBDの文脈における細菌相の変化、炎症および微生物-宿主相互作用の変化に対する潜在的な影響を考慮することの重要性を強調している。
STAR★方法
主要リソース表
試薬またはリソースのソース IDENTIFIER
抗体
CD45 Biolegend Cat# 103138
TCR_b Biolegend Cat# 109222
CD19 Biolegend Cat# 115530
TCR_g/d Biolegend Cat# 118118
CD4 バイオレジェンド Cat# 100510
CD8 バイオレジェンド Cat# 100730
FoxP3 eBioscience Cat# 17-5773-82
ヘリオス バイオレジェンド Cat# 137220
RORgt eBioscience Cat# 12-6988-82
細菌およびウイルス株
Bacteroides fragilis NCTC 9343 ATCC ATCC 25285
バクテリオファージ Barc2635 本研究 N/A
mpi 遺伝子欠損 B. fragilis
B. fragilis NCTC 9343 ΔmpiM44 Chatzidaki-Livanis et al.43 N/A
PSA生合成遺伝子を欠くB. fragilis - NCTC 9343 ΔmpiM44 Chatzidaki-Livanis et al.
B. fragilis NCTC 9343 ΔPSA Coyne et al.44 N/A
生物学的サンプル
マウスから採取した糞便サンプル 本試験 該当なし
IBD患者から採取した糞便サンプル Rambam Health Care Campus N/A
化学物質、ペプチド、組換えタンパク質
デキストラン硫酸ナトリウム(DSS) TdB Cat#: DB001-500 G
DNAse New england biolabs Cat#: M0303S
qScript cDNA 合成キット Quantabio Cat#: 95049-100-2
SYBR® Green ミックス Thermo Fisher Scientific Cat#: AB-4385614
BRPMブロス Condalab Cat#: CL-1451
PEG(6,000-12,000 MW、8%) Merck Cat# :25322-68-3
塩化セシウム Thermo Fisher Scientific Cat# :7647-17-8
Tris-Cl Alfa Aesar Cat# :15424539
MgCl2 Merck Cat# :7786-30-3
トリス ph7.5 Thermo Fisher Scientific Cat# :15424539
EDTA Merck Cat# :60-00-4
脳心筋注入(BHIS) Becton Dickinson Cat# :237500
NH4Cl Alfa Aesar Cat# :12125-02-9
Na2HPO4 Merck Cat# :7558-79-4
KH2PO4 Merck Cat# :7778-77-0
NaCl Merck Cat# :7647-14-5
CaCl2 Merck Cat# :10043-52-4
MgSO4 Merck Cat# :7487-88-9
グルコース Merck Cat# :50-99-7
L-システイン Merck Cat# :7048-04-6
FeSO4 Strem Cat# :7782-63-0
VitB12 Glentham Life Sciences Cat# :68-19-9
ビタミンK Merck Cat# :84-80-0
ヘミン Alfa Aesar Cat# :16009-13-5
寒天 Merck Cat# :9002-18-0
アジ化ナトリウム Merck Cat#: 26628-22-8
FBS Biological industries 社の Cat# :04-127-1A
PBSx10 Thermo Fisher Scientific(サーモフィッシャーサイエンティフィック)の Cat# :02-023-5A
透過バッファー Thermo Fisher Scientific Cat# :00-8333-56
固定バッファー Thermo Fisher Scientific Cat# :00-8222-49
2% ラット血清 Stemcell Technologies Cat#: 45135
ヘキスト色素 Thermo Fisher Scientific Cat#: 62249
重要な市販アッセイ
ZymoBIOMICS DNA Miniprep Kit Zymo Cat#: ZR-D4300
ZymoBIOMICS RNA Miniprep Kit Zymo Cat#: R2001
Qubit™ dsDNA Quantification Assay Kit ThermoFisher Cat#: Q32850
IDT for Illumina DNA/RNA UD indexes イルミナ Cat#: 20027213
Nextera DNA CDインデックス Illumina Cat#: 20018708
MiSeq 試薬キット v2 イルミナ Cat#:MS-102-2002
NovaSeq 6000 S4 試薬キット v1.5 イルミナ Cat#: 20028312
PhiXコントロールv3 イルミナ Cat#: FC-110-3001
Millex®-GVフィルターユニット(滅菌済み) Merck Cat#: SLGV033RS
ガスパック(BBL)ジャー Becton Dickinson Cat#: 260626
LIAISON® カルプロテクチン ダイアゾリン Cat# :318960
ラミナプリア解離キット、マウス Miltenyi Biotec Cat#: 130-097-410
寄託データ
マウス糞便メタゲノムシーケンスの生データファイル 本研究 SRA: PRJNA916364
Bacteriophage Barc2635ゲノム 本研究 GenBank: MN078104
代表的なバクテロイデス種の同定に使用したヒト関連メタゲノミクスアセンブルゲノム Pasolli et al.61 http://segatalab.cibio.unitn.it/data/Pasolli_et_al.html
代表的なバクテロイデス種の同定に使用したヒト関連メタゲノミクスアセンブルゲノム Almeida et al.62 ENA: ERP108418
代表的なバクテロイデス属の同定に使用したヒト関連メタゲノミクスアセンブルゲノム Forster et al.63 ftp://ftp.ebi.ac.uk/pub/databases/metagenomics/hgg_mags.tar.gz
外部メタゲノムシークエンスデータ: 炎症性腸疾患Multi'omicsデータベース Proctor et al.27 SRA: PRJNA389280
外部メタゲノムシークエンスデータ: ヒトマイクロバイオームプロジェクト Loyd-Price et al;
Turnbaugh et al.28 SRA: PRJNA48479,SRA:
PRJNA275349
外部メタゲノム配列データ: MetaHIT: The European Union Project on Metagenomics of the Human Intestinal Tract(ヒト腸管のメタゲノミクスに関する欧州連合プロジェクト) Qin et al.29 SRA: PRJEB2054
外部メタゲノムシーケンスデータ: 1000IBDプロジェクト:1000人の炎症性腸疾患患者のマルチオミクスデータ Imhann et al.30 EGA: EGAS00001002702
外部メタゲノムシークエンスデータ: 「新規発症クローン病における治療歴のないマイクロバイオーム(The treatment-naive microbiome in new-onset Crohn's disease)」 Gevers et al.31 SRA: PRJNA237362
外部メタゲノムシーケンスデータ: 「小児クローン病における腸内細菌叢の環境ストレス因子としての炎症、抗生物質、食事」 Lewis et al.32 SRA: SRP057027
IBDMDB のカウント表、メタデータ、MAGs とウイルス領域の配列解析 Nishiyama et al.34 ftp://ftp.genome.jp/pub/db/community/ibd-phage/
実験モデル 生物/系統
マウス C57BL/6J_SPF Envigo、イスラエル C57BL/6JOlaHsd
マウス C57BL/6J_GF 現地飼育 C57BL/6NTac
オリゴヌクレオチド
B_Frag_upaY_F-オリゴヌクレオチド
CGCTCGGACAAAGAAGGACC 本研究 N/A
B_Frag_upaY_R-オリゴヌクレオチド
ACTTCTACCCTACGACGACGA 本研究 N/A
B_Frag_PSA_Fー
TGTGTAAATGATAGGAGGCTAGGG この研究 N/A
B_Frag_PSA_M-
GGTGTTCCAAAAGACGAACGT この研究 N/A
rpsL_F-CCGAACTCTGCAATGCGTAA Ben-Assa et al.7 N/A
rpsL_R -CGCGAACCAGTACGATTGAG Ben-Assaら7 N/A
wcf_F-GGCCTCCTTCATCTCAGGTTTATCC 本研究 N/A
wcf_R-GATAATCGCGGCACCCTATGGG本研究 N/A
mpi_F-AAGAGGGCTATGTGTTTCAGGACG この試験 N/A
mpi_R-CTGCGTGCGAGCTTCTTTG この研究は該当なし
ソフトウェアとアルゴリズム
Graphpad Prism GraphPad バージョン 9.0 以上 https://www.graphpad.com
FlowJo Tree Star,Inc. https://www.flowjo.com/
PhaseFinder v1.0 Jiang et al.9 https://github.com/XiaofangJ/PhaseFinder
MetaPhlan 4 Blanco-Miguez et al.64 https://github.com/biobakery/MetaPhlAn
gtdbtk v2.0.0 Chaumeil et al.65 https://github.com/Ecogenomics/GTDBTk
Bowtie2 v2.3.5.160 Langmead et al.66 http://bowtie-bio.sourceforge.net/bowtie2/index.shtml
NCBI Graphical Sequence Viewer v3.49.0 Rangwala et al.67 https://www.ncbi.nlm.nih.gov/projects/sviewer/
MicrobiomeAnalyst v2.0 Dhariwal et al.68 https://www.microbiomeanalyst.ca/
R v4.3.1 R 開発コアチーム https://www.r-project.org/
RStudio 2023.06.1 R Studio チーム https://www.rstudio.com/
Phyloseq v1.44 (R パッケージ) McMurdie et al.69 https://joey711.github.io/phyloseq/
Vegan v2.6-4 (R パッケージ) Oksanen et al.70 https://CRAN.R-project.org/package=vegan
Maaslin2 v1.14.1(Rパッケージ) Mallick et al.71 https://huttenhower.sph.harvard.edu/maaslin/
DeSeq2 v1.40.2 (R パッケージ) Love et al.72 https://github.com/thelovelab/DESeq2
ggplot2 v3.4.3 (R パッケージ) Wickham73 https://github.com/tidyverse/ggplot2
EnhancedVolcano v1.18.0 (R パッケージ) Blighe et al.74 https://github.com/kevinblighe/EnhancedVolcano
Tidyverse v2.0.0 (R パッケージ) Wickham et al.75 https://www.tidyverse.org/
ggpubr v0.6.0 (R パッケージ) Kassambara76 https://rpkgs.datanovia.com/ggpubr/
rstatix v0.7.2 (R パッケージ) N/A https://github.com/kassambara/rstatix
ggtree v3.4.4 (R パッケージ) Yu et al.77 https://github.com/YuLab-SMU/ggtree
BBDuk, BBTools v37.50 の一部 Bushnell78 https://jgi.doe.gov/data-and-tools/bbtools/
Velvet v1.2.10 Zerbino ら 79 https://github.com/dzerbino/velvet
Velvet Optimizer v2.2.5) N/A https://github.com/tseemann/VelvetOptimiser
Prokka v1.12 Seemann80 https://github.com/tseemann/prokka
Proksee Grant 他 81 https://proksee.ca/
MAFFT オンラインサービス v7 Katoh et al.82 https://mafft.cbrc.jp/
新しいタブで表を開く
資源の有無
連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、リードコンタクトであるNaama Geva-Zatorsky博士(naamagvz@gmail.com)までお願いします。
材料の入手可能性
本試験では新規の試薬は使用しなかった。
データおよびコードの利用可能性
メタゲノムシークエンシングのデータはSRAデータベースに寄託されている(プロジェクト・アクセッション番号 SRA: PRJNA779701)。Bacteriophage Barc2635ゲノムをGenBankデータベースに寄託した(アクセッション番号GenBank: MN078104。本研究で解析した既存の一般公開されているデータセットのアクセッション番号は、Key resources tableに記載されている。
本論文で使用したすべてのソフトウェアツールは公開されており、主要リソース表に記載されている。本論文では、新たなコードは生成していないため、オリジナルのコードは報告していない。
本論文で報告されたデータを再分析するために必要な追加情報は、要求があれば主担当者から入手可能である。
実験モデルと研究参加者の詳細
細菌培養条件
B. fragilis NCTC 9343は、1N NaOHに5mg/Lのヘミン(Alfa Aesar社製)、および2.5μg/LのビタミンKを添加したBrain heart infusion(BHIS)を用い、嫌気チャンバー内で37℃の厳密に嫌気的な条件(80%N2、10%H2、10%CO2)で培養した。
動物実験
すべてのマウス実験は、地元のIACUC委員会によって承認された承認番号のプロトコールに従った: IL-151-10-21およびIL-105-06-21。
4-5週齢のGerm-Free(GF)C57BL/6マウス(オスおよびメス)をTechnionコロニーから得たものを使用した。マウスはGFケア施設に収容・維持され、餌と水が自由に与えられ、室温で12:12時間の明暗サイクルにさらされた。
ヒト化マウスは、ヒト糞便微生物叢と培養B. fragilis NCTC 9343のミックス200μlをGF C57BL/6マウスに経口投与することにより作製した。この混合物を調製するために、1人の健康なヒトドナーからのヒト糞便を滅菌PBS 1:10 w/vに懸濁した(1グラムの糞便を10mlの滅菌PBSに懸濁)。次に、108 CFUのB. fragilis NCTC 9343を1 mlの滅菌PBSに懸濁し、1 mlの糞便上清に加えた。B. fragilis NCTC 9343を、1N NaOH中の5μg/mlのヘミン(Alfa Aesar)および100%EtOH中の2.5μg/mlのビタミンK(Thermo Fisher Scientific)を添加したBrain Heart Infusion寒天プレート(BHI、BD BBLTM)上で、嫌気チャンバー中、37℃、85%N2、10%CO2、5%H2(COY)で増殖させた。これらのマウスの子孫を同居させ、無作為化し、治療前に群分けした。
B. fragilisでモノコロニー化したGnotobioticマウスは、GF C57BL/6マウスに、上記と同じ条件で増殖させたB. fragilis NCTC 9343の5x108 CFU mlを200μl経口投与することにより作製した。投与前にマウスを同居させ、無作為化し、群分けした。ヒト化マウスとモノコロナイズドマウスでの両方のガベージを1回ずつ行った。
ファージ免疫調節試験のために、GFマウスにB. fragilis NCTC 9343(200μlのバクテロイデスファージ回収培地(BPRM)培地中108 CFU)とバクテリオファージBarc2635(200μlの0.22μm濾過BPRM中109 PFU)、B. fragilisのみ(200μlのBPRM培地中108 CFU)、または対照として増殖培地を2回(0日目と2日目)経口投与した。10日目にマウスを生け贄に捧げ、細菌と免疫の表現型を測定した。
ヒト参加者
本研究のためのIBD患者のリクルートは、Rambam Health Care Campus(RHCC)で行われた。ー0052-ー17、ー0075ー09。患者は診療前に糞便サンプルを採取した。ー80℃でー℃にてー。
11人のコホートでは、4人の患者にインフリキシマブ(HR)が投与され、7人の患者にヒュミラ(HuR)が投与された。コホートには男性6人、女性5人が含まれていた。ーBMIのー中央値はー22.57、ー16.94, 29.41]であった。ー治療開始時のー年齢中央値はー36.9歳、ー [24.8, 58.4]。ー イスラエル・アラブ人2ー イスラエル・ユダヤ人。社会経済的状態に関するデータは記録されていなかった。
患者の奏効分類は、以前に記載された判定アルゴリズムによって決定された。83,84 簡単に説明すると、臨床的奏効は、治療開始後少なくとも14週間で、IBD関連症状の臨床的および/または内視鏡的改善と治療継続の決定とが相まって、主治医によって定義された。ー非奏効とはー臨床的・内視鏡的症状のー症状のーのーのーのーのーのーのーのーのーのーのーのー治療開始後14週間以上経過してーIBD治療開始後14週間以上経過してー臨床的・内視鏡的症状のーIBD治療開始後14週間以上経過ー
方法の詳細
DNA逆位領域の同定
代表的なバクテロイデス属細菌種は、以下のアプローチで選択した:Pasolli et al. 分類の割り当ては、gtdbtk v2.0.0およびGTDBリリース207を使用し、classify_wfプログラムとデフォルトパラメーターを用いて行った65。全体として、34種のBacteroidesが同定され、そのうち33種が種レベルのGTDB分類を有していた。ーGTDBのー207をー65 全体でー34種のーBacteroides属がー33種がーGTDBのー33種がーGTDBでー33種がーこれらのーこれらのーこれらのーこれらのーこれらのーこれら各ー種のー種のー種ーー ーB. fragilis株、ーPhocaeicola dorei株ーParabacteroides distasonis株。全体で39ゲノムを収録した。ゲノムに関する情報は表S1に示す。
PhaseFinder9(v1.0)を用いて、メタゲノミクスサンプル中のインバーティブル領域を同定した。PhaseFinderのデフォルトパラメータを使用した。Bacteroidales属のゲノム中の逆位反復領域を「locate」機能を使って同定し、推定逆位領域を検出した。ツールの'create'機能を使って、逆位領域の順方向と逆方向を含むデータベースを作成した。ツールの'ratio'機能を用いて、公開されているコホートのメタゲノムサンプルをデータベースにアライメントし、各領域に割り当てられた全リードのうち、逆方向のリードの比率を算出した。ペアエンド法から得られた順方向、逆方向のどちらかを支持するリードが20本未満の領域、全サンプルの平均Pe_ratioが1%未満の領域、rRNA産物のコード領域内の領域を除外することで、結果をフィルタリングした。CDおよびUC患者と健常対照のDNA配向パターンを比較するため、少なくとも一方のグループ間で10%以上の差を示した部位に注目した。各反転領域は、そのコード領域、遺伝子アノテーション、推定機能を評価するために手作業でキュレーションした。簡単に言うと、ゲノム領域はNCBI Graphical Sequence Viewer(バージョン3.47.0)を用いてオンラインで可視化された。コード配列(CDS)を含む不可逆領域は、CDS名に従ってアノテーションされた。CDSが存在しない反転領域は、反転DNA部位に近接して開始するCDSを検索した(<200∼bp)。領域内のCDS(上流4つ、下流4つ)は、その領域の機能性を評価するために使われた。rRNAおよびtRNA遺伝子を含む、あるいは近接する領域は、CDSが反転反復に近接して開始しない反転領域と同様に比較から除外した。
マウスDSS誘発炎症モデル
DSS実験では、雄マウスと雌マウスを別々に同居させた。投与前にマウスを無作為にグループ分けした(水コントロールと黄砂を別々に)。実験中、マウスが示す苦痛反応を監視するために細心の注意が払われた:体重が20%減少したマウス、無動状態のマウス、または触覚に極端に反応するマウスは実験から除外された。
ヒト化マウスの急性DSS誘発性大腸炎については、ヒト化マウスの子孫に3%DSSを9日間飲水投与し、その後5日間回復させてから犠牲にした。対照動物には蒸留水を投与した。
糞便サンプルを0、6、9、14日目(DSS投与前、投与中、投与中止後)に採取し、さらなる分析を行った。
B. fragilisにコロニー形成されたgnotobioticマウスの急性DSS誘発性大腸炎については、モノコロナイズマウスを飲料水中の3%DSSで7日間処理した。対照動物には蒸留水を投与した。0日目と7日目(DSS投与前と投与後)に糞便サンプルを採取し、さらなる分析を行った。
マウスの炎症測定
糞便上清は、1:10滅菌PBSに懸濁し、4,500xgで15分間遠心分離した後に調製した。カルプロテクチン濃度を測定するための酵素結合免疫吸着測定法(ELISA)は、Mouse S100A8/S100A9 Heterodimerキットを用いて、メーカープロトコール[R&D systems]に従って行った。マウスの体重は、同じ日時に電子秤を用いて評価した。
PSAプロモーター配向の定量的PCR
ZymoBIOMICS DNA Miniprep Kit [Zymo research]を用いて糞便サンプル(30~50 mg)からDNAを抽出した。抽出したDNAサンプル中のPSAプロモーターの「ON」/「OFF」配向は、SYBR® Green mix [Thermo Fisher Scientific]を用いた定量的ポリメラーゼ連鎖反応(qPCR)により決定した。PSA遺伝子座を標的とするプライマーは2セット設計した(図S1A-S1C)。1セット(B_Frag_upaY_F、B_Frag_upaY_R)は、プロモーター領域のすぐ下流にある最初の遺伝子である参照遺伝子upaYを標的とし、サンプル中の細菌数の代用として使用した。2番目のプライマーセット(B_Frag_PSA_F ,B_Frag_PSA_M )はプロモーター領域をターゲットとし、オリエンテーションが'ON'の時のみ産物を産生する。サンプル中のPSAの'ON'/'OFF'配向の比率は、PSAロック'ON'結果(100%'ON'配向)に対して計算された2-ΔΔCT法85を用いて計算された。
upaY遺伝子発現は、upaYプライマーを用いたRT-qPCRにより決定した。RNA は、zymoBIOMICS RNA miniprep kit [Zymo research] を用いて糞便サンプルから抽出した。DNAse処理(NEB社)後、qScript cDNA Synthesis Kit [Quantabio社]を用いてRNAからcDNAへの逆転写を行った。upaY mRNA量は、参照遺伝子としてrpsLに対するプライマー(rpsL_F、rpsL_R)を用い、SYBR® Green mix [Thermo Fisher Scientific社]を用いたqPCRで測定した。非テンプレートおよび非逆転写のコントロールも含めた。プライマー効率は、プライマーの各セットについて決定した86。特異性倍数変化試験には、2-ΔΔCT法を採用した。
マウス糞便配列決定
ZymoBIOMICS DNA Miniprep Kit [Zymo research]を用いて糞便サンプル(30-50 mg)からDNAを抽出した。サンプルはQubit蛍光分析により品質管理を行い、下流分析用のDNA濃度を決定した(ThermoFisher、Cat. Q32850)。ライブラリーは、Illumina Tagmentation DNA prep合理化ライブラリー調製プロトコルを使用し、メーカーの説明書に従って、最低50 ngのDNA出発質量とPCR濃縮を8サイクル行い、フラグメントサイズ550 bpで終了した。IDT for Illumina DNA/RNA UDインデックスおよびNextera DNA CDインデックスを使用した(Illumina IDT、Cat. 20027213; Illumina Nextera、Cat. 20018708)。
すべてのライブラリーを96-plexプールで15 pMに希釈し、100サイクルペアエンドリードMiseq V2ラン(イルミナ、Cat. MS-102-2002)でバリデートした後、Novaseq 6000でS4モード、96-plex、300サイクルペアエンドリードラン、サンプルあたり推定リード深度30 Gbp(イルミナ、Cat. 20028312)でシーケンスするために4 nMで米国に出荷した。最終ロード濃度は600pM。すべてのシーケンスランは、1% PhiXコントロールライブラリーV3(イルミナ、Cat. FC-110-3001)のスパイクインで実施した。シーケンス平均ライブラリーサイズは134,629,540.5リード[範囲:10,107,679~396,239,822]であった。
分類学的プロファイリング
mpaデータベースvJan21とmetaphlan464 v4.0.059を用いて群集プロファイリングを行った。各サンプルについて、まずbowtie266 v2.3.5.160 (flags --sam-no-hd --sam-no-sq --no-unal --very-sensitive)を用いてフォワードリードをmpaデータベースにアライメントした。次に、得られたsamファイルをmetaphlan4でデフォルトのパラメータで解析し、マージされた相対存在量表を得た。
マイクロバイオーム解析
MicrobiomeAnalyst68ウェブプラットフォームを使用して、シーケンスデータの最初の視覚的な探索を行い、その後、R v4.3.1のPhyloseq69バージョン1.44.0とvegan70バージョン2.6-4パッケージを使用して包括的な統計解析を行った。リードカウントは、サンプルあたりのリード総数に対して正規化することで、相対アバンダンスに変換した。相対存在量が0.1%に達せず、サンプルの少なくとも20%に出現しない種を廃棄するために低存在フィルターを適用した。アルファ多様性(観察された種とシャノン多様性)は、'plot_richness'関数を用いて種レベルで計算した。ベータ多様性距離行列(Aitchison距離)は'ordinate'関数を用いて順序付けし、PCoAを用いて可視化した。ベータ分散(Aitchison距離)はvegan70パッケージの'betadisper'関数を用いて計算した。プロットは、Rパッケージtidyr version 1.3.0、reshape2 version 1.4.4、ggpubr version 0.6.0、ggplot273 version 3.4.3、EnhancedVolcano version 1.18.0を用いて行った。
IBD患者の糞便濾過液中のカルプロテクチン
LIAISON calprotectin(カタログNo.318960)を用いて、各糞便サンプル中のカルプロテクチン濃度を製造者の指示に従って測定した。糞便サンプル中のカルプロテクチン値は、IBD患者の疾患活動性の指標として使用された。
IBD患者の糞便濾液を用いたin vitroアッセイ
B. fragilis NCTC 9343を、5 mg/Lのヘミン(Alfa Aesar)と2.5 μg/LのビタミンKを1 N NaOHに添加したBrain heart infusion (BHIS)でOD600〜0.6まで培養し、4,500xgで5分間遠心した。菌ペレットは滅菌PBSで2回洗浄し、BHIS成分を除去した後、1mLのM9最小培地に懸濁した。
患者の糞便サンプルを滅菌PBS(1:5)に懸濁し、4,500xgで15分間遠心し、上清を回収し、Medical Millex-VVシリンジフィルターユニット、0.22μm、PVDF膜を用いてろ過した。
In vitroアッセイでは、B. fragilisをM9と患者の糞便上清を1:25:25の割合(M9:M9:糞便上清に懸濁した菌体)で混合培養し、嫌気性チャンバー、85%N2、10%CO2、5%H2(COY)、37℃で培養した。対照として、B. fragilisをM9で増殖させ、糞便濾液の代わりに滅菌PBSを用い、同じ比率で混合した。その後、各培養液200μlを採取し、ZymoBIOMICS DNA Miniprep Kit [Zymo research]を用いてOD600〜0.6でDNA抽出を行った。PSAプロモーター配向解析のためのqPCRは、マウス実験で使用したプライマーを用いて、各患者から3テクニカルレプリケートずつ行った。
M9培地は以下のように調製した:
18.7mMNH4Cl
42.2mMNa2HPO4
22mMKH2PO4
8.5mMNaCl
サプリメント
0.1mMCaCl2.2H2O
1mMMgSO4.7H2O
0.5%グルコース
0.05%L-システイン
5g/Lヘミン
2.5mg/mlVitK1
2mg/ml鉄SO4.7H2O
5ng/mlVitB12
Nishiyamaらによるファージの差分存在量
Nishiyamaら34のIBDMDB dataestの解析によるカウント表、メタデータ、MAGとウイルス領域の配列は以下のサイトから入手した:
ftp://ftp.genome.jp/pub/db/community/ibd-phage/。
統計解析はR v4.3.1のPhyloseq69バージョン1.44.0とDESeq272バージョン1.40.2バージョン2.6-4パッケージを用いて行った。データはウイルスOTUのみを含むようにフィルタリングされ、Low-abundanceフィルターを適用して、リードカウントが10未満で、サンプルの少なくとも20%に出現しないOTUを廃棄した。リードカウントは相対存在量に正規化した。サンプルは、PhaseFinderの結果に従って、PSAプロモーター「ON」配向の比率が低い(40%未満)または高い(60%以上)に分割した。グループ間のウイルスOTUの存在量の差は、デフォルト設定のRパッケージDESeq272を用いて計算した。プロットは、Rパッケージtidyr version 1.3.0、reshape2 version 1.4.4、ggpubr version 0.6.0、ggplot2 version 3.4.3、EnhancedVolcano version 1.18.0を用いて行った。ファージと宿主の存在比は、Nishiyamaら34の宿主予測に従って、ファージ-B. fragilisとファージ-B. thetaiotaomicronのペアごとに計算した。
バクテリオファージBARC2635の単離
バクテリオファージBARC2635は下水から単離された。簡単に説明すると、バルセロナ(スペイン)の廃水処理施設(WWTP)から流入する生下水を、細菌を除去するために、低タンパク質結合性0.22μm孔径ポリエーテルスルホン(PES)メンブレンフィルター(Millex- GP, Millipore, Bedford, Massachusetts)でろ過した。単離プラークは二重寒天層法で得た87。簡単に言うと、45℃に保った2.5mlの軟質BPRM寒天を入れたチューブに、BPRMブロスで増殖させた宿主細菌の指数関数増殖期培養(OD600=0.3、約2x108 CFU / mlに相当)1mlと、ろ過した下水サンプル1mlを接種した。穏やかに混合した後、各チューブの内容物をBRPM-寒天のプレートに注ぎ、GasPak(BBL)ジャー内で37℃で培養した。18時間培養後、プラークがはっきりと確認された。
ファージ分離のため、分離したプラークを滅菌針で刺し、5mlのBRPMブロスを入れたチューブに接種した。その後、指数関数的に増殖しているB. fragilis NCTC 9343の培養液1mlをチューブに接種し、37℃で18時間培養した。培養後、培養液のアリコートをクロロホルム(1:10(v;v))で処理し、5分間激しく混合した後、16,000xgで5分間遠心分離した88。ファージ懸濁液を含む上清を、さらに低タンパク質結合0.22μm孔径ポリエーテルスルホン(PES)メンブレンフィルター(Millex-GP、Millipore、Bedford、Massachusetts)で濾過し、希釈し、プラークの均一性を確認するために前項で示したようにプレーティングした。その後、よく分化したプラークを1つ刺し、この操作を繰り返して、1x109プラーク形成単位(PFU)を超える高力価のファージ懸濁液を得た。
ファージゲノム配列決定
ファージ粒子をPEG沈殿(6,000-12,000 MW、8%)し、CsCl勾配で単離した。50mlのTM緩衝液(50mM Tris-Cl pH8.0、10mM MgCl2)に33g、41g、55gを入れ、平均152,000xgで1.5時間超遠心し、100mM Tris ph7.5、1M NaCl、1mM EDTAで一晩透析した58。ゲノムDNAは、記載されているようにフェノール-クロロホルムを用いて抽出した89。
Bacteroides phage Barc2635のイルミナシーケンスは、ハーバード大学医学部遺伝学科のBiopolymers Facilityで行われ、150 bpのペアエンドリードが得られた。アダプター配列の除去および品質トリミングは、BBTools (v 37.50)プログラムの一部であるBBDukを用いて行った。さらに、NCBIのUniVec_Coreデータベース(build 10.0)およびB. fragilis NCTC 9343ゲノム配列に対してblastnを用いてスクリーニングし、いずれかに有意なヒットを示したリードを除去した。ファージゲノムはVelvet 1.2.10を用い、Velvet Optimizer (v. 2.2.5)で決定したk値でde novoアセンブルした。ゲノムアノテーションにはProkka80 v1.12をカスタマイズし、Pfam90 version 35, TIGRFAM91 version 15, Clusters of Orthologous Genes92 (COGs, 2020 update, and PRotein K(c)lusters (PRK) portion of NCBI's Conserved Domain Database93 (refxx4) を追加利用した。ファージゲノムマップ(図S3C)はオンラインツールProksee(https://proksee.ca/、2023年1月21日アクセス)を用いて可視化した。
ウイルスOTUのマルチプルアラインメント
B.fragilis34およびバクテリオファージBarc2635に対するバクテリオファージとして同定されたウイルスOTUの全ゲノムのアラインメントおよび系統樹を、MAFFT94オンラインサービス(バージョン7)を用いて作成した。多重配列アライメントは、サイトのデフォルト設定を用いて行った。平均連鎖UPGMAガイドツリーは、オンラインMAFFT94サービスを用いて平均連鎖UPGMAで構築し、Rパッケージggtree95(バージョン3.4.4)で可視化した。
Barc2635感受性および競合アッセイ
B. fragilis NCTC 9343 ΔmpiM4443(PSAを構成的に発現する遺伝子組換え菌)およびB. fragilis NCTC 9343 ΔPSA4443(PSA生合成遺伝子座を欠損)とを、-80℃の25%グリセロールで保存したものを、1N NaOH中の5μg/mlヘミン(Alfa Aesar)および100%EtOH中の2.5μg/mlビタミンK(Thermo Fisher Scientific)を添加したBrain Heart Infusion寒天培地プレート(BHI、BD BBLTM)上で解凍し、嫌気チャンバー内、37℃、85%N2、10%CO2、5%H2(COY)で培養した。その後、菌株を最大3日間嫌気的に増殖させ、各菌株についてシングルコロニーを摘出し、5mlのBPRMに接種して一晩嫌気的に増殖させ、実験用の出発培養とした。翌日、1:10の希釈を行い、希釈培養液を対数増殖期中期まで同じ条件で培養した。
実験開始時、OD 0.5で各菌株の同程度のCFU量を確認した(ΔmpiM44 2x108、ΔPSA 2x108 )。
各菌株300μlをBarc2635に1:100の割合で感染させ、37℃で5分間インキュベートした後、4,500g×5分間の遠心分離を行い、清浄な300μlのBPRMで再懸濁し、細胞に感染しなかった遊離ファージを除去した。感染した細菌細胞を溶融したソフトトップ寒天培地3mlに加え、よく混ぜてからボトム寒天培地に流し込んだ。翌日、以下の式に従ってプラークをカウントした:
PFU/ml=プラーク数/(希釈率*感染量(ml))。
試験管内での競合アッセイ 両菌株(ΔmpiM44とΔPSA)を同じ嫌気条件下で対数増殖中期まで増殖させた。等しいCFUが確認された。
次に、細菌細胞を1:1の割合で混合し、Barc2635を1:100の割合で添加した。時点(Tp)0(実験の開始時点)とTp2(Barc2635感染から2時間後)の200μlをqPCR分析に供した。
In vivoでの競合は、等しい比率のΔmpiM44とΔpsaをC57BL/6マウスに経口投与し、細菌が定着するまで2日間待ち、その後、Tp0にBarc2635(200μlの0.22μm濾過BPRM中109PFU)を添加することにより行った。接種10日後にマウスの糞便サンプルを採取し、qPCR解析を行った。ΔmpiM44を検出するプライマーは、PSA生合成遺伝子座のwcf遺伝子をターゲットとして設計した。
ΔPSAを検出するプライマーは、mpi遺伝子をターゲットとして設計された。
腸管前膜の調製
薄層前膜の免疫表現型を調べるために、マウスの結腸を盲腸結腸接合部から肛門まで切断して摘出した。大腸組織から脂肪組織を注意深く除去し、さらにlamina propria dissociation kit(Miltenyi)を用いて、メーカーのプロトコールに従って単一細胞懸濁液調製用に処理した。
フローサイトメトリー
フローサイトメトリー解析用の細胞調製は、5mlチューブまたはU字型96ウェルプレートで行った。単一細胞をPBSで洗浄し、PBS中1:1,000のゾンビ固定可能な生存率色素(Biolegend)を用いて、室温で10分間生死染色を行い、300xgで5分間遠心し、FACSバッファーで1回洗浄した。FcRブロッキングのため、細胞を0.5μgのCD16/CD32抗体と氷上で10分間インキュベートし、洗浄ステップなしでさらに染色を進めた。細胞外マーカーは、関連する抗体パネルで氷上30分間染色し、FACSバッファーで2回洗浄した。最後の洗浄後、細胞をFoxp3 Fixation/Permeabilization working solution(Thermo社製)で暗所、4℃で16時間固定した。細胞内染色のために、細胞を1X Foxp3 permeabilization buffer(Thermo社製)を用いて製造業者のプロトコールに従って透過処理した。細胞内ブロッキングのため、2%ラット血清(Stemcell technologies社製)2μlを各ウェルに加え、室温で15分間静置した。
PSAを表面に有するモノコロニーマウス由来のB. fragilisの割合を定量するために、ファージを有するまたは有さないB. fragilisを有するモノコロニーマウスの糞便を氷冷PBS(mg/μl)に1:10で懸濁し、300xg、5分間、4℃で遠心分離した。上清をペレットから分離し、さらに4,500xg、5分間、4℃で遠心した。細菌ペレットを氷冷FACS緩衝液に再懸濁した。100μlの再懸濁した細菌を、B. fragilis PSAに対する1:1,000のウサギ抗体(抗体の調製は前述;xx doxi: 10.1128/iai.67.7.3525-3532.1999)と4℃で30分間インキュベートした。菌体を氷冷FACSバッファーで2回洗浄した後、4,500xgで5分間遠心し、ロバ抗ウサギ蛍光標識二次抗体とインキュベートした。染色工程の後、細菌を氷冷FACSバッファーで2回洗浄し、最後に500μlの氷冷PBSと1:1,000のHoechst色素に再懸濁し、FSCとSSCの閾値を1,000、対数スケールを用いてフローサイトメトリーで解析した。ゲーティング戦略は図S5に詳述されている。PSAに対する抗体の特異性は、PSA変異体B. fragilisを用いて検証した。非特異的結合コントロールも含まれる。
定量および統計解析
各実験の具体的なサンプルサイズ(n)は図の凡例に、統計検定およびp値の定義は図または図の凡例に示した。ウィルコクソン順位和検定は、CDおよびUC患者と健常対照者のDNA反転領域の配向パターンを比較するために用い、多重比較の補正にはBenjamini-Hochberg法を用い、偽発見率(FDR)は0.1未満とした。メタゲノミクスサンプルについては、α多様性(観察された種とシャノン多様性)をクラスカル・ワリス順位和検定で比較した。β多様性距離行列(Aitchison距離)は、Vegan70パッケージの「adonis」関数(Permutational Multivariate Analysis of Variance)を用いて比較した。マウス群間およびタイムポイント間の種の存在量の差は、RパッケージMaaslin2,71バージョン1.14.1を用いて、データをCLR変換し、FDR(BH)を0.05未満に設定して計算した。Nishiyama et al.34のウイルスOTUの存在量の差は、RパッケージDESeq264を用いて、デフォルト設定でFDR(BH)を0.05未満に設定して計算した。
謝辞
有意義な議論と貢献をいただいたGeva-Zatorsky研究室のメンバーに感謝する。qPCR法の確立に協力してくれたZachary MerensteinとNeekoo Farahmandpour、バクテリオファージの特性解析について助言してくれたSvetlana Friedman博士、Ran Tahan、Debbie Lindell教授、洞察に満ちた議論をしてくれたCarolina Tropini博士とHMB CIFARグループに感謝する。Amir Grau博士、Ofer Shenker博士、およびフローサイトメトリーでお世話になったTechnion Rappaport Faculty of Medicineのバイオメディカルコア施設、メタゲノミクスのシーケンスでお世話になったBiotaX labs、およびデータへのアクセスでお世話になった京都大学化学研究所の緒方教授と西山博士に感謝する。図3AはBioRender.comで作成した。本研究は、テクニオン工科大学、"Keren haNasi"、Cathedra、Rappaport Technion Integrated Cancer Center、Alon Fellowship for Outstanding Young Researchers、イスラエル科学財団(助成金1571/17および3165/20)、D. Dan and Betty Kahn Foundationから助成を受けた。Dan and Betty Kahn Foundationによるミシガン大学への寄付、ワイツマン研究所、テクニオン-イスラエル工科大学共同研究、イスラエルがん研究基金研究キャリア開発賞、Seerave Foundation、CIFAR(アズリエリ・グローバル奨学生、助成金FL-000969/FL-001245/FL-001381)、ヒューマン・フロンティア・サイエンス・プログラム・キャリア開発賞(助成金CDA00025/2019-C)、Gutwirth Foundation賞、欧州連合(ERC, ExtractABact, 101078712)。ただし、表明された見解および意見は著者個人のものであり、必ずしも欧州連合または欧州研究会議執行機関の見解を反映するものではない。欧州連合(EU)および助成機関は、これらについて責任を負うことはできない。N.G.-Z.はCIFARフェロー、Kavliフェロー、Horevフェロー(Taub財団)。M.J.C.とL.E.C.はDuchossois Family Instituteの支援を受けている。S.C.はGutwirth Excellence ScholarshipとイスラエルのNational Forum for BioInnovators (NFBI)の一部としてTeva Pharmaceutical Industriesの支援を受けている。H.H.はLeonard and Diane Sherman Interdisciplinary Graduate Schoolのフェローシップ、MD/PhD Medical Scientist ProgramのためのWjuniski Fellowship Fund、アラブ共同体からの優秀な博士課程学生のためのVATAT Fellowshipの支援を受けている。
著者貢献
S.C.、R.Z.、H.H.、D.K.-K.、T.G.、N.G.-Z.がプロジェクトの構想および設計を行った。S.C.、H.H.、R.Z.、D.K.-K.、T.G.、実験の実施と解析。S.C.、I.S.、N.G.-Z.は、計算および解析面の計画・設計を行った。S.C.とI.S.は計算解析を行った。M.J.C.とL.E.C.は計算解析、ファージの配列決定と解析、結果の解釈に貢献した。S.P.とY.C.は臨床試験のデザイン、指導、実施に貢献した。K.L.J.はファージ-宿主菌研究およびバクテリオファージの形態学的特徴解析に貢献した。J.J.はバクテリオファージを単離した。N.M.、R.N.、N.B.-A.は実験に協力した。原稿はS.C.、R.Z.、H.H.、T.G.、I.S.、L.E.C.、N.G.-Z.が執筆した。S.C.、R.Z.、H.H.、D.K.-K.は本研究に等しく貢献した。著者全員が原稿を読み、承認した。N.G.-Z.は本研究の構想・計画、監督、実験の解釈、原稿執筆を行った。
利害関係
著者らは競合する利益はないと宣言している。
補足情報
pdfをダウンロード (2.17 MB)
pdfファイルのヘルプ
ドキュメントS1. 図S1-S5
ダウンロード .xlsx (.17 MB)
xlsxファイルのヘルプ
表S1. 図1に関連するヒトのデータセットにおける位相変動
ダウンロード .xlsx (.1 MB)
xlsxファイルのヘルプ
表S2. 図2に関連するマウスモデルの位相変動
ダウンロード .xlsx (.04 MB)
xlsxファイルのヘルプ
表S3. 図3に関連する西山らのタイトルファージの差分存在量
参考文献
モクソン R.
ベイリス C.
フード D.
細菌の偶発遺伝子座:細菌の適応における単純配列DNA反復の役割。
Annu. Rev. Genet. 2006; 40: 307-333
論文で見る
スコープス(315)
PubMed
クロス
グーグル奨学生
フィリップスZ.N.
トラムG.
セイブ・K.L.
アタックJ.M.
相変化する細菌の遺伝子座:変化する環境において、細菌はどのようにギャンブルでフィットネスを最大化するのか?
Biochem. Soc. Trans. 2019; 47: 1131-1141
論文で見る
スコープス (40)
PubMed
クロス
グーグル奨学生
ウェスト P.T.
チャニン R.B.
バット A.S.
ゲノム構造から機能へ:微生物学における構造変異への洞察。
Curr. Opin. Microbiol. 2022; 69: 102192
論文で見る
スコープス (4)
PubMed
クロス
グーグル奨学生
ゴールドバーグA.
フリドマンO.
ローニン I.
バラバン N.Q.
常在性および病原性大腸菌における位相変異の系統的同定と定量化。
Genome Med. 2014; 6: 112
論文で見る
スコープス (9)
PubMed
クロスリファレンス
グーグル奨学生
クリノス C.M.
コイン M.J.
ワイナハトK.G.
ツィアナボス A.O.
カスパー D.L.
コムストック L.E.
DNAの多重反転による常在微生物の広範な表面多様性。
Nature. 2001; 414: 555-558
論文で見る
スコープス(239)
PubMed
クロス
グーグル奨学生
ヴァン・デル・ウーデ M.W.
バウムラーA.J.
細菌の相変化と抗原変異。
Clin. Microbiol. Rev. 2004; 17: 581
論文で見る
スコープス (546)
PubMed
クロス
グーグル奨学生
ベン-アサN.
コイン M.J.
フォメンコフA.
リブニーJ.
ロビンズ W.P.
ムニエサ M.
キャリー V.
カラッソ S.
ゲフェン T.
ジョフレJ.
他。
ヒト腸内共生細菌バクテロイデス・フラジリスの相変化制限修飾系の解析。
Nucleic Acids Res.
論文で見る
スコープス (4)
PubMed
クロス
グーグル奨学生
ポーター N.T.
グリコウィアンA.J.
メリルB.D.
フエンテス J.J.
ガードナー J.O.
グロワッキ R.W.P.
シン S.
クロフォード R.D.
スニトキン E.S.
ソネンバーグJ.L.
マルテンス E.C.
相変化性莢膜多糖とリポタンパク質がバクテロイデス・テタイオタミクロンのバクテリオファージ感受性を修飾する。
Nat. Microbiol. 2020; 5: 1170-1181
論文で見る
スコープス (55)
パブコメ
クロス
グーグル奨学生
江 X.
ホール A.B.
アーサー T.D.
プリクタ D.R.
コビントン C.T.
ポイエット M.
クロサーズ J.
モーゼス P.L.
トロネン A.C.
ヴラマキスH.
他。
腸内細菌の相変化、抗生物質耐性、宿主適応を仲介する不可逆的プロモーター。
Science. 2019; 363: 181-187
論文で見る
スコープス (59)
PubMed
クロス
グーグル奨学生
マズマニアン S.K.
ラウンドJ.L.
カスパー D.L.
微生物共生因子が腸炎症性疾患を予防する。
Nature. 2008; 453: 620-625
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
スラナ N.K.
カスパー D.L.
細菌多糖の陰陽:B. fragilis PSAから学んだ教訓。
Immunol. 2012; 245: 13-26
論文で見る
スコープス (116)
PubMed
クロス
グーグル奨学生
ダスグプタ S.
エルトゥルク・ハスデミルD.
オチョア-レパラズJ.
ライネッカー H.C.
カスパー D.L.
形質細胞様樹状細胞は、腸内常在分子に対する抗炎症応答を、生得的および適応的メカニズムによって媒介する。
Cell Host Microbe. 2014; 15: 413-423
論文で見る
スコープス (216)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ラウンドJ.L.
マズマニアン S.K.
腸内常在細菌による誘導性Foxp3+制御性T細胞発生。
Proc. Natl. Acad. Sci. USA. 2010; 107: 12204-12209
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
チャン Y.C.
チン Y.H.
Chiu C.C.
リウ J.Y.
Hung S.W.
ホアン・W.C.
Te Huang Y.T.
Chuang H.L.
バクテロイデス・フラギリス(Bacteroides fragilis)によるDSS誘発性大腸炎の予防には、TLR2とインターロイキン10が関与している。
PLoS One. 2017; 12: e0180025
論文で見る
PubMed
グーグル奨学生
キャンベル D.E.
Ly L.K.
リドロンJ.M.
シャオ A.
ウィテカー R.J.
デグナン P.H.
バクテロイデスファージBV01の感染により、ヒト共通の腸内微生物における宿主のトランスクリプトームと胆汁酸代謝が変化する。
Cell Rep.
論文で見る
スコパス (26)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Hryckowian A.J.
メリルB.D.
ポーター N.T.
ヴァン・トレレンW.
ネルソン E.J.
ガーレナ R.A.
ラッセル D.A.
マーテンス E.C.
ソネンバーグ J.L.
バクテロイデス・テタイオタオミクロンに感染するバクテリオファージの分離株から、塩基配列に基づく宿主範囲の予測を得た。
Cell Host Microbe. 2020; 28: 371-379.e5
論文で見る
日本農芸化学会誌
PubMed
要旨
全文
全文PDF
グーグル奨学生
シュコポロフ A.N.
ホクロワ E.V.
スティーブンス N.
ヒュストンC.
シーモア S.
Hryckowian A.J.
ショルツ D.
ロス R.P.
ヒル C.
Bacteroides intestinalisにおけるcrAss様ファージcrAss001の長期持続性と相変異。
BMC Biol.
論文で見る
スコパス (27)
PubMed
クロス
グーグル奨学生
ラモス G.P.
パパダキスK.A.
疾患のメカニズム:炎症性腸疾患。
Mayo Clin. Proc. 2019; 94: 155-165
論文で見る
スコープス (483)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Guan Q.
炎症性腸疾患の病態に関する包括的レビューと最新情報。
J. Immunol. Res. 2019; 2019: 7247238
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
コリドーニ D.
アルセノーK.O.
コミネッリF.
炎症性腸疾患。
Immunol. Lett: 231-235
論文で見る
スコープス (96)
PubMed
クロス
グーグル奨学生
ハ C.W.Y.
マーティン A.
セピック-プーアG.D.
Shi B.
ワン Y.
グアン K.
ハンフリー G.
サンダース K.
ラトナヤケ Y.
チャン K.S.L.
ら。
腸内細菌叢の腸間膜脂肪への移行は、ヒトにおけるクリーピングファットの形成を促進する。
Cell. 2020; 183: 666-683.e17
論文で見る
日本学術振興会特別研究員
PubMed
要旨
全文
全文PDF
グーグル奨学生
リー M.
チャン E.B.
炎症性腸疾患(IBD)とマイクロバイオーム-犯行現場から手がかりを探る。
Gastroenterology. 2021; 160: 524-537
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
ボラムD.N.
コロパトキン N.M.
バクテロイデーテスのSus様システムによる糖鎖認識。
Curr. Opin. Struct. 2012; 22: 563-569
論文で見る
スコープス (48)
PubMed
クロス
グーグル奨学生
Kulagina E.V.
エフィモフB.A.
マキシモフP.Y.
カファルスカイアL.I.
チャップリンA.V.
シュコポロフ A.N.
様々な年齢の健康な人々の糞便中のバクテロイデス目細菌の種構成。
Biosci. Biotechnol. Biochem. 2012; 76: 169-171
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
クラールL.
アブバッカーS.
コタ K.
フィッシュバッハ M.A.
ミトレヴァ M.
ヒトマイクロバイオームにおける菌種と菌株の有病率: 実験的努力のためのリソース。
PLoS One. 2014; 9e97279
論文で見る
スコープス (73)
クロスリファレンス
グーグル奨学生
野村紘一
石川大介
岡原一彦
伊藤 聡
芳賀和彦
高橋正明
荒川 A.
渋谷 崇
長田哲也
桑原・新井和彦
他
潰瘍性大腸炎におけるバクテロイデーテス属細菌と疾患活動性との相関.
J. Clin. Med. 2021; 10: 1749
論文で見る
スコープス(52)
PubMed
クロス
グーグル奨学生
統合HMP(iHMP)研究ネットワークコンソーシアム
統合ヒトマイクロバイオームプロジェクト
Nature. 2019; 569: 641-648
論文で見る
スコープス (635)
PubMed
クロス
グーグル奨学生
ターンボー P.J.
レイ・R.E.
ハマディ M.
フレイザー・リゲットC.M.
ナイト R.
ゴードン・J.I.
ヒトマイクロバイオームプロジェクト。
Nature. 2007; 7164: 804-810
論文で見る
スコープス (4042)
クロスリファレンス
グーグル奨学生
Qin J.
Li R.
レーズ J.
アルムガム M.
ブルグドルフ K.S.
マニチャン C.
ニールセン T.
ポンズ N.
Levenez F.
Yamada T.
他。
メタゲノムシークエンシングにより確立されたヒト腸内細菌遺伝子カタログ。
Nature. 2010; 464: 59-65
論文で見る
日本学術振興会特別研究員
パブコメ
クロス
グーグル奨学生
イムハン F.
ヴァン・デル・ヴェルデK.J.
バルビエリR.
アルベルト R.
ヴォスクイル M.D.
ヴィラ A.V.
コリイ V.
スペックホルストL.M.
ヴァン・デル・スルート K.W.J.
ピータース V.
他
1000IBDプロジェクト: 炎症性腸疾患患者1000人のマルチオミクスデータ;データリリース1。
BMC Gastroenterol. 2019; 19: 5
論文で見る
スコープス (51)
PubMed
クロス
グーグル奨学生
ゲバース D.
クガタサンS.
デンソンL.A.
バスケス=バエサ Y.
Van Treuren W.
レン B.
シュワガー E.
ナイツ D.
ソン S.J.
ヤスールM.
他。
新規発症クローン病における治療歴のないマイクロバイオーム。
Cell Host Microbe. 2014; 15: 382-392
論文で見る
スコパス(2168)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ルイス J.D.
チェン E.Z.
バルダッサーノR.N.
オトリーA.R.
グリフィス A.M.
リー D.
ビッティンガーK.
ベイリー A.
フリードマン E.S.
ホフマン C.
他。
小児クローン病における腸内細菌叢の環境ストレス因子としての炎症、抗生物質、食事。
Cell Host Microbe. 2015; 18: 489-500
論文で見る
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
シャサイングB.
エイトケンJ.D.
マレシャッパM.
ビジェイ・クマール M.
マウスにおけるデキストラン硫酸ナトリウム(DSS)誘発性大腸炎。
Curr. Protoc. Immunol. 2014; 104: 15.25.1-15.25.14
論文で見る
スコープス (1193)
パブコメ
クロス
グーグル奨学生
西山博之
遠藤英明
ブラン-マチューR.
緒方英明
炎症性腸疾患罹患腸管における温帯バクテリオファージの生態学的構造化。
Microorganisms. 2020; 8: 1-15
論文で見る
スコープス (10)
クロスリファレンス
グーグル奨学生
ルパージュ P.
コロンベJ.
マルトー P.
Sime-Ngando T.
ドレ J.
Leclerc M.
炎症性腸疾患におけるディスバイオシス:バクテリオファージの役割?
Gut. 2008; 57: 424-425
論文で見る
スコパス (177)
PubMed
クロス
グーグル奨学生
ノーマンJ.M.
ハンドリー S.A.
ボールドリッジ M.T.
ドロワ L.
リュー C.Y.
ケラー B.C.
カンバル A.
モナコ C.L.
Zhao G.
フレシュナーP.
他。
炎症性腸疾患における腸内ビロームの疾患特異的変化。
Cell. 2015; 160: 447-460
論文で見る
スコープス (841)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Wang W.
ジョベル J.
ハロランB.
ワインE.
パターソン J.
フォード G.
オキーフ S.
Meng B.
Song D.
Zhang Y.
et al.
Metagenomic analysis of microbiome in colon tissue from subjects with inflammatory bowel diseases reveals interplay of viruses and bacteria.
Inflamm. Bowel Dis. 2015; 21: 1419-1427
論文で見る
PubMed
グーグル奨学生
アディリアグダムF.
アマトゥラーH.
ディグマルティS.
サンダース T.L.
ラーマン R.U.
ウォン・L.P.
サドレイエフ R.
ドロワ L.
パケット J.
ゴイエットP.
et al.
ヒト腸管ウイルスは、多様な自然免疫調節を介して炎症性腸疾患の表現型を自律的に形成する。
Sci. Immunol. 2022; 7: EABN6660
論文で見る
スコパス (27)
PubMed
クロス
グーグル奨学生
Qv L.
Mao S.
Li Y.
Zhang J.
Li L.
炎症性腸疾患の病因と治療における腸内バクテリオファージの役割。
Front. Cell. Infect. Microbiol. 2021; 11: 755650
論文で見る
スコープス (8)
パブコメ
クロス
グーグル奨学生
オギルビーL.A.
カプリンJ.
デディC.
ディストンD.
チーク E.
ボウラー L.
テイラー H.
エブドン J.
ジョーンズ B.V.
ヒト腸管特異的バクテリオファージφB124-14の比較(メタ)ゲノム解析と生態学的プロファイリング。
PLoS One. 2012; 7: e35053
論文で見る
PubMed
クロスレフ
グーグル奨学生
プイグ M.
ジロネスR.
バクテロイデス・フラジリスのファージB40-8のゲノム構造。
微生物学(読書)。1999; 145: 1661-1670
論文で見る
(0件)
PubMed
クロス
グーグル奨学生
ゲラン E.
シュコポロフ A.N.
ストックデール S.R.
コマス J.C.
ホクロワ E.V.
クルーニー A.G.
デーリー K.M.
ドレイパー L.A.
スティーブンス N.
ショルツD.
他
バクテロイデス・キシラニソルベンスに感染するヒト腸管由来crAss様ファージΦcrAss002の単離と特性解析。
Microbiome. 2021; 9: 89
論文で見る
(5)を参照。
PubMed
クロス
グーグル奨学生
チャツィダキ・リヴァニス M.
ワイナハトK.G.
コムストック L.E.
ヒト腸内共生細菌バクテロイデス・フラジリス(Bacteroides fragilis)において、遺伝子座転移阻害物質が同時多糖合成を制限している。
Proc. Natl. Acad. Sci. USA. 2010; 107: 11976-11980
論文で見る
スコープス (37)
PubMed
クロス
グーグル奨学生
コイン M.J.
ツィアナボスA.O.
マロリーB.C.
キャリー V.J.
カスパー D.L.
コムストック L.E.
Bacteroides fragilisの病原性に必要な多糖生合成遺伝子座。
Infect. Immun. 2001; 69: 4342-4350
論文で見る
(73件)
PubMed
クロス
グーグル奨学生
エルトゥルク・ハスデミルD.
オー S.F.
オカン N.A.
ステファネッティ G.
ガザニガ F.S.
ゼーバーガー P.H.
プレヴィ S.E.
カスパー D.L.
共生生物は複雑なシグナル伝達を利用して免疫系を教育する。
Proc. Natl. Sci. USA. 2019; 116: 26157-26166
論文で見る
スコープス (78)
PubMed
クロス
グーグル奨学生
ジョンソン J.L.
ジョーンズ M.B.
コブ B.A.
多糖を経験したエフェクターT細胞は、FoxP3+制御性T細胞のIL-10を誘導し、肺の炎症を予防する。
Glycobiology. 2018; 28: 50-58
論文で見る
スコープス (38)
PubMed
クロス
グーグル奨学生
テレスフォード K.M.
ヤン・W.
オチョア-レパラズJ.
パント A.
キルヒャー C.
クリスティ M.A.
ベガム=ハーク S.
カスパー D.L.
カスパー L.H.
Bacteroides fragilis由来の常在細菌共生因子は、ヒトCD39(+)Foxp3(+)T細胞とTreg機能を促進する。
Gut Microbes. 2015; 6: 234-242
論文で見る
スコープス (178)
PubMed
クロス
グーグル奨学生
ペデルセン T.K.
ブラウン E.M.
プリヒタ D.R.
ヨハンセン J.
トワードゥス S.W.
デロリー T.M.
ラウ H.
ヴラマキス H.
ムーン J.J.
ザビエル R.J.
グラハム D.B.
クローン病における常在菌由来エピトープに対するCD4+ T細胞応答は、寛容状態から炎症状態へと移行する。
Immunity. 2022; 55: 1909-1923.e6
論文で見る
スコパス (0)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
ブランドフォード L.E.
ジョンストン E.L.
サンダーソン J.D.
ウェイド W.G.
ラックス A.J.
炎症性腸疾患(IBD)患者では、免疫調節性バクテロイデス・フラジリス莢膜多糖体A(PSA)のプロモーター配向がずれている。
Gut Microbes. 2019; 10: 569-577
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
ロイド-プライスJ.
アーゼC.
アナンタクリシュナンA.N.
シルマー M.
アビラ=パチェコJ.
プーン T.W.
アンドリュース E.
アジャミ N.J.
ボナム K.S.
ブリスローンC.J.
他
炎症性腸疾患における腸内細菌生態系のマルチオミクス。
Nature. 2019; 569: 655-662
論文で見る
スコープス (1335)
PubMed
クロス
グーグル奨学生
フェデリーチ S.
クレド=ルッソS.
バルデス-マスR.
Kviatcovsky D.
ワインストック E.
マチューヒン Y.
シルバーバーグ Y.
アタラシ K.
古市美和
岡 A.
他
腸炎症治療のためのファージコンソーシアによるヒトIBD関連腸内常在菌の標的的抑制.
Cell. 2022; 185: 2879-2898.e24
論文で見る
スコパス(127)
PubMed
要旨
全文
全文PDF
グーグル奨学生
デュエルコップB.A.
クライナー M.
パエス-エスピノD.
Zhu W.
ブッシュネルB.
ハッセル B.
ウィンター S.E.
キルピデス N.C.
フーパーL.V.
マウス大腸炎が明らかにした疾患関連バクテリオファージ群集。
Nat. Microbiol. 2018; 3: 1023-1031
論文で見る
スコープス (103)
PubMed
クロス
グーグル奨学生
ウォレス K.L.
鄭 L.B.
金澤洋子
Shih D.Q.
炎症性腸疾患の免疫病理。
World J. Gastroenterol. 2014; 20: 6-21
論文で見る
スコープス (398)
PubMed
クロス
グーグル奨学生
ニュージェント S.G.
クマールD.
ランプトン D.S.
エバンス D.F.
炎症性腸疾患における腸管内腔pH:決定因子の可能性とアミノサリチル酸塩および他の薬剤による治療への影響。
Gut. 2001; 48: 571-577
論文で見る
スコパス (528)
PubMed
クロス
グーグル奨学生
ヴェルツォーニ M.
クルーリC.
Poulou A.
Goumas K.
レパスC.
クローン病が絶食状態の成人の胃内環境に及ぼす影響を探る。
ADMET DMPK. 2020; 8: 122-128
論文で見る
PubMed
クロスフィルム
グーグル奨学生
バーカス・F.
リベロプロスE.
ケイ A.
エリサフM.
炎症性腸疾患における電解質および酸塩基障害。
アン。Gastroenterol. 2013; 26: 23-28
記事で見る
パブコメ
グーグル奨学生
Tian T.
Wang Z.
Zhang J.
炎症性腸疾患における酸化ストレスの病態機序と抗酸化療法の可能性。
Oxid. Med. 細胞。Longev. 2017; 2017: 4535194
論文で見る
スコープス (400)
パブコメ
クロス
グーグル奨学生
ブルゴンジェA.R.
フィーリッシュ M.
フェイバー K.N.
パシュ A.
ダイクストラ G.
ファン・グールH.
炎症性腸疾患における酸化ストレスと酸化還元調節治療薬。
トレンドMol。Med. 2020; 26: 1034-1046
論文で見る
スコープス (145)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
トロピーニ C.
モス E.L.
メリル B.D.
ン K.M.
ヒギンボトム S.K.
カサヴァント E.P.
ゴンザレス C.G.
フレミン B.
ブーリー D.M.
イライアスJ.E.
et al.
一過性の浸透圧擾乱は腸内細菌叢に長期的な変化をもたらす。
Cell. 2018; 173: 1742-1754.e17
論文で見る
スコープス (137)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ミルマンO.
イェリン I.
キショニーR.
細菌ドメイン全体にわたる遺伝子改変プログラムされた逆位の系統的同定。
2023; 51: 553-573
論文で見る
遺伝子発現
PubMed
クロス
グーグル奨学生
パゾッリ E.
アスニカーF.
マナラ S.
ゾルフォ M.
カーチャー N.
アルマニーニ F.
ベギーニ F.
マンギ P.
テット A.
Ghensi P.
他
年齢、地理、ライフスタイルにまたがるメタゲノムから得られた15万以上のゲノムから明らかになった、未解明のヒト微生物叢の広範な多様性。
Cell. 2019; 176: 649-662.e20
論文で見る
スコープス (766)
PubMed
要旨
全文
全文PDF
グーグル奨学生
アルメイダ A.
ミッチェル A.L.
ボーランド M.
フォースター S.C.
グロールG.B.
タルコフスカA.
ローリー T.D.
フィン R.D.
ヒト腸内細菌叢の新しいゲノム設計図。
Nature. 2019; 568: 499-504
論文で見る
スコープス (711)
PubMed
クロス
グーグル奨学生
フォースター S.C.
クマール N.
アノニェB.O.
アルメイダ A.
ヴィシャニ E.
スタレス M.D.
ダン M.
ムカンダワレ T.T.
Zhu A.
シャオ Y.
他。
メタゲノム解析のためのヒト腸内細菌ゲノムと培養コレクション。
Nat. Biotechnol. 2019; 37: 186-192
論文で見る
スコープス (299)
PubMed
クロス
グーグル奨学生
ブランコ-ミゲスA.
ベギーニF.
クンボF.
マカイバー L.J.
トンプソン K.N.
ゾルフォ M.
マンギ P.
デュボア L.
ホアン・K.D.
トーマス A.M.
et al.
MetaPhlAn 4を用いた未同定種のメタゲノム分類学的プロファイリングの拡張と改善。
Nat. Biotechnol. 2023; 41: 1633-1644
論文で見る
スコープス (63)
PubMed
クロス
グーグル奨学生
ショーメイユ P.A.
ムッシグ A.J.
ヒューゲンホルツP.
パークス D.H.
GTDB-Tk v2: ゲノム分類データベースによるメモリフレンドリーな分類。
Bioinformatics. 2022; 38: 5315-5316
論文で見る
ゲノム分類データベース
パブコメ
クロス
グーグル奨学生
ラングミードB.
サルツバーグ S.L.
Bowtie 2による高速ギャップドリードアライメント。
Nat. Methods. 2012; 9: 357-359
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
ランワラ S.H.
クズネツォフA.
アナニエフV.
アシュタロス A.
ボロディン E.
エフゲニエフ V.
ジョウコフ V.
ロトフ V.
パンヌ R.
ルドネフD.
et al.
NCBI Sequence ViewerとGenome Data Viewer (GDV)を用いたNCBIデータへのアクセス。
Genome Res.
論文で見る
ゲノムデータ
PubMed
クロスリファレンス
グーグル奨学生
ダリワル A.
チョン J.
ハビブ S.
キング I.L.
アゲロン L.B.
Xia J.
MicrobiomeAnalyst: マイクロバイオームデータの包括的な統計・視覚・メタ解析のためのウェブベースツール。
Nucleic Acids Res. 2017; 45: W180-W188
論文で見る
スコープス (1074)
PubMed
Crossref
グーグル奨学生
マクマーディ P.J.
ホームズ S.
微生物センサスデータの再現性のあるインタラクティブな解析とグラフィックスのためのRパッケージ。
PLoS One. 2013; 8e61217
論文で見る
日本学術振興会特別研究員
パブコメ
クロス
グーグル奨学生
オクサネン J.
ブランシェF.G.
フレンドリーM.
キント R.
レジャンドル P.
マクグリン D.
ミンチン P.R.
オハラ R.B.
シンプソンG.L.
ソリモスP.
et al.
vegan: community Ecology Package, R package version 2.5-6.
2020
https://CRAN.R-project.org/package=vegan
記事で見る
グーグル・スカラー
マリック H.
ラーナバード A.
マカイバーL.J.
マー S.
チャン Y.
グエン L.H.
ティックル T.L.
ワインガート G.
レン B.
シュワッガー E.H.
他。
集団規模のメタオミクス研究における多変量関連発見。
PLoS Comput. 2021; 17e1009442
論文で見る
スコープス (479)
クロスリファレンス
グーグル奨学生
ラブ M.I.
フーバーW.
Anders S.
DESeq2によるRNA-seqデータのフォルドチェンジと分散のモデレート推定。
ゲノム生物学 2014; 15: 550
論文で見る
論文掲載
PubMed
クロスレビュー
グーグル奨学生
ウィッカム H.
ggplot2: データ分析のためのエレガントなグラフィックス。
シュプリンガー, 2016
論文で見る
クロスリファレンス
グーグル・スカラー
ケビン・B.
シャルミラ R.
マイルスL.
EnhancedVolcano:カラーリングとラベリングが強化された出版用の火山プロット。
https://github.com/kevinblighe/EnhancedVolcano
日付:2018年
記事で見る
グーグル・スカラー
ウィッカム H.
アヴェリック M.
ブライアンJ.
チャン・W.
マクゴーワンL.
フランソワ・R.
グローレムンド G.
ヘイズ A.
ヘンリー L.
ヘスターJ.
他
Tidyverseへようこそ。
J. Open Source Softw. 2019; 4: 1686
記事で見る
クロスレフ
グーグル・スカラー
Alboukadel K.
ggpubr: "ggplot2 "ベースの出版準備済みプロット。Rパッケージバージョン0.6.0。
https://cran.r-project.org/web/packages/ggpubr/index.html
日付:2023年
論文で見る
グーグル・スカラー
Yu G.
スミス D.K.
Zhu H.
グアン Y.
Lam T.T.Y.
ggtree: 共変量やその他の関連データを含む系統樹の可視化とアノテーションのためのRパッケージ。
Methods Ecol. Evol. 2017; 8: 28-36
論文で見る
スコープス (2247)
クロスリファレンス
グーグル・スカラー
ソースフォージ
Bushnell Brian BBMap:ショートリードアライナー、その他のバイオインフォマティックツール。
https://sourceforge.net/projects/bbmap/
日付:2014年
記事で見る
グーグル・スカラー
ゼルビーノ D.R.
バーニー E.
Velvet: de Bruijnグラフを用いたde novoショートリードアセンブリのアルゴリズム。
ゲノム研究 2008; 18: 821-829
論文で見る
ゲノムアセンブリ
PubMed
クロスリファレンス
グーグル奨学生
Seemann T.
Prokka: 迅速な原核生物ゲノムアノテーション。
Bioinformatics. 2014; 30: 2068-2069
論文で見る
筑波大学
PubMed
クロスリファレンス
グーグル奨学生
グラント J.R.
エンス E.
マリニエ E.
マンダル A.
ハーマン E.K.
チェン・C.Y.
グラハム M.
ヴァン・ドムセラーG.
Stothard P.
Proksee:細菌ゲノムの詳細な特性解析と可視化。
2023; 51: W484-W492
論文で見る
スコープス (74)
PubMed
クロスフィルム
グーグル奨学生
加藤和彦
ロゼヴィツキ J.
山田和彦
MAFFTオンラインサービス:多重配列アライメント、対話的配列選択、可視化。
概要。Bioinform. 2019; 20: 1160-1166
論文で見る
スコープス (4157)
PubMed
クロスフィルム
グーグル奨学生
ジェラシー-ヴァインバーグS.
スタロスベツキーE.
ゴジューR.
ブラット A.
マイモン N.
ゴレリック Y.
プレスマン S.
アルパート A.
バー・ヨセフH.
デュボヴィクT.
et al.
パーソナライズドネットワークフレームワークにより、疾患横断的な抗TNF反応の予測軸が明らかになった。
Cell Rep. Med. 2024; 5: 101300
論文で見る
日本
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ゴジューR.
スタロスヴェツキー E.
マイモン N.
ヴァラニア F.
バー・ヨセフH.
プレスマン S.
ヴァイスホフ R.
ゴーレン I.
ラビノウィッツ K.
ウォーターマンM.
et al.
細胞中心のメタアナリシスにより、IBD患者の生検と血液における抗TNFα非反応のベースライン予測因子が明らかになった。
Gut. 2019; 68: 604-614
論文で見る
スコープス(132)
PubMed
クロス
グーグル奨学生
リバク K.J.
シュミットゲン T.D.
リアルタイム定量PCRと2(-Delta Delta C(T))を用いた相対遺伝子発現データの解析 Method.
Methods. 2001; 25: 402-408
論文で見る
遺伝子発現
PubMed
クロス
グーグル奨学生
バスティン S.A.
ベネスV.
ギャルソンJ.A.
ヘルマンズJ.
ハゲットJ.
クビスタ M.
ミューラー R.
ノーラン T.
ファフル M.W.
シップリーG.L.
他。
MIQEガイドライン:定量的リアルタイムPCR実験の公表のための最小限の情報。
Clin. Chem. 2009; 55: 611-622
論文で見る
スコープス(11309)
PubMed
クロス
グーグル奨学生
アダムス M.H.
バクテリオファージ
インターサイエンス・パブリッシャーズ, 1959
記事で見る
クロスフィルム
グーグル・スカラー
ガルシア・アルジャロ C.
ムニエサ M.
Jofre J.
嫌気性細菌バクテロイデスのバクテリオファージの単離。
Methods Mol. Biol. 2018; 1693: 11-22
論文で見る
スコープス (3)
PubMed
クロス
グーグル奨学生
ISO/TC 147/SC 4
ISO 10705-4:2001-水質-バクテリオファージの検出と計数-第4部:バクテロイデス・フラジリスに感染するバクテリオファージの計数。
国際標準化機構, 2001
記事で見る
Google Scholar
エル・ゲバリ S.
ミストリー J.
ベイトマン A.
エディ S.R.
ルチアーニ A.
ポッター S.C.
クレシ M.
リチャードソン L.J.
サラザール G.A.
スマート A.
他。
2019年のPfamタンパク質ファミリーデータベース。
Nucleic Acids Res. 2019; 47: D427-D432
論文で見る
スコープス(3004)
PubMed
Crossref
グーグル奨学生
ハフト D.H.
セレンガットJ.D.
リヒターR.A.
ハーキンズD.
バス M.K.
ベック E.
2013年のTIGRFAMとゲノム特性。
核酸研究 2013; 41: D387-D395
論文で見る
スコープス (389)
PubMed
クロスリファレンス
グーグル奨学生
ガルペリン M.Y.
ウルフY.I.
マカロワ K.S.
ベラ・アルバレスR.V.
ランズマン D.
Koonin E.V.
COGデータベースの更新:微生物の多様性、モデル生物、広範な病原体に焦点を当てた。
核酸研究 2021; 49: D274-D281
論文で見る
スコープス (295)
PubMed
クロスリファレンス
グーグル奨学生
タツォフ R.L.
クーニンE.V.
リップマン D.J.
タンパク質ファミリーに関するゲノムの視点。
Science. 1997; 278: 631-637
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
加藤和彦
スタンドリーD.M.
MAFFTマルチプル配列アライメントソフトウェア バージョン7:パフォーマンスとユーザビリティの向上
Mol. Biol. Evol. 2013; 30: 772-780
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
Yu G.
ggtreeを用いたツリー状構造上のデータの可視化。
Curr. Protoc. Bioinformatics. 2020; 69: e96
論文で見る
スコープス (598)
PubMed
クロスリファレンス
グーグル奨学生
論文情報
出版履歴
出版 2024年2月28日
受理 受理:2024年2月6日
改訂版受理 2023年12月11日
受理:2023年12月11日 受理日:2023年4月1日
出版段階
インプレス、修正校正
識別
DOI: https://doi.org/10.1016/j.chom.2024.02.003
著作権
© 2024 The Author(s). 発行:エルゼビア社
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0)|情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図サムネイルfx1
グラフィカルアブストラクト
サムネイルgr1
図1バクテロイデス(Bacteroides)属は健康時と疾患時で反転領域の向きが異なる。
図のサムネイルgr2
図2B. fragilisのPSAプロモーターの相対的配向は炎症に影響される
図のサムネイルgr3
図3B. fragilis多糖体Aプロモーターの方向とファージとの相関の証拠
図4ファージ暴露がB.
図4ファージ暴露はPSA遺伝子座と表面PSAの発現を変化させる
図サムネイルgr5
図5バクテリオファージによるB. fragilisの相変化はTregの減少をもたらす。
表
表1本研究に含まれるメタゲノムデータセット
関連記事
広告
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
セルレポーツ・メソッド
セルレポート 物理科学
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
ヘリオン
免疫
アイサイエンス
ジュール
物質
医学
分子細胞
ニューロン
一つの地球
パターン
STARプロトコル
構造
トレンドレビュージャーナル
生化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
生態学・進化学
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理ジャーナル
生物物理学レポート
EBioMedicine
HGGアドバンス
分子植物
分子療法ファミリー
植物通信
幹細胞レポート
イノベーション
著者
論文投稿
複数ジャーナルへの投稿
STARメソッド
プレビュー - プレプリント
査読者
査読者向け情報
ニュース&イベント
ニュースルーム
細胞シンポジウム
コンソーシアムハブ
ウェビナー
ラボリンク
マルチメディア
セルプレスポッドキャスト
セルプレスビデオ
カラーリングとコミック
フィギュア360
セル画ショー
研究篇
セルプレスについて
セルプレスについて
オープンアクセス
COVIDハブ
持続可能性
インクルージョンと多様性
コンタクト
お問い合わせ
ヘルプ&サポート
採用情報
セルプレス採用情報
サイエンティフィックジョブボード
アクセス
登録する
請求
今すぐ読む
司書に推薦する
出版アラート
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
Nucleusコレクション
スナップショット・アーカイブ
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
プライバシーポリシー
ご利用条件
アクセシビリティ
本サイトのコンテンツは、あらゆる分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ Copyright © 2024 Elsevier Inc.、そのライセンサー、および寄稿者。
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
