微生物叢を介したコロニー形成抵抗性:メカニズムと制御
掲載:2022年12月20日
微生物叢を介したコロニー形成抵抗性:メカニズムと制御
rdcu.be/c10xj
グスタボ・カバレロ・フローレス、ジョセフ・M・ピカード&ガブリエル・ヌニェス
Nature Reviews Microbiology (2022)この記事を引用する
6 Altmetric
メトリクス詳細
概要
腸内や多くの上皮表面には、緻密で多様な微生物集団が生息している。微生物叢は宿主と共進化し、宿主の多くの生理的プロセスにとって有益である。これらの共生微生物の主な機能は、病原体のコロニー形成や常在病原体の過剰増殖からの保護である。正常な微生物群にディスバイオーシスが生じると、病原体の感染や有害な病原体の過剰増殖のリスクが高まります。微生物叢がもたらす防御機構は複雑で、微生物と微生物の競合的な相互作用や宿主の免疫反応の誘導などが含まれる。一方、病原体は、微生物叢が付与するコロニー形成抵抗性を覆すための複数の戦略を進化させてきた。微生物共生体が病原体のコロニー形成を制限するメカニズムを理解することは、疾病の予防や治療のための新しい治療法の開発の指針となるはずである。
Microbiota-mediated colonization resistance: mechanisms and regulation Gustavo Caballero-Flores ¹2, Joseph M. Pickard¹2 & Gabriel Núñez Ⓒ¹ Abstract 腸や多くの上皮表面には緻密で多様な微生物集団が生息している。微生物叢は、宿主と共進化し、宿主の多くの生理的プロセスにとって有益である。これらの共生微生物の主な機能は、病原体のコロニー形成や常在病原体の過剰増殖からの保護である。正常な微生物群にディスバイオーシスが生じると、病原体の感染や有害な病原体の過剰増殖のリスクが高まります。微生物叢がもたらす防御機構は複雑で、微生物と微生物の競合的な相互作用や宿主の免疫反応の誘導などが含まれる。一方、病原体は、微生物叢が付与するコロニー形成抵抗性を覆すための複数の戦略を進化させてきた。共生微生物が病原体のコロニー形成を制限するメカニズムを理解することは、疾患の予防や治療のための新しい治療法の開発につながるはずである。 哺乳類の腸内には、細菌、ウイルス、真菌、古細菌、原生動物など、宿主と共生関係を持ちながら進化してきた数兆個もの微生物が住みついている。宿主の体内に存在する微生物集団は、一般にマイクロバイオータと呼ばれる。共生微生物は、出生後すぐに哺乳類の宿主にコロニーを形成する(Box 1)。成体では、腸内真正細菌のうち、グラム陰性のPseudomonadota(旧Proteobacteria)、Bacteroidota(旧Bacteroidetes)、グラム陽性のClostridialesとLactobacillalesを含むBacillota(旧Firmicutes)が主要な門派を構成している¹。小腸と大腸、また同じ腸管内でも粘膜関連群集と管腔群では微生物群集が異なり、これは個々の細菌が必要とする栄養や代謝が異なることを反映しています。腸内では、常在菌がその地域の環境に適応し、宿主ニッチや他の共生生物との複雑な相互作用を発達させて、生存のための栄養を獲得している。さらに、微生物は互いに空間や利用可能な栄養素を奪い合い、この微生物間競争は、群集の構成を調整するだけでなく、常在微生物や外来微生物が腸に定着する能力を制限しているのである。宿主と微生物は数百万年にわたる共進化の結果、微生物相が宿主の代謝機能に貢献し、宿主は微生物に栄養と居心地の良い空間を提供するという相互依存的な共生を実現している。微生物叢は、代謝的な利点に加え、腸管上皮のバリアー、免疫恒常性、病原体のコロニー形成に対する防御を促進するいくつかの機能を宿主に提供している。20世紀初頭、Elie Metchnikoffによって、微生物叢の中のある種の有益なメンバーが有害なメンバーよりも優勢であるという考えが初めて提唱された。その後、抗生物質や無菌(GF)動物を用いた研究により、共生細菌が腸内の病原体のコロニー形成を制限する上で大きな役割を担っていることが明らかにされた。病原体の接種後、数時間で検出されるこの現象は、後に「コロニー形成抵抗性」と呼ばれるようになった10。微生物叢は、病原体の定着を制限するだけでなく、常在するが潜在的に危険な「病原体」の拡大や、プロバイオティクスなどの無害な種の定着を抑制することができる」。現在、コロニー形成抵抗性に関与するさまざまなメカニズムが知られている。その多くは、微生物細胞間の直接的な相互作用に関わるものであるが、一方で、宿主の生理機能や、腸内外の病原体のコロニー形成と増殖を制限する宿主の免疫反応を制御するものもある。本総説では、微生物叢が病原体のコロニー形成をどのように制限しているか、また病原体がコロニー形成抵抗性に対抗するために用いる戦略について、現在わかっていることを中心に解説する。直接的な機構 植民地化抵抗性の直接的な機構は、宿主を環境として競争が行われ、細菌間で行われる。細菌は、腸内(図1)および消化管外(ボックス2)の両方で、抑制性化合物を産生することで互いの増殖を直接抑制したり(生態学用語で「干渉的」競争)、資源を奪い合うことで(「利用的」競争)注2、増殖を抑制することが可能だ。腸内では、摂取した食物や粘液などの分泌物から、宿主によって利用可能な栄養資源が主に供給される。さらに、腸内に生息する他の微生物によっても栄養が供給される。空間的競合 ある種の「ニッチ」という概念、および2つの種が同じニッチを占有することはできないという考え方は、ダーウィンを含む自然科学者による観察から、数学的な概念に発展してきた¹3。本レポートでは、ニッチとは、物理的な位置と、酸素濃度や様々な栄養素の利用可能性など、生態系における種の実際の居場所を規定する多くの変数の組み合わせであると考えることができる。同じニッチを持つ2つの種が長く共存することはできないと、長い間考えられてきた。この「競争的排除」は、中性マーカーが異なるだけの2つの同一の細菌株をGFマウスに順次投与することで実証される。最初の株はニッチ全体を占有し、2番目の同じ株はコロニー形成ができなくなります¹4,15。ある系統に新たな機能的能力を付与することで、そのニッチを変化させ、かつての競争相手と共存することが可能となる。例えば、糖(グルコン酸)に対する高親和性トランスポーターを獲得したことで、似て非なる2つのEscherichia coli株が共存できるようになったという例がある¹。糖嗜好が部分的に重なる異なる自然界の大腸菌を比較することは、栄養利用が菌株間の競争において大きな要因である可能性を示唆している。Freterら1 は、腸内におけるある種の相対的な存在量は、わずか数種類の栄養素のレベルによって制御されているという「栄養ニッチ仮説」を提唱した。例えば、Klebsiella属、Citrobacter属、Clostridioides属は、より病原性の高い同属種とのコロニー形成を防ぐことができる¹9-21, 哺乳類の腸は、均質な環境ではない。哺乳類の腸内環境は均一ではなく、多くの異なる微小環境が存在し、異なる特性を持つより多くのニッチに効果的に分離しています。大腸では酸素濃度もpHも低下し、単糖やアミノ酸などの多くの栄養素が大腸に到達する前に宿主に吸収される。宿主細胞や粘液に表示される糖は、腸に沿った局所的なパッチで変化することができる22。また、宿主の炎症から生成される呼吸電子受容体が、物理的空間を異なるニッチに分割し、多様性を高めるか、さもなければ競合してしまう種や株の維持に役立つ可能性がある。このため、Freterは、栄養素の空間的不均質性を取り入れた栄養ニッチのアイデアを新たに考案した24。宿主細胞、粘液、食物粒子への細菌の付着は、腸内で細菌が生存し続けるための重要な要因である可能性がある。付着は、洗い流しを促進する場合と保持を促進する場合とで、異なる効果をもたらす可能性がある¹5,25,26. また、一部の細菌は、宿主の環境を変化させることで、独自のニッチを構築することができます。例えば、ある種の細菌は、宿主に栄養分や接着部位となる様々な糖分を生産させたり、より良いコロニー形成を可能にする特定の抗体を誘発させたりすることができるのである。栄養競合 腸内細菌叢は一般に長期間安定しており、抗生物質の投与などの大きなイベントがない限り、平衡状態に達したクライマックスコミュニティであると推定される。したがって、恒常性のある条件下では、利用可能なニッチのほとんどが満たされていると考えられ、このことがコロニー形成抵抗性の大きな要因となっている。16S rRNA遺伝子配列で定義される細菌分類は、個体間でかなり異なることがあるが、少なくとも細菌遺伝子の機能を正確に予測する我々の限られた能力からすると、存在する遺伝子機能はそれほど変動しない。このことは、ほとんどの個体で同じ機能的ニッチが満たされていることを示唆している。主な結果
Box 1 微生物叢の成熟と初期コロニー形成抵抗性 微生物叢の初期構成は、母親の感染、食事要因、分娩様式に大きく影響される158,150。帝王切開による微生物移送は、日和見感染を引き起こす病原体によるコロニー形成の増加と関連しているので、経膣分娩時の無傷の微生物叢獲得は重要だと考えられる1,58。偏性嫌気性菌が優勢な成人腸内細菌叢とは異なり、新生児や乳児の細菌叢は多様性に乏しく、多数の通性嫌気性菌を含んでいます159,160。成人と乳児の間の微生物叢組成の違いは、微生物叢の形成における栄養の重要な役割を反映しており、成人と同様の微生物叢に成熟するためには、母乳育児の停止が必要である。この移行は、母乳に含まれる単純な糖やオリゴ糖から、複雑な多糖類を豊富に含むより多様な食事への変化と一致する。乳幼児は、腸内細菌による感染症に非常にかかりやすい。このような感受性の高まりの理由は、成熟した免疫系がないことなど、多因子にわたるものと考えられています¹62。しかし、新生児の微生物叢は、宿主の年齢とは無関係に、2つの一般的な細菌性病原体によるコロニー形成を防ぐことができません¹3。コロニー形成抵抗性の欠如は、その原因として、腸内細菌が利用可能な栄養素のほとんどを捕捉し、定常状態では低レベルに保つことで、病原体の拡大を制限していると考えられる(図1)。実際、GFや抗生物質を投与したマウスでは、腸管内腔の糖やアミノ酸などの栄養素の量が増加し、それに伴ってコロニー形成抵抗性が低下する8,29,30。このことに関連して、遺伝子スクリーニングにより、微生物相による食事性アミノ酸の枯渇が、病原体Citrobacter rodentiumのコロニー形成抵抗性を支える主要因であることが明らかにされた。特に、従来飼育されていたマウスに高タンパク食を投与すると、病原体のコロニー形成が3ログも促進された。Salmonella Enterica subsp.enterica serovar Typhimuriumのような一般細菌に対する完全なコロニー形成抵抗性を達成するためには、おそらくすべてのニッチを満たす多様な微生物群集が必要である。正常な微生物叢の一部を再現し、安定的にコロニー形成する8つのマウス細菌株からなる改変Schaedler細菌叢は、S. Typhimuriumに対してほとんど抵抗性を示さなかった」。哺乳類の腸内を支配している5つの系統から12株を含むより大規模なコレクションでは、S. Typhimuriumに対する防御力が向上したが、完全な複合微生物叢の程度には至らなかった。群集から何が失われたかを明らかにするために、メタゲノム配列決定によって遺伝子含有量を調べた。12株では、従来の微生物相と比較して、呼吸関連遺伝子の減少が見られた。酸素呼吸ができる通性嫌気性菌3株を追加すると、S. Typhimuriumに対する抵抗力を完全な微生物相と同レベルまで向上させることができた。このことは、マウスのネイティブ大腸菌がS. Typhimuriumに対する防御と相関し、酸素呼吸が防御に必要であった別の研究でも観察されている。したがって、酸素あるいは嫌気性呼吸電子受容体は、S. Typhimuriumに対する抵抗性を媒介することができる制限的な資源である可能性がある。鉄、亜鉛、マンガンなどの必須金属補酵素も腸内で制限されており、新生児腸内でクロストリジウムが存在しない間は宿主によって活発に隔離される。クロストリジウムを投与すると、宿主免疫系とは無関係に病原体のコロニー形成に対する防御が回復する13。しかし、クロストリジウムの欠乏が新生児の腸管感染症に対する全般的な感受性の上昇を説明できるかどうかについては、まだ不明である。微生物叢は、免疫反応の刺激を通じて間接的に新生児の病原体に対する防御を促進することもできる。例えば、抗生物質による治療で誘発される微生物相の異常は、IL-17を介した好中球の恒常性を損なうことにより、敗血症への感受性を高める¹63。ヒトでは、周産期の抗生物質投与は早期発症の敗血症の発生率を増大させ、このことは新生児の腸および母親の膣内の乳酸菌の減少に関連していることが判明した。これらの知見と一致して、Lactobacillus属やEscherichia coliなどの新生児マイクロバイオータの細菌株は、新生児マウスを遅発性敗血症から保護するが、そのメカニズムは不明である¹65。 1つの可能性として、新生児腸内に存在する特定の細菌が、病原体を標的とする保護的IgG産生などの免疫応答を誘発することもできる¹30。この考えと一致して、母親の腸内細菌叢は、新生児を病原体や腸管系大腸菌感染から守るIgGを誘導することができます¹66。鉄と亜鉛の競合は、プロバイオティクス大腸菌Nissle株の腸内コロニー形成能力とS. Typhimuriumに対する抵抗性に寄与している34,35, Prokaryotic antimicrobial peptides 栄養素競合は確かに腸内のコミュニティ構成とコロニー形成抵抗性を決定する強力な要因である。しかし、積極的な増殖阻害や妨害が耐コロニー形成に寄与している例も多く存在する(図1)。バクテリオシンは、細菌が産生する異種ペプチドの一種で、共生細菌や病原体に対して静菌・殺菌活性を有する。競合排除の概念に基づき、標的範囲が狭く、一般に生産者に近縁の種に作用することが多い。バクテリオシンの作用機序は様々で、特定の受容体を必要とするものと、そうでないものがある。大腸菌のバクテリオシン産生株は、マウスモデルにおいて非産生株よりも高い競争力を示す。バクテリオシンは、プロバイオティクス大腸菌Nissle株が他の腸内細菌科の菌から身を守る能力にも寄与している」。バクテロイデー タ門は哺乳類の腸内に非常に多く存在し、そのメンバーは様々なタイプの分泌型抗菌タンパク質を産生することができ、通常は同じ属の中で作用する13.39. 少なくとも1つのケースでは、毒素産生菌がin vivoで感受性株を打ち負かすことが可能であった。エンテロコッカス・フェカリスおよびエンテロコッカス・フェシウムは、通常は無害な腸内細菌ですが、抗生物質耐性を獲得すると病原性となり、例えば、臨床で大きな問題となっているバンコマイシン耐性腸球菌(VRE)となることがあります1¹。バクテリオシンを産生するE. faecalis株は、おそらく先住の腸球菌を殺すことでマウスをコロニー化し、腸から病原性株を排除することができた¹2。腸内常在菌は、フェロモンと呼ばれる別の種類の分泌小ペプチドを介して病原性フェカリスも標的にすることができる¹3。

図1|コロニー形成抵抗性の直接的な機構。常在共生菌は、食事性アミノ酸(AAS)、糖、金属、O₂やNOなどの呼吸性電子受容体を消費し、病原体の必須栄養素や分子を飢餓状態にしている(左図)。上皮表面では、細菌は宿主の糖鎖を修飾し、および/またはそれを接着のための栄養分として利用し、病原体の上皮へのアクセスをブロックする新しいミクロのニッチを作り出すことができる。上皮や粘液中に付着する他の共生体も、病原体の侵入を阻止することができる。共生生物は接触によって病原体を直接殺すこともできるClostridia属の一種であるBlautia productaは、マウスのVREに抵抗し排除できる最小限の菌株群の一部として同定された。その後、そのメカニズムが分泌型バクテリオシンであることが判明し、VREだけでなく様々なグラム陽性菌の増殖を抑制することがわかった¹5。しかし、動物やヒトの無傷の微生物叢における原核生物の抗菌ペプチド(AMPS)がVREの保菌にどのように寄与しているかは、いまだ不明である。接触依存的な増殖抑制 バクテリオシンや類似の分子は、産生細胞からある程度離れて拡散することができるが、いくつかの抑制機構は、細胞-細胞間の直接的な接触を必要とする(図1)。細胞接触依存的な増殖阻害機構は、接触依存的阻害 (CDI) と呼ばれ、大腸菌で発見され、後に他のシュードモナド類でも発見された¹6,47。接触依存性阻害は、標的細胞上の特定の受容体タンパク質を必要とし、様々な阻害様式を持つ異なる毒性エフェクタードメインをコード化することが可能である。この遺伝子には通常、産生細胞を保護するために毒素を中和する免疫タンパク質が付随している¹。より精巧な接触依存性のシステムは、緑膿菌で初めて発見された¹。タイプVI分泌システム(T6SS)は、大きな多タンパク質複合体で、依存的阻害(CDI)、タイプVI分泌システム(T6SS)またはバクテリオシンやフェロモンペプチドなどの分泌分子を必要とせず、近くの細胞を「槍」で突き刺し毒性タンパク質を注入できる(中央のパネル)。酢酸、酪酸、プロピオン酸(短鎖脂肪酸(SCFAS))、インドール、1,2-プロパンジオール(1,2-PD)などの他の阻害化合物は微生物叢から分泌され、病原体の成長を阻害したり、病原因子の発現を抑制する(右パネル)。多くの共生生物は胆汁酸を脱共役化することで修飾できるが、一部の共生生物(例えばClostridium scindens)は、病原体の増殖を抑制する一次胆汁酸を二次胆汁酸に変換することが可能である。IEC(腸管上皮細胞)、受容体の略。これらのシステムは、多くのグラム陰性菌、特にPseudomonadotaとBacteroidotaに見られる50。毒性エフェクターは様々な機能を持ち、通常、同族の免疫タンパク質と一緒に発見される。また、免疫遺伝子のクラスターが単独で蓄積していることが分かっており、T6SSの攻撃から身を守ることが生体内で有益であることが示唆されている」ほか、T6SSによる殺傷から身を守るためのメカニズムも開発されている。T6SSは、ヒトやマウスの腸内におけるバクテロイデス目の種間の競争に関与し、病原性株の侵入を防ぐ役割を持ちうる 53-56。また、グラム陰性菌のT4SSとグラム陽性菌のT7SSはそれぞれ、トランスロケーションされた毒性タンパク質を介して細胞を殺すことが実証されている$7.58. このように、分泌型あるいは細胞接触型の拮抗作用は、腸内、特に限られた物理的ニッチにおける近縁種間の競争において重要な役割を担っていると考えられるが、病原体のコロニー形成抵抗性への寄与は未だ不明である。抑制性代謝産物 細菌が産生する代謝副産物は、他の腸内細菌に対して抑制活性を発揮することがある(Fig.1)。胆汁酸(BAS)は、宿主により合成され、肝臓でタウリンやグリシンに抱合され、胆嚢に貯蔵され、腸管に放出されて食事脂質の乳化と吸収を補助する。ほとんどの抱合型
一次BASは小腸で再吸収されるが、ごく一部は細菌の胆汁酸塩ヒドロラーゼによって脱共役され、遠位腸に到達し、Clostridium scindensなどの稀な細菌による7a/B-脱水素化を含むいくつかの修飾を受け、二次BASを生成する "と述べた。一次BASは芽胞の発芽を促進するが、デオキシコール酸やリトコール酸などの二次BASは、Clostridioides difficileの植物体を含む多くのグラム陽性菌の増殖を阻害する60-63。マウスおよびヒトにおいて、二次的なBAsの存在は、C. difficile感染に対する抵抗性および大腸炎の発症と関連している。同様に、7a-デヒドロキシル化活性を欠く単純化された微生物叢でコロニー形成されたgnotobioticマウスにC. scindensを投与すると、2次BA生産が部分的に回復し、C. difficile感染が制限される。逆に、抗生物質による微生物叢の選択的破壊は、C. difficileに対する感受性を高め、二次BAS65のレベルの低下と相関している。異なる臨床C. difficile分離株のリトコール酸に対する耐性レベルは、マウス感染モデルにおける疾患の重症度と正の相関がある66.67。注目すべきは、C. scindensは、検出可能なレベルの二次BASがない場合でも、C. difficile感染から保護することができ、保護のBA非依存性メカニズムを示唆することである。したがって、C. difficileおよび他の感染症に対するBASの特異的な寄与を完全に解読するためには、さらなる研究が必要である。酢酸、プロピオン酸、酪酸などの短鎖脂肪酸(SCFAS)は、植物由来の微生物発酵によって生産される Box 2 腸外でのコロニー形成耐性 腸のほか、外部環境にさらされる他の体腔や皮膚には、多様な微生物共生集団がコロニーを形成している。皮膚の最も外側の多層面である表皮の表面は、タンパク質と脂質に富む角質層からなり、毛母細胞単位と汗腺が点在している。これらの構造は、皮膚に病原体の侵入に対する保護だけでなく、微生物の生存のためのユニークな代謝ニッチを提供している167。皮膚は比較的栄養が乏しく、酸性であるにもかかわらず、数百万のバクテリア、菌類、ウイルスを抱え込み、病原体のコロニー形成や侵入を制限することができる1668。ほとんどの皮膚共生生物は共生的あるいは相互依存的であると考えられているが、黄色ブドウ球菌や表皮ブドウ球菌を含む一部の微生物は、宿主や微生物の要因によって病原性遺伝子の発現を誘導し、病原性を発揮することがあるが、まだ十分に解明されていない。他の微生物が豊富な宿主部位と同様に、皮膚共生細菌も他の細菌との競争を制限し、そのコロニー形成を促進するための戦略を発達させてきた。例えば、皮膚に多く存在するコアグラーゼ陰性ブドウ球菌(CONS)種は、バクテリオシンなどの抗菌ペプチド(AMPS)¹68170の産生を介して、病原性黄色ブドウ球菌のコロニー形成を抑制することができます。CONSの一部の株が産生するこれらのペプチドは、宿主のAMPと相乗効果を発揮して黄色ブドウ球菌の増殖を抑制することができる 170-172 皮膚細菌間の競合的相互作用には、原核生物の抗菌作用に基づかないものもある。例えば、Corynebacterium accolensは、皮膚表面のトリアシルグリセロールに作用して、日和見病原体Streptococcus pneumoniaeの増殖を抑制する抗菌性の遊離脂肪酸を放出するLiS1リパーゼを生産する73。CONSはまた、アクセサリー遺伝子レギュレーター(agr)クォーラムセンシングシステムを通じて、他のCoNS種や黄色ブドウ球菌に拮抗することができる。agrシステムは、すべてのブドウ球菌が、自己誘導ペプチド(AIP)174として知られる環状ペプチドの産生を通じて、細菌密度に応じた細胞挙動を調整するために使用されている。すべてのブドウ球菌種はagr遺伝子座を持ち、固有の刺激性AIP分子を産生するが、非認識性AIPは他の種における定足数感知活性化を阻害することができる。このようなagrクロストークのメカニズムは、皮膚内感染やアトピー性皮膚炎のモデルにおいて、黄色ブドウ球菌を抑制するために用いることができる176177。また、皮膚マイクロバイオータの一部は、ケラチノサイトのAMP産生を誘導し、病原体の侵入を抑制することで、間接的に病原体を攻撃することができる¹78。皮膚と同様に、鼻腔にも多様な微生物叢が存在し、健康な人の40%までの鼻腔に存在する黄色ブドウ球菌のような日和見病原体も含まれている。鼻腔内のCONSは、病原体のコロニー形成を制御する競合他社に対して複数の抗生物質を生産しています¹80。同様に、鼻腔に生息する別のCONSであるStaphylococcus lugdunensisは、黄色ブドウ球菌のコロニー形成を阻害する環状ペプチドlugduninを生産する。さらに、S. lugdunensisの鼻腔内保菌は、ヒトにおけるS. aureusの保菌と負の相関があることが分かっている。S. epidermidisは、黄色ブドウ球菌のバイオフィルム形成と鼻腔内定住に重要なタンパク質を分解するセリンプロテアーゼEspの産生を通じて、黄色ブドウ球菌の病原性と定着を阻害することもできる 182,183. また、ヒトの鼻腔内では、S. epidermidisとS. aureusやMoraxella catarrhalisを含むいくつかの日和見病原体の存在量に負の相関が見られ184、細菌間の競争が示唆されている。さらに、S. epidermidisは宿主のAMP産生を刺激し、S. aureusやM. catarrhalisを殺傷することができることを明らかにした84。皮膚や鼻腔におけるこれらの微生物間相互作用の生理的関連性はまだ不明であるが、これらの研究は、CONSや他の細菌が異なるメカニズムで病原体に拮抗することができることを示唆している。ほとんどの女性において、子宮頸管コミュニティはLactobacillus種によって支配されている185。乳酸菌が優勢な微生物相が、嫌気性菌の多い多様な微生物相に置き換わることは、細菌性膣炎と呼ばれる臨床症状で、いくつかの一般的な性感染症の危険因子である¹86。多様で非乳酸菌種優位の微生物叢が感染リスクを増加させるメカニズムは十分に解明されていない。乳酸を産生する乳酸菌の存在は、膣内のpHを低下させ、増殖に最適なpHが中性である尿路感染症に関連する細菌を含む病原体のコロニー形成を減少させることができます¹87。さらに、一部の乳酸菌は、H₂O₂およびAMPS188,189を産生することができます。細菌性膣炎はサイトカイン産生の増加と関連しており、病原菌の増殖を促進する可能性もあるが、いくつかの研究では炎症反応の増加は観察されなかった190。細菌性膣炎における微生物叢の異常と感染リスクの増加の関係を理解するために、さらなる研究が必要である。大腸の偏性嫌気性菌による食事性多糖類。SCFASは腸管上皮細胞(IECs)にエネルギー源を提供するが、コロニー形成抵抗性にも寄与しうる。例えば、SCFASは、マウスの腸において、病原性大腸菌、C. rodentiumおよびC. difficileの増殖を抑制し、サルモネラ菌のコロニー形成を制限する69-72。プロピオン酸を含むSCFASは、細菌膜を自由に拡散し(プロトン化された場合)、細胞内pHの恒常性を乱すことによって阻害活性を発揮する」と述べている。しかし、無傷の微生物環境からこれらの分子を特異的に除去することができないため、腸内病原体のコロニー形成に対するSCFAsの全体的な貢献は不明なままである。フコース ムチン ファイバーフリー食 ゴブレット細胞 酸素制限 -ロ 酪酸 0,0₂ 間接的メカニズム 共生生物やその産物による病原体の定着の直接阻害に加えて、腸内病原体の侵入や拡大を制限する間接的な防御メカニズムも存在する(図2)。これらには、病原体のコロニー形成を制限するために腸内細菌叢によって誘導または維持される粘液層や酸素濃度勾配、自然免疫反応や適応免疫反応が含まれる。粘膜バリアー 粘液層は、病原体とその下の上皮との相互作用を制限する物理的バリアを形成している(Fig.2)。C. rodentium、サルモネラ菌、一部の病原性大腸菌などの病原体は、図2.コロニー形成抵抗性の間接的メカニズム 粘液層が病原体の腸管上皮へのアクセスを制限している(左図)。微生物が宿主のフコシル化を刺激することで病原体から身を守る。一方、特定の共生生物(Bacteroides thetaiotaomicronなど)は粘液層からL-フコースを放出し、Citrobacter rodentium、病原性大腸菌およびEnterococcus faecalisの病原性遺伝子発現を抑制している。繊維不足は、粘液層を侵食する粘液分解共生細菌の増加をもたらし、C. rodentiumが上皮に早期にアクセスすることを促進する。クロストリジウムは酪酸を産生し、腸管上皮細胞(IEC)の好気性呼吸を促進し、腸内の酸素濃度を下げ、通性嫌気性病原体の拡大を抑制する(中央のパネル)。微生物関連分子パターン(MAMP)はIECとパネス細胞のToll様受容体(TLR)とNOD様受容体(図示せず)を刺激し、共生細菌と病原菌を標的とする抗菌ペプチド(AMP)の産生につながる(右図)。同様に、微生物叢はMAMPS o Con Fe LCN2 微生物叢が介在する免疫反応を促進する DC 阻害された病原体 ... AMPS Bb. dobbed Hoolabab Paneth cell O IL-22 IL-17 IL-23 Succinate IL-13 ILC3 Glycan IgGSystemic sigA プラズマ細胞 B細胞 SFB T,17 cell Macrophage Neutrophil lipocalin 2 (LCN2) 生産 IECにおける鉄に対する病原体のアクセスを限定している。共生細菌は、3型自然リンパ球(ILC3s)によるIL-22産生を刺激し、AMP産生と、Clostridioides difficileとコハク酸を競合する共生細菌のグリコシル化依存性拡大を制御している。共生菌はまた、常在マクロファージによるpro-IL-1ǩの産生を促進し、Salmonella Enterica subsp. 共生細菌は、腸管病原体(S. Typhimurium、病原性大腸菌、病原性Candida albicansなど)の抗原を認識できる多反応性分泌性IgA(sIgA)の産生を誘導する。slgAは、特定の共生細菌の増殖を制限または促進することもある。微生物によって誘導されたIgGは、主に全身性の部位で病原体に対する防御を行う。分節化糸状菌(SFB)は、Tヘルパー17(T17)細胞およびILC3によるIL-17およびIL-22産生を誘導し、好中球の動員および病原体の制御を促進する。DC, 樹状細胞。
は、その病原性プログラムの開始と効果的なコロニー形成のために、腸管上皮への付着が必要である。GF動物の粘液層は通常飼育のマウスよりも薄いため74,75、共生微生物が粘膜バリアを強化することで病原体のコロニー形成を制限している可能性がある。腸管粘液の主要構成成分であるムチン2を欠くマウスは、C. rodentium、S. Typhimurium、Listeria monocytogenesに感染すると、病原体負荷と疾患の重症度が増加する76-78。同様に、単純な細菌コンソーシアムを保有するgnotobioticマウスに繊維フリー食を投与して粘液層を薄くすると、C. rodentiumのコロニー形成と上皮浸潤が促進される。しかし、従来のファイバーフリー食を与えたマウスでは、病原体のコロニー形成の増加はごくわずかで、一時的なものであった。これらの結果は、粘液層が破壊された状態で粘液バリア機能とコロニー形成抵抗性を促進するためには、多様な微生物相が重要であることを示唆している。また、恒常的な条件下では、腸内細菌叢は粘液層やIECsの表面から化合物を放出し、病原体のコロニー形成に影響を与える(Fig.2)。例えば、IECから排出されたフコシル化タンパク質は、腸内細菌によって代謝されてL-フコースを放出し、病原体の病原性を低下させてC.rodentiumに対する感受性を低下させることができる22。一方、抗生物質による微生物叢の破壊は、微生物叢に依存した粘液層からの炭水化物の放出を誘発し、病原菌の増殖の燃料となりうる。例えば、Bacteroides thetaiotaomicronはムチン分解酵素を導入してシアル酸を放出し、代謝する。このシアル酸はC. difficileやS. Typhimuriumによって直接利用され、腸内での自らの増殖をサポートすることができる。このように、微生物相はさまざまなメカニズムで粘液層やIECsから特定の糖の放出を促進することにより、病原体のコロニー形成を抑制したり促進したりする。酸素制限 腸内細菌叢は、腸内環境の変化を促し、腸内病原体や病原菌に対するコロニー形成抵抗性に間接的につながる。この効果の明確な例として、病原性通性嫌気性菌の増殖を抑えるために、共生細菌が腸内低酸素状態を確立し維持することが挙げられる(図2)。例えば、Clostridia属細菌はSCFAである酪酸を生産し、β酸化によりIECの好気性呼吸を促進し、上皮表面の酸素濃度を低下させる82.83. 従って、クロストリジウムが減少すると腸内の酸素濃度が上昇し、S. Typhimurium の好気性増殖が促進される82.54. 同様に、腸の炎症と腸内細菌の異常は、しばしば酪酸と酪酸生産者の減少と同時に起こり、内腔酸素を増加させ、病原性通性嫌気性菌の増殖を促す。共生する通性嫌気性菌は、腸内の残存酸素を奪い合ったり、封鎖したりすることでパスオジェンのコロニー形成を制限し、Shigella flexneriの酸素依存性病原性遺伝子発現やC. rodentium, S. enterica subsp.enterica serovar Enteritidis $788の好気呼吸を損なわせることが可能である。また、Mucispirillum schaedleriなどの他の共生生物も、酸素がない状態で硝酸塩などの嫌気性呼吸基質を奪い合い、炎症を起こした腸内で硝酸塩呼吸に依存して増殖する大腸菌やS. Typhimuriumの増殖を制限することができる9-91. 抗菌ペプチドとタンパク質 微生物相は宿主の上皮細胞を刺激して、共生生物や病原体を標的とする様々なAMPを産生することができる(図2)。これらの阻害化合物は正電荷を帯びており、細菌表面の負電荷と相互作用することで細菌膜を破壊する」。RegllißとRegillyはパネス細胞の顆粒に含まれるAMPSで、腸管内腔に放出され、IECから共生細菌の空間的分離を促進する93.94. ReglIIßとRelllyの産生が損なわれると、動物モデルで様々な腸管病原体への感染感受性が上昇する9596。例えば、抗生物質投与による微生物叢の枯渇は、Reglllyの腸内発現を低下させ、VREの制御障害をもたらす。一方、Toll様受容体7(TLR7)の合成リガンドであるresiquimod(R848)の刺激は、抗生物質投与マウスにおいて腸内のRegilly発現を回復しVREの除菌を促進させた。同様に、受容体相互作用型セリン・スレオニン・プロテインキナーゼ2(RIPK2)を介したNOD1/2シグナルは、感染初期にRegIIIß産生の刺激を通じてC. rodentiumのコロニー形成を制限する」。微生物由来のペプチドグリカンによるNOD2刺激は、パネス細胞が産生する別の種類のAMPSであるクリプトジンの発現も誘導し、マウスにおけるL. monocytogenesのクリアランスを促進する100。AMPは、病原体に対する直接的な活性に加え、腸内細菌叢の組成や存在量も調節しており¹、コロニー形成抵抗性にも影響を及ぼす可能性があります。リポカリン2(LCN2)も重要な抗菌タンパク質で、エンテロバクチンなどの細菌の鉄捕捉性シデロフォアを封じ込め、病原菌の鉄獲得を防ぐ¹02。LCN2 の発現は炎症時に誘導され、腸内細菌叢の存在に依存する103,104。LCN2欠損マウスでは、野生型と比較して、エンテロバクチン発現量が増加し、腸内細菌の構成が異なることから、LCN2が微生物叢の構成を制御する役割も有していることが示唆されている103,104。LCN2と同様に、カルプロテクチン(炎症時に好中球やIECから放出されるタンパク質)は、鉄、亜鉛、カルシウム、マンガンなどの必須二価金属を封鎖することで病原体に対して抗菌活性を発揮する¹0s。しかし、腸内細菌叢がカルプロテクチンの発現や放出に影響を与え、病原体に対するコロニー形成抵抗性を付与しているかどうかは、まだ不明である。したがって、腸内細菌叢は、さまざまなメカニズムで病原体を直接抑制する宿主AMPSやタンパク質の産生と制御に重要な役割を担っていると考えられる。また、これらの分子は、腸内細菌叢を修飾し、その結果、コロニー形成抵抗性効果を発揮することもできる。サイトカイン いくつかのサイトカインは微生物叢によって誘導され、腸内病原体に対するコロニー形成抵抗性において保護的な役割を果たすことができる(図2)。例えば、IL-22の誘導は、セグメント化された糸状菌(SFB)の存在とC. rodentium感染に対する抵抗性の増大と関連している106。同様に、マウス腸管の持続的かつ無症候性コロニー形成者であるマウスノロウイルスを接種すると、同様にIL-22依存的にC. rodentium感染から若いマウスを保護する107,108。IL-22は、腸管バリア機能を促進し腸内細菌組成を変化させることによって病原体に作用するが0N_2079-1、C. difficileに対する保護にも貢献しうる。例えば、適応免疫を持たないGFマウスにヒトの微生物叢をコロニー形成すると、腸内でIL-22の産生が誘導され、宿主の糖鎖形成の変化と、コハク酸についてC. difficileと競合するPhascolarctobacterium種の増殖を促進します1¹2。注目すべきは、IL-22はS. Typhimuriumの腸内コロニー形成に対する防御を与えず、この病原体に腸内共生細菌に対する優位性を与える可能性さえあることである。同様に、SFB のコロニー形成は、IL-22 とは無関係に、おそらくウイルスの感染性および/または IECs¹5 での活性を直接変えることによって、腸でのネズミのロタウイルス感染を制限している。このように、病原体のコロニー形成に対する保護におけるIL-22の役割は、普遍的なものではありません。腸内細菌叢は、マクロファージのIL-13産生を誘導し、マクロファージがS. TyphimuriumやP. aeruginosaに対してより迅速に反応するように仕向けます。同様に、GFと抗生物質で治療したマウスにバクテロイ ド菌群を接種すると、IL-36シグナルを介してKlebsiella pneumoniaeから保護されます。酪酸産生菌は、IL-10シグナルを介してタイトジャンクションタンパク質の発現を調節することにより、病原体のコロニー形成を制限することもできる3.18. したがって、微生物叢によって誘導される様々なサイトカインは、複数のメカニズムを通じてコロニー形成抵抗性に貢献することができる。適応免疫 病原体除去に寄与する免疫グロブリンの産生も、腸内細菌叢の影響を受ける
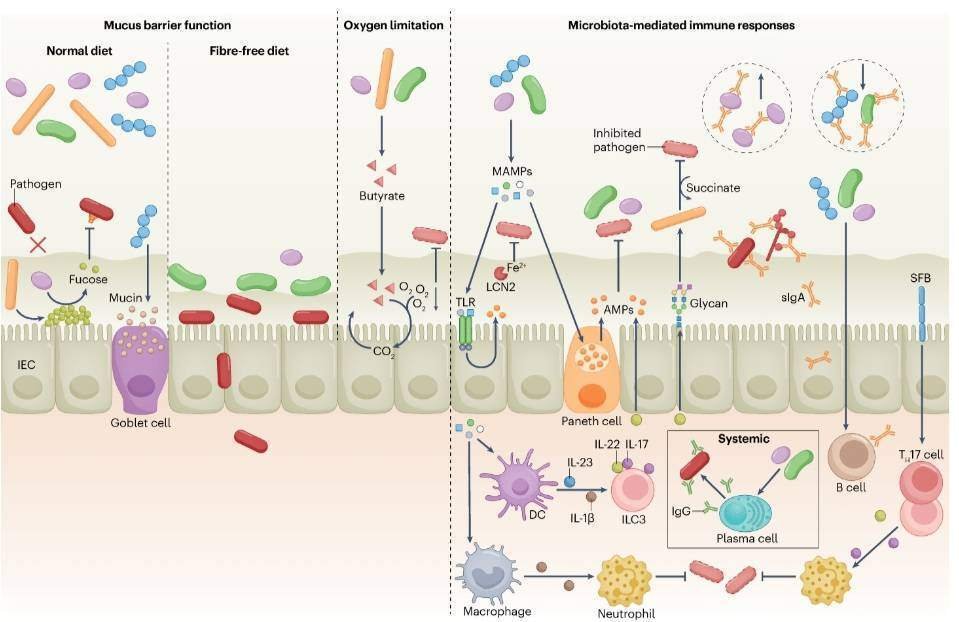
(Fig.2)。例えば、ある種の細菌共生体は、腸内病原体を含む他の細菌種が発現する抗原と交差反応することができる、多反応性低親和性IgA抗体の産生を誘導する19-121。したがって、腸内共生細菌の大部分はIgA抗体で被覆されている120,122。注目すべきは、ヒトの乳または初乳由来の恒常性分泌型IgAが、IgA関連糖鎖に依存した形でGF新生豚の壊死性大腸菌感染に対して防御的であり、種を超えて分泌型IgAの多面性と防御効果が強調されていることである。粘膜抗体反応は腸内細菌叢の組成を形成することもできるが、このことが腸内病原体に対するコロニー形成抵抗性にどの程度影響するかはまだ議論の余地があり、ほとんど未解明である。例えば、S. Typhimuriumに対する恒常的なIgA反応性のレベルは、一般的に使用されている近交系マウス系統間で異なっており、これは病原体曝露後の生存率の差と相関している¹24。一方、IgA や IgM を腸管内に輸送できない高分子免疫グロブリン受容体を欠くマウスでは、異なる研究において S. Typhimurium 感染に対する感受性が上昇または低下していた125, 126. これらの相違の理由は不明であるが、マウスによって微生物叢の構成や関連する免疫グロブリンのレパートリーが異なることによって説明されるかもしれない。通常、抗体結合は病原体に対する排除機能を持つが、IgAはヒトの共生生物であるBacteroides fragilisの生存をモノコロナイズドマウスで促進することができる¹5。同様に、健常者とIgA欠損者のIgA結合腸内細菌をメタゲノム解析したところ、IgA欠損に伴う有益な共生生物の減少が予想されました¹27。さらに、IgAは、マウスおよびヒトの両方において、病原性のある形態型を標的として抑制することにより、宿主と病原性のある菌類共生体との間の相互作用を促進することがわかった¹28。これらの研究により、IgAは、有益な共生生物の拡大を促進し、それらを好ましいニッチに保持し、あるいは阻害分子による殺傷を防ぐことによって、病原体のコロニー形成を制限していることが示唆された。
また、腸内細菌叢のメンバーによって誘導された血清IgAおよびIgGは、マウスにおける全身感染から身を守ることができる¹29,30。特に、粘膜免疫に特化した古代の免疫グロブリンクラスである分泌型IgTが枯渇すると、ニジマスでは鰓の微生物叢が異常になり、粘膜寄生虫感染に対する抵抗力が損なわれます。このことから、微生物叢に対する定常的な抗体反応は脊椎動物の進化の初期に出現し、様々なタイプの感染症に対する宿主の防御に貢献していることが示唆される。病原体のコロニー形成抵抗性の回避 成功した病原体は、コロニー形成抵抗性を克服するために複数の戦略を進化させた。これらは、病原体の毒性プログラムを用いて腸内環境を自分たちに適したものに変えたり、微生物叢が課す栄養上の制限を克服したりすることが多い(図3)。コロニー形成抵抗性に対抗するための病原体の病原性の重要性は、C. rodentiumの主要な病原性プログラムが、通常飼育マウスでは腸内コロニー形成に必須であるが、GFマウスでは必須ではない、という観察により明らかにされている¹32。病原体が腸に侵入した後、いつ、どこで病原性遺伝子を発現させるかは、複数の環境シグナルが統合されて決定される。微生物叢はこれらのシグナルの一部を修正することができ、SCFAS34-136、インドール¹37、1,2-プロパンジオール¹38などの細菌産物も病原性遺伝子の発現を制御することが可能であると考えられる。病原性因子によるニッチ構築 病原体は、宿主への感染を成功させるために、病原性因子に依存している(図3)。サルモネラ菌が宿主細胞にエフェクタータンパク質を注入し、その生理機能を変化させるために用いるT3SSや、C. difficile菌やビブリオコレラ菌が分泌する毒素がその代表例である。腸管病原体が用いる病原性プログラムのほとんどは、病原体の増殖をより良くするためにニッチを改変することに特化しており、「ニッチ構築」とも呼ばれる。C. rodentium、S. Typhimurium、その他の腸内細菌科細菌は通性嫌気性菌であり、好気的に増殖するだけでなく、様々な基質を発酵または呼吸することで嫌気的に増殖することが可能である。一方、大腸の共生菌の多くは発酵菌であり、酸素に非常に敏感である。そのため、通性嫌気性病原体は、酸素などの呼吸基質が利用できるようになると、増殖に有利になる。例えば、マウスに感染したC. rodentiumは、酸素が最も多く存在する大腸上皮に付着している。細菌が産生する抗菌ペプチドで、同種または近縁の細菌の増殖を抑制する。腸内細菌叢が病原菌や病原体の定着を抑制する仕組み。細胞から放出される小型の免疫調節タンパク質で、免疫反応における細胞間コミュニケーションを媒介する。無菌(GF)動物。微生物に接触することなく、アイソレーターの中で生まれ育った動物。正常な環境下では無害な共生生物として生息しているが、特定の条件下(通常は環境または遺伝子の変化を伴う)では、病気を誘発する微生物。宿主の細胞質または他の微生物細胞にエフェクタータンパク質を直接注入することを可能にする、細菌によって構築された分子構造。プレバイオティクス 有益な共生生物の成長または活動を促進する、食品中の化合物。プロバイオティクス 投与することで宿主に健康上の利益をもたらす可能性のある生きた微生物。分泌型IgA(sigA)。分泌型IgA(sigA)。結合ペプチドが結合したIgA分子の二量体(分泌成分)。slgAは、腸などの粘膜表面で優勢な免疫グロブリンである。共生生物 長期的な関係を保ちながら共生する異なる種の生物。多くの微生物共生体は、宿主と互いに利益を得る相互依存的な存在であるのに対し、通性共生体は宿主から利益を受けるが、宿主は助けたり傷つけたりすることはない。

図3|病原体のコロニー形成抵抗性の回避。腸に入ると、一部の病原体はVI型分泌システム(T6SS)を使って、競合相手を直接殺し、ニッチを開くことができる(左上)。ほとんどの共生生物と病原体は、内側の粘液層から排除される(左下)。Citrobacter rodentiumのような特定の病原体は、III型分泌システム(T3SS)を利用して上皮に付着し、腸管上皮細胞(IECS)にエフェクターを注入して上皮細胞の過増殖を引き起こし、酸素に敏感な共生細菌を殺す一方で病原体にO2を放出させて呼吸させるなどの生理的修飾を行う。C. rodentiumは、T3SSを介した初期の上皮へのアクセス時にIECSが生成する過酸化水素(H₂O₂)を呼吸することも可能である。腸管病原性大腸菌は、T3SSを利用して宿主細胞の細胞質から直接栄養を得ることもできる。食事性アミノ酸(AAS)は微生物叢によって枯渇するが、C. rodentiumを含む病原体はAAsをデノボで合成して宿主上皮細胞を回避し、その結果、クリプト細胞の特徴的な過形成を引き起こすことが可能である。これにより、上皮全体の代謝が変化し、酸素消費量が減少する。そして、余分な酸素はC.rodentiumによって呼吸されるようになる。実際、過形成が起こる前でも、T3SSを介した付着初期に上皮のNADPHオキシダーゼ(NOX1)が産生する過酸化水素をC. rodentiumは呼吸することができる¹39。この病原体は、微生物相が課すアミノ酸の制限を回避するために、アミノ酸生合成遺伝子を誘導し、腸のコロニー形成に不可欠なアミノ酸を自ら作る。また、C. rodentiumは、腸内での初期増殖のために、常在菌の活動によって利用可能となった食事由来の代謝物など、代替的な炭素源を利用することができる¹40。さらに、この病原体はT3SSを利用して上皮またはその近傍に局在し、微生物叢との空間的・栄養的な競合も回避します¹32。さらに、腸管病原性大腸菌やおそらくC.rodentiumは、IECに付着するとT3SSを用いて上皮細胞から栄養分を抽出し、微生物叢が課す栄養制限を覆すかもしれない¹1 S. TyphimuriumはT3SS Spilを用いて、最初のコロニー形成による栄養欠乏を克服するとマウスの回腸および盲腸に炎症を引き起こす(中心部)。Salmonella Enterica subsp. Enterica serovar Typhimuriumは、リポカリン2およびカルプロテクチンによる金属(Fe、Zn、Mn²)の隔離を克服するために、耐性シデロフォアおよび高親和性トランスポーターを進化させた。T3SSによるエフェクターの注入はまた、宿主の炎症反応を引き起こし、活性酸素種(ROS)と活性窒素種(RNS)を放出し、病原体の成長を促進するテトラチオン酸(S,O)や硝酸(NO₂)などの呼吸電子受容体を産生させる。酸化糖(例えば、グルカリン酸やガラクタル酸)もRNSによって生成され、病原体によって利用される。アスパラギン酸は、炎症時に放出され、病原体によるエネルギー生産に利用されることがある。一方、1,2-プロパンジオール(1,2-PD)、プロピオン酸および酪酸(短鎖脂肪酸(SCFAS))、H₂およびガラクツロン酸は微生物叢によって生産され、適切な電子受容体が存在する場合、特定の病原体が代謝することができ、ホスト由来のエタノールアミンも同様に代謝できる。抵抗¹42. Spil エフェクターは宿主に活性酸素と窒素種を発生させ、S. Typhimurium が呼吸できる副産物であるテトラチオン酸や硝酸塩、および代謝できる酸化糖が作られます¹45。また、この病原体は、炎症によって特定の生来の嫌気性菌が抑制されるとより豊富になる酸素を利用し、上皮細胞の酸素消費を阻害する³4. 腸内の特定の炭素源は、適切な呼吸基質の存在下で S. Typhimurium によって代謝される。例えば、宿主由来のエタノールアミンや細菌の代謝物である 1,2-propanediol¹46147 特定の共生生物が生産する水素 (H₂) は、病原体が呼吸電子供与体として利用できる¹48。注目すべきは、サルモネラ菌が、SCFASであるプロピオン酸や酪酸など、通常はその増殖を阻害する細菌産生化合物の一部を利用して、生存を促進することさえできることである149,150。さらに、S. Typhimurium は、鉄、亜鉛、マンガンなどの希少かつ必須な金属をめぐって宿主や他の細菌と競合する方法を進化させており、宿主要因に耐性を持つ高親和性トランスポーターやシデロフォアなどがある5-153 したがって、腸管病原体は、微生物相が課す定着抵抗性を克服すべく特殊戦略の数々を展開することができるのである。 Box 3 感染症対策における微生物叢の活用 感染症および炎症性疾患の治療における糞便微生物叢移植およびその他の微生物叢を用いた治療法については、最近、レビューが行われました¹91。腸内細菌叢を利用して感染症を治療するという概念は、1950年代に初めて検証され、その後、Clostridioides difficileによる再発性大腸炎の治療に有効であることが実証されました192,193, C. difficile感染には、腸内の細菌に対する耐コロニー形成性を仲介する共生細菌を取り除く広域スペクトル抗生物質の使用と関連しています。ドナーの微生物叢の生着は、ドナーとレシピエントの糞便中の細菌の存在量と系統性からほぼ予測することができる¹94。糞便微生物叢移植は、再発性C. difficile感染症の治療に非常に有効ですが、糞便微生物叢の性質が多様であり、病原体を伝播する可能性があるため、この方法を臨床で実施することは困難です。そのため、現在では、C. difficile菌やその他の病原体に対する防御を行う細菌分離の明確なコンソーシアムを特定し、その特徴を明らかにすることに専念しています95。腸内細菌の生態系に関する知識が不足しているため、疾患治療のための効果的なコンソーシアムの構築も困難です。代謝要件や微生物間の相互作用に関する理解が深まれば、より効果的に病原体を標的にするために協調的に機能する微生物のコンソーシアムの開発につながるはずです。しかし、臨床において単離された生きた微生物を投与することは問題である。なぜなら、これらの外来細菌種は宿主に持続的に定着できないことが多いため、プロバイオティクスは通常、微生物叢の全体組成に対して限られた効果しか発揮できないからである」。プレバイオティクスを同時に補充することで、C. difficileに対するコロニー形成抵抗性の強化など、外来微生物のコロニー形成を促進できるため、その点では有用であると考えられます。さらに、共生菌が病原菌に打ち勝つためのメカニズムを理解することで、病原菌のコロニー形成を制限する能力を高めた微生物種の遺伝子工学につながる可能性がある。例えば、共生細菌は、関連する常在菌に対して競争優位に立つように遺伝子操作することで、腸内でのコロニー形成を促進させることができる¹97。このようなアプローチにより、C. difficile に代表される腸内感染症を治療するための武器が改善される可能性があります。食事やプレバイオティクスは微生物叢の構成を変化させることができ、感染症の治療にも有効である可能性があります。しかし、このようなアプローチは、患者の微生物叢に十分な保護微生物が存在する場合にのみ有効であり、臨床の場では必ずしもそうではない。常在菌の直接拮抗 常在菌が外来菌に対して直接阻害を行うように、病原体もまた常在菌と競合し、ニッチを切り開いて侵入するために直接手段を用いることができる(図3)。T6SSは、病原体だけでなく共生生物も、近傍の細胞に様々な毒性エフェクターを注入することで互いに競合するために利用している。V. choleraeは、新生児マウスモデルにおいて、T6SSを利用して競合する大腸菌を死滅させ、より優れた感染と疾病の発生を可能にすることができる¹54。S. Typhimuriumもまた、T6SSを利用して成体マウスに定着し、競合する腸内細菌科細菌を死滅させることができる。Klebsiella oxytocalsを殺すことができる。ヒトの赤痢を引き起こすShigella sonneiも、近縁種のS. flexneriや大腸菌を殺すことができるT6SSを持ち、マウス腸管内でのコロニー形成を促進するが、それでも微生物叢によって速やかに除去される¹56。また、C.rodentiumのT6SSは、侵入初期に、同じくT6SSを持つ共生大腸菌を殺傷し、その殺傷を回避する役割を持つことが最近明らかにされている¹57。結論と今後の展望 共生微生物は、ヒトや動物の腸やあらゆる上皮表面に定着し、病原体の定着を防ぐなど、宿主に多くの利益をもたらしている。実際、本来の腸内細菌叢は、感染症の予防や治療に利用することができる(Box 3)。微生物叢がコロニー形成抵抗性を媒介するさまざまなメカニズムは、微生物叢のベースライン組成、食事、性、年齢、概日リズム、さらには病原体の投与量や発育段階などの広範な要因に影響される。病原体のコロニー形成に対する防御は、土着共生生物が腸などの上皮表面のニッチをめぐって関連微生物と競合するために進化してきた複数のメカニズムによって主に達成される。このように、コロニー形成抵抗性の基盤となる直接的な機構は、腸内における絶え間ない微生物同士の競争や微生物同士の戦いに利用されているという点で、病原体を特に標的にしているわけではない。直接的なコロニー形成抵抗性のメカニズムの多くは、病原体特異的ではないものの、その標的に対して狭い特異性を示すことが多い。バクテリオシンやT6SSのような接触依存的な殺傷がそうである。さらに、微生物叢はグラム陽性菌を殺す二次的なBAなどの代謝産物を産生することができる。耐コロニー形成における特定の微生物や微生物分子の役割を裏付ける証拠の多くは、ノトバイオティクスマウスを用いた簡便な微生物コンソーシアムによるものである。このようなコンソーシアムの使用は、その生物学的背景において重要な機構的洞察をもたらしたが、完全な微生物叢が存在する場合のコロニー形成抵抗性に対する特定の微生物または微生物分子の寄与は不明である。したがって、従来から飼育されている動物やヒトにおいて、そのような微生物や分子の役割を評価する研究が必要である。また、今後の研究により、特に腸内に存在する侵入病原体や日和見病原体が占める自然のニッチにおける微生物相互作用の複雑さについて、新たな知見が得られるはずである。さらに、常在微生物による病原体の抑制が行われる腸内の正確な位置はまだ不明であり、さらなる調査が必要である。利用可能な栄養素のほとんどを消費し、定常状態では低レベルに保つ、高密度で多様な腸内微生物の集団の存在は、病原体のコロニー形成と拡大をも制限しているのである。栄養素と物理的空間の制限は、様々な病原体に対するコロニー形成抵抗性に広く重要な役割を担っていると思われる。また、異なる食餌の摂取は、栄養素の量を変化させることにより、腸管病原体に対する防御に影響を与えることが予想されるが、病原体のコロニー形成抵抗性に対する食餌の影響はまだ十分に理解されておらず、さらなる調査が必要である。コロニー形成抵抗性の間接的なメカニズムには、微生物相が主に宿主の免疫応答を誘導することによって病原体のコロニー形成を制限するメカニズムが含まれる。このような機構は病原体特異的なものではなく、上皮由来のAMPSや多反応性抗体は細菌共生体も標的にすることができる。コロニー形成抵抗性のメカニズムをさらに理解することは、今後の感染症予防・治療法の指針となる。
参考文献
ピーターソン、J.ら、NIHヒトマイクロバイオームプロジェクト。Genome Res. 19, 2317-2323 (2009).
論文
Google Scholar
Gu, S. et al. Bacterial community mapping of the mouse gastrointestinal tract(マウス消化管内の細菌群集マッピング). PLoS ONE 8, e74957 (2013).
論文
CAS
Google Scholar
マウス上行結腸における腸内細菌叢の空間的構成.ISME J. 5, 627-638 (2011).
論文
CAS
Google Scholar
Clemente, J. C., Ursell, L. K., Parfrey, L. W. & Knight, R. The impact of the gut microbiota on human health: an integrative view(腸内細菌叢の健康への影響:統合的見解). Cell 148, 1258-1270 (2012).
論文
CAS
Google Scholar
腸内細菌叢による病原体および病原体の制御. Nat. Immunol. 14, 685-690 (2013).
論文
CAS
Google Scholar
腸内細菌叢:病原体のコロニー形成、免疫反応、および炎症性疾患における役割」(Pickard, J. M., Zeng, M. Y., Caruso, R. & Núñez, G. Immunol. Rev. 279, 70-89 (2017)に掲載されています。
論文
キャス
Google Scholar
Cavaillon, J.-M. & Legout, S. Centenary of the Death of Elie Metchnikoff: a visionary and an outstanding team leader.(エリー・メチニコフの没後100周年:先見の明と卓越したチームリーダー)。Microbes Infect. 18, 577-594 (2016).
論文紹介
CAS
Google Scholar
Bohnhoff, M., Drake, B. L. & Miller, C. P. Effect of streptomycin on susceptibility of intestinal tract to experimental Salmonella infection.ストレプトマイシンの腸管における実験的サルモネラ感染症に対する感受性。Proc. Soc. Exp. Biol. Med. 86, 132-137 (1954).
論文
CAS
Google Scholar
モルモットにおける腸管コレラの致死的感染、正常腸内細菌叢の阻害により達成された。J. Infect. Dis. 97, 57-65 (1955).
論文
CAS
Google Scholar
van der Waaij, D., Berghuis-de Vries, J. M. & Lekkerk-Van Der Wees, J. E. C. 従来のマウスと抗生物質処理マウスにおける消化管のコロニー形成抵抗性. J. Hyg. 69, 405-411 (1971).
論文
Google Scholar
Kristensen, N. B. et al. 健康な成人におけるプロバイオティクス補給による糞便微生物叢組成の変化:無作為化対照試験の系統的レビュー. Genome Med 8, 52 (2016).
論文
Google Scholar
Stecher, B. Salmonella-microbiota-host interaction interactionにおける因果関係の確立:gnotobiotic mouse modelと合成微生物コミュニティの利用. Int. J. Med. Microbiol. 311, 151484 (2021).
論文
CAS
Google Scholar
Hutchinson, G. E. An Introduction to Population Ecology (Yale Univ. Press, 1978).
Lee, S. M. et al. Bacterial colonization factors control specificity and stability of the gut microbiota(腸内細菌叢の特異性と安定性を制御する細菌コロニー形成因子)。Nature 501, 426-429 (2013).
論文
CAS
Google Scholar
Donaldson, G. P. et al. Gut microbiota utilize immunoglobulin A for mucosal colonization(腸内細菌は粘膜コロニー形成に免疫グロブリンAを利用する。サイエンス 360, 795-800 (2018)。この研究は、微生物特異的IgA抗体が、腸内の標的細菌のコロニー形成を促進することを実証しています。
論文紹介
キャス
グーグルスカラー
Sweeney, N. J. et al. Escherichia coli K-12 gntP gene allows E. coli F-18 to occupy a distinct nutritional niche in the streptomycin-treated mouse large intestine.大腸菌K-12は、ストレプトマイシン処理マウス大腸の栄養ニッチを占有する。Infect. Immun. 64, 3497-3503 (1996).
論文
CAS
Google Scholar
Maltby, R., Leatham-Jensen, M. P., Gibson, T., Cohen, P. S. & Conway, T. Nutritional basis for colonization resistance by human commensal Escherichia coli strains HS and Nissle 1917 against E. coli O157:H7 in the intestine in the mouse.(マウス腸管における大腸菌に対するヒト常在菌HSおよびNissle 1917株のコロニー形成抵抗性の栄養的基盤)。PLoS ONE 8, e53957 (2013).
論文
CAS
Google Scholar
Freter, R., Brickner, H., Botney, M., Cleven, D. & Aranki, A. マウス大腸叢の連続流培養モデルにおける細菌数の制御機構. Infect. Immun. 39, 676-685 (1983).
論文
CAS
Google Scholar
Mullineaux-Sanders, C. et al. Citrobacter amalonaticusは、腸管内腔におけるCitrobacter rodentiumの増殖を阻害する.mBio 12, e0241021 (2021).
論文
Google Scholar
レスリー、J.L.ら、コゲルマナントに対する種内競争を介した致死的なクロストリジョイデスディフィシル感染からの保護。
論文
Google Scholar
Klebsiella oxytocaは、腸内で多剤耐性K. pneumoniaeに対して炭水化物の協力的な競合を介してコロニー形成耐性を引き起こす。Cell Host Microbe 29, 1663-1679.e7 (2021).
論文
CAS
Google Scholar
Pickard, J. M. et al. Rapid fucosylation of intestinal epithelium sustains host-commensal symbiosis in sickness(腸管上皮の迅速なフコシル化により、病気における宿主-共役共生が維持される。ネイチャー 514, 638-641 (2014).
論文
CAS
Google Scholar
Liou, M. J. et al. 宿主細胞は栄養ニッチを腸内微生物のための個別の生物地理学的マイクロハビタットへと細分化する。Cell Host Microbe 30, 836-847.e6 (2022)。この最近の研究は、栄養素の微視的な位置が、腸内の細菌種にとって利用可能かどうかを決定する方法を示しています。
論文
CAS
Google Scholar
Leatham-Jensen, M. P. et al. ストレプトマイシン処理したマウス腸は、高密度で多様な腸内細菌叢と相互作用する大腸菌envZミスセンス変異体を選択する. Infect. Immun. 80, 1716-1727 (2012).
論文
CAS
Google Scholar
Moor, K. et al. 高活性IgAは、成長する細菌を鎖でつなぐことによって腸を保護する。ネイチャー 544, 498-502 (2017)。
論文
キャス
Google Scholar
McLoughlin, K., Schluter, J., Rakoff-Nahoum, S., Smith, A. L. & Foster, K. R. 差動接着による微生物叢の宿主選択. Cell Host Microbe 19, 550-559 (2016).
論文
キャス
Google Scholar
Bry, L., Falk, P. G., Midtvedt, T. & Gordon, J. I. A model of host-microbial interactions in an open mammalian ecosystem.(哺乳類生態系における宿主-微生物相互作用のモデル)。サイエンス 273, 1380-1383 (1996).
論文
CAS
Google Scholar
ターンボー、P.J.ら、肥満と痩せの双子における中核的な腸内細菌叢。Nature 457, 480-484 (2009)。
論文
CAS
Google Scholar
腸内細菌は、腸内のアミノ酸の競合を回避することにより、コロニー形成の耐性を破壊する。Cell Host Microbe 28, 526-533.e5 (2020). 本研究では、従来型飼育マウスとGFマウスにおいて、腸内コロニー形成に必要な病原体遺伝子を特定するために、ゲノムワイドなスクリーニングを行った。
論文
CAS
Google Scholar
Theriot, C. M. et al. Antibiotic-induced shifts in the mouse gut microbiome and metabolome increase susceptibility to Clostridium difficile infection.抗生物質が誘発するマウスの腸内細菌群とメタボロームのシフトは、クロストリジウム・ディフィシル感染症に対する感受性を増加させる。Nat. Commun. 5, 3114 (2014).
論文
Google Scholar
Stecher, B. et al. Like will to like: abundances of closely related species can predict susceptibility to intestinal colonization by pathogenic and commensal bacteria.シュテッカー、B.ほか。PLoS Pathog. 6, e1000711 (2010).
論文
Google Scholar
Brugiroux, S. et al. Genome-guided design of a defined mouse microbiota that confers colonization resistance against Salmonella Enterica serovar Typhimurium.(サルモネラ腸炎ビブリオマウスに対するコロニー形成耐性を付与するゲノム誘導型微生物群の設計)。Nat. Microbiol. 2, 16215 (2016).
論文
キャス
Google Scholar
Velazquez, E. M. et al. Endogenous Enterobacteriaceae underlie variation in susceptibility to Salmonella infection(サルモネラ感染症に対する感受性のばらつきの背景には、内因性腸内細菌がある。Nat. Microbiol. 4, 1057-1064 (2019).
論文
キャス
Google Scholar
Deriu, E. et al. プロバイオティクス細菌は、鉄を競合させることによってサルモネラ・ティフィムリウムの腸内コロニー形成を減少させる。Cell Host Microbe 14, 26-37 (2013).
論文
CAS
Google Scholar
Behnsen, J. et al. シデロフォアを介した亜鉛の獲得は、炎症を起こした腸の腸内細菌のコロニー形成を促進する。Nat. Commun. 12, 7016 (2021).
論文
CAS
Google Scholar
バクテリオシンの微生物学的な役割。Nat. Rev. Microbiol. 19, 726-739 (2021).
論文
CAS
Google Scholar
Gillor, O., Giladi, I. & Riley, M. A. Persistence of colicinogenic Escherichia coli in the mouse gastrointestinal tract(マウス消化管における大腸菌の持続性)。BMC Microbiol 9, 165 (2009).
論文
Google Scholar
Sassone-Corsi, M. et al. Microcins mediate competition among Enterobacteriaceae in the inflamed gut.(マイクロシンは炎症腸管における腸内細菌科細菌の競争を媒介する。ネイチャー 540, 280-283 (2016).
論文
キャス
Google Scholar
Coyne, M. J. et al. A family of anti-Bacteroidales peptide toxins wide-spread in the human gut microbiota(ヒト腸内細菌叢に広く存在する抗バクテロイダレスペプチド毒素のファミリー)。Nat. Commun. 10, 3460 (2019).
論文
Google Scholar
Roelofs, K. G., Coyne, M. J., Gentyala, R. R., Chatzidakii-Livanis, M. & Comstock, L. E. Bacteroidales secreted antimicrobial proteins target surface molecules necessary for gut colonization and mediate competition in vivo. mBio 7, e01055-16 (2016).をご参照ください。
論文
Google Scholar
Reyes, K., Bardossy, A. C. & Zervos, M. Vancomycin-resistant Enterococci: epidemiology, infection prevention, and control(バンコマイシン耐性腸球菌:疫学、感染予防、および制御). Infect. Dis. Clin. North Am. 30, 953-965 (2016).
論文
Google Scholar
Kommineni, S. et al. Bacteriocin production augments niche competition by enterococci in the mammalian gastrointestinal tract.(バクテリオシン生産は、哺乳類消化管における腸球菌によるニッチ競争を増大させる。ネイチャー 526, 719-722 (2015).
論文
キャス
Google Scholar
Gilmore, M. S. et al. Pheromone killing of multidrug-resistant Enterococcus faecalis V583 by native commensal strains(多剤耐性腸球菌V583の在来常在菌によるフェロモン殺傷)。Proc. Natl Acad. Sci. USA 112, 7273-7278 (2015).
論文
CAS
Google Scholar
Caballero, S. et al. Cooperating commensals restore colonization resistance to vancomycin-resistant Enterococcus faecium.(協力的な常在菌がバンコマイシン耐性エンテロコッカス・フェシウムのコロニー形成耐性を回復させる)。Cell Host Microbe 21, 592-602.e4 (2017).
論文
キャス
Google Scholar
Kim, S. G. et al. Microbiota-derived lantibiotic restores resistance against vancomycin-resistant Enterococcus.(微生物叢由来のランティバイオティックがバンコマイシン耐性腸球菌に対する耐性を回復させる)。Nature 572, 665-669 (2019). 本研究は、定義された細菌種群によって付与されるコロニー形成抵抗性の背後にある正確な分子メカニズムを同定している。
論文
キャス
Google Scholar
Aoki, S. K. et al. 接触依存的な大腸菌の増殖阻害. Science 309, 1245-1248 (2005).
論文
CAS
Google Scholar
Aoki, S. K. et al. 細菌の接触依存性毒素運搬システムの多型ファミリーが広く存在する。Nature 468, 439-442 (2010).
論文
CAS
Google Scholar
このような、接触依存的な増殖抑制システムの仕組みと生物学的な役割について、Cold Spring Harb. Cold Spring Harb. Perspect. Med. 4, a010025 (2014).
論文
Google Scholar
Hood, R. D. et al. 緑膿菌のタイプVI分泌系は、細菌に毒素を標的としている。Cell Host Microbe 7, 25-37 (2010).
論文
CAS
Google Scholar
Coyne, M. J., Roelofs, K. G. & Comstock, L. E. Human gut BacteroidalesのVI型分泌システムは3つの遺伝子構造に分離し、そのうち2つは移動性遺伝要素に含まれる。BMC Genomics 17, 58 (2016).
論文
Google Scholar
Ross, B. D. et al. Human gut bacteria contains acquired interbacterial defence systems(ヒト腸内細菌は後天的に細菌間防御システムを獲得する。ネイチャー 575, 224-228 (2019).
論文
キャス
グーグル スカラー
Flaugnatti, N. et al. Human commensal gut Proteobacteria withstand type VI secretion attacks through immunity protein-independent mechanisms.ヒト常在の腸内細菌は、免疫タンパク質に依存しないメカニズムでVI型分泌攻撃に耐える。Nat. Commun. 12, 5751 (2021).
論文
CAS
Google Scholar
Russell, A. B. et al. BacteroidetesにおけるVI型分泌関連経路は、細菌間拮抗を媒介する。Cell Host Microbe 16, 227-236 (2014).
論文
CAS
Google Scholar
Chatzidakii-Livanis, M., Geva-Zatorsky, N. & Comstock, L. E. Bacteroides fragilis type VI secretion systems use novel effector and immunity proteins to antagonize human gut Bacteroidales species.バクテロイデス属細菌のタイプVI分泌系は、ヒトの腸内細菌に拮抗する新規のエフェクターおよび免疫タンパク質を使用する。Proc. Natl Acad. Sci. USA 113, 3627-3632 (2016).
論文
CAS
Google Scholar
Wexler, A. G. et al. Human symbionts inject and neutralize antibacterial toxins to persist in the gut.(ヒト共生生物は抗菌毒素を注入し、中和して腸内に残留する。Proc. Natl Acad. Sci. USA 113, 3639-3644 (2016).
論文
キャス
Google Scholar
Hecht, A. L. et al. Strain competition restricts colonization of an enteric pathogen and prevents colitis.(菌株間競争は腸内細菌のコロニー形成を抑制し、大腸炎を予防する。EMBO Rep.17、1281-1291(2016)。
論文
CAS
Google Scholar
Souza, D. P. et al. タイプIV分泌系を介した細菌殺傷。Nat. Commun. 6, 6453 (2015).
論文
CAS
Google Scholar
Whitney, J. C. et al. A broadly distributed toxin family mediates contact-dependent antagonism between Gram-positive bacteria. eLife 6, e26938 (2017).「広く分布する毒素ファミリーは、グラム陽性菌間の接触依存的拮抗作用を媒介する」。
論文
Google Scholar
Guzior, D. V. & Quinn, R. A. Review: microbial transformations of human bile acids. マイクロバイオーム 9, 140 (2021).
論文
CAS
Google Scholar
Sannasiddappa, T. H., Lund, P. A. & Clarke, S. R. In vitro antibacterial activity of unconjugated and conjugated bile salts on Staphylococcus aureus(黄色ブドウ球菌に対する非共役および共役胆汁酸塩の抗菌作用)。Front. Microbiol. 8, 1581 (2017).
論文
Google Scholar
渡辺正樹・吹矢聡・横田明彦 ヒトおよびげっ歯類の大腸における遊離胆汁酸の殺菌活性を総合的に評価した。J. Lipid Res. 58, 1143-1152 (2017).
論文名
CAS
Google Scholar
Sun, X. et al. Microbiota由来の代謝因子はマウスのカンピロバクター症を軽減する. Gastroenterology 154, 1751-1763.e2 (2018年).
論文
キャス
Google Scholar
Buffie, C. G. et al. 精密マイクロバイオーム再構成は、クロストリジウム・ディフィシルに対する胆汁酸媒介性抵抗性を回復させる. ネイチャー 517, 205-208 (2015).
論文
CAS
Google Scholar
Studer, N. et al. Clostridium scindensによる機能的な腸内胆汁酸7α-デヒドロキシル化は、gnotobioticマウスモデルにおけるClostridium difficile感染からの保護と関連している。Front. Cell. Infect. Microbiol. 6, 191 (2016).
論文
Google Scholar
Theriot, C. M., Bowman, A. A. & Young, V. B. Antibiotic-induced alteration of the gut microbiota alter secondary bile acid production and allow for Clostridium difficile spore germination and outgrowth in the large intestine.mSphere 1, e00045-15 (2016).腸内細菌叢の抗生物質による変化は、二次胆汁酸産生を変え、大腸でのクロストリジウム・ディフィシルの芽胞発育と成長を可能にする。
論文
Google Scholar
Lewis, B. B., Carter, R. A. & Pamer, E. G. Bile acid sensitivity and in vivo virulence of clinical Clostridium difficile isolates.(胆汁酸感受性とクロストリジウム・ディフィシル臨床分離株の生体内病原性). Anaerobe 41, 32-36 (2016).
論文
キャス
Google Scholar
Lewis, B. B. et al. Clostridium difficile virulenceに対する病原性遺伝子座、コアゲノム、およびアクセサリー遺伝子の寄与. mBio 8, e00885-17 (2017).
論文
Google Scholar
Aguirre, A. M. et al. Bile acid-independent protection against Clostridioides difficile infection(胆汁酸に依存しないクロストリジウム・ディフィシル感染防御)。PLoS Pathog. 17, e1010015 (2021).
論文
CAS
Google Scholar
Bohnhoff, M., Miller, C. P. & Martin, W. R. 実験的サルモネラ感染に対するマウスの腸管の抵抗性。経口接種による感染開始を阻害する因子.J. Exp. Med. 120, 805-816 (1964).
論文
CAS
Google Scholar
腸管出血性大腸菌O157:H7の増殖に及ぼす腸内嫌気性菌と有機酸の影響. J. Med. Microbiol. 51, 201-206 (2002).
論文
CAS
Google Scholar
Rolfe, R. D. Clostridium difficileに対するコロニー形成抵抗性における揮発性脂肪酸の役割. Infect. Immun. 45, 185-191 (1984).
論文
CAS
Google Scholar
Osbelt, L. et al. 実験用マウスの微生物叢組成の変動は、可変短鎖脂肪酸産生を介してCitrobacter rodentium感染に影響を与える. PLoS Pathog. 16, e1008448 (2020).
論文
CAS
Google Scholar
Sorbara, M. T. et al. Inhibiting antibiotic-resistant Enterobacteriaceae by microbiota-mediated intracellular acidification(微生物が介在する細胞内酸性化による抗生物質耐性腸内細菌科細菌の抑制)。J. Exp. Med. 216, 84-98 (2019).
論文
CAS
Google Scholar
Petersson, J. et al.大腸炎モデルマウスにおける大腸粘液バリアの重要性と調節。Am. J. Physiol. Gastrointest. Liver Physiol. 300, 327-333 (2011).
論文
Google Scholar
Johansson, M. E. V. et al. Normalization of host intestinal mucus layers requires long-term microbial colonization. Cell Host Microbe 18, 582-592 (2015).
論文
キャス
Google Scholar
Bergstrom, K. S. B. et al. Muc2は、病原性細菌と常在菌を大腸粘膜から解離させることにより、致死的な感染性大腸炎から保護する。PLoS Pathog. 6, e1000902 (2010).
論文
Google Scholar
Zarepour, M. et al. ムチンMuc2は、Salmonella Enterica serovar Typhimurium大腸炎における病原体量と上皮バリア機能不全を制限している。Infect. Immun. 81, 3672-3683 (2013).
論文
CAS
Google Scholar
Muc2欠損マウスにおけるListeria monocytogenesの播種増加および集団動態の変化。Infect. Immun. 89, e00667-20 (2021).
論文
Google Scholar
Desai, M. S. et al. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility.食物繊維を欠く腸内細菌叢は、大腸粘液バリアを劣化させ、病原体感受性を高める。Cell 167, 1339-1353.e21 (2016).
論文
CAS
Google Scholar
Neumann, M. et al. Specific-pathogen-free mouseにおける食物繊維の欠乏は、腸管粘膜病原体Citrobacter rodentiumに対する感受性を促進する。Gut Microbes 13, 1966263 (2021).
論文
Google Scholar
Ng, K. M. et al. 微生物が解放した宿主の糖は、腸内病原体の抗生物質投与後の拡大を促進する。ネイチャー 502, 96-99 (2013).
論文
CAS
Google Scholar
Byndloss, M. X. et al. Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion.(微生物が活性化したPPAR-γシグナルは、腸内細菌の拡大を抑制する。サイエンス 357, 570-575 (2017年)。
論文
CAS
Google Scholar
Kelly, C. J. et al. マイクロビオータ由来の短鎖脂肪酸と腸管上皮HIFのクロストークは組織バリア機能を増強する. Cell Host Microbe 17, 662-671 (2015).
論文
CAS
Google Scholar
Rivera-Chávez, F. et al. Depletion of butyrate-producing Clostridia from the gut microbiota drives an aerobic luminal expansion of Salmonella.腸内細菌叢からの酪酸産生クロストリジアの枯渇は、サルモネラの好気性内腔拡大を促進する。Cell Host Microbe 19, 443-454 (2016).
論文
Google Scholar
Litvak, Y., Byndloss, M. X., Tsolis, R. M. & Bäumler, A. J. Dysbiotic Proteobacteria expansion: a microbial signature of epithelial dysfunction.腸内細菌叢の拡大:上皮機能不全の微生物学的特徴。Curr. Opin. Microbiol. 39, 1-6 (2017).
論文
CAS
Google Scholar
Marteyn, B. et al. Modulation of Shigella virulence in response to available oxygen in vivo.(マルテイン、B.他、生体内における利用可能な酸素に応じた赤痢菌の病原性の調節)。Nature 465, 355-358 (2010)。
論文
CAS
Google Scholar
Lopez, C. A. et al. Virulence factors enhances Citrobacter rodentium expansion through aerobic respiration(病原因子は好気性呼吸によってシトロバクター・ロデンティウムの増殖を促進する)。サイエンス 353, 1249-1253 (2016).
論文
CAS
Google Scholar
Litvak, Y. et al. Commensal Enterobacteriaceae protect against Salmonella colonization through oxygen competition.腸内細菌は酸素競争を通じてサルモネラ菌のコロニー形成を防ぐ。Cell Host Microbe 25, 128-139.e5 (2019).
論文
キャス
Google Scholar
Winter, S. E. et al. Host-derived nitrate boosts growth of E. coli in the inflamed gut.(宿主由来の硝酸塩は、炎症を起こした腸内で大腸菌の増殖を促進する)。サイエンス 339, 708-711 (2013).
論文
CAS
Google Scholar
Spees, A. M. et al. ストレプトマイシン誘発性炎症は、硝酸塩呼吸を介して大腸菌の腸内コロニー形成を促進する。
論文
Google Scholar
Mucispirillum schaedleriは、サルモネラの病原性に拮抗し、マウスを大腸炎から保護する。Cell Host Microbe 25, 681-694.e8 (2019).
論文
キャス
Google Scholar
Gong, T., Fu, J., Shi, L., Chen, X. & Zong, X. Antimicrobial Peptides in gut health: a review.(腸の健康における抗菌ペプチド:レビュー)。を参照。Nutr. 8, 751010 (2021).
論文
Google Scholar
Vaishnava, S. et al. 抗菌レクチンRegIIIγは腸内における微生物叢と宿主の空間的隔離を促進する。Science 334, 255-258 (2011).
論文
CAS
Google Scholar
共生細菌が腸内殺菌レクチンを直接発現させる。Science 313, 1126-1130 (2006).
論文
CAS
Google Scholar
MyD88シグナルは殺菌レクチンRegIIIγを誘導し、腸内リステリア菌感染からマウスを保護する。J. Exp. Med. 204, 1891-1900 (2007).
論文
CAS
Google Scholar
van Ampting, M. T. J. et al. 腸管分泌型C型レクチンReg3bはサルモネラ症を抑制するが、リステリア症は抑制しない。Infect. Immun. 80, 1115-1120 (2012).
論文
Google Scholar
Brandl, K. et al. バンコマイシン耐性腸球菌は、抗生物質によって誘発される自然免疫障害を悪用する。Nature 455, 804-807 (2008).
論文
CAS
Google Scholar
Abt, M. C. et al. TLR-7活性化は、バンコマイシン耐性腸球菌に対するIL-22媒介のコロニー形成耐性を強化する。サイエンス・トランスレーション・メッド. 8, 327ra25 (2016).
論文
Google Scholar
Waldschmitt, N.ら、再生ファミリーメンバー3βは、微生物叢のコミュニティ構造とは無関係にコロニー形成抵抗性を制御するためのNOD1/2シグナルの下流でIL-17A媒介好中球の動員を扇動している。Gut 68, 1190-1199 (2019).
論文
キャス
Google Scholar
Kobayashi, K. S. et al. Nod2依存的な腸管における自然免疫と適応免疫の制御. Science 307, 731-734 (2005).
論文
CAS
Google Scholar
抗菌ペプチド、あるいは我々の祖先はいかにしてマイクロバイオームを制御することを学んだのか。
論文
Google Scholar
宿主-微生物間のクロストークにおける鉄の役割と、全身のグルコース代謝に対するその効果。Nat. Rev. Endocrinol. 18, 683-698 (2022).
論文
CAS
Google Scholar
Singh, V. et al. Microbiota-inducible innate immune siderophore binding protein lipocalin 2 is critical for intestinal homeostasis(微生物が誘導する自然免疫シデロフォア結合タンパク質リポカリン2は、腸の恒常性維持に重要である)。Cell. Mol. Gastroenterol. Hepatol. 2, 482-498.e6 (2016).
論文
Google Scholar
Klüber, P. et al. Depletion of lipocalin 2 (LCN2) in mice leads to dysbiosis and persistent colonization with segmented filamentous bacteria.マウスにおけるリポカリン2(LCN2)の枯渇は、分節化した糸状菌によるディスバイオシスと持続的なコロニー形成をもたらす。Int. J. Mol. Sci. 22, 13156 (2021).
論文
Google Scholar
Zygiel, E. M. & Nolan, E. M. 宿主防御タンパク質カルプロテクチンによる遷移金属封鎖。Annu. Rev. Biochem. 87, 621-643 (2018).
論文
キャス
Google Scholar
Ivanov, I. I. et al. Induction of intestinal Th17 cells by segmented filamentous bacteria(イワノフ、アイ.アイ.ら、腸管Th17細胞の誘導。Cell 139, 485-498 (2009)。
論文
CAS
Google Scholar
Kernbauer, E., Ding, Y. & Cadwell, K. An enteric virus can replace the beneficial function of commensal bacteria.腸内細菌は腸内細菌の有益な機能を代替することができる。ネイチャー 516, 94-98 (2014).
論文
CAS
Google Scholar
Neil, J. A. et al. IFN-I and IL-22 mediate protective effects of intestinal virals infection.(IFN-IとIL-22は腸管ウイルス感染の保護効果を媒介する。Nat. Microbiol. 4, 1737-1749 (2019).
論文
キャス
Google Scholar
Zheng, Y. et al. Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens.(インターロイキン22は、付着・離脱する細菌病原体に対する初期の宿主防御を媒介する。Nat. Med. 14, 282-289 (2008).
論文
CAS
Google Scholar
Guo, X. et al. Innate lymphoid cells control early colonization resistance against intestinal pathogens through ID2-dependent regulation of the microbiota.腸管病原体に対する自然免疫系リンパ球の制御。Immunity 42, 731-743 (2015).
論文
CAS
Google Scholar
Chen, J., Waddell, A., Lin, Y. D. & Cantorna, M. T. ビタミンD受容体欠乏によるディスバイオーシスは、自然リンパ系細胞の調節を介してCitrobacter rodentiumに対するコロニー形成抵抗性を付与する。Mucosal Immunol. 8, 618-626 (2015).
論文
CAS
Google Scholar
Nagao-Kitamoto, H. et al. Interleukin-22を介した宿主の糖鎖修飾は、腸内細菌叢の代謝活性を調節することでClostridioides difficile感染を予防する. Nat. Med. 26, 608-617 (2020). 本研究では、IL-22が微生物叢のコロニー形成に応じて宿主のN-結合型糖鎖のグリコシル化を調節し、一方、宿主由来の糖鎖が、腸内の栄養ニッチをめぐってC. difficileと競合する保護共生体の成長を促進することを説明する。
論文
CAS
Google Scholar
Kim, Y. G. et al. Clostridia種の新生児獲得は、細菌性病原体によるコロニー形成から保護される。Science 356, 315-319 (2017)に掲載されています。新生児腸管におけるコロニー形成抵抗性の欠如は、宿主免疫系とは無関係にクロストリジウム属菌が存在しないことが原因であることを示した研究。
論文紹介
CAS
Google Scholar
Behnsen, J. et al. サイトカインIL-22は、関連する常在菌を抑制することで病原体のコロニー形成を促進する。Immunity 40, 262-273 (2014).
論文
CAS
Google Scholar
Shi, Z. et al. 分節化した糸状菌がロタウイルス感染を予防・治癒する。Cell 179, 644-658.e13 (2019).
論文
キャス
Google Scholar
Franchi, L. et al. NLRC4駆動のIL-1β産生は、病原性細菌と常在菌を識別し、宿主の腸管防御を促進する。Nat. Immunol. 13, 449-456 (2012).
論文
CAS
Google Scholar
バクテロイデスがIL-36シグナルを介してKlebsiella pneumoniaeのコロニー形成と感染から保護する。Nat. Microbiol. 5, 304-313 (2020). 本研究は、異なるニッチにおいて肺炎桿菌のコロニー形成を制限する、異なる微生物叢を介した免疫反応を解明し、腸での防御はバクテロイデータの発達とIL-36に依存し、一方上気道ではシュードモナドータがIL-17Aを介して免疫を誘導することを示している。
論文
CAS
Google Scholar
Zheng, L. et al. 微生物由来の酪酸は、IL-10受容体依存的なクローディン-2の抑制を介して上皮のバリア機能を促進する。J. Immunol. 199, 2976-2984 (2017).
論文
キャス
Google Scholar
Macpherson, A. J. et al. 常在菌に対する腸管粘膜IgA応答の原始的なT細胞非依存性機構. サイエンス 288, 2222-2226 (2000).
論文
CAS
Google Scholar
Bunker, J. J. et al. Innate and adaptive humoral responses coat distinct commensal bacteria with immunoglobulin A. Immunity 43, 541-553 (2015).
論文
CAS
Google Scholar
Bunker, J. J. et al. Natural polyreactive IgA antibodies coat the intestinal microbiota.(バンカー・J・J・他)。サイエンス 358, eaan6619 (2017).
論文
Google Scholar
van der Waaij, L. A., Limburg, P. C., Mesander, G. & van der Waaij, D. In vivo IgA coating of anaerobic bacteria in human faeces. Gut 38, 348-354 (1996).
論文
Google Scholar
Raskova Kafkova, L. et al. Secretory IgA N-glycansは、無菌子豚の大腸菌O55感染に対する防御に寄与している。Mucosal Immunol. 14, 511-522 (2021).
論文
CAS
Google Scholar
Fransen, F. et al. BALB/cとC57BL/6マウスでは多反応性IgAの存在量が異なり、これが抗原特異的IgAの生成と微生物叢の多様性に影響を与える。Immunity 43, 527-540 (2015).
論文
CAS
Google Scholar
Wijburg, O. L. C. et al. イネイト分泌抗体はサルモネラ・チフィムリウムの自然感染から保護する. J. Exp. Med. 203, 21-26 (2006).
論文
CAS
Google Scholar
Betz, K. J. et al. 高分子免疫グロブリン受容体ノックアウトマウスの経口および全身性サルモネラ・エンテリカ・セロバール・ティフィムリウム感染後の生存率の向上. PLoS ONE 13, e0198434 (2018).
論文
Google Scholar
Fadlallah, J. et al. ヒトIgA欠損症における微生物生態の擾乱. Sci. Transl Med. 10, eaan1217 (2018)に掲載されています。
論文
Google Scholar
Ost, K. S. et al. Adaptive immunity induces mutualism between commensal eukaryotes(適応免疫による常在真核生物間の相互作用). Nature 596, 114-118 (2021)に掲載されました。本研究は、腸管IgAがカンジダ・アルビカンスの病原性(菌糸)形態型を優先的に標的にして抑制し、恒常的な条件下でこの日和見病原体と宿主との間のコミューニズムを促進することを明らかにした。
論文
CAS
Google Scholar
Wilmore, J. R. et al. 宿主微生物が血清IgA反応を誘導し、多菌性敗血症から保護する。Cell Host Microbe 23, 302-311.e3 (2018).
論文
キャス
Google Scholar
Zeng, M. Y. et al. 腸内細菌が誘導する免疫グロブリンGは、共生細菌および病原体による全身感染を制御する。Immunity 44, 647-658 (2016).
論文
キャス
Google Scholar
Xu, Z. et al. 病原体制御と微生物叢の恒常性維持における粘膜免疫グロブリンの特殊化は、脊椎動物の進化の初期に起こった。Sci. Immunol. 5, eaay3254 (2020)に掲載されました。これは、哺乳類以外の生物において、分泌型免疫グロブリンが粘膜病原体の防御と微生物叢の恒常性の維持を行う好例であり、系統的に離れた分泌型免疫グロブリン間の機能的収斂進化が示唆された。
論文
CAS
Google Scholar
鎌田直樹ほか:病原体が腸内細菌叢と競合する能力を制御する。Science 336, 1325-1329 (2012).
論文
CAS
Google Scholar
Bajaj, V., Lucas, R. L., Hwang, C. & Lee, C. A. Salmonella typhimurium invasion genes by environmental and regulatory factors is co-ordinate regulation of hilA expression is mediated by control of the environmental and regulatory factors. Mol. Microbiol. 22, 703-714 (1996).
論文
CAS
Google Scholar
Hung, C. C. et al. 腸内脂肪酸プロピオン酸は、HilDの翻訳後制御によりサルモネラ菌の侵入を阻害する。Mol. Microbiol. 87, 1045-1060 (2013).
論文
CAS
Google Scholar
中西直樹ほか:腸管出血性大腸菌における酪酸センシングによる病原性制御. 微生物学 155, 521-530 (2009).
論文
CAS
Google Scholar
Durant, J. A., Corrier, D. E. & Ricke, S. C. Short-chain volatile fatty acids modulate the expression of the hilA and invF genes of Salmonella typhimurium.(短鎖揮発性脂肪酸はサルモネラ菌のhilAとinvFの発現を調節する)。J. Food Prot. 63, 573-578 (2000).
論文
CAS
Google Scholar
Kohli, N. et al.マイクロバイオータ代謝物インドールはサルモネラの病原性を阻害する:PhoPQ二成分系の関与. PLoS ONE 13, e0190613 (2018).
論文
Google Scholar
Connolly, J. P. R. et al. Host-associated niche metabolism controls enteric infection through fine-tuning the regulation of type 3 secretion.宿主関連ニッチ代謝は、3型分泌の制御を通じて腸管感染を制御する。Nat. Commun. 9, 4187 (2018).
論文
Google Scholar
Miller, B. M. et al. NOX1由来の過酸化水素の嫌気性呼吸は、大腸表面での細菌増殖を許可する。Cell Host Microbe 28, 789-797.e5 (2020). 本研究は、宿主のNOX1由来のH2O2が感染初期にC. rodentiumの嫌気性増殖を促進し、一方、病原体は炎症を起こした腸での増殖に好気性呼吸に依存していることを実証している。
論文
CAS
Google Scholar
腸管出血性大腸菌およびシトロバクター・ロデンティウムの病原性と腸管内コロニー形成を制御する食事由来のガラクツロン酸。Nat. Microbiol. 5, 368-378 (2020).
論文
CAS
Google Scholar
Pal, R. R. et al. 病原性大腸菌は、インジェクタソーム成分を利用して感染宿主細胞から栄養分を抽出する。Cell 177, 683-696.e18 (2019)。本研究は、宿主に付着した腸管病原性大腸菌が、そのT3SSのコア成分を用いてin vitroで感染細胞から栄養分を抽出することを報告し、腸内で付着または排出する病原体の特徴的な病原性プログラムの背後にある興味深い可能性を説明するものである。
論文
CAS
Google Scholar
Fattinger, S. A., Sellin, M. E. & Hardt, W. D. Salmonella effector driven invasion of the gut epithelium: breaking in and setting the house on fire.サルモネラ菌が腸管上皮に侵入する際のエフェクターの役割。Curr. Opin. Microbiol. 64, 9-18 (2021).
論文
CAS
Google Scholar
Winter, S. E. et al. 腸内炎症はサルモネラ菌の呼吸電子受容体となる。Nature 467, 426-429 (2010).
論文
CAS
Google Scholar
Lopez, C. A. et al. Phage-mediated acquisition of a type III secreted effector protein boosts of growth of Salmonella by nitrate respiration.
論文
Google Scholar
Faber, F. et al. Host-mediated sugar oxidation promotes post-antibiotic pathogen expansion(宿主による糖質酸化が抗生物質投与後の病原体の拡大を促進する). ネイチャー 534, 697-699 (2016).
論文
キャス
Google Scholar
Thiennimitr, P. et al. 腸の炎症により、サルモネラはエタノールアミンを使って微生物叢と競合することができる。Proc. Natl Acad. Sci. USA 108, 17480-17485 (2011).
論文
CAS
Google Scholar
Faber, F. et al. 大腸炎時に微生物叢由来の1,2-プロパンジオールの呼吸によってサルモネラの増殖が促進される。PLoS Pathog. 13, e1006129 (2017).
論文
Google Scholar
Maier, L. et al. Microbiota-derived hydrogen fuels Salmonella Typhimurium invasion of the gut ecosystem(微生物叢由来の水素が腸内生態系へのサルモネラの侵入を促進する。Cell Host Microbe 14, 641-651 (2013).
論文
CAS
Google Scholar
Shelton, C. D. et al. Salmonella Enterica serovar Typhimurium uses anaerobic respiration to overcome propionate-mediated colonization resistance(サルモネラ・エンテリカ・セロバー・ティフィムリウムは嫌気性呼吸を利用してプロピオン酸を介したコロニー形成抵抗を克服する。Cell Rep. 38, 110180 (2022).
論文
CAS
Google Scholar
Bronner, D. N. et al. Genetic ablation of butyrate utilization attenuates gastrointestinal Salmonella disease. Cell Host Microbe 23, 266-273.e4 (2018). 本論文は、腸内細菌叢が産生する抑制性化合物である酪酸が、サルモネラ属菌のコロニー形成や感染を良くするために利用されることも示しています。
論文内容
CAS
Google Scholar
Raffatellu, M. et al. Lipocalin-2 resistance confers an advantage to Salmonella Enterica serotype Typhimurium for growth and survival in the inflamed intestine.リポカリン-2耐性は、炎症腸での成長と生存のためにサルモネラ腸炎菌に優位性を与える。Cell Host Microbe 5, 476-486 (2009).
論文
CAS
Google Scholar
Liu, J. Z. et al. 好中球タンパク質カルプロテクチンによる亜鉛の隔離は、炎症腸内でのサルモネラの増殖を促進する。Cell Host Microbe 11, 227-239 (2012).
論文
CAS
Google Scholar
Diaz-Ochoa, V. E. et al. Salmonella mitigates oxidative stress and thrives in the inflamed gut by evading calprotectin-mediated manganese sequestration(カルプロテクチンによるマンガン封鎖を回避し、炎症腸内でサルモネラの酸化ストレスを軽減する)。Cell Host Microbe 19, 814-825 (2016).
論文
CAS
Google Scholar
Zhao, W., Caro, F., Robins, W. & Mekalanos, J. J. Antagonism towards the intestinal microbiota and its effect on Vibrio cholerae virulence(腸内細菌叢に対する拮抗作用とその病原性への影響). サイエンス 359, 210-213 (2018).
論文
キャス
Google Scholar
Sana, T. G. et al. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut.(サルモネラ・ティフィムリウムは、T6SSを介した抗菌兵器を利用して宿主の腸内に定着する。Proc. Natl Acad. Sci. USA 113, 5044-5051 (2016).
論文
Google Scholar
Anderson, M. C., Vonaesch, P., Saffarian, A., Marteyn, B. S. & Sansonetti, P. J. Shigella sonnei encodes a functional T6SS used for interbacterial competition and niche occupancy.(シゲラ・ソンネイは細菌間競争とニッチ占有に使用される機能的なT6SSをコードする。Cell Host Microbe 21, 769-776.e3 (2017).
論文
キャス
Google Scholar
Serapio-Palacios, A. et al. 病原性細菌と常在菌のVI型分泌系は、腸内のニッチ占有を媒介する。Cell Rep. 39, 110731 (2022).
論文
CAS
Google Scholar
Shao, Y. et al. Stunted microbiota and opportunistic pathogen colonization in caesarean section birth(帝王切開出産における微生物叢と日和見病原体のコロニー形成)。ネイチャー 574, 117-121 (2019).
論文
キャス
Google Scholar
Dominguez-Bello, M. G. et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns.出産形態は、新生児の複数の体内生息域における初期マイクロバイオータの獲得と構造を形成する。Proc. Natl Acad. Sci. USA 107, 11971-11975 (2010).
論文
Google Scholar
Bäckhed, F. et al. Dynamics and stabilization of the human gut microbiome during the first year of life.(生後1年間のヒト腸内細菌群の動態と安定化)。Cell Host Microbe 17, 690-703 (2015)。本研究は、生後1年間の腸内細菌叢の特徴を明らかにし、大規模な患者コホートにおける出産形態と摂食がその確立に及ぼす影響を評価するものである。
論文
Google Scholar
Lanata, C. F. et al. Global causes of diarrheal disease mortality in children(小児下痢性疾患死亡の世界的原因). PLoS ONE 8, e72788 (2013).
論文
CAS
Google Scholar
Prabhudas, M. et al. Challenges in infant immunity: implications for responses to infection and vaccines.プラブダス、M. et al. Nat. Immunol. 12, 189-194 (2011).
論文
CAS
Google Scholar
Deshmukh, H. S. et al. 好中球のホメオスタシスと新生児マウスの大腸菌K1敗血症に対する宿主抵抗性を制御する微生物叢(microbiota). Nat. Med. 20, 524-530 (2014).
論文
CAS
Google Scholar
Zhou, P. et al. 周産期の抗生物質曝露は母体と新生児の微生物叢間の伝達に影響を与え、早期発症の敗血症と関連する。 mSphere 5, e00984-19 (2020).
論文
Google Scholar
Singer, J. R. et al. Preventing dysbiosis of the neonatal mouse intestinal microbiome protects against late-onset sepsis.新生児マウスの腸内細菌叢の異常の予防は、発症後期の敗血症から保護する。Nat. Med. 25, 1772-1782 (2019).
論文
キャス
Google Scholar
Zheng, W. et al. Microbiota-targeted maternal antibodies protect neonates from enteric infection.(微生物叢を標的とした母体抗体は新生児を腸管感染から守る。ネイチャー 577, 543-548 (2020)。
論文
CAS
Google Scholar
Chen, Y. E., Fischbach, M. A. & Belkaid, Y. Skin microbiota-host interactions(皮膚マイクロバイオータ-ホスト相互作用)。ネイチャー 553, 427-436 (2018)。
論文
CAS
グーグル・スカラー
Grice, E. A. et al. ヒト皮膚マイクロバイオームの地形的・時間的多様性. サイエンス 324, 1190-1192 (2009)。
論文
CAS
Google Scholar
ヒト皮膚マイクロバイオータは、ヒトの病原体を殺すバクテリオシン産生ブドウ球菌の豊富な供給源である。FEMS Microbiol. Ecol. 95, fiy241 (2019).
グーグル・スカラー
Cogen, A. L. et al. Selective antimicrobial action is provided by phenol-soluble modulins derived from Staphylococcus epidermidis, a normal resident of the skin. J. Invest. Dermatol. 130, 192-200 (2010).
論文
CAS
Google Scholar
Bitschar, K. et al. Lugduninは、宿主および微生物由来の因子との相乗効果により、皮膚における自然免疫応答を増幅させる。Nat. Commun. 10, 2730 (2019).
論文
Google Scholar
Nakatsuji, T. et al. ヒト皮膚常在菌由来の抗菌薬は黄色ブドウ球菌を防御し、アトピー性皮膚炎では欠乏している。Sci. Transl Med. 9, eaah4680 (2017).
論文
Google Scholar
Bomar, L., Brugger, S. D., Yost, B. H., Davies, S. S. & Lemon, K. P. Corynebacterium accolens releases antipneumococcal free fatty acids from human nostril and skin surface triacylglycerols. mBio 7, e01725-15 (2016).コリネマ・アーコーレンス、ヒト皮膚常在菌からの遊離脂肪酸の放出。
論文
Google Scholar
Novick, R. P. & Geisinger, E. Quorum sensing in staphylococci. Annu. Rev. Genet. 42, 541-564 (2008).
論文
CAS
Google Scholar
Ji, G., Beavis, R. & Novick, R. P. 自己誘導性ペプチドバリアントによるバクテリアの干渉。サイエンス 276, 2027-2030 (1997).
論文
CAS
Google Scholar
Paharik, A. E. et al. Coagulase-negative staphylococcal strain prevents Staphylococcus aureus colonization and skin infection by blocking quorum sensing.(コアグラーゼ陰性ブドウ球菌株はクオラムセンシングを阻害することにより黄色ブドウ球菌のコロニー形成と皮膚感染を防ぐ)。Cell Host Microbe 22, 746-756.e5 (2017).
論文
キャス
Google Scholar
ウィリアムズ、M.R.ら. 皮膚上の細菌種間のクォーラムセンシングは、アトピー性皮膚炎における表皮傷害から保護する。Sci. Transl Med. 11, eaat8329 (2019)に掲載されています。
論文
キャス
Google Scholar
Naik, S. et al.常駐常在菌による皮膚免疫のコンパートメント型制御。Science 337, 1115-1119 (2012).
論文
CAS
Google Scholar
Bassis, C. M., Tang, A. L., Young, V. B. & Pynnonen, M. A. The nasal cavity microbiota of healthy adults.(健常成人の鼻腔内細菌叢)。Microbiome 2, 27 (2014).
論文
Google Scholar
Janek, D., Zipperer, A., Kulik, A., Krismer, B. & Peschel, A. High frequency and diversity of antimicrobial activities produced by nasal Staphylococcus strains against bacterial competitors. PLoS Pathog. 12, e1005812 (2016).
論文
Google Scholar
Zipperer, A. et al. 新規抗生物質を産生するヒト常在菌は、病原体のコロニー形成を損なう。Nature 535, 511-516 (2016).
論文
キャス
グーグルスクーラー
Iwase, T. et al. Staphylococcus epidermidis EspはStaphylococcus aureus biofilm formationと鼻腔内定着を阻害する. Nature 465, 346-349 (2010).
論文
CAS
Google Scholar
Staphylococcus epidermidis Espは、黄色ブドウ球菌のバイオフィルム形成と宿主-病原体相互作用に関連する特定タンパク質を分解する。J. Bacteriol. 195, 1645-1655 (2013).
論文
CAS
Google Scholar
Liu, Q. et al. Staphylococcus epidermidisは、抗菌ペプチド産生を刺激することで鼻腔内マイクロバイオームの健全な成熟に寄与している。Cell Host Microbe 27, 68-78.e5 (2020).
論文
CAS
Google Scholar
Ravel, J. et al. 生殖年齢女性の膣内マイクロバイオーム. Proc. Natl Acad. Sci. USA 108, 4680-4687 (2011).
論文
CAS
Google Scholar
フレドリックス、D.N.、フィードラー、T.L.&マラッツォ、J.M.細菌性膣炎に関連する細菌の分子的同定。N.Engl.J.Med.誌 353, 1899-1911 (2005).
論文
CAS
Google Scholar
Turovskiy, Y., Sutyak Noll, K. & Chikindas, M. L. The aetiology of bacterial vaginosis(細菌性膣炎の病因)。J. Appl. Microbiol. 110, 1105-1128 (2011).
論文
CAS
Google Scholar
H2O2生成乳酸菌による膣内の微生物叢の制御。J. Infect. Dis. 164, 94-100 (1991).
論文
CAS
Google Scholar
ヒト膣内乳酸菌による病原性細菌に対する拮抗作用。Anaerobe 12, 221-226 (2006).
論文
Google Scholar
また、膣内乳酸菌の病原性細菌に対する拮抗作用も確認されている。J. Infect. Dis. 214, s29-s35 (2016)に掲載されています。
論文
CAS
Google Scholar
Sorbara, M. T. & Pamer, E. G. Microbiome-based therapeutics. Nat. Rev. Microbiol. 20, 365-380 (2022).
論文
CAS
Google Scholar
Eiseman, B., Silen, W., Bascom, G. S. & Kauvar, A. J. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis.(偽膜性腸炎の治療における補助手段としての糞便浣腸). 外科 44, 854-859 (1958).
CAS
Google Scholar
van Nood, E. et al. 再発性クロストリジウム・ディフィシルに対するドナー糞便の十二指腸注入。N. Engl. J. Med. 368, 407-415 (2013).
論文
Google Scholar
Smillie, C. S. et al. Strain tracking reveals the determinants of bacterial engraftment in the human gut following fecal microbiota transplantation(便微生物移植後のヒト腸内細菌生着の決定要因を明らかにする)。Cell Host Microbe 23, 229-240.e5 (2018).
論文
キャス
Google Scholar
Dsouza, M. et al. 健康なボランティアにおける生きたバイオ治療製品VE303のコロニー形成と微生物叢および代謝産物の調節. Cell Host Microbe 30, 583-598.e8 (2022).
論文
CAS
Google Scholar
Mills, J. P., Rao, K. & Young, V. B. Clostridium difficile感染予防のためのプロバイオティクス. Curr. Opin. Gastroenterol. 34, 3-10 (2018).
論文
CAS
Google Scholar
Shepherd, E. S., Deloache, W. C., Pruss, K. M., Whitaker, W. R. & Sonnenburg, J. L. An exclusive metabolic niche enables strain engraftment in the gut microbiota(排他的な代謝ニッチが腸内細菌叢における株の移植を可能にする)。ネイチャー 557, 434-438 (2018).
論文
キャス
グーグルスカラー
参考文献のダウンロード
謝辞
B. Loによる原稿の査読に感謝する。また、紙面の都合上、引用できなかった同僚にお詫びを申し上げる。G.C.-F.は、米国国立衛生研究所からK99/R00賞の支援を受けている。著者らの研究室での研究は、米国国立衛生研究所の助成金によって支えられている(G.N.)。
著者情報
著者ノート
これらの著者は等しく貢献した。Gustavo Caballero-Flores, Joseph M. Pickard.
著者および所属
ミシガン大学医学部病理学教室・ローゲル癌センター(米国ミシガン州アナーバー、ミシガン州
Gustavo Caballero-Flores、Joseph M. Pickard、Gabriel Núñez。
貢献
本論文のすべての側面において、著者は等しく貢献している。
対応する著者
Gustavo Caballero-FloresまたはGabriel Núñezに連絡すること。
倫理的宣言
利益相反
著者らは、競合する利益を宣言していない。
査読
査読情報
Nature Reviews Microbiologyは、Lisa Osbeltと共同査読を行ったTill Strowig、およびその他の匿名査読者の査読への貢献に感謝します。
その他の情報
出版社からのコメント Springer Natureは、出版された地図や所属機関に関する管轄権の主張に関して、中立的な立場を維持しています。
用語解説
バクテリオシン
細菌が産生する抗菌ペプチドで、同種または近縁の細菌の増殖を抑制する。
耐コロニー性
腸内細菌叢が病原菌や病原体の定着を抑制する仕組み。
サイトカイン
細胞から放出される小型の免疫調節タンパク質で、免疫反応における細胞間コミュニケーションを媒介する。
無菌(GF)動物
微生物に接触することなく、隔離された場所で生まれ育った動物。
病原体
通常、害のない共生体として生息しているが、特定の条件下(通常は環境または遺伝子の変化)で病気を誘発する微生物。
分泌システム
宿主の細胞質または他の微生物細胞に直接エフェクタータンパク質を注入することを可能にする、細菌によって構築された分子構造。
プレバイオティクス
有益な共生生物の成長または活性を促進する食品中の化合物。
プロバイオティクス
投与することにより、宿主に健康上の利益をもたらす可能性のある生きた微生物。
分泌型IgA
(sIgA)。分泌型IgAは、腸などの粘膜表面に多く存在する免疫グロブリンで、結合ペプチドが結合したIgA分子の二量体(分泌型成分)。
共生生物
異なる種の生物が長期的な関係で共生すること、または共生。多くの微生物共生体は、宿主と互いに利益を得る相互依存的な存在であるが、共生体は宿主から利益を受けるが、宿主は助けたり傷つけたりすることはない。
権利と許可
Springer Natureまたはそのライセンサー(学会またはその他のパートナー)は、著者またはその他の権利者との出版契約に基づき、本論文の独占的権利を有する。本論文の受理済み原稿の著者によるセルフ・アーカイブは、かかる出版契約の条件および適用される法律のみに準拠するものとする。
転載と許可
この記事について
クロスマークで通貨と真偽を確認する
この記事の引用
Caballero-Flores, G., Pickard, J.M. & Núñez, G. Microbiota-mediated colonization resistance: mechanisms and regulation(微生物叢によるコロニー形成抵抗性:メカニズムと調節). Nat Rev Microbiol (2022)。https://doi.org/10.1038/s41579-022-00833-7。
引用文献のダウンロード
受理済
2022年11月16日
公開日
2022年12月20日発行
DOI
https://doi.org/10.1038/s41579-022-00833-7
この記事が気に入ったらサポートをしてみませんか?
