
腸の声を聞く 腸の先進モデルをバイオエンジニアリングするためのキーコンセプト
記事内容へスキップ
記事情報へスキップ
ワイリーオンラインライブラリー
先端科学早見2302165
レビュー
オープンアクセス
腸の声を聞く 腸の先進モデルをバイオエンジニアリングするためのキーコンセプト
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202302165






オリバー・キャメロン, ジョアナ・F・ネヴェス, アイリーン・ジェントルマン
初版発行:2023年11月27日
https://doi.org/10.1002/advs.202302165
について
セクション
概要
腸は、食物を分解して栄養素を吸収する一方で、腸内細菌叢に対する選択的バリアーを維持することで、ヒトの健康にとって中心的な機能を果たしている。このバリア機能の鍵となるのは、内腔を裏打ちする特殊な腸上皮細胞と、それを支える免疫細胞に富んだ間質組織の複合的な働きである。腸上皮が試験管内で腸オルガノイドとして再現できるという発見は、腸の発生、恒常性、疾患を理解する新しい方法を導入した。しかし、オルガノイドは腸上皮を単独で反映するのに対し、その下の組織には無数の細胞タイプが存在し、化学的、構造的に非常に複雑である。本総説では、腸の細胞およびマトリックス構成要素を解剖し、ボトムアップの生物学的自己組織化とトップダウンの生物工学の原理を用いて、それらをin vitroで再現する戦略について論じる。また、腸内微小環境の細胞的、生化学的、生物物理学的特徴や、オルガノイド生物学と材料科学の戦略を組み合わせることによって、これらを試験管内でどのように再現できるかについても取り上げている。特に、生来の細胞外マトリックスを模倣した利用しやすい化学物質が議論され、腸のモデル化における限界を克服することを目的とした生物工学的アプローチが批判的に評価されている。最後に、この総説では、さらなる進歩が腸管モデルの応用をどのように拡大し、臨床治療への適合性を高めるかを考察している。
1 はじめに
腸はヒトの健康の中心であり、消化された食物から栄養素を吸収する小腸と、水分やイオンの再吸収をサポートする大腸から構成されている。腸は共に、腸の内容物に対する選択的バリアーを構成し、哺乳類におけるマイクロバイオームの最大部分を収容している。腸は、分泌性・吸収性の腸上皮細胞(IEC)の単層によってこのバリアーを維持しており、その下層は、マトリックスを分泌する間葉系細胞、神経細胞、平滑筋、血管系、および多数の免疫細胞タイプを含む間質組織によって支えられている(図1a)。
詳細は画像に続くキャプションを参照。
図1
図ビューアで開く
パワーポイント
キャプション
腸管バリア機能の欠損は、自己免疫疾患、神経精神疾患[1]、炎症性腸疾患(IBD)[2, 3]、嚢胞性線維症[4]、大腸癌(CRC)[5]などの多様な病態に関与している。したがって、腸の研究モデルは、これらの疾患を理解し、薬剤開発に役立てるために極めて重要である。しかし、動物モデルはin vivoの複雑さや系統的な違いによって限界があり、標準的な2次元細胞培養モデルでは、本来の組織の複雑さや多様性を再現することはできない。
10年以上前、腸管上皮(IE)が試験管内で腸管オルガノイド(IO)として再現できることが示された(図1b,c)。IOは、原生的な先端基底極性を示す3次元構造体として無期限に培養することができ、腸の発生を研究するための利用しやすいツールであることがすぐに証明された。やがてIOは、遺伝子の変異が組織の恒常性にどのような影響を及ぼすかについての洞察を明らかにし、組織が損傷に応答するメカニズムを解明することを可能にした。重要なことは、IOはまた、研究者が病気に対する本来の組織のような反応をモデル化する新しい機会を提供したことである。要するに、IOは従来の2次元細胞培養や動物モデルの多くの欠点を克服し、腸管研究における有益なツールであることが証明されたのである。しかし、ほとんどのIOは単層の上皮細胞で構成されているのに対し、本来のIEは多数の間葉系細胞や免疫細胞によって支えられており、それらは生化学的に複雑で構造的に入り組んだ細胞外マトリックス(ECM)の中に配置されている。それゆえ、研究者たちは、IOだけでは解決できない疑問に答えるため、腸のin vitroモデルにこの多数の生理学的複雑性を組み込んだ新しいアプローチを開発している。
ここでは、腸を構成する細胞の種類とマトリックス成分について論じ、それらを試験管内で再現する研究アプローチを紹介する。上皮を形成するためにIOが本来持っている自己組織化能力に依存する戦略を強調し、これらを、組織をde novoで構築することを目的とする生物工学からの設計されたアプローチと併せて紹介する。本来の腸組織内の生物物理学的な手がかりや、腸内の生化学的、気体的、微生物的な勾配が、いかに正常な機能に寄与し、試験管内で再現できるかを論じる。また、化学的・生物学的手がかりを時間依存的・オンデマンド的に調節できるハイドロゲルなどの新素材が、本来のECMの物理化学的・力学的特性を模倣するためにどのように利用できるかを強調する。最後に、生物学のさらなる進歩と生物工学の革新とをどのように組み合わせれば、創薬スクリーニングや個別化医療への応用において、生来の組織に匹敵する精度を持つ高度な腸のモデルを創り出すことができるのか、その展望を述べて終わる。
2 ネイティブ腸内の細胞と可溶性シグナル伝達
腸は、内腔を覆う上皮と、その下にある固有層、より深い粘膜下層、筋層から構成され、これらには、それぞれ異なる局在と機能を持つ複数の間葉系細胞が存在する。これには、線維芽細胞、筋線維芽細胞、周皮細胞、平滑筋細胞(SMC)、腸神経細胞、内皮細胞、免疫細胞などが含まれる。腸にはまた、粘液という細胞を含まない重要な作用因子がある。この糖タンパク質ネットワークは、管腔を取り囲むように並んでおり、機械的、生物学的、化学的攻撃に対する防御の第一線として働いている[6, 7]。さらに、腸内には数兆個もの微生物が生息しており、腸粘膜免疫区画と連携して、微生物叢を許容し、さらには臓器に有利なように利用している。
2.1 腸管上皮と幹細胞ニッチ
腸管上皮は、栄養吸収を可能にしながらも、管腔内容物と体外との間の厳格なバリアーを維持している。IECは、その頂膜を通過する内腔内容物を厳密に制御すると同時に、選択的に透過するタイトジャンクションによって細胞間隙をしっかりと封鎖することで、これを実現している[8]。大腸上皮は平坦であるが、小腸の吸収能は、絨毛と呼ばれる内腔突起によって最大化されている。人を寄せ付けない内腔環境は、IECの継続的な交換を要求する。これを達成するために、リーベルキューンの陰窩と呼ばれる増殖性の浸潤内に存在する腸管幹細胞(ISC)が、この細胞源となる。
小腸では、ISCは陰窩の基部に存在し、連続的な自己複製や、終末分化の前に急速に増殖する娘細胞の生成によって、上皮のターンオーバーを促進する。これらの娘細胞は、腸細胞に分化する吸収性前駆細胞か、粘液分泌性杯細胞、抗菌ペプチド分泌性パネス細胞、ホルモン分泌性腸内分泌細胞、抗原結合性M細胞、サイトカイン分泌性房細胞などを生み出す分泌性前駆細胞である。 [10, 11] 陰窩のISC間に介在して下方に移動するパネス細胞を除いて、分化した他のIECは、陰窩-絨毛軸に沿って上方に移動し、最終的に絨毛の先端に達し、そこで内腔に排出される。このプロセスは、ヒトでは5~7日ごとに陰窩-絨毛軸を補充する細胞ベルトコンベヤーに供給され、恒常的なバリア機能を維持する[8]。
腸管陰窩内の幹細胞は上皮を補充するが、ISCニッチそのものが、この恒常性維持プロセスにおいてより重要な役割を果たしている。ISCニッチは、ISCを取り囲む物理的・細胞的な微小環境から構成され、ISCの自己複製、増殖、組織的分化を維持する生化学的・機械的な合図を提供する。ISCニッチから押し出された細胞は、静止と分化を促進するシグナル環境にさらされるが、ニッチ内にとどまる細胞は増殖性と多能性を示す。実際、ニッチは非常に指導的であるため、スペースが空けば、腸球前駆細胞でさえもニッチのシグナルに反応して幹細胞に戻ることができる、という証拠が示唆されている [12] 。
2.2 皮質-絨毛軸に沿ったシグナル伝達、気体、微生物勾配
複数のシグナル伝達経路が、陰窩-絨毛軸に沿って複雑な勾配として配置されており、上皮細胞や間葉細胞から放出される可溶性因子によって確立、維持されている。これらのうち最も重要なものは、Wnt、Notch、上皮成長因子(EGF)、Eph/Ephrin、骨形成タンパク質(BMP)シグナル伝達である。さらに、上皮を覆っている粘液層は、腸血液供給源から発せられる気体勾配(特に酸素)の継続を可能にすると同時に、管腔から発せられる気体および分子微生物産物の勾配の媒体にもなっている。
2.2.1 Wnt勾配
Wntシグナル伝達は、恒常性維持におけるISCの自己複製、増殖、 維持を制御するのに重要である。Wntシグナル伝達は、陰窩に向かって増加し、絨毛に向かって積極的に抑制される勾配として確立されている。パネス細胞は、抗菌性リゾチームとディフェンシンを陰窩内腔に分泌する多機能細胞であり、Wntの主要な供給源でもある[13, 14] 。Wntリガンドの拡散範囲は限られているため、パネス細胞は隣接するISCに直接Wntリガンドを供給できるように、ISC間に介在している。パネス細胞に加えて、Wntリガンドは、Gli1+細胞やCD34+細胞だけでなく、毛細血管球を含むクリプト周囲間葉系細胞からもニッチに供給される[15-17]。同様に、クリプト周囲間質細胞も、ISCの自己再生を制御するWntアゴニストR-スポンジンを供給する[18-20]。
2.2.2 ノッチ勾配
ノッチシグナルもまた、陰窩に向かって増加する勾配として存在し、ISCニッチにおける細胞運命の制御に重要な役割を果たしている。WntシグナルとNotchシグナルの両方が高レベルで結合することで、ISCの同一性が維持される。しかし、陰窩から移動すると、前駆細胞はNotchの活性化に基づいて運命を決定する[21]。Notchの活性化が低いと、Notchデルタ様リガンド(Dll1とDll4)が産生され、これが隣接する細胞のNotchを活性化し、分泌系へのコミットメントを促進する。あるいは、ノッチ活性が高いと、吸収細胞への分化が起こる。パネス細胞はDll1とDll4を供給するため、ノッチシグナルの重要なドライバーであり、吸収細胞系列へのコミットメントを偏らせる。重要なことは、Notchシグナルが少ないと分泌系に偏るが、Wntシグナルの状況によって、どの分泌系の細胞が採用されるかが決まるということである。従って、高いWntシグナルに依存するパネス細胞は陰窩の近くに生じ、一方、杯細胞は絨毛に多く存在するように、その位置は極めて重要である[23]。
2.2.3 EGF勾配
EGFはもう一つの可溶性因子であり、陰窩基盤に向かって最も活性の高いシグナル伝達勾配を形成する。EGFは、4つの異なるErbBレセプター間でホモおよびヘテロ二量体の形成を促す、構造的に関連した11種類のリガンドファミリーに属する。このように複雑であるため、EGFがISCの増殖状態を 維持する役割を担っていることは認められているものの、腸 内において他のEGFファミリーリガンドや受容体が果たしてい る役割については、よく理解されていない。実際、EGFRの阻害やマウスIOからのEGFの除去は、ISCの 増殖を劇的に減少させ、静止状態と腸内分泌シグネチャーを誘導 する。 [このことは、EGFファミリーのメンバーであるニューレグ リン1の欠損がISCの増殖を減少させるのとは対照的である。例えば、エピレグリンは発育中のヒト腸陰窩で高発現し、ヒト生検由来のIOにおいて陰窩様構造の形成を促進する。
2.2.4 BMP勾配
BMPシグナル勾配もまた腸内に存在し、終末分化したIECサブタイプの割合の調節や、ISCニッチと陰窩のコンパートメント化に役割を果たしている。Bmpr1aの欠損はパネス細胞の分化に影響を及ぼし、リゾチームや他のパネス細胞マーカーの発現低下をもたらす。Smadが介在する幹細胞シグネチャー遺伝子の抑制を通じて、BMPシグナル伝達は、恒常性と再生の間、ISCの適切な自己複製を保証する。BMP4は固有層全体に発現するが、その同族受容体であるBmpr1aは、絨毛に沿ってIECが発現し、ISCにも発現する [30] 。 [一方、クリプト周囲の腸管上皮下筋線維芽細胞およびSMCは、BMP拮抗物質であるグレミン、ノギン、およびコーディン様タンパク質のパラクリン分泌を通じて、クリプトにおけるBMPシグナル伝達に対抗する。
2.2.5 Eph/エフリン勾配
Eph/Ephrin相互作用は、接触に基づく細胞間相互作用であり、軸索の経路誘導や神経堤細胞の移動を含む発生過程において、反発性の合図を与えることで最もよく知られている。逆に、EphrinB2とEphrinB3の発現は絨毛先端で最も高い。この発現プロファイルは、増殖上皮細胞と分化上皮細胞間の機能的移行を反映している。EphB/EphrinBシグナル伝達が阻害されると、増殖細胞と分化細胞の混在が起こり、パネス細胞の下方への移動が失われる。また、EphBシグナルが細胞周期のリエントリーを誘導することで、腸前駆細胞の増殖を促進するという証拠もある[36]。
2.2.6 気体勾配
シグナル伝達経路の勾配に加えて、陰窩-絨毛軸に沿った気体勾配も存在する。例えば、クリプト基底部で圧力が80~100mmHgの粘膜下層から、圧力が10mmHg未満の絨毛先端部へと酸素が拡散する。実際、IEの内腔側は恒常的な条件下では低酸素状態であり、低酸素環境にエネルギー要求を適応させる[37]。酸素の利用可能性は、免疫調節、粘液産生、上皮分泌において役割を果たす一酸化窒素(NO)の化学的性質に影響を及ぼす[38]。酸素レベルはまた、腸内の微生物叢のタイプにも影響を及ぼす。実際、大腸内腔の酸素濃度が低いと、メタン、H2、H2Sのガス状勾配を産生する嫌気性微生物にとって好都合な環境となる[39, 40]。これらの嫌気性ガスは様々な疾患に関与しており[40]、NOと同様にH2Sも非常に低レベルのガス伝達物質であり、腸管における分泌促進作用、平滑筋弛緩作用、抗炎症作用が報告されている[41]。
2.2.7 微生物および微生物由来産物の勾配
腸内には、栄養吸収、代謝、免疫調節、潜在的病原体に対する防御などの役割を果たす数百種の常在細菌が存在し、複雑な生態系を形成している。微生物群集の不均衡は、様々な病態の原因となる。小腸は大腸よりも酸性で、抗菌防御機構が発達しているため、腸内細菌叢は比較的少なく、増殖の早い通性嫌気性菌が優勢である。大腸は、腸内細菌叢の中でより密度が高く、より生物多様性の高い部分を含んでおり、バクテロイデス・テタイオタミクロンなど、多糖類を炭素源として利用できる種が支配的である。無数の微生物と微生物産物が腸全体に勾配をもって存在し、管腔に近いほど増加している。このような環境では、活性化は連続的であるため、IECが産生する可溶性因子は内腔に拡散し、微生物産物と逆勾配で存在する。さらに、常在菌の代謝産物もIEを横切って勾配をもって存在し、バリア機能の維持に関与している。
2.3 腸管における間質細胞とその他の細胞の寄与
上皮の下には、無数の間質細胞を含む細胞およびECMに富んだ組織層がある。これらには、ECMを形成し維持する線維芽細胞、血管細胞、神経細胞、さらに多数の自然免疫細胞集団および適応免疫細胞集団が含まれる。
2.3.1 線維芽細胞、血管細胞、神経組織細胞
線維芽細胞と筋線維芽細胞は、上皮の下層と支持組織である固有層を支配し、創傷治癒において重要な役割を果たしている。これらの細胞はともに、ECM成分およびマトリックスメタロプロテアーゼ(MMP)などのECMリモデリング因子の重要な供給源である。 [43] 腸管上皮下筋線維芽細胞(ISEMs)は、デスミン非存在下でビメンチンとα-平滑筋アクチンを発現しており、その収縮力は間充織の生化学的および力学的性質に影響を及ぼす。固有層と粘膜下層を隔てる層にはSMCが存在する。SMCは食物の内容物を消化管に沿って移動させる蠕動運動を担っている。また、SMCは絶えず弛緩と収縮を繰り返し、微生物や分泌物を陰窩から排出し、宿主と病原体の相互作用を制御している。SMCとISEMは、ISCニッチを維持するBMP拮抗因子などの栄養因子の重要な供給源でもある。
SMCの下、粘膜下層内には、腸血管とそれに関連する周皮細胞がある。血管は組織に栄養を供給し、循環している免疫細胞を腸に送り込むため、粘膜内免疫応答を直接誘導することができる。さらに、放射線誘発性傷害後の内皮細胞の生存がマウスにおけるISCの生存に必要であることから、内皮細胞はISCの恒常性維持に重要であると考えられている [47] 。腸血管系は、腸の内容物を体内の他の部分から隔離するさらなるバリアーを構成し、ビタミン、コレステロール、および腸ホルモンの吸収と輸送にも重要である。
腸管神経系(ENS)は、腸管神経叢と粘膜下神経叢という2つのサブネットワークから構成されており、これら2つのサブネットワークは、共に局所的な自律機能を発揮することができる [49] 。腸管には、固有一次求心性ニューロン、運動ニューロン、介在ニューロン、腸グリア細胞など、多くの種類の腸管ニューロンが存在する。腸管ニューロンはともに粘膜下筋を支配し、腸の運動と蠕動を調節している。さらに、粘膜を神経支配する分泌運動ニューロンは、粘膜のイオン透過性を制御する。これは、血管系、間質液、および腸管内腔の間の体液交換と栄養要求のバランスをとるために、粘膜血流が適切であるようにする腸管血管拡張ニューロンの努力と連動して起こる[50]。一方、腸グリア細胞は、腸管バリア機能を制御し、炎症性サイトカインを分泌することによって、神経保護的役割を果たす[51]。
2.3.2 腸管免疫細胞集団
腸は免疫細胞に富んでおり、粘膜免疫は広範かつ複雑な分野である。簡潔に述べると、マスト細胞、自然リンパ系細胞(ILC)、マクロファージ、樹状細胞(DC)、T細胞、B細胞など、多数の特殊な自然免疫細胞集団および適応免疫細胞集団が、IECおよび常在細菌叢との双方向の相互作用に関与し、粘膜バリアを制御、維持、再生する寛容な粘膜免疫を形成している。
腸に特に多く存在する免疫細胞集団はマクロファージである。マクロファージは全身に存在するが、腸管固有層のマクロファージは、特にリクルートされたLy6C+血液単球から補充され [53] 、固有層でマクロファージに成熟する [54] 。これらのマクロファージはインターロイキン-10(IL-10)を産生し、マクロファージのTLR(toll-like receptor)低応答性を促進し、Treg細胞の分化を促し、抗原に寛容なFoxP3+Treg細胞の生存を促進する。 [炎症時には、正常なLy6C+単球の成熟が阻害され、単球とマクロファージの両方が、TLR応答性と炎症性エフェクター細胞への転換を刺激する炎症性サイトカインを産生する[56-59]。
腸は異物を受け入れるため、腸関連リンパ組織(GALT)が過剰に活動しないようにすることが重要である。重要なことは、アルカリゲネス属を含むリンパ組織常在細菌が粘膜寛容に重要であると考えられていることである[60-63]。例えば、アルカリゲネス属はDC内に不活性に存在し、IL-6とトランスフォーミング増殖因子-β(TGF-β)の産生を刺激することで免疫監視に関与し、Th17細胞の活性を抑制することで寛容を促進する。 [60, 61] さらに、DCはIL-23を産生し、このIL-23は3型ILCによるIL-22産生を誘導し、IECによる抗菌ペプチドの分泌につながり、他の細菌種によるコロニー形成を制限する。 [64] さらに、パイエルパッチと呼ばれるドーム状の構造を形成する濾胞関連上皮内では、特殊化したM細胞が内腔の内容物をサンプリングし、トランスサイトーシスによって基底部の細胞外腔に放出する[65]。M細胞はその基底部表面にマイクロフォールドを持ち、これらの抗原を処理するDCを取り込み、CD4+ T細胞にペプチドエピトープを提示し、適応免疫応答を誘導する[66]。
3 ネイティブ腸の物理的ニッチ
腸のECMは、組織に構造的支持を与え、ISCニッチに物理化学的な手がかりを与える。この物理的ニッチは、基底膜とその下の薄層前膜からなる。基底膜は主にラミニン、コラーゲンIV、ニドゲン、テ ナシンC、フィブロネクチンからなり、上皮を前膜に固定す る構造として強固に結合している。薄層前膜は、緩く結合したラミニン、線維性コラーゲン、フィブロネクチン、およびヘパラン硫酸プロテオグリカン(HSPG)とヒアルロン酸(HA)を含むグリコサミノグリカンで構成されている[51]。建築的支持を提供することに加え、腸ECMは成長因子のリザーバーとして、また細胞が生化学的シグナルと機械的力の両方に反応するための動的媒体として働く。
3.1 腸管ECMの構成
コラーゲンは豊富なタンパク質のスーパーファミリーであり、組織の重要な構造成分である。I型、III型、IV型、VI型コラーゲン(ColI、ColIII、ColIV、ColVI)は腸全体に豊富に存在するが、上皮系と間葉系による発現の違いにより、ColIVとColVIが存在する基底膜と、ColIとColIIIが優勢な固有層とは区別される。 [67-72] この分離は、ColIVとColVIが物理的なISCニッチを規定するのに役立っている可能性を示唆しており、IEC特異的ColVI欠失が、陰窩のホメオスタシスを阻害する細胞形態と遊走状態の変化をもたらすという証拠により支持されている[72]。例えば、傷害に応答して、ISEMはコラーゲンの沈着を制御し、バリアの完全性を補強して創傷治癒を可能にする。傷害治癒後、過剰なISEMはアポプトースし、コラーゲンレベルは恒常性レベルに戻る。
ラミニンは基底膜に豊富に存在する糖タンパク質で、そのサブタイプは空間的、時間的に異なる発現パターンを示し、種特異的である。ラミニン-α1と-α2はマウス腸全体の陰窩の基底膜に濃縮され、ラミニン-α5は絨毛領域に局在する。マウスの上皮下基底膜におけるラミニン-α5の条件付きノックアウトは、大腸ラミニン-α1および-α2の異所性沈着を引き起こし、小腸の絨毛構造を消失させる。 [対照的に、ヒトでは、ラミニン-α1およびラミニン-α5は絨毛に局在し、発生初期に存在する。
フィブロネクチンは腸ECMのもう一つの重要な構成成分であり、線維芽細胞とIECの両方から分泌される。フィブロネクチンは、グリコサミノグリカン、コラーゲン、およびRGD結合インテグリンに対する複数の結合部位を含む[76]。マウスの腸では、フィブロネクチンは炎症に応答して発現が上昇し、核因子-κβの発現を誘導することができる。
腸ECMの主要なグリコサミノグリカンはHSPGとHAである。HSPGは主にBMに局在する線状の多糖で、その中でもペルレカンが優勢である[77]。HSPGはWnts、ヘッジホッグリガンド、TGF-β、線維芽細胞増殖因子(FGF)などの増殖因子と結合する[51]。 [51] 実際、ヘパラン硫酸はマウスにおいてIECsとWntリガンドとの結合親和性を高め、放射線照射後の再生を助けている[78]。HAはd-グルクロン酸とN-アセチル-d-グルコサミンの二糖繰り返しからなる非分岐多糖である。HAは多くの組織に豊富に存在し、しばしば組織の水和に関与している。しかしながら腸内では、HAは免疫反応の制御においても重要な役割を果たしている。HAはtoll-like receptor 2と4(TLR2/4)によって認識される断片に切断され、炎症性サイトカインとケモカインの産生を誘導する[79]。TLR4を発現している陰窩周囲マクロファージはHA断片を感知し、最終的にISCの増殖と陰窩分裂を促進するシグナル伝達を引き起こすことができる[80]。さらにHAとその断片は、白血球浸潤と活性化された筋線維芽細胞を介する線維化に関連している。
3.2 腸ECMの酵素制御因子
腸管ECMは常にリモデリングを起こし、恒常性維持時および疾患時の双方において、その生化学的および力学的特性を変化させている。実際、ECMの沈着と分解のバランスを保つことは、傷害や炎症などの課題に対応し、比例し続けなければならない。数多くの酵素が直接的、間接的に腸管ECMの分解、沈着、構造に影響を与えている。
3.2.1 生理的ECMリモデリング
MMPはタンパク質分解酵素のファミリーで、ヒトには23のメンバーが存在し、他の機能の中でも特にECM成分を分解する[81]。その破壊的な性質から、MMPの発現と活性は厳密に制御されなければならない。この制御は、翻訳後修飾、miRNA[82]、および広範な組織メタロプロテアーゼ阻害剤(TIMPs)による酵素的な制御の組み合わせによって達成される[81]。アンカー型メタロプロテアーゼ-ジインテグリンタンパク質(ADAMs)などの他の分解性プロテアーゼもまた、腸管ECMを制御している。ECMのリモデリングは架橋によっても媒介される。例えば、組織トランスグルタミナーゼは、ポリペプチド鎖間およびポリペプチド鎖間のγ-グルタミル-ɛ-リジンイソペプチド結合の形成を触媒し [83] 、リジルオキシダーゼおよびリジルオキシダーゼ様酵素は、リジン残基およびヒドロキシリジン残基を脱アミノ化することにより、コラーゲン線維およびエラスチンを架橋する [84] 。これらにより、腸のホメオスタシスおよび再生に重要な動的ECMが形成される。
傷害に応答して、MMPおよびその阻害因子の発現は、高度に制御された様式で制御される。例えば、TIMP-1とTIMP-2の発現は初期に増加し、MMPの作用に対抗することが創傷治癒に重要であることを示唆している。コラーゲンの沈着は、損傷に対する急性反応の間、バリアー の完全性を補強し、創傷に関連した上皮細胞が創傷床に住み着くことを 可能にする。その後、隣接する陰窩のISCが移動してこれらの細胞と入れ替わり、再生を促 進する。間葉系細胞は創床の下にある間質に局在し、幹細胞の増殖を制限する [86] 。急性修復期の後、修復が完了するまでMMP2とMMP9の発現が上昇する。
3.2.2 病的ECMリモデリング
ECMリモデリングの調節異常は、多くの腸疾患に共通する特徴である。クローン病(CD)も潰瘍性大腸炎もECMリモデリングの異常を特徴とする。潰瘍性大腸炎は大腸BMの破壊による病変を引き起こす。従って、これらのタイプのIBDはECMリモデリング酵素の発現の差によって区別される。例えば、MMP7はCD患者の大腸組織で上昇し[88]、MMP2とMMP9の発現増加がCD患者で認められている[89]。実際、これらの患者ではMMP9レベルが非常に上昇するため、MMP9はしばしばこの疾患のバイオマーカーと考えられている[90, 91]。
ECMの非典型的なリモデリングもまた、炎症とCRCの進行に関与することが知られている[92, 93] 。ADAM17とADAM15の発現は炎症組織のIECにおいて増加し、一方ADAM10はCRCの後期においてアップレギュレートされる[94-96]。 [さらに、IBDと同様に、CRCではMMP2とMMP9の両方がアップレギュレートされている [89, 99] 。CRCにおけるこの異化酵素のアップレギュレーションは、コラーゲンIVがColIに置き換わり[93, 100]、CRCの進行に伴ってリシルオキシダーゼの発現が増加するにつれて架橋が進むため、ECM組成の変化とも相関している [101] 。]
マトリックスを物理的に変化させるだけでなく、ECMリモデリングの調節異常は成長因子の生物学的利用能にも影響を及ぼす。HSPGを含む腸管ECM成分は成長因子と結合し、リガンドリザーバーとして働く。実際、FGFシグナルは生存と増殖を促進し、CRCの幹細胞性を維持することが示唆されている。 [同様に、血管内皮増殖因子の様々なアイソフォームはコラーゲンと結合することができ、MMP9を介したリモデリングにより、通常は静止している血管系が癌の発生時に血管新生を起こすことがある。このような背景から、ECMの組成や力学的構造の変化が、腫瘍形成を促進する線維化微小環境の発達を促し、IBD患者がCRCを発症するリスクが高い理由を説明するかもしれない。
3.3 腸内の力学的手がかり
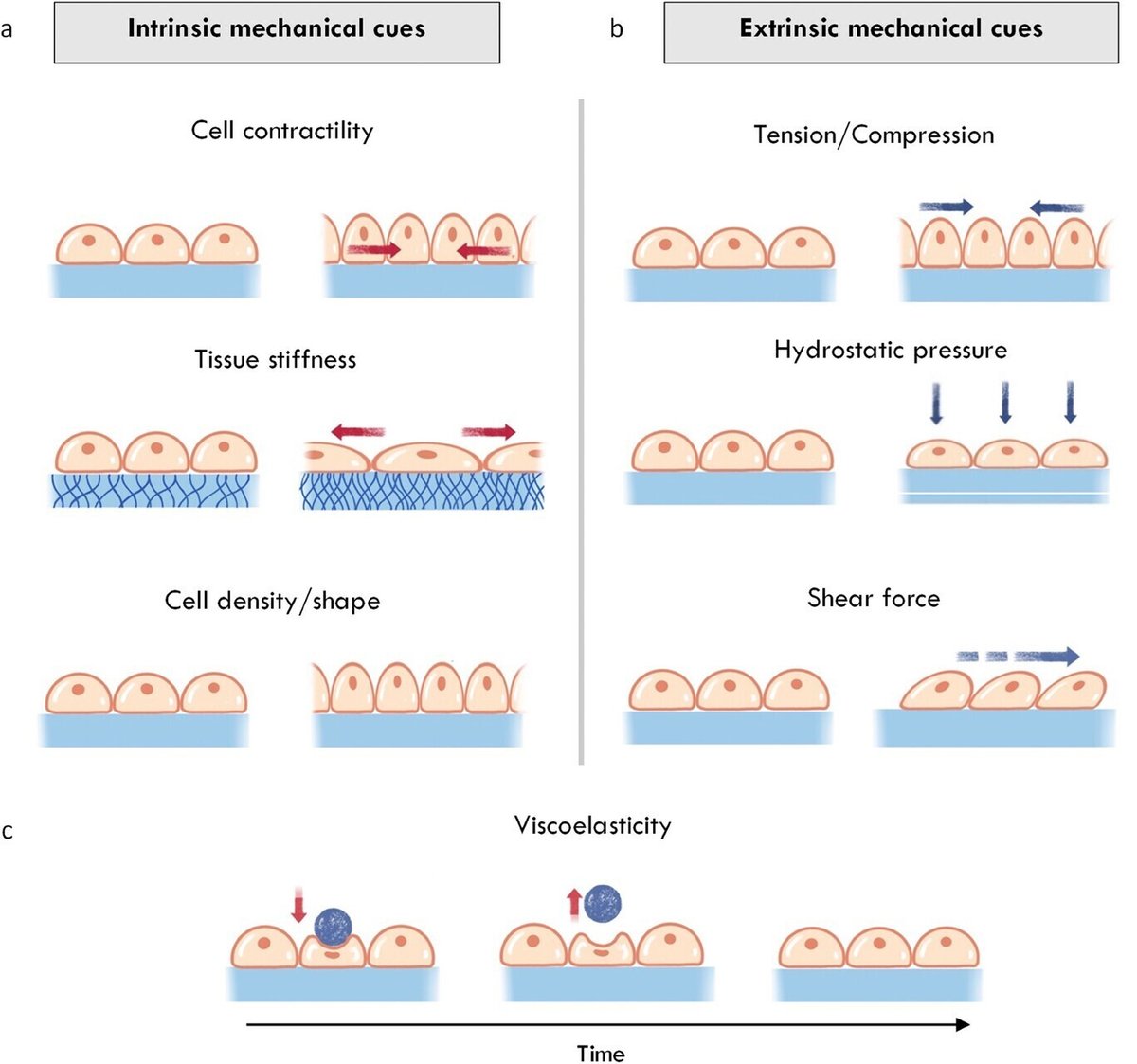
哺乳類の腸は、適切な臓器機能にとって重要な様々な物理的力を経験している。腸は、例えば組織の硬さのような内在的な機械的合図を受け(図2a)、せん断流、圧縮および静水圧[106]によって発生する外在的な力に反応します(図2b)。物理的な手がかりは組織レベルで作用し、器官の形態や機能に影響を与えるだけでなく、より小さなスケールでも作用し、それによって機械的な力が細胞内シグナルに変換され、増殖、分化、移動などの多様な細胞プロセスに影響を与える。腸のメカノバイオロジーの分野は多様であり、他の文献で詳しく概説されている[102]。ここでは、セクション4と5で述べたように、バイオエンジニアリング戦略を用いて現在利用されている腸内の力学的手がかりについて簡単に説明する。
詳細は画像に続くキャプションを参照されたい。
図2
図ビューアーで開く
パワーポイント
キャプション
3.3.1 腸組織の力学的特性
腸は粘膜、粘膜下層、筋層、漿膜という同心円状の管の層状複合体である。これらの層の構造と物理的特性(剛性および常在細胞が発生させる張力を含む)により、安静時の腸の力学的背景が確立される。剛性は加えられた力に抵抗する材料の能力を表す。弾性率(E)は剛性のサイズに依存しない尺度であり、材料の固有特性です。組織のEは、組織の常在細胞とECMタンパク質のE、その密度、組織内の空間的組織の両方から影響を受ける。健康な大腸組織のEは0.7~0.9 kPaと報告されている[96, 107, 108]が、Eが2.4~7.5 kPaの大腸がん組織とは対照的である。同様に、腸の炎症部位は非炎症部位の2倍も硬いようである[96]。CD患者の腸でも硬直が観察され、16.7kPaという高いEを持つ狭窄が報告されている[109]。
しかしながら、硬さだけでは腸組織の力学的特性の全体像を把握することはできない。他の軟組織と同様に、腸は粘弾性であり、これは組織が時間依存性の力学的特性を示すことを意味する(図2c)。例えば、加えられたひずみに対して、組織は応力緩和を起こすか、あるいは時間の経過とともに変形に対する抵抗力が減少する。このような粘弾性応答は、腸の高度に水和した複雑な線維性構造 [110, 111] に起因する。したがって、例えば食物の通過に伴う内腔の膨張から生じる圧縮力は、応力緩和によって粘膜と筋層との間で放散される可能性が高い [112] 。
腸の構造は物理的な力に対応するように設計されている(図3a)。例えば、ラットの小腸の走査型電子顕微鏡像によると、粘膜下コラーゲン線維は、時計回りと反時計回りの2本の糸が斜めに対をなして編まれており、消化中のように組織が経験する力に対抗するのに適した配列になっている。 [103]さらに、安静時には、腸管平滑筋は部分的に収縮した状態で存在することで、物理的な要求に反応するようにプライミングされている[107]。このように腸管層全体で張力が異なるため、組織は残留応力のレベルを維持することになる。
詳細は画像に続くキャプションに記載されている
図3
図ビューアーで開く
パワーポイント
キャプション
3.3.2 腸における動的な力学的手がかり
腸は消化活動中も消化間期も動的な力を受ける。組織レベルでは、摂取された食物や微生物代謝による分泌物やガスによって内腔が満たされる際に腸壁が膨張すると、腸は引張力や圧縮力を受ける(図3c)。膨張は組織に外力として作用し、断面積を増大させ、腸壁を薄くする。腸管はまた、内腔の内容物が通過する際に、上皮表面に平行に働くせん断力を経験する。蠕動収縮は、管腔内容物の一方向の変位を駆動する主な力である。同心円状の筋の分節性収縮は、栄養吸収を容易にするために、管腔内容物を腸分泌物と混ぜ合わせ、すりつぶす。これらの収縮は腸全体で起こり、内腔内容物をあらゆる方向に移動させる[108]が、縦走筋の収縮と同期して作用することにより、内腔内容物は腸管に沿って前進する[105]。この内腔の流れは、腸の異なる層や領域に異なる影響を与える。例えば、上皮はせん断力を直接受けるが、より深い層では圧縮力や引張力しか受けない。実際、絨毛に沿った細胞は、庇護されている陰窩の細胞よりも高いレベルのせん断力を経験している。同様に、小腸内の管腔内容物はより流動的であり、通過する際に比較的大きなせん断力を及ぼす。これとは対照的に、結腸の内容物はより固形であるため、組織に 対して比較的大きな圧縮力や引張力を及ぼす。
3.3.3 腸管上皮における機械的駆動過程
乳化
腸の乳化は胚発生の過程で起こる。マウスでは、この過程はあらかじめパターン化された局所的な上皮間葉相互作用に依存している。このプロセスを駆動する正確なメカニズムは不明であるが、上皮下間葉は高密度のクラスターに凝集し、外向きの上皮の変形を促進する。 [これらの細胞が増殖して丸くなると、圧縮力によって上皮細胞は基底方向に移動し、将来の陰窩の部位で頂端浸潤を起こす。ヒトにおける絨毛化を支配するメカニズムは不明なままであるが、空間トランスクリプトミクスは、マウスと同様に、出現した絨毛の下に生じる間葉系亜集団の存在を示している。
クリプトの形態形成
絨毛化と同様に、細胞から発生する機械的な力は陰窩の形態形成に中心的な役割を果たす。絨毛化では、増殖細胞は基底に押しやられ、絨毛間上皮に限定される。その後、絨毛間上皮は侵入し、ISC前駆体はこの領域に濃縮される。陰窩のコンパートメント化は、陰窩と絨毛の境界を決めるくさび形のヒンジ細胞の発生によって完了する。マイソシンIIに依存した絨毛間上皮の頂部収縮が陰窩の浸潤を促進し、アクトミオシンに依存したヒンジ細胞の基底部収縮がコンパートメント化を維持する[119-121]。このような過程は、柔らかい表面上で2次元単層培養したマウスIO(mIO)でモデル化されており、細胞緊張の差に応じて陰窩と絨毛様ゾーンに組織化される。 [これらの観察結果は、IECの張力と基質の硬さの両方が陰窩の形態形成を制御していることを示唆している。
陰窩の形態形成に関する洞察は、陰窩の分裂に関する研究からも得られている。パネス細胞はISCよりも約4倍硬く、インテグリンβ4の発現レベルが有意に高い[122, 123]。したがって、パネス細胞によって基底膜を通して加えられる細胞張力は、陰窩の分岐と出芽につながる陰窩壁の変形を制御している[123]。実際、パネス細胞の固定と張力は、ISCを機械的に、細胞張力の低い陰窩基部のクラスターに追いやると考えられている。ISCが増殖するにつれて、これらの柔らかい領域は、近接する陰窩からの圧縮力に応じて座屈しやすくなり、分裂現象につながる。一方、異常な陰窩の病巣はIBDでよくみられ、CRCで最も早く観察される変化と考えられている [124] 。APC遺伝子の活性化変異は散発性CRCにおける最も早い遺伝的変化と考えられており、それだけで陰窩の変形を引き起こすのに十分である [125] 。したがって、陰窩の細胞緊張も腸疾患において重要な役割を果たしている可能性がある。
細胞の運命決定
可溶性因子は腸細胞のアイデンティティに影響を及ぼす;しかしながら、機械的な合図も重要な役割を果たすことを示唆する証拠がある。メカノトランスデューサーであるYAP(Yes-associated protein)の発現は、前駆細胞の増殖を促進し、杯細胞の分化を誘導する [126] 。実際、硬い基質上で培養したmIO由来の単層はYAPの発現を上昇させ、ISCの分化は杯細胞へと偏る。 [126, 127] さらに、YAP発現は傷害時に誘導され、通常幹細胞コンパートメントを維持するWntシグナル勾配を弱める。YAP発現はまた、mIOにおける対称性の破れにも重要であることが示されている。この文脈では、確率的なYAP発現が対称性の破れに必要であり、ランダムに高いYAP発現を保持する細胞がパネス細胞に分化し、新しい陰窩の位置を決定する。
増殖、遊走、脱落
機械的な合図は、腸細胞の増殖、遊走、脱出などの基本的なプロセスにも影響を及ぼす。豚の空腸細胞は伸張に反応して増殖し [110] 、周期的伸張はCaco-2細胞単層とヒト初代IECの両方の増殖と分化を刺激することが示されている [111, 112] 。
遊走も同様に、機械的に駆動されるプロセスであると現在では理解されている。以前は、増殖圧がIECを陰窩-絨毛軸に沿って移動させると考えられていた。しかし、増殖を抑制しても、IECの陰窩からの移動が遅くなるだけで、細胞は依然として活発に絨毛を移動している。実際、mIO由来の単層膜の牽引力マッピングは、絨毛領域で発生する牽引力によって細胞が幹細胞コンパートメントから引き出されることを示している。これらの報告を総合すると、有糸分裂の圧力による押し出し力と、絨毛を活発に移動するIECによって発生する引っ張り力が相乗して、陰窩から細胞を引きずり出すことが示唆される。
正常なIECの交代期には、絨毛を移動する分化腸細胞は最終的に内腔に押し出され、そこで脱落(shhedding)と呼ばれる過程を経て、アノイキスにより死滅する[132]。これは伸張に応答するPiezo1によって感知され、アクトミオシン駆動性のタイトジャンクションの再配列を開始する[133]。押し出しはジッパーのように働くと提唱されており、それによって押し出された細胞はE-カドヘリンジャンクションを分解する一方で、タイトジャンクションを膜の基底側に再配列させる。
上皮分泌
蠕動運動とホルモンおよび粘液の分泌に必要な機械的プロセスを調整することは、栄養素の効率的な消化吸収に不可欠である。腸内分泌細胞は特殊なIECであり、腸神経シナプスとの結合と電気的興奮能力により、これらの機械的プロセスを制御する腸-脳軸に関与していると考えられている。腸内分泌細胞は、満腹感、消化、グルコース代謝を制御するホルモンの分泌を調整するために、内腔と循環する栄養素を感知し比較する役割を担っている。腸内分泌細胞は腸に沿ってまばらに存在し、ホルモンの発現に基づいて7つのサブタイプ(K細胞、L細胞、デルタ細胞、X細胞、I細胞、S細胞、N細胞)に分類される[134]。腸クロム親和細胞は、管腔内容物と管腔の力学を感知すると考えられているもう一つのサブタイプである。同様に、杯細胞はピエゾ1を発現しており、ムチンを分泌することで、結腸内の静水圧の上昇に応答する[137]。
4 腸の細胞的、生化学的、構造的構成要素を模倣する
生来の組織は複雑であるため、試験管内で臓器を構築することは困難である。実際、腸を正確にモデル化するには、細胞の不均一性と微生物相互作用を再現すること、機械化学的に正確なECM、生化学的・生物物理学的勾配、管腔の流れ、蠕動筋収縮を作り出すこと、さらに血管系やリンパ管と並ぶ正確な3D構造にこれらすべての手がかりを組み込むことが必要である。しかし、これらの細胞、特徴、機能性を、IOが本来持っている自己組織化能力と漸進的に組み合わせる共培養モデルや生物工学的アプローチによって、研究者はこのようなin vitroモデルを確立できるようになってきている。ここでは、セクション2と3で概説した本来の腸の細胞的・物理的構成要素に関する考察を踏まえ、腸の複雑な細胞を再現する戦略と、その生化学的組成と構造的特徴を模倣するための生物工学的取り組みについて概説する(図4)。
詳細は画像に続くキャプションにある。
図4
図ビューアで開く
パワーポイント
キャプション
4.1 腸管上皮の再現
2009年以前は、腸上皮のほとんどのin vitroモデルは腫瘍由来であった。腸管細胞のような極性と機能を持つ単層に分化する細胞株もあるが、親癌性の選択により増殖、増殖、分化が変化するため、疾患特異的な研究や健康な腸の生理と発達を理解するための使用は制限される[138]。初代IECの培養は、in vivoでの細胞の不均一性をより忠実に再現するが、これらの細胞を長期間維持することはできない[139-141]。
これらの障害に取り組むため、SatoらはIECの長期培養をサポートするために、ISCニッチを再現する方法について述べた。この戦略により、自己複製、増殖、多系統分化が可能なISCを含む、現在ではIOsと呼ばれる嚢胞構造が生成された。さらにIOは、構造の複雑さと極性を発達させ、最終的には親臓器を彷彿とさせる構造的・機能的特徴を獲得する[143, 144]。この画期的な研究は、ISCニッチの生化学的特徴と3D ECM特徴の両方の重要性を強調し、異なる細胞源からIOを開発する道を開いた。
4.1.1 IO細胞源とその応用
IOは、健康な、あるいは病気の生検やがん細胞から採取した組織常在 成人幹細胞(ASCs)から樹立することができる。また、人工多能性幹細胞(iPSC)のような多能性幹細胞から樹立することもできる。組織由来細胞は、組織を機械的または酵素的に破壊することで採取され、3Dマトリックス内に埋め込まれてENR培地で培養されると、自己集合してIOとなる。マトリックスに播種する前に、ISCはしばしば精製される。例えば、Lgr5-GFPを発現するトランスジェニックマウスからのISCを蛍光ベースの細胞選別することで、IOが正しい前駆細胞集団から形成されていることを確認できる。腫瘍生検も同様に処理できるが、オルガノイドを作製するのに十分な細胞数を拡大するために、異種移植片として培養する必要がある場合もある。さらに、がん由来のオルガノイドを形成するには、正常細胞からがん細胞を選別したり[145]、特別に調製した培地を用いてがん細胞を選択したりする必要がある場合もある。多能性幹細胞を用いてIOを形成する研究のほとんどは、iPSCに依存している。iPSCは、未分化のクローン性凝集体として樹立され、維持されている。ヒトiPSC由来のIO(HIO)を作製するために、iPSCはまずActivin Aの補充によってFOXA2+/SOX17+の内胚葉に分化させられ、続いてFGF4とWnt3aを用いてCDX2+の中後腸組織にパターニングされる。
疾患のモデル化
腸内の様々な細胞集団や構造が感染時に重要な役割を果たし、細胞株よりもIOの方がよく模倣される。例えば、IOは上皮と細菌の相互作用を調べるのに使われており、IOに細菌や細菌毒素をマイクロインジェクションして、先端側との相互作用を研究している。また、IOを先端側が外側になるように増殖させたり、菌や毒素を懸濁させたIOを解離させたりして、基底側との相互作用を調べた研究者もいる。これらの技術は、IECと様々な細菌種[150-152, 171, 173, 176]、さらにはウイルスとの相互作用の研究に用いられている[154, 155]。これらのモデルにおいて、IOはin vivoで見られる細菌/ウイルスの侵入、細胞構造、発現プロファイル、炎症反応を再現している。同様に、大腸がん[156]、嚢胞性線維症[157]、IBD[158]などの疾患も、IOを用いてモデル化されている。遺伝子編集はまた、嚢胞性線維症患者[157]のIOにおける膜貫通型受容体の修復にも用いられている。同様に、CD患者のIOは、上皮バリア機能の改善を目的とした治療法の試験に用いられている[158]。
バイオバンク、個別化医療、薬剤スクリーニング
個別化医療、特にがん患者に対する個別化医療の必要性から、健常および疾患患者由来オルガノイド(PDO)コレクションの作製が促されている。患者の遺伝的特徴をPDOで表現することができ、長期にわたって安定した状態を保つことができるため、このようなモデルは個別化された遺伝子検査や大規模な薬剤スクリーニングを可能にする。さらに、異種移植を用いることで、より生理学的に代表的な微小環境におけるPDOの発育をモニターすることができる。この分野はまだ比較的未発達であるが、すでに大腸PDOの利用により、標的となりうるが希少な遺伝子変異をスクリーニングするためのバイオバンクの可能性が浮き彫りになっている [159, 160]。
4.1.2 IOベースのモデルの限界
IOは腸の研究において有用であることが証明されているが、IOはその構成細胞内(臓器内異 質性)および異なるサンプル間(臓器間異質性)で不均一性を示す。オルガネラ内およびオルガネラ間の不均一性は、生物学的システムの複雑性を反映しているため、発生や再生のモデル化、患者間の疾患状態の比較に有用である。しかし、創薬や精密医療などの応用には、高いばらつきは適切ではない。HIO培養におけるばらつきの一部は、間葉系細胞の存在に起因すると考えられている。間葉系細胞の存在量は、継代時に行われる手作業による「洗浄」に依存するからである。CDX2eGFPノックインiPSCレポーター株を用いることで、研究者は後腸前駆細胞の出現を追跡し、それらを精製することが可能となり、その結果、間葉系細胞を含まないHIOを得ることができた。
HIOのもう一つの限界は、成体腸上皮を代表するものではないということである。その代わり、HIOのトランスクリプトーム・プロファイルは、 胎児腸管細胞のものと一致する[162, 163]。IL-2やニューレグリンを添加することで成熟を促進する ことができるが、細胞は依然として未成熟のままである[26, 164]。したがって、成体IECが必要な用途には、HIOよりも 組織由来のIOの方が適しているかもしれない。HIOを動物モデルに移植すると、細胞の複雑性が増すため、成熟が促進 される[165, 166]。他の限界としては、腫瘍を発生させる可能性があることもあり、再生への応用にはHIOは適さない。さらに、HIO関連間葉系細胞など、いくつかのIO集団は、その特性評価が不十分であり、実験結果の評価が困難になる可能性がある。
4.2 間質集団、免疫細胞、微生物叢の組み込み
間質細胞を組み込むことを目的とした腸管モデルは、多くの場合、上皮細胞との共培養の確立に依存している。これには間葉周囲細胞との共培養も含まれ、間葉周囲細胞はISCニッチ を支持する可溶性因子やマトリックスキューを提供する。腸神経系、血管、免疫細胞集団とのモデルも確立されている。さらに、腸管内腔に生息する数百種の微生物叢と腸管組織との相互作用を研究する方法も開発されている。
4.2.1 繊維芽細胞および神経系集団
IOを間葉系細胞またはそのマトリックスと共培養すると、その増殖と成熟が促進される。例えば、マウスIO(mIO)は、腸の筋線維芽細胞から分泌されるマトリックス上で培養すると、より大きな陰窩を発達させ、生存率が向上する。さらに、陰窩周囲の線維芽細胞がmIOの成長をサポートすることが示されている。
IEの根底にある他の重要な間質細胞には、周皮細胞、SMC、内皮細胞、腸神経、および無数の免疫細胞が含まれる。これらの細胞を腸の組織モデルに組み込むことはあまり進んでいない。しかしながら、機能的なENSを含むIOを発生させるための共培養プロトコルの報告はある。ヒトiPSCの神経堤細胞への分化プロトコルとHIOを組み合わせることにより、腸のENS発生を再現することができる。ENSを持つHIOは、HIO単独と比較して、低レベルの吸収系マーカーを発現し、杯細胞およびパネス細胞マーカーの発現を減少させた。さらに、ENSを持つHIOは、低レベルのTGF-βを発現し、高レベルのEGFを発現し、高い増殖率を示した[170]。最近では、このようなプロトコールが拡張され、hESCがENSや血管を含むヒト大腸に分化した[171]。
4.2.2 免疫細胞集団
常在マクロファージは、ホメオスタシスを維持・回復させる腸粘膜の寛容環境を作るのに重要である。当然のことながら、このシステムを支配するメカニズムや、IBDのような疾患においてそれがどのように障害されるかに関心が集まっている。HIOは基本的に単球走化性タンパク質-1を発現していることから、IE自体が走化性を持っていることが示唆される。これを裏付けるように、HIOとの共培養では、末梢血単核球がHIOに向かって遊走し、そこで経上皮突起を形成した。 [同様に、トランスウェル膜上で単層培養したヒト生検由来IO(hIO)を用いた2次元系では、単球由来マクロファージとの共培養によって単層の厚みが増し、バリア機能の指標である経上皮電気抵抗が改善した[175]。
マクロファージに加えて、腸粘膜にはILCを含む多数の抗原非特異的リンパ球集団が存在する。ILC1(タイプ1 ILC1)は、CD患者の腸内に濃縮されている。176] マウスILC1とmIO、および患者組織からの生検由来ILC1とHIOの両方を共培養することにより、腸管モデルを用いて、ILC1由来のTGF-βがCD44v6+上皮細胞の増殖と間葉系マトリックスのリモデリングを促進することが示されている。 [177]。腸におけるILC1のこの未記載の役割を解明することは、なぜIBD患者が癌や線維症のリスクが高いのかについての洞察を与えるかもしれない。ILC-オルガノイド共培養でも同様に、ILC-上皮相互作用が一方通行ではないことが明らかになった。共培養では、iPSC由来の腸オルガノイドも肺オルガノイドも、ILC前駆細胞にシグナルを送り、免疫細胞集団の組織特異的成熟を促すことができる[178]。
DCは腸においても重要な役割を果たしており、研究者たちはこれを組織モデルに組み込もうとしている。DCはIEと相互作用し、IEによって伝達された抗原をT細胞に提示して、適応免疫応答を行う。しかし、外来抗原によって活性化されると、DCは腸毒性炎症性サイトカインを分泌する。Nfκb2-/-マウスと野生型マウス由来のmIOを活性化したDCと共培養したところ[179]、IEがNFκBシグナルを調節して、DCの活性化による炎症ストレスに対処している可能性が浮き彫りになった。別の研究では、DCと共培養したmIOは、Notchシグナルの活性化に伴い、形態学的変化と杯細胞の枯渇を起こすことが示された。E-カドヘリンを介したDCのmIOへの直接接着は、Notchの活性化を引き起こし、DCの過剰活性化を防ぐ潜在的な標的であることを示唆している[180]。
4.2.3 微生物叢
乳児の腸が微生物のコロニー形成にどのように適応するかを理解するために、HIOに非病原性の大腸菌株をマイクロインジェクションした。実際、抗菌ペプチドの産生が増加し、粘液産生が成熟し、バリアが改善され、コロニー形成されたHIOは炎症性サイトカイン産生に対してより強くなった。
腸内細菌叢の多くは嫌気性であるため、腸管モデルに組み込むには課題がある。嫌気性菌とIOを同じ培地で培養することはできない。しかし、嫌気性菌またはその細菌産物をIOの内腔にマイクロインジェクションすることで、嫌気性菌が上皮に及ぼす影響を研究することができる。 [184]Caco-2細胞単層を支持する気密シールと微多孔膜で分離されたトランスウェルシステムを用いると、[185]嫌気性コンパートメントに添加されたFaecalibacterium prausnitziiは、Caco-2細胞の炎症反応を抑制し、バリア透過性を高めた[185]。トランスウェルと同様に、嫌気性ガスで調整された低酸素性アピカルチャンバーを含み、正常酸素性ベースナルチャンバーから分離された半嫌気性共培養システムも利用可能である。これらの培養系は、偏性嫌気性菌をコロノイド単層と一緒に培養するのに使用されてきた。このシステムでは、バクテロイデス・フラジリスはグルコースをめぐって単層と競合することが示された。これとは対照的に、A. muciniphilaとの相互作用は、ムチンの代謝を介した共生的なものであった[186]。このような進歩にもかかわらず、静的な共培養は、望ましくない細胞内代謝産物の蓄積や微生物の過剰増殖にもつながり、上皮細胞を死滅させる可能性がある[187]。
4.3 生化学的手がかりの再現における進歩
4.3.1 IO表現型の生化学的調節
腸をモデル化するためのエキサイティングなアプローチは、IOを特定の細胞タイプに濃縮することである。これによって研究者は、健康状態や疾患における特定の細胞タイプの役割を解明することができ、また、そうでなければ生体内では希少すぎて研究できない細胞集団の実験が可能になる。このようなアプローチにより、希少なIECの機能を探索する実験や、可溶性因子、薬剤、さらには共培養に対する細胞型特異的応答の解析が可能になる。
現在、ENR培地による補充は、mIOの培養に最低限必要なものである。このような可溶性の手がかりに関する知識を利用して、研究者たちは、CHIRとバルプロ酸の組み合わせでENR培地にWnt3aを添加すると、IOがISCに濃縮されることを発見した[190, 191]。逆に、R-スポンジンを除去すると、IOが腸細胞に濃縮される[191]。このアプローチにより、転写因子肝細胞核内因子4γが腸細胞分化に重要な役割を果たすことが同定された[192]。 [同様に、ノッチシグナル伝達の欠如が起こるWntシグナル伝達の状況によって、どちらの分泌細胞型(パネス細胞または杯細胞)が生成されるかが決定されるため[23]、ENRにCHIRと一緒にノッチ阻害剤DAPTを加えると、パネス細胞に濃縮されたmIOが発生し、一方、DAPTとWnt経路阻害剤IWP2を加えると、杯細胞に濃縮される。 [191] この濃縮プログラムは、mIOにおける制御ランドスケープが分泌系譜の分化によってどのような影響を受けるかを比較するために使用され、IBD関連表現型と関連する主要な制御因子が明らかにされた[193]。
M細胞は、パイエル板と同様にGALTを覆う濾胞関連上皮内に見られるまれなIECである。これらの細胞は、管腔粘液に捕捉された抗原と結合し、免疫監視のためにGALTのリンパ球に抗原を送り込む。 [194] 系統追跡により、濾胞関連上皮によって産生される核因子κ-Bリガンドの受容体活性化因子(RANKL)がM細胞の分化に重要であることが示されている。 [195] 実際、外因性RANKLで処理するとM細胞が豊富になり、以前は捉えることが不可能であった発現プロファイルが同定された [196] タフト細胞は、蠕虫による寄生虫感染に対する2型免疫応答の開始に重要な、もう一つの稀な細胞型である。蠕虫感染はIL-4とIL-13シグナル伝達を誘導し、正のフィードバックループでタフト細胞を拡大させる。これらの培養の解析から、神経細胞様シグネチャーと免疫細胞様シグネチャーを特徴とする房細胞のサブタイプを同定することができた[196]。
しかし、分化を制御する可溶性因子は、Wnt、Notch、およびマイトジェン活性化プロテインキナーゼシグナル伝達のコンビナトリアル阻害によるmIOを用いて再び見出された[199]。実際、このカクテルは、L細胞を含む陰窩の腸内分泌細胞を豊富にする。あるいは、BMP4を添加すると絨毛のS細胞が濃縮され、BMP1Aを阻害すると絨毛のL細胞が濃縮される[200]。このような進歩にもかかわらず、腸内分泌細胞のすべてのサブタイプを濃縮することは、まだ達成されていない。
4.3.2 腸全体にわたる生体内類似勾配の再現
生化学的勾配
セクション2.2で述べたように、可溶性と不溶性の勾配はISCニッチを区画化し、維持する。しかし、インビボで細胞に提示される成長因子の勾配とは対照的に、標準的なIOの培養では、ENR培地でIOを培養するため、均一な曝露となる。この問題に対処するため、生物工学的アプローチを用いて、試験管内で本来の化学的勾配を模倣することが試みられている。例えば、Wnt3aやR-スポンジンの勾配をマウス大腸腺全体に適用するために、マイクロ流体工学が用いられており、その結果、増殖因子の供給源に最も近い増殖側と、より分化した側との極性が形成されている。より最近では、フォトリソグラフィーを用いて、トランスウェルインサート上にColI官能化合成ハイドロゲルを装着した絨毛様微細構造を作製した[203]。ここで、ISCと増殖細胞は増殖因子の供給源に近い基部に局在し、分化細胞は先端部に局在した[203, 204]。しかしながら、有望ではあるが、これらのアプローチの多くは、ハイドロゲル中でさえ拡散が時間とともに勾配を無効にするため、短期的に勾配を維持するだけである。成長因子を化学的に繋ぎとめるか、一定の成長因子源を供給することが、長期培養において勾配を維持するためのより効果的な戦略であろう。
気体勾配
酸素勾配は、マイクロ流体工学を用いた腸のモデルにおいて、一つのマイクロチャンネルを通して酸素添加培地を、もう一つのチャンネルを通して反対方向に脱酸素培地を適用することにより生成されてきた。この方法によって、酸素培地が供給される側でCaco-2単 層を、脱酸素培地が供給される側の膜上で、偏性嫌気性細菌 を共培養することが可能になった[205]。別の報告では、中空の流路を持つ多孔質シルク ベースの足場に、ヒト腸の筋線維芽細胞を埋め込み、Caco-2細 胞で裏打ちした。ここでは、細胞自身の呼吸を利用して酸素勾配を発生させた[206]。
微生物勾配
微生物産物は、管腔-粘膜下勾配として腸内に存在する。Wangらは、成長因子勾配を再現した以前の研究[202] を基に、細菌発酵産物である酪酸の勾配を模倣するトランスウェルシステムを設計し、幹細胞の増殖を低下させ、吸収性結腸細胞への分化を促進した[207]。ここでは、マクロファージ-上皮間のコミュニケーションにより、上皮バリア機能とサイトカイン産生が改善され、マクロファージが上皮界面を横切って細菌産物勾配をサンプリングすることが観察された。
機械的勾配
組織の硬さは腸機能に影響を及ぼすが、IE全体に硬さの勾配が存在するかどうかは不明である。すなわち、大腸粘膜下層と粘膜のコラーゲン含有量の差(それぞれ80%と30%)[209]は勾配が存在することを示唆しているが、このような組成の変化が組織内の力学的勾配をもたらすのか、ECM-リガンド勾配をもたらすのかは不明である。2D剛性勾配を再現するために、ポリアクリルアミドハイドロゲルがしばしば採用されるが、これはその表面をECMタンパク質でコーティングし、その剛性を広い範囲で調節できるためである。剛性勾配を達成する1つの戦略は、ポリアクリルアミドがキャストされる傾斜した硬い基質を作製することであり、これにより下層の硬い基質の勾配が細胞により感知されるようになる[210, 211]。あるいは、光重合開始剤を含めることにより、UV光への時間制御された暴露を用いて架橋を制御し、その結果剛性を制御することができる。機械的勾配を再現するための生物工学的アプ ローチの詳細については、過去の総説を参照されたい。
5 物理的ニッチを模倣する
セクション3で述べたように、ECMは恒常性維持時 や疾患時に腸内で受動的な傍観者ではなく、積極的な参 加者である。上皮を模倣するIOの開発は、腸の物理的構造をより忠実に再現するin vitro系の進歩によって反映されてきた。多くのアプローチは、生きた細胞を封じ込め、生来のECMの多くの側面を模倣することができるハイドロゲル(水に膨潤したポリマーネットワーク)の使用に依存している[215, 216]。
5.1 腸管細胞培養を支持する3Dマトリックス
5.1.1 天然バイオポリマー
IOを含む3D細胞培養に最も広く用いられているマトリッ クスは、マウスのエンゲルブレヒト-ホルム-スウォーム 腫瘍由来の脱細胞化ECM(dECM)であり、Matrigel、 Geltrex、Cultrexなどの商業名で知られている[217-219]。マトリゲルは主に4つの主要なECMタンパク質で構成されている:ラミニン(約60%)、ラミニンα1が優勢、ColIV(約30%)、エンタクチン(約8%)、ペルレカン(約2~3%)。 [220]。ColIVは腸の基底膜の重要な構成成分であるが、幹細胞、上皮細胞、内皮細胞への結合部位を含むラミニン-α1が、腎臓、[221]脳、[222]肺、[223]前立腺、[224]肝臓を含む様々なオルガノイドをマトリゲルが幅広くサポートする原因であると考えられる[225]。
マトリゲルの多用途性とその使いやすさから研究者の間で人気があるが、マトリゲルには慎重な検討が必要な限界がある。マトリゲルは動物由来であるため、トランスレーショナルな研究や免疫原性によって混乱しうる実験には不適切である。例えば乳酸脱水素酵素上昇ウイルスは、宿主であるマウスマクロファージに感染し、マトリゲル内で見つかっている[226]。このウイルスはTLR7を活性化し[227]、マウスIECではTLR7の発現はほとんど検出されないが[228]、このことはTLR7発現細胞を用いた培養の限界を明確にし、他の可能性のある異種生物汚染物質についての疑問を提起している。さらに、脱細胞化は不完全なプロセスであり、構造的なECM成分とともに、実験を危険にさらす可能性のある成長因子、サイトカイン、酵素を残す。 [232] 最も重要なことは、ECM組成と細胞分泌物は異なる動物腫瘍間で異なるため、マトリゲルのロット間で組成と機械的なばらつきがかなりあり、ゲル化速度にも影響することである。
dECMで腸のECMを再現する代わりに、ColIのようなタンパク質、あるいはアルギン酸やHAのような多糖類を含む単離バイオポリマーを使うことで、より再現性の高い特性が得られる。酸で可溶化したColIフィブリルは中性pHで自己集合し、ハイドロゲルを形成するが、これはマウスやヒトのIOの樹立と維持に適している[44, 234] ColIハイドロゲルはまた、ヒトのコロノイドを作製したり、大腸腫瘍オルガノイドに対する線維トポロジーの影響をモデル化したりするのに使われてきた[235, 236] 。 [しかしながら、ColIは腸管ECMの重要な構成成分であるが、IECが主にColIVからなる基底膜上に存在するのに対し、ColIは前膜を支配しているため、ISCやIOの培養には適さないかもしれない。 [67-72] さらに、IBD患者の非炎症腸組織より炎症腸組織の方がColI mRNA総発現量が多く[100]、ColIはCRCの病期とともに増加するが、ColIVレベルは減少する[93]。従って、ColIはIOの生存と成長をサポートすることはできるが、本来の組織の生理的複雑性を反映しておらず、健常な腸ECMを模倣するには適切ではないかもしれない。
5.1.2 合成ポリマー
完全に定義されたマトリックスは、腸管ECMを高度に 制御可能かつ還元論的に模倣する可能性を提供する。合成高分子は生物学的に不活性であ るため、研究者が化学的に生理活性を「描く」ための 「白紙のキャンバス」として機能する。合成ハイドロゲルは、機械的および生化学的な手がかりを直交的に制御でき、生物学的成分特有のばらつきを抑えることができるため、力学的実験をより効果的にサポートできる可能性がある。IOを用いたこのような実験では、注目すべき成功が得られている。しかし、腸管マトリックスを再現する可能性を持つハイドロゲルの化学的性質については、まだほんの表面を掻いたに過ぎない。ハイドロゲル化学についてのより詳細な議論については、別の総説を参照されたい[215, 218, 238, 239]。
ハイドロゲルを形成するために用いられる一般的な合成材料には、ポリエチレングリコール(PEG)、自己組織化ペプチド、ポリ(N-イソプロピルアクリルアミド)、ポリ(ビニルアルコール)などがある。ペプチドの化学的コンジュゲーションにより、これらのハイドロゲルはRGD-および他のインテグリン結合モチーフを提供し、MMP切断可能な架橋を組み込むことができる[243]。PEGは、その親水性と構造的に強固でありながら柔軟な鎖により、ハイドロゲルの効果的なバックボーンとなる[243]。さらに、PEGは異なる分子量と化学的官能性で市販されており、生体適合性のあるゲル化条件を可能にする。従って、網目サイズと剛性が変化するPEGネットワークを設計し、細胞接着、リモデリング、成長因子結合のための生物活性部位を組み込むことが可能である。さらに、光開始架橋や分解のような重合化学は、ハイドロゲルの構造と力学を時空間的に制御する可能性をもたらす。
5.2 本来の腸管マトリックスの物理化学的・力学的手がかりを模倣する
腸のようなECMを組み込んだ組織モデルは、特に線維性疾患のモデリングにおいて、マトリックスの手がかりがどのようにIEに影響を与えるかをよりよく理解できる可能性がある。Matrigelには多数の定義されていないマトリックスタンパク質が含まれているが、合成マトリックスやその他の完全に定義されたマトリックスでは、マトリックスタンパク質やマトリックス模倣ペプチドを系統的に導入することができる(図5)。
詳細は画像に続くキャプションにある
図5
図ビューアで開く
パワーポイント
キャプション
5.2.1 PEGベースのハイドロゲル
Gjorevskiたちは、PEGハイドロゲル中でのmIOの培養に成功した最初の報告者である[244]。著者らは、接着モチーフを欠くハイドロゲルではISCの拡張が支持されないことを見出した。しかしながら、ペルレカン、HA、ColIV、フィブロネクチン、ラミニン-α1を組み込んだバイオハイブリッド、あるいはRGD配列含有ペプチドを組み込んだバイオハイブリッドは、マトリゲルより低率ではあるが、すべてISCの膨張とmIO形成を支持することができた。マウスとヒトのISCの持続的な培養は、RGDペプチドを含む低欠陥マイケル付加PEGベースのハイドロゲルでも報告されている[245]。HIOも同様に、MMP分解性ペプチドで架橋し、RGD配列含有ペプチドを組み込んだPEGハイドロゲル内で生存を維持し、先端基底極性を維持することが報告されている[177]。
hIOとmIOの形成効率と収率に最適な単離されたバイオポリマーを決定するために、PEG、HA、フィブリン、アルギン酸から形成されたハイドロゲルがすべてテストされた。しかしマトリゲルを添加したフィブリンヒドロゲルは100%マトリゲルに匹敵した。マトリゲルのどの成分がオルガノイド培養に必要かを絞り込もうとしたところ、フィブリン/ラミニン-α1ハイドロゲルのみが、良好なIO形成効率、成熟、長期継代をサポートすることがわかった。
他の組織のオルガノイドも同様に、組織モデルにおける上皮の支持における特定のECMの手がかりの重要性を探るために用いられてきた。例えば、インテグリン結合ペプチドで機能化され、MMP分解性ペプチドで架橋されたPEGハイドロゲルは、様々な上皮オルガノイドの培養をサポートしている[247]。ネイティブIECによるインテグリン発現にヒントを得て、インテグリンα5β1結合フィブロネクチン由来ペプチドか、陰窩底部で優勢なインテグリンα2β1に認識されるColI由来ペプチドを組み込んだハイドロゲルが作製された。内因的に産生されるECMとの相互作用を利用するために、フィブロネクチンまたは基底膜タンパク質に親和性のあるペプチドも添加し、分泌タンパク質を局所的に封鎖した[247]。ここで、ColI由来ペプチドの封入はIO形成に不可欠であり[247]、効果的な組織成長を達成するためにISCニッチを模倣することの重要性を強調している。
5.2.2 組換えタンパク質ハイドロゲル
マトリゲルや合成ハイドロゲルを使うことに代わる選択肢は、組換えタ ンパク質から形成された材料を使うことである。RGD配列を 含むペプチドで修飾されたエラスチン様構造骨格から形成された人工 ECM内で、mIOの培養に成功している。 [248-250] この人工エラスチン様タンパク質(ELP)ハイドロゲルを用いると、高剛性ハイドロゲル内のmIOはMMP活性が高く、MMPの阻害によりオルガノイド形成が減少したことから[251]、mIOによるECMリモデリングにより硬い微小環境に適応できることが示唆される。これらの系はまた、ヒドラジン修飾ELPとベンズアルデヒド修飾HAを混合することで改良され、ヒドロゾン架橋HA ELPハイドロゲルができ、mIOの膨張、成熟、継代をサポートした[180]。HIOは、哺乳類細胞の接着やリモデリングに必要な部位を欠くアルギン酸中で培養することに成功している[252]。HIOは上皮細胞と間葉細胞の両方から構成されているため、自らECMを生成する。そして実際に、アルギン酸ハイドロゲル内で、iPSCはマトリゲル包埋HIOに匹敵する成熟度を持つHIOを形成した[252]。
5.2.3 3Dハイドロゲルの機械的手がかり
IOの持続的培養は、特定のマトリックスタンパク質または生体模倣的な手がかりの存在に依存するとしばしば報告されているが、3Dマトリックスの硬さもまた役割を果たしている。例えば、ISCのコロニー形成効率は、弾性率1300 PaのPEGハイドロゲルで最適であることが示された[244]。しかし、弾性に加えて、3Dマトリックスの粘弾性、すなわち時間依存性もIOに影響を与える。組織は多くの場合、クリープと呼ばれる 過程で、加えられた荷重に応じて時間とともに変形す る。同様に、加えられた変形に対す る抵抗は、時間の経過とともに小さくなり、あるいは応 力緩和を示すようになる。ハイドロゲルは、イオン結合や超分子相互作用に依存することで、このような粘弾性特性を模倣するように設計することができる。
1つはマイケル付加による共有結合、もう1つは三重水素結合相互作用による可逆的結合である。非分解性粘弾性ハイドロゲルと非分解性完全共有結合ハイドロゲル(弾性)の両方に単一ISCを播種すると、弾性率が高いほどコロニー形成効率が向上し[244, 253]、応力緩和の影響を受けないことが確認された。しかし、分化条件に切り替えると、共有結合で架橋したハイドロゲル内のコロニーは、腸細胞からなる出芽構造を欠く嚢胞構造に発達した。対照的に、粘弾性ハイドロゲル内のコロニーは、成熟IOに関連した出芽構造と細胞多様性を発達させた。同様に、イオン結合に依存するアルギン酸ハイドロゲル内で増殖したmIOは、正常なmIOの出芽と分化を可能にするが、非分解性の弾性ハイドロゲル内では、球状の形態を持つmIOが得られた。これらの知見は、分解性そのものよりも、物理的な閉じ込めの欠如が、mIOの分化における鍵であることを示唆している。
胎児の発生段階を超えたHIOのin vitroでの成熟には問題がある。しかし、iPSC由来の腎臓オルガノイドを用いた最近の報告から、3Dマトリックスの物理化学的および機械的な手がかりを調節することによって、この問題をどのように改善できるかについて、いくつかの洞察が得られた[255]。腎臓オルガノイドは、異なる応力緩和特性を持つハイドロゲルと同様に、様々な硬さの生物学的に不活性な酸化アルギン酸ハイドロゲル内に封入された。 [255]。IOに関する報告[244]と同様に、腎臓オルガノイドはより軟らかいハイドロゲルでよりよく発育し、最も早く弛緩するハイドロゲルに包埋されたオルガノイドが最も成熟していた。
5.2.4 繊維性ハイドロゲル
多くの合成ハイドロゲルは、ナノスケールで集合したPEG分子のような小さな分子ビルディングブロックから作られている。このような材料は、生来のECMに似た3Dネットワークを形成するが、ECMタンパク質が生来の組織に与える線維性構造を欠くことが多い。細胞は、厚いECMバンドに沿って移動し、長距離で組織の力学的特性を調べることが知られている。コラーゲンのような生体高分子から形成されるハイドロゲルは、細胞にこのような線維性環境を提供し、加えられる応力に対して非線形応答を示すが、動物由来であること、組成が未定義であること、調整可能性に欠けることなどから、その使用には限界がある。活発な研究分野は、バルクのハイドロゲル内に繊維状構造を組み込んだアプローチを用いて、より明確な、さらには完全に合成されたハイドロゲルにおいて、生理的ECMの繊維状構造を模倣することを目指している。例えば、線維性ハイドロゲルは、線維の力学的特性と生化学的 組成がhMSCsの軟骨形成にどのように影響するかを解明する ために作られた。実際、機械的負荷によって近接させると共有結合を形成する相補的な化学部位を持つ繊維をエレクトロスピニングすることによって形成される多繊維ハイドロゲルは、マクロスケール構造の作製に用いられてきた。 [258]現在までのところ、繊維性ハイドロゲルがIOに及ぼす影響についての研究は行われていない。しかし、腸の恒常性と線維狭窄性疾患におけるマトリックス力学とECM組成の重要性を明らかにするのに役立つ可能性がある。
5.3 ホメオスタシスと疾患におけるマトリックスリモデリングの再現
3.2節で概説したように、ECMのリモデリングは傷害後の恒常性の維持と再確立を積極的に行い、疾患では障害される。さらに、ECMは成長因子のリザーバーとして働き、放出されると細胞機能を変化させる。3D腸特異的マトリックスは、これらのプロセスをin vitroでモデル化する可能性を提供する。マトリゲルの構成成分の多くは細胞由来のプロテアーゼによって分解されうるが、その組成は未定義であり、またメーカーがプロテアーゼ阻害剤を添加しているため、マトリゲルを用いてin vitroモデルを構築し、腸の恒常性と疾患におけるマトリックスのリモデリングの役割を理解しようとする研究は限られている。合成マトリックスは、分解を受けやすい分子の密度や特異性を制御できるため、制御された環境でマトリックスのリモデリングを研究できる可能性がある。
5.3.1 分解性ハイドロゲルのエンジニアリング
多くの生物由来のハイドロゲルや合成ハイドロゲルがリモデリングを可能にするために創製されてきたが、その多くはハイドロゲルを分解できるように工学的に設計したものである。実際、弾性ハイドロゲルはmIOのコロニー形成を支持するものの、スフェロイドは出芽形態を形成せず、YAP誘導増殖は高剛性で最初は増強されるものの、これは一過性であり、コロニーの破綻と同時に低下する[244]。しかしながら、徐々に軟化する加水分解性ハイドロゲル中では、mIOは中間レベルのYAP活性を維持し、マトリゲル内のマーカーと同様のマーカーを発現する[244]。
もう一つのアプローチは、特異的プロテアーゼによるペプチド架橋の酵素的切断によって分解可能になるようにハイドロゲルを設計することである。特定の哺乳類プロテアーゼによる切断に対するペプチド配列の感受性が報告されている。例えば、一般的にMMP分解に寛容なペプチド、あるいはMMP9やMMP14によって特異的に切断されるペプチドによって架橋されたハイドロゲルが形成されている。 [著者らは、線維芽細胞と血管平滑筋細胞をカプセル化し、一般的にMMP分解を許容するハイドロゲル内では両者が同程度に増殖するのに対し、MMP14選択的ハイドロゲル内では平滑筋細胞が2倍多く増殖し、線維芽細胞は2倍少ないことを示した。この発見は、PEGハイドロゲル内の新生血管形成が、一般的なコ ラゲナーゼ許容性架橋に対してMMP特異的架橋を組み込むことで 改善されることを示した研究によってさらに裏付けられた[261]。
5.3.2 生理的および病理学的マトリックスリモデリングのモデリング
特異的酵素分解性をハイドロゲルに組み込んだ戦略は、神経前駆細胞(NPCs)の増殖と幹細胞化に対するマトリックスリモデリングの寄与を評価するために用いられてきた。NPCは、エラスチン様ドメインとタンパク質分解を受けやすい接着性の生理活性ドメインを持つELPハイドロゲル内に埋め込まれた。さらに著者らは、NPCが発現するADAM9による分解を受けやすいように設計されたハイドロゲルが、幹細胞性を維持することを示した。従って、このようなシステムは、共培養において特定の細胞集団の成長を制限したり促進したりするのに適しており、腸のモデルにおいて間葉系細胞集団の成長を制限したり促進したりするのに応用できる可能性がある。
合成ハイドロゲルもまた、CD線維症モデルを作製するために、HIO周囲のECMリモデリングを調べるのに用いられてきた。PEGハイドロゲルは、ホモ二官能性システイン残基末端ペプチドと官能基化マルチアームPEGとのマイケル付加を用いて形成されることが多い。しかし、ポリマー濃度が低いと、この設計は一次ループの形成を促進し、ハイドロゲルの架橋に利用可能なPEGマクロマーアームの数を減少させ、ゲル化速度に影響を与える可能性がある。この問題を克服するために、ハイドロゲルは2段階のプロセスを用いて形成された。この2段階のプロセスでは、ヘテロ二官能性ペプチドを用いることで、それぞれが所望の方法でしか反応しないようにした[177, 237] 。このような完全合成系では、ILC1との共培養により、HIO間葉系細胞がMMPを介した分解とILC1によるECMの沈着の組み合わせにより、周囲の環境をリモデリングするように促した[177, 263]。つまり、ECMのリモデリングを可能にする合成ハイドロゲルは、生理学的プロセスの研究に適しており、疾患における力学とマトリックスリモデリングの関係を解明するために用いることができる。
5.4 組織様構造と機能の工学化
マイクロ流体または臓器オンチップアプローチは、マイクロチップをベースとしたシステムと微小流体チューブを組み合わせて組織モデルを作製する戦略を包含する。チップは組織-組織界面を模倣し、従来の細胞培養アプローチでは達成できない生理的複雑性を模倣するように設計することができ、本来の腸に内在する複雑な多細胞相互作用を再現するのに理想的である。
5.4.1 細胞間相互作用
ダブルチャンネル・オルガンチップは、ECMでコートされ た多孔性膜で仕切られた2つの平行培養チャンネルを持ち、その両 面に細胞を並べることができる(図6a)[187, 264] 専用の入口と出口チャンネルがあるため、細胞、化合 物、微生物の接種が可能であり、細胞単層を独立して研究す ることができる。主要な流路の周囲には真空チャンバーがあり、この真空チャンバーを通して、周期的な吸引により柔軟な側壁を伸展させ、蠕動運動を模倣することができる[187, 264]。その中でCaco-2およびHT-29上皮細胞を培養することにより、腸チップは周期的伸展に対する細胞応答を研究するために使用されてきた。例えば、伸展によって単層細胞が微絨毛構造を成長させ、標準的なトランスウェルモデルで観察されるよりも優れたバリア機能を獲得することが見出された。逆に、上皮の変形がないと、IBD患者で観察されるのと同様に、常在細菌の過剰増殖が誘発された[264]。同様の臓器チップデザインは、機械的変形が赤痢菌の侵入を促進することを強調し、蠕動運動と腸管構造が赤痢菌感染の重要なパラメーターであることを示唆している[265]。
詳細は画像に続くキャプションに記載
図6
図ビューアーで開く
パワーポイント
キャプション
最近になって、IOが腸チップのデザインに組み込まれるようになった[266]。hIO由来のIECが膜の上側に播種され、ヒト腸微小血管内皮細胞が下側に並んだ。ここで著者らは、特殊なIECを含む極性上皮を持つ細長い絨毛構造を報告した。さらに、強力なバリア機能、消化酵素の分泌、基部に近い細胞は増殖性であることが示された[266]。このような臓器チップは極めて汎用性が高く、組織-組織相互作用に関する基礎研究の機会を提供し、前臨床薬物スクリーニングの可能性も秘めている。チップの操作に必要な流体システムや空気圧シス テムの入手のしやすさが、現在のところ普及の妨げとなっている。
5.4.2 IE先端面へのアクセス
臓器チッププラットフォームの欠点は、陰窩/絨毛の形態や本来のECMの複雑さが欠けているため、その設計の中心となる多孔質膜の生理学的妥当性が疑わしいことである。しかし、IOは嚢胞構造として成長するが、これも同様に問題がある。というのも、密閉された内腔は、死んだ細胞や老廃物を内腔の流れによって除去するのではなく、内部に閉じ込めてしまうからである。このため、IOの寿命が制限され、上皮の先端表面へのアクセスが制限される。したがって、より長い寿命を必要とする研究や、バリア機能や微生物と上皮の相互作用を評価することを目的とする研究は複雑である。IOにアピカル・アクセスするための1つの戦略として、IOの極性を反転させ、アピカル面が外部環境に向くようにすることがある[153]。これにより、バリア機能の解析や微生物相互作用の調査が可能になる。あるいは、微生物や化合物を内腔にマイクロインジェクションする方法もあるが、これは技術的に難しく、自動化が困難であり、IOを損傷する可能性がある[268]。
バイオエンジニアリングのアプローチは、細胞の押し出しや脱落など、上皮先端表面に沿った基本的なプロセスを研究するために応用されている。これを達成するために、陰窩のような構造を形成したポリジメチルシロキサン(PDMS)スタンプをハイドロゲルの鋳型に用い、その上にmIOs単層を播種した[269](図6b)。ISCは陰窩型のくぼみの底に局在し、分化したIECは絨毛状構造を上行してから排出された。ここでは、操作されたプラットフォームにより、バリア機能の維持に中心的な役割を果たす、押し出し中のアクチン環を直接観察することができただけでなく、脱落過程におけるアポトーシスのタイミングを解析することもできた。これらの基本的なプロセスはいずれも、in vivoモデルでは観察が困難である。
5.4.3 内腔流を発生させるマイクロ流体アプローチ
IOが嚢胞構造として成長することに関連する問題を克服するために、研究者たちは、アピカル・アクセスと管腔流を組み合わせたアプローチも開発してきた。例えば、mIOは、腸の形態を模倣した形状のハイドロゲルで裏打ちされたマイクロ流体チップ内で培養されている(図6c)[204]。コアとなるPDMSデバイスは、内腔灌流を可能にする入口および出口チャネルを備えたハイドロゲルを含む中央チャンバーと、培地を底部に供給する側方リザーバーで構成されている。細胞導入に先立ち、中央チャンバー内のハイドロゲルをレーザーアブレーションし、本来の腸の陰窩-絨毛構造を模倣した円筒状の流路を構築した。得られた管状足場にマウスISCを充填し、コンフルエントな上皮を形成させた。標準的なmIOの寿命が7~10日であるのに対し、定期的な灌流を行うことで、システムの寿命は1ヶ月以上まで延びる可能性がある[204]。このデバイス内では、細胞運命パターニングは、ISCとパネス細胞を含む陰窩様領域がマイクロキャビティの底部に局在しており、本来の組織におけるものを彷彿とさせた。対照的に、腸細胞や杯細胞を含む分化したIECは、もっぱら内腔を覆う細胞に見られた。さらに、増殖は陰窩様領域に制限され、一方、娘細胞は分化した細胞を補充するために外に移動しており、これは生体内で見られるのと同様であった[204]。この系を用いて、著者らは、デキストラン硫酸ナトリウムの細胞毒性または低線量ガンマ線を介した損傷後の上皮再生を示した。また、クリプトスポリジウム・パルバム(Cryptosporidium parvum)による寄生虫感染もモデル化し、寄生虫のその場でのライフサイクルや宿主と微生物の相互作用について、これまでにない洞察を与えた。
このような戦略は、生体工学が現在の組織や疾患モデルの限界をどのように解決しうるかについての洞察を提供するだけでなく、将来の革新への道筋を示すものでもある。円筒状の流路を作る際、著者らはレーザーアブレーションを用いて組織を模倣した構造を作ったが、この方法では解像度に限界があり、細胞を含んだハイドロゲル中でリアルタイムに構造を編集することができない。しかし、顕微鏡の進歩と組織特異的でユーザーにより調節されたハイドロゲルの化学的性質を組み合わせることで、この問題を克服できる可能性がある。例えば、光応答性ハイドロゲルは細胞接着とリモデリングをサポートし、架橋剤の光開裂によりユーザー定義の分解が可能である。さらに、1点で結合する細胞適合性のある赤外レーザーを用いた二光子顕微鏡は、紫外線波長を実現することができ、レーザーの光路を横切る損傷を回避しながら、光学系によってのみ制限される解像度を提供することができる(図7)[270]。したがって、二光子顕微鏡と紫外線切断可能なハイドロゲル化学物質を組み合わせることで、in situで細胞を損なうことなく、リアルタイムの3D構造編集を提供できる可能性がある[270]。
詳細は画像に続くキャプションを参照。
図7
図ビューアーで開く
パワーポイント
キャプション
5.4.4 オルガノイドの形態とニッチ手がかりの制御
ISCとパネス細胞は湾曲した陰窩様構造体に局在するため、物理的な手がかりが陰窩の形成と細胞運命の特定をどのように促すかについて基本的な疑問を投げかけるために、生物工学的戦略も採用された。ソフトリソグラフィ技術を用いてColI-マトリゲルハイドロゲル内にピル状の空洞を作製し、マウスISCを播種した[269](図6d)。これらのピル型構造物内では、細胞は長い壁に沿って伸長した形態をとり、曲がった端ではより制限された形態をとり、その結果、YAPはそれぞれ核と細胞質に優先的に局在した。異なるYAPシグナル伝達が局所的なノッチシグナル伝達を促し、クリプトの位置を確定した。したがって、生体工学的アプローチは、陰窩の形態形成などのプロセスに関する基本的な洞察を明らかにするために、in vivoのアプローチを補完することができる。
腸の力学的特性は、発生過程においても、線維症のような疾患においても、時間とともに変化する。さらに、IEの陰窩形成のような正常な生物学的プロセスの駆動における組織力学的手がかりの役割が最近報告されている[269]。そのため、研究者は3Dハイドロゲルの力学的特性をオンデマンドで部位特異的に調節することを組織モデルに組み込み始めている。例えば、o-ニトロベンジルアクリレート基とメタクリ ル酸基で修飾されたハイドロゲルが報告されており、そ れぞれ異なる励起波長で光開裂と光架橋を可能にする[272]。例えば、分解動態を時空間的に制御できるPEG-硫化アリル ベースのハイドロゲル[273]は、単一ISCからのコロニー形成とmIO成熟の 両方をサポートすることが示された。 [274]。最近では、ハイドロゲルの力学とミクロトポロジーを局所的に光パターニングすることで、mIOの形態をユーザー定義で制御できるようになり[269]、YAPの不均一な発現がパネス細胞の分化の位置を予測するという以前の知見が確認された[199]。このように、生化学的な手がかりがない場合でも、制御された化学物質を用いて上皮のパターニングを指示することができる。可逆的な感光性化学物質はまだ腸管モデルに適応されていないが、近い将来利用可能になる可能性があり、ECMリモデリングに関連する機械的な合図が腸管生物学にどのような影響を与えるかを調査できる可能性を秘めた技術である。
機械的特性の変化に加え、腸管ECMの組成とそのリガンドも変化する。様々なハイドロゲル化学的手法により、シグナル伝達 リガンドを取り込んだり取り除いたりすることが可能であり、ハイド ロゲルをダイナミックに装飾できる可能性がある。 [276]。このようなシステムは、光毒性の問題によってまだ 制限されているが、近赤外フェムト秒レーザーを用いて紫外および可視 領域のシグナルを発生させることができる多光子顕微鏡を応用することで、こ れを克服できる可能性がある。このアプローチにより、近赤外波長を用いて細胞毒性のある365nmで励起するように設計された光化学物質を使用することが可能になる。これらの光化学物質は、腸管モデルやIOにはまだ適用されていないが、ユーザー定義の光化学マトリックスパターン形成[270, 277]や、IOの対称性の破れ、さらには光誘導化学物質を用いた幹細胞の運命決定への道を開く可能性がある。
6 視点
腸のin vitroモデルは、本来の腸組織の多細胞的な複雑さ、構造、組成を模倣しており、基本的な生理学的プロセスを理解し、疾患においてそれらがどのように異常をきたすのかを解明する上で、非常に有望である。10年以上前に発見されたIOは、複雑な腸上皮の簡便なモデルであり、細胞株と動物モデルの中間の妥協点を提供し、in vitro組織モデルの可能性を前面に押し出した。よりネイティブな組織に近い忠実性を実現するため、研究者たちはIOを他の腸管細胞集団と共培養し、さらに可溶性・非可溶性の手がかりを組み込もうと努力している。しかし、IOは依然として還元主義的なモデルであり、真の組織モデルの可能性を実現するには、克服すべき重要な欠点がある。腸の力学的特性や化学的複雑性など、腸の物理的構造を再現することも、同様にまだ未完成である。しかし、合成ハイドロゲルは、本来のECMの多くの特性を模倣しており、また、本来の組織に近似した物理的・生化学的特性を制御して設計できるため、このような組織モデルは現実に近づきつつある。さらに、単一細胞レベルを含むトランスクリプトームやプロテオミクスのアプローチも進歩しており、今後もin vitroモデルにおける細胞の挙動をよりよく理解できるようになるだろう。
多くの光学系は薄い2Dサンプル用に最適化されているため、3D組織とその中の細胞の画像化は複雑である。この限界に対処する一つの方法は、3Dオルガノイドを、3D IOを形成する能力を保持した異種単層としてプレート化し、画像化することである。共焦点顕微鏡や多光子顕微鏡を用いた非侵襲的な光学切片作製や、最近ではライトシート蛍光顕微鏡によって、固定されたホールマウント組織の3Dイメージングが可能になった。これらのアプローチと、ライブイメージング、光クリアリング、機械学習の進歩が組み合わさることで、細胞の形状、細胞運命決定、細胞間相互作用を精緻に可視化することが可能になった[149, 279, 280]。例えば、特注のライトシート顕微鏡を必要とせずに、3D IOの焦点面を制御する独創的な方法が最近報告された。トリプルデッカーサンドイッチ」培養と呼ばれるこの方法は、接着性のないポリヘ マヒドロゲル上にマトリゲルを播種し、その上にマトリゲルの最終層を重ねたものである。これにより、共焦点顕微鏡を用いた高品質のイメージングが可能になっただけでなく、栄養アクセスを均質化することでmIOの生存率も向上した[281, 282]。
オルガノイド技術は、腸の生物学にかつてない洞察をもたらし、動物モデルとin vitro実験とのギャップを埋めつつある。IEの化学的ニッチを解明することで、研究者たちはユーザー定義の細胞アイデンティティを持つIOを開発することができるようになり、マルチオミクスの進歩は、それぞれのIECタイプがどのように発生し、生理や疾患に寄与しているのかについての洞察をもたらしている。調整可能な化学的・機械的特性を持つデザイナー・マトリクスの開発と相まって、生理学的シグナルを工学的に制御し、ISCの自己組織化とパターニングを、より生理学的な方法で誘導することが可能になった。さらに、標準的な細胞培養の制限を回避する先駆的なアプローチは、幹細胞の自己組織化と生物工学を組み合わせた新しい研究分野の発展を可能にしている。しかし、IOは研究において素晴らしい均等化装置であり、豊富な低空飛行の果実を摘み取るための理想的なツールである一方、現在のところ、多くの生物工学技術は比較的アクセスしにくいままである。生理学的パラメーターを維持するためのプロトコールや、予測可能な同一性、発生段階、空間分布を持つ細胞集団を標準化することで、スケールアップしたハイスループット実験への前進が可能になる。患者のバイオバンクと相まって、疾患に対する患者特異的治療をモデル化し、提供できる大きな可能性が存在する。今、最先端の組織モデルを構築する研究は非常にエキサイティングな時期であり、腸はその最前線にある臓器である。
謝辞
EGは、英国工学・物理科学研究評議会(EP/V04723X/1)および英国医学研究評議会(MR/X008789/1)からの資金提供を謝意を表する。JFNは、BBSRCおよびNC3Rs(NC/X002497/1)からの資金提供を謝意する。OCは、UK Biotechnology and Biological Sciences Research Councilの助成によるLondon Interdisciplinary Doctoral Programmeの博士課程学生である。著者らは、本総説の図表作成に最初に協力してくれたMaria Carolina Albuquerque Faria Ferreira Carmoに感謝する。
利益相反
著者らは利益相反がないことを宣言する。
略歴
イメージ
オリバー・キャメロンはロンドン学際的博士課程プログラム(LIDo)の博士候補生。2014年、西イングランド・ブリストル大学で生物科学の理学士号を取得。医療機器の流通で2年間働いた後、ブリストル大学で生物医学研究の修士号(2017年)を取得し、その後ユニバーシティ・カレッジ・ロンドンで生物科学のMRes(2019年)を取得した。オリバーは博士号取得のため、炎症性腸疾患の還元主義モデルを開発し、炎症とは無関係に腸の再生における組織力学の役割を調査している。
画像
ジョアナ F. ネヴェスは、キングス・カレッジ・ロンドン(KCL)の粘膜免疫学上級講師兼グループリーダー。ジョアナはロンドン大学クイーン・メアリー校で免疫学の博士号を取得後、ブリガム・アンド・ウィメンズ病院とハーバード大学医学部で大腸炎における免疫学的応答を研究した。2014年にKCLに加わり、マリー・スクロドフスカ・キュリーとRCUK/UKRIラザフォード基金のフェローシップを得た後、研究グループを結成した。 ジョアナのチームは、免疫細胞を組み込んだ複雑な腸オルガノイド・システムを作り、健康と病気における細胞の相互作用を探求している。彼らの研究は、炎症性腸疾患における自然リンパ球の新たな役割をすでに明らかにしている。
画像
アイリーン・ジェントルマンは、2005年にテュレーン大学(米国)で生物医学工学の博士号を取得し、モリー・スティーブンス教授の指導の下、インペリアル・カレッジ・ロンドンで博士研究員としての研究を修了した。2011年にウエルカム・トラスト研究キャリア開発フェローシップを授与され、キングス・カレッジ・ロンドンに移った。現在は、顎顔面・再生生物学センターの生体工学教授であり、歯・口腔・頭蓋顔面科学部のインパクト担当アカデミック・リーダーを務めている。彼女の研究テーマは、組織工学や疾患モデリングのために幹細胞の分化を制御するための、3D細胞ニッチの物理的・生物学的特性を調節するバイオマテリアルの開発である。
参考文献
PDFダウンロード
戻る
その他のリンク
ワイリーオンラインライブラリーについて
プライバシーポリシー
利用規約
クッキーについて
クッキーの管理
アクセシビリティ
ワイリーリサーチDE&Iステートメントと出版ポリシー
発展途上国へのアクセス
ヘルプ&サポート
お問い合わせ
トレーニングとサポート
DMCAと著作権侵害の報告
チャンス
購読エージェント
広告主・企業パートナー
ワイリーとつながる
ワイリーネットワーク
ワイリープレスルーム
著作権 © 1999-2023 John Wiley & Sons, Inc. すべての著作権はワイリーに帰属します。
この記事が気に入ったらサポートをしてみませんか?
