SLEにおける腸内細菌叢:動物モデルから臨床エビデンスと薬理学的展望まで
SLEにおける腸内細菌叢:動物モデルから臨床エビデンスと薬理学的展望まで
https://lupus.bmj.com/content/10/1/e000776
http://orcid.org/0000-0001-6386-4074Eya Toumi1,2,3、Soraya Mezouar1,2,4、Anne Plauzolles3、Laurent Chiche5、Nathalie Bardin6, Philippe Halfon1,2,3,5 および Jean Louis Mege1,2,6
Eya Toumi博士宛; toumieya37@gmail.com
要旨
全身性エリテマトーデス(SLE)は、遺伝と環境要因の複雑な相互作用によって引き起こされる多因子性自己免疫疾患である。SLEは、自己免疫寛容の破綻と自己抗体産生を特徴とし、炎症と多臓器障害を誘発する。SLEは非常に不均一な疾患であるため、現在使用されている治療法は、かなりの副作用があり、まだ満足できるものではなく、より良い患者管理のための新しい治療法の開発が大きな健康上の課題となっています。このような状況において、マウスモデルはSLEの病態に関する知見に大きく貢献し、新規治療標的を検証するための貴重なツールとなっています。ここでは、最もよく使われているSLEマウスモデルの役割と、治療法の改善への貢献度について説明します。SLEの標的治療の開発が複雑であることを考慮し、補助療法もますます提案されるようになってきています。実際、近年、マウスやヒトでの研究により、腸内細菌叢が潜在的なターゲットであり、新しいSLE治療法の成功に大きく貢献することが明らかにされています。しかし、SLEにおける腸内細菌叢の異常のメカニズムは現在も不明である。本総説では、腸内細菌叢の異常とSLEの関係を調査した既存研究の目録を提案し、疾患とその重症度のバイオマーカーとして、また新たな治療標的として期待されるマイクロバイオームシグネチャーを確立することを目的としている。このアプローチにより、腸内細菌叢に基づくSLEの早期診断、予防、治療法の展望に新たな可能性が開かれるかもしれません。
http://creativecommons.org/licenses/by-nc/4.0/
本論文は、Creative Commons Attribution Non Commercial (CC BY-NC 4.0) ライセンスに従って配布されるオープンアクセス論文であり、原著が適切に引用され、適切なクレジットが与えられ、変更があればそれが示され、使用が非商業的である限り、他の人がこの作品を非商業的に配布、リミックス、適応、構築し、異なる条件で派生作品を許諾することが許可されています。参照: http://creativecommons.org/licenses/by-nc/4.0/.
http://dx.doi.org/10.1136/lupus-2022-000776
Altmetric.comの統計情報
記事のaltmetricスコアは1です
もっと詳しく見る
ツイート数:3
使用許諾の申請
この記事の一部または全部を再利用したい場合は、以下のリンクからCopyright Clearance CenterのRightsLinkサービスへアクセスしてください。このリンクからCopyright Clearance CenterのRightsLinkサービスにアクセスし、迅速な価格と様々な方法でのコンテンツの再利用許可を得ることができます。
許可を申請する
はじめに
SLEは、皮膚、関節、腎臓、肺などの多臓器に影響を及ぼす慢性かつ複雑な自己免疫疾患です。1 SLEは、生殖年齢にある若い女性に多く発症し、寛解期と再発期を繰り返します。2 3 SLEの病因はまだ不明ですが、おそらくホルモン、環境、遺伝的要因が関与しています(図1)。SLEの発症には、中枢および末梢の寛容性の障害が重要であり、核抗原に対する自己抗体や免疫複合体(IC)が産生される。ICが標的臓器に沈着すると、炎症環境が始まり維持されるため、軽度、中等度、重度の様々な症状が現れます。4 ループス腎炎は、この病気の最も一般的な合併症で、SLEの死亡率および病的状態の主要危険因子となっています5。

図1
図のダウンロード
新しいタブで開く
パワーポイントのダウンロード
図1
SLEの多因子性病因。遺伝的、ホルモン的、環境的要因が腸内細菌叢に影響を与え、SLEの病態生理につながる免疫応答の調節障害を引き起こしている。Ab:抗体;dsDNA:二本鎖DNA;IFN:インターフェロン;IL:インターロイキン;LB:Bリンパ球;LT:Tリンパ球;RNP:リボ核タンパク質;Sm:スミス;TNF:腫瘍壊死因子;UV:紫外線。
SLEは、その臨床的な不均一性と免疫機構の複雑さにより、その治療は依然として困難です。根治的な治療法はまだないため、SLE患者の現在の標準治療では、副腎皮質ステロイド、免疫抑制剤、非ステロイド性抗炎症剤(NSAIDs)、抗マラリア剤(ヒドロキシクロロキン)などが主症状のみを治療するために使用されています(6)。残念ながら、これらの治療法は単独または併用で使用されますが、特異的ではなく、重篤な感染症を引き起こすリスクを含むいくつかの望ましくない副作用があります。
8 マウスとヒトの解剖学的・免疫学的な違いやSLEの発現の不均一性から、ヒトのSLEを完全に再現した単一のマウスモデルは存在しません9 10。
11 定義によれば、腸内細菌叢の異常は、(1)有益な細菌の消失、(2)潜在的に有害な細菌の過剰増殖、(3)細菌の多様性の喪失、によって特徴付けられます。腸内細菌の組成や機能におけるこのような変化は、SLEの発症や症状の重さと関連しており、このような腸内細菌の異常がSLEの病態生理に関与している可能性を示しています12。マウスモデルにおける実験データでも、特定のマイクロバイオームの変化がSLEの活動にどのように影響するかを強調しています13 14。しかし、腸内細菌異常がSLE進行の結果であるのみか、その重症化や進行の原因であるかはまだ不明なままです。したがって、腸内細菌がSLEの免疫寛容をどのように撹乱するかを知ることは、腸内細菌叢の調節に基づく新しい治療法を模索するために不可欠である。
本総説では、SLEの病態生理を調べるために利用できる動物モデル(ホルモン、遺伝、環境因子との関連は除く)の一覧を紹介する。また、SLE患者におけるバイオマーカーおよび革新的な治療標的としての腸内細菌叢の位置づけを評価することを提案する。
一般的なループスのマウスモデル
過去50年にわたり、ループスのモデルマウスは、ループスの病態生理を解明し、新たな治療標的を研究するための貴重なリソースであることが証明されています9。
自然発症のマウス狼瘡モデル
マウスの自然発症の狼瘡モデルは、遺伝学的、免疫学的に異なる4つの主要な系統に代表されます(表1)。
インラインで見る ポップアップで見る
表1
狼瘡の臨床的マウスモデル
まず、ニュージーランドブラック(NZB)とニュージーランドホワイト(NZW)の交雑系統は、NZB/NZWF1あるいはBWモデルと呼ばれている15 16。BWマウスはANA、主に抗二本鎖DNA(dsDNA)を生産し、ICと軽い血管炎に伴う糸球体腎炎を発症する。BWマウスは、ヒトと同様に主に女性で発症するという利点がありますが、臨床症状が現れるのが遅いため16、このモデルによるSLEの研究は長期に及び、費用もかさみます。近年、インターフェロンαを発現するアデノウイルスの投与やToll-like receptor (TLR) -7アゴニストの注射により、この時間経過が短縮され、BWマウスはSLE研究に適しています17 18。
LG、B6、AKR、C3H などのマウス系統を交配し、Murphy-Roths-Large (MRL) /lymphoproliferation (lpr) モデルが作られました19 20 lpr突然変異が自然に起こり、後に、免疫細胞のアポトーシスを制御する主要なFas遺伝子を変化させるレトロトランスポゾンとして確認されています21 22 MRL/lprモデルは、LG、B6、AKR、C3Hなどの複数の系統の間で、マウスが交配されて誕生したモデルであり、このマウスは、MRL/lprモデルとして開発されました。22 MRL/lpr モデルは、ANA、抗dsDNA、抗Smith(Sm)、抗シェーグレン症候群関連抗原A(SSA、抗Roともいう)、抗シェーグレン症候群関連抗原B(SSB、抗Laともいう)を含むヒトSLE自己抗体のフルパネルを発症し、関節炎、認知機能障害、発疹、血管炎など複数の臨床症状が見られるユニークなモデルである。pr遺伝子は、この病気の発症と重症化を著しく促進させる。このモデルは、ループスにおける TRL-7 と TLR-9 の役割の研究に用いられ23 、新しい治療用分子の評価にも広く用いられています。24-26 しかし、その分子メカニズムは、前者が IFN-γ によって、後者が IFN-α によって駆動される、ヒト SLE で見られるものとは異なっていると考えられます27。
第3のモデルであるMRL+マウスは、Fasの変異を欠き、その結果、より軽度のループスを後期に発症します19。
最後に、4番目のモデルであるBXSBマウスは、他のモデルとは異なり、Y染色体上の遺伝的リスクにより雄で発症し28 、糸球体腎炎のみを発現するモデルである。このような制約があるにもかかわらず、BXSB モデルでは、SLE の病態生理に関与する重要なメカニズムである TLR-7 駆動機構を評価することができます29。
マウス狼瘡の誘発モデル
遺伝的要因が主要な役割を果たす前述の自然発症のマウスモデルとは異なり、ループスは健康なマウスを特定の環境要因に暴露することによって発症する可能性があります。30 31 また、遺伝的な欠陥がないにもかかわらず、耐性を破壊するに至る初期の事象を研究することができ、SLEの発症と進行に関与する細胞機構をより良く理解することができます。BALB/cマウスに腹腔内投与すると、鉱物油のプリスタン(2,6,10,14 tetramethylpentadecane)は数日から数ヶ月の間にヒトのSLE症状を引き起こす32。これらの症状は、IC糸球体腎炎、びらん性関節炎、皮疹、より重症なケースでは肺血管炎や出血を含んでいる。興味深いことに、プリスタン誘発性狼瘡(PIL)は、SLE患者でしばしば観察されるI型IFNの過剰産生によって特徴づけられます35。最近、TLR-7リガンドを含むレジキモドまたはイミキモドクリームが、特定の系統のマウスの耳に投与してマウスループスを誘発するために使用されています。SLE様疾患は、性別に関係なく2-4週間以内に発症しますが、一部の臓器に限定され、全身性疾患を反映するものではありません36。
SLEと腸内細菌叢異常症
狼瘡のマウスモデルと腸内細菌叢
ループスのマウスモデルは不完全であるにもかかわらず、SLEの病態生理を理解するのに有用である。遺伝的な類似性に加え、マウスは腸内細菌の分類学上、ヒトとある程度の類似性があり、ヒトに適用できる宿主-微生物相の相互作用を評価するための興味深いマウスモデルとなっています37 38。まず、PILマウスモデルで初めてSLEにおける腸内細菌叢の役割の可能性が報告されています。1998年、Hamiltonらは、特定の病原体を持たないマウスでは、通常飼育のマウスに比べて自己抗体の産生が低く、遅延することを示し、マウス狼瘡が微生物環境で有利になることを証明しました39。その後、異なるマウスモデルにより、狼瘡の発症における腸内細菌叢の役割を確認し、腸透過性と細菌転座が疾患の進行に有利であることが示されました(表2)。第二に、マウス狼瘡では雌マウスが雄マウスよりも10倍多く発症することが判明しており40 41 、ヒトにおけるSLEの性別による有病率を裏付けています。第三に、MRL/lpr雌マウスの症状の重さは、乳酸菌およびLachnospiraceaeの相対存在量とそれぞれ逆および正の関係があることが分かっています40。
インラインで見る ポップアップで見る
表2
狼瘡モデルマウスの腸内細菌叢
ループスモデルマウスと腸内細菌叢の関係については、そのメカニズムが理解され始めている。Lactobacillus属は、ループスモデルで最も研究されています。プロバイオティクスとして使用されているラクトバチルス属のいくつかの種は、IL-6の減少やIL-10の増加を介して免疫および抗炎症応答を制御しています13 43 雌マウスに食事性レチノイン酸(RA、ビタミンA)を投与すると、ラクトバチルス属による腸内コロニー形成を回復させることで疾患の臨床症状を改善します40 マウスループスの発症にラクトバチルスが予防的役割を果たすことが示唆された。ラクトバチルス菌の補充は、MRL/lprマウスの蛋白尿と自己抗体のレベルを下げ、炎症性サイトカインの低下、抗炎症サイトカインの増加、Tregの増加とともに腎臓病理スコアを改善する13。Zegarra-Ruizらは、TLR-7に依存する、またはイミキモドによって誘導されるマウスモデルにおいて、L. reuteriが疾患を悪化させ、L. reuteriおよびL. johnsonni細菌が内臓に転移していることを示しました。L. reuteriのみが、全身性自己免疫を伴うIFN遺伝子シグネチャーを誘導する47。この所見の矛盾は、いくつかの要因に起因すると思われる。Lactobacillus 属には多数の種があり、マウス狼瘡の発症において多くの異なる役割を担っている可能性があります。また、細菌の移動も重要な役割を担っている可能性がある。実際、Enterococcus gallinarumが腸から肝臓や他の臓器に転移して、ループスにおけるIFNの発現や抗dsDNA産生などの自己免疫反応を引き起こすことが知られている。
表2に示すように、回収された細菌集団は、マウス研究間で異なっている。これは、微生物組成に大きな影響を与えると思われる異なるマウスモデル間の遺伝的差異によって説明されるかもしれない。実際、実験用マウスの腸内細菌叢には、遺伝的・環境的要因がいくつか関連していることが分かっている48 49。したがって、遺伝子改変マウス間やヒトのコホートとの比較解析は控えめに行うべきである。
ヒトSLEコホートと腸内細菌叢
表3に示すように、新たな研究により、SLE患者における腸内細菌叢の異常の役割が確認された。
インラインで見る ポップアップで見る
表3
SLE患者の腸内細菌叢
まず、表3に示すように、ほとんどの研究がアメリカ人またはアジア人集団で行われた。その結果、糞便微生物群集の量は地域によって異なることが示された。門レベルでは、アメリカ人集団ではFirmicutesが他の国よりも多く、日本人集団ではActinobacteriaがより多く増加していた。50 このように地理的な影響が強いのは、主に食生活の多様性とそれに伴う食習慣が、微生物の構成に強い影響を与えているためである51。実際、高脂肪・高タンパクの欧米型食生活を送る欧米諸国の人々の腸内ではバクテロイデス属が多く、一方、繊維質を多く摂取する非欧米諸国ではプレボテラ属が多いことが示されている52。このことは、異なる国のコホート間の比較分析において、ヒトにおける微生物相の比較にはさらに慎重に、出身国について報告すべきことを示唆する。
ほとんどの研究は女性を対象としており、SLEの寛解期においても、ファーミキューテスとバクテロイデテスの存在量がそれぞれ減少、増加し53-57、全体の生物多様性も減少している56。さらに、SLE患者のIFNレベルの低下は、ファーミキューテスとバクテロイデス比(F:B)の低下、SLE患者の炎症反応の原因であるファーミキューテスの減少に関係していると言われています。このF/Bのアンバランスは、ライフスタイル、病気の期間/ステージ、食事に関係なく、SLEのディスバイオーシスの主な特徴であるように思われる。SLE患者では、Proteobacteria46 56 58とActinobacteria40が増加し、Synergistetes59とTenericutes60が減少しており、他の細菌群も変化している。Rhodococcus、Eubacterium、Flavonifractor、Eggerthella、Klebsiella、Prevotellaは対照群に比べSLE患者で有意に多く、PseudobutyrivibrioとDialisterは減少しています54。他の研究では、Odoribacter、46 Roseburia、Bifidobacterium、Faecalibacterium prausnitziiといったいくつかの有益な細菌の減少が報告されています60。これらの細菌は、エネルギーと栄養素の供給を通じて人体の恒常性を維持し、61 炎症を抑え62 腸管バリアを保護するという複数の役割を担っています63。興味深いことに、ラクトバチルス属、特にL. mucosaeの相対的な存在量はSLE患者で増加しており、ラクトバチルスがSLEの病因に関与していることを示すこれまでのヒトおよび動物のデータを裏付けています13。60 また、Streptococcus anginosusとVeiIlonellaがSLE患者で有意に上昇し、疾患活動性に関係することが示されています。60 SLEの女性にLachnospiraceae科に属するRuminococcus gnavusが過剰であることは、ループス腎炎患者の疾患活動性を反映しています。64 SLE患者の腸内細菌叢の構成とサイトカインプロファイルの関係を調べたところ、Bacteroides, Bilophila, Parabacteroides, Succinivibrioなどの特定の細菌属の増加が、IL-17, IL-21, IL-2R, IL-35, IFN, IL-10などの炎症性サイトカインのレベルに関係しており、これらの細菌が炎症反応を促進させる役割を果たしていることが示唆されている。しかし、Dialister属とGemmiger属はSLE患者で減少し、IL-17、IL-2R、IL-35レベルと負の相関を示しており、炎症性サイトカインの減少を介してこれらの細菌属の保護的役割の可能性が示唆されている57。
これと並行して、SLEでは異なる細菌集団との分子的擬態によって自己抗体が産生される可能性があることが示されている。実際、細菌は宿主タンパク質に類似したオーソログエピトープを模倣し、自己免疫T細胞やB細胞を活性化させることが分かっている。実際、Greilingらは、腸内常在菌のBacteroides thetaiotaomicronがヒト抗Ro60抗体を発現し、抗原を免疫細胞に送り込むことを発見した55。さらに、抗Ro60陽性のSLE患者の血清は、Ro60オルソログを含む細菌リボ核タンパク質複合体を免疫沈降させることがわかった55。さらに最近、Odoribacter splanchnicus および Akkermansia muciniphila の細菌が産生するペプチドが、Sm抗原およびFas抗原エピトープに非常に類似していることが明らかになった。興味深いことに、これらの細菌からのペプチドは、CD4+ T細胞やB細胞を活性化し、自己抗体を産生させることができる65。
腸内細菌叢とSLEの病因
生理的な条件下では、多様でバランスのとれた微生物プロフィールによって、腸管バリアの完全性が維持されている。短鎖脂肪酸(SCFAs)の細菌生産は、Tリンパ球とBリンパ球の正常な分化を保証し、Treg細胞を調節することによって免疫自己寛容を維持します66 Firmicutes細菌は、様々な組織、特に腸のTreg細胞の生成と維持に中心的な役割を果たす酪酸の主要生産者です67 T細胞のTh17エフェクターとTh1細胞への分化を阻害し、抗炎症性および炎症性サイトカインのバランスのよい生産を保証します(図2A)。SLEで観察される腸管バリア機能の低下は、「リーキーガット」と呼ばれる腸管透過性をもたらすことが明らかになっている64。R. gnavus64やE. gallinarum68などの細菌の増加により、全身性の炎症を悪化させる炎症因子が放出されるようになる。細菌が自己反応性T細胞やB細胞とともに前庭部へ移動すると、toll-like経路が刺激され、炎症性サイトカイン、I型IFN、自己抗体の産生が促される。これらの循環する炎症性産物は、耐性の喪失や臓器障害につながる69-71(図2B)。
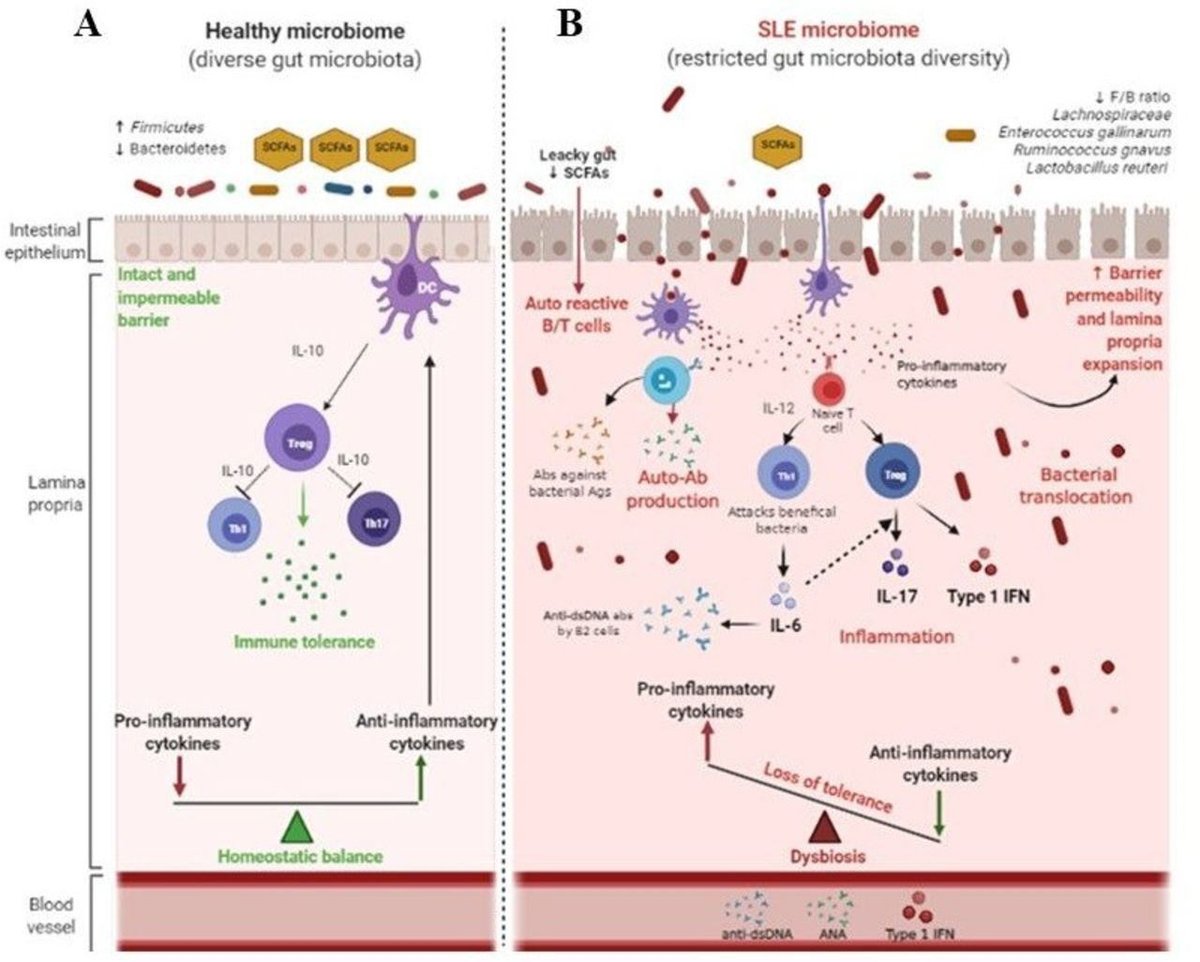
図2
図のダウンロード
新しいタブで開く
パワーポイントのダウンロード
図2
SLEの病態における腸内細菌叢と全身性免疫の相互作用の提案図。(A)共生状態(健康なマイクロバイオーム)では、多様でバランスのとれた微生物プロファイルにより、腸管バリアは無傷である。SCFA菌の産生により、免疫細胞(T細胞、B細胞)の正常な分化が保証され、Th1/Th17のバランスによるTreg細胞の制御や抗炎症サイトカインの産生により免疫自己耐性が維持されている。(B)腸内細菌症は、腸内細菌叢の多様性の制限と腸管透過性の上昇(「リーキーガット」)に伴うファーミキューテス類の変化によって特徴づけられることが多く、免疫調節障害を引き起こす。細菌の転座は、自己反応性T細胞およびB細胞のある層状膜での抗原曝露を増加させ、Treg細胞の過活性化およびTh17の分化を引き起こす。この過程は、様々な炎症性サイトカイン(IL-6、IL-17)、自己抗体(ANA、抗dsDNA)、I型IFNの産生を促進する。これらの循環炎症性産物はすべて、自己耐性の喪失、過剰な免疫反応、組織・臓器の破壊につながる。Ab、抗体;Ag、抗原;DC、樹状細胞;dsDNA、二本鎖DNA;F:B、ファーミキューテス/バクテロイデス比;IFN、インターフェロン;IL、インターロイキン;SCFA、短鎖脂肪酸;Th、Tヘルパー;Treg、制御性T細胞。
SLEの治療における課題
SLEの標準治療の失敗
72 SLEの治療は、病状や臨床経過が多様であるため困難です。73 これらの治療法は治癒をもたらすことができず、多くの副作用や大きな毒性を伴います。新しい治療法、特に標準治療の副作用を軽減し、長期的な予後を改善するための新しいバイオセラピーの開発が進められています。新しい治療薬は、主にループス疾患のキープレイヤーであるB細胞、T細胞、サイトカイン経路を標的としています9。そのアプローチは、B細胞の細胞表面マーカー(CD20やCD22)を標的とするものから、サイトカインやシグナル伝達分子(B細胞活性化因子(BAFF)、IL-6、IL-17、IL-2など)、誘導性T細胞コスト分子(ICOS)などのコスト分子や共刺激分子(CD40-CD40Lなど)間の相互作用まで、様々なものがあります。 抗CD20抗体(リツキシマブ、オファツムマブ、オクレリズマブ、ベルツズマブ)を用いてB細胞を減少させるか、BAFFに対するmAb(ベリムマブ、タバルマブ)を用いてその機能を調節することができる。前臨床試験での失敗は、モデルマウスの選択と関係があるのかもしれません。実際、治療法の評価は、使用するマウスモデルによって同じ治療法でも効果が異なるため、マウスループスのモデルに大きく依存しています。また、Systemic Lupus Erythematous Disease Activity Index(SLEDAI)は、SLE患者の治療管理に使用されているため、マウス試験への導入も検討する必要があります。SLEDAIはSLE患者の治療管理に使用されているため、今後のマウス試験でこのパラメータを導入し、あらかじめ定義された臨床スコアまたは重症度スコアに従って新しい治療分子を評価することが重要だと思われます。臨床試験の失敗に関しては、試験デザイン、サンプルサイズ、疾患の複雑性や不均一性、地理的・民族的差異、追跡調査期間など、いくつかの要因が考えられます6。
SLEにおける腸内細菌群の治療利用
SLEの治療法が満足のいくものでないことや、新しい生物学的治療が失敗していることから、臨床医は副作用なく使用できる補助療法を探しています。腸内細菌叢はSLEの病態生理に重要な役割を果たすと考えられており、食事療法、プロバイオティクス、糞便移植によって疾患活動性をコントロールすることが有用であると考えられます78。
SLEにおける食事療法
食生活の改善は、腸内細菌叢に影響を与えることが知られている主な環境要因の一つとして、SLE症状の発現に関与していることが示されています。79 ビタミン、多価不飽和脂肪酸(PUFA)、植物性エストロゲンの補給の影響に注目した研究でも、ループスのマウスモデルでタンパク尿と糸球体腎炎が減少することが示されています80。さらに、食物繊維の摂取は、高脂血症、血圧の低下、C反応性タンパク質(CRP)を調節します。83 PUFAを多く摂取すると、SLEの女性の症状が減衰し、抗リン脂質症候群が軽減し、臨床状態が改善されます81。84 また、CRP、抗dsDNA、IL-1、IL-1285、TNF86 のレベルを下げ、タンパク尿、87 血尿、血圧を調節することによって、SLE に対して有益な効果をもたらします。88 ビタミンも免疫系の恒常性において重要な役割を担っています89。ビタミン C の補給は、心血管系の合併症を予防し、炎症と抗体価を低下させます。
88 SLEに対する食事の長期的な影響を定量化し、免疫抑制剤よりも安価で安全な食事療法がSLEの管理において費用対効果の高いアプローチになるかどうかを判断するために、より多くの患者コホートに対するさらなる前向き研究が必要である。
SLEにおけるプロバイオティクスの介入
92 プロバイオティクスの長期使用は、炎症状態を制御し、自己抗体の産生とSLEの進行を減少させるという証拠が増えてきています。SLEの微生物群は、プロバイオティクスのビフィドバクテリウム属とラクトバクテリウム属に乏しい場合がある。この2種類の細菌は、食物繊維の発酵によりSCFAを産生するヒトの腸内細菌叢の中で最も豊富な有益な細菌の一つである96。また、SLE患者では、BifidobacteriumがCD4+ T細胞の過剰活性化を防ぎ、それによりTreg、Th17、Th1細胞のバランスを保つことが報告されている59。さらに、プロバイオティクス細菌の代表格のBifidobacterium bifidumによる補給はSLE患者におけるCD4+ T-リンパ球過剰活性化の防止となることが分かっている。健康なヒトの糞便から分離されたL. casei shirota株の治療効果が、MRL/lprマウスで評価された。97 MRL/lprマウスにLactobacillus属菌を投与すると、抗dsDNA抗体を減少させ、ループス腎炎を予防し、マウスの生存期間を延長させるという顕著な効果を示している13。L. delbrueckii subsp lactis PTCC 1743は、PILマウスモデルの疾患症状を改善し、Th17細胞集団とIL-17aを減少させる。後者は、炎症の発生と維持に関与する。98 また、L. rhamnosus, ATCC 9595は、Th17リンパ球の成熟に関わる転写因子RA receptor-related orphan receptor gammaを調節し、この細胞集団の減少を支持すると考えられる。我々は、SLE患者におけるこれらのSCFAs産生菌による補充は、SLEの治療のための新しいアプローチになり得ると仮定している。
糞便微生物叢移植(FMT)とSLE
FMTは、健康なドナーから患者への腸内細菌叢の移植であり、Clostridium difficile感染症に成功しました。100 マウス狼瘡とSLEに関する研究はごくわずかです。FMTは、抗生物質で初期治療したマウスのループスの重症度を、抗生物質による腸内細菌叢の異常を回復させることで抑制することが分かっている。しかし、ループス発症前の糞便移植は、グルココルチコイドの治療効果を阻害する71。プレドニゾン投与マウスからFMTを受けたループス未治療マウスは、治療の副作用なしにループス様疾患を減弱する101ことから、FMTがSLEに適した治療法となり得るという考えが支持されるようになった。これらの結果は、腸内細菌叢がSLEの治療に直接的な役割を果たすこと、あるいはSLEに対する薬剤の治療効果をモニタリングするのに役立つことを示唆しています。どの微生物種がSLEの病因に関与しているかを明らかにするためには、さらなる実験が必要である。ヒトでは、糸球体腎炎、体重減少、栄養失調を伴うSLEを患う34歳のメキシコ人女性1名にFMTが実施されました。下痢や不安が軽減され、改善が認められました。
最近、FMTカプセルの最初の臨床試験が、活動性のSLE患者20名を対象に12週間にわたって実施されました。重篤な有害事象や死亡例は認められませんでした。FMTの投与により、SLEDAIスコアと血清抗dsDNA抗体の有意な減少が認められました。さらに、SCFAs産生菌の濃縮と炎症関連菌の減少が確認され、腸管でのSCFAs産生の増加、末梢血でのIL-6レベルとCD4+メモリー:ナイーブ比の減少も確認された。このように、FMTは、腸内細菌叢を炎症促進状態から炎症抑制状態へと効果的に切り替えた。この研究は、FMTがSLEに対して安全で、実行可能で、潜在的に有効な治療法であるという証拠を示している。103 SLEにおけるFMTベースの介入の長期安全性、有効性、潜在的利益を確認するために、より長い追跡調査を伴うさらなる臨床研究を実施する必要がある。これらのことは、SLE患者に対する新たな推奨を臨床ガイドラインに盛り込むことに貢献するものと思われる。
まとめ
このレビューでは、SLEの複雑な病態生理を理解するために、主なループスマウスモデルが貢献していることを論じた。しかし、ループスマウスモデルを用いた治療研究にはいくつかの限界がある。同様に、ヒトの疾患の臨床症状は不均一であり、その基礎となるメカニズムも多様である。この異質性が、様々な臨床試験でSLE患者を十分に治療できず、副作用なく病気を完治させることができない理由だと思われます。腸内細菌叢の異常は、様々な自己免疫疾患の予後や診断のためのバイオマーカーや潜在的な治療標的の源として浮上しています。このアプローチは、マウス狼瘡の治療や、その背後にある細胞および分子メカニズムの理解において、いくつかの有望な結果を示しています。最近の結果では、ヒトのSLEにおいても同様のアプローチが治療を改善する可能性が示唆されているが、まだ大規模な確認はなされていない。我々は、SLEの病因における腸内細菌叢の役割について議論し、ヒトとマウスの研究を通じて、この疾患と関連する様々な細菌集団について報告した。現在、SLEのマイクロバイオームシグネチャーを確立し、診断、予防、治療法の新たな可能性を開くために、前向き、縦断的、比較的な研究が必要である。私たちは、このようなシグネチャーを定義することが、腸内細菌叢プロファイルが微生物叢の調節に基づく臨床診療のための有望なツールとなり得る、個別化医療につながると考えています。
倫理規定
発表に際しての患者の同意
該当なし
倫理承認
該当なし
参考文献
↵Tsokos GC. 全身性エリテマトーデスにおける自己免疫と臓器障害。Nat Immunol 2020;21:605-14. doi:10.1038/s41590-020-0677-6PubMedGoogle Scholar
↵カーターEE、バーSG、クラークAE。SLEの世界的負担:有病率、健康格差、社会経済的影響。Nat Rev Rheumatol 2016;12:605-20. doi:10.1038/nrrheum.2016.137CrossRefPubMedGoogle Scholar
↵Tsokos GC. 全身性エリテマトーデス。N Engl J Med 2011;365:2110-21. doi:10.1056/NEJMra1100359CrossRefPubMedWeb of ScienceGoogle Scolar
ループスを飼いならす-病態の新しい理解が臨床的進歩につながる。Nat Med 2012;18:871-82. doi:10.1038/nm.2752CrossRefPubMedGoogle Scholar
Lupus nephritis. StatPearls, 2022.Google Scholar
↵Hruskova Z, Tesar V. Lessons learned from the failure of several recent trials with biologic treatment in systemic lupus erythematosus.(全身性エリテマトーデスにおける生物学的治療に関する最近のいくつかの試験の失敗から得られた教訓)。Expert Opin Biol Ther 2018;18:989-96. doi:10.1080/14712598.2018.1504918PubMedGoogle Scholar
↵Tektonidou MG, Wang Z, Dasgupta A, et al. 全身性エリテマトーデスを有する成人における重篤な感染症の負担:全国人口ベース研究、1996-2011年. Arthritis Care Res (Hoboken) 2015;67:1078-85. doi:10.1002/acr.22575Google Scholar
↵Perry D, Sang A, Yin Y, et al. 全身性エリテマトーデスのマウスモデル。J Biomed Biotechnol 2011;2011:271694. doi:10.1155/2011/271694Google Scholar
↵Li W, Titov AA, Morel L. An update on lupus animal models. Curr Opin Rheumatol 2017;29:434-41. doi:10.1097/BOR.0000000000000412Google Scholar
↵Richard ML, Gilkeson G. Mouse models of lupus: what they tell us and what they do ''t. Lupus Sci Med 2018;5:e000199. doi:10.1136/lupus-2016-000199Google Scholar
↵Neuman H, Koren O. The gut microbiota: a possible factor influencing systemic lupus erythematosus.腸内細菌叢:全身性エリテマトーデスに影響を及ぼす可能性のある因子。Curr Opin Rheumatol 2017;29:374-7. doi:10.1097/BOR.0000000000000395CrossRefPubMedGoogle Scholar
↵Katz-Agranov N, Zandman-Goddard G. The microbiome links between aging and lupus. Autoimmun Rev 2021;20:102765. doi:10.1016/j.autrev.2021.102765Google Scholar
↵Mu Q, Zhang H, Liao X, et al. 腸内細菌叢の変化によるループス腎炎の制御. マイクロバイオーム 2017;5:73. doi:10.1186/s40168-017-0300-8Google Scholar
↵Ma Y, Xu X, Li M, et al. 腸内細菌叢は全身性エリテマトーデスの病態における炎症反応を促進する。モル・メッド 2019;25:35. doi:10.1186/s10020-019-0102-5Google Scholar
↵Andrews BS, Eisenberg RA, Theofilopoulos AN, et al. 自然発症のマウスループス様症候群。いくつかの系統における臨床的および免疫病理学的症状。J Exp Med 1978;148:1198-215. doi:10.1084/jem.148.5.1198Abstract/FREE Full TextGoogle Scholar
マウスにおける自然発症のループス様症候群の病因と病態。Arthritis Rheum 1978;21:S64-7. doi:10.1002/art.1780210909CrossRefPubMedGoogle Scholar
⅛Boneparth A, Woods M, Huang W, et al. マウス全身性エリテマトーデスにおける自己反応性B細胞選択に対するBAFF阻害の効果. モル・メッド 2016;22:173-82. doi:10.2119/molmed.2016.00022Google Scholar
↵Ramanujam M, Bethunaickan R, Huang W, et al. BAFFの選択的遮断によるNZM2410マウスの全身性エリテマトーデス腎炎の予防および治療法. Arthritis Rheum 2010;62:1457-68. doi:10.1002/art.27368CrossRefPubMedWeb of ScienceGoogle Scholar
変異型遺伝子lprによる各種自己抗体の誘導について、いくつかの系統のマウスを用いて検討した。J Immunol 1984;133:227-33.AbstractGoogle Scholar
ローゼンバーグ YJ、スタインバーグ AD、サントロ TJ. MRL-lpr/lprマウスにおける自己免疫の基礎:自己ia反応性T細胞の役割。↵Steinberg, AD, Santoro TJ.
↵Cohen PL, Eisenberg RA. 全身性自己免疫におけるlprとgld遺伝子:Fas Laneにおける生と死。Immunol Today 1992;13:427-8. doi:10.1016/0167-5699(92)90066-GCrossRefPubMedWeb of ScienceGoogle Scholar
lprマウスのFas抗原遺伝子のイントロンに挿入された初期トランスポーザブルエレメントによる転写異常。Proc Natl Acad Sci U S A 1993;90:1756-60. doi:10.1073/pnas.90.5.1756Abstract/FREE Full TextGoogle Scholar
Toll-Like receptor 7 と TLR9 は、自己抗体の特異性を決定し、ループスのマウスモデルにおいて炎症と調節に相反する役割を担っている。Immunity 2006;25:417-28. doi:10.1016/j.immuni.2006.07.013CrossRefPubMedWeb of ScienceGoogle Scholar
MRL/lprマウスにおけるスベロイルアニリドヒドロキサム酸による腎臓疾患の調節。J Immunol 2004;173:4171-8. doi:10.4049/jimmunol.173.6.4171Abstract/FREE Full TextGoogle Scholar
↵Gu Z, Tan W, Ji J, et al. Rapamycin reverses the senescent phenotype and improve mesenchymal stem cells from MRL/lpr mice and systemic lupus erythematosus patients through inhibition of the mTOR signaling pathway. Aging (Albany NY) 2016;8:1102-14. doi:10.18632/aging.100925Google Scholar
↵Mishra N, Reilly CM, Brown DR, et al. Histone deacetylase inhibitors modulate renal disease in the MRL-lpr/lpr mouse.(ヒストン脱アセチル化酵素阻害剤はMRL-lpr/lprマウスの腎疾患を修飾する。J Clin Invest 2003;111:539-52. doi:10.1172/JCI16153CrossRefPubMedWeb of ScienceGoogle Scholar
↵Rodríguez-Alba JC, Girón-Pérez DA, Romero-Ramírez H, et al. Regulatory IFN-γ-producing killer dendritic cells are enhanced in B6.MLR-faslpr /J lupus-prone mouse. Eur J Immunol 2018;48:1851-60. doi:10.1002/eji.201847547Google Scholar
↵Merino R, Fossati L, Izui S. lupus-prone bxsb strain: the yaa gene model of systemic lupus erythematosus.(ループスプレインbxsb株:全身性エリテマトーデスyaa遺伝子モデル)。Springer Semin Immunopathol 1992;14:141-57. doi:10.1007/BF00195291PubMedGoogle Scholar
Toll-like receptor 7 の発現制御は、自己免疫と樹状細胞の増殖を制限するために不可欠である。Immunity 2007;27:801-10. doi:10.1016/j.immuni.2007.09.009CrossRefPubMedWeb of ScienceGoogle Scholar
↵ Isenberg DA. 全身性エリテマトーデス。N Engl J Med 2008;358:929-39. doi:10.1056/NEJMra071297CrossRefPubMedWeb of ScienceGoogle Scholar
↵Freitas EC, de Oliveira MS, Monticielo OA. プリスタン誘発ループス:この実験モデルに関する考察。Clin Rheumatol 2017;36:2403-14. doi:10.1007/s10067-017-3811-6CrossRefGoogle Scholar
↵Satoh M, Reeves WH. プリスタンの腹腔内注射によるBALB/cマウスのループス関連自己抗体の誘導。J Exp Med 1994;180:2341-6. doi:10.1084/jem.180.6.2341Abstract/FREE Full TextGoogle Scholar
BALB/c マウスにプリスタンを投与した際の抗核抗体産生と免疫複合体糸球体腎炎。Proc Natl Acad Sci U S A 1995;92:10934-8. doi:10.1073/pnas.92.24.10934Abstract/FREE Full TextGoogle Scholar
プリスタンと他の天然炭化水素による自己免疫の誘導。Trends Immunol 2009;30:455-64. doi:10.1016/j.it.2009.06.003CrossRefPubMedWeb of ScienceGoogle Scholar
Lee PY, Weinstein JS, Nacionales DC, et al.マウス狼瘡における新規IFN産生細胞サブセット。J Immunol 2008;180:5101-8. doi:10.4049/jimmunol.180.7.5101Abstract/FREE Full TextGoogle Scholar
横川雅彦、高石美帆、中島和彦、他:Toll-like receptor 7アゴニスト皮下投与による野生型マウスの全身性自己免疫の発症。全身性エリテマトーデスの新しいモデル。Arthritis Rheumatol 2014;66:694-706. doi:10.1002/art.38298Google Scholar
↵Kostic AD、Howitt MR、Garrett WS. 動物モデルとヒトにおける宿主-微生物叢の相互作用の探索。Genes Dev 2013;27:701-18. doi:10.1101/gad.212522.112Abstract/FREE Full TextGoogle Scholar
環境と宿主の遺伝子型が腸内細菌に及ぼす影響を解明する。Nat Rev Microbiol 2011;9:279-90. doi:10.1038/nrmicro2540CrossRefPubMedGoogle Scholar
プリスタン誘発ループスにおけるハイパーガンマグロブリン血症と自己抗体産生に対する微生物刺激の影響 ↵Hamilton KJ, Satoh M, Swartz J, et al. Clin Immunol Immunopathol 1998;86:271-9. doi:10.1006/clin.1997.4481CrossRefPubMedWeb of ScienceGoogle Scholar
↵Zhang H, Liao X, Sparks JB, et al. 自己免疫性狼瘡における腸内細菌叢の動態. Appl Environ Microbiol 2014;80:7551-60. doi:10.1128/AEM.02676-14Abstract/FREE Full TextGoogle Scholar
↵Johnson BM, Gaudreau M-C, Gudi R, et al. Gut microbiota differently contributes to intestinal immune phenotype and systemic autoimmune progression in female and male lupus-prone mouse. J Autoimmun 2020;108:102420. doi:10.1016/j.jaut.2020.102420CrossRefGoogle Scholar
↵Weckerle CE, Niewold TB. 全身性エリテマトーデスの原因不明の女性優位性:遺伝子およびサイトカイン研究からの手がかり。Clin Rev Allergy Immunol 2011;40:42-9. doi:10.1007/s12016-009-8192-4CrossRefPubMedGoogle Scholar
プロバイオティクスとプレバイオティクスが免疫系に与える影響。Nat Rev Immunol 2012;12:728-34. doi:10.1038/nri3312CrossRefPubMedGoogle Scholar
↵Manirarora JN, Kosiewicz MM, Alard P. 乳酸菌の給与は、免疫調節の強化により、(nzbxnzw)F1ループスプリンシーマウスのループスの進行に影響を与える。Autoimmunity 2020;53:323-32. doi:10.1080/08916934.2020.1777282Google Scholar
↵Toral M, Robles-Vera I, Romero M, et al. Lactobacillus fermentum CECT5716: a novel alternative for the prevention of vascular disorders in a mouse model of systemic lupus erythematosus.乳酸菌発酵物CECT5716:血管障害予防のための新しい選択肢。FASEB J 2019;33:10005-18. doi:10.1096/fj.201900545RRGoogle Scholar
↵Luo XM, Edwards MR, Mu Q, et al. ヒト全身性エリテマトーデスおよびループスモデルマウスにおける腸内細菌叢(Gut microbiota). Appl Environ Microbiol 2018;84:e02288-17. doi:10.1128/AEM.02288-17CrossRefPubMedGoogle Scholar
↵Zegarra-Ruiz DF, El Beidaq A, Iñiguez AJ, et al. 食事感受性常在乳酸菌株がTLR7依存性の全身性自己免疫を媒介する。Cell Host Microbe 2019;25:113-27. doi:10.1016/j.chom.2018.11.009CrossRefPubMedGoogle Scholar
↵Hufeldt MR, Nielsen DS, Vogensen FK, et al. 実験用マウスの腸内細菌叢の変動は、遺伝要因と環境要因の両方に関連している。Comp Med 2010;60:336-47.PubMedGoogle Scholar
高脂肪食に対する代謝反応を説明するために、マウスの遺伝的背景は腸内細菌叢の変化を克服している。Nutrients 2020;12:287. doi:10.3390/nu12020287Google Scholar
韓国人の腸内細菌叢の比較解析(パイロシーケンサーによる)。PLoS One 2011;6:e22109. doi:10.1371/journal.pone.0022109Google Scholar
↵David LA, Maurice CF, Carmody RN, et al. Diet rapidly and reproducibly alters the human gut microbiome.食事はヒトの腸内細菌を急速に再現性高く変化させる。ネイチャー 2014;505:559-63. doi:10.1038/nature12820CrossRefPubMedWeb of ScienceGoogle Scholar
↵Arumugam M, Raes J, Pelletier E, et al. Enterotypes of the human gut microbiome(ヒト腸内細菌の腸型)。Nature 2011;473:174-80. doi:10.1038/nature09944CrossRefPubMedWeb of ScienceGoogle Scholar
↵Hevia A, Milani C, López P, et al. 全身性エリテマトーデスに関連する腸内ディスバイオーシス. MBio 2014;5:e01548-14. doi:10.1128/mBio.01548-14CrossRefPubMedGoogle Scholar
↵He Z, Shao T, Li H, et al. Chinese patients with systemic lupus erythematosesにおける腸内細菌叢の変容。ガット・パスオグ 2016;8:64. doi:10.1186/s13099-016-0146-9Google Scholar
↵Greiling TM, Dehner C, Chen X, et al. ループスにおける自己免疫のトリガーとしてのヒト自己抗原Ro60のコメンサルオーログ。Sci Transl Med 2018;10:eaan2306. doi:10.1126/scitranslmed.aan2306Google Scholar
↵van der Meulen TA, Harmsen HJM, Vila AV, et al. 原発性シェーグレン症候群と全身性エリテマトーデスにおける共有の腸、しかし異なる口腔微生物叢の組成. J Autoimmun 2019;97:77-87. doi:10.1016/j.jaut.2018.10.009CrossRefPubMedGoogle Scholar
↵Guo M, Wang H, Xu S, et al. 腸内細菌叢の変化は、全身性エリテマトーデスにおけるサイトカインの調節障害およびグルココルチコイド療法と関連しています。Gut Microbes 2020;11:1758-73. doi:10.1080/19490976.2020.1768644CrossRefPubMedGoogle Scholar
↵Wei F, Xu H, Yan C, et al. 中国東北部の全身性エリテマトーデス患者における腸内フローラの変化. PloS One 2019;14:e0213063. doi:10.1371/journal.pone.0213063Google Scholar
↵López P, de Paz B, Rodríguez-Carrio J, et al. Th17反応と天然igm抗体は、全身性エリテマトーデス患者の腸内細菌叢組成に関連しています。サイ・レップ 2016;6:24072. doi:10.1038/srep24072Google Scholar
↵Li Y, Wang H-F, Li X, et al. 腸内細菌の乱れは全身性エリテマトーデスの活動性と関連している。Clin Sci (Lond) 2019;133:821-38. doi:10.1042/CS20180841Google Scholar
↵Den Besten G, van Eunen K, Groen AK, et al. 食事、腸内細菌叢、宿主エネルギー代謝の間の相互作用における短鎖脂肪酸の役割. J Lipid Res 2013;54:2325-40. doi:10.1194/jlr.R036012Abstract/FREE Full TextGoogle Scholar
胃腸内細菌叢と大腸がん。Am J Physiol Gastrointest Liver Physiol 2015;308:G351-63. doi:10.1152/ajpgi.00360.2012CrossRefPubMedGoogle Scholar
↵Peng L, Li Z-R, Green RS, et al. 酪酸はCaco-2細胞単層でAMP-activated protein kinaseの活性化を介してタイトジャンクションの形成を促進し腸のバリアを強化する。J Nutr 2009;139:1619-25. doi:10.3945/jn.109.104638Abstract/FREE Full TextGoogle Scholar
↵Azzouz D, Omarbekova A, Heguy A, et al. Lupus nephritis is linked to disease-activity associated expansion and immunity to a gut commensal.ループス腎炎は、疾患活動関連拡張と腸内常在菌に対する免疫に関連している。Ann Rheum Dis 2019;78:947-56. doi:10.1136/annrheumdis-2018-214856Abstract/FREE Full TextGoogle Scholar
↵Chen B, Jia X-M, Xu J-Y, et al. 未治療の全身性エリテマトーデス患者の腸内細菌叢によって定義される自己免疫原性および炎症促進性プロファイル。Arthritis Rheumatol 2021;73:232-43. doi:10.1002/art.41511Google Scholar
↵Assimakopoulos SF, Triantos C, Thomopoulos K, et al. 重症患者における腸管由来の敗血症:病態生理と治療. Infection 2018;46:751-60. doi:10.1007/s15010-018-1178-5CrossRefPubMedGoogle Scholar
↵Martin-Gallausiaux C, Larraufie P, Jarry A, et al. 常在菌が産生する酪酸は、ヒト腸管上皮細胞において二重機構を介してインドラミン2,3ジオキシゲナーゼ1(IDO-1)発現をダウンレギュレートします。Front Immunol 2018;9:2838. doi:10.3389/fimmu.2018.02838PubMedGoogle Scholar
↵Manfredo Vieira S, Hiltensperger M, Kumar V, et al. 腸内病原体のトランスロケーションはマウスとヒトで自己免疫を駆動する。Science 2018;359:1156-61. doi:10.1126/science.aar7201Abstract/FREE Full TextGoogle Scholar
↵Li R, Meng X, Chen B, et al. 狼瘡における腸内細菌叢: バタフライ効果? Curr Rheumatol Rep 2021;23:27. doi:10.1007/s11926-021-00986-zGoogle Scholar
免疫介在性疾患、自己免疫性皮膚疾患およびそれらの併存疾患におけるヒト細菌性腸内細菌叢の意義:叙述的レビュー ↵Colucci R, Moretti S. Dermatol Ther (Heidelb) 2021;11:363-84. doi:10.1007/s13555-021-00485-0Google Scholar
↵Zhang Y, Liu Q, Yu Y, et al. 腸内細菌叢への早期および短期の介入は、MRL/lprマウスのループスの重症度、進行、および治療に影響を与える。Front Microbiol 2020;11:628. doi:10.3389/fmicb.2020.00628Google Scholar
↵Kuhn A, Bonsmann G, Anders H-J, et al. Dtsch Arztebl Int 2015;112:423-32. doi:10.3238/arztebl.2015.0423PubMedGoogle Scholar
↵Tunnicliffe DJ, Singh-Grewal D, Kim S, et al. 全身性エリテマトーデスの診断、モニタリング、治療:臨床実践ガイドラインのシステマティックレビュー. Arthritis Care Res (Hoboken) 2015;67:1440-52. doi:10.1002/acr.22591Google Scholar
↵マーフィーG、アイゼンバーグDA. 全身性エリテマトーデスの新しい治療法-過去は不完全、未来は時制。Nat Rev Rheumatol 2019;15:403-12. doi:10.1038/s41584-019-0235-5Google Scholar
↵Navarra SV, Guzmán RM, Gallacher AE, et al. 活動性全身性エリテマトーデス患者におけるベリムマブの有効性および安全性:無作為化プラセボ対照第3相試験. The Lancet 2011;377:721-31. doi:10.1016/S0140-6736(10)61354-2Google Scholar
↵Zhang F, Bae S-C, Bass D, et al. 中国、日本、韓国に所在する全身性エリテマトーデス患者におけるベリムマブの重要な第III相無作為化プラセボ対照試験です。Ann Rheum Dis 2018;77:355-63. doi:10.1136/annrheumdis-2017-211631Abstract/FREE Full TextGoogle Scholar
↵Ramanujam M, Wang X, Huang W, et al. Transembrane activator and calcium modulator ligand interactor-ig in murine systemic lupus erythematosusの作用機序。J Immunol 2004;173:3524-34. doi:10.4049/jimmunol.173.5.3524Abstract/FREE Full TextGoogle Scholar
↵Zhang L, Qing P, Yang H, et al. 全身性エリテマトーデスにおける腸内マイクロバイオームと代謝物:リンク、メカニズム、介入。Front Immunol 2021;12:686501. doi:10.3389/fimmu.2021.686501Google Scholar
↵Johnson BM, Gaudreau M-C, Al-Gadban MM, et al. ループス傾向Snf1マウスの疾患進行および腸内細菌組成に対する食餌逸脱の影響. Clin Exp Immunol 2015;181:323-37. doi:10.1111/cei.12609CrossRefGoogle Scholar
𡯥Vieira SM, Pagovich OE, Kriegel MA. 食事、微生物叢、自己免疫疾患。Lupus 2014;23:518-26. doi:10.1177/0961203313501401CrossRefPubMedWeb of ScienceGoogle Scholar
↵Reifen R, Amital H, Blank M, et al. Linseed oil suppresses the anti-beta-2-glycoprotein-I in experimental antiphospholipid syndrome.(リンシードオイルは実験的抗リン脂質症候群の抗β-2-糖タンパク質-Iを抑制する)。J Autoimmun 2000;15:381-5. doi:10.1006/jaut.2000.0439CrossRefPubMedWeb of ScienceGoogle Scholar
↵Yuen HK, Cunningham MA. 全身性エリテマトーデス患者における疲労の最適な管理:システマティックレビュー。Ther Clin Risk Manag 2014;10:775-86. doi:10.2147/TCRM.S56063PubMedGoogle Scholar
↵Klack K、Bonfa E、Neto EFB. 全身性エリテマトーデスにおける食事と栄養の側面。Rev Bras Reumatol 2012;52:395-408. doi:10.1590/S0482-50042012000300009Google Scholar
⅛Bello KJ, Fang H, Fazeli P, et al. SLEにおけるオメガ3:全身性エリテマトーデスにおける内皮機能障害および疾患活動性に関する二重盲検プラセボ対照無作為化臨床試験。Rheumatol Int 2013;33:2789-96. doi:10.1007/s00296-013-2811-3PubMedGoogle Scholar
↵Arriens C, Hynan LS, Lerman RH, et al. 全身性エリテマトーデスにおける疲労、生活の質、疾患活動性に対する魚油の影響に関するプラセボ対照無作為化臨床試験。Nutr J 2015;14:82. doi:10.1186/s12937-015-0068-2Google Scholar
↵Bhattacharya A, Sun D, Rahman M, et al. 市販魚油におけるエイコサペンタエン酸およびドコサヘキサエン酸オメガ3脂肪酸の比率の違いは、C57BL/6雌マウスの腹膜マクロファージの炎症性サイトカインを異なる方向に変化させます。J Nutr Biochem 2007;18:23-30. doi:10.1016/j.jnutbio.2006.02.005CrossRefPubMedWeb of ScienceGoogle Scholar
Duffy EM, Meenagh GK, McMillan SA, et al. 全身性エリテマトーデスにおけるオメガ3魚油および銅の栄養補給の臨床的効果。J Rheumatol 2004;31:1551-6.Abstract/FREE Full TextGoogle Scholar
↵Constantin M-M, Nita IE, Olteanu R, et al. 全身性エリテマトーデスの病態に対する食事要因の意義と影響. Exp Ther Med 2019;17:1085-90. doi:10.3892/etm.2018.6986Google Scholar
↵Mora JR, Iwata M, von Andrian UH. 免疫系におけるビタミン効果:ビタミンAとDが主役です。Nat Rev Immunol 2008;8:685-98. doi:10.1038/nri2378CrossRefPubMedWeb of ScienceGoogle Scholar
↵Mu Q, Zhang H, Luo XM. SLE:微生物と食事に影響されるもう一つの自己免疫疾患?Front Immunol 2015;6:608. doi:10.3389/fimmu.2015.00608Google Scholar
↵木下和彦、岸本和彦、島津秀樹、他 ループス腎炎患者におけるレチノイドの治療成功。Am J Kidney Dis 2010;55:344-7. doi:10.1053/j.ajkd.2009.06.012CrossRefPubMedGoogle Scholar
↵Guo X, Yang X, Li Q, et al. 全身性エリテマトーデスにおける微生物叢:プロバイオティクスの潜在的機能に関する最新情報. Front Pharmacol 2021;12:759095. doi:10.3389/fphar.2021.759095Google Scholar
↵Esmaeili S-A, Mahmoudi M, Momtazi AA, et al. 耐容性プロバイオティクス:全身性エリテマトーデスにおける潜在的免疫調節因子。J Cell Physiol 2017;232:1994-2007. doi:10.1002/jcp.25748Google Scholar
↵Schiffer C, Lalanne AI, Cassard L, et al. Lactobacillus caseiの株は、免疫炎症のエフェクター相を抑制する。J Immunol 2011;187:2646-55. doi:10.4049/jimmunol.1002415Abstract/FREE Full TextGoogle Scholar
↵Vlasova AN, Kandasamy S, Chattha KS, et al. プロバイオティクス乳酸菌とビフィズス菌の効果、免疫反応、ロタウイルスワクチンおよび感染の異なるホスト種における比較. Vet Immunol Immunopathol 2016;172:72-84. doi:10.1016/j.vetimm.2016.01.003CrossRefPubMedGoogle Scholar
↵de Oliveira GLV, Leite AZ, Higuchi BS, et al. 自己免疫疾患における腸内細菌の異常とプロバイオティクスの応用. イムノロジー 2017;152:1-12. doi:10.1111/imm.12765CrossRefPubMedGoogle Scholar
↵Mike A, Nagaoka N, Tagami Y, et al. MRL/lpr マウスにおける Lactobacillus casei による B220+ T 細胞の拡大防止と寿命延長の検討. また、"Lactobacillus casei "は、"MRL/lpr "マウスにおいて、B220+ T細胞の増殖抑制と寿命延長をもたらす。
⅛Mardani F, Mahmoudi M, Esmaeili S-A, et al. In vivo研究:耐容性乳酸菌プロバイオティクスによる治療後のプリスタン誘発全身性エリテマトーデスマウスのth1-th17減少. J Cell Physiol 2018;234:642-9. doi:10.1002/jcp.26819Google Scholar
↵Konturek PC, Koziel J, Dieterich W, et al. 便微生物移植によるクロストリジウム・ディフィシル感染症の治療成功。J Physiol Pharmacol Off J Pol Physiol Soc 2016;67:859-66.Googleスカラー
↵Smits LP, Bouter KEC, de Vos WM, et al. 便微生物移植の治療的可能性. Gastroenterology 2013;145:946–53. doi:10.1053/j.gastro.2013.08.058CrossRefPubMedGoogle Scholar
↵Wang M, Zhu Z, Lin X, et al. MRL/lprマウスの治療におけるプレドニゾンの治療効果と副作用を腸内細菌叢が介在している。Arthritis Res Ther 2021;23:240. doi:10.1186/s13075-021-02620-wGoogle Scholar
↵Zamudio Tiburcio Á. 腸内細菌叢の移植による活動性全身性エリテマトーデス患者の改善。GMR 2019;3:3. doi:10.31031/GMR.2019.03.000551Google Scholar
↵Huang C, Yi P, Zhu M, et al. 全身性エリテマトーデスの治療に対する糞便微生物叢移植の安全性と効果:エクスプローラートライアル. J Autoimmun 2022;130:102844. doi:10.1016/j.jaut.2022.102844Google Scholar
He H, Xu H, Xu J, et al. Sodium butyrate ameliorates gut microbiota dysbiosis in lupus-like mice.酪酸ナトリウムはループスマウスの腸内細菌叢の異常を改善する。Front Nutr 2020;7:604283. doi:10.3389/fnut.2020.604283Google Scholar
He J, Chan T, Hong X, et al.マイクロバイオームおよびメタボローム解析により、全身性エリテマトーデスにおける脂質代謝の乱れが明らかになりました。Front Immunol 2020;11:1703. doi:10.3389/fimmu.2020.01703Google Scholar
Wen M, Liu T, Zhao M, et al. 全身性エリテマトーデス患児における腸内細菌叢と代謝産物の相関解析. J Immunol Res 2021;2021:5579608. doi:10.1155/2021/5579608Google Scholar
Toumi E, Goutorbe B, Plauzolles A, et al. 全身性エリテマトーデス患者およびループスマウスモデルにおける腸内細菌叢:バイオマーカー探索のための種間比較解析. Front Immunol 2022;13:943241. doi:10.3389/fimmu.2022.943241Google Scholar
脚注
PHとJLMは同等に貢献した。
寄稿者 執筆およびオリジナル原稿の作成。ET. 査読と編集。SM、AP、JLM。最終原稿の確認。ET、SM、AP、LC、JLM。監修。JLM、PH。資金獲得。PH。全著者が論文に貢献し、提出されたバージョンを承認した。
資金提供 著者らは,公的,商業的,非営利的ないかなる資金提供機関からも,この研究のために特定の助成を受けることを宣言していない。
競合利益 なし。
証明と査読 受託研究ではなく、外部査読を受けている。
あなたにお勧めの他のコンテンツ
1302 ループス発症マウスにおける解糖抑制の治療効果は、糞便マイクロバイオームを通じて伝達可能である
Ahmed S Elshikhaら、Lupus Sci Med、2022年
27 乳酸菌とタクロリムスの併用療法は強力な治療効果を持ち、ループスの動物モデルでタクロリムスによるTh17/Treg細胞のアンバランスを改善する
ダ・ソム・キムら、Lupus Sci Med、2019年
外から狼を変える:マイクロバイオータが全身性エリテマトーデスを誘発する仕組み
Isabelle Peeneら、Ann Rheum Dis、2019年
thu0241 nzb/w f1マウスのhcmv pp65 422-439免疫によるループス活動増悪に関連する糞便微生物叢の変化
Y. C. Tsaiら、Ann Rheum Dis、2020年
腸内細菌異常は細菌の転座を介して子癇前症の発症を誘導する
Xia Chenら、Gut、2020年
プラークから過剰なコレステロールを除去するためのコレステロール排出の役割を発見する
出典 DiscoverCholesterolEfflux.com|CMD-MY-0033 I 2022年11月号
局所的な障壁が宿主と微生物叢の間の全身的なコミュニケーションを構成する
Qiuhe Luら、サイエンス、2022年
認知機能障害の治療標的としての腸内細菌叢
Yi Sunら、The Journals of Gerontology: シリーズA、2019年
免疫関連慢性腎臓病における微生物叢の変化の結果
Wei Ling Lauら、Nephrology Dialysis Transplantation、2020年
腸の向こう側
イリーナ・レオナルディ、サイエンス、2022年
協賛
アメリカ・ループス財団
コンテンツ
最新コンテンツ
アーカイブ
コレクション別に見る
最も読まれた記事
引用された記事のトップ
回答数
ポッドキャスト
RSSTwitterFacebookSoundcloud
ジャーナル
について
編集委員会
メールマガジン登録
LFAについて
査読者の皆様へ
著者紹介
著者の方へ
論文の投稿
編集方針
BMJのオープンアクセス
BMJオーサーハブ
ヘルプ
お問い合わせ
リプリント
許可証
広告掲載
フィードバックフォーム
ウェブサイト利用規約
プライバシーとクッキー
BMJへのお問い合わせ
Cookieの設定
オンライン ISSN 2053-8790
著作権 © 2023 BMJ Publishing Group Ltd & Lupus Foundation of America. 無断転載を禁じます。
この記事が気に入ったらサポートをしてみませんか?
