植物由来の代替食肉が消費者の腸内細菌叢に与える影響。実社会における研究
オープンアクセス論文
植物由来の代替食肉が消費者の腸内細菌叢に与える影響。実社会における研究
Miguel A. Toribio-Mateas 1,2,*ORCID, Adri Bester 1ORCID and Natalia Klimenko 3,4 によるものです。
1
ロンドン・サウスバンク大学応用科学部、ロンドンSE1 0AA, UK
2
ミドルセックス大学健康・教育学部、ロンドンSE1 0AA、UK
3
ロシア科学アカデミー・遺伝子生物学研究所 精密ゲノム編集・生物医学遺伝子技術センター 119334モスクワ、ロシア
4
Knomics LLC 研究開発部、Skolkovo Innovation Center、〒121205 モスクワ、ロシア
*
著者名
Foods 2021, 10(9), 2040; https://doi.org/10.3390/foods10092040
受理されました。2021年8月5日 / 改訂:2021年8月24日 / 受理:2021年8月25日 / 公開:2021年8月30日
(この記事は Section Plant Foods に所属しています)
ダウンロード ブラウズ図 レビューレポート版 ノート
概要
肉をあまり食べないことが、より健康的で倫理的な選択肢であると見なされるようになってきている。このため、消費する動物性肉の少なくとも一部を代替する植物性代替肉(PBMA)を求めるフレキシタリアン消費者の数が増加している。フレキシタリアンの間で人気のある植物性ミンチ、ハンバーガー、ソーセージ、ミートボールなどのPBMA製品は、しばしば低品質で超加工食品として認識されている。しかし、我々は、植物由来の原料を工業的に加工したからといって、PBMA製品がデフォルトで超加工食品になるわけではないことを主張する。この仮説を検証するため、我々は無作為化対照試験を実施し、週に数回の肉を含む食事をPBMA製品で調理した食事に置き換えた20人の参加者の腸内細菌叢の変化を評価し、これらの変化とサイズを合わせた対照者の変化を比較検討した。便サンプルは、16S rRNAの配列決定に供された。得られた生データは、革新的なバイオインフォマティクス手法により、組成を考慮した方法で解析された。注目すべき変化として、介入群では対照群と比較して、主に4-アミノブチレート/コハク酸経路とグルタル酸経路における酪酸代謝能の上昇と、酪酸産生菌の共同存在量の増加がみられた。また、Tenericutes門が介入群では減少し、対照群では増加した。これらの結果から、フレキシタリアン型の食事パターンに見られる、動物性肉を時折PBMA製品に置き換えることは、消費者の腸内細菌叢にポジティブな変化を促す可能性があると結論づけた。
キーワード:腸内細菌叢、腸内細菌叢、植物性肉代替品、フレキシタリアン、フレキシタリアニズム、植物性食事、肉代替品、肉代替品、植物性タンパク質、超加工済み食品

図表による概要
はじめに
食の選択が人間の健康に及ぼす影響について一般に知られるようになり、植物由来の製品への需要が世界的に高まっている。研究者たちは、過剰な肉の消費と肥満 [1,2]、2型糖尿病 [3,4,5]、心臓血管疾患 [6]、ある種の癌 [7,8] などの非伝染病の発症との間に存在する強いつながりを明らかにし続けている。逆に、植物性食品の消費量が多いことを特徴とする食事は健康を促進し、多くの慢性疾患のリスクを低減すること [9,10]、そして植物性食品の高い繊維とポリフェノールは、これらのポジティブな健康成果を仲介する腸内細菌叢組成の変化を促進するという証拠が増えています[11,12,13,14,15]。
最近の研究では、健康や環境に配慮するフレキシタリアンは、植物性食肉代替品を含む動物性食品を食事に取り入れる傾向があることが示唆されています[16,17,18]。また、ベジタリアンやビーガンに加えて、フレキシタリアンも、加工されていない肉、例えばステーキを模倣したものよりも、ハンバーガー、ミートボール、ソーセージなどの加工肉製品を模倣した植物由来の肉食品に魅力を感じることが研究で示されている [19].さらに、植物性食品の消費者の食事パターン分析では、コンビニエンス・ミールやスナックがこのコミュニティにとって非常に魅力的であることも判明している[20]。これらの知見は、いくつかの懸念を抱かせる。まず、すべての代用肉が持続可能というわけではありません。汚染、GHG排出、土地転換を増加させることが知られているパーム油を含むものもあり [21,22] 、世界的に論争の的になっている遺伝子組み換え食品を含むものもある [23]。第二に、ある種の代用肉は、高脂肪やナトリウム含量のために、あるいは消費者が「不必要な成分」と考えるもの、すなわち保存料、甘味料などの長いリストに基づいて、超加工品として分類されることがある[24]。[25,26,27].
植物由来の食事が人間の健康を増進するという証拠は増え続けているが、動物由来の食品を避けることは、一般に不健康とみなされる便利な超加工食品(UPF) [28] の消費量が増えることと関連していることが判明しているのである。UPFは、不健康な脂肪や精製された炭水化物を多く含むとともに、栄養価の高い成分を減らしていることが知られている[29,30]。繊維の乏しいUPFは、消化率の違いにより結腸への栄養基質の供給を変え、それにより腸内細菌叢の組成と代謝活性の両方に負の変化を促し[31,32]、ディスバイオシスとして知られる錯乱状態に導くことが知られている[33,34]。植物由来の代替肉(PBMA)の中には、UPFに分類されるものもある。しかし、私たちは、植物由来の成分を単に工業的に加工しただけでは、PBMA製品を超加工食品にすることはできないと主張する。実際、PBMA製品が消費者の腸内細菌叢の優生的あるいは異生的変化を促進する可能性は、個々の原材料の栄養プロファイルにあり、品質評価は製品ごとに、あるいは少なくとも、製品ポートフォリオ全体で同じ食品製造技術に従っているメーカーが極めて似た原材料で作ったPBMA製品群について実施されなければならないと、私たちは主張する。
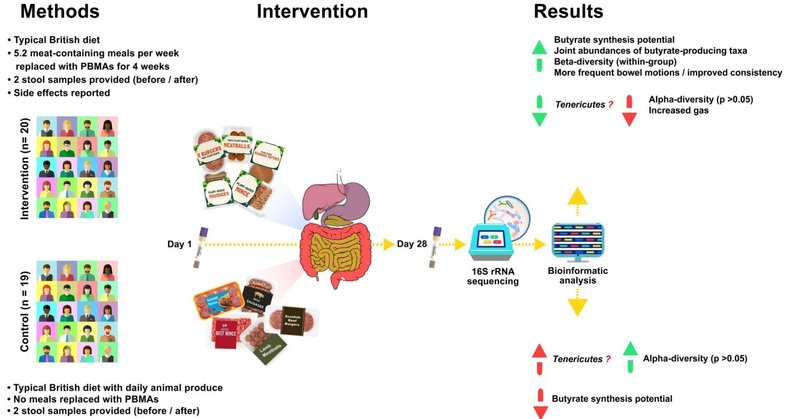
消費者のマイクロバイオームに対するPBMA製品と従来の(動物)肉製品の効果を比較するのに役立つ、厳密にデザインされた介入試験によるPBMAの品質に関する文献は、明らかに不足している。したがって、本研究は、栄養学、微生物学、消費者行動が交差するこの分野での知識のギャップを埋めることを目的としている。我々は、植物性タンパク質、繊維、フェノール化合物を豊富に含む天然植物性原材料で製造されたハンバーガー、ソーセージ、ミートボールなどのPBMA製品は、動物性肉製品の代替品として使用した場合、消費者の腸内マイクロバイオームにポジティブな変化をもたらすことができると仮定している(たとえ代替品がたまにしかない場合でも、つまりフレキシタリアン型の食事パターンのように)。この仮説を検証するため、40人の参加者のうち20人が4週間、前述の動物性食品を植物性食品で代替し、サイズを合わせた雑食性の対照群と比較して、腸内細菌叢の組成と機能の変化を評価した。材料と方法
この無作為化対照試験の材料と方法は、以下のセクションに記載されています。
2.1. 参加者
2.1.1. 参加者の募集方法
ソーシャルメディア広告でボランティア希望者を募り、210名が参加に関心を示した。参加者情報シートを読んだ後、48人が電子メールで、(1)参加基準を満たさない、または(2)除外基準の少なくとも1つを満たすため、参加資格がない、と回答してきた。参加資格と除外基準は以下の通りである。
包含基準
処方箋による投薬が必要な基礎疾患がないこと。
年齢が18歳以上55歳未満であること。
BMI が 18.5 以上 29.9 未満であること。
過去6ヶ月間、抗生物質を服用していないこと。
過去1ヶ月間、プロバイオティクスのサプリメントを使用していない。
毎日、赤身の肉/鶏肉/魚/卵/チーズを食べている。
植物性の肉代用品を食べていない。
除外基準。
潰瘍性大腸炎、クローン病、過敏性腸症候群、腸癌の医学的診断を受けた直系DNA家族(母、父、兄弟、姉妹)。
大豆にアレルギーのある方。
精神疾患または脳腫瘍の既往歴がある方。
NHSのサポートを受けている疾患と診断された方。
過去6ヶ月以内にCOVID-19の診断が陽性であった、またはCOVID-19の症状が疑われた方。
42名のボランティアが署名入りの同意書を返送しました。
2名の参加者が研究開始前に辞退した。1人はCOVID-19のロックダウンのため英国に戻ることができず、もう1人は抗生物質のコースを開始したばかりだった。もう1人の参加者は、最初の便サンプルを返送しなかったため、参加を取りやめた。39人の健康なボランティア(男性19人、女性20人)が、4週間の研究期間を全うしました(図1)。年齢 37.5 ± 8.9 歳 (範囲 21 ~ 55); 体重 70.3 ± 11 kg (範囲 55 ~ 90); BMI 23 ± 2.3 (範囲 19 ~ 27)。
食品 10 02040 g001 550図1.研究の流れ図。
本研究は、ボランティアに文書で十分に説明され、それぞれが参加する前に文書によるインフォームドコンセントを行った。ロンドン・サウスバンク大学応用科学部倫理委員会は、本研究を承認した。倫理承認参照番号はETH2021-0025である。
本研究のデータ収集は、2021 年 1 月から 2 月にかけて行われた。
2.1.2. 無作為化およびグループアロケーションの手順
Sealed Envelope Ltd ソフトウェア [35] を用いて層別ブロック無作為化法を適用し、参加者を性別で層別した 2 群(A、B)に無作為に振り分けた。研究に直接関与していない1名がグループのアイデンティティを選択し、Aを介入群に、Bを対照群に割り付けた。
2.1.3. 介入群で摂取された植物性製品
参加者は、The Meatless Farm, Leeds, UK [36]から提供された、市販の植物性タンパク質肉代替製品の中から選択したものを摂取した。彼らは、イギリス、アメリカ合衆国、カナダ、および欧州連合で市販されている植物由来のミンチ、植物由来のバーガーパテ、植物由来のソーセージ、植物由来のソーセージパテ、および植物由来のミートボールの中から選択されたものを受け取った。これは、介入製品が現実の製品であり、研究のためだけに製造された製品ではない点で注目される。ミートボールとパティは、この論文を書いている時点では外食産業用の製品である。介入製品の栄養組成を表1に示す。
表1. 介入製品の多量栄養素とタンパク質源。
表
製品情報シートの全文は、食品安全上の注意点、保存方法、調理方法に加えて、完全な栄養素の内訳を補足資料のセクションで見ることができる。
植物性ミンチを除くすべての製品において、エンドウ豆が主なタンパク質源となった。エンドウ豆粉、エンドウ豆タンパク質濃縮物(乾燥分画)、脱皮エンドウ豆の植物栄養素分析は、表2に記載されています。ルテイン、フェルラ酸、ゲニステインのようなフェノール化合物のレベルについては、この時点で強調しておきたいと思います。
表2. エンドウ豆全体、エンドウ豆粉、エンドウ豆タンパク質濃縮物中の植物栄養素の含有量。
表
2.1.4. 試験デザインおよび手順
本研究では、無作為化対照、介入前および介入後の評価デザインを採用し、植物性食品の定期的な摂取が参加者の腸内細菌叢に及ぼす影響を、対照群と比較しながら調査した。対照群の参加者は、何の介入も受けなかった。その代わり、彼らは赤肉、鶏肉、魚、卵、チーズなどの動物性食品を毎日摂取し続けるよう求められた。つまり、彼らは単に上記の表1のように、参加基準に明記されている食事パターンの金dを遵守し続けるだけであった。参加者の管理者を除くすべての研究者は、データ分析が終了するまで、参加者のグループ割り当てについて盲検化されていた。
参加者の両グループは、2つの検便キット(Atlas Biomed, UK)を受け取った。最初の便サンプルの提出後、介入群には、14日間、1日1食の植物性食品を調理するのに十分な植物性食材(ミンチ、ミートボール、ソーセージ、ソーセージパテ、ハンバーガーなど)が最初に届けられた。参加者は、4週間にわたり、1週間に最低4食の動物性タンパク質ベースの食事を植物性の食事に置き換え、提供された肉なし製品を摂取した食事の回数を記録するよう要請された。最初の2週間が終了した時点で、植物性食材の提供を繰り返した。
参加者の利便性と研究プロトコルの遵守を最適化するために、家族全員に食べさせるのに十分な量の植物性食材が送られた。食材は解凍方法とともに冷凍で送られ、介入に提供されたPBMA製品を参加者が調理するためのアイデア(合計26種類)が書かれたレシピ冊子も主催者から提供された。参加者に送られたレシピ冊子は、補足資料のセクションに掲載されている。
4週間の期間が終了した時点で、介入群、対照群ともに、参加者は2回目の便検査を完了し、検査室に送付するよう念を押された。
2.1.5. 参加者のデータ収集
登録とグループ配分の無作為化の後、参加者は身体測定データを提供するよう求められた。2つの表(1つは詳細、1つは要約)が補足資料のセクションから入手可能である。特に断りのない限り、データは平均値±SDで表される。身体測定の特性は、数値については一元配置分散分析、名目値についてはフィッシャーの正確性検定を用いて比較した。データは、IBM SPSS (IBM, Armonk, New York, NY, USA) (Statistics for Windows, Version 25.0) [37]を用いて分析された。
この時点で、参加者は2つの腸内細菌叢検査キット(Atlas Biomed, UK [38])を受け取り、自宅の便利な場所でサンプルを収集する方法について詳しい説明があった。最初の便サンプルは介入開始前に全参加者が採取して返送し、もう一つの便サンプルは4週間の介入期間の終了時(28日目)に全参加者が採取して返送した。介入群の参加者は、4週間の各期間終了時に消費データおよび副作用・有害症状データを、介入および参加者を管理する研究者に提供した。研究のフロー図は、図1に示すとおりです。包括的な身体測定、食事消費データ、週ごとの自己報告による副作用は、補足資料のセクションで別のファイルとして利用可能である。
2.2. 腸内細菌叢の解析
2.2.1. サンプル採取
マイクロバイオームサンプル収集は、英国に拠点を置くバイオテクノロジー企業Atlas Biomed [41]がISO 13485:2016認定パッケージ(医療機器)[42]で提供するOmnigene Gut OM-200 kit [39,40] を用いて実施した。OM-200キットは、Illumina MiSeqプラットフォームによって配列決定される前に、DNA抽出と安定化[43]を容易にした[44,45]。その後、生データはDeblurアルゴリズム[46]を使用して解析された。可変トリミング長が使用された:最大値(max_len)は、すべてのサンプルにわたって最も頻繁にリード長として決定され、次に[max_len-1:max_len-4]の範囲内のトリミング長の各値は、別々に処理された。ノイズ除去されたリードの分類は、QIIME2 Naive-Bayes分類器 [47]を用いて行った。この分類器は、Greengenes データベース v.13.5 [48]を用いて、OTU 類似度 97%で学習させた。陰性対照試料で検出された、皮膚や環境中に生息することが知られているASV(amplicon sequencing variants)は、解析から除外された。α-diversityとβ-diversityの解析では、各サンプルについて、分類されたリードをランダムに同じ数(3000リード/サンプル)に希釈した。各サンプルについて、Shannon [49] および Chao1 diversity メトリクス [50] を用いてα-diversityを推定した。β-diversity(腸内コミュニティ構造間のペアワイズ非類似度)は、Bray-Curtis非類似度メトリックスを用いて推定した[51,52]。微生物の種、属、科のリード数は、それぞれの分類群に属するASV(amplicon sequencing variants)に割り当てられたリードの合計として計算された。
2.2.2. マイクロバイオームデータの拡張統計解析
16S rRNA遺伝子アンプリマーのハイスループットシーケンスによって生成されたマイクロバイオームデータセットは、装置によって任意の合計が課されるため、構成的であるという事実が認識されつつある。このため、5サンプル未満の相対存在量が1%を超える分類群をすべて削除した後、存在量テーブルのゼロ値を置き換えるという、組成を考慮した方法でマイクロバイオームデータ解析を実施した。残りの分類群については、ベイズ乗算置換法(Palarea-Albaladejo と Martín-Fernandez による zCompositions パッケージの CMultRepl 関数 [53] )を使用して、すべてのゼロオブザベーションを置換した。
ベータ多様性を分析するための組成を考慮したアプローチには、Aitchison距離(clr座標におけるユークリッド距離)の評価と、さらに主座標分析(PCoA)が含まれている。各群について個別にPERMANOVA検定を行い、時間軸との有意な関連性を同定した。ペアサンプル間のβ多様性(変化の大きさ)とメタデータ(年齢、性別、BMI、体重、摂取した食事回数)の関連は、各群について個別に線形モデルを用いて分析した。ペアサンプル間のβ多様性の介入群との関連も線形モデルを用いて分析した。
α-多様性の変化(Shannon指数およびChao1指数)と介入群との関連は、以下の式を用いたANCOVA分析により分析した。
(介入後の多様性)~切片+(介入前の多様性)+グループ
アルファ多様性の変化とメタデータの関連は、各グループについて個別に線形回帰を用いて算出した。
組成を考慮した分類学的現存量差解析は、グループ内解析とグループ間解析の2種類のアプローチで実施した。まず,DBAアルゴリズム(discriminative balance analysis)[54]を用いて,各群で個別に分類群バランスの差を推定した。このとき,より小さい残高を優先する DBA 変種を選択した(sbp.fromADBA).このアルゴリズムは、メタデータ(我々の場合、時点)に基づいてilr(等尺性対数比)座標を選択する。そして、選択された座標におけるバランス値を計算した。次に、線形回帰(被験者IDをランダム効果にした混合効果モデル)を用いて、各バランスの変化の有意性を評価した。次に、Benjamini-Hochberg法を用いて多重比較補正を行い、False Discovery Rate(FDR)を制御した[55,56]。
次に,グループ間で分類群存在量の変化が異なるかどうかを調べるために,クラス間分析を行った.グループ間のベースライン差に起因する変化を排除するため、介入前のグループ間差が介入後の差より大きい分類群を除去する追加的なろ過ステップを含む。要約すると、我々の解析手順のプロトコルは以下のステップを含んでいた。
介入前の群間差が介入後の群間差より小さい分類群の検出(ALDEx2アルゴリズム[57]を使用)。
ALDEx2により検出された細菌のみを用いた細菌変化の行列(abundance_after/abundance_before)の計算。
介入群を因子として細菌変化の行列をDBAし(sbp.fromADBA)、ilr座標を求める。
DBAで求めたilr座標を用いて、介入前後のバランス値を算出。
各バランスについて、以下の式でANCOVA分析を行う。
(介入後のバランス)~切片+(介入前のバランス)+群
グループ要因の p 値の推定と FDR 補正。
2.2.3. 腸内細菌群の代謝ポテンシャルの推定
微生物群の代謝能を推定するために、16S rRNA配列データベース(Greengenes v. 13.5 [48]、OTU類似度97%)に対してQIIME1.9 [58]に実装されているusearchアルゴリズムを用いて閉参照OTUピックを行い、その後PICRUSt1 (Pylogenetic Investigation of Communities by Reconstruction of Unobserved States) algorithmのバージョン1 [59] に従って実施した。酪酸産生活性は、Knomics-Biotaバイオインフォマティクスプラットフォーム[60]を用いて、酪酸産生経路の存在比を推定した。統計的精度を高めるためにBenjamini-Hochberg(FDR)補正をさらに加えたANCOVAを用いて、グループ間の酪酸経路存在量の変化の差異を分析した[55]。
さらに、酪酸産生能の変化を、その生産者の存在量の変化から推定した。このため、文献から酪酸産生菌のリストを作成し、これらの微生物が我々のデータで存在量が 0 でないことを確認した。これらの分類群を分子とし、それ以外の微生物は分母として天秤にかけた。バランスはANCOVA分析を用いてグループとの関連性を確認した。
結果
3.1. 参加者データ。食事の消費量と副作用
介入群(A群)の参加者は、提供された植物性食品で調理した食事を週に何回摂取したかを報告するよう求められた。平均値(平均±SD)は、第1週が5.97±2.70、第2週が5.39±1.70、第3週が5.10±1.81、第4週が4.53±1.23であった。この結果、4週間の平均値は5.20±0.56となった。冊子の26のレシピには、提供されたPBMA製品の1人分の最低量が100g含まれており、これらのPBMAの平均繊維含有量(上記の表1による)が3.65±0.56(平均±SD、100gあたりのグラム数)であることを考慮すると、試験中、Aグループのすべての参加者が1週間の食事に平均18.98gの繊維を追加したことになる。このことは、A群の参加者の50%以上が、3回の追跡調査のそれぞれでガスや腹部の膨満感の増加を報告し、これが最もよく報告された有害症状であったことを説明するかもしれない。高繊維食の摂取は、直腸へのボーラス推進力を減少させることに加えて、腸内細菌叢の組成の変化を促すことによって腸のガス通過を遅らせることが知られており、これはガスの滞留を促進することによってガス状症状を誘発する可能性がある [61]. しかし、腸内ガスの増加と1週間あたりの食事回数との間に統計的に有意な関連は見られず(Pearson chi-square p > 0.1)、最初のフォローアップ(7日目)ではその可能性は弱い示唆(Pearson chi-square p > 0.06)だけであった。また、ガスの増加と性別との間に統計的に有意な関連性は認められませんでした(フィッシャーの正確さ p > 0.1)。
その他の副作用として、「だるさが減り、便秘が改善した」(n = 1)、「便の粘度が改善した」(n = 1)、「便通が規則的になった」(n = 3)、「便の量が100%増えた」(n = 1)、「便通が規則的になり食後の疲れがなくなった」(n = 1)、「IBS症状の改善」(n = 1)、「摂取後数時間の胃部不快感」(n = 1)などが報告されたものもある。サンプル数が少ないこととコメントの異質性を考慮し、この質的データの主題分析を行う必要はないと判断した。
すべての参加者のコメントは、「食事摂取と有害事象」と題するスプレッドシートに記録され、これは補足資料のセクションで閲覧できる。この文書には、このセクションで前述した統計解析も含まれている。
3.2. 参加者のマイクロバイオータのベースライン分類学的組成
参加者の便のベースラインのマイクロバイオーム組成は、Bacteroides(23±13%)、Prevotella(10±17%)、Faecallibacterium(9±4%)に支配されていた(補図S1)。一般に、マイクロバイオーム組成は、以前に報告された都市住民の便のマイクロバイオーム内容と一致した[62]。ベースライン時の多様性(ShannonおよびChao1メトリック)は、介入群と対照群の間で差はなかった(Studentのt検定、p>0.8)。同様に、分類群バランス(DBAで定義、方法参照)にも群間差はなかった(線形モデルFDR > 0.2)。
1つのサンプル(099-756-826、Control群)を除くすべてのサンプルは、高いマッピングリード数(38,734 ± 4387)で表される良好な品質を示しました。カバレッジの低いサンプル(マッピングされたリードが7本)およびそのペアサンプルは解析から除外した。
3.3. 介入によるマイクロバイオーム組成の変化
3.3.1. ベータ多様性
介入前後のペアサンプル間のβダイバーシティとして測定した全体的なマイクロバイオーム組成の変化(Aitchison distance)は、研究グループと有意な関連はなかった(線形モデル、p=0.3、図2)。しかし、群内変化を推定したところ(Stata 17を用いたPERMANOVA解析[63])、介入群(ペア距離6.46±2.46)でのみ有意な結果が検出され、対照群(ペア距離5.78±1.20)には有意な結果は見られなかった。また、年齢、性別、BMI、体重など、参加者のすべてのメタデータと変化の大きさを、各群で別々に比較し、介入群の参加者が摂取した食事回数と比較した。この分析では、有意な結果は得られなかった(p > 0.1)。
食品 10 02040 g002 550図2. 主要な分類群。対数スケールで適切に表示するために、ゼロ値を擬似数(0.1%)に置き換えた。また、ベースライン時の各分類ランクで最も多い25種の相対現存量分布の箱ひげ図も補足資料に掲載されている。
3.3.2. グループ間差分現存量分析
クラス間差分存在量解析の結果、A群(介入)とB群(対照)のマイクロバイオーム変化の差に関連するバランス(DBA、方法参照)を得た。この生物統計解析の結果、CoprococcusとRoseburia、ParabacteroidesとTenericutes目ML615J-28の未分類の属の間に関係があることがわかった(ANCOVA、FDR > 0.05、図3)。最初のバランスは対照群よりも介入群でより減少する傾向があったが、2番目のバランスはまさに逆の関連を示している。
食品 10 02040 g003 550図3. 介入後のマイクロバイオーム組成の一般的な変化(Aitchison distance)。(a) 介入群(A群)(PERMANOVA p = 0.01, R2 = 0.88%); (b) 対照群(B群)、(p = 0.571, R2 = 0.27%); (c) 介入群と対照群を合わせた群。なお、赤い点は介入前、青い点は介入後の試料を示す。
3.3.3. グループ内差分現存量分析
分類群の差分現存量解析は、サンプル間または条件間の分類群構成の違いを検出することを目的としています[64,65,66]。ここでは、組成を考慮した手法に従い、微生物バランスに差分現存量分析を適用し、各研究グループにおけるマイクロバイオーム組成の変化を調査した[54,64,65,66]。微生物バランスとは、特定の方法で算出された2つの細菌分類群(分子と分母)の比率であり、マイクロバイオーム組成の特徴として用いられる。詳細については、Egozcueらによるプロトコルを参照されたい[67]。DBAで定義された分類群バランスの統計的に有意な変化は、いずれのグループでも見られなかった(FDR > 0.05)。DBAの定義については、「方法」の項を参照されたい。しかし、図4および図5に見られるように、介入群のみにおいて、Lachnospira/FaecalibacteriumおよびRuminococcaceae/Oscillospira分類群のバランスに注目すべき、わずかに有意な傾向(0.05 < FDR < 0.06)を確認したが、対照群ではそのような挙動が見られなかった。
食品 10 02040 g004 550図4. DBAを用いたグループ内差分存在量解析。植物性介入に関連する微生物バランス。(a) Lachnospira/Faecalibacterium のバランス。(b) Ruminococcaceae/Oscillospira のバランス。ドットは有意に近い関連性を示す(FDR < 0.06)。
食品 10 02040 g005 550図5 (a)グループ間差分存在比解析結果。対照群、介入群ともに介入前後で有意に変化したバランス値。図の解釈は以下の通り。参加者1人につき1点である。ポイントが灰色の線の下にある場合、その参加者はバランスが減少した。点が灰色の線の下にある場合、その参加者はバランスが低下しており、点が線の上にある場合、バランスは増加している。アスタリスクは有意な関連性を示す(FDR < 0.05)。(b) 有意に変化したバランスの分子と分母に含まれる分類群の相対的存在量(%)。これらの相対量を考慮すると、2番目のバランスにおける主な影響は未分類のTenericutesによってもたらされたことが示唆される。
残高の概念では、介入群では分母の分類群(それぞれFaecalibacteriumとOscillospira)に対して、残高の分子(LachnospiraとRuminococcaceae未分類の分類群)が増加した。興味深いことに、分子と分母の両方には酪酸産生菌 [68,69,70,71,72] と健康的な食事パターンに関連する分類群が含まれている。
介入群と対照群の研究開始1日目と28日目のサンプルにおける主要な微生物属の相対的存在量を表すインタラクティブなヒートマップは、http://bit.ly/ETH2021-0025a。
あるいは、selbal 法で解析を再現した。この方法では、1つの有意な関連性(未分類のTenericutes_ML615J-28)/Sutterella balance(クロスバリデーションAUC = 0.68±0.11)を明らかにした。このバランスでは、未分類のTenericutesのみが信頼できる再現性を示し(74%)、一方Sutterellaは再現性が低いため、バランスの信頼できない部分と考えられる(34%)。
2つの解析結果をまとめると、Tenericutes_ML615J-28の存在量の変化は、介入群と対照群で有意差があり、すなわち介入群では相対的に減少し、対照群では相対的に増加したと結論づけられる。
3.3.4. アルファ多様性の変化
全体として、シャノンインデックスは、介入群(A群)では5.65 ± 0.94 から 5.44 ± 0.85 (ウェルチの検定 p = 0.45 × 10-5, n = 40 samples)とわずかに減少し、対照群(B群)では5.65 ± 0.94 から 5.44 ± 0.85( ウェルチの検定 p = 0.57 × 10-5, n = 38 samples)と増加した。この変化は、2つのグループ間で有意に異なっていた(ANCOVA p = 0.004、図6)。この変化は、どちらのグループでも年齢、性別、BMI、体重と関連していなかった(p > 0.05)。興味深いことに、介入群における多様性の分数的減少は、提供された植物由来の代替食事(PBMA)食材を用いて調理した週当たりの食事回数の報告とは関連がなかった(p>0.1)。
食品 10 02040 g006 550図6. 介入前後のα-ダイバーシティの値。(a) シャノン指数ANCOVA(p = 0.004)。(b) Chao index ANCOVA (p = 0.243)。
Chao1指数による多様性には、グループ間で有意な差は見られなかった(ANCOVA p = 0.243)。
3.4. 3.4. 酪酸産生菌の変化の可能性
酪酸産生菌の潜在的変化量は、3つの方法で推定した。まず、ヒト腸内で酪酸産生に関与する主な分類群を分子とし、それ以外の分類群を分母としてバランスを算出した。以下の酪酸産生菌が評価対象となった。Faecalibacterium、Eubacterium、Roseburia、Ruminococcus、Anaerostipesである。
このバランスの変化には、グループ間で有意な差は見られなかった(p = 0.08)。しかし、介入で提供された植物性食品を摂取した参加者では、対照群の参加者と比較して、やや強い増加が観察された(図7)。
食品 10 02040 g007 550図7. 酪酸産生能のある分類群の変化。(a) 介入群と対照群における主な酪酸産生性分類群とその他すべての細菌とのバランスの変化。(b-d) 2群における介入前後の酪酸合成経路の変化。
次に、Lactobacillus属とBifidobacterium属について、酪酸産生菌との協力関係が報告されている[73,74,75]ことから調査した。その結果、両者の変化量に群間差は認められなかった(p=0.14)。
第三に、ヒトの腸内細菌に共通に存在する酪酸合成経路の3つの変異体の相対量を、補足資料のセクションにある生物統計学的手法で分析した。グルタル酸」経路の変化は、2つのグループ間で有意に異なっていた(FDR = 0.0382、図7b-d)。4-aminobutyrate/succinate」経路については、同じ方向で有意でない傾向が観察された(FDR = 0.0891)。
3.5. 教育・研究目的のためのデータ利用可能性
我々はマイクロバイオームと食品科学分野の教育者であり、教育目的で使用できる実データセットの必要性を痛感している。そのため、すべてのFASTQをオープンアクセスで公開し、教育利用を可能にすることをうれしく思います。dataview.ncbi.nlm.nih.gov/object/PRJNA738373?reviewer=5h6j0rs8dejqdch5ts6ur5n0t7 からダウンロードすることが可能です。プロジェクトIDはPRJNA738373です。議論
4.1. 所感の検討
健康な腸」を定義する際の最大の課題の1つは、集団規模の研究 [76,77] で確認されているように、ヒトのマイクロバイオーム内の分散の大部分(〜85%)がまだ説明されていないことである。しかしながら、食物繊維のような難消化性基質を発酵させて短鎖脂肪酸(SCFA)を生産することができる微生物の相対的な存在量は、引き続きこのような定義のための議論の余地のない基準の一つである [78,79,80,81,82] 。生産される主なSCFAである酢酸、プロピオン酸及び酪酸のうち、酪酸は結腸細胞の主要なエネルギー源を構成するという単純な理由から特に重要である [83]。酪酸はまた、腸の糖新生を活性化し、宿主のグルコースおよびエネルギーのホメオスタシスに有益な効果をもたらすことができる [84] 。さらに、この微生物由来の代謝物の枯渇は、2型糖尿病(T2D)[85]、肥満[86]および心血管疾患[87]など、いくつかの非感染性疾患と関連している。さらに、酪酸産生菌の減少は、動物モデルにおいて腸内病原菌の定着を促進することが示されており[88,89]、クローン病[90]や潰瘍性大腸炎(UC)などの炎症性腸疾患の患者におけるCRPなどの全身性炎症のマーカーと関連していることが知られている[91]。特定の酪酸産生菌の相対量に統計的に有意な増加は認められなかったが、介入群でのみ酪酸産生経路の有意な増加が認められ、特にグルタル酸酪酸代謝経路が有意に増加していることが確認された。さらに、アセチルCoA経路とX4-アミノ酪酸-コハク酸経路、および酪酸生産者の共同存在量にも同じ方向の傾向が検出された。これらの微生物のうち、Lachnospira/FaecalibacteriumとRuminococcaceae/Oscillospiraの分類群のバランスには、介入群のみで顕著な、わずかに有意な傾向が認められたが、対照群ではそのような挙動は認められなかった。RuminococcaceaeおよびLachnospiraceaeファミリーの属は、酪酸産生菌としてよく知られている[68,69,92,93,94]。また、VitalらによるIntegrated Microbial Genomeデータベースから3184の配列決定された細菌ゲノムのメタゲノムスクリーニング[95]は、RuminococcaceaeとLachnospiraceaeファミリーの属が、健康な大腸の個体に特徴的な酪酸生産分類学的コアを代表していることを示唆するものであった。さらに、Flavonifractor plautii などの Oscillospira 属の細菌は、繊維やポリフェノールを豊富に含む食事パターンをとっている人により多く存在することが分かっている [60,71,96,97].Faecalibacterium prausnitziiなどのフェカリス菌種も、地中海型および植物ベースの食事パターンの両方で繁栄することが実証されている[98,99,100]。提供されたPBMA製品には、ヘミセルロース、ペクチン、リグニン、セルロースを含むチコリ根、ニンジン、エンドウ、およびジャガイモ(詳細については補足資料のセクションを参照)の水溶性および不溶性繊維が含まれており、これらは人間の健康に対して様々な利益を有することが分かっている[101]。さらに、介入グループが摂取したPBMAの基本成分である全エンドウ、エンドウ豆粉、濃縮エンドウタンパクには、ルテイン、ゲニステイン、ダイゼイン、フェルラ酸などの植物栄養素も含まれており、これらはすべて腸内マイクロバイオームの調節物質として報告されており、SCFA代謝微生物の増殖を促進する[102,103,104,105]。酪酸は健康および疾病において重要な役割を果たす[95]。したがって、介入群における酪酸産生微生物の共同存在量および合成経路の存在の高まりを、肉を含む食事をPBMAを含む食事に代えた効果のポジティブな兆候として慎重に解釈した。より多くの参加者による研究によって、私たちの解釈を確認することができるはずである。さらに、観察された酪酸産生菌と経路の変化は、「健康な腸」の微生物のサインと一致すると解釈し、したがって、すべてのPBMAが必ずしも超加工され、ヒト腸内細菌にダメージを与えるわけではないという我々の仮説の確認と見なします。
なお、提供されたPBMA製品で動物性肉を置き換えることは奨励されたが、強制されたわけではない。私たちの目的は、消費者が1週間に何回でも、あるいは何回でもPBMAを含む食事を自由にとることができる現実の環境において、PBMAが腸内細菌叢に及ぼす潜在的影響を理解することであった。さらに、介入群の参加者に提供された小冊子のレシピでは、肉をPBMAの1つに置き換えることは、健康的でバランスのとれた食事の一部として実施されることが明示された。これは、参加者がPBMAを独占的に摂取するのではなく、既存の食事パターンの一部として調理に使用することを意図したものであることを明確にするためです。我々は、参加者が1週間に摂取したPBMAを含む食事の回数を考慮し、我々が観察したポジティブな変化を引き出すには、平均5回で十分であることを発見した。
私たちは、特にテネリキュート門の変化に興味を持ちました。まず何よりも、全体的なTenericutesのレベルが介入群で減少し、対照群で増加し、群間の相対的存在度の差の統計的有意性が強かったことです。この挙動は、Davidらによる画期的な研究でも観察され、研究者は、動物性または植物性製品のみからなる食事を短期間摂取すると、微生物群集構造が変化することを実証している。この研究では、主に動物性食品を摂取した参加者では、主に植物を摂取した参加者と比較して、Tenericutes門が増加した[106]。第二に、我々のサンプルで最も多く見られたTenericutes分類群、すなわちML615J-28目は、これまでヒトにおける食事の変化や表現型の変化とは関連がなく、この分類群について病気のヒトのコホートで得られるわずかな観察的証拠も、この変化を説明する助けとはならない。Bonderらによる研究 [107] では、4週間グルテンフリー食を続けた健康なボランティア21人の腸内細菌群の変調を評価した。著者らは、グルテンを排除した結果、Tenericutes ML615J-28の順位が低下したことを発見した。介入群に提供された植物由来の製品はグルテンフリーであったが、参加者は、研究期間中、食事からグルテンを減らすこと、あるいは実際に排除することは勧められなかったので、これは興味深いことである。グルテンの摂取に関するデータは収集されなかったが、介入群にそのような行動があったことを、非公式ながら我々は認識していない。介入群に提供されたPBMA製品は確かにグルテンフリーであったが、研究期間中、参加者はグルテンを含む食品を食事から排除するよう奨励されなかった。したがって、我々の所見とBonderらの所見が類似しているのは偶然であると考えられる。Patroneらによる別の研究 [108] では、多価不飽和脂肪を多く含む餌を与えたマウスでは、ココナツ由来の中鎖トリグリセリドを多く含む餌を与えたマウスと比較して、Tenericutesが増加する傾向があることが判明した。介入群に提供された植物由来の製品には、少量のココナッツオイルが含まれていた。しかし、テネリクスの食事による調節について、実質的な臨床例がないことから、これらの仮説は、確認するためにさらなる試験が必要と思われる。あるマウスモデル研究では、アミノ酸であるL-カルニチンに加えて、フェノール化合物を豊富に含むウーロン茶エキスとシトラスピールを与えたマウスグループでは、L-カルニチンだけを与えたマウスと比較して、テネリクスのレベルが有意に減少したことを発見した[109]。L-カルニチンは、食肉に最も多く含まれるアミノ酸の1つである。これは、腸内細菌によってトリメチルアミンN-オキシド(TMAO)に代謝され、心血管疾患[109]とある種のがん[110,111]と関連している化合物である。Chenと同僚は、両方のマウス群の炎症性マーカーのレベルを測定し、茶と柑橘類の抽出物を与えたマウスでTMAOレベルがコントロールと比較して大幅に減少したことを発見し、ウーロン茶抽出物と柑橘類の皮の食物フェノール化合物が腸内細菌叢によるTMAO形成能を低下させてカルニチン誘発血管炎症を抑制することを示唆しました[109]。
また、両群でα-とβ-ダイバーシティの両方に小さな変化が観察された。介入群ではα-ダイバーシティがわずかに減少し、対照群ではα-ダイバーシティがわずかに増加したが、これはPBMA食の摂取回数と統計的に有意な関連は認められなかった。研究の限界(下記参照)に従い、我々の統計分析は、PBMA食品と共に摂取された新鮮な果物、野菜、豆類、全粒粉などの繊維とフェノール化合物の増加による推定効果を考慮に入れていない。しかし、介入群に提供されたPBMAは、食物繊維およびポリフェノール源を特徴とする食事パターンの一部として消費されることを意図しているため、この点は議論の余地があるかもしれない。この研究の主な制限は、我々のサンプルサイズである。この要因だけでは、これらの変化の関連性を確立することは困難である。興味深いことに、248人の市民科学ボランティアから採取した便サンプルの16S rRNA配列決定を含む短期間の高繊維食介入後に、アルファ多様性のわずかではあるが有意な減少が観察された。この効果は、そのコホートで明らかに見られた多様性と長期的な野菜消費との相関とは逆のようであったが、アルファ多様性は短期の食事変化に対して敏感であるかもしれないが、そのような変化の永続性を評価するためにはより長い介入時間が必要であることを示唆する証拠がある [62]。著者らは、これらの予期せぬ変化を「摂取する栄養素のスペクトルが比較的急速に変化したことによるショック効果で、腸内コミュニティの生態系を一過性に乱す可能性がある」、あるいはこの一過性の期間に関連した微生物群の「ストレス」の一面として解釈した [62].食事介入に対する反応が安定的/永続的であると考えられるように十分な時間を確保することの重要性は、インパクトのあるいくつかの出版物で文書化されている。加えて、我々はオックスフォード大学のJohnsonとBurnetに同意し、より広い生態系からの教訓として、多様性は生態系を分析する際に考慮すべき無数の要因の一つに過ぎず、その安定性、構造、機能も同様に重要であることを示している [112]。したがって、アルファ多様性とベータ多様性の限界的な変化は、腸内マイクロバイオームの自己組織化の自然な状態の一部であり、複雑適応力学の主要な特性の一つである進行中の順応に関与する生きた複雑適応システムであると我々は考えている [113, 114]。腸内細菌は、毎日異なる植物性食品から異なる化合物を摂取するなど、継続的な微小摂動によって常に挑戦されているため、常に流動的な状態にあると言ってよいでしょう。17日間にわたる34人の健康な参加者の毎日のサンプリングに基づいた最近の研究で、ジョンソンら[115]は、マイクロバイオームの組成がわずか48時間で変化し、食事に対する毎日の微生物の反応が非常に個人化されることを実証しました。これに基づいて、参加者に7日ごとに1つのサンプルを提供してもらうなど、中間的なマイクロバイオーム検査のデータを含めることで、観察された変化の安定性に関するより良い洞察を得ることができ、研究の堅牢性が増した可能性がある。
4.2. 興味深いパラドックス
果物や野菜、ナッツや種子、全粒穀物や豆類が健康に良いことは議論の余地がないにもかかわらず [116,117,118,119,120] 、肉やその他の動物性食品が世界中の多くの食事パターンや文化の中心的要素であり続けているという現実がある [121] 。一例として、レディング大学の研究者が発表した英国全国食事栄養調査のデータを用いた最近の横断的分析では、英国の成人の43%(男性57%、女性31%)が赤肉と加工赤肉だけで[122]、つまり鶏肉や魚、卵や乳製品を追加で含めずに70g/日以上摂取していることが判明した。しかし、肉やその他の動物性食品の摂取量を減らすことは、より健康的で倫理的で持続可能な選択肢 [123] であり、「体に良い」だけでなく「地球にも良い」 [124] と考えられるようになってきている。こうした事実に対する認識の高まりは、食肉消費に対する政策の焦点と国民の態度の変化に寄与している。例えば、Public Health Englandの減塩目標レポートは、2017年以降PBMAを特集しており[125,126]、最近の欧州イノベーション技術研究所(EIT)の食品研究「The V-Place-Enabling consumer choice in Vegan or Vegetarian Food Products」-ホーエンハイムバイオエコノム研究センターの科学者によって行われ、毎年約7500万の欧州消費者がビーガンまたはベジタリアン食品を購入していると結論づけ、この傾向は上昇していることがわかった [127](The European Institute of Innovation & Technology)。さらに、COVID-19に関する公衆衛生メッセージは、疾患の疫病、食品システム、栄養の相互関連性を強調し[128]、健康な免疫力をサポートするための実用的なリスク管理アプローチとして、健康でバランスのとれた食事の役割を強調している[129,130,131]。さらに、COVID-19パンデミック中の公衆衛生メッセージは、疾患の疫病、食品システム、栄養の相互関連性を強調した[132,133]。したがって、植物性食品の消費を増やし、動物性食品の消費を減らす人が増えている。その結果、パンデミック中に世界中の集団から食習慣の変化として最も多く報告されたのがこの2つである[134,135,136,137,138,139,140]。
このシステム的な変化の結果のひとつは、人気のある社会的アイデンティティとライフスタイルの選択としてのフレキシタリアニズムの成長である。健康や環境に配慮するフレキシタリアンは、肉、魚、魚介類、鶏肉やその他の動物製品を時折消費することを許容する「準ベジタリアン」の食事パターンを受け入れている[141,142]。個人の健康とウェルビーイングを向上させるという議論の余地のない焦点に加え、フレキシタリアンによる肉食を減らす動機には、価格、食事の多様性を高めたいという願望、肉食を否定する可能性のある仲間との食事の際の社会的不安の軽減が含まれる[143,144]。その他、より利他的な動機としては、環境の将来や動物福祉に対する懸念がある [145,146]。さらに、肉の消費を減らすこれらすべての理由、少なくともその意図は、私たちの食品選択と摂取に強力な影響を与える社会的規範として組み込まれている。肉をあまり食べないことがより健康的で倫理的で持続可能な選択肢とみなされるようになってきており [147]、人々は自分のパブリックイメージを管理し「他人に一定の印象を与える」ために食行動を調整する [148]。興味深いことに、最近の研究では、フレキシタリアンは植物性代替肉(PBMA)を食事に取り入れる傾向があることが示唆されている [149,150]。また、ベジタリアンやビーガンに加えてフレキシタリアンは、加工されていない肉を模したもの、例えば植物由来のステーキよりも、ハンバーガー、ミートボール、ソーセージといった加工された肉製品を模した植物由来の肉代替品に魅力を感じていることが研究によって示されている[151]。このことは、人は味覚の結果として経験する喜びを含む様々な異なる理由で食品に惹かれるという事実によって説明されるかもしれない[152,153,154,155,156]。これらの肉を含む製品のリアルな外観と味の植物性代替物は、消費者の価値観により合致した同様の経験を提供する。さらに、PBMAの消費者は肉食の消費者と比較して、他の便利な植物由来の食事やスナックを食べる可能性が高い[20]。これらの要因のすべてが,世界中で植物由来の肉の代用品に対する需要を増大させることに寄与しており,この市場は,2020年に合計36億米ドルに成長し,2021年末までに42億米ドルに増加すると予測される速度で繁栄し続ける[157].
植物ベースの食事は、適切に計画され、多様な高品質の食材を含む限り、栄養的に十分であり、様々な健康上の利点をもたらすことができる[158,159,160]。残念ながら、植物ベースの食事は必ずしも健康的な食事ではなく、植物ベースの食事に関する研究の大半はすべての植物性食品を一緒にしているため、この声明を批判的に評価しようとすると難しい作業になる可能性があります。実際、ハーバード大学チャン公衆衛生学部栄養学科の研究者が、成人の心血管疾患と2型糖尿病リスクに対する健康な植物性食事と不健康な植物性食事の効果の分岐を示した最初の研究を発表したのはつい最近(2016-2017)であり[161,162]、植物性食事はその一部として摂取する食品の質に応じてのみ健康になることを強調したものであった。それにもかかわらず、植物性栄養の科学に対する最近の「深堀り」でさえ、PBMA製品が世界中の何百万人もの人々によって毎日消費されているという事実や、動物性食品の回避は、低繊維および微量栄養素レベルに加えて、高カロリー、精製でんぷんおよび不健康タイプの脂肪を含む大量の超加工食品の導入と対になっていると思われることを無視している [20, 27, 28]。MonteiroらによるNOVA食品分類[24]によれば、超加工食品(UPF)は、消費者の利便性のために、非常においしく魅力的で、長い保存期間を持つように作られている[24]。UPFはまた、精製炭水化物及び糖類が消化管の上部で消化されることにより、腸内細菌叢の組成及び代謝活性の両方に対して負の変化を促進するという事実により、結腸細菌に対する栄養基質の供給を変化させる能力についても記録されている[31,32,33,163,164]。最も重要なことは、植物由来の代替肉(PBMA)の中には、栄養価の高い成分の含有量を減らし、UPFの定義に合致するものもあるということである [29,30]。
我々は、植物由来の成分を単に工業的に加工しただけで得られるPBMA製品がデフォルトで超加工品になるという提案には同意しない。我々の仮説を検証するために、我々は、介入に使用される市販の植物性ミンチ、ハンバーガー、ソーセージ、ソーセージパテ、ミートボールが、対照群と比較して、介入群に割り付けられた参加者の腸内細菌叢にプラスの変化を誘発することができるだろうと仮定している。UPFがヒトの腸内細菌叢に悪影響を及ぼすことを示す文献が増えつつあること、および微生物の組成と機能的特徴が様々な健康マーカーと関連していることを考えると、参加者の腸内細菌叢の変化は、我々の主張、すなわち健康的なバランスのとれた食事の一部としてPBMA製品を消費すると、健康上のプラスの成果と一致する腸内細菌叢の変化を引き出すことができるという根拠として考慮されます。
研究のコンセプトの一部として、我々は、消費者、栄養士、食品科学者、食品メーカーに、PBMAの健康への影響について情報を提供し、栄養学、微生物学、内分泌学、精神衛生、公衆衛生など多くの分野の研究者が動物肉の影響と比較できるような質の良い証拠が明らかに不足していることを確認した。さらに、PBMA製品が消費者の腸内細菌叢に与える影響と動物性食肉の影響を比較することを目的とした無作為化比較試験(RCT)はほとんど存在しないことに気づきました。我々の知る限り、本研究は、その比較を確立する目的で実施された最初のRCTであり、したがって、特定された知識のギャップを埋めることに貢献するものである。
4.3. 研究の限界
我々は、研究の主な制限として、研究のサンプルサイズを考慮し、より大きなサンプルは、統計的有意性のために受け入れ信頼区間をわずかに超えていたいくつかの結果についてより明確に提供することができたかもしれない、と考えています。我々は、クロスオーバー試験デザインの利点を認識しているが、参加基準を満たし、介入期間中、研究に専念する参加者を見つけることは困難な作業である。健康科学の文献では、データの信頼性という点ではクロスオーバーデザインが優れているとされています。しかし、我々の研究室では過去数年間、いくつかの小規模試験のリクルートを行っており、クロスオーバーデザインの研究では、参加者のコンプライアンスレベルが低く、脱落率が高いことが観察されている [165] 。これは、統計学的な観点からすると、並行試験よりもはるかに問題となる。加えて、我々の試験の資金は非常に限られていた。これらの実用性に基づき、我々は出発点としてパラレルデザインを選択し、将来の反復試験では、例えば7〜10日ごとの中間サンプリングを組み込んだクロスオーバーデザインを使用することを視野に入れている。さらに、SCFAsの合成のための代謝の可能性の分析は、16S rRNAの生データのバイオインフォマティクス解析に依存している。今回もこれは出発点であり、ショットガン・メタゲノム解析データを追加して、我々の仮説を再確認したいと考えています。
設計段階で議論したもう一つの問題は、参加者に詳細な食物摂取記録を提供してもらうかどうかということである。このデータがあれば研究に役立つことは間違いないが、我々のチームが重視したのは、参加者ができるだけ「現実の世界」に近い体験ができるようにすることであった。私たち自身の様々な食品報告アンケートの使用経験から、参加者は食品摂取量を忘れたり、誤ったり、誤答したりする傾向があり、時には、コンプライアンスを欠くことを恥ずかしいと思うなどの理由で、意図的にすることもあります。その上で、30日間の詳細な食事記録を求めることの潜在的な効果について考え、報告された潜在的な副作用に加えて、1週間に摂取した肉なしの食事の数に基づいて、調査結果を評価することにしたのである。我々は、将来の反復研究において食物報告ツールの使用を否定するものではないが、それでも我々が上記で述べた周知の注意事項を強く意識している。
研究のタイミングは、多くの人がより健康的な食事とライフスタイルの変化を試みる月である1月に実施され、この年の最初の月を通してVeganuary [167]として知られる人気キャンペーンが行われたことを考えると、もう一つの潜在的な制限をもたらしたかもしれない。私たちは、参加者に、私たちの参加基準に従って、「典型的なイギリス人」[168,169]、すなわち、毎日ではないにしても、週のほとんどの日に肉、魚、卵、乳製品を含む、普段買い物する食品の種類を消費し続けるように助言した。しかし、我々は対照群からの食事情報を取得していなかったので、一部の対照群はこの期間に肉を減らし、果物、野菜、その他の植物由来の食品をより多く取り入れることによって、食事とライフスタイルを改善することにした可能性がある。我々は、対照群にバイアスがかかる可能性があることをもう一つ確認した。すべての参加者に送られた参加者情報シートは、研究終了後に検査結果を受け取ることになることを意識させるものであった。そのため、対照群の参加者は、マイクロバイオーム検査の前後結果を受け取ることを知りながら、自分自身を測定するために研究者と共有しない食生活の変化に取り組む機会だと考えた可能性があります。また、1月は、人々が他の種類の「健康キック」に参加する傾向がある月であり、例えば、飲酒量を減らしたり、運動を増やしたりすることで、腸内細菌叢に影響を与えることが知られていることも承知している[170,171]。5.結論
我々の研究チームは、植物由来の原料を工業的に加工しただけでは、PBMA製品がデフォルトで超加工製品になるわけではないという仮説を検証することを目的とし、PBMA製品が消費者の腸内細菌叢における優生的または異生的変化を促進する可能性は、その個々の原料の栄養プロファイルにあることを主張した。我々は、動物性食品を含む週5食以上の食事を植物性ミンチ、ミートボール、ソーセージ、ソーセージパテ、ハンバーガーに置き換えた参加者の便サンプルの16S rRNA配列決定を行い、サイズを合わせた対照群のサンプルと結果を比較した。その結果、介入群では酪酸産生経路(主に4-aminobutyrate/succinate経路とglutarate経路)の存在がわずかながら統計的に有意に変化し、酪酸産生分類群の総量が一貫して増加していることが明らかになった。また、介入群ではTenericutes門が減少し、対になったサンプル間でβ多様性が増加したが、対照群ではTenericutes門が増加した。サンプル数が少ない、並行試験デザイン、16S rRNAデータのみへの依存という制限はあるものの、介入群の参加者に提供されたPBMA製品は、eubiosis、すなわち「健康な腸内細菌叢」と一致する腸内細菌叢の変化を誘発することを確認することができた。つまり、柔軟主義の食事パターンに見られる動物肉をPBMA製品で時折置き換えることは、消費者の腸内細菌叢にポジティブな変化を促進するかもしれないということである。これを出発点として、クロスオーバー試験デザインとショットガン・メタボロミクスデータを追加して、仮説の検証を続けていく予定です。
補足資料
以下は、オンライン(https://www.mdpi.com/article/10.3390/foods10092040/s1)で公開されています。補足資料として、1. ビフォーアフターヒートマップ。2. 成分表の更新。3. 食事摂取データ、副作用。4. 身体測定データ(詳細)。4a. 身体測定データ(要約)。5. レシピ本 6. 学習フロー図 7. エンドウタンパク質の植物栄養素の分析データ。8-12. 製品情報シート 13. 13. 付加的なデータの視覚化
著者の貢献
構想、M.A.T.-M.、方法論、M.A.T.-M.、A.B.、ソフトウェア、N.K.、M.A.T-M、形式分析、 M.A.T.-M., N.K., A.B.;investigation, M.A.T.-M., N.K., A.B.;data, data, M.A.T.-M., A.B. M.A.T.-M.、N.K.、A.B.、資料、M.A.T.-M.、A.B.、データキュレーション、執筆-原案作成、M.A.T. -M. 執筆-原案作成, M.A.T.-M.; 執筆-レビューおよび編集, M.A.T.-M., A.B., N.K.; 視覚化, M.A.T.-M., N.K.; 監督, M.A.T.-M.; プロジェクト管理, A.B.; 資金調達, M.A.T.-M., A.B. 全著者が本原稿を読んで合意している.
資金提供
本研究および APC は,ロンドン・サウスバンク大学応用科学部(英国,ロンドン)より資金提供を受けた.これらは、助成金番号ETH2021-0025でカバーされている。The Meatless Farm (Leeds, UK) はマイクロバイオーム検査キットの費用を提供した。
施設審査委員会の声明
本研究は、ヘルシンキ宣言のガイドラインに従って実施され、2020年11月にロンドン・サウスバンク大学の応用科学部倫理委員会(SASEC)により承認されました。この研究の倫理承認参照番号は ETH2021-0025 です。
インフォームド・コンセントに関する声明
本研究に参加したすべての被験者からインフォームドコンセントを取得した。この論文で共有されるデータは、いずれも参加者の特定につながるものではありません。
データの利用可能性に関する声明
データセット、すべての統計解析のレポート、マイクロバイオーム生データ/生リードは、http://bit.ly/ETH2021-0025a で公開されており、ダウンロードすることができる。(メインレポート)およびhttp://bit.ly/ETH2021-0025b (機能解析レポート)。このオンラインレポートには、ヒートマップ、PCoAに基づく分類学的構成、階層的クラスタリング、分類群共起グラフ、代謝ポテンシャルグラフなど、インタラクティブな可視化が豊富に含まれており、これらのデータセットをより詳しく調査したい方は、これらを利用することも可能である。
謝辞
ミートレスファームの栄養コンサルタントであるアンジェラ・ウォーカーには、ロジスティックス、介入グループの参加者への食材の配送、および著者への製品データの提供をサポートしていただき、大変感謝している。Knomics-Biotaプラットフォームの開発者であるKnonics社のStanislav Koshechkin氏、Alexander Tyakht氏、Alexander Karasev氏には、本調査をサポートしていただき、感謝の意を表したいと思います。そして、最も重要なことは、すべての研究参加者の協力と高いコンプライアンスに感謝することである。
利益相反について
Miguel Toribio-Mateas (M.T-M) は、マイクロバイオーム科学と腸脳軸の講師であり、ロンドン南岸大学応用科学部の客員研究員です。M.T-Mは、アトラスバイオメッド社のコンサルタントとして、本試験が実施された期間の一部において、研究開発の役割を担っていました。彼の役割は、The Meatless Farmと商業的なつながりはない。Adri Bester (A.B.) は、ロンドン南バンク大学応用科学部のエンタープライズリードであり、ロンドン・アグリフード・イノベーション・クリニック(LAFIC)のリードアカデミックである。彼女は、The Meatless Farmとの商業的なつながりはなく、研究倫理と学術助成金の承認を促進した。Natalia Klimenko (N.K.) は、モスクワのロシア科学アカデミー、遺伝子生物学研究所、精密ゲノム編集および生物医学のための遺伝子技術センターのバイオインフォマティシャンである。N.K.は、Knomics-Biotaプラットフォームの開発者であるKnomics社にバイオインフォマティクス・コンサルタントとして依頼されている。N.K.は、Knomics社(Knomics-Biotaプラットフォームの開発者)のバイオインフォマティクス・コンサルタントとして活動しており、The Meatless Farmとは商業的なつながりはない。我々は、The Meatless Farmが研究のデザイン、データの収集、分析、解釈、原稿の執筆、結果の公表の決定においていかなる役割も担っていないことを確認する。
参考文献
You, W.; Henneberg, M. 現代の食生活で余剰エネルギーを供給する肉の消費は、肥満の蔓延に寄与している。生態学的分析。BMC Nutr. 2016, 2, 22. [Google Scholar] [CrossRef] [グリーン版]。
Montonen, J.; Boeing, H.; Fritsche, A.; Schleicher, E.; Joost, H.-G.; Schulze, M.B.; Steffen, A.; Pischon, T. 赤肉と全粒粉パンの消費と肥満、炎症、グルコース代謝、酸化ストレスのバイオマーカーの関連性。Eur. J. Nutr. 2013, 52, 337-345. [Google Scholar] [CrossRef][グリーンバージョン].
インターアクト・コンソーシアム 食事性肉の消費量と2型糖尿病の発症との関連性。EPIC-InterAct研究. Diabetologia 2013, 56, 47-59. [Google Scholar] [CrossRef][Greenバージョン].
Feskens, E.J.M.; Sluik, D.; van Woudenbergh, G.J. Meat Consumption, Diabetes, and Its Complications.肉類摂取、糖尿病、その合併症. Curr. Diabetes Rep. 2013, 13, 298-306. [Google Scholar] [CrossRef]を参照してください。
Micha, R.; Wallace, S.K.; Mozaffarian, D. Red and Processed Meat Consumption and Risk of Incident Coronary Heart Disease, Stroke, and Diabetes Mellitus.(赤肉と加工肉の消費量と冠動脈疾患、脳卒中、糖尿病の発症リスク)。循環2010、121、2271-2283。[Google Scholar] [CrossRef][グリーンバージョン].
Bechthold, A.; Boeing, H.; Schwedhelm, C.; Hoffmann, G.; Knüppel, S.; Iqbal, K.; De Henauw, S.; Michels, N.; Devleesschauwer, B.; Schlesinger, S.; et al. 食品グループと冠動脈心疾患、卒中および心臓不全の危険度: 前向き研究のシステマティックレビューと用量反応メタアナリシス。Crit. Rev. Food Sci. Nutr. 2019, 59, 1071-1090. [Google Scholar] [CrossRef][グリーンバージョン]。
パーキン、D.M.;ボイド、L.;ウォーカー、L.C.16. 2010年の英国における生活習慣および環境要因に起因するがんの割合. Br. J. Cancer 2011, 105 (Suppl. 2), S77-S81. [Google Scholar] [CrossRef] [Green Version].
Bouvard, V.; Loomis, D.; Guyton, K.Z.; Grosse, Y.; Ghissassi, F.E.; Benbrahim-Tallaa, L.; Guha, N.; Mattock, H.; Straif, K. 赤肉と加工肉の摂取の発がん性。Lancet Oncol. 2015, 16, 1599-1600. [Google Scholar] [CrossRef][グリーンバージョン]。
Boeing, H.; Bechthold, A.; Bub, A.; Ellinger, S.; Haller, D.; Kroke, A.; Leschik-Bonnet, E.; Müller, M.J.; Oberritter, H.; Schulze, M.; et al. Critical review.ベジタリアンの発がん性。慢性疾患の予防における野菜と果物。Eur. J. Nutr.2012、51、637-663。[Google Scholar] [CrossRef] [PubMed] [Green Version].
Wang, X.; Ouyang, Y.; Liu, J.; Zhu, M.; Zhao, G.; Bao, W.; Hu, F.B. 果物と野菜の消費とすべての原因、心血管疾患、がんによる死亡率。前向きコホート研究の系統的レビューと用量反応メタ解析。BMJ 2014, 349, g4490. [Google Scholar] [CrossRef] [PubMed] [グリーン版].
Sakkas, H.; Bozidis, P.; Touzios, C.; Kolios, D.; Athanasiou, G.; Athanasopoulou, E.; Gerou, I.; Gartzonika, C. Nutritional Status and the Influence of the Vegan Diet on the Gut Microbiota and Human Health(栄養状態と菜食主義の影響が腸内細菌叢と人間の健康に対して及ぼす影響).Medicina 2020, 56, 88. [Google Scholar] [CrossRef] [Green Version].
Medawar, E.; Huhn, S.; Villringer, A.; Veronica Witte, A. The effects of plant-based diets on the body and the brain, A.植物性食の身体と脳への影響。A systematic review. Transl. Psychiatry 2019, 9, 226. [Google Scholar] [CrossRef]を参照してください。
Barber, T.M.; Kabisch, S.; Pfeiffer, A.F.H.; Weickert, M.O. The Health Benefits of Dietary Fibre.(食物繊維の健康効果). ニュートリエンツ2020, 12, 3209. [Google Scholar] [CrossRef] [PubMed].
Tomova, A.; Bukovsky, I.; Rembert, E.; Yonas, W.; Alwarith, J.; Barnard, N.D.; Kahleova, H. The Effects of Vegetarian and Vegan Diets on Gut Microbiota.ベジタリアンおよびビーガン食の腸内細菌叢への影響. Front. Nutr. 2019, 6, 47. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Wilson, A.S.; Koller, K.R.; Ramaboli, M.C.; Nesengani, L.T.; Ocvirk, S.; Chen, C.; Flanagan, C.A.; Sapp, F.R.; Merritt, Z.T.; Bhatti, F.; et al. Diet and the Human Gut Microbiome.食事とヒトの消化器病菌(英語): An International Review. Dig. Dis. Sci. 2020, 65, 723-740. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Boukid, F.; Rosell, C.M.; Rosene, S.; Bover-Cid, S.; Castellari, M. 動物性食品を改質するための最先端成分としての非動物性タンパク質: 現状と将来の展望。Crit. Rev. food Sci. Nutr. 2021, 1-31. [Google Scholar] [CrossRef].
Chen, C.; Chaudhary, A.; Mathys, A. Dietary Change Scenarios and Implications for Environmental, Nutrition, Human Health and Economic Dimensions of Food Sustainability(食生活の変化に関するシナリオと環境、栄養、人間の健康、食品の持続可能性に関する経済的側面). ニュートリエンツ 2019, 11, 856. [Google Scholar] [CrossRef] [PubMed] [グリーン版].
Curtain, F.; Grafenauer, S. Flexitarian Ageにおける植物由来の肉代替品。スーパーマーケットの棚にある製品の監査。ニュートリエンツ 2019, 11, 2603. [Google Scholar] [CrossRef] [グリーンバージョン].
Michel, F.; Hartmann, C.; Siegrist, M. Consumers' associations, perceptions and acceptance of meat and plant-based meat alternatives.(消費者の肉および植物性肉代替物に対する連想、認識および受容). Food Qual. Prefer. 2021, 87, 104063. [Google Scholar] [CrossRef]を参照。
Gallagher, C.T.; Hanley, P.; Lane, K.E. ヴィーガン食のパターン分析により、ヴィーガン食の中の健康的なパターンと不健康なパターンが明らかになりました。Public Health Nutr.2021、1-33。[Google Scholar] [CrossRef]を参照してください。
Saswattecha, K.; Kroeze, C.; Jawjit, W.; Hein, L. Assessing the environmental impact of palm oil produced in Thailand.(タイで生産されたパーム油の環境への影響を評価する). J. Clean. Prod. 2015, 100, 150-169. [Google Scholar] [CrossRef]を参照。
Wahyono, Y.; Hadiyanto, H.; Budihardjo, M.A.; Adiansyah, J.S. Assessing the Environmental Performance of Palm Oil Biodiesel Production in Indonesia: ライフサイクルアセスメントによるアプローチ. Energies 2020, 13, 3248. [Google Scholar] [CrossRef].
Boccia, F.; Punzo, G. A choice experiment on consumer perceptions of three generations of genetically modified foods(3世代の遺伝子組み換え食品に対する消費者の認識に関する選択実験). Appetite 2021, 161, 105158. [Google Scholar] [CrossRef] [PubMed].
Monteiro, C.A.; Cannon, G.; Moubarac, J.C.; Levy, R.B.; Louzada, M.L.C.; Jaime, P.C. The UN Decade of Nutrition, the NOVA food classification and the trouble with ultra-processing.国連栄養の10年、NOVA食品分類、超加工のトラブル。Public Health Nutr. 2018, 21, 5-17. [Google Scholar] [CrossRef] [グリーンバージョン]。
Clune, S.; Crossin, E.; Verghese, K. Systematic review of greenhouse gas emissions for different fresh food categories.(生鮮食品カテゴリー別の温室効果ガス排出量の系統的レビュー). J. Clean. Prod. 2017, 140, 766-783. [Google Scholar] [CrossRef][グリーンバージョン]。
Soret, S.; Mejia, A.; Batech, M.; Jaceldo-Siegl, K.; Harwatt, H.; Sabaté, J. Climate change mitigation and health effects of varied dietary patterns in real-life settings throughout North America.北米の実生活における気候変動の緩和と多様な食事パターンの健康効果。Am. J. Clin. Nutr. 2014, 100, 490S-495S. [Google Scholar] [CrossRef][グリーンバージョン]。
Alcorta, A.; Porta, A.; Tárrega, A.; Alvarez, M.D.; Vaquero, M.P. Foods for Plant-Based Diets: チャレンジとイノベーション. Foods 2021, 10, 293. [Google Scholar] [CrossRef]を参照してください。
Gehring, J.; Touvier, M.; Baudry, J.; Julia, C.; Buscail, C.; Srour, B.; Hercberg, S.; Péneau, S.; Kesse-Guyot, E.; Allès, B. ペスコ・ベジタリアン、ベジタリアン、ビーガンによる超加工食品の消費量について。食事開始の期間および年齢との関連性。J. Nutr. 2021, 151, 120-131. [Google Scholar] [CrossRef]を参照してください。
Bohrer, B.M. An investigation of the formulation and nutritional composition of modern meat analogue products(現代の肉類アナログ製品の処方と栄養組成の調査)。Food Sci. Hum. Wellness 2019, 8, 320-329. [Google Scholar] [CrossRef]を参照してください。
Thavamani, A.; Sferra, T.J.; Sankararaman, S. Meet the Meat Alternatives: 代替タンパク質源の価値。Curr. Nutr. Rep. 2020, 9, 346-355. [Google Scholar] [CrossRef]を参照してください。
Dahl, W.J.; Rivero Mendoza, D.; Lambert, J.M. Diet, nutrients and the microbiome.(ダイエット、栄養素、マイクロバイオーム). Prog. Mol. Biol. Transl. Sci. 2020, 171, 237-263. [Google Scholar] [CrossRef]を参照してください。
Martínez Leo, E.E.; Segura Campos, M.R. Effect of ultra-processed diet on gut microbiota and thus its role in neurodegenerative diseases.超加工食の腸内細菌叢への影響と神経変性疾患におけるその役割。Nutrition 2020, 71, 110609. [Google Scholar] [CrossRef]を参照してください。
Zinöcker, M.K.; Lindseth, I.A. The Western Diet-Microbiome-Host Interaction and Its Role in Metabolic Disease.欧米型食生活とマイクロバイオームの相互作用とその代謝疾患における役割. ニュートリエンツ 2018, 10, 365. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン].
Kamm, M.A. Processed food affects the gut microbiota: 革命が始まった。J. Gastroenterol. Hepatol. 2020, 35, 6-7. [Google Scholar] [CrossRef] [PubMed] を参照。
ブロック化ランダム化リストを作成する。Available online: https://www.sealedenvelope.com/simple-randomiser/v1/lists (accessed on 20 November 2020).
Farm, M. Meatless Farm-Make It Meatless! Available online: https://meatlessfarm.com/ (accessed on 20 November 2020).
Corp, I. IBM SPSS Statistics for Windows, Version 25.0; IBM Corp: Armonk, NY, USA, 2017. [Google Scholar】を参照。]
Biomed, A. Atlas Biomed Microbiome Test. Available online: https://atlasbiomed.com/uk/microbiome (accessed on 22 March 2021).
Panek, M.; Čipčić Paljetak, H.; Barešić, A.; Perić, M.; Matijašić, M.; Lojkić, I.; Vranešić Bender, D.; Krznarić, Ž.; Verbanac, D. Methodology challenges in studying human gut microbiota - Effects of collection, storage, DNA extraction and next generation sequencing technologies.(パネックの手法の課題). Sci. Rep. 2018, 8, 5143. [Google Scholar] [CrossRef] [グリーンバージョン]。
Park, C.; Yun, K.E.; Chu, J.M.; Lee, J.Y.; Hong, C.P.; Nam, Y.D.; Jeong, J.; Han, K.; Ahn, Y.J. 宿便保存液とストック液の室温保存での性能比較. J. Microbiol. 2020, 58, 703-710. [Google Scholar] [CrossRef]を参照。
Biomed, A. アトラスについて。Available online: https://atlasbiomed.com/uk/about (accessed on 22 March 2021).
ISO. ISO 13485:2016(en), 医療機器-品質マネジメントシステム. 規制目的のための要求事項; 国際標準化機構: ジュネーブ, スイス, 2016. [Google Scholar】を参照してください。]
Chen, C.C.; Wu, W.K.; Chang, C.M.; Panyod, S.; Lu, T.P.; Liou, J.M.; Fang, Y.J.; Chuang, E.Y.; Wu, M.S. DNA stabilizer and storage conditions on preserving fecal microbiota profiles.の比較(Chern, C.C., Wu,K.; Chang, C.M., S., W.S.). J. Formos. Med. Assoc. 2020, 119, 1791-1798. [Google Scholar] [CrossRef]を参照してください。
Caporaso, J.G.; Lauber, C.L.; Walters, W.A.; Berg-Lyons, D.; Huntley, J.; Fierer, N.; Owens, S.M.; Betley, J.; Fraser, L.; Bauer, M.; 他 Illumina HiSeq および MiSeq プラットフォームでの超高スループットの微生物コミュニティ分析。ISME J. 2012, 6, 1621-1624. [Google Scholar] [CrossRef] [グリーンバージョン]。
Ravi, R.K.; Walton, K.; Khosroheidari, M. MiSeq: A Next Generation Sequencing Platform for Genomic Analysis(MiSeq:ゲノム解析のための次世代シーケンスプラットフォーム)。メソッズ Mol. Biol. 2018, 1706, 223-232に掲載されています。[Google Scholar] [CrossRef][PubMed]を参照してください。
Amir, A.; McDonald, D.; Navas-Molina, J.A.; Kopylova, E.; Morton, J.T.; Zech Xu, Z.; Kightley, E.P.; Thompson, L.R.; Hyde, E.R.; Gonzalez, A.; 他 Deblur Rapidly Resolves Single-Nucleotide Community Sequence Patterns. mSystems 2017, 2, e00191-16. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Bolyen, E.; Rideout, J.R.; Dillon, M.R.; Bokulich, N.A.; Abnet, C.C.; Al-Ghalith, G.A.; Alexander, H.; Alm, E.J.; Arumugam, M.; Asnicar, F.; et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2.Nat.に基づく再現性の高い対話型、スケーラブルで拡張可能なマイクロバイオームデータサイエンス。Biotechnol. 2019, 37, 852-857. [Google Scholar] [CrossRef]を参照してください。
DeSantis, T.Z.; Hugenholtz, P.; Larsen, N.; Rojas, M.; Brodie, E.L.; Keller, K.; Huber, T.; Dalevi, D.; Hu, P.; Andersen, G.L. Greengenes, a Chimera-Checked 16S rRNA Gene Database and Workbench Compatible with ARB.(ARBに対応したキメラ検査された16S rRNA遺伝子データベースとワークベンチ)。このデータベースは、"Science "と呼ばれています。Microbiol. 2006, 72, 5069-5072. [Google Scholar] [CrossRef] [Green Version].
Wagner, B.D.; Grunwald, G.K.; Zerbe, G.O.; Mikulich-Gilbertson, S.K.; Robertson, C.E.; Zemanick, E.T.; Harris, J.K. On the Use of Diversity Measures in Longitudinal Sequencing Studies of Microbial Communities.(微生物群集の縦断的配列解析研究における多様性指標の使用について). Front. Microbiol. 2018, 9, 1037. [Google Scholar] [CrossRef] [グリーンバージョン]。
Willis, A.D. Rarefaction, Alpha Diversity, and Statistics(レアファクション、アルファ多様性、統計学). Front. Microbiol. 2019, 10, 2407. [Google Scholar] [CrossRef][Greenバージョン]。
Maziarz, M.; Pfeiffer, R.M.; Wan, Y.; Gail, M.H. Using standard microbiome reference groups to simplify beta-diversity analyses and facilitate independent validation.標準マイクロバイオーム参照グループを使用したベータダイバーシティ分析の簡略化と独立した検証の促進. バイオインフォマティクス 2018, 34, 3249-3257. [Google Scholar] [CrossRef] [グリーンバージョン]。
Modin, O.; Liébana, R.; Saheb-Alam, S.; Wilén, B.-M.; Suarez, C.; Hermansson, M.; Persson, F. Hill-based dissimilarity indices and null models for analysis of microbial community assembly.(微生物群集集合の解析のためのヒルベースの非類似度指標とヌルモデル)。Microbiome 2020, 8, 132. [Google Scholar] [CrossRef] [PubMed].
Palarea-Albaladejo, J.; Martín-Fernández, J.A. zCompositions-R package for multivariate imputation of left-censored data under a compositional approach.「左打ち切りデータの多変量解析のためのコンポジションRパッケージ」。Chemom. Intell. Lab. Syst. 2015, 143, 85-96. [Google Scholar] [CrossRef]を参照してください。
Quinn, T.P.; Erb, I. Interpretable Log Contrasts for the Classification of Health Biomarkers(健康バイオマーカー分類のための解釈可能なログコントラスト)。mSystems 2020, 5, e00230-19. [Google Scholar] [CrossRef] [Green Version].
ヘインズ、W. Benjamini-Hochberg Method. Encyclopedia of Systems Biology; Dubitzky, W., Wolkenhauer, O., Cho, K.-H., Yokota, H., Eds.; Springer: New York, NY, USA, 2013; p. 78. [Google Scholar].
高橋 圭、西田 敦、藤本 崇、藤井 正、塩谷 真、今枝 裕、稲富 修、バンバ S、杉本 真、安藤 明. クローン病の糞便微生物群集における酪酸産生菌種の存在量減少. Digestion 2016, 93, 59-65. [Google Scholar] [CrossRef] [PubMed].
Gloor, G. ALDEx2: 組成データのためのANOVA-Like Differential Expressionツール. ALDEX Man. Modul. 2015, 20, 1-11. [Google Scholar】を参照してください。]
Caporaso, J.G.; Kuczynski, J.; Stombaugh, J.; Bittinger, K.; Bushman, F.D.; Costello, E.K. QIIME allows analysis of high-throughput community sequencing data.(QIIMEはハイスループットのコミュニティシーケンスデータの解析を可能にする。Nat. Methods 2010, 7, 335-336. [Google Scholar] [CrossRef] [PubMed] [Green Version].
Langille, M.G.I.; Zaneveld, J.; Caporaso, J.G.; McDonald, D.; Knights, D.; Reyes, J.A.; Clemente, J.C.; Burkepile, D.E.; Vega Thurber, R.L.; Knight, R.; 他 16S rRNAマーカー遺伝子配列を用いた微生物コミュニティの予測機能プロファイリング. Nat. Biotechnol. 2013, 31, 814-821. [Google Scholar] [CrossRef]を参照。
Efimova, D.; Tyakht, A.; Popenko, A.; Vasilyev, A.; Altukhov, I.; Dovidchenko, N.; Odintsova, V.; Klimenko, N.; Loshkarev, R.; Pashkova, M.; et al. Knomics-Biota-A system for exploratory analysis of human gut microbiota data.(Knots-Biota-ヒト腸内細菌群データの探索解析のためのシステム).(原題:Knots-Biota). BioData Min. 2018, 11, 25. [Google Scholar] [CrossRef] [グリーンバージョン]。
Gonlachanvit, S.; Coleski, R.; Owyang, C.; Hasler, W. Inhibitory actions of a high fibre diet on intestinal gas transit in healthy volunteers.(健康なボランティアにおける高繊維食の腸内ガス通過抑制作用). Gut 2004, 53, 1577-1582. [Google Scholar] [CrossRef] [Green Version].
Klimenko, N.S.; Tyakht, A.V.; Popenko, A.S.; Vasiliev, A.S.; Altukhov, I.A.; Ischenko, D.S.; Shashkova, T.I.; Efimova, D.A.; Nikogosov, D.A.; Osipenko, D.A.; 他 市民科学プロジェクト枠での非制御短期食事介入に対するマイクロバイオーム応答(Microbiome Responses to an Uncontrolled Short-Term Diet Intervention in the Frame of the Citizen Science Project. ニュートリエンツ 2018, 10, 576. [Google Scholar] [CrossRef] [グリーンバージョン].
StataCorp. Stata|New in Stata. Available online: https://www.stata.com/new-in-stata/ (accessed on 10 May 2021).
林宏樹;Peddada, S.D. 微生物の組成の分析。このような場合、「曖昧さ」を解消するために、"曖昧さ "と "曖昧さ "の両方を解消する必要があります。NPJ Biofilms Microbiomes 2020, 6, 60. [Google Scholar] [CrossRef] [PubMed].
Weiss, S.; Xu, Z.Z.; Peddada, S.; Amir, A.; Bittinger, K.; Gonzalez, A.; Lozupone, C.; Zaneveld, J.R.; Vázquez-Baeza, Y.; Birmingham, A.; et al. 正規化と微生物の差異存在量の戦略はデータの特徴によって異なる。マイクロバイオーム 2017, 5, 27. [Google Scholar] [CrossRef] [グリーンバージョン]。
Kurtz, Z.D.; Müller, C.L.; Miraldi, E.R.; Littman, D.R.; Blaser, M.J.; Bonneau, R.A. Sparse and Compositionally Robust Inference of Microbial Ecological Networks.(微生物生態ネットワークのスパースおよびコンポジションロバスト推論)。PLoS Comput. Biol. 2015, 11, e1004226. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Egozcue, J.J.; Pawlowsky-Glahn, V. Groups of Parts and Their Balances in Compositional Data Analysis(組成データ解析における部品のグループとそのバランス). 数学. Geol. 2005, 37, 795-828. [Google Scholar] [CrossRef] [Green Version].
腸内細菌研究のメタアナリシスにより、疾患特異的および共有された反応が特定された。Nat. Commun. 2017, 8, 1784. [Google Scholar] [CrossRef][グリーンバージョン]。
Rackerby, B.; Kim, H.J.; Dallas, D.C.; Park, S.H. Understanding the effects of dietary components on the gut microbiome and human health(食事成分の腸内細菌と人間の健康への影響を理解する)。Food Sci. Biotechnol. 2020, 29, 1463-1474. [Google Scholar] [CrossRef][PubMed]を参照してください。
Nagpal, R.; Shively, C.A.; Register, T.C.; Craft, S.; Yadav, H. Gut microbiome-Mediterranean diet interactions in improving host health.(宿主の健康改善における腸内細菌と地中海食の相互作用)。F1000Research 2019, 8, 699. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Wang, D.D.; Nguyen, L.H.; Li, Y.; Yan, Y.; Ma, W.; Rinott, E.; Ivey, K.L.; Shai, I.; Willett, W.C.; Hu, F.B.; et al. The gut microbiome modulates the protective association between a Mediterranean diet and cardiometabolic disease risk.地中海食は心肥大性疾患リスクとの関連性を調節する。Nat. Med. 2021, 27, 333-343. [Google Scholar] [CrossRef]を参照してください。
Louis, P.; Flint, H.J. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine.(ヒト大腸由来酪酸産生菌の多様性、代謝および微生物生態)。FEMS Microbiol. Lett. 2009, 294, 1-8. [Google Scholar] [CrossRef] [PubMed] [Green Version].
Patman, G. Lactobacillus acidophilus opens the door to butyrate.(ラクトバチルス・アシドフィルスが酪酸への扉を開く)。Nat. Rev. Gastroenterol. Hepatol. 2015, 12, 552. [Google Scholar] [CrossRef][PubMed]を参照してください。
Rivière, A.; Selak, M.; Lantin, D.; Leroy, F.; De Vuyst, L. Bifidobacteria and Butyrate-Producing Colon Bacteria.ビフィズス菌と酪酸産生大腸菌の重要性とその刺激戦略: ヒト腸管におけるビフィズス菌と酪酸産生菌の重要性とその活性化戦略. Front. Microbiol. 2016, 7, 979. [Google Scholar] [CrossRef] [グリーン版]。
Markowiak-Kopeć, P.; Śliżewska, K. The Effect of Probiotics on the Production of Short-Chain Fatty Acids by Human Intestinal Microbiome.(プロバイオティクスのヒト腸内微生物による短鎖脂肪酸の産生に対する効果). Nutrients 2020, 12, 1107. [Google Scholar] [CrossRef].
Rothschild, D.; Leviatan, S.; Hanemann, A.; Cohen, Y.; Weissbrod, O.; Segal, E. An atlas of robust microbiome associations with phenotypic traits based on large-scale cohorts from two continents.bioRxiv2020.(2020年) [Google Scholar] [CrossRef].
Falony, G.; Joossens, M.; Vieira-Silva, S.; Wang, J.; Darzi, Y.; Faust, K.; Kurilshikov, A.; Bonder, M.J.; Valles-Colomer, M.; Vandeputte, D.; et al. Population-level analysis of gut microbiome variation.腸内細菌の集団レベルでの変異の解析. サイエンス 2016, 352, 560-564. [Google Scholar] [CrossRef]を参照。
Coppola, S.; Avagliano, C.; Calignano, A.; Berni Canani, R. The Protective Role of Butyrate against Obesity and Obesity-Related Diseases(酪酸塩の肥満および肥満関連疾患に対する保護的役割). Molecules 2021, 26, 682. [Google Scholar] [CrossRef].
McNabney, S.M.; Henagan, T.M. Short Chain Fatty Acids in the Colon and Peripheral Tissues(大腸と周辺組織における短鎖脂肪酸): 酪酸、大腸がん、肥満、インスリン抵抗性に焦点をあてて。ニュートリエンツ 2017, 9, 1348. [Google Scholar] [CrossRef] [グリーンバージョン].
Sivaprakasam, S.; Bhutia, Y.D.; Yang, S.; Ganapathy, V. Short-Chain Fatty Acid Transporters.短鎖脂肪酸トランスポーター: 大腸のホメオスタシスにおける役割. Compr. Physiol. 2017, 8, 299-314. [Google Scholar] [CrossRef][PubMed]を参照してください。
Wong, J.M.; de Souza, R.; Kendall, C.W.; Emam, A.; Jenkins, D.J. Colonic health.(ウォン、J.M.、デ・スーザ、R.、ケンドール、C.W.、エマム、A.): 発酵と短鎖脂肪酸。J. Clin. Gastroenterol. 2006, 40, 235-243. [Google Scholar] [CrossRef]。
Ashaolu, T.J.; Ashaolu, J.O.; Adeyeye, S.A.O. ヒト腸内細菌叢によるプレバイオティクスのin vitro発酵と短鎖脂肪酸の産生。批評的レビュー J. Appl. Microbiol. 2021, 130, 677-687. [Google Scholar] [CrossRef]を参照してください。
Velázquez, O.C.; Lederer, H.M.; Rombeau, J.L. Butyrate and the colonocyte.(酪酸と大腸細胞). Dig. Dis. Sci. 1996, 41, 727-739. [Google Scholar] [CrossRef][PubMed]を参照してください。
Zhang, L.; Liu, C.; Jiang, Q.; Yin, Y. Butyrate in Energy Metabolism(エネルギー代謝における酪酸の役割): 酪酸のエネルギー代謝における役割:まだ学ぶべきことがある。このような場合、「酪酸のエネルギー代謝」と「酪酸のエネルギー代謝」に分けて考える必要があります。Metab. 2021, 32, 159-169. [Google Scholar] [CrossRef][PubMed]を参照してください。
Qin, J.; Li, Y.; Cai, Z.; Li, S.; Zhu, J.; Zhang, F.; Liang, S.; Zhang, W.; Guan, Y.; Shen, D.; et al. A metagenome-wide association study of gut microbiota in type 2 diabetes.邦訳:2型糖尿病における腸内細菌叢のメタゲノム関連研究. Nature 2012, 490, 55-60. [Google Scholar] [CrossRef]を参照してください。
Le Chatelier, E.; Nielsen, T.; Qin, J.; Prifti, E.; Hildebrand, F.; Falony, G.; Almeida, M.; Arumugam, M.; Batto, J.M.; Kennedy, S.; et al. Human gut microbiome richness correlates with metabolic markers(ヒト腸内細菌の豊かさは、代謝マーカーと関連している). ネイチャー2013, 500, 541-546. [Google Scholar] [CrossRef]を参照してください。
Karlsson, F.H.; Fåk, F.; Nookaew, I.; Tremaroli, V.; Fagerberg, B.; Petranovic, D.; Bäckhed, F.; Nielsen, J. Symptomatic atherosclerosis is associated with an altered gut Metagenome. Nat. Commun. 2012, 3, 1245. [Google Scholar] [CrossRef] [Green Version].
Vital, M.; Karch, A.; Pieper, D.H. Colonic Butyrate-Producing Communities in Humans(ヒトの大腸酪酸産生コミュニティ。オミックスデータを用いた概要. mSystems 2017, 2, e00130-17. [Google Scholar] [CrossRef] [グリーンバージョン].
Rivera-Chávez, F.; Zhang, L.F.; Faber, F.; Lopez, C.A.; Byndloss, M.X.; Olsan, E.E.; Xu, G.; Velazquez, E.M.; Lebrilla, C.B.; Winter, S.E.; et al. Depletion of Butyrate-Producing Clostridia from the Gut Microbiota Drives an Aerobic Luminal Expansion of Salmonella.(消化器官内の酪酸産生菌の減少によるサルモネラの好気性ルミナル拡大。Cell Host Microbe 2016, 19, 443-454. [Google Scholar] [CrossRef] [PubMed] [Green Version].
Pavel, F.M.; Vesa, C.M.; Gheorghe, G.; Diaconu, C.C.; Stoicescu, M.; Munteanu, M.A.; Babes, E.E.; Tit, D.M.; Toma, M.M.; Bungau, S. Inflammatory Bowel DiseaseにおけるGut Microbiota Manipulationの関連性を明らかにする. ダイアグノスティックス 2021, 11, 1090. [Google Scholar] [CrossRef] [PubMed].
Prosberg, M.; Bendtsen, F.; Vind, I.; Petersen, A.M.; Gluud, L.L. The association between the gut microbiota and the inflammatory bowel disease activity.腸内細菌叢と炎症性腸疾患の活動性の関連性。システマティックレビューとメタアナリシス。Scand. J. Gastroenterol. 2016, 51, 1407-1415. [Google Scholar] [CrossRef][PubMed]を参照してください。
Oliphant, K.; Allen-Vercoe, E. Human gut microbiomeによる多量栄養素の代謝。主な発酵副産物と宿主の健康への影響。マイクロバイオーム2019, 7, 91. [Google Scholar] [CrossRef][PubMed]を参照してください。
Louis, P.; Flint, H.J. Formation of propionate and butyrate by the human colonic microbiota(ヒト大腸マイクロバイオータによるプロピオン酸および酪酸の形成). Environ. Microbiol. 2017, 19, 29-41. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Louis, P.; Young, P.; Holtrop, G.; Flint, H.J. Diversity of human colonic butyrate-producing bacteria revealed by analysis of the butyryl-CoA:acetate CoA-transferase gene.ヒト大腸酪酸産生細菌の多様性. Environ. Microbiol. 2010, 12, 304-314. [Google Scholar] [CrossRef] [PubMed].
Vital, M.; Howe, A.C.; Tiedje, J.M. Revealing the bacterial butyrate synthesis pathways by analyzing (meta) genomic data.(メタ)ゲノムデータ解析によるバクテリアの酪酸合成経路の解明。MBio 2014, 5, e00889. [Google Scholar] [CrossRef] [グリーンバージョン].
Haro, C.; Montes-Borrego, M.; Rangel-Zúñiga, O.A.; Alcalá-Díaz, J.F.; Gómez-Delgado, F.; Pérez-Martínez, P.; Delgado-Lista, J.; Quintana-Navarro, G. M.; Tinahones, F.J.; Landa, B.B.; et al. Two Healthy Diets Modulate Gut Microbial Community Improving Insulin Sensitivity in a Human Obese Population(2つの健康的な食事がヒト肥満集団のインスリン感受性を改善する腸内細菌群集を調節する)。J. Clin. Endocrinol. Metab. 2016, 101, 233-242. [Google Scholar] [CrossRef][グリーンバージョン]。
Rosés, C.; Cuevas-Sierra, A.; Quintana, S.; Riezu-Boj, J.I.; Martínez, J.A.; Milagro, F.I.; Barceló, A. Gut Microbiota Bacterial Species Associated with Mediterranean Diet-Related Food Groups in a Northern Spanish Population(スペイン北部集団における地中海食関連食品群に関する腸内細菌種). ニュートリエンツ2021, 13, 636. [Google Scholar] [CrossRef].
Meslier, V.; Laiola, M.; Roager, H.M.; De Filippis, F.; Roume, H.; Quinquis, B.; Giacco, R.; Mennella, I.; Ferracane, R.; Pons, N.; et al. 過体重および肥満被験者における地中海食介入により血漿コレステロールが下がり、エネルギー摂取とは別に腸内マイクロバイオームおよびメタボロームに変化が生じること。Gut 2020、69、1258-1268。[Google Scholar] [CrossRef] [Green Version].
Kahleova, H.; Rembert, E.; Alwarith, J.; Yonas, W.N.; Tura, A.; Holubkov, R.; Agnello, M.; Chutkan, R.; Barnard, N.D. Effects of a Low-Fat Vegan Diet on Gut Microbiota in Overweight Individuals and Relationships with Body Weight, Body Composition and Insulin Sensitivity.体重が増えすぎた人の消化器系の微生物相に対する、低脂肪の菜食の影響、体重、体組成、インスリン感受性との関連性。無作為化臨床試験。ニュートリエンツ2020、12、2917。[Google Scholar] [CrossRef]を参照してください。
De Filippis, F.; Pasolli, E.; Ercolini, D. Newly Explored Faecalibacterium Diversity Is Connected to Age, Lifestyle, Geography, and Disease(新たに探索された糞便性細菌の多様性は、年齢、ライフスタイル、地理、および疾患と関連している)。Curr. Biol. 2020, 30, 4932-4943.e4. [Google Scholar] [CrossRef]を参照してください。
Shevlyakov, A.; Nikogosov, D.; Stewart, L.-A.; Toribio-Mateas, M. UK Biobankデータに基づく英国健康住民の6種類の水溶性および不溶性食物繊維の摂取に関する基準値。公衆衛生栄養学2021、1-41。[Google Scholar] [CrossRef]を参照してください。
Molan, A.L.; Liu, Z.; Plimmer, G. ブラックカラント製品の腸内細菌叢およびヒトの大腸がんリスクマーカーに対する影響の評価。Phytother. Res. 2014, 28, 416-422. [Google Scholar] [CrossRef]を参照してください。
Dingeo, G.; Brito, A.; Samouda, H.; Iddir, M.; La Frano, M.R.; Bohn, T. Phytochemicals as modifiers of gut microbial communities.(腸内細菌群集の修飾因子としてのファイトケミカル). Food Funct. 2020, 11, 8444-8471. [Google Scholar] [CrossRef]を参照。
Song, Y.; Wu, M.-S.; Tao, G.; Lu, M.-W.; Lin, J.; Huang, J.-Q. また、このような環境下でも、「食の安全・安心」を実現するために、「食の安全・安心」を実現するために、「食の安全・安心」を実現するために、「食の安全・安心」を実現するための様々な取り組みを行っています。Food Res. Int. 2020, 137, 109410. [Google Scholar] [CrossRef] [PubMed].
Corona, G.; Kreimes, A.; Barone, M.; Turroni, S.; Brigidi, P.; Keleszade, E.; Costabile, A. 若い健康な女性および閉経前の女性の腸内マイクロバイオーム組成およびエンテロリジナン生成に対するオイルシードミックスのリグナンの影響: 試験管内パイロットスタディ。Microb. セルファクトリー2020、19、82。[Google Scholar] [CrossRef] [PubMed] [Green Version].
David, L.A.; Maurice, C.F.; Carmody, R.N.; Gootenberg, D.B.; Button, J.E.; Wolfe, B.E. Diet rapidly and reproducibly alters the human gut microbiome.(ダイエットは、ヒトの腸内細菌を迅速かつ再現性高く変化させる。ネイチャー 2014, 505, 559-563. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Bonder, M.J.; Tigchelaar, E.F.; Cai, X.; Trynka, G.; Cenit, M.C.; Hrdlickova, B.; Zhong, H.; Vatanen, T.; Gevers, D.; Wijmenga, C.; et al. 短期グルテンフリー食が及ぼすヒト腸内細菌の影響(原題:The influence of a short-term gluten-free diet on the human gut microbiome. Genome Med. 2016, 8, 45. [Google Scholar] [CrossRef]を参照。
Patrone, V.; Minuti, A.; Lizier, M.; Miragoli, F.; Lucchini, F.; Trevisi, E.; Rossi, F.; Callegari, M.L. Differential effects of coconut versus soy oil on gut microbiota composition and predicted metabolic function in adult mice.成体マウスにおける腸内細菌群の組成と予測代謝機能に対するココナッツ油と大豆油の差異効果。BMC Genomics 2018, 19, 808. [Google Scholar] [CrossRef]を参照してください。
Chen, P.Y.; Li, S.; Koh, Y.C.; Wu, J.C.; Yang, M.J.; Ho, C.T.; Pan, M.H. Oolong Tea Extract and Citrus Peel Polymethoxyflavones Reduce Transformation of l-Carnitine to Trimethylamine-N-Oxide and Decrease Vascular Inflammation in l-Carnitine Feeding Mice.(ウーロン茶エキスとシトラスピールポリメトキシフラボンは、カルニチン供給マウスにおけるl-カルニチンのトリスメチルアミンN酸化体への変換を抑制して血管炎症を抑制する。J. Agric. Food Chem. 2019, 67, 7869-7879. [Google Scholar] [CrossRef]を参照してください。
Wu, W.-K.; Panyod, S.; Liu, P.-Y.; Chen, C.-C.; Kao, H.-L.; Chuang, H.-L.; Chen, Y.-H.; Zou, H.-B.; Kuo, H.-C.;et al. カルニチン挑戦からのTMAO生産性の特徴付けにより個人化栄養とマイクロバイオームのシグナルの発見が促進されます。Microbiome 2020, 8, 162. [Google Scholar] [CrossRef].
Liu, Z.Y.; Tan, X.Y.; Li, Q.J.; Liao, G.C.; Fang, A.P.; Zhang, D.M.; Chen, P.Y.; Wang, X.Y.; Luo, Y.; Long, J.A.; et al. Trimethylamine N-oxide, a gut microbiota dependent metabolite of choline, is positively associated with the risk of primary liver cancer.ある種の腸内細菌のコリン依存性は、肝臓がんのリスクに正の相関があると考えられる。症例対照研究。Nutr. Metab. 2018, 15, 81. [Google Scholar] [CrossRef] [グリーンバージョン]。
Johnson, K.V.A.; Burnet, P.W.J. Microbiome: 多様性から多様化すべきなのか?腸内細菌 2016, 7, 455-458. [Google Scholar] [CrossRef][PubMed]を参照。
Ackoff, R.L.; Gharajedaghi, J. Reflections on systems and their models. このような場合、「システムとは何か?このような場合、「システムとは何か?[Google Scholar] [CrossRef]。
Sturmberg, J.P. Health and Disease Are Dynamic Complex-Adaptive States Implications for Practice and Research(健康と病気は動的な複合適応状態である。Front. Psychiatry 2021, 12, 354. [Google Scholar] [CrossRef]を参照してください。
Johnson, A.J.; Vangay, P.; Al-Ghalith, G.A.; Hillmann, B.M.; Ward, T.L.; Shields-Cutler, R.R.; Kim, A.D.; Shmagel, A.K.; Syed, A.N.; Walter, J.; et al. Daily Sampling Reveals Personalized Diet-Microbiome Associations in Humans.(毎日サンプリングを実施することでヒトの食事とマイクロバイオームの関連性が明らかになる)。Cell Host Microbe 2019, 25, 789-802.e5. [Google Scholar] [CrossRef]を参照してください。
Ventriglio, A.; Sancassiani, F.; Contu, M.P.; Latorre, M.; Di Slavatore, M.; Fornaro, M.; Bhugra, D. Mediterranean Diet and its Benefits on Health and Mental Health.地中海食と健康およびメンタルヘルスに関する効果。文献レビュー。Clin. Pract. Epidemiol. Ment. Health 2020, 16, 156-164. [Google Scholar] [CrossRef] [PubMed].
Sofi, F.; Abbate, R.; Gensini, G.F.; Casini, A. Accruing evidence on benefits to the adherence to the Mediterranean diet on health(地中海食の健康への順守の利点に関する証拠の蓄積)。最新のシステマティックレビューとメタアナリシス。Am. J. Clin. 2010年、92、1189-1196。[Google Scholar] [CrossRef] [PubMed] [Green Version].
Sánchez-Sánchez, M.L.; García-Vigara, A.; Hidalgo-Mora, J.J.; García-Pérez, M.; Tarín, J.; Cano, A. Mediterranean diet and health(地中海食と健康。地中海食と健康:疫学研究と介入試験の系統的レビュー。Maturitas 2020、136、25から37まで。[Google Scholar] [CrossRef]を参照してください。
Mancini, J.G.; Filion, K.B.; Atallah, R.; Eisenberg, M.J. Systematic Review of the Mediterranean Diet for Long-Term Weight Loss.地中海式ダイエットの長期的な体重減少に関する系統的レビュー。Am. J. Med. 2016, 129, 407-415.e4. [Google Scholar] [CrossRef][グリーンバージョン]。
Guasch-Ferré, M.; Salas-Salvadó, J.; Ros, E.; Estruch, R.; Corella, D.; Fitó, M.; Martínez-González, M.A. PREDIMED試験、地中海食と健康上の成果。どのように強力な証拠ですか?Nutr. Metab。Cardiovasc。Dis. 2017, 27, 624-632. [Google Scholar] [CrossRef][グリーンバージョン].
Beardsworth, A.; Bryman, A. Meat consumption and meat avoidance among young people(若者の肉消費と肉回避). Br. Food J. 2004, 106, 313-327. [Google Scholar] [CrossRef][Greenバージョン].
Hobbs-Grimmer, D.A.; Givens, D.I.; Lovegrove, J.A. Associations between red meat, processed red meat and total red and processed red meat consumption, nutritional adequacy and markers of health and cardio-metabolic diseases in British adults.イギリスの成人における赤身肉、赤身肉加工品と総消費量、栄養の適正と健康のマーカー、心臓代謝疾患との関連性。UK National Diet and Nutrition Surveyのデータを用いた横断的分析。Eur. J. Nutr. 2021, 60, 2979-2997. [Google Scholar] [CrossRef]を参照してください。
Stoll-Kleemann, S.; Schmidt, U.J. 気候変動と生物多様性の損失に対抗するための先進国および移行国における肉の消費量の削減。影響要因のレビュー. Reg. Reg. Environ. Chang. 2017, 17, 1261-1277. [Google Scholar] [CrossRef][グリーンバージョン]。
Boukid, F. Plant-based meat analogues: ニッチからメインストリームへ。Eur. Food Res. Technol. 2021, 247, 297-308. [Google Scholar] [CrossRef].
イングランド公衆衛生局. ソルト・ターゲット 2017.第2回進捗報告書;Public Health England: ロンドン、イギリス、2017年。
Public Health England. 2024年の塩分削減目標; Public Health England: London, UK, 2020.
Gebhardt, B. Plant-Based for the Future. 欧州の消費者と専門家の意見に関する洞察;EIT食品、ホーエンハイム大学、農業市場学科。Stuttgart, Germany, 2021. [Google Scholar] [CrossRef].
Gillespie, S. Epidemics and Food Systems(疫病と食糧システム)。What gets framed, gets done. Food Secur. 2020, 12, 895-898. [Google Scholar] [CrossRef][PubMed]。
Gasmi, A.; Noor, S.; Tippairote, T.; Dadar, M.; Menzel, A.; Bjørklund, G. Individual risk management strategy and potential therapeutic options for the COVID-19 pandemic(COVID-19パンデミックの個別リスク管理戦略と潜在的治療オプション). Clin. Immunol. 2020, 215, 108409. [Google Scholar] [CrossRef]を参照してください。
Bousquet, J.; Anto, J.M.; Iaccarino, G.; Czarlewski, W.; Haahtela, T.; Anto, A.; Akdis, C.A.; Blain, H.; Canonica, G.W.; Cardona, V.; et al. 国間および国内のCOVID-19死亡率の違いは食事に一部起因するか? Clin. Transl. Allergy 2020, 10, 16. [Google Scholar] [CrossRef][PubMed]を参照してください。
Maggini, S.; Pierre, A.; Calder, P.C. Immune Function and Micronutrient Requirements Change over the Life Course(免疫機能と微量栄養素の必要量はライフコースで変化する。ニュートリエンツ 2018, 10, 1531. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Sanderson Bellamy, A.; Furness, E.; Nicol, P.; Pitt, H.; Taherzadeh, A. Shaping more resilient and just food systems: COVID-19 パンデミックからの教訓。Ambio 2021, 50, 782-793. [Google Scholar] [CrossRef] [PubMed].
Keenan, J.M. COVID, resilience, and the built environment. Environ. Syst. Decis. 2020, 40, 216-221. [Google Scholar] [CrossRef]。
Tavakol, Z.; Ghannadi, S.; Tabesh, M.R.; Halabchi, F.; Noormohammadpour, P.; Akbarpour, S.; Alizadeh, Z.; Nezhad, M.H.; Reyhan, S.K. Physical activity, healthy lifestyle and COVID-19 disease severity between a crosssectional study. J. Public Health 2021. [Google Scholar] [CrossRef]を参照してください。
Wang, J.; Yeoh, E.K.; Yung, T.K.C.; Wong, M.C.S.; Dong, D.; Chen, X.; Chan, M.K.Y.; Wong, E.L.Y.; Wu, Y.; Guo, Z.; et al. 香港における COVID-19 パンデミック前と流行中の食習慣および身体活動の変更。無作為電話調査による横断的研究。J. Int. Soc. Sports Nutr. 2021, 18, 33. [Google Scholar] [CrossRef][PubMed]を参照してください。
Di Renzo, L.; Gualtieri, P.; Pivari, F.; Soldati, L.; Attinà, A.; Cinelli, G.; Leggeri, C.; Caparello, G.; Barrea, L.; Scerbo, F.; et al. COVID-19 ロックダウン中の食習慣とライフスタイルの変化。イタリアの調査。J. Transl. Med. 2020, 18, 229. [Google Scholar] [CrossRef]を参照してください。
Abouzid, M.; El-Sherif, D.M.; Eltewacy, N.K.; Dahman, N.B.H.; Okasha, S.A.; Ghozy, S.; Islam, S.M.S.; Elburki, A.R.F.; Ali, A.A.M.; Hasan, M.A.; et al. Middle East and North Africa Region におけるライフスタイル行動への COVID-19 の影響について: 5896人を対象とした調査。J. Transl. Med. 2021, 19, 129. [Google Scholar] [CrossRef][PubMed]を参照。
Kolokotroni, O.; Mosquera, M.C.; Quattrocchi, A.; Heraclides, A.; Demetriou, C.; Philippou, E. CyprusにおけるCOVID-19パンデミックロックダウン中の大人の生活習慣。横断的研究からのエビデンス。BMC公衆衛生2021、21、786。[Google Scholar] [CrossRef]を参照してください。
Abdulah, D.M.; Hassan, A.B. Relation of Dietary Factors with Infection and Mortality Rates of COVID-19 across the World.日本におけるCOVID-19の感染率および死亡率と食事要因の関係. J. Nutr. Health Aging 2020, 24, 1011-1018. [Google Scholar] [CrossRef] [PubMed].
Ogueji, I.A.; Okoloba, M.M.; Demoko Ceccaldi, B.M. COVID-19パンデミック時の英国における個人の対処戦略. Curr. Psychol. 2021. [Google Scholar] [CrossRef] [PubMed].
Verain, M.; Dagevos, H.; Antonides, G. Flexitarianism: 持続可能な食スタイルの範囲. In Handbook of Research on Sustainable Consumption; Reisch, L., Thogersen, J., Eds.; Edward Elgar Publishing: Cheltenham, UK, 2015; pp.209-223.より。[Google Scholar】を参照。]
Derbyshire, E.J. Flexitarian Diets and Health: エビデンスに基づく文献のレビュー. Front. Nutr. 2016, 3, 55. [Google Scholar] [CrossRef][グリーンバージョン]。
Kemper, J.A.; White, S.K. Young adults' experiences with flexitarianism: 4つのC. Appetite 2021, 160, 105073. [Google Scholar] [CrossRef].
Plante, C.N.; Rosenfeld, D.L.; Plante, M.; Reysen, S. The role of social identity motivation in dietary attitudes and behaviors among vegetarians.ベジタリアンの食事態度・行動における社会的アイデンティティの動機付けの役割. Appetite 2019, 141, 104307. [Google Scholar] [CrossRef]を参照してください。
Dakin, B.C.; Ching, A.E.; Teperman, E.; Klebl, C.; Moshel, M.; Bastian, B. ベジタリアンまたはフレキシタリアン食の処方は、肉摂取量の持続的減少につながる。Appetite 2021, 164, 105285. [Google Scholar] [CrossRef] [PubMed].
ミンテル 肉なし食品-英国-2017年5月-市場調査報告書;Mintel: ロンドン, イギリス, 2017. [Google Scholar】を参照。]
Bianchi, F.; Dorsel, C.; Garnett, E.; Aveyard, P.; Jebb, S.A. Interventions targeting conscious determinants of human behaviour to reduce the demand for meat.肉に対する需要を減らすために、人間の行動の意識的な決定要因をターゲットにした介入策。質的な比較分析によるシステマティック・レビュー。を含む系統的レビュー。J. Behav. Nutr. Phys. Act. 2018, 15, 102. [Google Scholar] [CrossRef] [グリーンバージョン]。
Higgs, S. Social norms and their influence on eating behaviours. Appetite 2015, 86, 38-44. [Google Scholar] [CrossRef][PubMed]を参照。
Chen, C.; Chaudhary, A.; Mathys, A. Nutritional and environmental losses embedded in global food waste.(世界の食品廃棄物に埋め込まれた栄養と環境の損失). Resour. Conserv. Recycl.2020, 160, 104912. [Google Scholar] [CrossRef].
Dagevos, H. Finding flexitarians: フレキシタリアンの発見:肉食系と減肉系に関する最近の研究. Trends Food Sci. Technol. 2021, 114, 530-539. [Google Scholar] [CrossRef].
Michel, F.; Sanchez-Siles, L.M.; Siegrist, M. Predicting how consumers perceive the naturalness of snacks.消費者がスナックの自然さをどのように感じるか。簡単な指標の有用性. Food Qual. Prefer. 2021, 94, 104295. [Google Scholar] [CrossRef]を参照。
Phan, U.T.; Chambers, E.T. Motivations for choosing various food groups based on individual foods(個々の食品に基づく様々な食品群の選択動機). Appetite 2016, 105, 204-211。[Google Scholar] [CrossRef]を参照してください。
Hess, J.M.; Jonnalagadda, S.S.; Slavin, J.L. What Is a Snack, Why Do We Snack, and How Can We Choose Better Snacks? 間食の定義、間食の動機、食事摂取量への貢献、改善のための推奨事項のレビュー。アドバンス・ニュートリション 2016, 7, 466-475. [Google Scholar] [CrossRef][Green版]を参照。
Yates, L.; Warde, A. The evolving content of meals in Great Britain.(イギリスにおける食事の進化した内容。1950年代と比較した2012年の調査結果。Appetite 2015, 84, 299-308. [Google Scholar] [CrossRef]を参照。
Chandler, P.D.; Balasubramanian, R.; Paynter, N.; Giulianini, F.; Fung, T.; Tinker, L.F.; Snetselaar, L.; Liu, S.; Eaton, C.; Tobias, D.K.; et al. Metabolic signatures associated with Western and Prudent dietary patterns in women.女性における欧米型食事パターンに関するメタボリックシグニチャ。Am. J. Clin. Nutr.2020、112、268-283。[Google Scholar] [CrossRef]を参照してください。
Clatici, V.G.; Voicu, C.; Voaides, C.; Roseanu, A.; Icriverzi, M.; Jurcoane, S. Diseases of Civilization-Cancer, Diabetes, Obesity and Acne-the Implication of Milk, IGF-1 and mTORC1.(文明病-がん、糖尿病、肥満、ニキビ、牛乳の意味合い). マエディカ2018, 13, 273-281. [Google Scholar] [CrossRef].
世界の植物由来肉市場-ソース別、製品別、地域別、国別の分析(2020年版): 市場インサイト、COVID-19の影響、競争、予測(2020-2025);Azoth Analytics: アイルランド、ダブリン、2021年
Song, M.; Fung, T.T.; Hu, F.B.; Willett, W.C.; Longo, V.D.; Chan, A.T.; Giovannucci, E.L. Association of Animal and Plant Protein Intake With All-Cause and Cause-Specific Mortality.(動物性タンパク質と植物性タンパク質の摂取と全死亡率および特定原因による死亡率の関連性). JAMA Intern. Med. 2016, 176, 1453-1463. [Google Scholar] [CrossRef][PubMed]を参照してください。
Mariotti, F. Animal and Plant Protein Sources and Cardiometabolic Health(動物性および植物性タンパク質源と心代謝の健康). アドバンス・ニュートラ. 2019, 10, S351-S366. [Google Scholar] [CrossRef][PubMed]を参照してください。
Hemler, E.C.; Hu, F.B. Plant-Based Diets for Cardiovascular Disease Prevention(心臓血管疾患予防のための植物性食事): すべての植物性食品は等しく作成されていません。Curr. Atheroscler. Rep. 2019, 21, 18. [Google Scholar] [CrossRef][PubMed]を参照してください。
Satija, A.; Bhupathiraju, S.N.; Rimm, E.B.; Spiegelman, D.; Chiuve, S.E.; Borgi, L.; Willett, W.C.; Manson, J.E.; Sun, Q.; Hu, F.B. Plant-Based Dietary Patterns and Incidence of Type 2 Diabetes in US Men and Women.米国男女の食生活パターン。3つのプロスペクティブ・コホート研究からの結果。PLoS Med. 2016, 13, e1002039. [Google Scholar] [CrossRef][グリーンバージョン].
Satija, A.; Bhupathiraju, S.N.; Spiegelman, D.; Chiuve, S.E.; Manson, J.E.; Willett, W.; Rexrode, K.M.; Rimm, E.B.; Hu, F.B. Healthful and Unhealthful Plant-Based Diets and the Risk of Coronary Heart Disease in U.S. Adults.(アメリカ成人における健康な植物ベースの食事と冠動脈心臓病の危険性). J. Am. Coll. Cardiol. 2017, 70, 411-422. [Google Scholar] [CrossRef]を参照してください。
Lane, M.; Howland, G.; West, M.; Hockey, M.; Marx, W.; Loughman, A.; O'Hely, M.; Jacka, F.; Rocks, T. The effect of ultra-processed very low energy diets on gut microbiota and metabolic outcomes in individuals with obesity.超低エネルギー食の腸内細菌叢と代謝アウトカムへの影響。系統的な文献レビュー。肥満。Res. Clin. Pract. 2020, 14, 197-204. [Google Scholar] [CrossRef]を参照してください。
Sandall, A.M.; Cox, S.R.; Lindsay, J.O.; Gewirtz, A.T.; Chassaing, B.; Rossi, M.; Whelan, K. Emulsifiers Impact Colonic Length in Mice and Emulsifier Restriction is Feasible in People with Crohn's Disease.乳製品は、マウスの大腸長に影響を与え、クローン病患者では乳製品の制限が可能である。ニュートリエンツ2020、12、2827。[Google Scholar] [CrossRef]を参照してください。
Miranda, J.; Portocarrero, A.; Freire, A.; Abuin, C.; Saez, A. Advantages, Disadvantages, and Future Trends on the Use of Experiments in Cross-Over Trials in Nutritional Clinical Investigation; IGI Global: Hershey, PA, USA, 2020; pp. 158-173.より。[Google Scholar]
Mills, E.J.; Chan, A.-W.; Wu, P.; Vail, A.; Guyatt, G.H.; Altman, D.G. Design, analysis, and presentation of crossover trials(クロスオーバー試験の設計、分析、プレゼンテーション). トライアルズ 2009, 10, 27. [Google Scholar] [CrossRef][グリーンバージョン]。
ヴィーガニュアリー Veganuary-The International Movement Inspiring People to Try Vegan! Available online: https://veganuary.com/ (accessed on 20.4.20 2021).
Evans, C.E.L. Dietary fibre and cardiovascular health: 現在の証拠と政策の見直し。Proc. Nutr.Soc.2020、79、61から67まで。[Google Scholar] [CrossRef]を参照してください。
Livesey, G.; Taylor, R.; Livesey, H.F.; Buyken, A.E.; Jenkins, D.J.A.; Augustin, L.S.A.; Sievenpiper, J.L.; Barclay, A.W.; Liu, S.; Wolever, T.M.S.; et al. Dietary Glycemic Index and Load and the Risk of Type 2 Diabetes.食事性血糖値インデックスと負荷、2型糖尿病リスク。前向きコホート研究の系統的レビューと更新されたメタ分析。ニュートリエンツ 2019, 11, 1280. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン].
Litwinowicz, K.; Choroszy, M.; Waszczuk, E. アルコール使用障害におけるヒト腸内マイクロバイオームの組成の変化: を、システマティックレビューで紹介しました。Am. J. Drug Alcohol. Abus. 2020, 46, 4-12. [Google Scholar] [CrossRef] [PubMed] [グリーンバージョン]。
Ortiz-Alvarez, L.; Xu, H.; Martinez-Tellez, B. Influence of Exercise on the Human Gut Microbiota of Healthy Adults(健康な成人のヒト腸内細菌叢に対する運動の影響): A Systematic Review. Clin. Transl. Gastroenterol. 2020, 11, e00126. [Google Scholar] [CrossRef][PubMed]を参照。
出版社からのコメント:MDPIは出版された地図や機関所属の管轄権主張に関して中立的な立場をとっています。
© 2021 by the authors. ライセンシー:MDPI, Basel, Switzerland. この記事は、クリエイティブ・コモンズ表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条件に基づいて配布されるオープンアクセス記事です。
共有と引用
MDPIおよびACSスタイル
Toribio-Mateas, M.A.; Bester, A.; Klimenko, N. Impact of Plant-Based Meat Alternatives on the Gut Microbiota of Consumers(植物性代替肉の消費者腸内細菌叢への影響。実世界での研究。Foods 2021, 10, 2040. https://doi.org/10.3390/foods10092040
AMAスタイル
Toribio-Mateas MA, Bester A, Klimenko N. Impact of Plant-Based Meat Alternatives on the Gut Microbiota of Consumers(植物由来の代替肉が消費者の腸内細菌叢に及ぼす影響。A Real-World Study. Foods. 2021; 10(9):2040。https://doi.org/10.3390/foods10092040。
シカゴ/トゥラビアンスタイル
Toribio-Mateas, Miguel A., Adri Bester, and Natalia Klimenko.(トリビオ・マテアス、ミゲル・A、アドリ・ベスター、ナタリア・クリメンコ)。2021. "Impact of Plant-Based Meat Alternatives on the Gut Microbiota of Consumers(植物性肉代替品の消費者腸内細菌叢への影響。A Real-World Study" Foods 10, no.9: 2040. https://doi.org/10.3390/foods10092040.
この記事が気に入ったらサポートをしてみませんか?
