凍結乾燥糞便カプセルの投与が犬の腸内細菌叢に及ぼす影響:パイロット研究
本文へスキップ
米国国旗アメリカ合衆国政府の公式ウェブサイトです。
NIH NLMロゴログイン
アクセスキーNCBIホームページMyNCBIホームページメインコンテンツメインナビゲーション
NLMは図書館として、科学文献へのアクセスを提供しています。NLMデータベースへの掲載は、NLMまたは米国国立衛生研究所がその内容を支持または同意していることを意味するものではありません。
詳細はこちら: PMC免責事項|PMC著作権表示
遺伝子のロゴ
遺伝子(バーゼル) 2023 Sep; 14(9): 1676. オンライン公開 2023年8月25日. doi: 10.3390/genes14091676
PMCID: PMC10530739PMID: 37761817
凍結乾燥糞便カプセルの投与が犬の腸内細菌叢に及ぼす影響:パイロット研究
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10530739/

Sandra Carapeto,1,2,* Eva Cunha,1,2,* Isa Serrano,1,2 Pedro Pascoal,3 Marcelo Pereira,3 Raquel Abreu,1,2 Sara Neto,4 Beatriz Antunes,4 Ricardo Dias,3,5 Luís Tavares,1,2 and Manuela Oliveira1,2,5
著者情報 論文ノート 著作権とライセンス情報 PMC Disclaimer
関連データ
補足資料
データ利用声明
戻る
要旨
糞便微生物叢移植(FMT)は腸内細菌叢を調節するための有望な戦略である。我々は、凍結乾燥した糞便を含むカプセルを2ヵ月間下痢症のイヌに経口投与した場合の効果を評価するとともに、動物の糞便の一貫性と腸内マイクロバイオームに対する長期的影響を評価することを目的とした。この試験的研究には5頭の犬が参加した:2頭はコントロールとして、3頭は下痢症であった。月1回の糞便サンプルの採取と身体検査を行い、ブリストルスケールを用いた糞便一貫性の判定を含む評価を4ヶ月間行った。カプセル内に存在する生菌の総数を定量し、16S rRNA遺伝子の塩基配列決定によって細菌組成を決定した。試験中、副作用は報告されなかった。動物の糞便の一貫性は改善し、カプセルの投与を終了した後も、3匹のうち2匹ではブリストルスケールの値は安定していた。動物のマイクロバイオームは、バランスのとれた微生物叢に関連する組成へと徐々に変化した。FMT後、その組成にわずかな変化が観察されたが、カプセルの影響は4ヶ月間明らかであった。カプセルの投与は、微生物叢の調整にプラスの効果をもたらすようである。しかし、我々の観察結果を確認するためには、より多くの動物を用いた研究を行う必要がある。
キーワード:糞便微生物叢移植、腸内マイクロバイオーム、犬、下痢、糞便カプセル
次へ
はじめに
消化管の微生物叢は膨大な数の微生物から構成されている[1]。その安定性と適切な組成は宿主の健康維持に有益であるため、細菌集団の構成は極めて重要である。これらの微生物は、短鎖脂肪酸や二次胆汁酸の産生など、いくつかの代謝経路に関与しており、これらは免疫系、腸管バリアの維持、病原性細菌によるコロニー形成に対する抵抗力にとって重要である [2]。健康なマイクロバイオームの維持には、年齢、食事、遺伝、その他多くの環境因子が重要な役割を果たす。しかし、これらの因子が引き起こす可能性のある変化は、疾患動物に見られる変化と比較すると小さい。急性または慢性の消化管炎症はしばしばディスバイオーシスを引き起こし、健康な動物に比べて微生物の多様性が著しく低下することが特徴である [3] 。ディスバイオーシスは、微生物群集の構成における広範な変化、種の多様性の低下、特定の生物の相対的存在量の変化、代謝産物の産生における結果的なシフトによって特徴づけられる。しかし、健康な動物が不安定な微生物叢を示す可能性も見逃してはならない [3,4]。
もし腸内細菌叢に異常が生じたら、腸内細菌叢の不安定性をコントロールする必要がある。この目的のために、食事療法、プレバイオティクス、プロバイオティクス、シンバイオティクス、抗菌薬などが頻繁に使用されるが、場合によってはこれらの治療が有効でないこともあり、また抗菌薬の場合には、その投与が抗菌薬耐性の増加や腸内細菌叢異常の増加に関連することもある [5]。糞便微生物叢移植(FMT)は、宿主に健康な「微生物生態系」を導入することにより、腸管の安定性を回復することを目的としている[1]。FMTは、健康なドナーの糞便を健康でないレシピエントの腸内に移植し、腸内細菌叢を回復させるものである。この代替法の有益な効果はまだ明らかにされていない。しかし、マイクロバイオームの濃縮と微生物プロファイルの変化に寄与することが知られている[2]。
獣医学では、FMTは治療抵抗性のジアルジア症、慢性腸症、パルボウイルス感染症、および出血性胃腸炎などの他のタイプの急性下痢症における治療の可能性があると考えられている[5,6,7,8,9]。これまでのところ、FMTに関連した重篤な副作用は報告されていないが、これはおそらくデータが限られているためであろう [10]。現在、ヒトおよび獣医学の両方において、糞便材料の調製および保存方法、ドナーの選択基準、投与量、投与間隔、投与頻度および投与経路について、まだコンセンサスが得られていないことに留意すべきである[2]。
本研究の目的は、凍結乾燥した糞便カプセルを経口的に長期投与することで、犬の腸内細菌叢の構成に与える影響と、動物の糞便の一貫性を修正する効果を評価することである。
次へ
2. 材料と方法
2.1. 試験動物
本研究のために、5頭の動物を公的なレスキュー機関から選択した。すべての動物は、現行のEU(指令2010/63/EC)および国内法(DL 276/2001およびDL 113/2013)、ならびにポルトガルの管轄当局(Direção Geral de Alimentação e Veterinária、DGAV)の定める規則に従って飼育された。本研究では、公的なレスキューセンターの倫理ガイドラインに従い、研究実施のためのプロトコルを文書化した。すべての処置は訓練を受けた獣医師によって行われ、非侵襲的な処置のみが用いられた。
5頭の研究対象犬のうち、2頭は糞便が正常であり、陽性対照(PC-カプセル投与)および陰性対照(NC-カプセル投与なし)として選択された。残りの3頭は慢性下痢(3週間以上[11])を呈し、研究の対象動物(治療群)となった。
選択されたイヌは犬舎で別々の屋外屋根付きボックスに収容され(ただし、動物1とNCは同じボックスに一緒に収容された)、共通の環境(水質、空気質、清掃手順を含む)を共有し、同じ食餌を与えられた。これらの犬は表1に示す特徴を示し、Bristol Stool Scale [12]による初期糞便粘度の分類も含まれる。この尺度の使用は、その簡便さによるもので、ヒトの医療に特化したものではない[13]。
表1
試験動物の特徴
性別 去勢 年齢
(kg) 駆虫 ワクチン接種 糞便の
一貫性
動物 1 オス はい 6 25 規則正しい 規則正しい 6/7
動物 2 オス はい 2 25 規則正しい 規則正しくない 7
動物 3 オス あり 10/11 15 規則正しい 規則正しい 5/6
陽性
コントロール 男性 はい 2 10 規則正しい 規則正しい 4
陰性
コントロール 男性 はい 2 27 規則正しい 規則正しい 4
別ウィンドウで開く
犬種不詳、2歳以上、体重9kg以上27kg以下。選択された犬は、試験前の6ヵ月間に、内服および外用駆虫薬を除き、いかなる種類の投薬も受けていない。ワクチン接種は、犬舎に入ったばかりの2頭を除き、定期的に受けていた。動物1、動物2、動物3は糞便の硬度が変化した以外は、病気の肉眼的徴候は認められなかった。
2.2. 糞便微生物叢移植
経口FMTは、AnimalBiome®社(米国カリフォルニア州オークランド)が2016年から販売している経口カプセルの投与により実施した。AnimalBiome®のウェブサイトで入手可能な情報によると、カプセルは厳密に選別されたイヌのドナーの糞便材料を凍結乾燥することによって製造され、移植された糞便材料内の病原体や多剤耐性菌の存在を排除することを目的としている。ドナー動物は、好ましくは1歳から10歳で、最適な体調と正常な糞便の一貫性を有し、健康診断で健全な健康状態である。さらに、過去3ヶ月、6ヶ月、12ヶ月以内に抗菌薬を使用していないこと、最新のワクチン接種、広域スペクトル薬による経験的駆虫が必須条件である。検査室スクリーニングでは、血液学および生化学が正常であること、糞便浮遊検査結果が陰性であること、ジアルジアなどの病原体やパルボウイルス、ジステンパーなどの疾患が陰性であることが要求される[2,14,15]。このケースでは、市販の製品であることを考慮し、研究中に使用されたカプセルの糞便ドナーに関する情報は得られなかった。
カプセルの組成については、糞便に加えて、グリセロールや胃や腸の区画で酵素作用に対する耐性を与えるカプセルなどの不活性成分も含まれている。
2.3. 実験デザイン
この試験的臨床試験は、陰性対照(糞便の硬さが正常で無処置)としての犬1頭と、糞便の硬さが正常である1頭(陽性対照)と糞便の硬さが変化している3頭(処置群)の2つの試験群を含む対照試験であった。試験開始時およびカプセル投与前に、試験に参加した各動物からサンプルを採取し、臨床試験に沿った比較に使用した。そのため、これらのサンプルは元の動物のコントロールとして使用された。
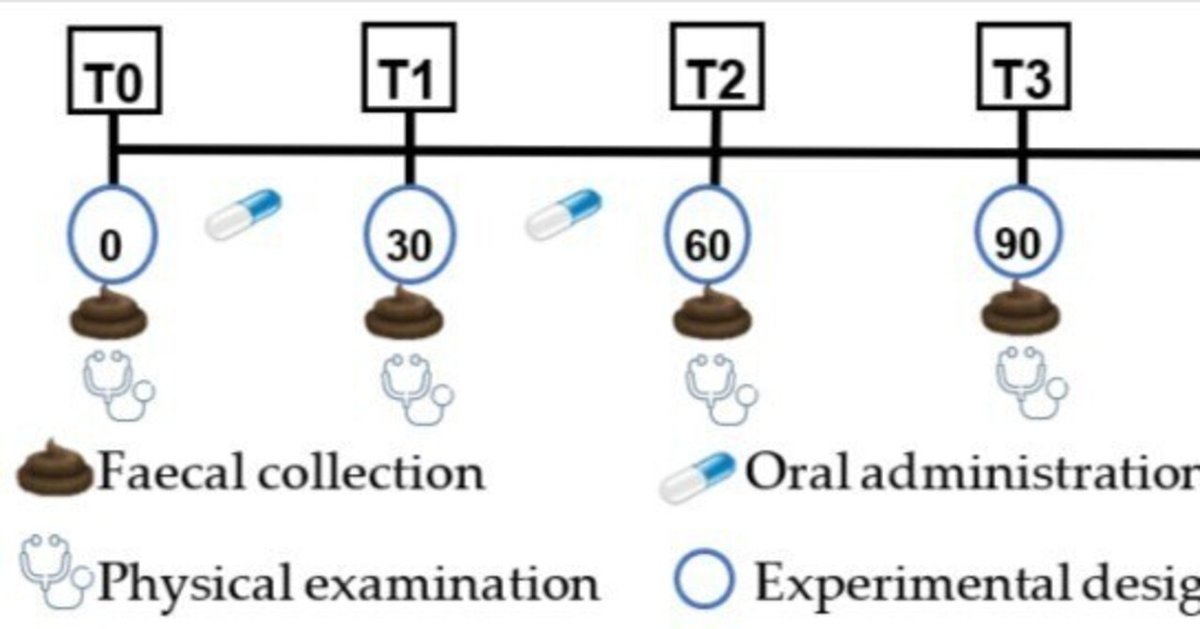
陽性対照群と治療群の動物には、アニマル・バイオーム®を1日1カプセル、2ヶ月間(60日間)経口投与した。陰性対照動物には、治療薬もプラセボも投与しなかった。試験期間は合計4ヶ月で、1頭につき毎月糞便サンプルを採取した(図1)。最初のサンプリングは、前述のように、動物にカプセルを投与することなく、試験開始時(T0)に実施した。2回目の糞便サンプリングは、凍結乾燥カプセルの最初の投与から30日後に行った(T1)。3回目のサンプリングは、T1から30日後、FMT投与終了時に行った(T2)。最後のサンプリング(T3)は、T2から1ヵ月後に行い、糞便カプセル投与の長期的な有効性を評価することを目的とした。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はgenes-14-01676-g001.jpg。
図1
研究のさまざまな時間的瞬間を表す。
各サンプリング時点において、動物の全身観察、糞便の性状評価、直腸温測定、呼吸数・心拍数測定、心音・呼吸音聴診、眼・耳・鼻・口・皮膚の異常の有無の評価、リンパ節の観察と触診、腹部の触診と睾丸の触診、粘膜の観察などの健康診断を1頭ずつ行った。さらに、カプセル投与終了から2ヵ月後に新たな身体評価を行った(T4)。
月1回の訪問に加え、週1回の電話連絡により、動物の健康状態および副作用の有無を確認した。
2.4. 糞便サンプルの採取、包装および保管
糞便サンプルは、動物の毎日の散歩中または給餌時間後のいずれかの排便後に、滅菌プラスチックカップを使用して採取した。サンプルは発泡スチロールの箱に凍結プレートとともに一時保管し、その後-20℃の冷凍庫に移し、24時間以内に長期保管した。
2.5. カプセルに存在する細菌集団の定量化
まず、カプセル内の糞便1mgを生理食塩水1mLで希釈した。その後、10-10希釈までの連続10倍希釈液100 µLをTrypticase Soy Agar (TSA)プレートの表面に二重に接種し、凍結乾燥カプセル内に存在する生菌の総数の定量を行った。すべてのプレートを37℃で24時間好気的に培養した後、各プレート上のコロニー数を定量した。
2.6. カプセルおよび糞便サンプルのマイクロバイオームの特性評価
カプセルと糞便サンプルに存在するマイクロバイオームの構成を調べるため、QIAamp® PowerFecal® Pro DNAキット[16]を用いてDNA抽出を行った。その後、DNAをBiometra T1 Thermocycler T-1 Thermoblockを用いたPCRで増幅した。使用したマスターミックスの組成は以下の通りである: 60 mM Tris-SO4、20 mM (NH4) 2SO4、2 mM MgSO4、0.3 mM dNTPs、3% Glycerol、0.06% IGEPAL® CA-630、0.05% Tween20、125 units/mL LongAmp Taq DNA Polymerase; pH 9.1、25 °C、16S rRNAをターゲットとする27fと1492rの各プライマー1.5 µL。増幅プロトコールは、変性(95℃、10-30秒)、アニーリング(55℃、15-60秒)、複製(65℃、50秒)を35サイクル行った。その後、増幅産物をゲル電気泳動で可視化し、磁気ビーズを用いた固相可逆固定化(SPRI)法で精製した[17,18]。その後、DNAライブラリーを構築した。その後、サンプルをQubit®蛍光光度計で定量し、Oxford Nanopore Technologies®社から発売されているGridION X5を用いて、その後のゲノム配列決定のためにアダプターを固定した[19]。
2.7. 統計解析とデータ処理
高精度の分類学的分類を得るために、BioISIGenomics®が開発したカスタム分析パイプラインを用いてサンプルを分析した。最初に、各サンプルについて、操作上の分類単位(OTU)が同定され、続いて、サンプルの細菌組成を比較するためのヒートマップが確立された。さらに、各サンプルのα多様性をシャノン多様性指数に基づいて分析し、サンプル間のβ多様性をBray-Curtis非類似度指数に基づいて分析した。β多様性は主座標分析(PCoA)を用いて表した。各サンプルのα多様性を比較するために、複数の対比較においてKruskal-Wallisノンパラメトリック統計検定を適用した(p値=0.05)。
次へ
3. 結果
3.1. 動物の身体検査
試験期間中、動物の身体検査では軽症および肉眼的な疾患の徴候は認められず、糞便カプセルの投与に関連した副作用は報告されなかった。
糞便の硬さに関しては、カプセル投与30日後、このパラメータに改善が見られた(表2)。実際、週1回の検診によると、下痢はFMT開始後3週目に消失した。しかし、動物2はBristol Scaleで定められた糞便一貫性のレベル4に達しておらず、T1ではレベル5の糞便一貫性を示した。T2では、すべての動物で糞便の硬さが改善した。カプセル投与終了後の数ヵ月間(T3およびT4)、動物2のみ、試験開始時に観察されたレベルには達しなかったものの、糞便一貫性のレベルが後退した。試験期間中、対照犬として選択された犬は、正常な糞便の硬さを継続的に示した。
表2
ブリストルスケールによる分類。
T0 T1 T2 T3 T4
動物1 6/7 4 4 4
動物2 7 5 5 5/6 6
動物 3 5/6 4 4 4
陽性コントロール 4 4 4 4
陰性コントロール
別ウィンドウで開く
3.2. マイクロバイオーム解析
ゲノム配列決定で得られた結果を分析するため、まずカプセルの組成と健康な腸内細菌叢を決定した。その後、被験動物の糞便微生物叢に存在する各細菌群の濃度に対するカプセル投与の影響を評価するため、残りの糞便サンプルの分析を行った。
3.2.1. カプセル カプセルの生菌数は108 CFU/mLであった。ゲノムシークエンシングの結果、カプセルに含まれる細菌のほとんどが固形化門(96.56%)に属し、次いで放線菌門(2.27%)、バクテロイデーテス門(1.13%)の順であった。クラスレベルでは、Clostridiaが最も多く(86.49%)、次いでBacilli(9.04%)、Bacteroidia、Coriobacteriia、Erysipelotrichiクラスは相対的に低い濃度(それぞれ1.13%、2.27%、1.06%)であった。最も頻度の高い細菌科は、Lachnospiraceae、Clostridiaceae、Peptostreptococcaceaeであった(それぞれ41.13%、23.13%、20.38%)。種レベルでは、Clostridium hiranonis(38.28%)、Blautia spp.(29.24%)、Ruminococcus gnavus(6.76%)、Streptococcus luteciae(8.09%)の濃度が高かった。クロストリジウム・パーフリンゲンス(Clostridium perfringens)(4.80%)がフェカリバクテリウム・プラウスニッツィ(Faecalibacterium prausnitzii)(1.04%)よりも高濃度で存在することが注目される(図2)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はgenes-14-01676-g002.jpg。
図2
本研究で使用した糞便カプセルに存在する細菌種。
3.2.2. 対照 本試験では、対照(陽性対照および陰性対照)として選択したイヌの初期糞便サンプル(T0)を評価し、下痢がなく、糞便カプセルの投与および影響の可能性がない平衡状態における腸内細菌叢の組成を決定した。陰性対照(NC)の場合、この動物はFMTカプセルの投与を受けていないため、翌月に採取したサンプルから得られたデータも陰性対照として考慮した。
これらの動物では、すべての糞便サンプルにおいて、ファーミキューテス属(93.68%)が優勢であり、バクテロイデーテス属(5.65%)がこれに続いたが、フソバクテリア属(0.09%)、プロテオバクテリア属(0.09%)、アクチノバクテリア属(0.48%)は少なかった。細菌クラスについては、Clostridia、Bacilli、Bacteroidiaの濃度が高く(それぞれ20.82%、72.86%、5.66%)、GammaproteobacteriaとActinobacteriaの濃度は低かった(それぞれ0.02%、0.003%)。科のレベルでは、乳酸菌科の細菌が多く観察され、腸内細菌科は最も少ないもののひとつであった。Clostridiaceae(クロストリジウム科)、Peptostreptococcaceae(ペプトストレプトコッカス科)、Lachnospiraceae(ラクノスピラ科)の濃度が最も高かったのは、NC動物のサンプルT1であった(それぞれ19.97%、26.38%、23.16%)。より具体的には、ほとんどの糞便サンプルで優勢な菌種はLactobacillus reuteri(24.50%)であり、これにLactobacillus属に属する他の菌種が続いた。ほとんどのサンプルで、Clostridium hiranonisとBlautia spp.がかなり検出され、Streptococcus spp.とFaecalibacterium prausnitziiは低濃度で検出された。また、Clostridium perfringens(0.48%)の常在も観察された。
NC動物については、T1サンプルにおける組成の明らかな変化について言及することが重要である。この変化は、Clostridia(クロストリジウム)クラスの著しい増加、それに続くBacilli(バチルス)クラスの減少、および細菌科の多様性の増加によって特徴づけられる。
3.2.3. FMT対象動物のマイクロバイオーム
当初、すべてのイヌは凍結乾燥カプセルに存在するものと比較して、ファーミキューテス属とプロテオバクテリア属の濃度が高く、バクテロイデーテス属とアクチノバクテリア属の濃度が低かった(図3)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はgenes-14-01676-g003.jpg。
図3
試験中の各糞便サンプルに存在する各細菌門の相対濃度を、カプセルおよび陰性対照糞便サンプルに存在するものと比較したもの。
FMT期間中、すべての糞便サンプルにおいて、ファーミキューテス属の濃度の減少が観察され、バクテロイデーテス属の増加が観察された。アクチノバクテリア(Actinobacteria)の濃度は、動物NCと2を除き、FMT投与を通じて増加した。最後に、T1ではプロテオバクテリアの有病率にわずかな変化が観察された。しかし、T2では、動物2および3のサンプルでこの門の濃度が高かった。
FMT後、ファーミキューテス類とバクテロイデーテス類の変動は、動物2を除いて移植中に観察された変動とは逆であった。アクチノバクテリアは動物3で著しく減少し、プロテオバクテリアは動物2と3で増加した。T3の糞便サンプルでは、ファーミキューテス属が優勢で、バクテロイデーテス属がそれに続いた。しかし、T0と比較すると、ファーミキューテス類の濃度が低く、バクテロイデーテス類の濃度が高かった。T3では、放線菌の割合はT0とあまり変わらなかった。最後に、最初に分析した糞便サンプルと比較すると、動物2および3では、プロテオバクテリアが明らかに増加していた。
クラス T0では、すべての糞便サンプルでBacilliが優勢で、FMTカプセルに存在するものより高い値を示し、Clostridia、Bacteroidia、Coriobacteriia、Erysipelotrichiは低い値を示した(図4)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はgenes-14-01676-g004.jpg。
図4
試験期間中、各糞便検体中に存在した各細菌クラスの相対濃度を、カプセルおよび陰性対照糞便検体中に存在したものと比較した。
移植中は、動物2を除くすべてのサンプルで、T0時よりもBacilli濃度が低かった。Clostridia、ErysipelotrichiおよびCoriobacteriiaについては、動物2とNCを除いて逆の結果が観察された。一方、BacteroidiaはFMT投与中にすべての動物で増加した。
試験終了時に採取されたサンプルでは、PCとして選択された動物での減少は明らかではなかったが、動物2とPCのものを除いて、Bacilliの顕著な増加が認められた。さらに、ClostridiaとCoriobacteriiaは、対照として選択されたイヌのサンプルで増加が観察された以外は、すべての試験対象動物で減少を示した。さらに、バクテロイデスは動物2を除くすべての犬で減少し、うどんこ病は動物2で減少した。T0と比較すると、イヌ科動物NCを除くすべての検体で、BacilliとClostridiaの濃度はそれぞれ減少および増加した。バクテロイディアは試験終了時に全イヌで高濃度を示し、うどんこ病も動物2を除いて高濃度であった。最後にT3では、コリオバクテリアは最初に得られた濃度と同程度であった。
次数 本試験を通して次数レベルでの変動は、クラスレベルで観察されたものと同様であった。Lactobacillales、Clostridiales、Bacteroidales、CoriobacterialesおよびErysipelotrichalesは、それぞれBacilli、Clostridia、Bacteroidia、CoriobacteriiaおよびErysipelotrichiのクラスと同様の変動を示した。
ファミリー T0では、乳酸桿菌科と腸内細菌科がすべての糞便サンプルにおいて、莢膜と比較して高濃度で存在した。Streptococcaceae(連鎖球菌科)も動物3とPCのサンプルで高濃度であった。一方、Clostridiaceae, Lachnospiraceae, PeptostreptococcaceaeおよびPrevotellaceaeは、凍結乾燥カプセルのものと比較して、糞便サンプル中の濃度が低かった(図5)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はgenes-14-01676-g005.jpg。
図5
試験期間中、各糞便検体中に存在した各細菌ファミリーの相対濃度を、カプセルおよび陰性対照糞便検体中に存在したものと比較したもの。
FMT期間中、動物2のT1検体と動物PCのT2検体を除き、ほとんどの糞便検体で乳酸菌が減少した。ほとんどの糞便検体は、動物2とNCの検体を除き、初期検体と比較してClostridiaceaeの濃度が高かった。最初の糞便サンプルとFMT中に得られた糞便サンプルのLachnospiraceaceaeとPrevotellaceaeの組成を比較すると、すべてのイヌのサンプルでこれらの細菌ファミリーの濃度が高かったが、T2では動物2と3のみがLachnospiraceaceaeの増加を示し、動物PCではPrevotellaceaeの増加は認められなかった。ペプトストレプトコッカス科はLachnospiraceaeと同様の変化を示したが、T0と比較すると、犬によって異なる結果を示した。連鎖球菌科はT1で得られた検体間で異なる変化を示したが、T2ではFMTを受けたすべての犬がT0と比較してこの科の濃度が低いことを示した。最後に、腸内細菌科の濃度は、NCを除くすべての犬でT0と比較して低かった。
FMT後、乳酸桿菌科はばらつきを示したが、FMT終了時にはすべての動物でT0時のサンプルより低い値を示した。さらに、ClostridiaceaeとPeptostreptococcaceaeは異なるばらつきを示したが、T0と比較すると、Clostridiaceaeは動物2とNCのサンプルを除き、測定中に採取されたサンプルで高い濃度を示し、Peptostreptococcaceaeは動物3のサンプルでのみ高い濃度を示した。T3では、LachnospiraceaceaeとPrevotellaceaeは動物2を除いて減少した。しかし、T0と比較すると、NC動物を除くすべての動物でこれらの科の値が高くなった。さらに、T3のサンプルでは、Streptococcaceaeはすべての犬でT0で得られた値より低い値を示し、T3でStreptococcaceae濃度の減少を示したのはNC動物だけであったため、この細菌群の濃度はNC動物が最も低かった。最後に、T3では、腸内細菌科細菌は動物間で異なる変動が観察されたが、すべての糞便検体はT0検体と比較して低い値を示した。
属 細菌の属については、分析した糞便サンプルで観察された違いは、上記の科レベルと同様であった。
菌種 研究開始時、すべての犬で、Blautia spp.、Clostridium hiranonis、Faecalibacterium prausnitziiの濃度が凍結乾燥カプセルに含まれるものと比較して減少していた。また、ストレプトコッカス属の濃度は、動物3とPCを除くすべての犬で低かった(図6)。
画像やイラストなどを保持する外部ファイル。
オブジェクト名はgenes-14-01676-g006.jpg。
図6
本試験の各時点で分析した異なる糞便サンプル中のClostridium hiranonis、Blautia spp.、Streptococcus spp.およびFaecalibacterium prausnitziiの濃度の変動。
投与中、F. prausnitziiとBlautia spp.の濃度はT0より高かったが、T1で採取した動物2と3のサンプルの増加は比較的目立たなかった。しかし、T2でこれら2つの細菌種の増加を示したのは、これら2つの動物のサンプルだけであった。C. hiranonisに関しては、T1とT2で得られた濃度は、動物2のT1とT2、および動物NCのT2で得られた試料を除いて、T0時の低い値には達しておらず、後者がT2でC. hiranonisの最低値を示した。最後に、FMTの30日後、連鎖球菌属の値は糞便サンプル間で乖離した。しかし、2ヵ月目には、動物NCの検体を除き、T0と比較して低濃度であった。
FMT終了後、F. prausnitziiの変動は動物間で乖離したが、NC動物では増加は少なかったものの、すべての犬の検体で元の値より高い値を示した。FMT終了1ヵ月後、Blautia spp.はすべてのイヌの検体で減少したが、カプセル投与を受けたすべてのイヌの検体は、T0時の値よりもT3時に高い値を示した。C. hiranonisの有病率は動物によってばらつきがあったが、動物2とNCの検体を除き、すべての糞便検体でこの細菌群が試験開始時と比較して増加していた。最後に、Streptococcus spp.は、T3で得られた他のサンプルと比較して最低値を示したNC動物のものを除き、すべてのサンプルで増加した。しかし、すべての検体で、T0検体と比較してこの細菌群の値は低く、NC動物ではより顕著であった。
3.2.4. 動物間の比較 各糞便サンプルに存在する細菌群を比較するために、異なる動物および異なる時点から得られたサンプル間の類似度をチェックするためにヒートマップを実行した。その結果、動物間およびタイムポイント間で乖離がみられ、パターンを示すことはできなかった(補足ファイルS1)。
3.3. 多様性解析
3.3.1.α多様性 α多様性は、サンプルに存在するマイクロバイオームの多様性を評価するもので、値が低いほど多様性が低く、逆に低いほど多様性が低いことを示す[20](補足ファイルS2)。前節と同様、結果もまた異なっていた。動物3(p = 0.512691)と動物2とPCのT2(p = 0.827259)から得られたT1サンプルとT2サンプルを除くと、ほとんどが統計的に有意に異なっていた。
3.3.2.β多様性 β多様性は、Bray-Curtis非類似度指数[20]に基づき、異なる糞便サンプルに存在する細菌集団を比較することができた。α多様性で観察されたように、パターンは検出されなかったが、T1で採取されたNC動物のサンプルの値が、莢膜に存在する多様性に似ていたことは注目に値する(補足ファイルS3)。
に進む:
4. 考察
このパイロット研究は、慢性下痢症の動物における長期的な糞便微生物叢移植の影響を評価することを目的とした。したがって、分析する糞便サンプルの採取は移植後の後期に行い、この新たな刺激に対する腸内細菌叢の適応過程を長期的に評価できるようにした。
対象となる動物は犬舎で生活していたため、動物医療訓練を受けた職員がアッセイ中ずっと監視を続けることができた。さらに、腸内細菌叢に関する研究であるため、同じ環境、食餌、獣医学的ケアを共有する動物を選択することで、存在する変数を最小化し[21]、サンプル収集と保存の手順を標準化することを目的とした。サンプルサイズが小さいことに加え、年齢、体調、ワクチン接種状況など、動物が示す特徴的な特性は、腸内細菌叢の構成に影響を与える可能性があるため、限界と考えることができる[21,22,23]。例えば、動物2のワクチン接種状況に関する情報がないことは、そのサンプルが他のサンプルと異なる結果を示したことから、注意すべきである。研究対象動物の糞便の粘稠度の変化の根本的な原因について、詳細な臨床病歴と診断がないことも、慢性腸症の可能性 [24]と同様に注意すべきである [11]。とはいえ、本研究は、凍結乾燥糞便カプセルの経口投与に基づくFMTが、対象犬の糞便粘稠度および腸内細菌集団の組成に及ぼす影響の予備的評価を目的としたにすぎない。
糞便の厳密なスクリーニングが実施されれば、FMTに関連する副作用はほとんど認められず[6,25]、本研究でもそれが証明された。糞便の粘稠性については、動物1と3で改善が認められ、長期評価(T4)でもその値が維持された。また、動物2はFMT期間中、このパラメータに関して良好な評価を示したが、長期評価ではサンプルの糞便一貫性が再発し、T0で観察されたものと同様の糞便一貫性の値を示した。この動物は非常に心配性で神経質であり[26]、さらに、試験に登録された動物の中で最も若く、ワクチン接種の状況が不明な動物であった。
AnimalBiome® [27]によれば、試験したカプセルには糞便 1g あたり 20×109 CFU が含まれている。本研究で実施した定量では、その差はわずか100 CFU/gであり、カプセルの製造手順が細菌集団の保存を支えていることが明らかになった。カプセルの構成については、Clostridia綱Clostridia門FirmicutesのLachnospiraceae科、Clostridiaceae科、Peptostreptococcaceae科が最も豊富であることが示された。しかし、この門に対応する値は予想よりも高く、その結果、残りの門の濃度は極めて低かった[10]。さらに、放線菌の濃度が高かったことは、この門は一般的に低濃度で存在するとしたPereira and Clemente [28]の研究と一致しない。プロテオバクテリア(Proteobacteria)の濃度が低いことは、この門が病気の動物でのみ増加することを示した先行研究と一致している[29]。存在する菌種については、胆汁酸の変換を担う主要な細菌であるC. hiranonisが優勢で、宿主の恒常性維持に有益な役割を持つBlautia属とRuminococcus属に属する細菌も高濃度で存在した。S. luteciaeも高濃度で検出されたが、この細菌群が高濃度になるのは通常、疾患、特に慢性腸炎と関連しているため、入手可能な文献とは異なっていた[3,30]。C.perfringensの濃度は、この細菌種の常在菌としての存在を示しており、消化管疾患を示すものではなかった[10,31]。しかし、この菌種はF. prausnitziiよりも高濃度で存在し、Honnefferら[30]によれば、低濃度で存在する場合は糞便性腸内異常症のマーカーと考えられる。
Niinaら[29]によれば、この門の割合が低く、プロテオバクテリアが増加すると腸症を示唆する可能性があるからである。しかし、これらの動物では、プロテオバクテリアの増加も、胃腸障害を示唆する臨床症状も認められなかった。特筆すべきは真菌の濃度が高いことで、特に乳酸桿菌は一般に疾患の場合に増加する[2,32]。Aboim[33]によれば、研究対象の動物が犬舎で飼育されていたことが、この結果を正当化する可能性があるという。さらに、Clostridiaceae、PeptostreptococcaceaeおよびLachnospiraceaeは、T1のNC動物でのみ高濃度であり、平衡状態の微生物叢の存在を裏付けるものではなかった[4]。しかし、ほとんどのサンプルでは、腸内細菌科と連鎖球菌属の濃度が低く、健康な微生物叢の特徴であるC. hiranonisとBlautia属の濃度が高かった[3]。カプセルの組成で観察されたように、F. prausnitziiも減少した量で検出され、C. perfringensの常在も検出された。陰性対照のT1サンプルについては、動物の健康診断が正常で、試験中も糞便の一貫性が一定であったにもかかわらず、細菌多様性の増加が観察された。しかし、健康な動物は微生物叢が不安定である可能性があり、この結果が正当化される可能性があるということは重要である[3,4]。
マイクロバイオーム組成に対するカプセルの作用については、有意差は検出されなかったものの、FMT投与の結果と思われる一定の傾向が観察された[4,34,35]。例えば、ほとんどの糞便サンプルにおいて、バクテロイデーテス(Bacteroidetes)と放線菌(Actinobacteria)が増加し、ファーミキューテス(Firmicutes)が減少した。これは、優勢な門が減少し、以前は低濃度で存在していた門が増加したことに相当し、細菌集団の多様性の増加をもたらした。それにもかかわらず、T2のPC動物のサンプルでは逆の変動が観察され、これは腸内細菌叢の正常化とカプセル摂取への適応に関連している可能性がある。動物2でFMT2ヵ月後にのみ認められた放線菌のわずかな増加は、初期の糞便性腸内細菌叢異常の程度を反映している可能性がある。また、T2時点のNC動物からのサンプルは、T0時点のサンプルに存在するものと比較して放線菌の濃度が低い唯一のものであったという事実は、この門の増加におけるカプセル投与の重要性を反映している。プロテオバクテリア(Proteobacteria)で確認された変動は、これらの値を減少させようとする試みを明らかにした。しかし、プロテオバクテリアが不均衡な微生物叢と関連しているにもかかわらず、この門の値は研究対象の動物で特に高くなることはなかった[3]。全体として、FMT後に採取されたサンプルは、逆の変動が特徴的であった。しかし、T0と比較すると、カプセルの効果は、ファーミキューテス類の濃度低下とバクテロイデーテス類の濃度上昇に関連していた。放線菌の濃度は有意な変動を示さなかった。最後に、動物2でプロテオバクテリア(Proteobacteria)の濃度が最も高かったことは注目に値する。
細菌クラスについては、1ヶ月目にはBacilliの濃度が減少し、他のクラス(Clostridia、Coriobacteriia、Erysipelotrichi、Bacteroidia)の濃度が増加した。2ヶ月目には、その変動は動物によって異なった。FMT終了後、バクテロイディアはほとんどの動物で減少し、残りのクラスは多様な変動を示した。これは、FMT後に異なる反応を引き起こす可能性のあるディスバイオシスのためかもしれない。にもかかわらず、カプセルの影響は残っており、ほとんどのサンプルはT0と比較して、Bacilliの値が低く、Clostridia、Erysipelotrichi、Bacteroidiaの値が高く、健康な微生物叢に存在するものと類似していた[3,32]。再び、動物2とNCは例外であったが、これは動物2が示した違いと、動物NCにカプセルを投与しなかったという事実によって正当化できる。コリオバクテリウム(Coriobacteriia)だけは、それが属する門のように、T0からの値とまったく異なる値を示さなかった。
より具体的には、FMT期間中、予想されたように[8,32]、ほとんどの糞便サンプルでPrevotellaceae、Lachnospiraceae(Blautia spp.)、Peptostreptococcaceae、Clostridiaceae(C. hiranonis)、Faecalibacterium prausnitziiが増加し、LactobacillaceaeとEnterobacteriaceaeが減少したが、動物2とNCは例外であった。特に連鎖球菌科の減少は、動物NCを除くすべての動物で、FMTプロトコールの2ヶ月目でのみ明らかであった。このことは、この科の濃度を低下させるには、30日以上のFMT期間が必要であることを示しているようである。
FMT終了の翌月には、ほとんどのサンプルがカプセル投与後に観察された変動とは逆の変動を示した。この軽度の再発は、ChaitmanとGaschen[2]が行った、慢性下痢症の犬は再発を防ぐためにしばしば複数回のFMT治療が必要であるという観察と一致する。しかし、研究開始時に得られたサンプルの結果と比較すると、ほとんどの動物で、Prevotellaceae、Lachnospiraceae、Clostridiaceae、F. prausnitziiの濃度が高く、StreptococcaceaeとEnterobacteriaceaeの濃度が低く、健康な微生物叢と近似していることが示唆された[10]。さらに、フソバクテリウム科に関しては最小限の変化しか観察されなかった[10]。
β多様性は、すべての犬からT0時に採取したサンプルとカプセルとの間に高い非類似性を示した。試験終了時には、すべての動物でT0時に採取したサンプルとの類似性が高くなり、前述のようにわずかに再発したことが示された。しかし、T3では、細菌の高い値が有益であると考えられ、疾患関連細菌の低い値も明らかであった[36]。
事前に定義された基準間隔がないため、研究開始時に各動物に存在した腸内細菌異常症の程度を定義することは不可能であり、サンプルサイズが小さいため糞便腸内細菌異常症指数 [37,38] を決定することもできなかった。
に進む:
5. 結論
現在、FMTは獣医学的環境では広く使用されていないが、この処置は抗生物質の使用に代わる信頼できる選択肢となる可能性がある。自宅での経口カプセル投与によるFMTの実施は、この技術の幅広い適用を大いに促進するであろう。
本研究では、副作用が認められなかったことが特筆され、抗生物質の代替療法としての安全性が強調された。さらに、投与したカプセルの期間と投与量は、動物1と3の糞便の硬さを回復させることに成功した。しかし、動物2では同様の回復効果は見られなかった。この特定の犬に対しては、投与期間を延長するか、下痢の根本原因に対処する治療戦略が必要かもしれない。最後に、本研究に含まれた少数の犬群の多様な特性を考慮すると、結果をより大きな集団に外挿する際には注意が必要である。とはいえ、これらの限界にもかかわらず、所見には顕著な傾向が認められ、イヌ患者におけるFMT介入の可能性が強調されている。
将来的には、同様の特徴を有し、消化管診断が確定している、より多くの動物を用いた前向き実験プロジェクトを実施することが極めて重要であろう。さらに、初期の腸内細菌叢異常の程度を定義し、FMTを通じてその変化を検証するために、糞便性腸内細菌叢異常指数のような他のパラメータを評価することも適切であろう。
結論として、獣医療におけるFMTの有益性を調査し、この療法の標準的な使用のためのガイドラインを作成することが重要である。
次へ
謝辞
カニール・デ・ペニシェ "の技術支援に感謝する。
謝辞
略語
FMT:糞便微生物叢移植、NC:陰性対照、PC:陽性対照、OTU:操作分類単位。
補足資料
補足資料
以下の補足資料は、https://www.mdpi.com/article/10.3390/genes14091676/s1。補足ファイルS1:図S1-全サンプルでリードカウントの合計が最も高かった50のOTUを表すヒートマップ;補足ファイルS2:図S2-各糞便サンプルのシャノン指数によるα多様性をFMTカプセルに存在するものと比較したもの;補足ファイルS3: 図S3-同じ動物の糞便サンプル間の違いをPCoAプロットで表したβ多様性。
追加データファイルはこちら(582K, zip)
こちらへ
資金提供について
CIISA-Centro de Investigação Interdisciplinar em Sanidade Animal, Faculdade de Medicina Veterinária, Universidade de Lisboa, Project UIDB/00276/2020 (Funded by FCT); and the Associate Laboratory for Animal and Veterinary Sciences (LA/P/0059/2020-AL4AnimalS) に謝意を表したい。
こちらへ
著者貢献
構想、S.C.およびM.O.、方法論、S.C.、R.D.およびM.O.、ソフトウェア、M.P.、P.P.およびR.D.、検証、S.C、 E.C.、M.O.、形式分析、S.C.、P.P.、M.P.、調査、S.C.、P.P.、M.P.、R.A.、S.N.、B.A.、R.D.、M.O.、リソース、S.N.、B.A.、I.S.、R.D、 データキュレーション、S.C.およびM.P.、執筆・原案作成、S.C.、執筆・査読・編集、E.C.、R.A.、R.D.、I.S.、L.T.およびM.O.、視覚化、S.C.、監督、M.O.、プロジェクト管理、M.O.、資金獲得、S.C.、L.T.およびM.O.。
こちらへ
施設審査委員会声明
本研究の検体は、訓練された獣医師により、標準的な日常手順の間に、犬舎の倫理指針に従って採取されたため、倫理的審査および承認は免除された。サンプリング手順の間、非侵襲的サンプルのみが収集された。
こちらへ
インフォームド・コンセント
インフォームド・コンセントは、本研究に参加したすべての被験者から得た。
次へ
データ利用声明
本研究で使用されたデータセットは、合理的な要求があれば、対応する著者から入手可能である。
このページへ
利益相反
著者らは利益相反がないことを宣言する。資金提供者は、本研究のデザイン、データの収集、分析、解釈、原稿の執筆、結果の公表の決定に関与していない。
次へ
脚注
免責事項/出版者注:すべての出版物に含まれる声明、意見およびデータは、著者および投稿者個人のものであり、MDPIおよび/または編集者のものではない。MDPIおよび/または編集者は、コンテンツで言及されているアイデア、方法、指示、製品に起因する人体または財産の損害について、一切の責任を負いません。
こちらへ
参考文献
犬と猫の健康と病気における腸内細菌叢の役割。Open Vet. J. 2019;9:253-258. doi: 10.4314/ovj.v9i3.10. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Chaitman J., Gaschen F. Fecal Microbiota Transplantation in Dogs. Vet. Clin. N. Am. Small Anim. Pract. 2021;51:219-233. doi: 10.1016/j.cvsm.2020.09.012. [CrossRef] [Google Scholar].
健康と消化器疾患におけるイヌの腸内マイクロバイオームとメタボロームの役割。Front. Vet. doi: 10.3389/fvets.2019.00498. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Barko P.C., McMichael M.A., Swanson K.S., Williams D.A. The Gastrointestinal Microbiome: A Review. J. Vet. J. Vet. Intern. Med. 2018;32:9-25. doi: 10.1111/jvim.14875. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Menard J., Goggs R., Mitchell P., Yang Y., Robbins S., Franklin-Guild R.J., Thachil A.J., Altier C., Anderson R., Putzel G.G., et al. Effect of Antimicrobial Administration on Fecal Microbiota of Critically Ill Ill Dogs: Dynamics of Antimicrobial Resistance over Time. Anim. Microbiome. doi: 10.1186/s42523-022-00178-9. [このような背景のもと、犬における抗菌薬耐性の経時的な変化について検討した。
Salavati Schmitz S. 犬の糞便微生物叢移植に関する小動物診療医の意識、臨床実践および経験に関する観察研究。Top. Companion Anim. Med. 2022;47:100630. doi: 10.1016/j.tcam.2022.100630. [PubMed] [CrossRef] [Google Scholar].
イヌの慢性炎症性腸症の管理のための非薬理学的治療戦略-ナラティブレビュー。Vet. この論文では、「犬の慢性炎症性腸症の管理における非薬物療法戦略-ナラティブレビュー-」を掲載した。[PMC free article] [PubMed] [CrossRef] [Google Scholar].
Chaitman J., Ziese A.L., Pilla R., Minamoto Y., Blake A.B., Guard B.C., Isaiah A., Lidbury J.A., Steiner J.M., Unterer S., et al. Fecal Microbiota Transplantation or Oral Metronidazoleのいずれかを受けた急性下痢犬の糞便中微生物および代謝プロファイル。Front. Vet. doi: 10.3389/fvets.2020.00192. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ペレイラG.Q.、ゴメスL.A.、サントスI.S.、アルフィエリA.F.、ウィースJ.S.、コスタM.C. 犬パルボウイルス感染子犬における糞便微生物叢移植。J. Vet. Intern. Med. 2018;32:707-711. doi: 10.1111/jvim.15072. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Case Report Faecal Microbiome Transplantation as a Solution to Chronic Enteropathies in Dogs: A Case Study of Beneficial Microbial Evolution. Animals. 2021;11:1433. doi: 10.3390/ani11051433. [PMC無料論文] [PubMed] [CrossRef] [Google Scholar].
Dandrieux J.R.S., Mansfield C.S. Chronic Enteropathy In Canines: Prevalence, Impact And Management Strategies. Vet. Med. Res. Rep. 2019;10:203-214. doi: 10.2147/VMRR.S162774. [CrossRef] [Google Scholar].
Stool Form Scale as a Useful Guide to Intestinal Transit Time. Scand. J. Gastroenterol. 1997;32:920-924. doi: 10.3109/00365529709011203. [PubMed] [CrossRef] [Google Scholar].
Alves J.C., Jorge P., Santos A. A Survey on the Prevalence of Diarrhea in a Portuguese Population of Police Working Dogs. BMC Vet. doi: 10.1186/s12917-021-02920-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
特発性炎症性疾患の犬16頭における糞便微生物叢。Veterinaria. 2017;31:1-12. [Google Scholar].
Redfern A., Suchodolski J., Jergens A. Role of the Gastrointestinal Microbiota in Small Animal Health and Disease. Vet. Record. Vet. 2017;181:370. doi: 10.1136/vr.103826. [PubMed] [CrossRef] [Google Scholar].
QIAGEN . QIAamp® PowerFecal® Pro DNA Kit Handbook. QIAGEN; Hilden, Germany: 2020. [2022 年 10 月 12 日アクセス)]. Available online: https://www.qiagen.com/us/resources/download.aspx?id=8896817a-253f-4952-b845-0aab796813ce&lang=en [Google Scholar].
DeAngelis M.M., Wang D.G., Hawkins T.L. Solid-Phase Reversible Immobilization for the Isolation of PCR Products. Nucleic Acids Res. 1995;23:4742-4743. doi: 10.1093/nar/23.22.4742. [PMCフリー記事] [PubMed] [CrossRef] [Google Scholar].
SPRI Beads-Based Size Selection in the Range of 2-10 kb. J. Biomol. Tech. 2020;31:7-10. doi: 10.7171/jbt.20-3101-002. [このような研究成果をもとに、バイオメディシンの研究開発を進めている。
オックスフォード・ナノポア・テクノロジーズ. 微生物ゲノム研究におけるナノポアシーケンシングの利点. Oxford Nanopore Technologies; Oxford, UK: 2018. (accessed on 23 May 2022)]. Available online: https://nanoporetech.com/sites/default/files/s3/NAN100043_Microbiome_White_Paper_020818_ml_DIGITAL.pdf [Google Scholar].
Ramette A. Multivariate Analyses in Microbial Ecology. FEMS Microbiol. Ecol. 2007;62:142-160. doi: 10.1111/j.1574-6941.2007.00375.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jarett J.K.、Kingsbury D.D.、Dahlhausen K.E.、Ganz H.H. コンパニオンアニマル研究におけるマイクロバイオーム研究デザインのベストプラクティス。Front. Vet. この論文では、動物実験におけるマイクロバイオーム研究のベストプラクティスを紹介する。[このような研究は、動物実験に限らず、様々な分野で行われている。
肥満犬・痩せ犬の糞便微生物叢(Faecal Microbiota in Lean and Obese Dogs. FEMS Microbiol. Ecol. 2013;84:332-343. doi: 10.1111/1574-6941.12067. Google Scholar] [PubMed] [CrossRef] [Google Scholar] [PubMed] [CrossRef] [Google Scholar].
イヌとネコの福祉における微生物叢とプロバイオティクス。Anaerobe. 2015;34:14-23. doi: 10.1016/j.anaerobe.2015.04.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Allenspach K., Wieland B., Gröne A., Gaschen F. 犬の慢性腸炎:ネガティブな転帰の危険因子の評価. J. Vet. Intern. Med. 2007;21:700-708. doi: 10.1111/j.1939-1676.2007.tb03011.x. [PubMed] [CrossRef] [Google Scholar].
URAL K. 犬のアトピー性皮膚炎に対する経口投与による糞便微生物叢移植カプセル療法. Ank. Üniversitesi Vet. Fak. Derg. doi: 10.33988/auvfd.822971. [CrossRef] [Google Scholar].
Fowler M., Shiau D.-S., Xie H. A Randomized, Controlled Study Comparing Da Xiang Lian Wan to Metronidazole in the Treatment of Stress Colitis in Sheltered/Rescued Dogs. Am. J. Trad. Chin. Vet. Med. 2017;12:45-54. [Google Scholar].
AnimalBiome . The Promise of Fecal Transplants-A Microbiome Solution for Veterinary Practitioners. AnimalBiome; Oakland, CA, USA: 2019. Smart Focus on Animal Health. [Google Scholar].
Pereira A.M., Clemente A. Dogs' Microbiome From Tip to Toe. Top. コンパニオンアニマル。Med. 2021;45:100584. doi: 10.1016/j.tcam.2021.100584. [PubMed] [CrossRef] [Google Scholar].
炎症性腸疾患の犬における糞便微生物叢移植後の臨床症状と糞便微生物叢の改善.Vet. Med. Res. Rep. 2019;10:197-201. doi: 10.2147/VMRR.S230862. [CrossRef] [Google Scholar].
Honneffer J.B., Minamoto Y., Suchodolski J.S. Microbiota Alterations in Acute and Chronic Gastrointestinal Inflammation of Cats and Dogs. World J. Gastroenterol. 2014;20:16489-16497. doi: 10.3748/wjg.v20.i44.16489. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
下痢をした犬の糞便検体におけるClostridium Perfringens、Clostridium Perfringens EnterotoxinおよびDysbiosisの有病率.Vet. Microbiol. 2014;174:463-473. doi: 10.1016/j.vetmic.2014.10.005. [PubMed] [CrossRef] [Google Scholar].
Ziese A.L., Suchodolski J.S. Impact of Changes in Gastrointestinal Microbiota in Canine and Feline Digestive Diseases. Vet. Clin. N. Am. Small Anim. Pract. 2021;51:155-169. doi: 10.1016/j.cvsm.2020.09.004. [CrossRef] [Google Scholar].
Aboim C. 修士論文。University of Lisbon; Lisbon, Portugal: 2019. 健康な犬と猫の腸内マイクロバイオーム。[Google Scholar].
ガードB.C.、バーJ.W.、レッドディヴァリL.、クレマシェヴィッチC.、ジャヤラマンA.、スタイナーJ.M.、バナマラJ.、スチョドルスキーJ.S.急性下痢の犬における微生物性ディスバイオシスとメタボローム変化の特性化。PLoS ONE. 2015;10:e0127259. doi: 10.1371/journal.pone.0127259. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
コンパニオンアニマルシンポジウム: Microbes and Gastrointestinal Health of Dogs and Cats. J. Anim. Doi: 10.2527/jas.2010-3377. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Blake A.B., Suchodolski J.S. 犬猫の健康と病気における腸内細菌叢の重要性. Anim. Front. 2016;6:37-42. doi: 10.2527/af.2016-0032. [CrossRef] [Google Scholar].
Pilla R., Suchodolski J.S. The Gut Microbiome of Dogs and Cats, and the Influence of Diet. Vet. Clin. N. Am. Small Anim. Pract. 2021;51:605-621. doi: 10.1016/j.cvsm.2021.01.002. [PubMed] [CrossRef] [Google Scholar].
AlShawaqfeh M.K., Wajid B., Minamoto Y., Markel M., Lidbury J.A., Steiner J.M., Serpedin E., Suchodolski J.S. A Dysbiosis Index to Assess Microbial Changes in Fecal Samples with Dogs with Chronic Inflammatory Enteropathy. FEMS Microbiol. Ecol. 2017;93:fix136. doi: 10.1093/femsec/fix136. [PubMed] [CrossRef] [Google Scholar].
Genesからの記事はMultidisciplinary Digital Publishing Institute (MDPI)の提供によりここに提供されます。
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ、メリーランド州20894
ウェブポリシー
情報公開
HHS脆弱性情報公開
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
保健省
USA.gov
ご意見をお聞かせください!
この記事が気に入ったらサポートをしてみませんか?
