胆汁性肝疾患における腸内細菌叢と胆汁酸のクロストーク
オープンアクセスレビュー
胆汁性肝疾患における腸内細菌叢と胆汁酸のクロストーク
https://www.mdpi.com/2072-6643/15/10/2411


著
Qingmiao Shi
†,
Xin Yuan
†,
Yifan Zeng
†,
ジンジー・ワン
,
Yaqi Zhang
,
チェン・シュエ
そして
李 蘭娟
*
浙江大学医学部第一付属病院感染症診断治療共同イノベーションセンター感染症診断治療国家重点実験室、国立感染症臨床研究センター、国立感染症医療センター、杭州310003、中国
*
Author to whom correspondence should be addressed.
†
これらの著者は、この仕事に等しく貢献した。
栄養素 2023, 15(10), 2411; https://doi.org/10.3390/nu15102411
受理された: 19 April 2023 / Revised: 13 May 2023 / Accepted: 20 May 2023 / Published: 22 May 2023
(この記事は、特集「栄養、腸内細菌叢とメタボリズム」に属しています)
ダウンロード
図表を見る
バージョン情報
要旨
コレステロール代謝の重要な最終産物である胆汁酸と腸内細菌叢との間に複雑な相互作用があることが、新たな証拠によって示唆されている。胆汁酸性肝疾患は、胆汁の生成、分泌、排泄の機能障害と、潜在的に有毒な胆汁酸の過剰蓄積を特徴とする。胆汁酸のホメオスタシスの重要性を考えると、胆汁酸-微生物ネットワークの複雑なメカニズムが、胆汁酸性肝疾患において徹底的に理解される必要がある。この分野での最近の研究進展をまとめることは急務である。本総説では、腸内細菌叢が胆汁酸代謝をどのように制御しているか、胆汁酸プールが細菌群をどのように形成しているか、そしてそれらの相互作用が胆汁酸性肝疾患の病態にどのように寄与しているかを明らかにします。これらの知見は、胆汁酸経路を標的とした潜在的な治療戦略の開発に新たな視点を提供するものと思われる。
キーワード
胆汁酸、腸内細菌叢、胆汁酸性肝疾患、クロストーク
はじめに
近年、健康や病気に対する腸内細菌の貢献が認識されつつある[1,2]。ヒトの腸内には、多種多様な共生菌やその他の微生物を含む多様で複雑な微生物群集が存在し、これらを総称して「腸内細菌叢」と呼んでいる[3,4]。腸内細菌叢を構成する微生物は100兆個とも言われ、ファーミキューテスとバクテロイデーテスが腸内細菌叢の90%以上を占めています [5]。腸内細菌叢は、バリア機能、代謝機能、免疫調節などに重要な役割を担っています。[6]. 例えば、微生物は宿主と協力して多数の代謝物やシグナル伝達因子を産生し、宿主の消化や代謝に関与しています [7,8]。腸内細菌叢は、二次胆汁酸(BAs)を産生できることから、宿主の生理状態に影響を与える「内分泌器官」と考えることができる、という研究もあります[9]。
BAsは腸内細菌の重要な代謝産物であり、その生体内変換は腸内細菌と密接に関連しています。肝臓でコレステロールがBAsに変換されると、BAsはタウリンまたはグリシンの結合体として胆道を通って腸管内腔に分泌されます [10,11]。十二指腸では、BAsは主に脂質の消化吸収に関与し、一方、回腸および結腸では、BAsは腸内細菌叢の影響下で生物変換され[12]、その後、腸肝循環に再吸収される。BAのホメオスタシスの調節不全は、腸内細菌叢の豊富さ、組成、代謝活性に影響を与え、それによって炎症性腸疾患(IBD)、肝臓疾患、代謝疾患、Clostridium difficile感染、腫瘍などの複数の疾患の発症に影響を与える[10, 13, 14, 15, 16, 17, 18]. 腸内細菌は、一次BAの代謝に重要な役割を果たし、脱共役やジヒドロキシル化などの様々な修飾を誘導することで、BAプールの多様性に寄与しています[19]。さらに、腸内細菌叢は、ファルネソイドX受容体(FXR)や膜貫通型Gタンパク質共役受容体5(TGR5)経路などのシグナル伝達経路を調節することにより、BA合成や宿主代謝に影響を与えることができます。また、BAsとその受容体は、腸内細菌叢を制御する[20,21,22,23,24]。これらの知見は、腸内細菌叢とBAsの間の複雑な相互作用を示唆している。
胆汁性肝疾患(CLD)とは、免疫学的要因、遺伝的要因、薬学的要因、環境影響などの様々な要因によって、胆汁の生成、分泌、排泄が障害され、BAが十二指腸に入ることができなくなる肝胆道疾患の分類を含む言葉です[25]。CLDには、主に原発性胆汁性胆管炎(PBC)、原発性硬化性胆管炎(PSC)、閉塞性胆汁うっ滞が含まれます[26]。PBCとPSCの病因は主に免疫学的および遺伝学的な要因が関与しており、乾癬、関節リウマチ、IBDなど他の自己免疫疾患を伴うことが多い[27]。ウルソデオキシコール酸(UDCA)はCLDの治療の第一選択薬である。しかし、現在進行中の研究では、「良好な生化学的反応」を示さない患者に対する追加の治療選択肢の特定に焦点が当てられている[25, 28, 29]。いくつかの研究により、CLD患者における肝臓へのBAsの過剰な沈着と腸内細菌叢の組成および多様性の大幅な変化が検証されています[30, 31, 32, 33, 34]. BAsの異常な沈着は、腸肝循環を通じて腸内細菌叢のホメオスタシスに影響を与えることが観察されており [35]、腸内細菌叢は、今度はBAsを代謝的に分解してBAプールの組成に影響を与えることが示されている。
ここ数年、CLDにおけるBAと腸内細菌叢の役割を調査する研究が顕著に急増している [19,36,37,38] 。ここでは、CLDにおける腸内細菌叢とBAsの相互作用に関する既存の研究の要約を提供する。このレビューは、CLDの潜在的な治療標的としてのBAシグナルネットワークの新規メカニズムの理解に貢献する可能性があります。BAホメオスタシス
2.1. BAsの合成
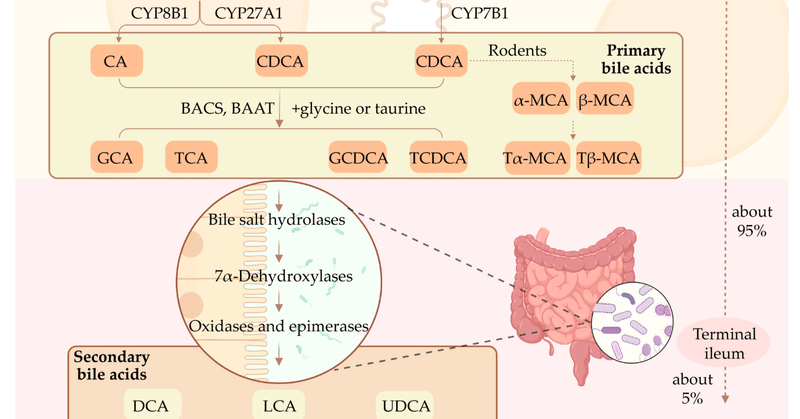
BA類は、肝周縁部のチトクロームP450(CYP)を介したコレステロールの異化により、2つの主要な生合成経路を経て合成される(図1) [39] 。古典的な」経路は、まずコレステロール7α-ヒドロキシラーゼ(CYP7A1)が肝コレステロールに作用して7α-ヒドロキシコレステロールを生成し、その後CYP8B1およびCYP27A1が触媒となって、それぞれコール酸(CA)およびチェノデオキシコール酸(CDCA)という一次BAを形成する [40]. ネズミの肝臓では、CDCAの大部分はα-ムリコール酸とβ-ムリコール酸に変換される[41]。代替経路は、ミトコンドリアのCYPであるステロール27-ヒドロラーゼ(CYP27A1)がコレステロールの側鎖を水酸化することから始まり、CYP7B1を介して27-ヒドロキシコレステロールを7α-水酸化することによりCDCAを生成する[42]。その後、BA-コエンザイムA(BA-CoA)合成酵素とBA-CoA:アミノ酸N-アシルトランスフェラーゼが、アミノ酸のタウリンやグリシンと統合した一次BAをタウロコール酸(TCA)、タウロヘノデオキシコール酸、グリシンコール酸(GCA)、グリコヘノデオキシコール酸に変換します [16].
図1. 胆汁酸の合成と腸肝循環。肝細胞における一次胆汁酸の合成経路と腸における二次胆汁酸の代謝経路を模式的に示したものである。胆汁酸の約95%は門脈から再吸収され、約5%は受動拡散により再吸収される。
2.2. BAsの肝内循環
肝臓で合成され、または腸肝循環に吸収された一次BAsは、胆汁塩輸出ポンプ(BSEP)または多剤耐性関連タンパク質2(MRP2)によって胆管に活発に輸送される [43,44,45]. 食後、胆嚢は収縮してBAsを腸内に放出し、小腸での脂質の乳化と吸収を助ける。腸内細菌の働きにより、一次BAsはデオキシコール酸(DCA)、リトコール酸(LCA)、UDCAといった二次BAsに変換される。その後、非共役BAのごく一部は前小腸で受動拡散により再吸収されるが、95%のBAは終末回腸でapical sodium-dependent BA transporter (ASBT) [46] を介して効率的に再吸収され、回腸BA結合タンパク質を通じて基底側膜に輸送される。その後、有機溶質トランスポーター-α/β(OSTα/β)により、門脈血行へのBAsの流入が促進される[47]。最終的に、BAsは肝臓のタウロコール酸ナトリウム共輸送ポリペプチド(NTCP)、有機アニオン輸送ポリペプチド1(OATP1)、OATP4を介して肝細胞に再吸収される[48]。この一連の過程は腸肝循環と呼ばれ、BAsのホメオスタシスに重要な役割を担っている。
2.3. BAシグナルレセプター
BAsは様々な受容体を介して細胞間コミュニケーションを実現します。BAsは、FXR、プレグナンX受容体(PXR)、構成性アンドロスタン受容体(CAR)、ビタミンD受容体(VDR)などの核内受容体や、TGR5、スフィンゴシン-1-リン酸受容体2(S1PR2)などのいくつかのGタンパク質共役受容体(GPCR)[49、50]を直接活性化することができます。
FXRは遊離型および抱合型BAsの主要な受容体であり、肝細胞および腸で高発現している[51]。BAsによるFXRの活性化は、律速酵素CYP7A1の発現を阻害し、BA合成の負のフィードバック制御を媒介することができる。研究によると、腸管FXRシグナルが線維芽細胞増殖因子(FGF)15/19を活性化し、門脈から肝臓に循環して肝細胞表面のFGF受容体に結合し、Jun N末端キナ依存経路を介してCYP7A1の遺伝子転写を阻害し、それによって肝臓でのBA合成を阻害することが示されている[52,53]。逆に、肝臓におけるFXRの活性化は、小さなヘテロダイマーシャペロンの転写を誘導し、肝臓受容体ホモログ-1と肝細胞核因子-4αを阻害し、CYP7A1の転写抑制をもたらす [54]. さらに、FXRの活性化は、BA排出トランスポーターであるBSEP、MRP2、OSTα/βの発現をアップレギュレートし[55,56,57]、BA取り込みトランスポーターのASBTとNTCPの発現をダウンレギュレートし[58]、肝細胞へのBA蓄積を防止する。
TGR5はBA特異的GPCRの一種で、腸管上皮、肝類洞内皮、肝マクロファージ、クッパー細胞で発現している [59,60] 。TGR5のリガンドは主にLCA、DCA、CDCA、CAであり、エネルギー恒常性の調節やインスリン感受性の改善に重要な役割を果たす[61,62]。PXR、CAR、VDRは、BAの解毒とクリアランスにおいて同様の機能を持つ核内受容体と密接な相関があります[63]。S1PR2は主に肝細胞に発現し、ネズミの肝細胞において、そのリガンド、すなわち共役BAと結合することにより、細胞外調節タンパク質キナーゼ1/2およびタンパク質キナーゼBシグナル伝達経路を活性化することが示されている [64、65]。BA代謝に及ぼす腸内細菌叢の影響
3.1. 腸内細菌叢はBAプールの組成を変化させることができる
腸内細菌叢は、BAのホメオスタシスにおいて重要な因子と考えられており、BAの化学的性質に大きく影響する。具体的には、腸内細菌は、様々な酵素の作用により、脱水素化、二水素化、脱硫を経て、BAプールの組成を変化させることが明らかにされている。
3.1.1. 胆汁酸ヒドロラーゼ (BSH)
BA二次代謝の第一段階は、BSHによるアミド結合の加水分解である。BSHはBSH遺伝子[66]によってコードされる細胞内酵素であり、微生物が成長・増殖する際に合成される代謝産物である。BSHは酸素に鈍感で、その活性に最適なpHは5〜6にある[67,68]。BSHは、胆汁酸塩のステロイド結合核のグリシン部分とタウリン部分をつなぐアミド結合を切断し、未結合のBAsを放出する。その後、腸内細菌叢は7α-デヒドロキシル化によってこれらのBAsを代謝し、最終的に二次および三次BAsを生成する [69,70].
BSHは、Clostridium、Bifidobacterium、Lactobacillus、Bacteroidetes、Enterococcusなど、複数の系統の様々な微生物種で確認されています。また、BSHの存在は、ヒトの腸の古細菌でも実証されている[71]。BSHが放出するアミノ酸は、特定の細菌種のエネルギー源として機能し、その活性は、微生物の胆汁耐性と胃腸環境のコロニー形成に寄与すると考えられています [72]。
3.1.2. ヒドロキシステロイド脱水素酵素(HSDH)
ヒトはα-指向性水酸基を含むBAを産生するが、腸内細菌はこれらのBAをDCAのような有害な疎水性BAに生変換することを促進することができる。ピリジンヌクレオチド依存性のHSDHは、CAの3-、7-および12-水酸基を可逆的に酸化してオキソBA中間体を生成し、より親水性で有害性の低いBAを生成しやすくすることができる。BAを認識するHSDH酵素は、領域および立体特異的な性質を示し、ステロイド核の水酸基を修飾することができる[73]。現在までに、HSDH活性はBacteroidetes、Eubacillus、Clostridium、Bifidobacterium、Lactobacillus、Streptococcus peptidis、Escherellaなど、様々な細菌で観察されている[74,75,76]。また、12ɑ-HSDH、7ɑ-HSDH、3ɑ-HSDHのようなBA経路に関連する遺伝子も報告されている [77,78].
3.1.3. 7α-デヒドロキシル化酵素
7α-デヒドロキシラーゼを用いて、大腸の細菌は一次BAであるCAとCDCAをそれぞれDCAとLCAに変換し[79]、両者は終末回腸で一部再吸収されて肝臓に輸送されます。7α-デヒドロキシル化は正味の還元過程であるため、デヒドロキシル化した細菌のエネルギー代謝における重要な電子受容反応と考えられている [80,81]。7α-デヒドロキシラーゼは低存在量の嫌気性細菌にのみ存在し、複数のステップがbai遺伝子群にコードされたBA誘導性酵素によって触媒される [82].baiを発現する細菌の多くは、Ruminococcus属に属する。クロストリジウムでは、bai遺伝子のオペロンbaiA-Jの配列が決定され、bai遺伝子がコードする酵素が同定されている。詳細には、BA 7α-HSDHはbaiE遺伝子にコードされており、7β-HSDHはbaiI遺伝子にコードされている可能性がある[9,79,83,84]。
3.1.4. その他の酵素
エステル化されたBAsは、糞便中のBAs総量の25%以上を占めると考えられる。BAsのエステル化は、これらの分子をより疎水性かつ不溶性にし、その結果、糞便中の濃度を低下させる[85]。BAの脱硫に関与する細菌属には、ClostridiumとGastrococcusが含まれる。しかし、エステル化および脱硫における腸内細菌叢の役割は、依然として不明である[82]。
3.2. 腸内細菌叢はFXRシグナル分子を介してBA代謝に影響する
腸内細菌叢は、BAの変換とBA再吸収の制御に関与している。腸内細菌叢は、BAsの脱離、脱水素、脱水素に関与するだけでなく、FXR-FGF15/19経路を通じてBA合成をネガティブに制御する [86]. BAsは肝臓でコレステロールから合成され、さらに腸内細菌叢によって二次BAsに代謝される。回腸と肝臓の核内受容体FXRの活性化は、BA産生の負のフィードバック制御を変調させる。
Sayinらは、無菌マウスと通常食(CONV-R)マウスの腸肝系全体のBAプールの組成を分析し、CONV-Rマウスはムリコール酸のレベルが有意に低下するがCAは低下しないことを検証している[87]。腸内細菌叢は、FXR依存的なメカニズムを通じて、回腸のFGF15と肝臓のコレステロール7α-水酸化酵素(CYP7A1)の発現を制御する。Sunらは、新たに2型糖尿病(T2D)と診断された患者の便サンプルを用いて、メタゲノム解析とメタボローム解析を実施しました[88]。その結果、3日間のメトホルミン投与後、腸内のBacteroides fragilisの存在量が減少し、BAマンデオキシコール酸(GUDCA)の濃度が上昇したことが明らかになりました。これらの変化は、腸内のFXRシグナルの阻害と相まって、B. fragilis-GUDCA-腸内FXR軸を操作することで代謝機能障害を改善できる可能性が示唆されました。さらに、60%の高脂肪食(HFD)を与え、抗生物質を投与したハムスターを用いた別の研究では、腸内細菌叢の消失に起因する腸内TMCAレベルの上昇と二次BAレベルの低下が、腸内FXRシグナルの阻害と代謝障害の改善をもたらすことが示されました [89]。これらの研究は、腸内細菌叢がFXRシグナル分子を介してBA代謝に影響を与えることを示し、FXRがBAホメオスタシスを制御する重要なターゲットとなり得ることを示唆しています。BAが腸内細菌叢に与える影響
BAプールのサイズと多様性は、腸内細菌叢に影響を与える可能性があります。CAはラットの腸内細菌叢の構成を門レベルで変化させ、ファーミキューテスの数の増加とバクテロイデーテスの数の減少をもたらすことが研究で示されている [67]. 二次胆汁酸塩の補給と比較して、Ctenopharyngodon idellusの飼料に一次胆汁酸塩を補給すると、胆汁性BAsの組成がより変動することが示されている [90].一次胆汁酸は腸内細菌叢の多様性を高め、細菌叢の継承を誘導するのに対し、二次胆汁酸は堅果類とバクテロイデーテスの比率を増加させる。ヒトにおいては、BAsは出生後の腸内細菌叢の組成に影響を与える宿主因子として同定されている。UDCA、GCA、TCAは、加齢に伴う腸内細菌叢の組成の変化と有意な相関があることが分かっています。これらの知見と一致して、TCAの経口投与は、新生児マウスの生後マイクロバイオータの成熟を促進することが示されている[91]。
BA類は、腸内細菌叢に対して毒性作用を有する。細菌の細胞膜を傷つけることに加え、BAsはタンパク質のコンフォメーションに影響を与え、タンパク質のミスフォールディングや変性を引き起こす可能性がある。さらに、DNA損傷を誘発し、DNA修復関連酵素を活性化するほか、酸素フリーラジカルを生成して、酸化ストレスを引き起こす可能性もある[92]。腸内細菌は、適応反応によってBAによるダメージに抵抗することができるが、そのためには、細胞外皮の構造や細胞内の動的バランスの維持に関与するタンパク質を含むいくつかのタンパク質が必要となる可能性がある [92]。さらに、BAsは粘膜免疫応答や腸管上皮細胞の完全性に影響を与え、それによって微生物群集の組成と多様性を間接的に制御することができる。
腸内細菌叢の組成に対するBAsの効果は、FXRによっても調節され得る。FXRを介して、BAsは誘導性一酸化窒素合成酵素の発現とインターロイキン18の発現と分泌をアップレギュレートし、それによって腸内微生物の増殖を防止することができる[93]。稲垣らは、FXRが胆管結紮による回腸の細菌過剰増殖と粘膜損傷を抑制し、腸管防御に関わる遺伝子を活性化し、遠位小腸の細菌侵入に対する保護に重要な役割を果たすことを明らかにした[94]。さらに、FXR-/-マウスと野生型マウスでは、BAプールと糞便微生物叢の組成が異なることが研究で示されている[95]。FXR欠損マウスの腸内細菌叢は、Bacteroidetesの存在量が増加し、Firmicutesの存在量が減少するという特徴があり、BAがFXRシグナル伝達経路を通じて腸内細菌叢の組成に影響を与えることが示されています。さらに、オベチコール酸(OCA)が内因性BA合成を阻害し、グラム陽性菌の可逆的な誘導を引き起こし、DNA合成とアミノ酸代謝に関連する微生物ゲノム経路の性能を改善することが臨床研究で示されました[96]。動物実験では、OCAを与えたマウスは、小腸において内因性BAsのレベルが低下し、ファーミキューテスの存在量が増加することが示されています[96]。CLDにおけるBAと腸内細菌叢の相互作用の影響とメカニズム
CLDは、免疫、遺伝、環境要因などによって引き起こされる肝胆道疾患の一種で[25]、肝臓内外の胆汁の生成、分泌、排泄が障害され、十二指腸への胆汁の流入と血液への流入が妨げられる。CLDは、急性と慢性に分類されます。急性CLDは総胆管結石や悪性腫瘍が原因となることがあり、一方、慢性CLDは遺伝性胆汁性疾患、PBC、PSC、二次性硬化性胆管炎などがあり[35]、肝外および/または肝内胆管が関与する[97]。PBCとPSCの両患者において、微生物の多様性の低下が観察されました[30,31]。CLDにおいて、異常なBAが腸内細菌叢を変化させる主なメカニズムは、腸管バリアの直接的な損傷、免疫による組織攻撃、細菌の細胞膜の損傷、FXR結合による抗菌ペプチド分泌の促進、種間で異なるBAに対する耐性、などです。[32,35]. BAsと腸内細菌叢の相互作用は、CLDにおいて重要な役割を担っている(図2)。
図2. 胆汁性肝疾患における胆汁酸と腸内細菌叢の相互作用。免疫反応、遺伝的要因、環境、医薬品など多くの危険因子が、一次胆汁酸の合成、分泌、排泄の機能不全を引き起こし、胆汁うっ滞性肝疾患を引き起こすと考えられています。一次胆汁酸は、抗菌作用やエネルギー源として腸内細菌叢に影響を与えます。腸内細菌叢は、腸内に排出される一次胆汁酸の代謝・合成に関与している。
5.1. PBC
PBCは、抗ミトコンドリア抗体の存在と小葉間胆管の進行性破壊を特徴とする自己免疫性肝疾患である[98]。PBC患者と健常者の間では、腸内細菌叢の組成と機能に大きな違いがある。PBC患者は、Clostridiumの存在量が減少し、Lactobacillusの存在量が増加するという、不均衡な腸内細菌叢を示す[99]。PBCと新たに診断された患者では、Haemophilus、Veillonella、Clostridiumなどの複数の属の存在量が著しく増加しています。UDCA治療により腸内細菌叢の組成が変化し、PBC患者の細菌異常症が部分的に改善されることが判明している[31]。
PBCにおける腸内細菌叢のアンバランスは、BAプールの変化と関連している。UCDAで治療したPBC患者における腸内微生物の存在量は、ビリルビン濃度に応じて変化します[100]。PBCは、共役BAから非共役BA、一次BAから二次BAへの変換率の低下とも関連する。PBC患者では、DCAや共役DCAなどの二次BAsの濃度は、VeillonellaやKlebsiellaなどの腸内微生物の増加量と負の相関があり、FaecalibacteriumやOscillospiraなどの健常者に多い微生物と正の相関があります。UDCA治療後、患者は血清中のタウリン結合型BAsの減少、タウリン代謝細菌Bilophila属の有意な増加、FGF19の有意な減少を示す[101]。
PBCでは、BAsはFXRおよびTGR5経路を活性化することにより、肝臓再生を促進することができる[102]。LXR経路の活性化は、肝類洞内皮細胞による毛細血管形成を妨げ、細胞外マトリックスの生成を抑えて線維化を防止する[103]。しかし、BAsのレベルの過剰な上昇は、細胞の壊死とアポトーシスを悪化させ、最終的に線維化をもたらす[104]。PBCにおけるBAプールと腸内細菌叢の組成の異常は、BA代謝およびBAプール組成と腸内細菌叢の組成との間に複雑なクロストークが存在することを示し、これはPBCの基礎メカニズムの解明と治療にとって極めて重要な意味を持っている。
5.2. PSC
PSCは慢性的なCLDであり、胆道炎症と管周囲線維化を特徴とする[105]。PSCは一般的に進行性で、胆汁うっ滞や肝不全などの合併症の発症につながることがあります。PSCは潰瘍性大腸炎と関連し、胆管癌を併発することもある。肝移植を行わない患者さんの場合、診断後の生存期間中央値は約10年です。
PSC患者は、腸内細菌叢の多様性の低下を示し、IBDやUDCA治療とは無関係に、Enterococcus、Fusobacterium、Lactobacillusの存在比が有意に増加する。さらに、Enterococcusの操作上の分類単位は、疾患の重症度を示す血清アルカリホスファターゼ(ALP)値の上昇と正の相関があることが判明しています[30]。PSC患者の胆汁中のEnterococcusの多さは、毒性二次BA TCAの濃度と密接に関連している[38]。IBDを伴うPSC患者(PSC-IBD)における大腸癌のリスクは非常に高い[106]。PSC-IBD患者の腸内細菌叢の組成は、IBD患者のそれとは異なっている。詳細には、Ruminococcus菌とFusobacterium菌の存在量が増加し、Dorea、Veillonella、Lachnospira、Blautia、Roseburia菌の存在量が減少する。さらに、微生物相と糞便中のBA含量の間に特定の相関があることが解明されている[106]。
PSCマウスモデルでは、腸内細菌叢の欠如が肝胆道系疾患を悪化させることが示されている[107]。腸内細菌叢のアンバランスは、腸管バリア機能障害と細菌の移動の増加をもたらし、その結果、NOD様受容体タンパク質3を通じて肝臓疾患の進行を促進する [34] 。mdr2-/-マウスおよびPSC患者において、糞便中のLachnospiraceaeはPSCの臨床的重症度と負の相関があり、Enterococcus faecalisおよびEnterobacteriaceaeはPSCの臨床的重症度と正の相関がある。回腸BA輸送の阻害は、抗生物質による肝疾患の進行を緩和し、血清および肝臓のBA総含有量を減少させる[108]。遺伝的PSCマウスモデルにおいて、微生物枯渇はFXRシグナル伝達を障害し、その後、胆汁性肝障害を悪化させることが示されている。その後、BA合成の負のフィードバック制御の欠如により、肝臓のBA濃度が上昇し、胆管バリア機能が損なわれます[109]。PSCにおけるプレボテラの介入は、FXRシグナル伝達経路を強化し、胆汁うっ滞と肝線維症の改善につながることが報告されている[110]。
5.3. 閉塞性胆汁うっ滞
胆道閉塞症は、一般的に胆道系の閉塞を指し[111]、その結果、肝臓から腸への胆汁の流れが阻害される。肝内胆道系の障害による胆汁の流れの遮断は、一般に胆汁うっ滞と呼ばれる。胆汁うっ滞は肝機能異常として現れ、黄疸やそう痒症に進行することがあります。胆道閉塞の最も一般的な原因は総胆管結石または胆石である。
胆石症患者29名と健常者38名を対象とした研究 [112] では、胆石症患者では、Proteobacteriaの存在量が著しく増加し、Faecalibacterium、Lachnospira、Roseburiaの存在量は減少していることが明らかになりました。さらに、胆石症患者における胆道細菌の多様性は腸内細菌よりも有意に高く、腸内細菌の操作分類単位のほとんどが胆道で検出されました。同様に、別の研究では、胆石患者の糞便中では、BAsの総濃度が高く、微生物の多様性が低く、Roseburiaの存在量が減少し、Oscillospiraの存在量が増加していることが明らかになった[113]。さらに、胆嚢摘出術は、糞便中のバクテロイデーテスの存在量の増加をもたらすことが示されている。
Wuらは、マウスモデルで胆道閉塞、排液、胆汁再注入の過程をシミュレーションし、胆道閉塞の発生にもかかわらず、マウスは二次的なBAを生成し続け、そのレベルは肝臓と血清の両方で増加することを発見しました。12日間の胆道閉塞の後、Ruminococcus_1の存在量が増加することが観察された[114]。別の研究では、胆石患者のDesulfovibrionalesを豊富に含む糞便微生物叢を胆石耐性系統のマウスに移植し、胆石形成を誘導した [115] 。DesulfovibrionalesはBAプールに影響を与え,二次BAの産生を増加させ,腸管コレステロールの吸収を促進し,その代謝物H2SはFXR発現を促進し,CYP7A1発現を阻害した.また、Desulfovibrionalesを保有するマウスでは、コレステロールの胆汁分泌を促進するコレステロールトランスポーターAbcg5/g8の発現が確認された。新規FXRアゴニストであるTC-100は、腸肝軸でFXRを活性化し、血清や胆汁のBAプールを小さくし、より親水性の高いBAに変換し、腸管粘膜障害を予防することが明らかにされている。さらに、TC-100を投与したマウスでは、ファーミキューテスとバクテロイデーテスの比率が徐々に増加することが示されている[116]。
一般に、CLDでは、腸内細菌叢はBAと相互作用することで疾患の進行に影響を与える。BA代謝に影響を与える薬剤や腸内細菌叢を変化させる薬剤は、これらの疾患の治療に用いられる可能性があります。疾患と腸内細菌の関係をより深く理解することは、治療戦略を立てる上で非常に重要である。治療標的の可能性
腸内細菌叢を対象とした従来の介入法には、プレバイオティクス、プロバイオティクス、抗生物質、糞便微生物叢移植(FMT)などがあります[35]。プロバイオティクスは、CDCA、DCA、LCAを含むBA同化経路に広く関与し、FXRシグナルと腸内細菌叢の組成を制御することができる[117]ので、胆嚢症の補助治療として使用することができる可能性がある。マウスモデルを用いた実験では、プロバイオティクスであるLactobacillus rhamnosus GG(LGG)が、腸管FXR-FGF15シグナル伝達経路を活性化することによって肝臓BA合成を抑制しBA排泄を促進し、マウスにおける肝臓損傷と繊維化を防ぐことが示されました[118]。さらに、一連の動物実験により、妊娠性肝内胆汁うっ滞症[119]および胆汁性薬剤誘発性肝障害[120]の治療におけるLGGの大きな可能性が解明されました。動物実験では、胆管結紮(BDL)後に骨髄細胞2(TREM-2)に発現するトリガー受容体欠損マウスで観察された胆汁うっ滞の増加を抗生物質処理で部分的に解消しました [121]。この実験では、TREM-2が炎症の負の制御因子として、CLDの治療ターゲットとなりうることも示されました。PSC のマウスモデルに基づく別の研究では、多剤耐性 2 欠損(mdr2-/-)マウスにおいて、早期の FMT により死亡率が低下した [108].BAシグナルに基づくCLDに対するその他の潜在的な治療標的について、以下に詳細に説明する。
6.1. FXRアゴニスト
FXRの活性化は、肝細胞におけるBAsの合成を阻害し、肝細胞からのBAsの流出を増加させ、それによって肝細胞のBAsへの曝露を減少させ、胆汁うっ滞に対する重要な治療標的となっている[122]。現在、FXR活性化を標的とした薬剤としては、OCAなどのステロイド系FXRアゴニスト、cilofexor、tropifexor、MET409、EDP-305、EYP001などの非ステロイド系FXRアゴニストがあります。OCAは、UDCAに十分な反応を示さない、あるいは不耐性のCLD患者を治療するための最初のステロイドFXRアゴニストとして、米国食品医薬品局[123]および中国食品医薬品局から承認されています[124]。2023年3月、第IV相試験(NCT02308111)の予備結果が発表されたが、市販後試験のデザインは実現不可能であるとして、データモニタリング委員会の勧告により早期に終了した。しかし、そう痒症などの有害事象(AE)や、低比重リポ蛋白コレステロール値の上昇を伴う長期的な心血管安全性への懸念があり、OCAの臨床薬としての普及に影響を与える可能性がある[50]。
非ステロイド性FXRアゴニストは、現在激しい研究の対象となっており、多くの関連薬が開発されている。Cilofexorは、有効な非ステロイド性FXRアゴニストである。シロフェキサーを96週間投与された52名のPSC患者を含む新しい第II相試験(NCT02943460)では、シロフェキサーが肝生化学および胆汁うっ滞のバイオマーカーを改善することが示されました。具体的には、治療によりγ-グルタミルトランスペプチダーゼ(GGT)、アラニンアミノトランスアミナーゼ(ALT)、アスパルテートアミノトランスアミナーゼ(AST)などのレベルが低下したのです [125,126]. そのほか、PSCと診断された非出血成人における線維化進行リスクの低減におけるシロフェキソールの可能性を評価することを目的とした第III相ランダム化二重盲検臨床試験(NCT03890120)が現在進行中であり、結果はまだ報告されていない。Tropifexorは、もう一つの非ステロイド性FXRアゴニストです。UDCAで効果不十分なPBC患者61名を対象とした第II相臨床試験(NCT02516605)において、その有効性が検討されました。その結果、tropifexor群ではプラセボ群と比較して胆汁うっ滞マーカーが改善され[127]、最も多く見られたAEはそう痒症であった。現在までに、MET409、EDP-305、EYP001に関する研究は、主に非アルコール性脂肪肝炎(NASH)とB型肝炎を対象としており、CLDを対象とした研究はわずかである[128]。
6.2. ペルオキシソーム増殖剤活性化受容体(PPAR)アゴニスト
近年、PPARα作動薬のbezafibrate、PPARα/δ作動薬のelafibranor、PPARδ作動薬のseladelpar、PPARα/γ作動薬のsaroglitazarがCLDの治療法として検討されている。いくつかの研究では、UDCAとフィブラートの一種であるベザフィブラートの併用が、PBC患者の生化学的指標と長期転帰を改善できることが示されている[129,130]。重要なことに、オランダで行われた研究では、PSCおよびPBCの患者において、ベザフィブラートが血清ALP値の低下と関連するそう痒症の強さを軽減することが示されました [131]。そう痒症の緩和の基礎となる特定のメカニズムは、肝臓の胆汁うっ滞、サイトカインが介在する胆道炎症、および線維化の緩和が関与している可能性がある [132].PSCの治療を目的としたセラデルパーの臨床試験は、この薬を投与された数名の患者に肝障害が疑われたため、一旦中止された。それでも2022年、52週間の第II相臨床試験(NCT02955602)により、UCDAに反応しないか不耐性のPBC患者において、セラデルパーの投与がALPを改善することが実証されました [133]。12週間の第II相臨床試験[134]において、エラフィブラノールは、UDCAに反応しないPBC患者のALP、ビリルビン、GGTレベルを低下させることが確認されました。さらに、パンPPARアゴニストであるラニフィブラノールを実験的進行性慢性肝疾患の治療薬として用いた第II相臨床試験 [135] では、ラニフィブラノールが門脈圧亢進と肝線維化を改善したことから、CLD治療への応用が期待されています。
6.3. FGF19のアナログ
FGF19は回腸末端で発現し、腸肝循環を経て肝臓に到達し、FGFR4/βKlotho受容体複合体に結合する[128]。アルダフェルミンは、ヒトホルモンであるFGF19を非発がん性で操作した変異体である。FGF19アナログの開発当初の目的は、主にT2D患者の高血糖を改善することでしたが[136]、NGM(NGM Biopharmaceuticals, Inc. 近年、NGMはNASHとPSCの第II相臨床試験を完了しました。PSC患者62名を対象とした第Ⅱ相臨床試験において、NGM282投与群では肝線維化バイオマーカーが有意に減少し、NGM282の12週間投与後のALP値には差がなかった。Aldaferminは、BAsの合成を阻害し、肝臓のCYP7A1を阻害することにより、胆汁うっ滞から肝臓を保護する[137]。しかし、これらの薬剤の開発および適用における主な懸念は、胃腸症状と肝臓癌の潜在的リスクである。
6.4. その他
前節で述べた一般的な薬剤のほかにも、多くの種類の薬剤が存在する。例えば、ヒトPXRアゴニストとして有効なリファンピシンなど、様々なPXRアゴニストが存在する。現在、PBCおよびPSC患者のそう痒症の治療にリファンピシンおよびPPARアゴニストのベザフィブラートを使用することは、経験則によって支持されています [132] 。INT-767などのFXR/TGR5デュアルアゴニストは、NASHや糖尿病などの代謝性疾患に対する治療効果や、B型肝炎ウイルス感染の抑制効果が報告されている[138]。リシルオキシダーゼ様2を標的とするモノクローナル抗体simtuzumab [140]、デュアルケモカイン受容体-2(CCR2)/CCR5ケモカイン受容体拮抗薬cenicriviroc [128] のPSCに対する治療効果を探索する第Ⅱ相臨床試験が行われたが、結果は大きなものとはなっていなかった。
近年、漢方薬の薬理作用が盛んに研究されています。BA代謝経路を標的とした漢方薬も徐々に登場してきている。例えば、Schisandrae chinensis Fructusから分離された生理活性成分であるリグナンは、胆汁性肝障害においてPXRシグナル伝達経路を活性化することにより保護的役割を果たすことが解明されている [120].結論と展望
BAsと腸内細菌叢の相互作用は、CLDの進行および予後と関連している。両者の関係は一方通行ではなく、ネットワークで高度に絡み合っている。腸内細菌叢とBAsが病態生理学的プロセスに関与する具体的なメカニズムについては、まだ多くの発見が残されている。BAシグナル伝達経路と腸内細菌叢を標的とした治療法は成功を収めているが、新たな治療標的やCLDの症状寛解の分子メカニズムをさらに探求し、より多くの臨床試験のエビデンスを得るために、さらなる研究が必要である。
著者貢献
構想、L.L.、原案作成、Q.S., X.Y. and Y.Z. (Yifan Zeng)、執筆-レビューおよび編集、J.W. and Y.Z. (Yaqi Zhang) 、可視化、C.X、監督、L.L、資金獲得、L.L。 すべての著者がこの原稿を読んで出版版に合意している。
資金提供
本研究は、中国国家重点研究開発プログラム(2021YFC2301800)および中国国家自然科学基金(U20A20343)から資金提供を受けた。
施設審査委員会声明
該当なし。
インフォームド・コンセントに関する声明
該当なし。
データ利用可能性ステートメント
該当事項はありません。
利益相反
著者らは、利益相反がないことを宣言している。
参考文献
Leviatan, S.; Segal, E. 人間の健康に影響を与える腸内細菌の特定。Nature 2020, 587, 373-374. [Google Scholar] [CrossRef] [PubMed].
プロバイオティクスとその代謝産物は炎症性腸疾患を改善する: A Critical Review. Infect. Microbes Dis. 2021, 3, 4-13. [Google Scholar] [CrossRef]を参照。
Turnbaugh, P.J.; Ley, R.E.; Hamady, M.; Fraser-Liggett, C.M.; Knight, R.; Gordon, J.I. The human microbiome project. Nature 2007, 449, 804-810. [Google Scholar] [CrossRef] [PubMed].
胆汁酸代謝における腸内細菌叢の役割(Ramírez-Pérez, O.; Cruz-Ramón, V.; Chinchilla-López, P.; Méndez-Sánchez, N. Ann. Hepatol. 2017, 16, S15-S20. [Google Scholar] [CrossRef] [PubMed].
Ley, R.E.; Peterson, D.A.; Gordon, J.I. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell 2006, 124, 837-848. [Google Scholar] [CrossRef].
Bäckhed、F.; Ley、R.E.; Sonnenburg、J.L.; Peterson、D.A.; Gordon、J.I. ヒト腸内の宿主-細菌相互主義。Science 2005, 307, 1915-1920. [Google Scholar] [CrossRef]を参照。
Nicholson, J.K.; Holmes, E.; Kinross, J.; Burcelin, R.; Gibson, G.; Jia, W.; Pettersson, S. Host-gut microbiota metabolic interactions. Science 2012, 336, 1262-1267. [Google Scholar] [CrossRef].
Swan、J.R.、Want、E.J.、Geier、F.M.、Spagou、K.、Wilson、I.D.、Sidaway、J.E.、Nicholson、J.K.、Holmes、E。ホスト組織区画における全身性の腸微生物調節による胆汁酸代謝の調節。Proc. Natl. Acad. Sci. USA 2011, 108, 4523-4530. [Google Scholar] [CrossRef].
Ridlon, J.M.; Bajaj, J.S. The human gut sterolbiome: 胆汁酸-マイクロバイオーム内分泌の側面と治療法. Acta Pharm. シン(Sin. B 2015, 5, 99-105. [Google Scholar] [CrossRef]を参照してください。
Fuchs, C.D.; Trauner, M. Role of bile acids and their receptors in gastrointestinal and hepatic pathophysiology. Nat. Reviews. Gastroenterol. Hepatol. 2022, 19, 432-450. [Google Scholar] [CrossRef]を参照。
Hofmann, A.F. Bile acid secretion, bile flow and biliary lipid secretion in human. Hepatology 1990, 12, 17S-22S; discussion 22S-25S. Google Scholar] [Google Scholar
Russell, D.W. 胆汁酸合成の酵素、制御、および遺伝学. Annu. Rev. Biochem. 2003, 72, 137-174. [Google Scholar] [CrossRef]。
Cai, J.; Sun, L.; Gonzalez, F.J. 腸管免疫、炎症、腫瘍形成における腸内細菌叢由来の胆汁酸。Cell Host Microbe 2022, 30, 289-300. [Google Scholar] [CrossRef]を参照。
Song, X.; Sun, X.; Oh, S.F.; Wu, M.; Zhang, Y.; Zheng, W.; Geva-Zatorky, N.; Jupp, R.; Mathis, D.; Benoist, C.; et al. 微生物胆汁酸代謝産物が腸内RORγ+制御性T細胞恒常性を変調させる. Nature 2020, 577, 410-415. [Google Scholar] [CrossRef]を参照してください。
de Aguiar Vallim, T.Q.; Tarling, E.J.; Edwards, P.A. Pleiotropic roles of bile acids in metabolism. Cell Metab. 2013, 17, 657-669. [Google Scholar] [CrossRef]を参照してください。
胆汁酸シグナリングの代謝疾患への応用を目指す。Nat. Rev. Drug Discov. 2008, 7, 678-693. [Google Scholar] [CrossRef].
Jia, W.; Wei, M.; Rajani, C.; Zheng, X. Targeting the alternative bile acid synthetic pathway for metabolic diseases. Protein Cell 2021, 12, 411-425. [Google Scholar] [CrossRef]を参照。
Cortés, V.; Eckel, R.H. Insulin and Bile Acids in Cholesterol Homeostasis: 糖尿病関連アテローム性動脈硬化の新しいプレーヤー。Circulation 2022, 145, 983-986. [Google Scholar】【CrossRef】。
Collins, S.L.; Stine, J.G.; Bisanz, J.E.; Okafor, C.D.; Patterson, A.D. Bile acids and the gut microbiota: 代謝的相互作用と疾患への影響。Nat. Rev. Microbiol. 2023, 21, 236-247. [Google Scholar] [CrossRef]を参照してください。
胆汁酸と微生物叢の腸内クロストークと宿主メタボリズムへの影響. Cell Metab. 2016, 24, 41-50. [Google Scholar] [Ref]を参照してください。
Ding, L.; Yang, L.; Wang, Z.; Huang, W. Bile acid nuclear receptor FXR and digestive system diseases. Acta Pharm. シン(Sin. B 2015, 5, 135-144. [Google Scholar] [CrossRef] [PubMed].
Sorrentino, G.; Perino, A.; Yildiz, E.; El Alam, G.; Bou Sleiman, M.; Gioiello, A.; Pellicciari, R.; Schoonjans, K. Bile Acids Signal via TGR5 to Activate Intestinal Stem Cells and Epithelial Regeneneration. Gastroenterology 2020, 159, 956-968.e8. [Google Scholar】【CrossRef】【PubMed】。
Reich, M.; Spomer, L.; Klindt, C.; Fuchs, K.; Stindt, J.; Deutschmann, K.; Höhne, J.; Liaskou, E.; Hov, J.R.; Karlsen, T.H.; et al. 胆汁上皮細胞におけるTGR5(GPBAR1)の下方制御は硬化性胆管炎の病因に寄与しています。J. Hepatol. 2021, 75, 634-646. [Google Scholar】【CrossRef】【PubMed】。
Holter, M.M.; Chirikjian, M.K.; Govani, V.N.; Cummings, B.P. TGR5 Signaling in Hepatic Metabolic Health. ニュートリエンツ2020, 12, 2598. [Google Scholar] [CrossRef] [PubMed].
欧州肝臓学会(European Association for the Study of the Liver. EASL臨床実践ガイドライン: 胆汁性肝疾患の管理. J. Hepatol. 2009, 51, 237-267. [Google Scholar] [CrossRef].
Heathcote, E.J. 胆汁性肝疾患の診断と管理. Clin. Gastroenterol. Hepatol. 2007, 5, 776-782. [Google Scholar] [CrossRef]を参照してください。
Jansen, P.L.; Ghallab, A.; Vartak, N.; Reif, R.; Schaap, F.G.; Hampe, J.; Hengstler, J.G. The ascending pathophysiology of cholestatic liver disease. Hepatology 2017, 65, 722-738. [Google Scholar] [CrossRef]を参照してください。
Tsochatzis, E.A.; Gurusamy, K.S.; Gluud, C.; Burroughs, A.K. Ursodeoxycholic acid and primary biliary cirrhosis: EASLとAASLDのガイドライン。J. Hepatol. 2009, 51, 1084-1085; author reply 1085-1086. [Google Scholar] [CrossRef]を参照してください。
Tint, G.S.; Salen, G.; Shefer, S. ursodeoxycholic acid and chenodeoxycholic acid on cholesterol and bile acid metabolism. Gastroenterology 1986, 91, 1007-1018. [Google Scholar] [CrossRef]を参照してください。
Sabino, J.; Vieira-Silva, S.; Machiels, K.; Joossens, M.; Falony, G.; Ballet, V.; Ferrante, M.; Van Assche, G.; Van der Merwe, S.; Vermeire, S.; et al. Primary sclerosing cholangitis is characterised by intestinal dysbiosis independent from IBD. Gut 2016, 65, 1681-1689. [Google Scholar] [CrossRef]を参照してください。
Tang, R.; Wei, Y.; Li, Y.; Chen, W.; Chen, H.; Wang, Q.; Yang, F.; Miao, Q.; Xiao, X.; Zhang, H.; et al. 腸内細菌プロファイルは原発性胆汁性胆管炎で変化し、UDCA療法後に一部回復された。Gut 2018, 67, 534-541. [Google Scholar] [CrossRef]を参照してください。
Mattner, J. Primary Biliary Cirrhosis (PBC) and Primary Sclerosing Cholangitis (PSC) の病態に及ぼす微生物の影響. Int. J. Mol. Sci. 2016, 17, 1864. [Google Scholar】【CrossRef】。
Li, B.; Zhang, J.; Chen, Y.; Wang, Q.; Yan, L.; Wang, R.; Wei, Y.; You, Z.; Li, Y.; Miao, Q.; et al. Alterations in microbiota and their metabolites are associated with beneficial effects of bile acid sequestrant on icteric primary biliary Cholangitis. Gut Microbes 2021, 13, 1946366. [Google Scholar] [CrossRef]を参照してください。
Liao, L.; Schneider, K.M.; Galvez, E.J.C.; Frissen, M.; Marschall, H.-U.; Su, H.; Hatting, M.; Wahlström, A.; Haybaeck, J.; Puchas, P.; et al. 腸のディスバイオシスは原発硬化性胆管炎のネズミモデルでNLRP3を通じて肝臓疾患の進行を増大させます。Gut 2019, 68, 1477-1492. [Google Scholar] [CrossRef]を参照。
Blesl, A.; Stadlbauer, V. 胆汁性肝疾患における腸-肝臓軸. ニュートリエンツ2021, 13, 1018. [Google Scholar】【CrossRef】。
Li, Y.; Tang, R.; Leung, P.S.C.; Gershwin, M.E.; Ma, X. Bile acids and intestinal microbiota in autoimmune cholestatic liver Diseases. Autoimmun. Rev. 2017, 16, 885-896. [Google Scholar] [CrossRef]を参照してください。
Jia, W.; Xie, G.; Jia, W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nat. Rev. Gastroenterol. Hepatol. 2018, 15, 111-128. [Google Scholar] [CrossRef]を参照。
Liwinski, T.; Zenouzi, R.; John, C.; Ehlken, H.; Rühlemann, M.C.; Bang, C.; Groth, S.; Lieb, W.; Kantowski, M.; Andersen, N.; et al. Primary sclerosing cholangitisにおける胆汁マイクロバイオームの変容. Gut 2020, 69, 665-672. [Google Scholar] [CrossRef]を参照してください。
Axelson, M.; Ellis, E.; Mörk, B.; Garmark, K.; Abrahamsson, A.; Björkhem, I.; Ericzon, B.G.; Einarsson, C. Bile acid synthesis in cultured Human Hepatocytes: コール酸の代替生合成経路を支持する。Hepatology 2000, 31, 1305-1312. [Google Scholar] [CrossRef]を参照してください。
Chiang, J.Y. 胆汁酸の代謝とシグナル伝達. Compr. Physiol. 2013, 3, 1191-1212. [Google Scholar] [CrossRef]を参照してください。
Takahashi, S.; Fukami, T.; Masuo, Y.; Brocker, C.N.; Xie, C.; Krausz, K.W.; Wolf, C.R.; Henderson, C.J.; Gonzalez, F.J. Cyp2c70 is responsible for the species difference in bile acid metabolism between mice and human. J. Lipid Res. 2016, 57, 2130-2137. [Google Scholar] [CrossRef] [PubMed].
Chen, W.; Chiang, J.Y. Regulation of human sterol 27-hydroxylase gene (CYP27A1) by bile acids and hepatocyte nuclear factor 4alpha (HNF4falpha). Gene 2003, 313, 71-82. [Google Scholar] [CrossRef] [PubMed].
Trauner, M.; Boyer, J.L. 胆汁酸トランスポーター: 分子特性、機能、および制御。Physiol. Rev.2003、83、633-671。[Google Scholar] [CrossRef] [PubMed].
胆汁形成の生理・病態におけるナトリウム・タウロコール酸共輸送ポリペプチド(NTCP)および胆汁酸輸出ポンプ(BSEP)の役割. Handb. Exp. Pharmacol. 2011, 201, 205-259. [Google Scholar] [CrossRef]を参照してください。
Borst、P.; Zelcer、N.; van de Wetering、K. 健康および疾患におけるMRP2および3。Cancer Lett. 2006, 234, 51-61. [Google Scholar] [CrossRef]を参照してください。
チロシンリン酸化は、ヒト胆汁酸トランスポーターASBT(SLC10A2)のプラズマ膜の発現と安定性を制御する. Mol. Pharm. 2019, 16, 3569-3576. [Google Scholar] [CrossRef]を参照。
Dawson, P.A.; Lan, T.; Rao, A. Bile acid transporter. J. Lipid Res. 2009, 50, 2340-2357. [Google Scholar] [CrossRef]を参照。
Kullak-Ublick, G.A.; Stieger, B.; Meier, P.J. Enterohepatic bile salt transporters in normal physiology and liver disease. 胃腸病学 2004, 126, 322-342. [Google Scholar] [CrossRef]を参照。
Thibaut, M.M.; Bindels, L.B. Crosstalk between bile acid-activated receptors and microbiome in entero-hepatic inflammation. Trends Mol. Med. 2022, 28, 223-236. [Google Scholar] [Ref]を参照してください。
Fiorucci, S.; Distrutti, E.; Carino, A.; Zampella, A.; Biagioli, M. Bile acids and their receptors in metabolic disorders. Prog. Lipid Res. 2021, 82, 101094. [Google Scholar] [CrossRef]を参照してください。
Di Ciaula, A.; Bonfrate, L.; Baj, J.; Khalil, M.; Garruti, G.; Stellaard, F.; Wang, H.H.; Wang, D.Q.; Portincasa, P. Recent Advances in the Digestive, Metabolic and Therapeutic Effects of Farnesoid X Receptor and Fibroblast Growth Factor 19: From Cholesterol to Bile Acid Signaling. ニュートリエンツ2022, 14, 4950. [Google Scholar] [CrossRef].
稲垣 毅; Choi, M.; Moschetta, A.; Peng, L.; Cummins, C.L.; McDonald, J.G.; Luo, G.; Jones, S.A.; Goodwin, B.; Richardson, J.A.; et al. Fibroblast growth factor 15 functions as a enterohepatic signal to regulate bile acid homeostasis. Cell Metab. 2005, 2, 217-225. [Google Scholar] [CrossRef]を参照。
胆汁酸の生合成を抑制するための新規成長因子依存的なシグナルカスケードの定義。Genes Dev. 2003, 17, 1581-1591. [Google Scholar] [CrossRef].
核内受容体HNF4αとLRH-1は、生体内でCyp7a1を制御する際に協力する。J. Biol. Chem. 2012, 287, 41334-41341. [Google Scholar] [CrossRef]を参照。
Ananthanarayanan, M.; Balasubramanian, N.; Makishima, M.; Mangelsdorf, D.J.; Suchy, F.J. Human bile salt export pump promoter is transactivated by the farnesoid X receptor/bile acid receptor. J. Biol. Chem. 2001, 276, 28857-28865. [Google Scholar] [CrossRef]を参照。
Boyer、J.L.、Trauner、M、Mennone、A、Soroka、C.J.、Cai、S.Y.、Moustafa、T、Zollner、G、Lee、J.Y、Baratori、N。 ヒトおよびネズミの胆石症における基底部FXR依存胆汁酸排出トランスポーターオスタルファ-オスタベータを上昇させた。Am. J. Physiol. Gastrointest. Liver Physiol. 2006, 290, G1124-G1130. [Google Scholar] [CrossRef]を参照。
Kast, H.R.; Goodwin, B.; Tarr, P.T.; Jones, S.A.; Anisfeld, A.M.; Stoltz, C.M.; Tontonoz, P.; Kliewer, S.; Willson, T.M.; Edwards, P.A. 多剤耐性関連タンパク質2(ABCC2)の核受容体のプレグナンX受容体とファーネスX活性受容体と構成的アンドロスタン受容体による制御について. J. Biol. Chem. 2002, 277, 2908-2915. [Google Scholar] [CrossRef]を参照。
Denson, L.A.; Sturm, E.; Echevarria, W.; Zimmerman, T.L.; Makishima, M.; Mangelsdorf, D.J.; Karpen, S.J. オーファン核内受容体、shpはラット胆汁酸トランスポーター、ntcpの胆汁酸誘発抑制を仲介する. Gastroenterology 2001, 121, 140-147. [Google Scholar] [CrossRef]を参照。
Gタンパク質共役型胆汁酸受容体TGR5は、肝類洞内皮細胞で発現している。Hepatology 2007, 45, 695-704. [Google Scholar] [CrossRef]を参照してください。
胆汁酸膜受容体TGR5は、代謝と炎症における新たな標的として注目されている。J. Hepatol. 2011, 54, 1263-1272. [Google Scholar] [CrossRef].
トーマス、C.、ジョイエロ、A.、ノリエガ、L.、シュトレ、A.、オリー、J.、リゾ、G.、マッキアルロ、A.、山本浩二、マタキ、C、プルザンスキー、M.、他 TGR5を介した胆汁酸センシングはグルコース恒常性をコントロールしている。Cell Metab. 2009, 10, 167-177. [Google Scholar] [CrossRef] [PubMed].
肝疾患におけるTGR5 (GPBAR1) の役割. Semin. Liver Dis. 2018, 38, 333-339. [Google Scholar] [CrossRef] [PubMed].
Noh, K.; Chow, E.C.Y.; Quach, H.P.; Groothuis, G.M.M.; Tirona, R.G.; Pang, K.S. Significance of the Vitamin D Receptor on Crosstalk with Nuclear Receptors and Regulation of Enzymes and Transporters. AAPS J. 2022, 24, 71. Google Scholar] [PubMed] [CrossRef] [PubMed]。
Chiang, J.Y. Sphingosine-1-phosphate receptor 2: A novel bile acid receptor and regulator of hepatic lipid metabolism? Hepatology 2015, 61, 1118-1120. [Google Scholar] [CrossRef]を参照。
Nagahashi, M.; Takabe, K.; Liu, R.; Peng, K.; Wang, X.; Wang, Y.; Hait, N.C.; Wang, X.; Allegood, J.C.; Yamada, A.; et al. Conjugated bile acid-activated S1P receptor 2 is a key regulator of sphingosine kinase 2 and hepatic gene expression. Hepatology 2015, 61, 1216-1226. [Google Scholar] [CrossRef]を参照。
Dussurget, O.; Cabanes, D.; Dehoux, P.; Lecuit, M.; Buchrieser, C.; Glaser, P.; Cossart, P. Listeria monocytogenes bile salt hydrolase is a PrfA-regulated virulence factor involved in the intestinal and hepatic phases of listeriosis. Mol. Microbiol. 2002, 45, 1095-1106. [Google Scholar] [CrossRef]を参照。
胆汁酸はラットの腸内細菌叢の組成を制御する宿主因子である(Islam, K.B.M.S.; Fukiya, S.; Hagio, M.; Fuji, N.; Ishizuka, S.; Ooka, T.; Ogura, Y.; Hayashi, T.; Yokota, A.). Gastroenterology 2011, 141, 1773-1781. [Google Scholar] [CrossRef].
Bourgin, M.; Kriaa, A.; Mkaouar, H.; Mariaule, V.; Jablaoui, A.; Maguin, E.; Rhimi, M. Bile Salt Hydrolases: 胆汁酸ヒドロラーゼ:微生物相とヒトの健康の交差点で。Microorganisms 2021, 9, 1122. [Google Scholar] [CrossRef]を参照。
Begley, M.; Sleator, R.D.; Gahan, C.G.; Hill, C. Contribution of three bile-associated loci, bsh, pva, and btlB, to gastrointestinal persistence and bile tolerance of Listeria monocytogenes. Infect. Immun. 2005, 73, 894-904. [Google Scholar] [CrossRef].
Bustos, A.Y.; Font de Valdez, G.; Fadda, S.; Taranto, M.P. New insights into bacterial bile resistance mechanisms: 胆汁酸塩ヒドロラーゼの役割と人間の健康への影響。Food Res. Int. 2018, 112, 250-262. [Google Scholar] [CrossRef]を参照。
Jones, B.V.; Begley, M.; Hill, C.; Gahan, C.G.M.; Marchesi, J.R. Human gut microbiomeにおける胆汁酸ヒドロラーゼ活性の機能的および比較的メタゲノム解析. Proc. Natl. Acad. Sci. USA 2008, 105, 13580-13585. [Google Scholar] [CrossRef]を参照。
Lactobacillus salivariusにおける胆汁酸ヒドロラーゼ遺伝子の変異は、胆汁耐性レベルを決定しない。J. Bacteriol. 2009, 191, 5743-5757. [Google Scholar] [CrossRef]を参照。
Doden, H.L.; Wolf, P.G.; Gaskins, H.R.; Anantharaman, K.; Alves, J.M.P.; Ridlon, J.M. Completion of the gut microbial epi-bile acid pathway. Gut Microbes 2021, 13, 1907271. [Google Scholar] [CrossRef]を参照。
Macdonald, I.A.; Sutherland, J.D.; Cohen, B.I.; Mosbach, E.H. Effect of bile acid oxazoline derivatives on microorganisms participating in 7 alpha-hydroxyl epimerization of primary bile acids. J. Lipid Res. 1983, 24, 1550-1559. [Google Scholar] [CrossRef]を参照。
Devendran, S.; Méndez-García, C.; Ridlon, J.M. 嫌気性腸内細菌Butyricicoccus desmolans ATCC 43058由来の20β-HSDHの同定と特徴づけ。J. Lipid Res. 2017, 58, 916-925. [Google Scholar] [CrossRef]を参照。
平野聡;増田直樹 7α-および7β-ヒドロキシステロイドデヒドロゲナーゼ活性を有する2種類の微生物の併用による胆汁酸の7-ヒドロキシ基のエピマー化. J. Lipid Res. 1981, 22, 1060-1068. [Google Scholar] [CrossRef]を参照。
Doden, H.; Sallam, L.A.; Devendran, S.; Ly, L.; Doden, G.; Daniel, S.L.; Alves, J.M.P.; Ridlon, J.M. Metabolism of Oxo-Bile Acids and Characterization of Recombinant 12α-Hydroxysteroid Dehydrogenases from Bile Acid 7α-Dehydroxylating Human Gut Bacteria. Appl. Environ. Microbiol. 2018, 84, e00235-18. [Google Scholar] [CrossRef]を参照してください。
Mythen, S.M.; Devendran, S.; Méndez-García, C.; Cann, I.; Ridlon, J.M. Targeted Synthesis and Characterization of a Gene Cluster Encoding NAD(P)H-Dependent 3α-, 3β- and 12α-Hydroxysteroid Dehydrogenases from Eggerthella CAG:298, a Gut Metagenomic Sequence. Appl. Environ. Microbiol. 2018, 84, e02475-17. [Google Scholar] [CrossRef]を参照。
Bhowmik, S.; Chiu, H.-P.; Jones, D.H.; Chiu, H.-J.; Miller, M.D.; Xu, Q.; Farr, C.L.; Ridlon, J.M.; Wells, J.E.; Elsliger, M.-A.; et al. 胆汁酸二次合成における胆汁酸7α脱水酵素BaiEに関する構造および機能特性評価. Proteins 2016, 84, 316-331. [Google Scholar] [CrossRef]を参照。
Kriaa, A.; Bourgin, M.; Potiron, A.; Mkaouar, H.; Jablaoui, A.; Gérard, P.; Maguin, E.; Rhimi, M. Microbial impact on cholesterol and bile acid metabolism: 現状と将来展望。J. Lipid Res. 2019, 60, 323-332. [Google Scholar] [CrossRef]を参照。
Ridlon, J.M.; Kang, D.-J.; Hylemon, P.B. Bile salt biotransformations by human intestinal bacteria. J. Lipid Res. 2006, 47, 241-259. [Google Scholar] [CrossRef] [PubMed].
Chiang, J.Y.L.; Ferrell, J.M. Bile acid receptors FXR and TGR5 signaling in fatty liver diseases and therapy. Am. J. Physiol. Gastrointest. Liver Physiol. 2020, 318, G554-G573. [Google Scholar] [CrossRef] [PubMed].
Kim, K.H.; Park, D.; Jia, B.; Baek, J.H.; Hahn, Y.; Jeon, C.O. Identification and Characterization of Major Bile Acid 7α-Dehydroxylating Bacteria in the Human Gut. MSystems 2022, 7, e0045522. [Google Scholar] [CrossRef] [PubMed].
Dawson, J.A.; Mallonee, D.H.; Björkhem, I.; Hylemon, P.B. Eubacterium sp. strain VPI 12708由来のC24 bile acid 7 alpha-dehydrataseのEscherichia coliでの発現と特徴づけ. J. Lipid Res. 1996, 37, 1258-1267. [Google Scholar] [CrossRef]を参照。
Ridlon, J.M.; Harris, S.C.; Bhowmik, S.; Kang, D.-J.; Hylemon, P.B. Consequences of bile salt biotransformations by intestinal bacteria. Gut Microbes 2016, 7, 22-39. [Google Scholar] [CrossRef]を参照。
Qiu, Y.; Yu, J.; Li, Y.; Yang, F.; Yu, H.; Xue, M.; Zhang, F.; Jiang, X.; Bao, Z. Depletion of gut microbiota induces skeletal muscle atrophy by FXR-FGF15/19 signalling. Ann. Med. 2021, 53, 508-522. [Google Scholar] [CrossRef]を参照。
Sayin, S.I.; Wahlström, A.; Felin, J.; Jäntti, S.; Marschall, H.-U.; Bamberg, K.; Angelin, B.; Hyötyläinen, T.; Orešič, M.; Bäckhed, F. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, an natural occurring FXR antagonist. Cell Metab. 2013, 17, 225-235. [Google Scholar] [CrossRef]を参照してください。
Sun, L.; Xie, C.; Wang, G.; Wu, Y.; Wu, Q.; Wang, X.; Liu, J.; Deng, Y.; Xia, J.; Chen, B.; et al. Gut microbiota and intestinal FXR mediate the clinical benefits of metformin. Nat. Med. 2018, 24, 1919-1929. [Google Scholar] [CrossRef]を参照してください。
Sun, L.; Pang, Y.; Wang, X.; Wu, Q.; Liu, H.; Liu, B.; Liu, G.; Ye, M.; Kong, W.; Jiang, C. Ablation of gut microbiota alleviates obesity-induced hepatic steatosis and glucose intolerance by modulating bile acid metabolism in Hamsters. Acta Pharm. Sin. B 2019, 9, 702-710. [Google Scholar] [CrossRef]を参照してください。
Xiong, F.; Wu, S.-G.; Zhang, J.; Jakovlić, I.; Li, W.-X.; Zou, H.; Li, M.; Wang, G.-T. 食餌性胆汁酸の種類は草鯉の胆汁酸組成と腸内細菌叢に影響する。Front. Microbiol. 2018, 9, 2209. [Google Scholar] [CrossRef]を参照してください。
van Best, N.; Rolle-Kampczyk, U.; Schaap, F.G.; Basic, M.; Olde Damink, S.W.M.; Bleich, A.; Savelkoul, P.H.M.; von Bergen, M.; Penders, J.; Hornef, M.W. Bile acids drive the newborn's gut microbiota maturation. Nat. Commun. 2020, 11, 3692. [Google Scholar] [CrossRef]を参照。
Begley, M.; Gahan, C.G.M.; Hill, C. The interaction between bacteria and bile. FEMS Microbiol. Rev. 2005, 29, 625-651. [Google Scholar] [CrossRef]を参照してください。
Ridlon, J.M.; Kang, D.J.; Hylemon, P.B.; Bajaj, J.S. Bile acids and the gut microbiome. Curr. Opin. Gastroenterol. 2014, 30, 332-338. [Google Scholar] [CrossRef]を参照してください。
Inagaki, T.; Moschetta, A.; Lee, Y.-K.; Peng, L.; Zhao, G.; Downes, M.; Yu, R.T.; Shelton, J.M.; Richardson, J.A.; Repa, J.J.; et al. 小腸における抗菌防御の制御は核胆汁酸受容体で行う. Proc. Natl. Acad. Sci. USA 2006, 103, 3920-3925. [Google Scholar] [CrossRef].
Parséus, A.; Sommer, N.; Sommer, F.; Caesar, R.; Molinaro, A.; Ståhlman, M.; Greiner, T.U.; Perkins, R.; Bäckhed, F. Microbiota-induced obesity requires farnesoid X receptor. Gut 2017, 66, 429-437. [Google Scholar] [CrossRef]を参照してください。
Friedman, E.S.; Li, Y.; Shen, T.-C.D.; Jiang, J.; Chau, L.; Adorini, L.; Babakhani, F.; Edwards, J.; Shapiro, D.; Zhao, C.; et al. FXR-Dependent Modulation of the Human Small Intestinal Microbiome by the Bile Acid Derivatives Obeticholic Acid. Gastroenterology 2018, 155, 1741-1752.e5. [Google Scholar] [CrossRef]を参照してください。
Gossard, A.A.; Talwalkar, J.A. Cholestatic liver disease. Med. Clin. North Am. 2014, 98, 73-85. [Google Scholar] [CrossRef]を参照してください。
Terziroli Beretta-Piccoli, B.; Mieli-Vergani, G.; Vergani, D.; Vierling, J.M.; Adams, D.; Alpini, G.; Banales, J.M.; Beuers, U.; Björnsson, E.; Bowlus, C.; et al. Primary biliary cholangitisの挑戦: 何が新しく、何が必要なのか。J. Autoimmun. 2019, 105, 102328. [Google Scholar] [CrossRef]を参照してください。
古川真也; 守屋和也; 中山淳; 井上哲也; 百田尚樹; 河原谷宏; 波崎哲也; 佐藤聡; 堂原暁; 加治工一; et al. 腸内細菌異常に関連した原発性胆汁性胆管炎患者の臨床予後. Hepatol. Res. Off. J. Jpn. Soc. Hepatol. 2020, 50, 840-852. [Google Scholar] [CrossRef]を参照してください。
Han, W.; Huang, C.; Zhang, Q.; Tao, S.; Hu, X.; Xu, J.; Jiang, R.; Xu, B.; Liu, Y.; Hou, J. Alterations in gut microbiota and elevated serum bilubin in primary biliary cholangitis patients treated with ursodeoxycholic acid. Eur. J. Clin. Investig. 2022, 52, e13714. [Google Scholar] [CrossRef]を参照。
Chen, W.; Wei, Y.; Xiong, A.; Li, Y.; Guan, H.; Wang, Q.; Miao, Q.; Bian, Z.; Xiao, X.; Lian, M.; et al. Primary Biliary Cholangitisにおける血清・便中胆汁酸プロファイルおよび腸内細菌叢との相互作用の包括的解析. Clin. Rev. Allergy Immunol. 2020, 58, 25-38. [Google Scholar] [CrossRef] [PubMed].
Sawitza, I.; Kordes, C.; Götze, S.; Herebian, D.; Häussinger, D. Bile acids induce hepatic differentiation of mesenchymal stem cell. Sci. Rep. 2015, 5, 13320. [Google Scholar] [CrossRef] [PubMed].
Xing, Y.; Zhao, T.; Gao, X.; Wu, Y. 肝X受容体αは肝障害における肝類洞内皮細胞の毛細血管形成に必須である。Sci. Rep. 2016, 6, 21309. [Google Scholar] [CrossRef] [PubMed].
Yang, H.; Duan, Z. Bile Acids and the Potential Role in Primary Biliary Cirrhosis. Digestion 2016, 94, 145-153. [Google Scholar] [CrossRef] [PubMed].
Rawla, P.; Samant, H. Primary Sclerosing Cholangitis. StatPearls; StatPearls Publishing: Tampa, FL, USA, 2023に掲載されています。[Google Scholar】を参照してください。]
Torres, J.; Palmela, C.; Brito, H.; Bao, X.; Ruiqi, H.; Moura-Santos, P.; Pereira da Silva, J.; Oliveira, A.; Vieira, C.; Perez, K.; et al. The gut microbiota, bile acids and their correlation in primary sclerosing cholangitis associated with inflammatory bowel disease. United Eur. Gastroenterol. J. 2018, 6, 112-122. [Google Scholar] [CrossRef]を参照してください。
Tabibian, J.H.; O'Hara, S.P.; Trussoni, C.E.; Tietz, P.S.; Splinter, P.L.; Mounajjed, T.; Hagey, L.R.; LaRusso, N.F. Absence of the intestinal microbiota exacerbates hepatobiliary disease in a murine model of primary sclerosing cholangitis. Hepatology 2016, 63, 185-196. [Google Scholar] [CrossRef]を参照してください。
Awoniyi, M.; Wang, J.; Ngo, B.; Meadows, V.; Tam, J.; Viswanathan, A.; Lai, Y.; Montgomery, S.; Farmer, M.; Kummen, M.; et al. Protective and aggressive bacterial subsets and metabolites modify hepatobiliary inflammation and fibrosis in a murine model of PSC. Gut 2023, 72, 671-685. [Google Scholar] [CrossRef]を参照してください。
Caforio, A.; Argenziano Cutolo, A.; Skoff, G. The presence of mercury in the ecosystem. Boll. Chim. Farm. 1987, 126, 486-489. [Google Scholar】。]
プレボテラ・コプリはFXRシグナル伝達経路を増強することにより、原発性硬化性胆管炎の胆汁うっ滞および肝線維症を改善する。Biochim. Biophys. Acta Mol. Basis Dis. 2022, 1868, 166320. [Google Scholar] [CrossRef]を参照。
Coucke, E.M.; Akbar, H.; Kahloon, A.; Lopez, P.P. Biliary Obstruction. StatPearls; StatPearls Publishing: Tampa, FL, USA, 2022に掲載されています。[Google Scholar】に掲載されています。]
Wu, T.; Zhang, Z.; Liu, B.; Hou, D.; Liang, Y.; Zhang, J.; Shi, P. Gut microbiota dysbiosis and bacterial community assembly associated to cholesterol gallstones in large-scale study. BMC Genom. 2013, 14, 669. [Google Scholar] [CrossRef].
胆石症患者における腸内細菌叢と胆汁酸の相互作用. Environ. Microbiol. Rep. 2015, 7, 874-880. [Google Scholar] [CrossRef]を参照してください。
Wu, R.; Zhang, Y.; Cheng, Q.; Wu, J.; Zhu, Y.; Shi, X.; Qiu, X.; Yang, S.; Wang, S.; Zheng, B.; et al. マウスにおける胆道閉塞、胆汁排出および胆汁再注入が胆汁酸代謝および腸内細菌叢に与える影響. Liver Int. Off. J. Int. Assoc. Study Liver 2022, 42, 135-148. [Google Scholar] [CrossRef]を参照。
Hu, H.; Shao, W.; Liu, Q.; Liu, N.; Wang, Q.; Xu, J.; Zhang, X.; Weng, Z.; Lu, Q.; Jiao, L.; et al. Gut microbiota promotes cholesterol gallstone formation by modulating bile acid composition and biliary cholesterol secretion. Nat. Commun. 2022, 13, 252. [Google Scholar] [CrossRef]を参照。
Marzano, M.; Fosso, B.; Colliva, C.; Notario, E.; Passeri, D.; Intranuovo, M.; Gioiello, A.; Adorini, L.; Pesole, G.; Pellicciari, R.; et al. 新規アゴニストTC-100(3α, 7α, 11β-トリヒドロキシ-6α-エチル-5β-コラン-24-オイックアシッド)によるファルネソイドX受容体の活性化は、胆汁酸流動阻害モデルマウスにおいて腸管バリアの完全性を維持し、腸内微生物の再形成を促す。Biomed. Pharmacother. Biomed. Pharmacother. 2022, 153, 113380. [Google Scholar] [CrossRef]を参照してください。
Yu, L.; Liu, Y.; Wang, S.; Zhang, Q.; Zhao, J.; Zhang, H.; Narbad, A.; Tian, F.; Zhai, Q.; Chen, W. Cholestasis: 腸内細菌叢-胆汁酸-胆汁うっ滞の三角関係とプロバイオティクス戦略の可能性を探る。腸内細菌2023, 15, 2181930. [Google Scholar] [CrossRef]を参照してください。
Liu, Y.; Chen, K.; Li, F.; Gu, Z.; Liu, Q.; He, L.; Shao, T.; Song, Q.; Zhu, F.; Zhang, L.; et al. Probiotic Lactobacillus rhamnosus GG Prevents Liver Fibrosis Through Inhibiting Hepatic Bile Acid Synthesis and Enhancing Bile Acid Excretion in Mice. Hepatology 2020, 71, 2050-2066. [Google Scholar] [CrossRef].
Ren, L.; Song, Q.; Liu, Y.; Zhang, L.; Hao, Z.; Feng, W. Probiotic Lactobacillus rhamnosus GG prevent progesterone metabolite epiallaopregnanolone sulfate-induced hepatic bile acid accumulation and liver injury. Biochem. Biophys. Res. Commun. 2019, 520, 67-72. [Google Scholar】【CrossRef】。
Chen, Q.-W.; Li, Q.-R.; Cao, M.-W.; Yan, J.-H.; Zhang, X.-Z. Hierarchy-Assembled Dual Probiotics System Ameliorates Cholestatic Drug-Induced Liver Injury via Gut-Liver Axis Modulation. Adv. Sci. 2022, 9, e2200986. [Google Scholar] [CrossRef]を参照。
Labiano, I.; Agirre-Lizaso, A.; Olaizola, P.; Echebarria, A.; Huici-Izagirre, M.; Olaizola, I.; Esparza-Baquer, A.; Sharif, O.; Hijona, E.; Milkiewicz, P.; et al. TREM-2 plays protective role in cholestasis by acting as a negative regulator of inflammation. J. Hepatol. 2022, 77, 991-1004. [Google Scholar] [CrossRef]を参照。
Gulamhusein, A.F.; Hirschfield, G.M. Primary biliary cholangitis: 病理学と治療の機会。Nat. Rev. Gastroenterol. Hepatol. 2020, 17, 93-110. [Google Scholar】【CrossRef】。
Lindor, K.D.; Bowlus, C.L.; Boyer, J.; Levy, C.; Mayo, M. Primary Biliary Cholangitis: 2018 Practice Guidance from the American Association for the Study of Liver Diseases. Hepatology 2019, 69, 394-419. [Google Scholar] [CrossRef] [PubMed].
Nevens, F.; Andreone, P.; Mazzella, G.; Strasser, S.I.; Bowlus, C.; Invernizzi, P.; Drenth, J.P.H.; Pockros, P.J.; Regula, J.; Beuers, U.; et al. A Placebo-Controlled Trial of Obeticholic Acid in primary Biliary Cholangitis. N. Engl. J. Med. 2016, 375, 631-643. [Google Scholar】【CrossRef】【PubMed】。
Trauner, M.; Bowlus, C.L.; Gulamhusein, A.; Hameed, B.; Caldwell, S.H.; Shiffman, M.L.; Landis, C.; Muir, A.J.; Billin, A.; Xu, J.; et al. PSC患者における96週間のオープンラベル延長でのファルネソイドX(FXR)作動薬シロフェキソルの安全性および持続的有効性の検討.Clin. Gastroenterol. Hepatol. 2022. [Google Scholar】【CrossRef】【PubMed】。
Trauner、M.、Gulamhusein、A.、Hameed、B.、Caldwell、S.、Shiffman、M.L.、Landis、C.、Eksteen、B、Agarwal、K、Muir、A、Rushbrook、S、ら。非ステロイド性ファルネソイドX受容体作動薬シロフェクサー(GS-9674)は、原発性硬化性胆管炎患者における胆汁うっ滞と肝障害のマーカーを改善する。Hepatology 2019, 70, 788-801. [Google Scholar] [CrossRef] [PubMed].
Schramm, C.; Wedemeyer, H.; Mason, A.; Hirschfield, G.M.; Levy, C.; Kowdley, K.V.; Milkiewicz, P.; Janczewska, E.; Malova, E.S.; Sanni, J.; et al. Farnesoid X receptor agonist tropifexor attenuates cholestasis in a randomised trial with primary biliary cholangitis patients. JHEP Rep. Innov. Hepatol. 2022, 4, 100544. [Google Scholar] [CrossRef]を参照してください。
Trauner, M.; Fuchs, C.D. Novel therapeutic targets for cholestatic and fatty liver disease. Gut 2022, 71, 194-209. [Google Scholar] [CrossRef]を参照してください。
Corpechot, C.; Chazouillères, O.; Rousseau, A.; Le Gruyer, A.; Habersetzer, F.; Mathurin, P.; Goria, O.; Potier, P.; Minello, A.; Silvain, C.; et al. A Placebo-Controlled Trial of Bezafibrate in primary biliary Cholangitis. N. Engl. J. Med. 2018, 378, 2171-2181. [Google Scholar] [CrossRef]を参照してください。
Tanaka, A.; Hirohara, J.; Nakano, T.; Matsumoto, K.; Chazouillères, O.; Takikawa, H.; Hansen, B.E.; Carrat, F.; Corpechot, C. Association of bezafibrate with transplant-free survival in patients with primary biliary cholangitis. J. Hepatol. 2021, 75, 565-571. [Google Scholar] [CrossRef]を参照してください。
de Vries, E.; Bolier, R.; Goet, J.; Parés, A.; Verbeek, J.; de Vree, M.; Drenth, J.; van Erpecum, K.; van Nieuwkerk, K.; van der Heide, F.; et al. Fibrosing Cholangiopathiesにおけるかゆみに効く繊維剤(FITCH): 二重盲検、無作為化、プラセボ対照試験。Gastroenterology 2021, 160, 734-743. [Google Scholar] [CrossRef]を参照。
Beuers, U.; Wolters, F.; Oude Elferink, R.P.J. Cholestasisにおける痒みのメカニズム: 痒みを理解し治療する。Nat. Rev. Gastroenterol. Hepatol. 2023, 20, 26-36. [Google Scholar] [CrossRef]を参照してください。
Bowlus, C.L.; Galambos, M.R.; Aspinall, R.J.; Hirschfield, G.M.; Jones, D.E.J.; Dörffel, Y.; Gordon, S.C.; Harrison, S.A.; Kremer, A.E.; Mayo, M.J.; et al. Primary biliary cholangitis 患者におけるセラデルパの第Ⅱ相無作為非盲検 52 週間の検討. J. Hepatol. 2022, 77, 353-364. [Google Scholar] [CrossRef]を参照してください。
Schattenberg, J.M.; Pares, A.; Kowdley, K.V.; Heneghan, M.A.; Caldwell, S.; Pratt, D.; Bonder, A.; Hirschfield, G.M.; Levy, C.; Vierling, J.; et al. UDCAに不完全な応答を示したプライマリー・バリバリ・コール炎におけるelaafibranorの無作為プラセロナコントロールトラック。J. Hepatol. 2021, 74, 1344-1354. [Google Scholar] [CrossRef]を参照してください。
Boyer-Diaz, Z.; Aristu-Zabalza, P.; Andrés-Rozas, M.; Robert, C.; Ortega-Ribera, M.; Fernández-Iglesias, A.; Broqua, P.; Junien, J.-L.; Wettstein, G.; Bosch, J.; et al. Pan-PPAR agonist lanifibranor is improved portal hypertension and hepatic fibrosis in experimental advanced chronic liver disease. J. Hepatol. 2021, 74, 1188-1199. [Google Scholar】【CrossRef】。
Talukdar, S.; Kharitonenkov, A. FGF19とFGF21: In NASH we trust. Mol. Metab. 2021, 46, 101152. [Google Scholar] [CrossRef]を参照。
Hirschfield, G.M.; Chazouillères, O.; Drenth, J.P.; Thorburn, D.; Harrison, S.A.; Landis, C.S.; Mayo, M.J.; Muir, A.J.; Trotter, J.F.; Leeming, D.J.; et al. Primary sclerosing cholangitisにおけるFGF19類似体NGM282の影響.多施設共同無作為化二重盲検プラセボ対照第Ⅱ相試験。J. Hepatol. 2019, 70, 483-493. [Google Scholar】【CrossRef】。
Wang, X.X.; Wang, D.; Luo, Y.; Myakala, K.; Dobrinskikh, E.; Rosenberg, A.Z.; Levi, J.; Kopp, J.B.; Field, A.; Hill, A.; et al. FXR/TGR5 Dual Agonist Prevent the progression of Nephropathy in Diabetes and Obesity. J. Am. Soc. Nephrol. 2018, 29, 118-137. [Google Scholar] [CrossRef]を参照してください。
伊藤 圭一; 奥村 敦; 竹内 淳; 渡部 圭一; 井上 亮; 山内 孝; 坂本 圭一; 山下 靖; 井口 靖; 宇根 真; 他. ファネソイドX受容体と武田Gタンパク質共役受容体5のデュアルアゴニストはB型肝炎ウイルス感染をIn Vitro and In Vivoで阻害する. Hepatology 2021, 74, 83-98. [Google Scholar] [CrossRef]を参照。
Trivedi, P.J.; Muir, A.J.; Levy, C.; Bowlus, C.L.; Manns, M.P.; Lu, X.; Crans, G.; Chung, C.; Subramanian, G.M.; Myers, R.P.; et al. Primary Sclerosing Cholangitis患者の試験における血清アルカリ性ホスファターの個人間および個人内変動と限られた予後有用度(Impoint of Serum Alkaline Phosphatase in a trial With Patients Together). Clin. Gastroenterol. Hepatol. 2021, 19, 1248-1257. [Google Scholar] [CrossRef]を参照してください。
免責事項/出版社からの注意事項:すべての出版物に含まれる声明、意見およびデータは、個々の著者および寄稿者のみのものであり、MDPIおよび/または編集者のものではありません。MDPIおよび/または編集者は、コンテンツで言及されたアイデア、方法、指示または製品に起因する人または財産の損害について責任を負わない。
© 2023 by the authors. ライセンシー MDPI, Basel, Switzerland. この記事は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条件に基づいて配布されるオープンアクセス記事です。
共有と引用
MDPIおよびACSスタイル
胆汁性肝疾患における腸内細菌叢と胆汁酸のクロストーク。Nutrients 2023, 15, 2411. https://doi.org/10.3390/nu15102411
AMAスタイル
Shi Q, Yuan X, Zeng Y, Wang J, Zhang Y, Xue C, Li L. Crosstalk between Gut Microbiota and Bile Acids in Cholestatic Liver Disease(胆汁性肝疾患における腸内細菌と胆汁酸のクロストーク). Nutrients. 2023; 15(10):2411。https://doi.org/10.3390/nu15102411。
シカゴ/トゥラビアンスタイル
Shi, Qingmiao, Xin Yuan, Yifan Zeng, Jinzhi Wang, Yaqi Zhang, Chen Xue, and Lanjuan Li. 2023. "Crosstalk between Gut Microbiota and Bile Acids in Cholestatic Liver Disease" Nutrients 15, no. 10: 2411. https://doi.org/10.3390/nu15102411.
他のスタイルを探す
なお、2016年創刊号より、本誌はページ番号の代わりに記事番号を使用しています。詳しくはこちらでご確認ください。
記事のメトリックス
引用文献
この記事には引用が見つかりませんでしたが、Google Scholarで確認することができます。
記事アクセス統計
記事アクセス統計情報記事閲覧数22. 5月23日 5月24日 5月25日 5月26日 5月27日 5月28日 5月0100200300400500
ジャーナル統計の詳細については、こちらをご覧ください。
同一IPアドレスからの複数のリクエストは、1回の閲覧としてカウントされます。
Nutrients, EISSN 2072-6643, 発行:MDPI
RSSコンテンツアラート
その他の情報
論文処理料請求書の支払いオープンアクセスポリシーMDPIへのお問い合わせMDPIでのお仕事情報
ガイドライン
著者向け査読者向け編集者向けライブラリアン向け出版社向け学会向け会議主催者向け
MDPIの取り組み
SciforumMDPI BooksPreprints.orgScilitSciProfilesEncyclopediaJAMSProceedings Series
MDPIをフォローする
LinkedInFacebookTwitter
MDPIジャーナルからの発行通知やニュースレターを受け取るには、購読してください。
Acoustics Actuators 行政科学 Adolescents Advances in Respiratory Medicine 航空宇宙 農業工学 Agrochemicals Agronomy AI Air Algorithms Allergies Alloys Analytica Analytics Anatomia Anesthesia Research Animals Antibiotics Antibodies Antioxidants Applied Biosciences 応用力学 応用微生物学 応用ナノ応用科学 応用システム革新 ApplicationChem AppliedMath Aquaculture Journal 建築 Arthropoda 芸術 Astronomy Atmosphere Atoms Audiology Research Automation Axioms Bacteria Batteries Behavioral Sciences Beverages Big Data and Cognitive Computing BioChem バイオエンジニアリング Biologics Biology and Life Sciences Forum バイオマス Biomechanics BioMed Biomedicines BioMedInformatics Biomimetics Biomolecules Biophysica Biosors BioTech Birds ブロックチェーン Brain Sciences Buildings Businesses C Cancers Cardiogenetics Catalysts Cells Ceramics Challenges ChemEngineering Chemistry Proceedings Chemosensors 子どもたち チップス CivilEng クリーンテクノロジー 気候 臨床とトランスレーショナル神経科学 臨床と実践 時計と睡眠 コーティング コロイドと界面 色材 商品 複雑さ 化合物 計算 コンピュータ科学と数学 フォーラム コンピュータ 物性 保存 建設材料 腐食と材料劣化 化粧品 COVID 作物 暗号 結晶 分子生物学の最新の問題 現在の腫瘍学 乳製品のデータ 歯学 Journal Dermato Dermatopathology Designs Diabetology Diagnostics Dietetics Digital Disabilities Diseases Diversity DNA Drones Drugs and Drug Candidates Dynamics Earth Ecologies Econometrics Economies Education Sciences Electricity Electrochem Electronic Materials Electronics Encyclopedia Endocrines Energies Eng Engineering Proceedings Entropy Environmental Sciences Proceedings Environments Epidemiologia Epigenomes European Burn Journal European Journal of Investigation in Health、 Fermentation Fibers FinTech Fire Fishes Fluids Foods Forecasting Forensic Sciences 森林 Fossils Foundations Fractal and Fractional Fuels Future Future Internet Future Pharmacology Future Transportation Galaxies Games Gases Gastroenterology Insights Gastrointestinal Disorders Gastronomy Gels Genealogy Genes Geographies GeoHazards Geomatics Geosciences Geotechnics Geriatrics Gout,Urate、 and Crystal Deposition Disease Grasses Hardware Healthcare Hearts Hemato Hematology Reports Heritage Histories Horticulturae Hospitals Humanities Hydrobiology Hydrogen Hydrology Hygiene Immuno Infectious Disease Reports Informatics Information Infrastructures Inorganics Insects Instruments International Journal of Environmental Research and Public Health International Journal of Financial Studies International Journal of Molecular Sciences International Journal of Neonatal Screening International Journal of Plant Biology International Journal of Translational Medicine International Journal of Turbomachinery、 国際医学教育発明IoT ISPRS 国際地理情報ジャーナル 加齢・長寿ジャーナル 循環器発達・疾患ジャーナル 臨床・トランスレーショナル眼科ジャーナル 臨床医学ジャーナル 複合材料科学ジャーナル サイバーセキュリティ・プライバシージャーナル 発達生物学ジャーナル 実験・理論解析ジャーナル 機能的バイオマテリアル・ジャーナル 機能形態学・運動学ジャーナル 菌類ジャーナル イメージングジャーナル 知能ジャーナル 低電力エレクトロニクスと応用ジャーナル 製造・材料加工ジャーナル 海洋科学・工学ジャーナル 分子病理学ジャーナル ナノテラノスティクスジャーナル 原子力工学ジャーナル 耳鼻咽喉科学ジャーナル、 Hearing and Balance Medicine Journal of Personalized Medicine Journal of Respiration Journal of Risk and Financial Management Journal of Sensor and Actuator Networks Journal of Theoretical and Applied Electronic Commerce Research Journal of Vascular Diseases Journal of Xenobiotics Journal of Zoological and Botanical Gardens Journalism and Media Kidney and Dialysis Kinases and Phosphatases Knowledge Land Languages Laws Life Limnological Review Liquids Literature Livers Logics Lubricants Lymphatics 機械学習と知識抽出の機械類 Macromol 磁性 磁気化学 海洋薬物 材料 論文集 数理・計算応用 数学 医学 医学フォーラム Medicina メディシン メンブレン メリット メタボライト 金属 気象学 メタン 方法とプロトコル 計測学 マイクロ微生物学研究 マイクロマシン 微生物 マイクロプラスチック ミネラル マイニング モデリング Molbank Molecules Multimodal Technologies and Interaction Muscles ナノエネルギーの進歩 ナノマテリアル NDT Network Neuroglia Neurology International NeuroSci Nitrogen Non- Nutraceuticals Nutrients Obesities Oceans Onco Optics Oral Organics Organoid Osteology Oxygen Parasitologia Particles Pathogens Pathophysiology Pediatric Reports Pharmaceuticals Pharmaceutics Pharmacoepidemiology Pharmacy Philosophies Photochem Photonics Phycology Physchem Physical Sciences Forum Physics Physiologia Plants Plasma プラットフォーム 汚染物質 高分子 多糖類 家禽類 粉体 講演録 プロセス プロテオーム 精神医学 国際精神薬理学 出版物 量子ビーム科学 量子レポート 四元放射線反応 受容体 リサイクル 宗教 リモートセンシング レポート 生殖医療 資源 リウマチ リスク ロボット工学 ルミナス 安全科学 サイエンティア 薬剤学 硬化症 種子 センサー 分離 性別 信号 副鼻腔炎 スマートシティ 社会科学 社会 ソフトウェア 土壌システム 太陽固体 分光学 ジャーナル スポーツ 規格 統計 ストレス 表面 手術 手術技術 開発 サステナビリティ 持続可能 化学 シンメトリー シンバイオ システム 目標 分類技術 電気通信 繊維製品 サラセミア レポート サーモトモグラフィー 観光とホスピタリティ 毒素 移植学 トラウマケア 高等教育の動向 熱帯医学と感染症 宇宙 都市科学 ウロワクチン 自動車 性病学 獣医科学 振動 仮想世界 ウイルス 視覚 廃棄物 水 風 女性 世界 電気自動車 雑誌 若者 人獣共通感染症
オプションを選択
購読する
© 1996-2023 MDPI (スイス・バーゼル) 特に明記されていない限り、このサイトはMDPIが運営しています。
免責事項 利用規約 プライバシーポリシー
トップ
この記事が気に入ったらサポートをしてみませんか?
