微生物-免疫-脳の相互作用。ライフスパンの視点から
神経生物学におけるカレントオピニオン
第78巻、2023年2月、102652号
微生物-免疫-脳の相互作用。ライフスパンの視点から
著者リンク オーバーレイパネルを開くAnnaRatsika12#John F.Cryan12
https://doi.org/10.1016/j.conb.2022.102652
権利と内容を取得する
クリエイティブ・コモンズ・ライセンスに基づくオープンアクセス
要旨
腸内細菌叢が恒常性の維持に重要な役割を果たし、生涯を通じて重要な時期に脳と行動に影響を与えるという認識が広まってきている。腸と脳の間のコミュニケーションが、複数の精神神経疾患を理解する鍵になることを示唆する証拠が増えつつあり、免疫系が重要なメカニズム的メディエーターとして最前線に登場しつつある。生涯を通じて、免疫系は中枢神経系と継続的に相互のシグナルを交換する。腸内細菌が免疫メディエータを変化させ、宿主の神経生理学と行動に影響を及ぼす。腸内細菌叢の構成にはいくつかの要因があり、それに応じて神経・免疫活性を持つ分子が放出され、適切な神経・免疫相互作用に極めて重要である。このレビューでは、これらのシステムの健康と疾病の間の絶妙なバランスを維持するために貢献している複数の要因について議論し、我々は、生涯にわたって宿主の脳と行動に対する腸内細菌叢の入力の潜在的なメカニズム的意味を明らかにする。
前の記事へ次の記事へ
キーワード
免疫シグナル発達思春期老化
はじめに:微生物叢-腸-免疫-脳軸
腸内細菌叢と総称される消化管内に生息する微生物の多様な生態系は、免疫系の成熟や機能など、宿主の多くの生理的プロセスを制御しています [1]。さらに、腸内細菌叢が生涯を通じて脳機能と行動の制御に関与していることを示す多くの証拠が得られています [2,3]。腸-脳シグナルのメカニズムには多くの提案がありますが、微生物叢と免疫系の相互作用は、微生物叢-腸-脳コミュニケーションを組織化する重要な経路として浮上しています。
腸内細菌叢は、病原体に対する宿主の自然免疫と適応免疫、および非病原性刺激に対する免疫寛容の両方を制御することに関与していることが、研究により明らかにされている。腸内細菌叢と宿主免疫の相互作用は、複雑かつ動的で、内外のシグナルに大きく依存しています [4]。腸内細菌叢が神経免疫に影響を与える能力は、微生物が脳の恒常性と神経疾患の症状を制御する主要な経路を提供します。実際、腸内細菌叢の組成を乱したモデルを用いた前臨床研究は、腸内細菌叢の免疫調節効果を評価するための貴重なツールであることが証明されている。本総説では、腸内細菌叢の免疫調節作用と中枢神経系(CNS)への影響、さらにその後の生涯を通じた微生物叢-腸-脳軸コミュニケーションへの示唆について論じる。
両親のライフスタイル
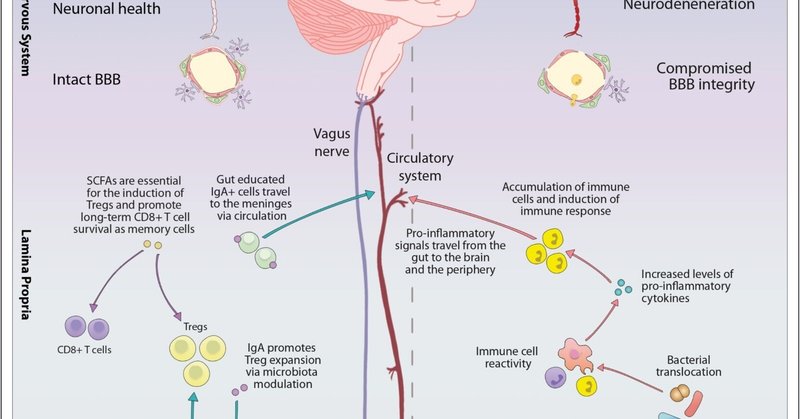
妊娠前および妊娠中の両親の健康は、胎児の神経発達に不可欠です。妊娠中、母体は胎盤を介して胎児と常に連絡を取り合い、胚の発達に重要な栄養素を伝達し、母体と胎児の間で継続的に相互の情報交換を維持しています[5]。親のライフスタイル(食事、喫煙、薬物/アルコール使用、運動)、抗生物質への曝露、精神衛生、環境因子などは、妊娠に伴うホルモン、微生物、免疫の変化から常に入力され、胎児の発達を形成している(図1)[5]。CNS内の主要な自然免疫細胞であるミクログリアを中心に、母親の栄養が子孫の脳免疫に及ぼす影響について、ますます研究が進んでいます [6、7、8]。親の健康に影響を与えるすべての要因(感染やストレスを含む)は、必然的に周産期の子孫の発達の運命に影響を与えます。(図2)。

図1
ダウンロード 高解像度画像のダウンロード(1MB)Download : フルサイズ画像のダウンロード
図1. 健康状態および炎症状態における微生物叢-腸-免疫-脳の軸。

図2
ダウンロード 高解像度画像のダウンロード (883KB)Download : フルサイズ画像のダウンロード
図2. 生涯を通じて腸内細菌叢-脳-免疫の相互作用を媒介する因子。胎生期には、食事などの親要因が子世代の微生物叢組成、免疫系、認知発達に影響を与える。出生後早期には、母乳育児とミルク育児により、腸内細菌叢を介して免疫系と脳の発達の素因が異なる。思春期は、ボディイメージや体重管理に関する同世代のプレッシャーに特徴づけられる。したがって、思春期には、栄養との健全な関係を築き、脳や免疫系などの生理系に恩恵をもたらすために、ポジティブな食習慣の確立が極めて重要である。成人期には、食品選択、アルコール摂取、体重管理、カロリー制限などの一般的なライフスタイルパラメータが、免疫系の調節を介して脳機能に永続的な影響を及ぼす可能性のある腸内細菌叢の構成に影響を与えることが示されている。加齢に伴う腸内細菌叢の変化は、虚弱体質の増加、炎症、認知機能の低下と関連しています。これらの変化は、ライフスタイルの選択によって同時に影響を受ける臨床パラメータによって部分的に駆動されている可能性がある。
疫学的および前臨床研究により、母親の免疫活性化(MIA)と自閉症スペクトラム障害(ASD)、注意欠陥多動性障害(ADHD)、不安・うつ病、認知障害、発達遅延、統合失調症、双極性障害などの精神・神経疾患との関連性が明らかになりつつある [9].ASDの文脈では、累積的な証拠は、Th17細胞によって産生される母親のインターロイキン17a(IL-17a)[10、11、12、13]、さらに子における微生物叢組成の変化および腸管透過性の上昇に関与している[14]。これを裏付けるように、複数のヒトの研究により、妊娠中の免疫チャレンジがIL-6およびIL-17aのサイトカインレベルの調節異常をもたらし、それが子孫のASD発症のリスク上昇と関連することが示されている[15,16]。さらに、感染による父方の生殖細胞でのエピジェネティックな変化は、子孫の健康に持続的な変化をもたらしました[17]。したがって、両親のどちらかが妊娠中または妊娠前に感染すると、腸と脳の間のコミュニケーション経路として機能する免疫系に明確な影響を与え、子孫の健康を変調させる可能性があります。
妊娠中の母親の過度のストレス(例えば、不安、うつ病、外傷性イベント)は、神経発達に永続的かつ有害な影響を及ぼす可能性がある [9,18,19] 。例えば、動物モデルでは、母親のストレスは胎盤および胎児の脳における炎症性サイトカイン(IL-1βおよびIL-6)のレベルを乱し[20、21、22]、子孫にASD様の表現型をもたらし[23]、これは母親の抗炎症治療によって部分的に軽減された[22]。同様に、出生前ストレス時のIL-6シグナル伝達を阻害すると、IL-6によって誘発された子孫のミクログリア欠損が改善された[24]。最近の研究では、妊娠中に慢性的な拘束ストレスにさらされると、ケモカインCCL2を介して、微生物依存性の子宮内炎症が誘発され、胎盤のセロトニン作動性シグナルが障害され、子孫の行動障害が誘発されることが示された [25](※1) 。
幼少期における微生物と免疫の相互作用
腸内細菌のコロニー形成は幼少期に起こり、これが子宮内で始まるかどうかは議論の余地がある [26, 27, 28, 29, 30, 31]。しかし、腸内細菌叢の主要なコロニー形成は出生時に起こり、宿主の免疫系の発達と成熟に情報を与えることはよく知られています [32]。実際、宿主免疫の最も重要な発達は、生後数年以内に起こり、不安定な生態系から成人期に非常に多様で強固なコミュニティへと発達する腸内細菌叢の成熟と一致する [33,34]。出生形態(帝王切開、経膣分娩)、未熟児、食事(母乳、非母乳、離乳)、ストレス、投薬(例:抗生物質)、環境などの要因がこの重要な発達段階における微生物叢の構成に影響を与える可能性がある [5, 35]。これらの要因の一部は腸内細菌叢に一過性の影響を及ぼすだけかもしれないが、これらの早期の影響は子孫の免疫トレーニング、代謝機能、さらには神経発達の転帰に永続的な影響を及ぼす可能性があると仮定されている [35, 36, 37, 38]。
新生児は、出産時に母体の膣および糞便微生物に曝露されるが、帝王切開ではその曝露が妨げられる [39]。重要な発達過程がまだ進行している人生の早い段階で、分娩様式によって課されるこの差のある微生物コロニー形成は、健康と疾病を制御する生理学的システムに持続的なサインを残す。実際、多くの研究が帝王切開をアレルギーや喘息などの免疫関連の障害に関連付ける一方 [40、41、42、43] 、神経細胞死の増加 [44] や後年における初期のコミュニケーションおよび社会的行動の障害という特徴を持つCNSの構造および機能への明確な影響を示唆する研究もある [45]。出産形態は、免疫機能、脳および行動発達の変化と関連しており、腸内細菌叢の播種が重要なメディエーターとして関与している証拠が増えてきている。帝王切開児に見られるように、特定の「好ましい」微生物が存在しないことと、潜在的な日和見病原体が存在することの両方が、免疫系および中枢神経系の健全な発達のバランスを崩す可能性があるという仮説が立てられている。
腸内微生物のアンバランスは、早産、感染症、幼少期の抗生物質の使用など、他の複数の事象でも明らかである。実際、早産で生まれた乳児は神経炎症に対する感受性が高く [46] 、これは神経発達障害と関連している [47] 。抗生物質は譲れない健康上の利益をもたらす一方で、腸内細菌叢への影響は宿主に悪影響を及ぼすかもしれない。抗生物質による微生物叢の枯渇は、腸の成熟、免疫細胞のプライミング、および脳の発達に極めて重要な役割を果たす微生物由来のSCFAを変化させる可能性がある [48]。さらに、周産期の抗生物質による微生物相の枯渇は、免疫[51]および脳障害[52, 53∗, 54]と並んで、微生物相の組成および多様性に長期にわたる刷り込みを伴う腸内の日和見微生物の増殖[49, 50]を高めるかもしれません。最近の研究では、妊娠中の母親の微生物叢が、子孫の視床皮質ニューロンの発達やその後の感覚運動行動において重要な役割を果たすことが示されました[53∗]。
近年、末梢の手がかりが髄膜に沿って集積する免疫細胞と相互作用することが示され[55, 56, 57∗] 、脳が免疫優先臓器であるにもかかわらず、末梢のシグナルが中枢神経系に到達することが明らかにされています。髄膜に存在するIL-17産生γδT細胞は、新生児マウスのグルタミン酸シナプス可塑性を高めることで短期記憶の発達に影響を与え、免疫系が短期記憶形成と脳機能に関与していることが示唆されています[58]。興味深いことに、別の研究では、Th17細胞由来のIL-17は、腸のホメオスタシスと微生物叢の組成を調節し、間接的にCNSの自己免疫に影響を与えた[59]。腸で教育された免疫細胞は、循環系に入り髄膜を取り囲むことができ、免疫系が腸と脳の間の主要なコミュニケーション経路であることがさらに確認された[60∗]。また、他の研究により、微生物叢由来のシグナルが、発達の重要な時期にミクログリア機能に必須であることが示されている[61,62∗]。微生物がいない動物では、思春期にミクログリアの樹状突起が増加し、過剰な神経シナプスを除去する能力が高まることから、ミクログリアの形態と機能において微生物が重要な役割を果たすことが明らかになりました[61, 62∗, 63∗].このように、発達の初期段階における微生物の不在は、生涯を通じて腸内細菌叢の構成に長期的な影響を及ぼし、免疫系に明確な影響を与える可能性がある。
母乳は、出生後の最初の食物として、発達段階に応じて赤ちゃんのニーズに合わせた金字塔である。母乳に関する研究により、授乳期や母親の要因(精神的健康、食事、ライフスタイル)に応じて母乳の組成が複雑に変化することが明らかにされています[5]。母乳には、ヒトミルクオリゴ糖(HMO)、多価不飽和脂肪酸、タンパク質、ホルモン、ビタミン、サイトカインなど、多くの分子が含まれています[64]。母乳には、乳児の胃腸(GI)管に継続的に繁殖する母性微生物と、授乳期間中に乳児に受け渡される様々な免疫細胞も含まれています[65]。母乳のこれらの成分は、免疫調節の可能性を持ち、腸内細菌叢の組成、神経伝達物質合成、および末梢神経系と中枢神経系の神経発達に影響を与える[5]。例えば、HMOは、腸管上皮細胞の成熟を誘導し [66]、腸管バリア機能を高め [67]、日和見病原体の腸管への付着能力を低下させる一方で常在菌の生存能力を促進することが示されてきた [68]。このようにHMOを介した腸内細菌叢の調節は、ビフィズス菌のような免疫調節能を有する腸内細菌の属の有病率を変化させる[69]。ビフィズス菌とそのHMO利用遺伝子の欠如は、乳児の全身性炎症と免疫調節障害と相関しているが、ビフィドバクテリウム・インファンティスの補充は、炎症を抑制することが知られている2種類の細胞、血中のT調節性単球と非古典的単球のレベルを増加させた[69]。
生後1年間は、固形食の導入期である離乳期が始まり、同時に腸内細菌叢が基質の変化に対応して複雑かつ豊富になり、これは免疫系の刷り込みに極めて重要である [70]。離乳期には、新しい食品が腸管内に提示されるが、免疫系は新しい「初発」成分を認識し続ける。この時期の免疫系のプライミングは、腸内細菌による適応免疫細胞の制御的な「トレーニング」を通じて、生涯を通じて免疫病理の発達に重要である[70∗]。この時期の腸内細菌叢は、栄養のほか、出産形態[71]、地理、室内ペットの保有[72]などの環境因子や母親因子[5]からの入力により、ますます成人に近い組成になり始める。同時に、この時期の腸内細菌叢の組成の変化と複合栄養素の利用可能性は、発達中の脳に入力する [5] ことから、固形食の導入は脳の成長と微生物叢の成熟の両方にとって最も重要であることが示されている。
思春期
発育に大きな違いがあるため、思春期を種間で翻訳することは困難であるが、思春期の開始は一般的に視床下部-下垂体-性腺軸の再活性化によって特徴付けられる。この軸は出生前および出生後早期には活性化されているが、小児期には「休止」したままである [73]。同時に、免疫系は、ここ10年でようやく解明された時間特異的な実質的変化を遂げており、免疫系をCNSの発達プログラミングの最前線に位置づけている [74,75]。この時期の脳における炎症性シグナルの増加は、ミクログリアの機能と形態を調節し、ネズミやヒトにおけるシナプスの刈り込みとその結果としての行動に影響を与える[76,77∗]。ミクログリアのニューロンリモデリング能力により、ミクログリアはニューロンコネクトームと行動表現型の重要なメディエーターとして位置づけられている[78]。末梢の免疫シグナルは、血液脳関門(BBB)を迂回して、脳内の脳脊髄液と免疫細胞のフラックスを調節するglymphaticsと呼ばれる複雑なシステムを介して、脳に到達することができる[79,80]。げっ歯類では、腸内微生物のシグナルが腸のリンパ系を変化させることができるため [81]、腸からの微生物誘発性免疫刺激がリンパ系ルートを通じて脳に到達する可能性が考えられる [79,80]。微生物叢は、思春期という多感な時期に、脳の境界線に沿ったダイナミックな内分泌および免疫入力を介して、脳の発達プログラミングに重要な役割を果たす可能性がある。
同時に、思春期は、個人が多くの心理社会的および生理的な変化にさらされる時期である [82] 。思春期には、視床下部-下垂体-副腎(HPA)軸の反応性の著しい変化が、皮質-辺縁系脳領域の敏感な成熟と一致し、個人をストレス要因に対して特に脆弱にする。最近、成体マウスにおいて腸内細菌叢がHPA軸を介して社会的行動を調節することが議論されている[83]。免疫系は、HPA軸を調節することによって、ストレスに対する脆弱性と回復力の間の媒介者である。実際、炎症性の侮辱はニューロンの軌道を変化させ、不安、うつ病、薬物/アルコール乱用などのストレス関連精神障害の発症に寄与することがある [84,85] 。性別もまた、ストレス応答を調節する上で重要な因子であり、メスのげっ歯類はストレス因子に対する応答が増大し、より長引き、微生物叢組成の変化が大きくなることを示す [86,87] 。実際、腸内細菌叢の発達、神経炎症、および心理的転帰に対するストレス曝露による年齢および性特異的な影響を完全に解明するためには、さらなる研究が必要である。
成人期
青年期が終わると、小児期や青年期に比べて腸内細菌叢の組成が安定し、脳が十分に発達しながらも腸内細菌および免疫系からの継続的なシグナルを受容する成人期が始まる。食事の選択は、腸内細菌叢の主要な調節因子であり続け、免疫系に影響を及ぼし、したがって一般的な恒常性の維持に影響を及ぼす [88] 。複合繊維を分解できる特定の細菌は、その代謝の副産物として短鎖脂肪酸(SCFAs)などの分子を放出し、腸管バリアと免疫- [89,90] および宿主の末梢および中枢神経系に対する神経調節能を高める能力がある [48,91]。食物繊維と発酵食品の摂取は、成人の腸内の微生物叢の多様性と機能を高め、その後、摂取した食品の特定のカテゴリー(高繊維または発酵食品のいずれか)に起因する個人化された免疫応答が起こりました [92∗]。このような規模でのヒトへの介入は、様々な食品が腸内細菌叢に及ぼす影響の違いを解明する貴重なツールであり、免疫系の調節や生涯を通じた脳の健康への恩恵の可能性を示唆するものである。
恒常性においては、腸内細菌叢に対する宿主の免疫応答は、腸粘膜表面にしっかりと区分けされている(図1)[93]。常在菌は、高グリコシル化ムチンMUC2を中心に組織化された厚い粘液層によって分離されており、この粘液層が抗原サンプリング樹状細胞に抗炎症シグナルを刷り込むことによって寛容化サイトカインを促進し、常在菌に対する免疫学的寛容を可能にしている [94].微生物代謝物、すなわちインドールは、炎症性因子を減少させる一方で、タイトジャンクションおよびムチン産生の調節による粘膜バリアの強化に関与する遺伝子をアップレギュレートすることができる[95]。
腸内細菌叢は、主に肝臓で生産される一次胆汁酸の、遠位腸の腸内細菌が生産する主要な酵素を介した二次胆汁酸への変換を厳密に制御している[96]。二次胆汁酸は、粘膜免疫を強化するなど、宿主の健康に対して多くの効果を有している[97]。自閉症および精神疾患における微生物叢-胆汁酸相互作用に関与する証拠が増えている[98,99]。胆汁酸受容体FXRの活性化は、マウスの大腸炎を背景に、腸の透過性の低下および大腸の炎症性サイトカインの発現の減少をもたらす[100]。FXRおよび他の胆汁酸受容体は、免疫細胞の制御に関与しており、微生物叢に依存した胆汁酸代謝が腸および末梢免疫応答を制御することが示唆されている[100、101、102]。同時に、炎症は、免疫細胞からのコレステロールの輸送を損なうことにより、胆汁酸代謝に影響を与える[103]。興味深いことに、胆汁酸酵素と胆汁酸レセプターは脳にも存在することが知られている。多発性硬化症(MS)との関連では、循環二次胆汁酸がMS患者の脳のグリアおよび免疫細胞における胆汁酸受容体とともに変化していた[104]。胆汁酸が脳に存在するグリア細胞および免疫細胞を介してCNS機能に影響を与えることを考慮すると、腸内細菌叢がこれらの代謝物を制御することの意味は、神経精神疾患に対して腸胆汁酸-脳軸を標的とするアプローチである可能性がある。
腸内細菌叢と腸および脳をつなぐ直接的な経路として免疫系があるほか、これらの系をつなぐコミュニケーションの経路も存在する。最近、腸内細菌の変化が、肝の求心性レベルの迷走神経信号を介して脳幹に伝わり、さらに腸管ニューロンまで到達することが明らかになった [105] 。この肝臓-脳-腸の神経フィードバック回路は、腸の炎症の亢進を防ぎ、腸のT制御細胞の分化と維持を調節することで腸のホメオスタシスを維持するのに役立つ[105]。
腸内細菌叢は、腸関連リンパ組織の構造的発達に影響を与え、パターン認識受容体(PRR)およびSCFAなどのエピジェネティック制御因子による病原体関連パターン(PAMP)の認識を通じて、常在菌に対する耐性を維持し宿主防御を誘発する免疫応答を形成する[106]。最近、Akkermansia muciniphilaは、非カノニカルTLR2-TLR1ヘテロダイマーのアゴニストとして作用するリン脂質を通じて、炎症性サイトカインを選択的に刺激し、恒常的な宿主免疫応答を促進することが示された[107]。さらに、腸内細菌叢は、適応免疫系との相互依存的な関係も提示している。B細胞から分泌される腸管免疫グロブリンA(IgA)は、腸内細菌群集を修正し、さらには微生物相の多様化に寄与し、その結果、共生ループを通じてT制御細胞の拡大を促進することができる[108]。さらに、常在菌が生成するSCFAは、T制御細胞の誘導に不可欠であり、細菌の代謝産物が宿主免疫系の調節に重要であることがさらに示されている[90]。さらに、常在細菌(SFB)は、Th17細胞の静穏化様状態を誘発するが、病原性刺激に応答するとTh17細胞は炎症性プロファイルに偏る[109]。さらに、CD8+ T細胞は、記憶細胞としての長期生存を促進するために、微生物由来のSCFA、すなわち酪酸を必要とする[110]。免疫系の制御における腸内細菌シグナルの貢献はさておき、腸内細菌叢は神経炎症の媒介にますます関与している [111]。実際、興味深い新しい研究により、アストロサイトの特定のサブセットであるLAMP1+TRAIL+アストロサイトが、腸管修飾ナチュラルキラー細胞が産生するIFN-γに応答して、T細胞のアポトーシスを誘導することによりCNS炎症を制限し、CNS炎症における腸管微生物の調節の役割を証明した [112].
脳卒中との関連では、IL-6、CRP、リポ蛋白関連ホスホリパーゼA2が脳卒中リスクの潜在的慢性炎症マーカーとして提案されている[113]。さらに、好中球とリンパ球の比率は虚血性脳卒中と関連し[114]、CD64+好中球は脳卒中の6時間後に高く、発作の1週間後に低くなることから、好中球は脳卒中の病態に関与していることが示唆されている[115]。脳卒中の動物モデルでは、IL-17+γδT細胞が腸から交通し、脳卒中発作後に髄膜に集積し、脳実質への好中球浸潤を促進することから[116]、腸内細菌叢が脳卒中による神経炎症に影響を与えることが示唆された。
大うつ病性障害(MDD)は、神経炎症との関連性が高まっている複雑な衰弱性障害である [111] 。IL-8レベルをより良い抗うつ剤反応と関連付ける研究もあり[117]、一方、TNF-αレベルはMDD治療反応者において抗うつ剤治療により減少し、したがって、特定の末梢サイトカインレベルが抗うつ剤治療結果に重要であることを示唆している[118]。さらに、IL-6は、MDDにおいて上昇することが強固に報告されており、その結果、その遮断がより良い臨床結果をもたらすという提案がなされた。しかし、造血細胞移植を受けた個人における最近の研究では、IL-6拮抗薬のトシリズマブは、実際に有意にうつ症状を悪化させる結果となった [119] 。炎症性ミクログリアの活性化を抑制するテトラサイクリン系抗生物質であるミノサイクリンは、治療抵抗性うつ病の補強療法として有望な結果を示し、おそらくCNSの炎症を改善することを通してである [120] 。抗うつ剤治療は、炎症性因子を調節・抑制することから、うつ病に炎症が関与していること、また治療のターゲットとなりうることが示唆されている [121,122] 。
抗うつ剤は腸内細菌叢の構成を変化させ、Ruminococcus flavefaciensとAdlercreutzia equolifaciensを減少させ、R. flavefaciensは抗うつ剤の効果を妨害することが知られている [123].最近の研究では、MDDの個人において、3つの微生物種-Ruminococcus bromii、Lactococcus chungangensis、Streptococcus gallolyticus-が、IL-1βレベルの増加および臨床抑うつスコアパラメーターと異なる関係にあったことが示されている[124]。要約すると、サイトカインレベルは抗うつ薬治療に対する反応の中心であるように思われ、抗うつ薬治療におけるサイトカイン調節の重要性がさらに解明されると、腸内細菌叢とその代謝産物を調節することで炎症レベルも調節でき、その結果、より良い治療成績につながるという仮説が成り立つのである。
統合失調症は、IL-6、IL-8、IL-10などの多くの末梢循環サイトカインおよびケモカインの変化を伴う衰弱した精神疾患であり、免疫活性化の増加を示唆している [125] 。実際、IL-8、IL-10、TNF-αの高値は陰性症状の重症度と正の相関があり、特にIL-8の増加は抗精神病薬治療の反応不全と関連している [126]。さらに、早期の感染症や自己免疫疾患は統合失調症の発症と相関し、CSFにおける自己抗体やサイトカインの変化が同時に存在することが判明している[127]。報告された末梢の変化とともに、統合失調症患者の死後脳組織では、背外側前頭前野で炎症マーカーの増加がみられ、炎症が神経病理学、ひいては症状に影響を与えることが示唆されている[128]。さらに、統合失調症患者の腸内細菌叢はStreptococcus vestibularisに富んでおり、マウスに移植すると社会的相互作用の障害と運動過多の行動を誘発し、腸内の炎症関連経路の遺伝子発現を増加させることが明らかになった [129].特定の腸内細菌種がどの程度炎症に影響を与え、その結果、統合失調症の文脈における行動変化や神経病理学に影響を与えるかを理解するために、さらなる研究が必要である。
加齢
加齢に伴い、しばしば機能の低下や時には増加によって表されるように、顕著な免疫の違いが生じる。これは免疫老化という概念で、最終的には免疫反応の低下を促進する [130]。加齢に伴い、腸はリモデリングを起こし、バリア機能の低下、IgA、TLR4、T細胞(CD3ε+)、Tヘルパー(CD4+またはCD8+)などの自然免疫および適応免疫に関連する遺伝子の減少をもたらし、老化した腸におけるT細胞シグナル伝達経路が全体的に減少することが示唆されている。この適応免疫の活性化の減少が自然免疫系の刺激を誘発する可能性があるため、この減少は、慢性的な低悪性度炎症状態 [131] に寄与しうる [130]。加齢に伴い、A. muciniphilaの存在量が減少し、腸管リークを誘発し、その結果、炎症性因子が循環し、CCR2+単球を含むカスケードを誘発し、B細胞に干渉する [132] 。高齢のドナーから若いレシピエントへの糞便微生物腔移植(FMT)は、T細胞の活性化を介して、腸および全身性の低悪性度炎症を誘発するのに十分である[133,134∗]。逆に、若いドナーからの微生物叢を高齢のマウスに曝露すると、パイエル板におけるM細胞の成熟が促進され、腸のIgA応答が上昇したが、これは加齢によって破壊されたものである[135]。腸内細菌叢は、免疫学との接点を考えると、哺乳類の加齢に伴う顕著な低レベルの炎症性表現型である炎症性の調節の重要な候補である [136] 。例えば、末梢性の炎症マーカーは、精神的健康マーカーとともに、食事依存的に高齢者の腸内細菌叢プロファイルにリンクされている[137]。百寿者では、Bifidobacterium、Akkermansia、Christensenellaceaeが豊富に存在することから、長寿には特定の微生物生態系が見られ、健康に関連した特徴を持つ可能性があることが示唆されている[138]。これらを総合すると、加齢に伴うマイクロバイオームの変化が加齢に伴う炎症に寄与している可能性が示唆され、腸内細菌群の操作によって加齢に伴う炎症を緩和することができるという仮説が成り立つ [139]。
加齢は、単球、CD4+、CD8+ T細胞の増加など、末梢の免疫細胞集団の変化によっても特徴づけられるが、樹状細胞やB細胞などの他の細胞集団は加齢によって減少するようである[140]。加齢は、IL1-β、IL-6、IFN-βなどのサイトカイン、ケモカイン、免疫調節因子のレベル上昇によって強調される低レベルの全身性炎症を促進し、免疫細胞におけるさらなる炎症性状態を促進させる[140,141]。
加齢の過程で、老化細胞は、老化関連分泌表現型(SASP)の特徴として、老化細胞を除去するために免疫細胞の募集のために、炎症性サイトカインを放出する[142]。しかし、加齢に伴う老化細胞の蓄積とそれに伴うSASPの活性化は、慢性炎症の増大を促し、必然的に組織の変性をもたらし、加齢性疾患の進展に寄与する[113,142]。実際、神経炎症は、アルツハイマー病[143]やパーキンソン病[144]などの加齢に伴う神経変性疾患と関係があるとされています。炎症を抑えることで、マイクロバイオーム標的治療介入は、老化細胞の影響を緩和する可能性があり、したがって、加齢に伴う健康低下を緩和するための興味深い戦略を提起している [145]。さらに、動脈硬化性脳小血管疾患(aCSVD)患者では、腸内細菌組成が変化しており、これは炎症マーカー、特にIL-17aの発現の増加と相関していた[146]。今後、どの腸内細菌代謝物が、特に好中球によるIL-17a産生の悪化を引き起こしているかを特定することを目的とした研究は、aCSVDの標的治療法の開発につながる可能性を秘めています[146]。
一方、最近の前臨床研究では、加齢に伴いミクログリアが脂質滴を蓄積し、高レベルの活性酸素種を生成し、食作用が低下して炎症性サイトカインを放出することが示されている[148∗]。腸内細菌は加齢に伴うミクログリア機能に大きく影響し、より具体的には、加齢に伴う腸管透過性の上昇により、腸由来の代謝物であるN6-カルボキシメチルリジン(CML)が加齢マウスやヒト脳のミクログリアに蓄積し、活性酸素が増加し、ミクログリアのミトコンドリア活性が阻害されます[149]*]。加齢によるマイクロバイオームは、ミクログリア機能の障害とともに、網膜の炎症にも影響を与え、若いドナーから加齢したレシピエントへのFMTは、加齢によって引き起こされる腸管透過性の障害と全身性炎症を逆転させます[134∗]。さらに、若いドナーマウスからのFMTは、高齢マウスの微生物叢組成を再構築し、行動にプラスの影響を与えることが分かりました[150∗,151∗]。興味深いことに、腸内細菌叢由来の代謝物であるδ-バレロベタインは、FMTドナーの年齢依存的にレシピエントマウスの血清と脳で変化していました[151**]。さらに、マウスとヒトの両方で加齢に伴うδ-バレロベタインの増加が観察され、この代謝物の注射は若いマウスの認知能力を悪化させ、一方、若いドナーからの糞便移植の有益な認知効果を高齢マウスで逆転させた[151**]。また、腸内細菌由来の代謝物であるイソアミルアミンは、ミクログリア細胞死の誘導を介して加齢に伴う認知機能障害を促進することが知られており、腸内細菌叢の代謝が加齢に伴う脳機能・行動に影響を与えることが改めて確認された[152]。食事による介入もまた、加齢における炎症の重要なメディエーターであることが広く提唱されている。特に、地中海食は、寿命の延長、加齢に伴う疾患リスクの低減 [153] 、認知機能障害のリスク低減 [154] など、加齢の特徴を積極的に調節することが示唆されている。さらに、食事による介入は、老化の中心的な調節因子であるオートファジーの効果的な媒介となり得る [155]。まとめると、加齢は、炎症性疾患によって特徴づけられる広範な腸および神経炎症性環境を誘発する。興味深いことに、食事による介入の可能性はオートファジーを促進する可能性があり [155] 、これは非常に効果的な長寿調節因子であることが示されており、年齢依存の生理学的メカニズムにおける腸-脳軸の役割を示唆するものであった。
治療的意義と将来の展望
今後の微生物相研究は、病気の治療や予防のために微生物相を標的とすることに集中すべきであるが、それには課題がないわけではない [156] 。その焦点は、縦断的解析、介入研究、微生物工学と精密医療の可能性の活用に移行する必要がある。例えば、腸管に遺伝子を導入する細菌治療薬は、肥満マウスモデルでグルコース感受性を逆転させることができました[157]。さらに、炎症性腸疾患(IBD)コホートの微生物叢に存在する病原体をファージコンソーシアムによって抑制することで、これらの人々の腸の炎症を治療し、IBDの症状を緩和できたことが現在明らかになっている[158]。宿主の健康を改善するために腸内常在菌や病原体を標的としたこのようなツールは、疾患治療のための科学的アプローチの最前線に置かれるべきものです。脳の健康状態における微生物-免疫系の相互作用の理解が深まれば、標的を定めた介入につながる可能性があり、治療に対する個人間反応の理解に役立ち、おそらく将来的にはさまざまな精神神経疾患に対する治療のための精密なアプローチを指し示すことができるかもしれません。
結論
健康および疾病の制御における腸内細菌叢の新たな役割は、腸-免疫-脳の相互作用を調節する標的介入の新たな方法を指し示している。微生物叢の変化のメカニズムや腸-免疫-脳の相互作用の重要性を理解するためには、免疫および神経調節の可能性を持つ微生物由来の代謝物のスクリーニングを含む、FMT、薬理学的および食事介入などのアプローチに焦点を当てたさらなる研究が必要である。
利害関係者の宣言
APCマイクロバイオーム・アイルランドはアイルランド科学財団(SFI/12/RC/2273_P2)の助成を受けた研究センターである。クライアン教授はアイルランド科学財団(SFI/12/RC/2273_P2)、サックス・カバノー財団、スイス国立科学財団プロジェクトCRSII5_186346/NMS2068から資金提供を受けており、IFF、レキット、ヌトリシアから研究資金を受けている。フライスランドカンピーナとヌトリシアが主催する会合で招待講演者を務め、ネスレからコンサルタントを受けていたことがある。Clarke教授はJanssen、Probi、Apsenから招待講演者として謝礼を受け取り、PharmaviteとFonterraから研究資金を受け、Yakult、Zentiva、Heal pharmaceuticalsの有料コンサルタントである。
データの入手
この論文に記載されている研究には、データは使用されていない。
参考文献
1
T.C. Fung、C.A. Olson、E.Y. Hsiao
健康および疾患における微生物叢、免疫および神経系の相互作用
Nat Neurosci, 20 (2017), pp.145-155
CrossRefView Record in ScopusGoogleスカラー
2
J.F. Cryan, K.J. O'Riordan, C.S.M. Cowan, K.V. Sandhu, T.F.S. Bastiaanssen, M. Boehme, M.G. Codagnone, S. Cussotto, C. Fulling, A.V. Golubeva, et al.
マイクロバイオータ-腸-脳軸
Physiol Rev, 99 (2019), pp.1877-2013
CrossRefView レコードをScopusGoogle Scholarで見る
3
L.H.モライス、H.L.シュライバー、S.K.マズマニアン
行動と脳疾患における腸内細菌叢-脳軸
Nat Rev Microbiol, 19 (2021), pp.241-255
CrossRefView レコードをScopusGoogle Scholarで見る
4
D. Zheng, T. Liwinski, E. Elinav
健康・疾病における微生物叢と免疫の相互作用
Cell Res, 30 (2020), pp.492-506
CrossRefView レコードをScopusGoogle Scholarで見る
5
A. ラツィカ、M.C.コダニョーン、S.オマホニー、C.スタントン、J.F.クライアン
生命への呼び水:幼少期の栄養と微生物相
腸脳軸, 13 (2021), p.423
CrossRefView レコードをScopusGoogle Scholarで見る
6
M. Bordeleau, C.H. Comin, L. Fernández de Cossío, C. Lacabanne, M. Freitas-Andrade, F. González Ibáñez, J. Raman-Nair, M. Wakem, M. Chakravarty, LdF. Costa, et al.
マウスにおける母親の高脂肪食は、子マウスに脳血管、ミクログリアおよび長期的な行動変化を誘発する
コミュニケーションズバイオロジー, 5 (2022), p.26
ScopusGoogle Scholarで記録を見る
7
S. Xavier, A. Soch, S. Younesi, S. Malik, S.J. Spencer, L. Sominsky
妊娠前および妊娠中の母親の食事は、産後のラット脳におけるミクログリア活性化および神経新生を調節する
ブレイン・ビヘイビア・イミュン, 98 (2021), pp.185-197
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
8
S.D. Bilbo、V. Tsang
母親の肥満が子孫の脳内炎症と行動に及ぼす永続的な影響
24 (2010), pp.2104-2115
CrossRefView Record in ScopusGoogle Scholar
9
H.-K. Kwon, G.B. Choi, J.R. Huh
母体の炎症とその胎児神経発達への影響
Trends Immunol, 43 (2022), pp.230-244
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
10
C.R. Lammert, E.L. Frost, A.C. Bolte, M.J. Paysour, M.E. Shaw, C.E. Bellinger, T.K. Weigel, E.R. Zunder, J.R. Lukens
最先端:自閉症の出生前免疫活性化モデルにおける微生物叢を介した免疫系の制御の重要な役割
201 (2018), pp.845-850
CrossRefView レコードをScopusGoogle Scholarで見る
11
S. Kim, H. Kim, Y.S. Yim, S. Ha, K. Atarashi, T.G. Tan, R.S. Longman, K. Honda, D.R. Littman, G.B. Choi, et al.
母親の腸内細菌は、マウスの子孫の神経発達異常を促進する
ネイチャー, 549 (2017), pp.528-532
CrossRefView レコードをScopusGoogle Scholarで見る
12
G.B. Choi、Y.S. Yim、H. Wong、S. Kim、H. Kim、S.V. Kim、C.A. Hoeffer、D.R. Littman、J.R.Huh
マウスの母親のインターロイキン-17a経路は、子孫の自閉症様表現型を促進する
サイエンス, 351 (2016), pp.933-939
CrossRefView レコードをScopusGoogle Scholarで見る
13
Y. Shin Yim, A. Park, J. Berrios, M. Lafourcade, L.M. Pascual, N. Soares, J. Yeon Kim, S. Kim, H. Kim, A. Waisman, et al.
母体の炎症にさらされたマウスの行動異常を回復させる
ネイチャー, 549 (2017), pp.482-487
CrossRefView レコードをScopusGoogle Scholarで見る
14
E.Y. Hsiao、S.W. McBride、S. Hsien、G. Sharon、E.R. Hyde、T. McCue、J.A. Codelli、J. Chow、S.E. Reisman、J.F. Petrosino, et al.
神経発達障害に関連する行動的・生理的異常を微生物叢が調節する
Cell, 155 (2013), pp.1451-1463
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
15
S. Casey, M. Carter, A.M. Looney, V. Livingstone, G. Moloney, G.W. O'Keeffe, R.S. Taylor, L.C. Kenny, F.P. McCarthy, L.M.E. McCowan, et al.
自閉症スペクトラム障害児の母親における妊娠中期のサイトカイン調節障害
J Autism Dev Disord, 52 (2021), pp.3919-3932
Google Scholar
16
A.M. Graham, J.M. Rasmussen, M.D. Rudolph, C.M. Heim, J.H. Gilmore, M. Styner, S.G. Potkin, S. Entringer, P.D. Wadhwa, D.A. Fair, et al.
妊娠中の母親の全身性インターロイキン-6は、新生児の扁桃体の表現型および2歳時のその後の行動と関連している
Biol Psychiatr, 83 (2018), pp.109-119
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
17
S. タイブジ、A.J.ハナン、C.J.トンキン
雄マウスの病原性感染は精子small RNAプロファイルを変化させ、子孫の行動をトランスジェネレーション的に変化させる
セルリプ, 31 (2020), 記事 107573
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
18
M. ヴァインストック
げっ歯類の出生前ストレス要因:行動への影響
ニューロバイオル・ストレス, 6 (2017), pp.3-13
記事ダウンロードPDFView Record in ScopusGoogle Scholar
19
B.R. Van den Bergh, M.I. van den Heuvel, M. Lahti, M. Braeken, S.R. de Rooij, S. Entringer, D. Hoyer, T. Roseboom, K. Räikkönen, S.J.N. King, et al.
行動とメンタルヘルスの出生前発達の起源:妊娠中の母親のストレスの影響
117(2020)年、26-64頁
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
20
S. 聯、郭淳、王玲、李和、王貞、季宏、孔福、徐斌、李淑、楊宏
出生前の低温ストレスがラットの胎盤生理、炎症反応、アポトーシスに与える影響
オンコターゲット, 8 (2017), pp.115304-115314
CrossRefView Record in ScopusGoogleスカラー
21
T.L.Gur, L.Shay, A.V.Palkar, S.Fisher, V.A.Varaljay, S.Dowd, M.T.Bailey
出生前ストレスは胎盤のサイトカインとニューロトロフィン、常在菌、成人女性の子孫の不安様行動に影響を与える
ブレイン・ビハーブ・イミュン,64(2017),50-58頁
記事ダウンロードPDFView Record in ScopusGoogle Scholar
22
S.L.ブロンソン、T.L.ベール
出生前ストレスによる胎盤炎症の増加と子孫の多動は男性特異的であり、母親の抗炎症治療により改善される
エンドクリノロジー, 155 (2014), pp.2635-2646
CrossRefView レコードをScopusGoogle Scholarで見る
23
A.R. Zuena、J. Mairesse、P. Casolini、C. Cinque、G.S. Alemà、S. Morley-Fletcher、V. Chiodi、L.G. Spagnoli、R. Gradini、A. Catalani、et al.
出生前の拘束ストレスは、雄ラットと雌ラットに2つの異なる行動および神経化学的プロフィールを生成する
PLoS One, 3 (2008), 記事 e2170
CrossRefView Record in ScopusGoogle Scholar
24
S.B. Gumusoglu、R.S. Fine、S.J. Murray、J.L. Bittle、H.E. Stevens
出生前ストレス後の神経発達におけるIL-6の役割
ブレイン・ビハーブ・イミュン,65(2017),274-283頁
記事ダウンロードPDFView Record in ScopusGoogle Scholar
25
H.J. Chen, A.M. Antonson, T.A. Rajasekera, J.M. Patterson, M.T. Bailey, T.L. Gur
出生前ストレスは子宮内炎症とセロトニン作動性機能障害を引き起こし、微生物とCCL2依存性の機序で長期的な行動障害を引き起こす
Transl Psychiatry, 10 (2020), p.191
クロスレフゴーグルスカラー
26
R.W.ウォーカー、J.C.クレメンテ、I.ピーター、R.J.F.ルース
出生前の腸内細菌叢:我々は胎内で細菌にコロニー化されているのか?
Pediatr Obes, 12 (Suppl 1) (2017), pp.3-17
CrossRefView Record in ScopusGoogleスカラー
27
M.E.ペレス-ムニョス、M.-C. アリエッタ、A.E.ラメール-テイト、J.ウォルター
無菌子宮」と「子宮内コロニー化」仮説の批判的評価:パイオニア乳児マイクロバイオーム研究への示唆
マイクロバイオーム、5(2017)、48頁
ScopusGoogle Scholarで記録を見る
28
K.E. Fujimura, A.R. Sitarik, S. Havstad, D.L. Lin, S. Levan, D. Fadrosh, A.R. Panzer, B. LaMere, E. Rackaityte, N.W. Lukacs, et al.
新生児腸内細菌叢は小児期の多感性アトピーおよびT細胞分化と関連する
ナットメッド, 22 (2016), pp.1187-1191
CrossRefView レコードをScopusGoogle Scholarで見る
29
M.C.コラード、N.セガタ
子宮内微生物コロニー形成の初期探索
ナットメッド, 26 (2020), pp.469-470
CrossRefView レコード in ScopusGoogle Scholar
30
E. ラカイティテ、J. ハルキアス、E.M. フクイ、V.F. メンドーサ、C. ヘイゼルデン、E.D. クロフォード、 K.E. 藤村、 T.D. バート、S.V. リンチ
子宮内のヒト腸内では有効な細菌のコロニー形成が高度に制限される
Nat Med, 26 (2020), pp.599-607
CrossRefView レコードをScopusGoogle Scholarで見る
31
J. ウォルター、M.W.ホルネフ
出生前の子宮内マイクロバイオーム論争に関する哲学的な視点
マイクロバイオーム、9(2021)、p. 5
ScopusGoogle Scholarで記録を見る
32
T. ゲンソレン、S.S.アイヤー、D.L.カスパー、R.S.ブラムバーグ
幼少期の微生物叢によるコロニー形成が免疫系を形成する仕組み
サイエンス、352号(2016)、pp.539-544
CrossRefView レコードをScopusGoogle Scholarで見る
33
J.A. Gilbert, M.J. Blaser, J.G. Caporaso, J.K. Jansson, S.V. Lynch, R. Knight
ヒトマイクロバイオームに関する現在の理解
ナットメッド, 24 (2018), pp.392-400
CrossRefView レコードをScopusGoogle Scholarで見る
34
J. Roswall, L.M. Olsson, P. Kovatcheva-Datchary, S. Nilsson, V. Tremaroli, M.-C. Simon, P. Kiilerich, R. Akrami, M. Krämer, M. Uhlén, et al.
生後5年間の健康なヒトの腸内細菌叢の発達の軌跡
Cell Host Microbe, 29 (2021), pp.765-776.e763
ScopusGoogle Scholarで記録を見る
35
M.G. Codagnone, C. Stanton, S.M. O'Mahony, T.G. Dinan, J.F. Cryan(コダニョーン、スタントン、S.M. オマホニー、T.G. ディナン、J.F. クリアン
微生物叢と神経発達の軌跡:母親と早期の栄養の役割
Ann Nutr Metabol, 74 (suppl 2) (2019), pp.16-27
CrossRefView Record in ScopusGoogleスカラー
36
C. Milani, S. Duranti, F. Bottacini, E. Casey, F. Turroni, J. Mahony, C. Belzer, S. Delgado Palacio, S. Arboleya Montes, L. Mancabelli, et al.
ヒト腸管の最初の微生物コロニー:乳児腸内細菌叢の組成、活動、および健康への影響
マイクロバイオル・モルバイオル・レブ、81(2017)年
Google Scholar
37
B.L. Callaghan, A. Fields, D.G. Gee, L. Gabard-Durnam, C. Caldera, K.L. Humphreys, B. Goff, J. Flannery, E.H. Telzer, M. Shapiro, et al.
心と腸:逆境にさらされた子どもの気分と胃腸の苦痛の関連性
デブサイコパス, 32 (2020), pp.309-328
クロスレフゴーグル・スカラー
38
C.S.M.コーワン、T.G.ディナン、J.F.クライアン
年次研究レビュー:クリティカルウィンドウ-神経認知発達における微生物叢-腸-脳軸
JCPP(J Child Psychol Psychiatry), 61 (2020), pp.353-371
CrossRefView レコードをScopusGoogle Scholarで見る
39
M.G.ドミンゲス-ベロ、E.K.コステロ、M.コントレラス、M.マグリス、G.イダルゴ、N.フィーア、R.ナイト
新生児の初期微生物叢の獲得と構造は、出産形態によって異なる。
Proc Natl Acad Sci U S A, 107 (2010), pp.11971-11975
CrossRefView ScopusGoogle Scholarで記録を見る
40
C. Roduit, S. Scholtens, J.C. de Jongste, A.H. Wijga, J. Gerritsen, D.S. Postma, B. Brunekreef, M.O. Hoekstra, R. Aalberse, H.A. Smit
帝王切開で出生した小児の8歳時の喘息について
Thorax, 64 (2009), pp.107-113
CrossRef記録をScopusGoogle Scholarで見る
41
H. Bisgaard, N. Li, K. Bonnelykke, B.L. Chawes, T. Skov, G. Paludan-Muller, J. Stokholm, B. Smith, K.A. Krogfelt
乳幼児期の腸内細菌叢の多様性低下は、学童期のアレルギー疾患リスク上昇と関連する
J Allergy Clin Immunol, 128 (2011), pp.646-652
e641-645
ScopusGoogle Scholarで記録を見る
42
J. Stokholm, J. Thorsen, M.J. Blaser, M.A. Rasmussen, M. Hjelmsø, S. Shah, E.D. Christensen, B.L. Chawes, K. Bønnelykke, S. Brix, et al.
出産形態と腸内細菌の変化は小児喘息のリスク上昇と相関する
12 (2020), 記事 eaax9929
ScopusGoogle Scholarで記録を見る
43
V. アンデルセン、S.メラー、P.B.イェンセン、F.T.メラー
Green A:帝王切開分娩と慢性炎症性疾患(炎症性腸疾患、関節リウマチ、セリアック病、糖尿病)のリスク:1973~2016年のデンマークにおける2,699,479人の出生に関する人口ベースのレジストリ調査
Clin Epidemiol, 12 (2020), pp.287-293
CrossRefView レコードをScopusGoogle Scholarで見る
44
A. カスティーリョ-ルイーズ、M.モズレー、A.J.ジェイコブス、Y.C.ホフィズ、N.G.フォージャー
マウス脳における出産形態の周産期細胞死への影響
Proc Natl Acad Sci U S A, 115 (2018), pp.11826-11831
CrossRefView レコードをScopusGoogle Scholarで見る
45
L.H.モライス、A.V.ゴルベバ、G.M.モロニー、A.モヤ=ペレス、A.P.ベンチュラ=シルバ、S.アルボレヤ、T.F.バスティアーンセン、O.オサリバン、K.レア、Y.ボルレ
マウスの帝王切開による出産がもたらす永続的な行動効果
Curr Biol, 30 (2020), pp.3761-3774
ScopusGoogle Scholarで記録を見る
46
M.A. Underwood、K. Sohn
極早産児の微生物叢について
Clin Perinatol, 44 (2017), pp.407-427
記事ダウンロードPDFView Record in ScopusGoogle Scholar
47
M. フェルナンデス、S.ハンナ、A.シャーマ
極早産児の神経発達アウトカム:シェアードケアの意思決定の指針となる理論的・疫学的視点
小児保健,32(2022),18-27頁
記事ダウンロードPDF表示ScopusGoogle Scholarで記録を見る
48
Y.P. Silva, A. Bernardi, R.L. Frozza
腸-脳コミュニケーションにおける腸内細菌叢由来の短鎖脂肪酸の役割
Front Endocrinol, 11 (2020), p. 25
ScopusGoogle Scholarで記録を見る
49
B.H. Mullish, H.R.J.C.M. Williams
クロストリジウム・ディフィシル感染症と抗生物質関連下痢症
18 (2018), p. 237
CrossRefView レコード in ScopusGoogle Scholar
50
J. ラミレス、F.グアルナー、L.ブストス・フェルナンデス、A.マルイ、V.L.スデパニアン、HJFicコーエン、アイ・マイクロビオロジー
腸内細菌叢の主要な破壊者としての抗生物質
(2020), p. 731
ScopusGoogle Scholarで記録を見る
51
F. Ahmadizar, S.J.H. Vijverberg, H.G.M. Arets, A. de Boer, J.E. Lang, J. Garssen, A. Kraneveld, A.H. Maitland-van der Zee
早期の抗生物質曝露は、その後のアレルギー症状の発症リスクを高める:メタアナリシス
73 (2018), pp.971-986
CrossRefView レコードをScopusGoogle Scholarで見る
52
A. ヴォルコヴァ、K. ラグルズ、A. シュルファー、Z. ガオ、S.D. ギンズバーグ、M.J. ブレイザー
幼少期のペニシリン曝露が腸内細菌叢、前頭葉および扁桃体の遺伝子発現に与える影響
iScience, 24 (2021), 記事 102797
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
53∗
H.E. Vuong, G.N. Pronovost, D.W. Williams, E.J.L. Coley, E.L. Siegler, A. Qiu, M. Kazantsev, C.J. Wilson, T. Rendon, E.Y. Hsiao
母体マイクロバイオームがマウスの胎児の神経発達を調節する
ネイチャー, 586 (2020), pp.281-286
CrossRefView Record in ScopusGoogleスカラー
母体腸内のある種の微生物が、母体血清や胎児脳内の循環小分子を調節し、視床皮質神経細胞の成長や感覚運動行動に関連していることを示唆。
54
S. Leclercq, F.M. Mian, A.M. Stanisz, L.B. Bindels, E. Cambier, H. Ben-Amram, O. Koren, P. Forsythe, J. Bienenstock
幼少期の低用量ペニシリンは、マウスの腸内細菌叢、脳内サイトカイン、行動において長期的な変化を誘発する
Nat Commun, 8 (2017), 記事 15062
ScopusGoogle Scholarで記録を見る
55
K. アルベス・デ・リマ、J.ルステンホーベン、キプニス・JJAroi
髄膜免疫とその機能による健常・疾病時の中枢神経系の維持
38 (2020), pp.597-620
CrossRefView Record in ScopusGoogle Scholar
56
S. Brioschi, W.-L. Wang, V. Peng, M. Wang, I. Shchukina, Z.J. Greenberg, J.K. Bando, N. Jaeger, R.S. Czepielewski, A.J.S. Swain.
髄膜B細胞の異質性から明らかになった中枢神経系境界のリンパ球造血ニッチ
373 (2021), Article eabf9277
ScopusGoogle Scholarで記録を見る
57∗∗
J. Rustenhoven, A. Drieu, T. Mamuladze, K.A. de Lima, T. Dykstra, M. Wall, Z. Papadopoulos, M. Kanamori, A. F. Salvador, W.J.C. Baker.
神経免疫インターフェースとしての硬膜洞の機能的特徴づけ
184 (2021), pp.1000-1016. e1027
ScopusGoogle Scholarで記録を見る
末梢信号が硬膜洞に到達し、脳における免疫監視と免疫反応に機能的な成果をもたらすことを初めて明らかにした。
58
M. Ribeiro, H.C. Brigas, M. Temido-Ferreira, P.A. Pousinha, T. Regen, C. Santa, J.E. Coelho, I. Marques-Morgado, C.A. Valente, S. Omenetti, et al.
髄膜γδT細胞由来のIL-17はシナプス可塑性と短期記憶を制御する
サイエンス・イムノロジー, 4 (2019), p. eaay5199
ScopusGoogle Scholarで記録を見る
59
T. Regen, S. Isaac, A. Amorim, N.G. Núñez, J. Hauptmann, A. Shanmugavadivu, M. Klein, R. Sankowski, I.A. Mufazalov, N. Yogev, et al.
IL-17は腸内マイクロバイオームを通じて中枢神経系の自己免疫を制御する
サイエンス・イミュノロジー, 6 (2021), p. eaaz6563
ScopusGoogle Scholarで記録を見る
60∗
Z. Fitzpatrick、G. Frazer、A. Ferro、S. Clare、N. Bouladoux、J. Ferdinand、Z.K. Tuong、M.L. Negro-Demontel、N. Kumar、O. Suchanek、et al.
腸で教育されたIgA形質細胞は髄膜静脈洞を守る
Nature, 587 (2020), pp.472-476
CrossRefView レコードをScopusGoogle Scholarで見る
ヒトおよびマウスの硬膜静脈洞に隣接して、血液を介した病原体が脳に侵入するのを防ぐために機能的に重要な腸管型IgA産生形質細胞の存在を決定し、髄膜IgAが脆弱な瞬間に中枢神経系を「守る」ために重要であることを示唆している。
61
D. 61 D. Erny, A.L. Hrabě de Angelis, D. Jaitin, P. Wieghofer, O. Staszewski, E. David, H. Keren-Shaul, T. Mahlakoiv, K. Jakobshagen, T. Buch, et al.
宿主微生物叢は、CNSにおけるミクログリアの成熟と機能を常に制御している
Nat Neurosci, 18 (2015), pp.965-977
CrossRefView レコードをScopusGoogle Scholarで見る
62∗∗
D. Erny、N. Dokalis、C. Mezö、A. Castoldi、O. Mossad、O. Staszewski、M. Frosch、M. Villa、V. Fuchs、A. Mayer、et al.
微生物叢由来の酢酸は、健康時および疾患時の脳自然免疫系の代謝的適性を可能にする
Cell Metabol, 33 (2021), pp.2260-2276.e2267
ScopusGoogle Scholarで記録を見る
微生物由来の酢酸が、健康時および神経変性時のミクログリアの成熟、代謝状態、貪食のメカニキックモデュレーターであることを明らかにした。
63∗∗
C. 朱、M.H. Murdock、D. Jing、T.H. Won、H. Chung、A.M. Kressel、T. Tsaava、M.E. Addorisio、 G.G. Putzel、L. Zhou、et al.
微生物叢は、神経細胞機能と恐怖の消滅学習を制御する
ネイチャー, 574 (2019), pp.543-548
CrossRefView Record in ScopusGoogleスカラー
重要な発生寡少期の腸内細菌叢のシグナルが、成体動物におけるミクログリアを介したシナプス後樹状突起スパインの学習関連リモデリングを逆転させることができることを実証。
64
O. バラード、A.L.モロー
ヒトの母乳組成:栄養素と生理活性因子
小児科臨床、60(2013)、49-74頁
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
65
R. カブレラ・ルビオ、M.C.コラード、K.ライティネン、S.サルミネン、E.イソラウリ、A.ミラ
ヒトのミルクマイクロバイオームは授乳期を通じて変化し、母親の体重と分娩様式によって形成される
Am J Clin Nutr, 96 (2012), pp.544-551
CrossRefView ScopusGoogle Scholarで記録を見る
66
H.D. Holscher、L. Bode、K.A. Tappenden
ヒトミルクオリゴ糖はin vitroで腸管上皮細胞の成熟に影響する
J Pediatr Gastroenterol Nutr, 64 (2017), pp.296-301
ScopusGoogle Scholarで記録を見る
67
F. Chleilat、T. Klancic、K. Ma、A. Schick、J.E. Nettleton、R.A. Reimer
人乳オリゴ糖の補給は、幼若スプラグドーリーの消化管における腸管バリア機能と微生物組成に影響を与える
ニュートリエンツ, 12 (2020)
Google Scholar
68
R.Y. Wu, B. Li, Y. Koike, P. Määttänen, H. Miyake, M. Cadete, K.C. Johnson-Henry, S.R. Botts, C. Lee, T.R. Abrahamsson, et al.
ヒト乳オリゴ糖は実験的壊死性腸炎におけるムチンの発現を増加させる
Mol Nutr Food Res, 63 (2019), 記事 1800658
ScopusGoogle Scholarで記録を見る
69
B.M. Henrick、L. Rodriguez、T. Lakshmikanth、C. Pou、E. Henckel、A. Arzoomand、A. Olin、J. Wang、J. Mikes、Z. Tan、et al.
ビフィズス菌を介した生後早期の免疫系の刷り込み
Cell, 184 (2021), pp.3884-3898.e3811
ScopusGoogle Scholarで記録を見る
70∗∗
Z. Al Nabhani、S. Dulauroy、R. Marques、C. Cousu、S. Al Bounny、F. Dejardin、T. Sparwasser、M. Berard、N. Cerf-Bensussan、G. Eberl
成人における免疫病理学への抵抗性には、微生物叢に対する離乳反応が必要である
Immunity, 50 (2019), pp.1276-1288.e1275
ScopusGoogle Scholarで記録を見る
腸内細菌叢による早期の免疫細胞のプライミングが免疫系機能に及ぼす長期的な影響についての解説。
71
F. Fouhy, C. Watkins, C.J. Hill, C.A. O'Shea, B. Nagle, E.M. Dempsey, P.W. O'Toole, R.P. Ross, C.A. Ryan, C. Stanton
周産期因子は出生後4年までの腸内細菌叢に影響を与える
Nat Commun, 10 (2019), p.1517
ScopusGoogle Scholarで記録を見る
72
A.M. Levin, A.R. Sitarik, S.L. Havstad, K.E. Fujimura, G. Wegienka, A.E. Cassidy-Bushrow, H. Kim, E.M. Zoratti, N.W. Lukacs, H.A. Boushey, et al.
妊娠、社会文化的、環境的要因が幼少期の腸内細菌叢の構造と多様性に及ぼす共同効果
サイ・レップ, 6 (2016), p.31775
ScopusGoogle Scholarで記録を見る
73
J.S.ペパー、R.E.ダール
ホルモンの急増:思春期における脳と行動の相互作用
Curr Dir Psychol Sci, 22 (2013), pp.134-139
CrossRefView レコードをScopusGoogle Scholarで見る
74
H.C.ブレンハウス、J.M.J.N.シュワルツ、B.レビュー、イムノアドレスィセンス
神経免疫発達と思春期の行動,70 (2016), pp.288-299
記事PDFダウンロードScopusで記録を見る
75
B. マクドナルド、K.D.マッコイ
妊娠・初期における母体微生物叢, 365 (2019), pp.984-985
CrossRefRefView Record in Scopus
76
A. ダネーゼ、T・E・モフィット、H・ハリントン、B・J・ミルン、G・ポランチク、C・M・パリアンテ、R・ポルトン
Caspi AJAop, medicine a: 小児期の有害体験と成人後の加齢性疾患の危険因子:うつ病、炎症、代謝性危険因子のクラスタリング
163 (2009), pp.1135-1143
ScopusGoogle Scholarで記録を見る
77∗
P. 蔡 瑩、陳 慈、劉 咏、山 喆、朱 慈、彭 喆、張 茂、ファージンプール、周 偉之、趙 晓
早期の炎症は樹状突起スパインのミクログリアによる巻き込みを介して思春期の抑うつ症状を促進する
109 (2021), pp.2573-2589
e2579
ScopusGoogle Scholarで記録を見る
幼少期のミクログリアによる神経シナプスの巻き込みが炎症時に阻害され、その後のうつ様行動に長期的な影響を及ぼすことを強調している。
78
S.D. Bilbo
Schwarz JMJFibn: Early-life Programming of later-life brain and behavior: a critical role for the immune system(シュワルツ JMJ フィブン:脳と行動の初期プログラミング:免疫系の重要な役割
3 (2009), p. 14
ScopusGoogle Scholarで記録を見る
79
A. ルーヴォー、I. スミルノフ、T.J. キーズ、J.D. エクルズ、S.J. ルハニ、J.D. ペスケ、N.C. デレッキ、D. キャッスル、J.W. マンデル、K.S.J.N. リー
中枢神経系リンパ管の構造的・機能的特徴
523 (2015), pp.337-341
CrossRefView レコードをScopusGoogle Scholarで見る
80
L.M.ハブリッツ、ネデルガードMJJoN
グリムパティックシステム:新規の
基礎神経生物学の構成要素, 41 (2021), pp.7698-7711
CrossRefView レコードをScopusGoogle Scholarで見る
81
S.H. Suh, K. Choe, S.P. Hong, S.H. Jeong, T. Mäkinen, K.S. Kim, K. Alitalo, C.D. Surh, G.Y. Koh, J.H. Song.
腸内細菌叢は腸絨毛マクロファージのVEGF-Cを誘導することで乳汁分泌の完全性を制御している
EMBO Rep, 20 (2019)
グーグル スカラー
82
L. ファルクス、S.J.ブレイクモア
ヒト思春期の脳発達における個人差の研究
ナット・ニューロサイ、21(2018)、315-323頁
CrossRefView レコードをScopusGoogleスカラーで見る
83
W.-L. Wu、M.D. Adame、C.-W. Liou、J.T. Barlow、T.-T. Lai, G. Sharon, C.E. Schretter, B.D. Needham, M.I. Wang, W. Tang, et al.
微生物相は脳のストレス応答ニューロンを介して社会的行動を制御する
ネイチャー, 595 (2021), pp.409-414
CrossRefView レコードをScopusGoogle Scholarで見る
84
Simkin DR: マイクロバイオームとメンタルヘルス
特に思春期に関連するものとして
Curr Psychiatr Rep, 21 (2019), p.93.
グーグルスカラー
85
Z.M. Tapp, J.P. Godbout, Kokiko-Cochran ONJFin
傾いた軸:不適応な炎症とHPA軸の機能不全はTBIの結果に寄与する
10 (2019), p. 345
ScopusGoogle Scholarで記録を見る
86
N. ロピッツォ、M.マリゾーニ、V.ベグニ、M.マゼッリ、S.プロヴァシ、L.ボルルッソ、M.A.リヴァ、A.カッタネーオ
思春期の社会的孤立と腸内細菌叢組成および海馬の炎症の長期的変化:精神疾患への影響-dirk Hellhammer Award Paper 2021
精神神経内分泌学, 133 (2021), 記事 105416
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
87
C.M.マコーミック、K.スミス、J.L.バウンバック、A.P.N.デリマ、M.シェーバー、T.E.ホッジス、M.L.マルコリン、N.イスマイル
思春期の社会的不安定性ストレスはラットの神経内分泌-免疫-腸軸に即時的かつ持続的な性特異的変化をもたらす
Horm Behav, 126 (2020), 記事 104845
記事ダウンロードPDF表示ScopusGoogle Scholarで記録を見る
88
E.D. Sonnenburg、J.L. Sonnenburg
微生物の自己を飢えさせる:微生物がアクセスできる炭水化物を欠く食事の有害な結果
セル・メタボル, 20 (2014), pp.779-786
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
89
P.M.スミス、M.R.ハウィット、N.パニコフ、M.ミショー、C.A.ガリーニ、M.ボーロリー-Y、J.N.グリックマン、W.S.ギャレット
微生物の代謝物である短鎖脂肪酸は
大腸Treg細胞のホメオスタシスを制御する, 341 (2013), pp.569-573
CrossRefView レコードをScopusGoogle Scholarで見る
90
N. このような状況下において、「食の安全・安心」を確保するためには、「食の安全・安心」を確保することが重要である。
常在菌が産生する代謝産物は、末梢性制御性T細胞の生成を促進する
ネイチャー, 504 (2013), pp.451-455
CrossRefView レコードをScopusGoogle Scholarで見る
91
K. マッキ、E.C.ディーハン、J.ウォルター、FJChベックヘド
Microbe 宿主の健康と疾患における食物繊維の腸内細菌叢への影響、23 (2018), pp.705-715
記事PDFをダウンロードするScopusで記録を見る
92∗
H.C. Wastyk、G.K. Fragiadakis、D. Perelman、D. Dahan、B.D. Merrill、F.B. Yu、M. Topf、C.G. Gonzalez、W. Van Treuren、S. Han, et al.
腸内細菌叢を標的とした食事はヒトの免疫状態を調節する
Cell, 184 (2021), pp.4137-4153.e4114
グーグルスカラー
高発酵食品食や高繊維食などの微生物叢を標的とした食事は、腸内微生物叢に異なる影響を与え、個々に応じた免疫反応をもたらすことが可能であり、個々に応じた介入に基づく戦略の可能性を示唆。
93
A. コンラッド、コン、ダック、ボルラザ、エルソン、C.O.
腸内細菌叢の抗原に対するマウス免疫応答の緊密な粘膜コンパートメント化
消化器病学, 130 (2006), pp.2050-2059
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
94
M. シャン、ジェンティル、イェイザー・ジョン、ウォーランド、ボーンスタイン・ビクター、チェン、ヘー、カシス、ビガス、コルス、他。
粘液が免疫制御シグナルを伝達することにより、腸の恒常性と口腔内耐性を高める
サイエンス, 342 (2013), pp.447-453
CrossRefView レコードをScopusGoogle Scholarで見る
95
T. バンサル、C.アラニズ・ロバート、K.ウッド・トーマス、A.ジャヤラマン
細菌のシグナルであるインドールは、上皮細胞のタイトジャンクション抵抗を増加させ、炎症の指標を減弱させる。
Proc Natl Acad Sci USA, 107 (2010), pp.228-233
CrossRef記録をScopusGoogle Scholarで見る
96
A.F. Hofmann
毒性胆汁酸であるリトコール酸の解毒:薬物肝毒性との関連性
Drug Metab Rev, 36 (2004), pp.703-722
ScopusGoogle Scholarで記録を見る
97
R. 孫、徐、馮、高、劉
腸管粘膜免疫応答の制御における胆汁酸の重要な役割
消化器病学の治療的進歩, 14 (2021), 記事 17562848211018098
Google Scholar
98
A.V. Golubeva, S.A. Joyce, G. Moloney, A. Burokas, E. Sherwin, S. Arboleya, I. Flynn, D. Khochanskiy, A. Moya-Pérez, V. Peterson, et al.
胆汁酸およびトリプトファン代謝における微生物に関連した変化は、自閉症モデルマウスの胃腸機能障害と関連している
EBioMedicine, 24 (2017), pp.166-178
記事ダウンロードPDFView Record in ScopusGoogle Scholar
99
S. スピチャック、T.F.S.バスティアンスセン、K.ベルディング、K.ヴルコヴァ、G.クラーク、T.G.ディナン、J.F.クライアン
メンタルヘルスのための微生物マイニング:ヒトの脳の健康と疾患における微生物代謝経路の役割の決定
Neurosci Biobehav Rev, 125 (2021), pp.698-761
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
100
R.M. Gadaleta, K.J. van Erpecum, B. Oldenburg, E.C. Willemsen, W. Renooij, S. Murzilli, L.W. Klomp, P.D. Siersema, M.E. Schipper, S. Danese, et al.
ファルネソイドX受容体の活性化は、炎症性腸疾患における炎症を抑制し、腸管バリアを維持する
Gut, 60 (2011), pp.463-472
CrossRef記録をScopusGoogle Scholarで見る
101
V. Massafra, N. Ijssennagger, M. Plantinga, A. Milona, J.M. Ramos Pittol, M. Boes, S.W. van Mil
FXRを介した黄砂大腸炎の改善における脾臓樹状細胞の関与
バイオキム・バイオフィジックス・アクタ, 1862 (2016), pp.166-173
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
102
S. Cipriani, A. Mencarelli, M.G. Chini, E. Distrutti, B. Renga, G. Bifulco, F. Baldelli, A. Donini, S. Fiorucci
胆汁酸受容体GPBAR-1(TGR5)は腸管バリアーの完全性と実験的大腸炎に対する免疫応答を調節する
PLoS One, 6 (2011), 記事e25637
CrossRefView レコードをScopusGoogle Scholarで見る
103
F.C. McGillicuddy、MdlL. Moya, C.C. Hinkle, M.R. Joshi, E.H. Chiquoine, J.T. Billheimer, G.H. Rothblat, M.P. Reilly
炎症は生体内の逆コレステロール輸送を阻害する
Circulation, 119 (2009), pp.1135-1145
Google Scholar
104
P. Bhargava, M.D. Smith, L. Mische, E. Harrington, K.C. Fitzgerald, K. Martin, S. Kim, A.A. Reyes, J. Gonzalez-Cardona, C. Volsko, et al.
多発性硬化症では胆汁酸代謝が変化しており、補充することで神経炎症が改善する
J Clin Investig, 130 (2020), pp.3467-3482
CrossRefView レコードをScopusGoogle Scholarで見る
105
T. 寺谷拓也、三上雄一郎、中本直樹、鈴木崇生、原田泰治、岡林宏一、萩原康弘、谷木直樹、河野恭一郎、柴田茂、他.
肝-脳-腸神経アークは腸のTreg細胞ニッチを維持する
Nature, 585 (2020), pp.591-596
CrossRefView レコードをScopusGoogle Scholarで見る
106
Y. Jiao, L. Wu, N.D. Huntington, X. Zhang
腸内細菌叢と自然免疫のクロストークと自己免疫疾患への関与
(2020), p. 11
ScopusGoogle Scholarで記録を見る
107
M. Bae, C.D. Cassilly, X. Liu, S.-M. P. Filipčík, A.S. Bolze, Z. Liu, et al.
アッケシソウのリン脂質は恒常的な免疫反応を誘導する
ネイチャー, 608 (2022), pp.168-173
CrossRefView レコードをScopusGoogle Scholarで見る
108
S. 川本真一、丸屋真男、加藤ルシア、須田和彦、新建設、土井康弘、筒井康隆、秦肇、本田健、岡田知也、他。
Foxp3+T細胞は免疫グロブリンAの選択を制御し、免疫恒常性維持に関わる細菌種の多様化を促進する
イミュニティ, 41 (2014), pp.152-165
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
109
S. Omenetti, C. Bussi, A. Metidji, A. Iseppon, S. Lee, M. Tolaini, Y. Li, G. Kelly, P. Chakravarty, S. Shoaie, et al.
腸は機能的に異なる恒常性組織常在細胞と炎症性Th17細胞を保有する
イミュニティ, 51 (2019), pp.77-89.e76
ScopusGoogle Scholarで記録を見る
110
A. Bachem, C. Makhlouf, K.J. Binger, D.P. de Souza, D. Tull, K. Hochheiser, P.G. Whitney, D. Fernandez-Ruiz, S. Dähling, W. Kastenmüller, et al.
微生物叢由来の短鎖脂肪酸は、抗原活性化CD8(+)T細胞の記憶能を促進する
イミュニティ, 51 (2019), pp.285-297.e285
ScopusGoogle Scholarで記録を見る
111
J.S. クルス-ペレイラ、K. レア、Y.M. ノーラン、オリアリーOF、T.G. ディナン、J.F. クライアン
うつ病の三位一体:ストレスの調節障害
免疫とマイクロバイオーム, 71 (2020), 49-78頁
CrossRefView レコードをScopusGoogle Scholarで見る
112
L.M. Sanmarco, M.A. Wheeler, C. Gutiérrez-Vázquez, C.M. Polonio, M. Linnerbauer, F.A. Pinho-Ribeiro, Z. Li, F. Giovannoni, K.V. Batterman, G. Scalisi, et al.
腸管ライセンスされたIFNγ(+)NK細胞はLAMP1(+)TRAIL(+)抗炎症性アストロサイトを駆動する
ネイチャー, 590 (2021), pp.473-479
CrossRefView レコードをScopusGoogle Scholarで見る
113
C.E.フィンガー、I.モレノ-ゴンザレス、A.グティエレス、J.F.モルノ-マンチョン、L.D.マッカロー
加齢に伴う免疫変化と脳血管の炎症
Mol Psychiatr, 27 (2022), pp.803-818
CrossRefView ScopusGoogle Scholarで記録を見る
114
L.-Y. Huang, F.-R. Sun, J.-J. Yin, Y.-H. Ma, H.-Q. Li, X.-L. Zhong, J.-T. Yu, J.-H. Song, L. Tan
好中球/リンパ球比と頭蓋内動脈狭窄症および虚血性脳卒中との関連性
BMC Neurol, 21 (2021), p. 56
クロスリファレンス Google Scholar
115
A. Folyovich, E. Biró, C. Orbán, A. Bajnok, V. Varga, A.K. Béres-Molnár, B. Vásárhelyi, G. Toldi
脳卒中による免疫抑制における新規炎症マーカーの関連性
BMC Neurol, 14 (2014), p. 41
ScopusGoogle Scholarで記録を見る
116
C. Benakis, D. Brea, S. Caballero, G. Faraco, J. Moore, M. Murphy, G. Sita, G. Racchumi, L. Ling, E.G. Pamer, et al.
腸内細菌叢は腸内γδT細胞の制御により虚血性脳卒中の転帰に影響を与える
ナットメッド、22(2016)、516-523頁
CrossRefView レコードをScopusGoogle Scholarで見る
117
J.L. Kruse, M.M. Vasavada, R. Olmstead, G. Hellemann, B. Wade, E.C. Breen, J.O. Brooks, E. Congdon, R. Espinoza, K.L. Narr, et al.
ケタミンに対するうつ病治療反応:インターロイキン8の性特異的役割、ただし他の炎症マーカーではない
Transl Psychiatry, 11 (2021), p. 167
ScopusGoogle Scholarで記録を見る
118
J.J. Liu、Y.B. Wei、R. Strawbridge、Y. Bao、S. Chang、L. Shi、J. Que、B. S. Gadad、M. H. Trivedi、J. R. Kelsoe, et al.
うつ病における末梢性サイトカインレベルと抗うつ薬治療への反応:系統的レビューとメタ解析
Mol Psychiatr, 25 (2020), pp.339-350
CrossRefView レコードをScopusGoogle Scholarで見る
119
J.M. Knight, E.S. Costanzo, S. Singh, Z. Yin, A. Szabo, D.S. Pawar, C.J. Hillard, J.D. Rizzo, A. D'Souza, M. Pasquini, et al.
IL-6拮抗薬トシリズマブは、内科的疾患患者におけるうつ病および関連症状の悪化と関連している
Transl Psychiatry, 11 (2021), p. 58
ScopusGoogle Scholarで記録を見る
120
M.A. Nettis, G. Lombardo, C. Hastings, Z. Zajkowska, N. Mariani, N. Nikkheslat, C. Worrell, D. Enache, A. McLaughlin, M. Kose, et al.
低悪性度末梢炎症を有する治療抵抗性うつ病患者におけるミノサイクリンによる補強療法:二重盲検無作為化臨床試験の結果
ニューロサイコファーマコロジー, 46 (2021), pp.939-948
CrossRefView レコードをScopusGoogle Scholarで見る
121
R. Afridi, K. Suk
うつ病の神経炎症性基盤:実験モデルからの学習 第15巻(2021)
122
J.L.リーマス、R.ダンツァー
げっ歯類におけるうつ病の炎症モデル:向精神薬創製への関連性
Int J Neuropsychopharmacol, 19 (2016), p. pyw028
CrossRefGoogle Scholar
123
I. ルキッチ、D. ゲッツェルター、O. ジブ、O. オロン、E. ロイヴェニ、O. コレン、E. エリオット
抗うつ薬は腸内細菌叢に影響を与え、Ruminococcus flavefaciensはうつ様行動に対するその影響を消失させることができる
トランス・サイキアトリー, 9 (2019), p.133
ScopusGoogle Scholarで記録を見る
124
H. Zhao、K. Jin、C. Jiang、F. Pan、J. Wu、H. Luan、Z. Zhao、J. Chen、T. Mou、Z. Wang、et al.
大うつ病性障害における腸内細菌叢のマルチオミクス研究のパイロット的探求
Transl Psychiatry, 12 (2022), p. 8
ScopusGoogle Scholarで記録を見る
125
D. F. Frydecka, M. Krzystek-Korpacka, A. Lubeiro, F. Stramecki, B. Stańczykiewicz, J.A. Beszłej, P. Piotrowski, K. Kotowicz, M. Szewczuk-Bogusławska, E. Pawlak-Adamska, et al.
統合失調症の炎症シグネチャーのプロファイリング:横断的およびメタ分析研究
ブレイン・ビハーブ・イミュン,71(2018),28-36頁
記事ダウンロードPDF表示ScopusGoogle Scholarで記録を見る
126
D. Enache, N. Nikkheslat, D. Fathalla, B.P. Morgan, S. Lewis, R. Drake, B. Deakin, J. Walters, S.M. Lawrie, A. Egerton, et al.
精神病における末梢性免疫マーカーと抗精神病薬不応性
Schizophr Res, 230 (2021), pp.1-8
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
127
B.J.ミラー、D.R.ゴールドスミス
統合失調症の免疫表現型に向けて:進展、潜在的メカニズム、将来の方向性
ニューロサイコファーマコロジー, 42 (2017), pp.299-317
CrossRefView レコードをScopusGoogle Scholarで見る
128
C.E.マーフィー、A.K.ウォーカー、C.S.ウェイカート
統合失調症における神経炎症:核因子κBの役割
Transl Psychiatry, 11 (2021), p. 528
ScopusGoogle Scholarで記録を見る
129
F. 129 F. Zhu, Y. Ju, W. Wang, Q. Wang, R. Guo, Q. Ma, Q. Sun, Y. Fan, Y. Xie, Z. Yang, et al.
統合失調症に対する腸内細菌群の特徴のメタゲノム規模での関連性
Nat Commun, 11 (2020), p. 1612
ScopusGoogle Scholarで記録を見る
130
T. Fulop, A. Larbi, G. Dupuis, A. Le Page, E.H. Frost, A.A. Cohen, J.M. Witkowski, C. Franceschi
免疫老化と炎症老化は表裏一体:友か敵か?
フロント・イミュノール, 8 (2017), p.1960
ScopusGoogle Scholarで記録を見る
131
B. Sovran, F. Hugenholtz, M. Elderman, A.A. Van Beek, K. Graversen, M. Huijskes, M.V. Boekschoten, H.F.J. Savelkoul, P. De Vos, J. Dekker, et al.
加齢に伴う粘液バリア機能の障害は、微生物叢および免疫の深遠な変化と関連している
サイ・レップ, 9 (2019), pp.1437-1449
ScopusGoogle Scholarで記録を見る
132
M. Bodogai, J. O'Connell, K. Kim, Y. Kim, K. Moritoh, C. Chen, F. Gusev, K. Vaughan, N. Shulzhenko, A. Mattison Julie, et al.
自然界に存在するB1a細胞の活性化により、加齢に伴うインスリン抵抗性にコミューナル細菌が寄与する
Sci Transl Med, 10 (2018), Article eaat4271
ScopusGoogle Scholarで記録を見る
133
F. Fransen, A.A. van Beek, T. Borghuis, S.E. Aidy, F. Hugenholtz, C. van der Gaast-de Jongh, H.F.J. Savelkoul, M.I. De Jonge, M.V. Boekschoten, H. Smidt, et al.
無菌マウスへの移植後の老化した腸内細菌叢は全身性炎症に寄与する
フロント・イミュノール, 8 (2017), p.1385
ScopusGoogle Scholarで記録を見る
134∗
A. Parker, S. Romano, R. Ansorge, A. Aboelnour, G. Le Gall, G.M. Savva, M.G. Pontifex, A. Telatin, D. Baker, E. Jones, et al.
若齢マウスと高齢マウスの間の糞便微生物叢の移行は、腸、眼、脳の老化の特徴を逆転させる
Microbiome, 10 (2022), p. 68
ScopusGoogle Scholarで記録を見る
老化した微生物叢を若いマウスに移植すると、炎症性サイトカインシグナルが増加し、老化に関連した脳と網膜の炎症が起こることを示唆。
135
D.S. Donaldson、J. Pollock、P. Vohra、M.P. Stevens、N.A. Mabbott
微生物刺激は加齢に伴うマウスのM細胞の減少を逆転させる
iScience, 23 (2020), 記事 101147
記事ダウンロードPDFViewレコードin ScopusGoogle Scholar
136
A. サルミネン、K. Kaarniranta、A. Kauppinen
炎症:オートファジーとインフラムマソームの相互作用の乱れ
エイジング, 4 (2012), pp.166-175
CrossRefView レコードをScopusGoogle Scholarで見る
137
M.J. Claesson, I.B. Jeffery, S. Conde, S.E. Power, E.M. O'Connor, S. Cusack, H.M.B. Harris, M. Coakley, B. Lakshminarayanan, O. O'Sullivan, et al.
腸内細菌叢の組成は、高齢者の食事と健康に相関する
ネイチャー, 488 (2012), pp.178-184
CrossRefView ScopusGoogle Scholarで記録を見る
138
E. Biagi, C. Franceschi, S. Rampelli, M. Severgnini, R. Ostan, S. Turroni, C. Consolandi, S. Quercia, M. Scurti, D. Monti, et al.
腸内細菌叢と極端な長寿
Curr Biol, 26 (2016), pp.1480-1485
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
139
T.S.Ghosh, F.Shanahan, P.W.O'Toole
健康的な加齢の調節因子としての腸内細菌叢
Nat Rev Gastroenterol Hepatol (2022)
Google Scholar
140
D.A. Mogilenko, I. Shchukina, M.N. Artyomov
シングルセル分解能での免疫加齢
Nat Rev Immunol (2021)
Google Scholar
141
K.A. Scott, M. Ida, V.L. Peterson, J.A. Prenderville, G.M. Moloney, T. Izumo, K. Murphy, A. Murphy, R.P. Ross, C. Stanton, et al.
メチニコフの再訪:マウスにおける微生物叢-腸-脳軸の加齢に伴う変化
ブレイン・ビハーブ・イミュン,65(2017),20-32頁
記事ダウンロードPDFView Record in ScopusGoogle Scholar
142
B.G.チャイルズ、M.ドゥリック、D.J.ベイカー、J.M.ヴァン・ドゥールセン
加齢と加齢性疾患における細胞老化:メカニズムから治療まで
ナットメッド, 21 (2015), pp.1424-1435
CrossRefView レコードをScopusGoogle Scholarで見る
143
F. レング、P.エジソン
アルツハイマー病における神経炎症とミクログリア活性化:ここからどこへ行くのか?
Nat Rev Neurol, 17 (2021), pp.157-172
CrossRefView レコードをScopusGoogle Scholarで見る
144
M.G. Tansey、R.L. Wallings、M.C. Houser、M.K. Herrick、C.E. Keating、V. Joers
パーキンソン病における炎症と免疫機能障害
Nat Rev Immunol (2022)
Google Scholar
145
N. ボスコ、M. ノティ
腸内細菌群の老化と宿主免疫への影響
ジーン・イミュン, 22 (2021), pp.289-303
CrossRefView レコードをScopusGoogle Scholarで見る
146
W. 蔡、陳、孟、阮、胡、劉、呂、廖、張、呂、他。
動脈硬化性 CSVD 患者の腸内細菌叢は、RORγt の活性化を介して好中球の IL-17A 産生をより多く誘導する
7 (2021), p. eabe4827
ScopusGoogle Scholarで記録を見る
147
W.J. Streit、N.W. Sammons、A.J. Kuhns、D.L. Sparks
老化したヒトの脳におけるジストロフィー型ミクログリア
グリア, 45 (2004), pp.208-212
ScopusGoogle Scholarで記録を見る
148∗
J. M. Zardeneta、S.E. Lee、B. Lehallier、M.S. Haney、J.V. Pluvinage、V. Mathur、O. Hahn、 D.W. Morgens, et al.
脂質滴下型ミクログリアは、加齢脳における機能不全および炎症性状態を示す
Nat Neurosci, 23 (2020), pp.194-208
CrossRefView Record in ScopusGoogleスカラー
老化したミクログリアは、蓄積した脂質滴に反応し、ヒトとマウスの両方で貪食、酸化ストレス、炎症性シグナルに関連する機能的な意味を持つ、異なる表現型を明らかにする。
149∗
O. Mossad, B. Batut, B. Yilmaz, N. Dokalis, C. Mezö, E. Nent, L.S. Nabavi, M. Mayer, F.J.M. Maron, J.M. Buescher, et al.
腸内細菌叢は、代謝産物N(6)-カルボキシメチルリジンを介してミクログリアの加齢関連酸化ストレスとミトコンドリア障害を駆動する
Nat Neurosci, 25 (2022), pp.295-305
Google Scholar
加齢に伴うマイクロバイオータとミクログリア酸化ストレス、ミトコンドリア機能との関連性を示す。
150∗
M. Boehme, K.E. Guzzetta, T.F.S. Bastiaanssen, M. van de Wouw, G.M. Moloney, A. Gual-Grau, S. Spichak, L. Olavarría-Ramírez, P. Fitzgerald, E. Morillas, et al.
若いマウスの微生物叢は、選択的な加齢に伴う行動障害を打ち消す
ネイチャーエイジング, 1 (2021), pp.666-676
Google Scholar
加齢に伴う末梢のアウトカムや加齢に伴う衰えが、腸内細菌叢とその代謝産物によって機能的に媒介されているという考えを補強している。
O. Mossad, E. Nent, S. Woltemate, S. Folschweiller, J.M. Buescher, D. Schnepf, D. Erny, P. Staeheli, M. Bartos, A. Szalay, et al.
微生物叢に依存したδ-バレロベタインの増加が神経細胞機能を変化させ、加齢に伴う認知機能の低下に関与していること
ネイチャーエイジング, 1 (2021), pp.1127-1136
Google Scholar
加齢マウスの可塑性、機能的結合性、認知力を調節する機構的な微生物代謝産物を同定。加齢マウスの脳におけるこれらの障害はすべて、若い動物ドナーからの腸内細菌叢移植によって回復し、加齢に伴う認知機能低下を回復させる微生物叢の強力な役割が明らかになった。
152
Y. このような背景のもとで、「腸内細菌は加齢に伴う認知機能低下に対して強力な役割を果たす」ことが明らかになった。
腸内細菌イソアミルアミンは、ミクログリア細胞死を促進することにより、加齢に伴う認知機能障害を促進する
Cell Host Microbe, 30 (2022), pp.944-960
e948
Google Scholar
153
O.M. Shannon、A.W. Ashor、F. Scialo、G. Saretzki、C. Martin-Ruiz、J. Lara、J. Matu、A. Griffiths、N. Robinson、L. Lillà, et al.
地中海食と加齢の特徴
Eur J Clin Nutr, 75 (2021), pp.1176-1192
Google Scholar
154
T.D. Keenan, E. Agrón, J.A. Mares, T.E. Clemons, F. van Asten, A. Swaroop, E.Y. Chew
A群、AR群について:加齢性眼疾患研究1および2における地中海食のアドヒアランスと認知機能
アルツハイマー型認知症, 16 (2020), pp.831-842
Google Scholar
155
Y. Aman, T. Schmauck-Medina, M. Hansen, R.I. Morimoto, A.K. Simon, I. Bjedov, K. Palikaras, A. Simonsen, T. Johansen, N. Tavernarakis, et al.
健康な老化と疾患におけるオートファジー
ネイチャーエイジング, 1 (2021), pp.634-650
Google Scholar
156
J.F. クライアン、S.K. マズマニアン
微生物叢-脳軸:文脈と因果関係
サイエンス, 376 (2022), pp.938-939
Google Scholar
157
B.J. Russell, S.D. Brown, N. Siguenza, I. Mai, A.R. Saran, A. Lingaraju, E.S. Maissy, A.C. Dantas Machado, A.F.M. Pinto, C. Sanchez, and al.
大腸菌のシャーシを用いた腸管への遺伝子導入により、持続的な生理的変化が可能になった
Cell, 185 (2022), pp.3263-3277.e3215
Google Scholar
158
S. フェデリーチ、S. クレド・ルッソ、R. バルデス-マス、D. クヴィアトコフスキー、E. ワインストック、Y. マチウヒン、Y. シルバーバーグ、アタラシ、古市、岡、他.
ファージコンソーシアムによるヒトIBD関連腸内細菌叢常在菌の抑制を目的とした腸管炎症の治療法
Cell, 185 (2022), pp.2879-2898.e2824
Google Scholar
引用元: (0)
この記事が気に入ったらサポートをしてみませんか?
