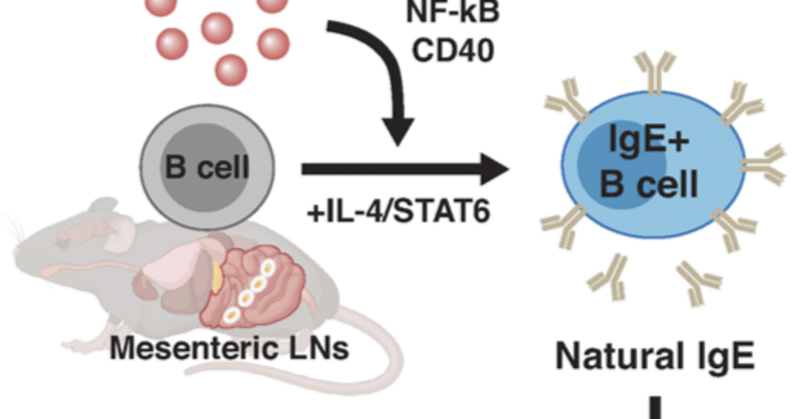
グルココルチコイドによる天然型IgEの誘導
メインコンテンツへスキップ
傘のAltテキスト
傘のオルトテキスト閉じる
プレスについて
図書館員の方へ
権利と許可
書籍
JCB
細胞生物学ジャーナル
JEM
実験医学ジャーナル
JGP
生理学雑誌
LSA
ライフサイエンス・アライアンス
検索ドロップダウンメニュー
ユーザーツールドロップダウン
実験医学ジャーナル
トグルメニュー
スキップナビ移動先
論文|2022年9月13日
グルココルチコイドによる天然型IgEの誘導
https://rupress.org/jem/article/219/10/e20220903/213459/Induction-of-natural-IgE-by-glucocorticoidsIgE?searchresult=1
特別コレクション:2022:実験医学の年
イム・ジェチョル
ORCIDロゴ
エリカ・V・リン
ORCIDロゴ
ホン・ジュンヨン
ORCIDロゴ
バラット・ヴァイディヤナサン
ORCIDロゴ
スティーブン・A・エリクソン
ORCIDロゴ
チャールズ・アニチェリ
ORCIDロゴ
ルスラン・メジトフ
ORCIDロゴ
クロスマーク 更新の確認
著者・論文情報
J Exp Med (2022) 219 (10): e20220903.
https://doi.org/10.1084/jem.20220903
論文履歴
標準表示
別ウィンドウで
PDFを別ウィンドウで開く
共有する
ツール
IgEは、肥満細胞や好塩基球の表面をコーティングし、特異的アレルゲンと結合すると脱顆粒を誘導することにより、アレルギー反応を媒介する。IgEはまた、外来アレルゲンの非存在下でも自然に産生される。しかし、このような「天然の」IgEの起源、制御、および機能については、いまだに不明な点が多い。しかし、このような「天然の」IgEの起源、制御、機能については、まだほとんど解明されていない。ここで我々は、グルココルチコイドが、抗原チャレンジのないin vivoおよびex vivoの両方で、B細胞におけるIgEの産生を促進することを見出した。このようなIgE産生は、CD40シグナル伝達を強化し、IL-4/STAT6経路と相乗的に作用するB細胞内在性のグルココルチコイド受容体シグナル伝達によって促進される。さらに、腸間膜リンパ節に存在するまれなB細胞がグルココルチコイド誘導性IgEの産生を担っていることも見いだした。さらに、腸内で局所的に産生されたグルココルチコイドは、腸内環境の恒常性が乱れるような場合、天然のIgEを誘導する可能性がある。注目すべきことに、グルココルチコイドで先制治療したマウスは、その後の病原性アナフィラキシーから保護された。これらの結果から、グルココルチコイドは広範な免疫抑制作用があると考えられているが、B細胞においては選択的な免疫賦活作用があることが示唆される。
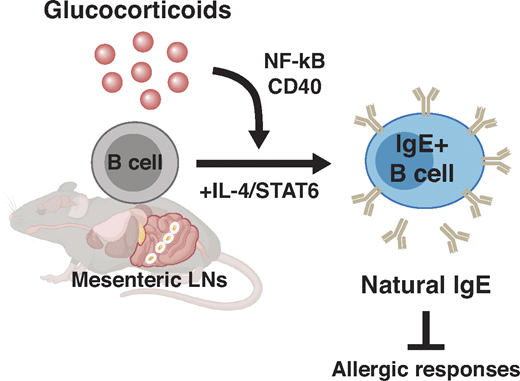
図解抄録
グラフィック
大きく表示する スライドをダウンロードする
対象:リンパ球生物学
はじめに
アレルギーは、世界中で何億人もの人々が罹患している主要な慢性疾患であり、2型免疫応答を活性化することによって、花粉やピーナッツのような多様で一見無害な環境刺激を標的としている(Lloyd and Snelgrove, 2018; Palm et al.) 細菌やウイルスなどの病原体を扱う1型免疫とは異なり、2型免疫はマクロ寄生虫、有害化学物質、毒素から身体を防御する(Iwasaki and Medzhitov, 2015; Palm et al.) 2型免疫は、IgEおよびIgG1抗体を分泌するB細胞と並んで、主にTヘルパー2細胞によって媒介される(Lloyd and Snelgrove, 2018; Palm et al.) アレルゲンとT細胞のシグナルが最初に存在すると、アレルゲン特異的B細胞はクラススイッチ組み換えと体細胞超変異(SHM)を起こして高親和性IgEを産生し、このIgEはマスト細胞や好塩基球のような自然免疫センチネル表面に発現する高親和性Fcε受容体I(FcεRI)を被覆する(Heら、2015;Oettgen、2016;Stavnezer and Schrader、2014)。IgEが介在する炎症性エフェクター反応(血管外遊出、粘液分泌、腸蠕動など)は、蠕虫や有害化学物質に対する防御反応と考えられているが、誤った方向や過剰な場合には病的な反応となることもある(Anthony et al. 実際、通常無害なアレルゲンと結合すると、アレルゲン特異的IgEはFcεRI受容体を架橋し、肥満細胞や好塩基球にヒスタミンのような炎症性メディエーターの放出を促し、軽度のかゆみから、生命を脅かす低血圧や気道閉鎖を伴うアナフィラキシーショックに至るまで、下流の症状を引き起こすことがある(Galli and Tsai, 2012; Kelly and Grayson, 2016; Reber et al.)
不思議なことに、IgEは、特定の環境アレルゲンや微生物や食物由来の抗原がなくても、また抗原提示やT細胞のコストイムレーションとは無関係に、自然に誘導されることもある(McCoyら、2006;Pabst and Slack、2020)。このようなIgE抗体は、同様の広範な特異性を有する天然のIgM抗体にちなんで「天然の」IgEと呼ばれており(McCoyら、2006)、がん監視や皮膚バリア防御において恒常的な役割を担っている可能性がある(Crawfordら、2018;Hayesら、2020)。したがって、天然IgEの自発的な誘導と恒常性維持能は、生理的または環境的シグナルが、潜在的に保護的役割を有する天然IgEの基礎レベルを誘導するのに十分である可能性を示唆している。例えば、無菌マウスは、基礎IgEレベルの上昇および食物抗原依存性腸Tヘルパー2細胞応答を示し(Hongら、2019;Kimら、2016)、また、腸間膜LN(mLN)において、IgEスイッチングに必要なεGLT転写産物(Cahenzliら、2013;Hillら、2012)の発現が増加している。さらに、広域抗生物質やtoll様受容体シグナル伝達における遺伝的欠陥によって誘導される腸内細菌異常症は、炎症の増加だけでなくIgEレベルの上昇とも関連しており、炎症シグナルと相まって乱れた微生物シグナルがIgEの誘導を促進する可能性が示唆されている(Gavinら、2006;Hillら、2012;Schnareら、2001;Wesemann and Nagler、2016)。しかしながら、このような広範に特異的または非特異的な天然IgEがどのように産生されるのか、また、どのような機能を有するのかは、依然として不明である(Kelly and Grayson, 2016)。
グルココルチコイドは、一般的なストレス応答に関与する内因性ステロイドホルモンシグナルであり、アレルギー治療のための免疫抑制薬として使用されている(Cain and Cidlowski, 2017)。しかしながら、最近の文献によると、グルココルチコイドは免疫応答に対して細胞種特異的かつ用量依存的な作用を有しており、これはその複数の作用様式と一致している(Franco et al.) B細胞において、グルココルチコイドはB細胞の成熟度と寿命を変化させることが示されており、これは下流の抗体産生や特定の抗原に対する親和性を規定しうる(Cainら、2020;Gruver-Yatesら、2014)。副腎皮質ステロイドはまた、ヒトおよびマウスのT細胞における2型サイトカイン産生を変化させることにより(Blottaら、1997;Ohnishiら、2008)、CD40L-CD40を制御することによりヒト末梢血単核球(PBMC)におけるIgEレベルを増減させることにより(Jabaraら、2001;Salviら、2000)、アレルギー反応に関与している。しかしながら、多面的な作用のために、アレルギーにおけるグルココルチコイドの詳細な分子機序や機能については議論があり、現在でも十分に解明されていない(Lane and Kemeny, 1994; Pullerits et al.)
ここでわれわれは、グルココルチコイドがB細胞に直接作用して、アレルギーにおける潜在的な防御機能を有する「天然」IgEの合成を促進しうることを示す。天然の」IgEとは、実験的に投与した抗原がない場合に誘導されるIgEと定義する。生体外マウスB細胞培養を用いて、グルココルチコイドが、B細胞内在性およびIL-4/STAT6依存的に、CD40シグナル伝達を強化および代替することによって、B細胞にIgEへのクラススイッチ組換えを誘導することを見出した。我々はまた、グルココルチコイドを、in vivoで実験的に添加した抗原の非存在下での基礎的天然IgEの上昇に結びつけ、このIgEは、mLNにおいて形質芽細胞様シグネチャーを持つまれなB細胞によって局所的に分泌された。注目すべきことに、グルココルチコイドによって誘導された天然IgEは、その後のアナフィラキシー反応の大きさを鈍らせた。以上より、我々の研究は、グルココルチコイドと天然IgEとの関連を確立し、アレルギー発症時における天然IgEおよびそのB細胞産生因子の潜在的特性を明らかにすることができる。
結果
グルココルチコイドは生体外でB細胞におけるIgEスイッチングを増加させる
天然IgEの存在は確立されているが(McCoyら、2006)、天然IgEの産生を誘導する内因性シグナルは、特に抗原性のチャレンジがない場合には、まだ同定されていない。我々は、正常血清中に存在し、IgE産生に影響を与える内因性シグナル分子が存在するかどうかを検討した。この目的のために、成熟したナイーブ脾臓B細胞をIL-4とCD40Lで刺激し、IgEスイッチングを誘導することにより、IgEクラススイッチ組み換えの有効性をスクリーニングするために、生体外培養を用いた実験を行った(図1のAおよび図S1のA、B;Geha et al.) 我々は、一過性の血清飢餓が、IL-4とCD40L刺激の存在下でも、IgEへのクラススイッチングを減少させることを発見した(図1のAおよび図S1のC)。しかし、IgG1クラススイッチングは同じ条件下でほとんど影響を受けなかったことから、IgEの減少はクラススイッチの組換えにおける一般的な欠陥に起因するものではないことが示唆された。正常なFBSは多様な因子からなる未解明の組成を持つため、IgEのクラススイッチ組換えを促進する血清中の特定の因子を突き止めることは困難であった(van der Valk, 2022)。IgE+B細胞の減少の原因となる、血清飢餓時の欠乏因子を特定するために、我々はまず、FBSの未定義の組成を回避するために、神経細胞や幹細胞を培養するための、化学的に定義された血清の代替物であるB-27を利用した(Brewerら、1993)。興味深いことに、B-27を添加すると、無血清(SF)培養条件下でのIgEスイッチングの減少が完全に解消されたことから、B-27にはIgEスイッチングを引き起こす1つ以上の因子が含まれていることが示唆された(図S1 D)。候補を絞り込むために、抗酸化物質、ビタミンA、インスリンなどの成分のサブセットを欠くB-27変異体をSF培養液に補充したが、これらの定義された変異体はいずれもIgEスイッチングの欠損を示さなかった(図S1 D)。さらに、煮沸したFBSはIgEへのB細胞スイッチングを減少させなかったことから、血清中のタンパク質成分はIgEスイッチングの原因ではないことが示唆された(図S1 E)。B-27の残りの非タンパク質成分を調べるために、化学的に定義された脂質、プロゲステロン、または甲状腺ホルモン(T3)をSF条件に加えたが、IgEスイッチングの有意な回復は観察されなかった(図S1、FとG;および表S1)。
興味深いことに、B-27とFBSにも存在するステロイド系ストレスホルモンであるグルココルチコイドが、IgEのスイッチングに寄与することがわかった。コルチコステロン(Cort)と、グルココルチコイド受容体(GR)により高い親和性を持つ合成グルココルチコイドであるデキサメタゾン(DEX)の両方が、SF条件におけるIgE+ B細胞の割合を有意に回復させた(図1 Bおよび図S1 H)。さらに、対照完全培地にCortまたはDEXを添加すると、IgEスイッチングがさらに増加した(図1 C)。この条件では、IgG1+ B細胞もDEXによってわずかに増加した(図S1 I)。しかし、IgEスイッチングに必要なεGLTは、このようなDEX処理によって選択的に増加することが確認され、少なくとも我々のex vivo環境では、IgMからIgEへの直接的なIgEスイッチングが示唆された(図1 D)。これらの観察と一致して、対照完全培地で培養したB細胞を、GR阻害剤であるRU-486でインキュベートすると、IgG1クラスではなくIgEクラスのスイッチングが有意に阻害された(図1 Eおよび図S1 J)。さらに、Nr3c1 GR遺伝子をB細胞特異的に欠失させたマウス(Cd19-CreまたはMb1-CreによるcKO)のB細胞の完全培地培養にDEXを添加しても、IgEのクラススイッチングは増加しなかった(図1のFおよびG、ならびに図S1のKおよびL)。以上のことから、グルココルチコイドは生体外において、B細胞内在性の方法でIgEへのB細胞クラススイッチングを誘導することが示唆された。
グルココルチコイドはCD40シグナル伝達と形質芽細胞様遺伝子発現を強化する
次に、グルココルチコイドがどのようにしてIgEスイッチングを誘導するのかを検討した。メカニズム的には、IL-4/IL-4Rシグナルを介したSTAT6転写因子の活性化がIgEのスイッチングに重要であることが文献に記載されている(Linehanら、1998)。DEXは、Stat6ノックアウトマウスの成熟ナイーブ脾B細胞のex vivo培養においてIgEスイッチングを誘導できなかったことから、グルココルチコイドによるIgEスイッチングの誘導は、STAT6に依存していることが示唆された(図2 A)。このことから、グルココルチコイドによるIgEスイッチングの誘導は、STAT6に依存していることが示唆された(図2 A)。これと同様に、培養液からIL-4を除去したWT B細胞では、IgEスイッチングはDEXによって誘導されなかった(図2 B)。しかし興味深いことに、CD40L刺激を除去したB細胞では、DEXによってIgEスイッチングが有意に誘導されることが観察され、グルココルチコイドが少なくともex vivoではCD40Lの喪失を補う可能性が示唆された(図2 B)。根底にある分子メカニズムをよりよく理解するために、DEXの有無にかかわらず、生体外で培養したB細胞のRNA配列決定(RNA-seq)を行った(図2 C、図S2 A、表S2)。先の考えを支持するように、B細胞におけるCD40シグナルの重要な標的であるNF-κBは、RNA-seqデータにおいてDEXによって有意に活性化された(図2 D; Gehaら、2003; Luoら、2018; Mizuno and Rothstein, 2005)。グルココルチコイドは、NF-κB標的転写を活性化するよりもむしろ阻害することが正統的に知られているので(Tan and Wahli, 2016)、NF-κBの阻害剤であるIκBaと、NF-κBの下流標的であるIRF4のタンパク質レベルを測定することによって、NF-κBがDEXによって本当に活性化されるかどうかを検証した(Grumont and Gerondakis, 2000)。我々のシークエンスデータと一致して、培養B細胞中のIκBaのレベルはDEXによって減少し、IRF4のレベルは増加した(図2 E)。さらに、選択的NF-κB阻害剤(TPCA-1、IκBキナーゼの可逆的阻害剤)を用いてDEX処理中のNF-κB活性化を抑制すると、DEXの効果が逆転した(図S2 B)。しかしながら、GRと免疫グロブリン遺伝子との結合や、IgH遺伝子座のクロマチンアクセシビリティに変化は見られなかった(図S2 C)。従って、我々のデータを総合すると、グルココルチコイドはB細胞においてNF-κBへのCD40L/CD40シグナル伝達を促進し、下流のIgEクラススイッチングを誘導することが示唆される。
さらに、高度に分裂したIgE+ B細胞(>5分裂)は、DEX処理によって特異的に増加することがわかった(図S2 D)。IgE+ B細胞の活性化は細胞増殖と密接に関連していることから(Wuら、2017)、DEXはB細胞の活性化をサポートし、IgE産生を促進する可能性がある。IgE+B細胞に特異的なDEXの効果を調べるため、培養後にFACSで選別したIgE+B細胞の全RNAの塩基配列を決定した(図2 Fおよび図S2 A)。対照のIgE+ B細胞と比較して、DEX処理IgE+ B細胞は、Prdm1、Cd93、Xbp1を含む、より強い形質芽細胞様シグネチャーを示した(図2 Fおよび表S2;Brynjolfssonら、2018;Crooteら、2018;Glarosら、2021)。さらに、DEXは、分化形質芽細胞/形質細胞または未成熟B細胞である可能性のあるCD93+ B細胞におけるIgEスイッチングを増強することができたが、後者は、直接IgEスイッチングの増加を通じて、IgG1よりもIgEに優先的にスイッチングすることが以前に報告されている(図2 Gおよび図S2 E; Wesemannら、2011)。従って、我々のデータは、グルココルチコイドがB細胞の成熟と運命を変化させることにより、IgE産生に偏り、IgE産生のステージを設定する、B細胞における別個のトランスクリプトームを確立する可能性を示唆している。
天然IgEはin vivoでグルココルチコイドによってmLNに誘導される
次に、グルココルチコイドへの曝露がin vivoでの抗体産生に影響するかどうかを評価するため、WT C57BL/6J(B6;「野生型」)マウスに、DEXまたはビヒクルコントロールのいずれかを飲料水を通して全身投与した(図3 Aおよび図S3 A)。興味深いことに、WTマウスはDEX投与後2週目と4週目の両方で、血漿中IgEの基礎レベルが上昇した(図3 A)。ナイーブなWTマウスでは基礎IgEは一般に低く、また刺激を受けていないマウスは病原体のない特定の条件下で飼育されていたことから、DEXによって誘導されるIgEの特異性は「天然」IgEの広範な特異性を反映していると推測される(McCoyら、2006)。対照的に、B細胞にのみGRを欠損させたcKOマウスでは、DEX投与4週間後に血漿中IgEの上昇はみられず、DEX依存性IgE反応のB細胞内在性が強調された(図3 C)。しかし、注目すべきことに、B細胞特異的なGRの欠失は、定常状態におけるIgEのベースライン・レベルに影響を与えなかったことから、グルココルチコイドを介したIgE産生は、ベースラインIgEレベルに構成的に寄与しているのではなく、誘導性であることが示唆された(図3 C)。さらに、T細胞特異的GRノックアウトマウスでは、DEXが依然としてIgEレベルを上昇させることが確認された(図S3 B)。しかし、IL-4の主要な供給源と考えられているCD4+細胞の枯渇は、in vivoでの天然IgEの誘導を実際に消失させることがわかった(図S3 C)。これは、天然IgEに関する以前の研究(McCoyら、2006年)と一致している。グルココルチコイド誘導性IgEの産生は、生体外ではCD40L/CD40シグナルに依存していないことから(図2)、IL-4が必要であるにもかかわらず、同族T細胞の助けが天然IgEの合成に必要でない可能性がある。しかし、これについてはさらなる研究が必要であろう。以上の結果から、グルココルチコイドへの曝露はin vivoでのIgEの誘導を増加させ、グルココルチコイドによる天然IgEの誘導はB細胞内在性であり、IL-4に依存することが示された。
さらに、われわれは、推定される天然のIgE分泌B細胞をin vivoで同定しようとした。IgE産生細胞をin vivoで検出することは困難であるため、まず、グルココルチコイド誘導性IgEがどこで産生されるのかを理解するために、間接的なアプローチをとった。特定の組織における局所IgE濃度の代用として、濾胞(FO)B細胞上のIgEの低親和性受容体(CD23またはFcεRII)に結合した表面IgEのレベルを分析することにより、腸管排液LNは皮膚排液LNまたは脾臓よりもIgEのレベルが高いことが観察された(図3 Dおよび図S3 D;材料および方法)。このことは、B6マウスにおいて、IgEは定常状態では、低レベルではあるが、主に腸管排液性LNで局所的に産生されていることを示唆している。この観察と一致して、DEX投与マウスは、回腸および結腸LNにおけるFO B細胞上の結合IgEレベルの上昇を維持し、これは循環中の総IgEレベルとも相関していた(図S3 E)。
さらに、インビボで天然のIgE分泌B細胞を直接同定するために、蛍光Venusタンパク質(黄色蛍光タンパク質誘導体;Yangら、2012年)でIgE発現細胞を標識したIgEレポーターマウスと同時にフローサイトメトリー染色を利用した。このアプローチにより、非IgE+ B細胞に発現するCD23に結合した表面IgEによる偽陽性シグナルの可能性を回避し、稀ではあるが真のIgE+ B細胞を検出することが可能となった。そこで、まずIgEレポーターマウスをDEXまたはビヒクルコントロールで2~4週間処理した後、フローサイトメトリーで様々なリンパ組織におけるIgEの発現を解析した(図3 Eおよび図S3 F)。DEX投与マウスは、小腸と結腸からリンパを排出し、食物抗原と常在腸内微生物に対する免疫寛容を促進するのに重要なmLNからのIgE発現B細胞の有意な増加を示した(図3のEとF;および図S3のG)(Houstonら、2016)。対照的に、DEX投与マウスの脾臓、腹腔、骨髄では、有意なIgEシグナルは検出されなかった(図S3 H)。mLN由来のB細胞におけるIgEの発現を確認するため、FACSで選別したmLN B細胞についてtotal RNA-seqを実施したところ、εGLTおよびIgheの成熟転写産物がin vivoのDEX処理によって高度に誘導されることが判明した(図3のG、図S3のIおよびJ)。さらに、これらのDEX処理B細胞は、対照B細胞と比較して、形質芽細胞様シグネチャーを示し(図3 Hおよび表S3)、これはex vivoでの観察結果(図2 F)と一致した。しかし興味深いことに、脾臓B細胞もmLN B細胞も、生体外でDEXを添加して培養した場合、同程度のIgEスイッチングを示したことから、生体内でlgEスイッチングを引き起こすには、DEXに対する反応性の差よりも、むしろmLNのマイルームに特異的な局所的環境シグナルが重要であることが示唆された(図3 I)。こうして得られた知見は、グルココルチコイドに暴露されると、mLNのB細胞が天然型IgEを優先的に産生することを示している。
次に、単一細胞のV(D)Jシークエンシングによって、mLN B細胞のB細胞レセプターレパートリーを調べた。天然抗体に関するこれまでの報告(Hayesら、2020;Kwonら、2022)と同様に、mLN B細胞は定常状態ではポリクローナルであることがわかった(図S3 K)。クローン型の多様性に加えて、SHMはほとんど検出されなかったことから、定常状態のmLN B細胞は胚中心反応を起こしにくいことが示唆された(図S3 L)。興味深いことに、mLN B細胞のこれらの特性はDEXの影響を受けず、グルココルチコイドだけではレパートリーやSHMシグネチャーの変化を引き起こさないことが示された(図S3、KおよびL)。我々のモデルでは抗原性チャレンジがないことから、グルココルチコイドはレパートリーに影響を与えることなく、mLNにおけるポリクローナルIgE+ B細胞の頻度を増加させる可能性があることが示唆された。
グルココルチコイドは腸内細菌異常症において天然型IgEの産生を促進する
次に、グルココルチコイドがmLNにおける局所的IgE誘導を促進するのは、どのような生理的状況においてかについて検討した。腸から排出されるLNの免疫細胞は、腸の恒常性を維持するために常に微生物シグナルと相互作用し、微生物シグナルに依存していることを考えると、微生物誘導シグナルの欠如による腸の恒常性の乱れが、IgEの上昇を引き起こす可能性がある(Wesemann and Nagler, 2016)。以前に報告されたように、微生物シグナルに応答する能力を欠くMyd88/Trifダブルノックアウト(DKO)マウスは、血漿中IgEの著しい上昇を示した(図4 A; Gavin et al.) このことは、DKOマウスにおける微生物由来のシグナル伝達の欠如に伴う腸管擾乱または腸内細菌異常症が、IgEの誘導に実際に寄与していることを示唆している。このことから、我々は、腸内細菌叢の形成異常の際にグルココルチコイド産生が増加することで、食物アレルギーのような異常な免疫感知を可能にする過剰な炎症から身を守るために、mLNにおける局所的な天然IgEレベルが誘導されるのではないかと考えた(Renz et al.) 実際、DKOマウスでは回腸Cortレベルが高く、グルココルチコイド合成に関与する酵素の発現も高いことが観察された(図4、BおよびC)。IgE誘導におけるグルココルチコイドの役割を調べるため、DKOマウスでグルココルチコイド合成を阻害した(図4 D)。定常状態では、DKOマウスはIgEレベルの上昇を示し、それは成体初期まで上昇し続けた(図4 D)。この観察は、無菌マウスで報告されている循環IgEの自然誘導を彷彿とさせるものであった(Cahenzliら、2013;Hongら、2019)。興味深いことに、生合成経路の最後の11β-水酸化酵素(CYP11B1)を競合的に阻害するメチラポンによるグルココルチコイド合成の抑制は、DKOマウスにおけるIgEの上昇を有意に消失させた(図4 D)。同様に、DKOマウスのmLNにおけるIgEの局所レベルは、メチラポンによって低下した(図S4 A)。しかし、メチラポンはDKOマウスのCortの全身レベルを低下させなかった(図S4 B)。このことは、腸内環境において局所的に産生されたグルココルチコイドが、DKOマウスにおけるIgEの誘導に関与している可能性を示唆している。この全身性グルココルチコイドと局所性グルココルチコイドの対比に関連して、WTマウスでは、生理的ストレス条件による全身性Cortの増加は、基礎IgEレベルを上昇させるのに十分ではないことがわかった(図S4 C)。我々は、このようなストレス条件下では交感神経系が同時に活性化され、IgE合成を含む2型反応の抑制につながる可能性があると推測している(Florsheimら、2021)。したがって、視床下部-下垂体-副腎軸の活性化によって産生される循環グルココルチコイドは、in vivoでの天然IgEの誘導には関与していない可能性があり、このことは、代わりに腸におけるグルココルチコイドの局所産生が重要であることを示唆している。
天然IgEはアレルギーを防御する役割を持つ可能性がある。
最後に、高親和性抗原特異的IgEが大量に存在するアレルギー時の天然IgEの生理的機能を調べた。DEXまたはビヒクルコントロールによる4週間の治療後、免疫系と副腎機能を回復させるために2週間の漸減投与を行った後、抗ジニトロフェニル(DNP)IgE(DNP-IgE)注射とDNPチャレンジにより、IgE介在性の受動的全身性アナフィラキシーモデルを誘導した(図4 Eおよび図S4 D)。DNP-ヒト血清アルブミン(HSA)チャレンジの際、先制的にDEXを投与したマウスは低体温を示し、その結果、「アレルギー性」対照マウスと比較して、アナフィラキシーの重症度が低いことを示唆するベースライン体温への回復が早かった(Fig. 4 E)。同様に、対照血漿を投与したマウスと比較して、DEX投与および漸減したマウスの血漿を受動的に投与したナイーブB6マウスは、低体温が減少し、DNP-IgEを介した受動的全身アナフィラキシーからの回復が早いことが観察された(図4 F)。また、抗OVA IgE(OVA-IgE)注射とOVAチャレンジによる受動的皮膚アナフィラキシーモデルでも、先制的にDEXを投与したマウスでは、アナフィラキシー時の血管拡張と体液滲出の代用として、耳へのエバンスブルー色素の蓄積が減少した(図4 G)。In vivoでの所見と同様に、DEX投与マウスと漸減マウスのIgEを先行してインキュベートしたex vivo骨髄由来肥満細胞のDNP-IgE誘発性脱顆粒の減少も検出された(図S4 E)。IgG抗体からの寄与を完全に排除することはできないが、グルココルチコイドによって先制的に誘導される天然IgEは、おそらく高親和性アレルゲン特異的IgEとFcεRI結合を競合することによって、その後のアレルギー症状を和らげたり、防御したりする生理的役割を果たす可能性がある(Erb, 2007; Oettgen, 2016)。
考察
我々は、実験的に投与した抗原がない場合、グルココルチコイドがB細胞に直接作用して、生体外および生体内の両方でIgEのスイッチングを促進することにより、「天然の」IgEを自発的に誘導することを報告した(図4 H)。グルココルチコイドのIgE促進作用がCD40L/CD40シグナルに依存していないことから(図2)、インビボでの天然IgEの合成には、同族T細胞の助けは必要ないのかもしれない。このことは、抗原非依存的かつMHCクラスII非依存的な天然IgEの産生を示した先行研究(McCoyら、2006年)と一致している。従って、今回の知見は、天然IgEの誘導には、抗原提示との直接的な細胞間相互作用ではなく、可溶性因子が重要であることを浮き彫りにした。
さらに、グルココルチコイドによって誘導される天然IgE抗体は、最小限のSHMを持つポリクローナルレパートリーである可能性が示された。他のタイプの天然抗体と同様に、グルココルチコイド誘導性IgEもまた、広い特異性と低い親和性で内因性抗原を認識する可能性がある。このことは、グルココルチコイドがIgMからIgEへの直接的なIgEスイッチングを促進し、低親和性IgEを生成することを示した我々の結果と一致している(図1 Dおよび図2 G)。天然のIgEが認識する抗原を同定することは興味深い。しかし、抗原提示は天然IgEの誘導には必要でなく(McCoy et al., 2006)、SHMによる親和性成熟も起こりそうにないことから、天然IgEが抗原とは無関係に、あるいは少なくとも特定のクラスの内因性抗原に限定して生じ、機能する可能性もある。
それでもなお、このようなポリクローナルIgEがどのようにしてアレルギー反応を軽減するのかは、依然として不明である。先行研究では、高親和性IgEと低親和性IgEの両方でマウスをアレルゲンに感作すると、その後のアナフィラキシーからマウスを保護することが示されている(Xiong et al. さらに、シアル酸糖鎖を除去するとIgEのアナフィラキシー能が変化することが示されている(Shade et al.) DEXで処理したB細胞では、St3gal1のような糖鎖修飾酵素のレベルに違いが見られることから(図2 C)、天然のIgEは、FcεRIとの親和性を変えたり、IgEが結合すると下流のFcεRIシグナル伝達を弱めたりするような、異なる糖鎖修飾を受けている可能性がある(Jennewein and Alter, 2017; Shade et al.) おそらく過剰量の低親和性天然IgEは、FcεRIに対する親和性が高い可能性があるため、肥満細胞や好塩基球上のFcεRI部位でアレルゲン特異的IgEと競合し、これを上回ることができる。あるいは、FcεRIに対する親和性が同等であっても、天然IgEは下流のFcεRIシグナル伝達経路に異なる影響を与え、それによって肥満細胞や好塩基球の脱顆粒や活性化状態を変化させる可能性もある。
私たちの研究はまた、ストレスと2型免疫との間に関連性がある可能性も示している。ストレスホルモンは通常、2型免疫応答を含む免疫系を抑制すると考えられているが、我々のデータは、グルココルチコイドがB細胞を陽性に制御し、天然のIgEを分泌させることを示唆している。では、どのような種類のストレスでもIgEの誘導を促進することができるのかという疑問が残る。生体のストレス条件によって産生されるグルココルチコイドはIgEを誘導できないことが示されたように(図S4 C)、副腎に由来する全身性グルココルチコイドは、in vivoでの天然IgE産生の主要な寄与者ではない可能性がある。その代わりに、局所的ストレス条件によって回腸で産生される副腎外グルココルチコイドが、天然IgEの誘導に関与している可能性がある(Ahmed et al.) このような局所的ストレス状態は、上皮障壁の破壊や腸内恒常性の擾乱など、2型免疫応答の引き金と特異的に関連しているのではないかと推測している。
将来的には、おそらく腸管免疫応答の変化と同時に、腸内のグルココルチコイドの局所レベルを上昇させる生理学的・病態生理学的条件を特定することが重要であろう。微生物叢の枯渇が回腸グルココルチコイドの誘導と関連することが以前に示されており(Mukherji et al. さらに、炎症と上皮細胞損傷は、オーファン核内受容体LRH-1(肝臓受容体ホモログ-1またはNR5A2;Ahmedら、2019;Muellerら、2006)を介して、主に回腸でグルココルチコイドの副腎外合成を誘導することができる。同様に、2型免疫応答を誘発しうる毒素、有害化学物質、異種生物は、腸管上皮におけるグルココルチコイド産生を誘導するのに十分な炎症組織損傷を引き起こし、粘膜免疫にさらなる影響を与える可能性がある。このように、腸の恒常性の乱れによって引き起こされる "局所的ストレス "は、局所的グルココルチコイドの誘導、ひいては天然IgEの誘導に起因すると考えられる。したがって、このような局所的ストレスによって誘発される天然IgEは、腸の恒常性を維持し、食物アレルギーのような異常な免疫感覚の発症を防ぐ上で極めて重要な役割を果たすと考えられる(Renz et al.)
局所的なグルココルチコイド産生の概念に沿って、我々はまた、mLNのまれなB細胞が天然IgEの産生と分泌を担っていることを実証している。定常状態では、非排便性LNよりもmLNの方が免疫活性が高い可能性が高いことが、これまでの研究で示されている(Casolaら、2004;Hoshiら、2001;Kuniedaら、2002)。しかしながら、どのような組織特異的特性が、IgEのスイッチングにとって優先的で特に好都合な環境としてmLNを際立たせているのかは、依然として不明である。例えば、IL-4やグルココルチコイドは、他のリンパ組織と比較して、mLNでより容易に利用できる可能性がある。主要なIL-4産生細胞であるCD4発現細胞を枯渇させると天然IgEが消失する一方、それらの細胞におけるGRを枯渇させると消失しないことから(図S3、BおよびC)、IL-4産生はグルココルチコイドに依存せず、一定に保たれている可能性がある。腸内でIL-4が恒常的に産生されている可能性は、微生物叢や食事との恒常的な相互作用から生じている可能性があり、mLNが天然のIgEの産生に適した組織である可能性がある。同様に、IL-4産生細胞のmLN周辺での動態の違いによって、グルココルチコイドに暴露された場合と同様に、mLN B細胞がスイッチングを受け、天然IgEを産生する態勢が容易に整うために、IL-4の利用可能性が高まる可能性もある。これらのことは、mLNと脾臓の精製B細胞が、IL-4存在下、生体外でDEXに対して同様の反応性を示すという我々の観察結果と一致する(図3 I)。
さらに、DEXがmLNのεGLTを増加させ、IgEのスイッチングが亢進していることを示したが、天然のIgE産生B細胞がクラススイッチングと分化の後、どのようにホーミングするのかは、まだ完全には解明されていない。一方では、B6マウスの定常状態ではIgEが主にmLNで局所的に産生され、DEXによってさらに誘導されうるという我々の知見から支持されるように、成熟したナイーブB細胞はmLNを遊走し、DEXに応答してより頻繁にIgEスイッチングを受けるため、その後もmLNに留まり、DEXを投与したマウスのmLNに天然IgEを分泌する形質芽細胞がより多く蓄積する可能性がある。対照的に、GRシグナルがCXCR4を介した血液と骨髄間のB細胞のホーミングを制御することが示されていることから(Cainら、2020)、DEXに反応してmLNを通過し、より頻繁にIgEスイッチングを受ける成熟したナイーブB細胞は、mLNに常在するIgE+ B細胞として蓄積するのではなく、mLNをホーミングする嗜好性を持つ形質芽細胞としてリンパ組織間を移動し続けるのかもしれない。従って、グルココルチコイド曝露に伴うmLNにおけるIgE+ B細胞の移動動態と分化動態を調べることは興味深い。
今回の知見は、グルココルチコイドの古典的な免疫抑制作用に関する長年の見解に反するように思われるが、最近の研究では、グルココルチコイドがB細胞やT細胞に対して用量依存的に作用し、特定の範囲では免疫増強作用を示すことが同様に見出されている(Cainら、2020;Hongら、2020;Shimbaら、2018)。さらに、我々の知見と一致して、グルココルチコイドによるNF-κBシグナルの誘導も他の研究者によって確認されている。例えば、低用量のCortはミクログリア様免疫細胞においてNF-κBの転位と下流の炎症性遺伝子転写を増加させる(Liuら、2018年)。実際、CD40L/CD40シグナル伝達を強化するためにNF-κBを活性化することによってIgEスイッチングを促進することに加えて、グルココルチコイドは、RNA-seqによって明らかにされたように、生体外B細胞を、Prdm1やXbp1のような遺伝子に濃縮された明瞭なトランスクリプトームを有する形質芽細胞様細胞へと誘導することが観察された。このように、われわれのデータは、NF-κBを活性化し、形質芽細胞様運命を促進し、下流のIgE産生を誘導することによって、B細胞におけるグルココルチコイドの免疫増強作用をさらに補強するものである。
しかしながら、IgEの誘導にもかかわらず、DEX投与によって免疫系が全身的に抑制されることも観察された。B細胞におけるグルココルチコイドによるIgE合成誘導に関する今回の知見に加え、先行文献では、喘息のために高用量のコルチコステロイド治療を複数回受けた患者では、免疫抑制の指標となるIFN-γ産生T細胞やナチュラルキラー細胞が減少しているにもかかわらず、IgEレベルが高いことが報告されている(Ziegら、1994)。このように、グルココルチコイドによる免疫細胞の制御は、細胞種特異的であり、用量依存的であり、周囲の組織環境からの手がかりに敏感であることから、グルココルチコイドは、生体全体では正味の免疫抑制状態であるにもかかわらず、特定の免疫細胞集団に対して免疫増強作用を示す可能性がある。グルココルチコイドがどのような生理的状況において免疫応答を積極的に制御しうるのか、また、GRを介した変化が、特定の細胞タイプに応じてエピジェネティックな修飾を伴うのかどうかを調べることは、特に興味深い。
全体として、我々の研究は、グルココルチコイドが天然のIgE産生促進因子として働くことを示唆しており、グルココルチコイド誘導性IgEの誘導と保護生理機能について、重要なメカニズム的洞察を与えている。さらに、我々の結果は、慢性的なグルココルチコイド治療がヒトにおけるIgEレベルを上昇させる可能性があることを示唆しており、このことは、プレドニゾンの長期投与を受けた前述の患者について以前に報告されている(Ziegら、1994)。われわれの研究で同定されたのと同じ経路が、ヒトにおいても同様にIgE誘導の原因となっているかどうかを明らかにするためには、さらなる研究が必要である。さらに、B細胞に対するグルココルチコイドの免疫増強作用を理解することは、アレルギーやその他のIgEを介する過敏症状に対する新規治療法の設計に、多くの新しい道を開くことになる。例えば、グルココルチコイドの予防的局所投与は、食物アレルゲンに対する腸のアレルギー反応を緩和する可能性がある。さらに、組換え天然IgE抗体の受動的投与は、アレルギー患者の治療薬として使用できる可能性がある。このように、われわれの研究は、グルココルチコイドと天然IgEの上昇との間にメカニズム的な関連性を確立するだけでなく、今日われわれの世界の多くを苦しめているアレルギーを治療するための新たなアプローチにつながるものである。
材料と方法
マウス
C57BL/6J WT(B6、000664)、Stat6ノックアウト(005977)、Cd19-Cre(006785)、Cd4-Cre(022071)、およびNr3c1fl/fl(GRfl/fl、021021)マウスをJackson Laboratoryから購入し、自家繁殖した。Mb1-CreマウスはYale(New Haven, CT)のJoao Pereira博士からいただいた。Mb1-CreマウスまたはCd19-CreマウスをNr3c1fl/flマウスと交配し、Mb1-Cre+/-またはCd19-Cre+/-Nr3c1+/+、Nr3c1fl/+、Nr3c1fl/flマウス(B細胞特異的Nr3c1 WT、Het、KO [cKO])を得た。Stat6-/-マウスをB6マウスと交配してStat6+/-マウスを得、これを交配してStat6+/-マウス、Stat6+/-マウス、Stat6-/-マウスを得た。Cd4-CreマウスをNr3c1fl/flマウスと交配し、Cd4-Cre+/-Nr3c1fl/flマウス(T細胞特異的Nr3c1 KOマウス)を得た。Myd88/Trif KOマウス(DKO)のブリーダーは、2週おきにスルファメトキサゾール/トリメトプリム抗生物質食で維持した(Rakoff-Nahoumら、2015)。IgE KO B6マウスは、Boston Children's Hospital(マサチューセッツ州ボストン)のHans Oettgen博士から寛大な寄付を受けたIgE KO Balb/cJマウスから10回戻し交配して作製した。B6 Venus IgEレポーターマウス(Verigem)は、カリフォルニア大学サンフランシスコ校(カリフォルニア州サンフランシスコ市)のChristopher Allen博士からいただいた。すべてのマウスはメスで、実験開始時に3-6.5週齢、特に断りのない限り同腹仔であり、特定の病原体フリー施設で維持された。マウスはイェール大学のイェール動物資源センターで繁殖され、病原体のない特定の条件下で維持された。すべての動物プロトコールは、イェール大学のInstitutional Animal Care and Use Committeeの規定に基づいて検討、承認、実施された。
脾臓B細胞とリンパ組織の採取
CD19+脾臓B細胞を分離するために、WT B6マウス、Stat6マウス、またはcKOマウスの脾臓を採取し、70μmストレーナー(087712;Thermo Fisher Scientific)を通して、「完全培地」(2μM L-グルタミンを含むRPMI-1640培地[R8758; Sigma-Aldrich; 21875034; Thermo Fisher Scientific]、15% FBS [10438026; Gibco or 100-106; BenchMark or S11550; R&D Systems]、100 U/mlペニシリンおよび100 µg/mlストレプトマイシン [P4333; Sigma-Aldrich] 、および50 µM 2-ME [M6250; Sigma-Aldrich]を添加した)。赤血球を1×塩化アンモニウム-カリウム溶解バッファー(BP10-548E;Lonza)で溶解した。ペレットを1×磁気活性化細胞選別(MACS)緩衝液(0.5%BSA[BP1600-100;Thermo Fisher Scientific]および2mM EDTA[AM9260G;Invitrogen]を含む1×PBS[14190144;Gibco])で洗浄した。CD19+B細胞は、MACS MultiStand (130-042-303; Miltenyi Biotec)上のマウスCD19 MicroBeads (130-121-301; Miltenyi Biotec)およびLSカラム (130-042-401; Miltenyi Biotec)を用いてMACSでポジティブ選択した。十二指腸、空腸、回腸、結腸、鼠径部、および腋窩LNを採取し、70μmのストレーナーを通して氷冷した2.5%FBS入り1×PBSに入れ、1×塩化アンモニウム-カリウム溶解バッファーでインキュベートした後、フローサイトメトリー、FACS、またはRNA-seqの調製を行った。具体的には、採取した十二指腸、空腸、回腸、大腸LNからmLNをプールした。腹膜洗浄と骨洗浄でそれぞれ分離した腹膜細胞と骨髄は、フローサイトメトリー準備の前に洗浄した。
生体外B細胞培養
IgEおよびIgG1 B細胞クラススイッチ組換えについては、Vaidyanathanら(2017)のプロトコルを採用した。WT、cKO、Stat6ノックアウト、またはVerigem IgEレポーターマウスの精製脾臓CD19+ B細胞、ならびに精製WT mLN CD19+ B細胞を、1μg/mlの抗マウスCD40モノクローナル抗体(aCD40;553721;BD Biosciences)および10ng/mlのIL-4(404-ML;R&D Systems)を含む完全培地中で、8.75×105細胞/mlで6ウェル平底プレートに播種した。48時間から72時間までの6時間のインキュベーションの間、細胞を12ウェル平底プレートに106細胞/mlで、0.5μg/ml aCD40と5ng/ml IL-4を含む完全培地、あるいはFBSを欠くが0.5μg/ml aCD40と5ng/ml IL-4を含む残りの完全培地成分を含むSF培地に再懸濁した。この6時間の間に、細胞はさらに0. 1% DMSO(AB03091;AmericanBio)またはコントロールとしてPBS;100 ng/ml Cort(DMSOで希釈;C2505;Sigma-Aldrich);100 ng/ml DEX(DMSOで希釈;D1756;Sigma-Aldrich);1 mg/ml RU-486(DMSOで希釈; M8046;Sigma-Aldrich);2%50X B-27 SFサプリメントまたはその変種(17504044、10889038、12587010、またはA1895601;Thermo Fisher Scientific);90℃で15分間インキュベートした15%「ボイル」FBS;0. 2%化学的に定義された脂質混合物(CDLまたはCDLipid;L0288;Sigma-Aldrich);3.15ng/mlプロゲステロン(Prog;P8783;Sigma-Aldrich);1ng/ml 3,3′,5-トリヨード-L-チロニン(T3;T2877;Sigma-Aldrich);または20μg/ml TPCA-1(ab145522;Abcam)。同様の細胞密度を維持しながら、72時間から78時間まで同じ6時間のインキュベーションを繰り返した。96時間時点までの2回の6時間インキュベーション以外では、洗浄した細胞を0.5μg/ml aCD40と5ng/ml IL-4を含む完全培地に再懸濁した。IL-4またはCD40L(aCD40)の枯渇実験では、細胞を10 ng/ml IL-4と1 µg/ml aCD40を含む完全培地で0から48時間培養し、0.5 µg/ml aCD40、5 ng/ml IL-4、または0.5 µg/ml aCD40と5 ng/ml IL-4の両方を含む完全培地で、適切なDEXインキュベーションの有無にかかわらず48から96時間培養した。細胞増殖標識のため、B細胞は培養前にCellTrace Violet Cell Proliferation Kit (C34571; Thermo Fisher Scientific)を用いて製造業者のプロトコールに従って染色し、96時間後にフローサイトメトリーで細胞分裂を評価した。mLN B細胞培養では、上述のようにmLNを抗CD19 MACSに供した後、脾B細胞と同じ条件下で生体外で培養した。培養はすべて、37℃、5%CO2条件下で行った。
フローサイトメトリーと解析
フローサイトメトリー用の抗体はすべて表S4に示し、メーカーのプロトコールに基づいて滴定した。0時間、48時間、72時間、96時間の時点におけるex vivo培養の準備のために、細胞内IgEタンパク質を染色する前に、最初に表面FcεRII-IgE複合体を切断することによって真のIgE+ B細胞を検出するWesemannら(2011)のプロトコルを適応し、表面CD23(FcεRII)に結合したIgE- B細胞からの偽シグナルを回避した。簡単に説明すると、まず採取したB細胞を0.1%トリプシン-EDTA(25200056;ギブコ)で1分間インキュベートし、氷冷FBSと1×PBSで中和した後、ゾンビレッドまたはゾンビイエロー固定可能生存率キット(423110または423103;バイオレジェンド)を用いて生存率を評価した。次に細胞を固定し、Foxp3/Transcription Factor Staining Buffer Set (00-5523-00; eBioscience)で透過処理した後、Staining Bufferのプロトコールに従って、フルオロクロム標識抗体と抗CD16/32 Fc block (14-0161-86; eBioscience)で細胞内染色を行った。特に、cKOマウスの透過化PBMCは、モノクローナル非抱合ウサギ抗マウスGR抗体(12041;Cell Signaling)、続いてAlexa Fluor 488(A-11034;Invitrogen)に結合したポリクローナルヤギ抗ウサギIgG(H+L)抗体を用いてGR欠失を確認した。採取したin vivo組織の調製には、任意でゾンビレッドまたはゾンビイエローを用いて細胞の生存率を評価し、続いて2.5% FBSおよびFcブロックを含む1×PBSで希釈したフルオロクロム標識抗体で表面染色を行った。生存率および/または抗体染色後の全サンプルについて、細胞を洗浄し、2.5%FBSを含む氷冷1×PBSに再懸濁し、80μmナイロンメッシュで濾過した。FACSデータはLSR II Flow Cytometer(BD Biosciences)で収集し、FlowJo 9(Tree Star)で解析した。B細胞集団は、一重項、生細胞、B220+(CD45Rとしても知られる)のゲーティングにより同定された。具体的には、FO B細胞は、シングレット、生細胞、CD19+ FcεRI-、Fas-、CD38+ IgD+細胞に順次ゲーティングすることで同定し、IgEの蛍光強度中央値(MFI)を解析した。IgEレポーターマウスを用いた真のIgE+ B細胞同定のために、シングレット、ライブ、CD45+、c-kit-、B220+、およびCD19+細胞を、IgEの表面発現およびレポーターVenusシグナルについて分析した。染色されたサンプルは、蛍光マイナス1(FMO)コントロールに対して検証された。このアプローチにより、FcεRIにIgEが結合した肥満細胞または好塩基球、およびCD23にIgEが結合した非IgE産生B細胞が除外された。
RT-qPCR
全RNAは、オンカラムDNase処理(79256; Qiagen)を施したRNeasy Micro Kit(74004;Qiagen)またはDirect-zol RNA Miniprep(R2052;Zymo)により抽出した。逆転写は、ランダムヘキサマープライマーとSMART MMLV Reverse Transcriptase(639524;Clontech)を用いて行った。RNA量は、PerfeCTa SYBR Green SuperMix, Low ROX (95056-02K; Quantabio)とCFX96 Touch Real-Time PCR Detection System (Bio-Rad)を用いて測定した。RT-qPCRプライマーのリストを表S5に示す。
RNA-seqと解析
上記のように、DEXまたはDMSOで処理したex vivo B細胞培養からのIgE+ B細胞(Venus IgEレポーター陽性)、またはDEXまたはビヒクル処理マウスのmLNからのB細胞(一重項生CD45+ c-Kit- B220+でゲーティング)を、Yale Flow Cytometry Facilityを通じてFACSで選別した。RNeasy Micro Kit (74004; Qiagen)を用いて全RNAを単離した。RNA-seqライブラリーはSMARTer Stranded Total RNA-Seq Kit v2-Pico Input Mammalian (634413; Takara)を用いて調製した。ライブラリーはNextSeq 500(Illumina)でペアエンドラン(38×38または42×42bp)により配列決定した。リード2の5′末端から3ヌクレオチドをFASTX-Toolkit (http://hannonlab.cshl.edu/fastx_toolkit/)でトリミングした。リードをマウスcDNA/ncRNAトランスクリプトーム(GRCm38 ensembl v89)にマッピングし、kallisto(v0.46.2, k-mer index 25, bootstrap 60; Bray et al., 2016)を用いて100万あたりの転写産物で定量した。遺伝子発現の差分解析はRStudio(v4.1.0)を用い、biomaRt、tximport、edgeR、Glimma、limmaパッケージを用いて、一般化線形モデルの尤度比検定とロバストな遺伝子ごとの分散パラメータ推定で行った。パスウェイ解析はingenuity pathway analysis (Qiagen)で行った。また、STAR (v2.5.3)を用いてmm10ゲノムとのアライメントを行い、同様の結果が得られた。ε、γ1、μ生殖細胞系列転写産物(εGLTs、γ1GLTs、μGLTs)を定量化するために、免疫グロブリン遺伝子(Ighe: Ighe:chr12:113,273,506-113,277,355、Ighg1:chr12:113,338,827-113,339,438およびchr12:113,334,226-113,337,296、Ighm:chr12:113,422,854-113,424,477)。シーケンスデータはNational Center for Biotechnology InformationのGene Expression Omnibusデータベースに登録されている(アクセッション番号:GSE203542)。
ウェスタンブロッティング
細胞を1% radioimmunoprecipitation assay buffer (9806S; Cell Signaling Tech)で溶解し、15 µgの溶解液を4-15% Mini-PROTEAN TGX Precast Protein Gels (4561084; Bio-Rad)にロードした。Trans-Blot Turbo Transfer System(Bio-Rad)を用いてメタノール活性化ポリフッ化ビニリデン膜(1620175;Bio-Rad)に転写した後、膜を5% BSAを含む1×PBS中0.1% Tween 20(P9416;Sigma-Aldrich)でブロックし、以下に示す一次抗体でプローブし、3回洗浄した。その後、抗マウスStarBright Blue 700(12004158;Bio-Rad)または抗ウサギHRP標識二次抗体(18-8816-33;Rockland)でメンブレンをインキュベートし、さらに3回洗浄した。検出はWest Pierce ECL Substrate (32106; Thermo Fisher Scientific)で行い、化学発光シグナルはChemiDoc Imaging System (Bio-Rad)で検出した。一次抗体として、抗IκBa(1:1,000, sc-371; SantaCruz)、抗IRF4(1:1,000, 62834T; Cell Signaling Tech)、または抗β-アクチン(1:2,000, 3700S; Cell Signaling Tech)を用いた。
In vivo薬剤処理
DEX投与では、WTマウス、cKOマウス、IgEレポーターマウスを、2-ヒドロキシプロピル-β-シクロデキストリン(2-HCD;H107;Sigma-Aldrich)をビヒクルとして、または0. 02%DMSOで希釈し、0.0018%2-HCDビヒクルとバランスさせたものをオートクレーブした飲料水(200μlのDMSOまたはDEXを1,800μlの1%2-HCDと最初に混合し、すべてを1リットルの水に溶かした)に入れた。ストレスを軽減するために、注射ではなく経口飲水でマウスを治療し、マウスは1日あたり0.36mg/kgのDEXを全身投与されたと推定した(Hongら、2020;Yangら、2009)。メチラポン投与では、Myd88/Trif DKOマウスを2-HCDビヒクル、または0.16% DMSOで希釈し0.0034% 2-HCDとバランスさせた0.8mg/mlメチラポン(14994; Cayman)で3週間処置した。処理物は水ボトルで提供され、7~10日ごとに補充され、処理されたケージでは自動給水バルブが取り外された。CD4+細胞の枯渇のために、B6マウスに1mgの抗CD4抗体(BE0003-1;Bio X Cell)またはアイソタイプ・コントロール(Bio X Cell、BE0090;Bio X Cell)をi.p.注射した。
血漿分離
マウスから後眼窩出血により全血を採取した。血漿を分離するために、採取した血液サンプルを、ヘパリンリチウム(365985;BD Biosciences)を添加したBD Microtainer PSTチューブで、製造業者のプロトコールに基づいて紡糸した。分離した血漿サンプルは直ちに分析するか、評価まで-80℃で保存した。
ELISA法
血漿中の総IgEを測定するために、96ウェルNunc MaxiSorpプレート(44-2404-21;ThermoFisher)に、0.1M pH9.6炭酸-重炭酸緩衝液(C3041;Sigma-Aldrich)で希釈した2μg/mlラット抗マウスIgE(553413;BD Biosciences)を4℃で一晩コートした。プレートを0.05% Tween 20を含む1×PBSで洗浄し、1% BSAを含む1×PBSで室温で1時間ブロッキングした後、1% BSAを含む1×PBSで希釈した血漿または連続希釈したマウスIgEκアイソタイプコントロール(557080; BD Pharmingen)と室温で2時間インキュベートした。検出のために、洗浄したプレートを0.5 µg/mlビオチン化ラット抗マウスIgE(553419; BD Biosciences)と室温で1時間インキュベートし、洗浄後、ストレプトアビジン-HRP(1:1,000, 554066; Thermo Fisher Scientific)と室温で30分間インキュベートした。洗浄したウェルを TMB 基質溶液 (555214; BD Biosciences) で展開し、3 M H2SO4 (258105; Sigma-Aldrich) でクエンチし、分光光度計 (SpectraMax M5) により 450 nm で光学濃度と逆算濃度を検出した。その他の抗体アイソタイプは、フローサイトメトリーによる LEGENDplex Mouse Immunoglobulin Isotyping Panel (740493; BioLegend)を用いてアッセイした。ツァイトゲーバー時間4(ZT4)で採取した血漿または回腸上皮の細胞溶解液からのコルチコステロン・レベルは、DetectX Corticosterone Enzyme Immunoassay Kit(K014-H1;Arbor)を用いてアッセイした。
In vivo受動的全身アナフィラキシー
上記のようにビヒクルまたはDEXを4週間投与した後、B6マウスは2週間かけて飲水に漸減した。血漿移植実験のために、このような対照マウスまたはDEX投与マウスおよび漸減マウスの血漿をプールし、B6レシピエントマウスにi.p.注射した。次にマウスに、100μlの1×PBSで希釈した2μgのモノクローナル抗DNP IgE(DNP-IgE、クローンSPE-7;D8406;Sigma-Aldrich)をi.v.注射した。24時間後、マウスに100μlの1×PBSで希釈した20μgのDNP-HSA(D-5059;Biosearch Technologies)をi.v.投与した。DNP-HSAチャレンジ後、マウスの直腸温を経時的にプローブした(TH-5およびRET-3;Physitemp)。
In vivo受動的皮膚アナフィラキシー
上記のようにビヒクルまたはDEXを4週間投与した後、B6マウスは2週間かけて飲水に漸減した。その後、マウスに20ngのモノクローナル抗OVA IgE(クローンE-C1;7091;Chondrex)を皮内注射した。24時間後、マウスに20μgのグレードVのOVA(A5503;Sigma-Aldrich)と1%のエバンスブルー色素(E2129;Sigma-Aldrich)を混合したものをi.v.投与した。30分後、マウスを安楽死させ、アナフィラキシー時の血管透過性とヒスタミンによる血管外浸潤を示す、耳におけるエバンスブルー色素の漏出を評価した。
定量化と統計解析
エラーバーはSEMを表し、特に断りのない限り、各ドットは個々のマウスのサンプルを表す。図の凡例にあるように、また実験デザインによって適切と判断されるように、統計解析は、両側パラメトリック非対Studentのt検定またはWelchのt検定、比対Studentのt検定、一元配置ANOVAとポストホックTukeyの多重比較検定、または二元配置ANOVAとポストホックŠídákの多重比較検定(フルモデル混合効果解析)によって決定した。P < 0.05を統計的に有意とみなした。検定はGraphPad Prism 9.0(GraphPad Software, Inc)で行った。
ATACシーケンス(ATAC-seq)と解析
Omni-ATACプロトコル(FC-121-1031; Illumina; Corces et al., 2017)に従い、各条件から5×104個の細胞を用いてATAC-seqライブラリーを構築した。ライブラリーはYale Center for Genome Analysis(YCGA)によりIllumina HiSeq 2,000(ペアエンドラン、100 × 100 bp)でシーケンスした。配列決定したリードをアダプター配列でトリミングし(cutadapt v1.9.1; Martin, 2011)、Bowtie2(v2.3.4.1; Langmead and Salzberg, 2012)でマウスゲノム(GRCm38, ensembl release 93)にマッピングした。ミトコンドリアリードと重複リードはそれぞれSAMtools (v1.9; Li et al., 2009)とPicard (v2.9.0, https://broadinstitute.github.io/picard/)で除去した。ピークはMACS2 (v.2.1.1; Zhang et al., 2008)で検出し、deepTools (v3.1.1; Ramirez et al., 2014)で可視化した。
単一細胞のV(D)J配列決定と解析
mLN B細胞(CD45+ FcεRI- B220+ CD23loまたはCD45+ FcεRI- c-kit- B220+ CD19+)をB6コントロールマウスまたはDEX投与マウスから選別し、10×Chromium Single Cell 5′ Reagent Kits v2にかけた。 遺伝子発現ライブラリーとV(D)JライブラリーをYCGAで構築した。ライブラリーはNovaSeq 6000(ペアエンドラン、26×90bp)でシークエンシングした。生シーケンスデータは、mm10-2020-AおよびGRCm38-alts-ensembl-5.0.0を用いてCell Ranger(v6.1.2)で解析した。クローン型はLoupe VDJ Browser 4.0で解析し、SHMの頻度はChange-O (v1.0.0)のAssignGenesとMakeDB pythonパッケージで解析した。
生物学的ストレス条件
寒冷負荷では、マウスを4℃で14日間飼育した。断続的絶食負荷では、マウスを29日間にわたり1~2日ごとに一晩絶食させた。拘束負荷では、マウスを14日間にわたり1~2日ごとに50mlのコニカルチューブに4~6時間拘束した。
In vitro肥満細胞脱顆粒(β-ヘキソサミニダーゼ[β-hex])アッセイ
マスト細胞の脱顆粒を評価するため、β-hex放出の定量化について公表されているプロトコルを応用した(Kuehn et al.) 簡単に説明すると、96ウェルU底プレートに播種した骨髄由来肥満細胞を、等容量の培地のみ、ビヒクル投与マウスと漸減マウスの培地と規格化血漿、またはDEX投与マウスと漸減マウスの培地と規格化血漿のいずれかと37℃で30分間プレインキュベートした。洗浄後、細胞を培地中2μg/mlのDNP-IgEとともに37℃で30分間インキュベートした。25μg/mlのDNP-HSAで肥満細胞を刺激すると、肥満細胞顆粒から放出されたβ-hexは、消化されたp-ニトロフェニルN-アセチル-β-D-グルコサミニド基質の比色アッセイを用いて定量された。脱顆粒細胞のパーセンテージは、上清中のβ-hex含量を、上清と溶解液を合わせた総β-hex含量で割った値として算出した。
オンライン補足資料
図S1は、IgG1スイッチングがグルココルチコイドの影響をほとんど受けないことを示している。図S2は、グルココルチコイドがIgE+ B細胞の活性化を支持し、クロマチンアクセシビリティのグローバルな変化を伴わずにIgE産生を促進することを示している。図S3は、グルココルチコイド誘導性の天然IgEが、mLNにおいて局所的に産生されている可能性を示している。図S4は、天然IgEが、生体のストレス条件によってではなく、腸内の局所的なグルココルチコイドによって産生されることを示している。表S1は、B-27サプリメントの定義されたビタミン、タンパク質、その他の成分のリストである。表S2は、生体外で培養したB細胞から得られた全RNA-seqデータである。表S3は、選別されたmLN B細胞から得られたtotal RNA-seqデータである。表S4は、フローサイトメトリー用の抗体のリストである。表S5にRT-qPCR用プライマーを示す。
謝辞
特にCuiling Zhang、Shuang Yu、Jaime Cullenにはマウスのコロニーとin vivo実験についてお世話になった。IgEレポーターマウスを提供してくれたChristopher Allen博士(カリフォルニア大学サンフランシスコ校)に感謝する。IgE KO Balb/cJ マウスを提供してくれたHans C. Oettgen博士(Boston Children's Hospital)に感謝する。Mb1-Creマウスを提供してくれたJoao Pereira博士(Yale)に感謝する。また、Yale Flow CytometryのFACSサービスとYCGAの10× Immune Profilingに感謝する。画像はBioRender.comで作成した。
本研究は、Howard Hughes Medical Institute、Blavatnik Family Foundation、Food Allergy Science Initiative、National Institutes of Healthからの助成金(R. MedzhitovへのAI144152)、Yonsei Research Fund(2021-22-0049)、Yonsei Signature Research Cluster Program of 2022(2022-22-0013)、韓国科学・情報通信技術(ICT)・未来企画部National Research Foundation, NRF-2022R1C1C1007283の支援を受けている。J. Limは、国際ヒューマン・フロンティア・サイエンス・プログラム機構(LT000037/2018-L)およびJane Coffin Childs Memorial Fundからのポスドクフェローシップの支援を受けている。R. Medzhitovはハワード・ヒューズ医学研究所の研究員である。
著者貢献: J. Lim、B. Vaidyanathan、R. Medzhitovは本研究を発案した。J. Lim、E.V. Lin、J.Y. Hongは、B. Vaidyanathan、S.A. Erickson、C. Annicelliの協力を得て、実験の計画、実施、データ解析を行った。J. Lim、E.V. Lin、J.Y. Hong、R. Medzhitovは、他の共著者の意見を参考に原稿を執筆した。
参考文献
Ahmed, A., C. Schmidt, and T. Brunner. 2019. 腸粘膜における副腎外グルココルチコイド合成:免疫恒常性と免疫逃避の間。Front. Immunol. 10:1438. https://doi.org/10.3389/fimmu.2019.01438
Google ScholarCrossref PubMed
Anthony, R.M., L.I. Rutitzky, J.F. Urban Jr., M.J. Stadecker, and W.C. Gause. 2007. 蠕虫感染における防御免疫機構。Nat. Rev. Immunol. 7:975–987. https://doi.org/10.1038/nri2199
Google ScholarCrossref PubMed
Blotta, M.H., R.H. DeKruyff, and D.T. Umetsu. 1997. 副腎皮質ステロイドはヒト単球のIL-12産生を阻害し、CD4+リンパ球のIL-4合成誘導能を増強する。J. Immunol. 158:5589-5595
Google ScholarCrossref PubMed
Bray, N.L., H. Pimentel, P. Melsted, and L. Pachter. 2016. 最適に近い確率的RNA-seq定量化。Nat. Biotechnol. 34:525–527. https://doi.org/10.1038/nbt.3519
Google ScholarCrossref PubMed
Brewer, G.J., J.R. Torricelli, E.K. Evege, and P.J. Price. 1993. B27添加ニューロバサル、新しい無血清培地の組み合わせにおける海馬ニューロンの生存の最適化。J. Neurosci. https://doi.org/10.1002/jnr.490350513.
Google ScholarCrossref PubMed
Brynjolfsson, S.F., L. Persson Berg, T. Olsen Ekerhult, I. Rimkute, M.J. Wick, I.L. Martensson, and O. Grimsholm. 2018. マウスと男性における長寿命形質細胞。Front. Immunol. 9:2673. https://doi.org/10.3389/fimmu.2018.02673
Google ScholarCrossref PubMed
Cahenzli、J.、Y.Koller、M.Wyss、M.B.Geuking、およびK.D.McCoy。2013. 幼少期のコロニー形成における腸内微生物の多様性が長期的なIgE値を形成する。Cell Host Microbe. 14:559–570. https://doi.org/10.1016/j.chom.2013.10.004
Google ScholarCrossref PubMed
Cain, D.W., C.D. Bortner, D. Diaz-Jimenez, M.G. Petrillo, A. Gruver-Yates, and J.A. Cidlowski. 2020. マウスのグルココルチコイド受容体は、骨髄と血液の間でB細胞の移動を選択的に制御する。J. Immunol. 205:619–629. https://doi.org/10.4049/jimmunol.1901135
Google ScholarCrossref PubMed
Cain, D.W., and J.A. Cidlowski. 2017. グルココルチコイドによる免疫制御。Nat. Rev. Immunol. 17:233–247. https://doi.org/10.1038/nri.2017.1
Google ScholarCrossref PubMed
カソラ、S.、K.L.オチポビー、M.アリムジャノフ、S.フンメ、N.ウイッタースプロット、J.L.クトック、M.C.キャロル、およびK.ラジェフスキー。2004. B cell receptor signal strength determines B cell fate. Nat. Immunol. 5:317–327. https://doi.org/10.1038/ni1036
Google ScholarCrossref PubMed
Corces、M.R.、A.E. Trevino、E.G. Hamilton、P.G. Greenside、N.A. Sinnott-Armstrong、S. Vesuna、A.T. Satpathy、A.J. Rubin、K.S. Montine、B. Wu、他 2017年。ATAC-seqプロトコルの改良により、バックグラウンドが減少し、凍結組織の解析が可能になった。Nat. Methods. 14:959–962. https://doi.org/10.1038/nmeth.4396
Google ScholarCrossref PubMed
Crawford, G., M.D. Hayes, R.C. Seoane, S. Ward, T. Dalessandri, C. Lai, E. Healy, D. Kipling, C. Proby, C. Moyes, et al. 上皮障害と組織γδT細胞は、ユニークな腫瘍保護IgE応答を促進する。Nat. Immunol. 19:859–870. https://doi.org/10.1038/s41590-018-0161-8
Google ScholarCrossref PubMed
Croote, D., S. Darmanis, K.C. Nadeau, and S.R. Quake. 2018. 単一IgE B細胞トランスクリプトームからクローニングされた高親和性アレルゲン特異的ヒト抗体。Science. 362:1306–1309. https://doi.org/10.1126/science.aau2599
Google ScholarCrossref PubMed
Erb, K.J. 2007. 蠕虫、アレルギー疾患、IgE介在性免疫応答: 我々はどこに立っている?Eur. J. Immunol. 37:1170–1173. https://doi.org/10.1002/eji.200737314
Google ScholarCrossref PubMed
Florsheim, E.B., Z.A. Sullivan, W. Khoury-Hanold, and R. Medzhitov. 2021. 生物学的食品品質管理システムとしての食物アレルギー。細胞。184:1440–1454. https://doi.org/10.1016/j.cell.2020.12.007
Google ScholarCrossref PubMed
Franco, L.M., M. Gadkari, K.N. Howe, J. Sun, L. Kardava, P. Kumar, S. Kumari, Z. Hu, I.D.C. Fraser, S. Moir, et al. グルココルチコイドによる免疫制御は、細胞種依存的な転写反応と関連づけることができる。J. Exp. Med. 216:384–406. https://doi.org/10.1084/jem.20180595
Google ScholarCrossref PubMed
Galli、S.J.、M. Tsai。2012. アレルギー疾患におけるIgEと肥満細胞。Nat. Med. 18:693–704. https://doi.org/10.1038/nm.2755
Google ScholarCrossref PubMed
Gavin, A.L., K. Hoebe, B. Duong, T. Ota, C. Martin, B. Beutler, and D. Nemazee. 2006. Toll様受容体シグナル非存在下におけるアジュバントによる抗体応答の増強。Science. 314:1936–1938. https://doi.org/10.1126/science.1135299
Google ScholarCrossref PubMed
ゲハ、R.S.、B.ヘルム、H.グールド。1985. 大腸菌で合成された免疫グロブリンε鎖フラグメントによるPrausnitz-Kustner反応の阻害。Nature. 315:577–578. https://doi.org/10.1038/315577a0
Google ScholarCrossref PubMed
Geha、R.S.、H.H.Jabara、およびS.R.Brodeur。2003. 免疫グロブリンEクラススイッチ組み換えの制御。Nat. Rev. Immunol. 3:721–732. https://doi.org/10.1038/nri1181
Google ScholarCrossref PubMed
グラロス、V.、R.ラウシュマイヤー、A.V.アルテモフ、A.ラインハルト、S.オルス、A.エマヌイリディ、C.グスタフソン、Y.ユー、C.ミラベロ、A.K.ビョークランド、他2021年。抗原へのアクセスを制限することで、形質芽細胞応答を抑制しながら、初期B細胞記憶を生成する。Immunity. 54:2005–2023.e10. https://doi.org/10.1016/j.immuni.2021.08.017
Google ScholarCrossref PubMed
Grumont, R.J., and S. Gerondakis. 2000. Relはリンパ球においてインターフェロン調節因子4(IRF-4)の発現を誘導する: rel/核内因子κBによるインターフェロン制御遺伝子発現の調節。J. Exp. Med. 191:1281–1292. https://doi.org/10.1084/jem.191.8.1281
Google ScholarCrossref PubMed
Gruver-Yates, A.L., M.A. Quinn, and J.A. Cidlowski. 2014. 発生期の雄性マウスB細胞におけるグルココルチコイド受容体とデキサメタゾンに対するアポトーシス反応の解析。Endocrinology. 155:463–474. https://doi.org/10.1210/en.2013-1473
Google ScholarCrossref PubMed
ヘイズ、M.D.、S.ワード、G.クロフォード、R.C.ソアネ、W.D.ジャクソン、D.キプリング、D.ヴォーリンガー、D.ダン-ウォルターズ、およびJ.ストリッド。2020. 炎症誘発性IgEは上皮過形成と腫瘍増殖を促進する。Elife. 9:e51862. https://doi.org/10.7554/eLife.51862
Google Scholar
He, J.S., S. Narayanan, S. Subramaniam, W.Q. Ho, J.J. Lafaille, and M.A. Curotto de Lafaille. 2015. IgE産生の生物学: IgE細胞の分化とIgE応答の記憶。Curr. Top. Microbiol. Immunol. 388:1–19. https://doi.org/10.1007/978-3-319-13725-4_1
Google ScholarCrossref PubMed
Hill, D.A., M.C. Siracusa, M.C. Abt, B.S. Kim, D. Kobuley, M. Kubo, T. Kambayashi, D.F. Larosa, E.D. Renner, J.S. Orange, et al. 好塩基球の造血とアレルギー性炎症を制御する常在細菌由来のシグナル。Nat. Med. 18:538–546. https://doi.org/10.1038/nm.2657
Google ScholarCrossref PubMed
Hong、J.Y.、J. Lim、F. Carvalho、J.Y. Cho、B. Vaidyanathan、S. Yu、C. Annicelli、W.K.E. Ip、およびR. Medzhitov。2020. グルココルチコイドへの周産期曝露によるCD8 T細胞免疫の長期プログラミング。Cell. 180:847–861.e15. https://doi.org/10.1016/j.cell.2020.02.018
Google ScholarCrossref PubMed
Hong, S.W., E.O., J.Y. Lee, M. Lee, D. Han, H.J. Ko, J. Sprent, C.D. Surh, and K.S. Kim. 2019. 食物抗原は、常在細菌叢の非存在下で自発的IgE上昇を駆動する。Sci. Adv. 5:eaaw1507. https://doi.org/10.1126/sciadv.aaw1507.
Google Scholar
Hoshi, H., K. Horie, K. Tanaka, H. Nagata, S. Aizawa, M. Hiramoto, T. Ryouke, and H. Aijima. 2001. 成長期C57Bl/6マウスの体性リンパ節および腸間膜リンパ節におけるリンパ濾胞数および胚中心数の加齢変化パターン。J. Anat. 198:189–205. https://doi.org/10.1046/j.1469-7580.2001.19820189.x
Google ScholarCrossref PubMed
Houston, S.A., V. Cerovic, C. Thomson, J. Brewer, A.M. Mowat, and S. Milling. 2016. 小腸と結腸を支配するリンパ節は解剖学的に分離しており、免疫学的にも別個である。Mucosal Immunol. 9:468–478. https://doi.org/10.1038/mi.2015.77
Google ScholarCrossref PubMed
岩崎明彦、R. Medzhitov. 2015. 自然免疫系による適応免疫の制御。Nat. Immunol. 16:343–353. https://doi.org/10.1038/ni.3123
Google ScholarCrossref PubMed
Jabara, H.H., S.R. Brodeur, and R.S. Geha. 2001. グルココルチコイドはCD40リガンドの発現をアップレギュレートし、CD40L依存的な免疫グロブリンのアイソタイプスイッチングを誘導する。J. Clin. Invest. 107:371–378. https://doi.org/10.1172/JCI10168
Google ScholarCrossref PubMed
Jennewein, M.F., and G. Alter. 2017. 抗体のグリコシル化の免疫調節的役割。Trends Immunol. 38:358–372. https://doi.org/10.1016/j.it.2017.02.004
Google ScholarCrossref PubMed
Kelly, B.T., and M.H. Grayson. 2016. 免疫グロブリンE、それは何のために良いですか?Ann. Allergy Asthma Immunol. 116:183–187. https://doi.org/10.1016/j.anai.2015.10.026
Google ScholarCrossref PubMed
Kim, K.S., S.W. Hong, D. Han, J. Yi, J. Jung, B.G. Yang, J.Y. Lee, M. Lee, and C.D. Surh. 2016. 食餌性抗原は小腸の制御性T細胞を誘導することにより粘膜免疫を制限する。Science. 351:858–863. https://doi.org/10.1126/science.aac5560
Google ScholarCrossref PubMed
Kuehn, H.S., M. Radinger, and A.M. Gilfillan. 2010. 肥満細胞メディエーター放出の測定。Curr. Protoc. Immunol. 第7章:Unit7 38. https://doi.org/10.1002/0471142735.im0738s91
Google ScholarCrossref PubMed
國枝真理子、平本昌彦、堀江謙一郎、永田秀樹、相澤聡、星秀樹. 2002. マウス体性リンパ節および腸間膜リンパ節におけるリンパ濾胞および胚中心の形成.Okajimas Folia Anat. Jap. 79:63–74. https://doi.org/10.2535/ofaj.79.63
Google ScholarCrossref
Kwon, D.I., E.S. Park, M. Kim, Y.H. Choi, M.S. Lee, S.H. Joo, Y.W. Kang, M. Lee, S.B. Jo, S.W. Lee, et al. 恒常性血清IgEは胸腺の形質細胞から分泌され、肥満細胞の生存を促進する。Nat. Commun. 13:1418. https://doi.org/10.1038/s41467-022-29032-x
Google ScholarCrossref PubMed
Lane, S.J., and D.M. Kemeny. 1994. グルココルチコイドとIgE:in vitroパラドックス。Clin. Exp. Allergy. 24:1001–1004. https://doi.org/10.1111/j.1365-2222.1994.tb02734.x
Google ScholarCrossref PubMed
Langmead, B., and S.L. Salzberg. 2012. Bowtie 2による高速ギャップドリードアライメント。Nat. Methods. 9:357–359. https://doi.org/10.1038/nmeth.1923
Google ScholarCrossref PubMed
li,H.、B. Handsaker、A. Wysoker、T. Fennell、J. Ruan、N. Homer、G. Marth、G. Abecasis、R. Durbin、および1000 Genome Project Data Processing Subgroup. 2009. 配列アライメント/マップフォーマットとSAMtools. Bioinformatics. 25:2078–2079. https://doi.org/10.1093/bioinformatics/btp352
Google ScholarCrossref PubMed
遺伝子発現を解析した結果。1998. STAT6はIL-4誘導生殖細胞系列Ig遺伝子の転写とスイッチ組換えに必要である。J. Immunol. 161:302-310
Google ScholarCrossref PubMed
Liu, J., S. Mustafa, D.T. Barratt, and M.R. Hutchinson. 2018. Corticosterone prexposure increases NF-κB translocation and sensitizes IL-1β responses in BV2 microglia-like cells. Front. Immunol. 9:3. https://doi.org/10.3389/fimmu.2018.00003
Google ScholarCrossref PubMed
Lloyd, C.M., and R.J. Snelgrove. 2018. 2型免疫: 視野の拡大。Sci. Immunol. 3:eaat1604. https://doi.org/10.1126/sciimmunol.aat1604
Google Scholar
Luo, W., F. Weisel, and M.J. Shlomchik. 2018. B細胞受容体とCD40シグナルは、胚中心B細胞におけるc-myc転写因子の相乗的誘導のために再配線される。Immunity. 48:313–326.e5. https://doi.org/10.1016/j.immuni.2018.01.008
Google ScholarCrossref PubMed
Martin, M. 2011. EMBnet.journalに掲載されている。EMBnet.journal. 17(1):10–12. https://doi.org/10.14806/ej.17.1.200
Google ScholarCrossref
McCoy、K.D.、N.L. Harris、P. Diener、S. Hatak、B. Odermatt、L. Hangartner、B.M. Senn、B.J. Marsland、M.B. Geuking、H. Hengartner、他 2006年。MHCクラスII同族体ヘルプ非存在下での天然IgE産生。Immunity. 24:329–339. https://doi.org/10.1016/j.immuni.2006.01.013
Google ScholarCrossref PubMed
Mizuno, T. and T.L. Rothstein. 2005. B細胞受容体(BCR)のクロストーク: CD40の関与は、PI3KやホスホリパーゼCγを必要とせずにIκBキナーゼ/IκBα/NFκBを活性化するBCRシグナルの代替経路を作り出す。J. Immunol. 174:6062–6070. https://doi.org/10.4049/jimmunol.174.10.6062
Google ScholarCrossref PubMed
Mueller, M., I. Cima, M. Noti, A. Fuhrer, S. Jakob, L. Dubuquoy, K. Schoonjans, and T. Brunner. 2006. 核内受容体LRH-1は、腸における副腎外グルココルチコイド合成を決定的に制御している。J. Exp. Med. 203:2057–2062. https://doi.org/10.1084/jem.20060357
Google ScholarCrossref PubMed
Mukherji, A., A. Kobiita, T. Ye, and P. Chambon. 2013. 腸管上皮の恒常性は、概日時計とTLRによって伝達される微生物叢の合図によって調整される。Cell. 153:812–827. https://doi.org/10.1016/j.cell.2013.04.020
Google ScholarCrossref PubMed
Oettgen, H.C. 2016. 50年後: 宿主防御、免疫調節、アレルギー疾患におけるIgE抗体の新たな機能。J. Allergy Clin. Immunol. 137:1631–1645. https://doi.org/10.1016/j.jaci.2016.04.009
Google ScholarCrossref PubMed
大西秀樹、宮原直樹、ダクハマ篤史、武田和彦、S. Mathis、B. Haribabu、E.W. Gelfand. 2008. 副腎皮質ステロイドは、ロイコトリエンB4受容体1をアップレギュレートすることにより、CD8+ T細胞を介する気道過敏性およびアレルギー性炎症を増強する。J. Allergy Clin. Immunol. 121:864–871.e4. https://doi.org/10.1016/j.jaci.2008.01.035
Google ScholarCrossref PubMed
Pabst, O., and E. Slack. 2020. IgAと腸内細菌叢: 特異的であることの重要性。Mucosal Immunol. 13:12–21. https://doi.org/10.1038/s41385-019-0227-4
Google ScholarCrossref PubMed
Palm, N.W., R.K. Rosenstein, and R. Medzhitov. 2012. アレルギー性宿主防御。Nature. 484:465–472. https://doi.org/10.1038/nature11047
Google ScholarCrossref PubMed
プルレリッツ、T.、J.ロットバル、A.トギアス。2002. グルココルチコイドと免疫グロブリンE: グルココルチコイドと免疫グロブリンE: No new in vivo paradigms. Clin. Exp. Allergy. 32:345–346. https://doi.org/10.1046/j.1365-2222.2002.01336.x
Google ScholarCrossref PubMed
Rakoff-Nahoum、S.、Y. Kong、S.H. Kleinstein、S. Subramanian、P.P. Ahern、J.I. Gordon、およびR. Medzhitov。2015. 哺乳類腸の生後発達における遺伝子-環境相互作用の解析。Proc. Natl. Acad. Sci. USA. 112:1929–1936. https://doi.org/10.1073/pnas.1424886112
Google ScholarCrossref
Ramirez, F., F. Dundar, S. Diehl, B.A. Gruning, and T. Manke. 2014. deepTools: ディープシーケンスデータを探索するための柔軟なプラットフォーム。Nucleic Acids Res. 42:W187-W191. https://doi.org/10.1093/nar/gku365
Google ScholarCrossref PubMed
Reber, L.L., J.D. Hernandez, and S.J. Galli. 2017. アナフィラキシーの病態生理学。J. Allergy Clin. Immunol. 140:335–348. https://doi.org/10.1016/j.jaci.2017.06.003
Google ScholarCrossref PubMed
Renz, H., K.J. Allen, S.H. Sicherer, H.A. Sampson, G. Lack, K. Beyer, and H.C. Oettgen. 2018. 食物アレルギー。Nat. Rev. Dis. Prim. 4:17098. https://doi.org/10.1038/nrdp.2017.98
Google ScholarCrossref
Salvi, S.S., K.S. Babu, and S.T. Holgate. 2000. グルココルチコイドはIgEの合成を促進する。我々は新しいパラダイムに向かっているのか?Clin. Exp. Allergy. 30:1499–1505. https://doi.org/10.1046/j.1365-2222.2000.00990.x
Google ScholarCrossref PubMed
Sasse, S.K., M. Gruca, M.A. Allen, V. Kadiyala, T. Song, F. Gally, A. Gupta, M.A. Pufall, R.D. Dowell, and A.N. Gerber. 2019. グルココルチコイドとTNFとのクロストークの新規転写産物解析は、一次的かつ協調的な炎症抑制を定義する。Genome Res. 29:1753-1765. https://doi.org/10.1101/gr.248187.119
Google ScholarCrossref PubMed
Schnare、M.、G.M.Barton、A.C.Holt、K.Takeda、S.Akira、R.Medzhitov。2001. Toll様受容体は適応免疫応答の活性化を制御する。Nat. Immunol. 2:947–950. https://doi.org/10.1038/ni712
Google ScholarCrossref PubMed
シェイド、K.T.C.、M.E.コンロイ、N.ウォッシュバーン、北岡正明、D.J.フイン、E.ラプライズ、S.U.パチル、W.G.シュレフラー、R.M.アンソニー。2020. 免疫グロブリンEのシアリル化はアレルギー病原性の決定因子である。Nature. 582:265–270. https://doi.org/10.1038/s41586-020-2311-z
Google ScholarCrossref PubMed
Shimba, A., G. Cui, S. Tani-Ichi, M. Ogawa, S. Abe, F. Okazaki, S. Kitano, H. Miyachi, H. Yamada, T. Hara, et al. グルココルチコイドはインターロイキン-7受容体とCXCR4を誘導することにより、T細胞の分布と応答の日内振動を駆動する。Immunity. 48:286–298.e6. https://doi.org/10.1016/j.immuni.2018.01.004
Google ScholarCrossref PubMed
Stavnezer, J., and C.E. Schrader. 2014. IgH鎖クラススイッチ組換え: Mechanism and regulation. J. Immunol. 193:5370–5378. https://doi.org/10.4049/jimmunol.1401849
Google ScholarCrossref PubMed
Tan, C.K., and W. Wahli. 2016. A trilogy of glucocorticoid receptor actions. Proc. Natl. Acad. Sci. USA. 113:1115–1117. https://doi.org/10.1073/pnas.1524215113
Google ScholarCrossref
Vaidyanathan, B., A. Chaudhry, W.T. Yewdell, D. Angeletti, W.F. Yen, A.K. Wheatley, C.A. Bradfield, A.B. McDermott, J.W. Yewdell, A.Y. Rudensky, and J. Chaudhuri. 2017. アリール炭化水素受容体は、B細胞における細胞運命決定を制御する。J. Exp. Med. 214:197–208. https://doi.org/10.1084/jem.20160789
Google ScholarCrossref PubMed
van der Valk, J. 2022. ウシ胎児血清-細胞培養のジレンマ。Science. 375:143–144. https://doi.org/10.1126/science.abm1317
Google ScholarCrossref PubMed
Weikum, E.R., M.T. Knuesel, E.A. Ortlund, and K.R. Yamamoto. 2017. 転写のグルココルチコイド受容体制御: アロステリーを介した精密性と可塑性。Nat. Rev. Mol. Cell Biol. 18:159-174. https://doi.org/10.1038/nrm.2016.152
Google ScholarCrossref PubMed
Wesemann, D.R., J.M. Magee, C. Boboila, D.P. Calado, M.P. Gallagher, A.J. Portuguese, J.P. Manis, X. Zhou, M. Recher, K. Rajewsky, et al. 未熟B細胞は、直接SμからSεへの組み換えが増加すると、優先的にIgEに切り替わる。J. Exp. Med. 208:2733–2746. https://doi.org/10.1084/jem.20111155
Google ScholarCrossref PubMed
Wesemann, D.R., and C.R. Nagler. 2016. アレルギー疾患におけるマイクロバイオーム、タイミング、バリア機能。Immunity. 44:728–738. https://doi.org/10.1016/j.immuni.2016.02.002
Google ScholarCrossref PubMed
Wu, Y.L., M.J.T. Stubbington, M. Daly, S.A. Teichmann, and C. Rada. 2017. B細胞における転写の本質的不均一性は、IgEへの初期クラススイッチングを制御する。J. Exp. Med. 214:183–196. https://doi.org/10.1084/jem.20161056
Google ScholarCrossref PubMed
Xiong, H., J. Dolpady, M. Wabl, M.A. Curotto de Lafaille, and J.J. Lafaille. 2012. 高親和性IgE抗体の生成には、連続的なクラススイッチングが必要である。J. Exp. Med. 209:353–364. https://doi.org/10.1084/jem.20111941
Google ScholarCrossref PubMed
Yang, L., K. Boyd, S.C. Kaste, L. Kamdem Kamdem, R.J. Rahija, and M.V. Relling. 2009. グルココルチコイド誘発性骨壊死モデルマウス: ステロイド休薬の効果。J. Orthop. 27:169-175. https://doi.org/10.1002/jor.20733
Google ScholarCrossref PubMed
Yang, Z., B.M. Sullivan, and C.D.C. Allen. 2012. 蛍光in vivo検出により、IgE(+)B細胞は内在性の細胞運命素因によって抑制されていることが明らかになった。Immunity. 36:857–872. https://doi.org/10.1016/j.immuni.2012.02.009
Google ScholarCrossref PubMed
Zhang, Y., T. Liu, C.A. Meyer, J. Eeckhoute, D.S. Johnson, B.E. Bernstein, C. Nusbaum, R.M. Myers, M. Brown, W. Li, and X.S. Liu. 2008. ChIP-seqのモデルベース解析(MACS)。Genome Biol. 9:R137. https://doi.org/10.1186/gb-2008-9-9-r137
Google ScholarCrossref PubMed
遺伝子発現を解析するために必要な遺伝子発現の解析法。1994. グルココルチコイドのIgE産生に対するin vivo効果。J. Allergy Clin. Immunol. 94:222–230. https://doi.org/10.1016/0091-6749(94)90044-2
Google ScholarCrossref PubMed
著者ノート
*J. Lim、E.V. Lin、J.Y. Hongは本論文に等しく貢献した。
開示: 著者らは競合する利益はないと宣言している。
Bharat Vaidyanathanの現住所はEMD Serono Research & Development Institute, Billerica, MAである。
© 2022 Lim et al.
この論文はクリエイティブ・コモンズ・ライセンス(表示4.0インターナショナル、https://creativecommons.org/licenses/by/4.0/)の下で利用可能である。
補足データ
表S1
B-27サプリメントに含まれるビタミン、タンパク質、その他の成分の一覧。
docxファイル
表S2
は、生体外で培養したB細胞から得られたtotal RNA-seqデータである。xlsxファイル
表S3
選別したmLN B細胞からのtotal RNA-seqデータを示す。xlsxファイル
表S4
フローサイトメトリー用抗体のリスト。docxファイル
表S5
RT-qPCR用プライマーの一覧。docxファイル
ソースデータF2
図2のオリジナルブロットを含む。pdfファイル
実験医学雑誌
最新記事
最新号
アーカイブ
アラート
原稿の投稿
著者の方へ
図書館員の方へ
JEMについて
編集者とスタッフ
ポリシーと許可
アクセシビリティ・ステートメント
広告掲載
お問い合わせ
ニュースルーム
プライバシーポリシー
フェイスブック
X/Twitter
インスタグラム
YouTube
RSSフィード
フェイスブック
X/ツイッター
インスタグラム
YouTube
オンライン ISSN 1540-9538 プリント ISSN 0022-1007
この記事が気に入ったらサポートをしてみませんか?
