
粘膜免疫監視に関与するII型味覚細胞
粘膜免疫監視に関与するII型味覚細胞
https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3001647
Yumei Qin, Salin Raj Palayyan, Xin Zheng, Shiyi Tian, Robert F. Margolskee, Sunil K. Sukumaran.
要旨
口腔内細菌は腸内細菌に次いで多様で豊富であるが、その味覚細胞への影響はほとんど未解明である。我々はシングルセルRNASeqを用いて、マウスの味覚細胞、特に味覚1受容体メンバー3(Tas1r3)を発現する甘味・うま味受容体細胞が、パイエル板や扁桃などの粘膜関連リンパ組織(MALT)における免疫監視の中心人物、マイクロフォールド(M)細胞を思わせる遺伝子発現特性を有することを見いだした。M細胞の分化に必要な成長因子であるTumor necrosis factor ligand superfamily member 11(TNFSF11、別名RANKL)を投与すると、野生型(WT)マウスの味覚乳頭と培養味覚オルガノイドでM細胞の増殖とマーカー遺伝子発現が劇的に増加することが判明した。一方、M細胞の発生と再生に必要なRANKL制御転写因子Spibを欠損したノックアウトマウス(SpibKO)の味覚乳頭とオルガノイドは、RANKLに反応しなかった。SpibKOマウスの味覚乳頭は、NF-κBシグナル伝達経路の構成要素や炎症性サイトカインの発現も低下し、免疫細胞の誘引も少なかった。しかし、リポポリサッカライドによるサイトカインの発現は、SpibKOマウスではWTマウスに比べ強く上昇していた。味覚細胞はM細胞と同様、蛍光標識したマイクロビーズを容易に取り込み、微生物のトランスサイトーシスの代用とした。SpibKOマウスでは、味覚細胞のサブタイプの割合に変化はなかったが、甘味やうま味の刺激に対する誘引が増加した。味覚細胞は免疫監視に関与しており、微生物のシグナル伝達や感染に対して味覚反応を調節している可能性が示唆された。
引用元 Qin Y, Palayyan SR, Zheng X, Tian S, Margolskee RF, Sukumaran SK (2023) Type II taste cells participate in mucosal immune surveillance. PLoS Biol 21(1): e3001647.doi:10.1371/journal.pbio.3001647
アカデミックエディター Piali Sengupta, Brandeis University, UNITED STATES(ブランダイス大学、アメリカ合衆国
Received: 2022年4月15日、受理。2022年12月10日、発行。2023年1月12日
Copyright: © 2023 Qin et al. 本論文は、原著者および出典を明記することを条件に、あらゆる媒体での無制限の使用、配布、および複製を許可するクリエイティブ・コモンズ表示ライセンスの条件の下で配布されるオープンアクセス論文である。
データの利用可能性 本研究で使用したすべての配列データは、NCBIのshort read archive (SRA)からアクセッション番号SRP094673で取得可能です。その他の関連データは、論文およびそのSupporting Informationファイル内にあります。
資金提供 この研究は、NIH-NIDCDのR01 DC014105とP30 DC011735によるR.F.M.への助成を受けたものである。Y.Q.には中国国家自然科学基金若手科学者基金(31800875)、S.K.にはNebraska Center for the Prevention of Obesity Diseases (NIH-NIGMS grant no. P20GM104320) からプロジェクトリーダー賞が授与された。 S. Imagingは、NIH-NIDCD Core Grant P30DC011735およびNational Science Foundation Grant DBI-0216310(Gary Beauchampへ)の資金援助を一部受けているMonel Histology and Cellular Localization Coreで実施された。研究助成機関は、研究デザイン、データ収集と解析、発表の決定、原稿の作成において、いかなる役割も担っていない。
競合する利益 著者らは、競合する利害関係が存在しないことを宣言している。
略語 APC、抗原提示細胞、CVP、乳頭、EGFP、増強緑色蛍光タンパク質、FACS、蛍光活性化セルソーティング、FAE、毛包関連上皮、FFP、菌状乳頭、FOP、毛包関連上皮。 FOP, foliate papillae; GP2, glycoprotein 2; GST, glutathione-S transferase; IPTG, isopropyl-D-1-thiogalactopyranoside; LB, Luria-Bertani; LPS, lipopolysaccharide; MALT, mucosa-associated lymphoid tissue; M細胞、マイクロフォールド細胞;MSG、グルタミン酸ナトリウム;NF-κB、核因子κB;NT、無味;PBS、リン酸緩衝生理食塩水;PGLYRP1、ペプチドグリカン認識タンパク質1;PMT、光電子増倍管。 PVR, ポリオウイルス受容体;scRNASeq, 単一細胞RNASeq;Tas1r3, 味覚1受容体メンバー3;TLR, Toll様受容体;TNFSF11, 腫瘍壊死因子リガンド スーパーファミリ メンバー11;WT, 野生型
はじめに
マウスなどの哺乳類では、味蕾の多くは舌背面にある3種類の味蕾乳頭に存在する[1,2]。このうち、前舌にある菌状乳頭(FFP)にはそれぞれ単一の味蕾があり、後舌の外側と内側にある葉状乳頭(FOP)と円状乳頭(CVP)にはそれぞれ数百個の味蕾がある [1,2]。CVPとFOPの味蕾は、舌の中に伸びる溝を取り囲むように配置されている。各味蕾は、形態とマーカー遺伝子の発現から、I型、II型、III型、IV型に分類される約50〜100個の成熟した受容体細胞を含んでいます[1-3]。これらの細胞はさらに、甘味、苦味、うま味(タイプII細胞のサブタイプ)、酸味、塩味(主にタイプIII細胞のサブタイプ)の基本的な味質に反応する機能的サブタイプに分類されています[1-3]。味覚細胞の半減期は8日から24日で、味覚乳頭の基底部に存在する幹細胞集団から継続的に再生される[4-7]。
16s RNAシーケンスとメタゲノム研究により、舌背部を含む口腔内は多様な微生物種によってコロニー化されていることが示されています[8-11]。味覚細胞は、味を感じない舌上皮の細胞とは異なり、味孔を通じて舌表面に突出する微絨毛を通じて口腔微生物叢に継続的に曝されています。しかし、味覚シグナル伝達や味覚細胞の再生に与える影響は、これまで十分に注目されていませんでした。味覚乳頭は、ランゲルハンス細胞サブタイプを含む樹状細胞、T細胞、マクロファージなど、多様な免疫細胞集団によってパトロールされています[12,13]。ほとんどの口腔粘膜常在菌は無害または有益であり、宿主はそれらに対する免疫寛容を獲得する[14]。しかし,口腔粘膜の異常は味覚の喪失や歪みを引き起こすことがあり,インフルエンザ,口腔鵞口瘡(カンジダ症),HIV,細菌感染,COVID-19などの疾患患者によく見られる [15-21].味覚細胞、口腔マイクロバイオーム、上皮免疫細胞の間の細かく調整されたクロストークの基礎となる経路を特定することは、健康および疾患においてマイクロバイオータが味覚細胞にどのように影響を与えるかを明らかにするのに役立つであろう。
粘膜における適応免疫の最も重要な構成要素は粘膜関連リンパ組織(MALT)である[22,23]。MALTは、管腔内微生物をサンプリングし、適切な粘膜免疫応答を生み出す免疫誘導部位である。MALTは、B細胞およびT細胞を含むリンパ濾胞からなり、濾胞関連上皮(FAE)と呼ばれる上皮層によって覆われている[24]。マイクロフォールド細胞(M細胞)と呼ばれるFAEの特殊な上皮細胞は、内腔の微生物をトランスサイトーシスし、その基底ポケットに収容されている樹状細胞やマクロファージなどの抗原提示細胞(APC)に渡す [25,26].APCによる抗原の処理と提示は、その下にあるリンパ濾胞内のBおよびTリンパ球を刺激し、適切な免疫応答を行う [24,26,27].これらのエフェクター細胞は、その後、粘膜の他の部分や血液中に全身的に移動する。このように、M細胞は粘膜免疫において中心的な役割を担っている。M細胞は、糖タンパク質2(GP2)、ペプチドグリカン認識タンパク質1(PGLYRP1)、ポリオウイルス受容体(PVR)など、微生物に対するいくつかの受容体を発現し、内腔の微生物に結合して内在化する [28-30]。M細胞は、よく発達した小胞体を持っているが、リソソームはあまり発達していないため、上皮を横切ってほとんど無傷で微生物の荷物を迅速に輸送することができる [26].MALT上皮の下にある結合組織細胞から分泌されるtumor necrosis factor ligand superfamily member 11(TNFSF11;RANKLとも呼ばれる)により、M細胞の分化が誘導される [31].RANKL は受容体 tumor necrosis factor receptor superfamily member 11A (TNFRSF11A) に結合し、非正規の nuclear factor kappa B (NF-κB) シグナル経路を活性化して初期 M 細胞マーカー遺伝子の発現をオンにしている [31-34]。中でも最も顕著なのは、M細胞分化の後期を司る転写因子であるSpibである[35,36]。GFP標識したマウス味覚細胞のシングルセルRNASeq(sCRNASeq)を用いて、味覚1受容体メンバー3(Tas1r3)を発現する甘味・うま味受容体細胞(Tas1r3+細胞)が、いくつかのM細胞マーカー遺伝子を発現することを発見しました[37]。この遺伝子発現プロファイルと一致して、RANKL投与により、野生型(WT)マウスの味覚乳頭および培養味覚オルガノイドにおいて、Spibノックアウト(SpibKO)ではなくM細胞マーカー遺伝子の著しい発現上昇がみられた。また、SpibKOマウスは、味覚乳頭においてNF-κBシグナル経路の構成要素の発現および炎症性サイトカインの遺伝子発現が低下し、乳頭への免疫細胞の誘引も少なかった。しかし、SpibKOマウスでは、リポポリサッカライド(LPS)誘発性のサイトカイン発現がWT同腹子に比べ非常に上昇していた。また、SpibKOマウスの味覚細胞は、蛍光標識したマイクロビーズを細胞内に取り込むことが可能であった。Spibの欠損は乳頭内の味覚細胞サブタイプの割合に影響を与えなかったが、甘味とうま味の刺激に対する誘引が増加した。この結果は、味細胞がM細胞様の性質を持ち、微生物のコロニー形成や感染に応答して味覚シグナルを調節している可能性を示している。
研究結果
味覚細胞はM細胞マーカー遺伝子を発現している
味覚細胞に発現する粘膜免疫に関わる遺伝子を同定するために、それぞれのEGFPトランスジェニックマウスのCVPから得られたGnat3-EGFP+(主に苦味受容体をCVPで発現、タイプII)、Tas1r3-EGFP+(甘味・うま味受容体を発現、タイプII)、Gad1-EGFP+(タイプIII)の味細胞についてscrNASeqデータを解析しました。その結果、すべての細胞型、特にTas1r3+細胞はM細胞の成熟と機能に重要ないくつかの遺伝子を選択的に発現していることがわかった(S1 Table)[37]。これらの遺伝子のサブセットの味覚細胞におけるmRNAおよびタンパク質レベルでの発現は、分子および組織学的手法で確認された。エンドポイントPCRと定量的リアルタイムPCRにより、M細胞マーカー遺伝子Gp2, Marcksl1, Ccl9, Anxa5, Sgne1, SpibがCVPでしっかり発現していることが示されたが、NT舌上皮ではかなり低いレベルか全く発現しなかった(S1AおよびS1B Fig)。Spib特異的プローブセットを用いたRNAscopeハイブリダイゼーションでは、CVPとFFPの味覚細胞で発現していることがわかった(S1CとS1D Fig)。これらの結果は、SPIBに対する抗体を用いた間接的な免疫組織化学によってタンパク質レベルで確認され、CVP、FOP、PPの味覚細胞の亜集団の核を染色した(S1EとS1G Fig)。SPIB抗体と二次抗体の特異性は、SpibKOマウスのPPとCVPが染色されないこと、WTマウスのCVPを染色する際に一次抗体を省略したことで確認した(S1HとS1J Fig)。
M細胞マーカー遺伝子を発現している味覚細胞のタイプを同定するために、RNAscope Hiplex Fluorescent Assayと二重ラベル免疫組織化学に注目した。RNAscopeアッセイは、CVPのM細胞マーカー遺伝子Spib、Gp2、Tnfrsf11aおよび味細胞マーカー遺伝子Tas1r3、Gnat3、Trpm5(全II型細胞のマーカー)、Ddc(全III型細胞のマーカー)に対するプローブセットで実施された。scRNASeqのデータと一致して、SpibとTas1r3の間に強い共局在性が観察され、Spib+細胞の95%がTas1r3を共発現していた(図1AおよびS2表)。Spib+細胞の約27%がGnat3を、93%がTrpm5を、約18%がDdcを共発現していた(図1B-1D、S2表)。注目すべきは、Ddc+細胞とGnat3+細胞におけるSpibの発現レベル(細胞あたりの蛍光スポット数で示す)は、Tas1r3+細胞とTrpm5+細胞に比べてはるかに弱いことである(図1A〜1D)。Gp2の発現はテストしたすべての細胞型に分布しているが、II型味覚細胞により強く関連する傾向があった(図1E-1HおよびS2表)。Tnfrsf11aの発現は、すべての細胞型に均等に分布している(図1I-1L、S2表)。
拡大サムネイル
図1. 味覚細胞のM細胞マーカー遺伝子発現のRNAScope解析。
RNAscope Hiplex蛍光アッセイを用いて、Spib (A-D), Gp2 (E-H), Tnfrsf11a (I-L) とCVPにおける味覚細胞マーカーTas1r3, Gnat3, Trpm5, Ddcの共発現を測定した。SpibはTas1r3、Trpm5と強い共発現が見られ、Gnat3、Ddcとはあまり強くない共発現が見られた。Gp2はII型味覚細胞と相関が高い傾向があり、Tnfrsf11aの発現はすべての味覚細胞型に均等に分布している。スケールバー=10μm。
doi:10.1371/journal.pbio.3001647.g001
詳細 "
CVPとFOPにおいて、SPIB抗体と、II型味覚細胞マーカーTRPM5、T1R3、GNAT3、III型マーカーCAR4、またはI型マーカーENTPD2に対する第2の抗体を組み合わせて、ダブルラベル免疫組織化学を行った(図2)。その結果、SPIB発現細胞の約91%から97%がTRPM5とT1R3を共発現していることが確認された(S3 Table)。SPIBはGNAT3と弱い共発現(8%〜28%)、CAR4とは無視できるほど(4%〜6%)共発現している。SPIBはENTPD2とは共発現していないようであるが、I型細胞が他の味覚細胞に巻きついているため、共発現の正確な判定が困難であるため、定量化されていない。
拡大サムネイル
図2. SPIBはT1R3と共発現している。
CVPおよびFOP切片に、SPIBとII型味覚細胞マーカーTRPM5(A、F)、T1R3(B、G)、GNAT3(C、H)、III型味覚受容体マーカーCAR4に対する抗体を二重標識した免疫蛍光共焦点顕微鏡(D.I)、I型味覚細胞マーカーENTPD2(E、J)は、SPIBとT1R3との共発現が多く、TRPM5とGNAT3との共発現は少なく、CAR4とENTPD2とはごくわずかの共発現であることを示す。核はDAPIで青く対比染色した。スケールバー:50μm。
doi:10.1371/journal.pbio.3001647.g002
詳細 "
二重標識免疫組織化学はまた、他の2つのM細胞マーカー、GP2とCCL9が、定量化されていないが、CVPにおいてタイプII細胞マーカーTRPM5と共発現し、タイプIII細胞マーカーCAR4とはしないようであることを示した(S2 Fig)。注目すべきは、味蕾の頂点、おそらく味細胞の微絨毛に見られる強いGP2染色で、この受容体タンパク質について他のMALTのM細胞に観察されるパターンと類似している(S2CおよびS2F Fig)[28]。Tas1r3+細胞を含む全てのII型味覚細胞を欠損したPou2f3ノックアウトマウスのCVPは、CCL9、GP2、SPIBを発現しない(S3 Fig)[38]。以上の結果から、味覚細胞、特にタイプIIサブタイプは、いくつかのM細胞マーカー遺伝子を発現していることが決定的になった。
RANKLは味覚乳頭および培養味覚オルガノイドのM細胞マーカー遺伝子発現をSpib依存的にアップレギュレートする
次に、RANKLが他のMALTと同様にSpib依存的に味覚乳頭のM細胞マーカー遺伝子の発現を増加させるかどうかを検討した[31,35,36]。M細胞マーカータンパク質GP2、CCL9、MARCKSL1、SPIBの基礎発現レベルはWT動物では比較的低く、Gp2とCcl9をコードするmRNAはSpibKOマウスのCVPでは低い(S4A、S4D、S4IおよびS4K Fig)。RANKLの投与により、SpibKOではなくWTマウスのCVPにおいて、GP2、CCL9、MARCKSL1、およびSPIBの発現細胞の割合と対応するmRNAのレベルが劇的に増加した(S4EおよびS4L Fig)。同時に、qPCR解析により、両系統のNT上皮において、Gp2、Ccl9、Marcksl1 mRNAの発現はRANKL処理により上昇しないことが示された(S4M Fig)。
PPと腸絨毛では、RANKL処理により様々なM細胞マーカー遺伝子が定型的な時間順序で発現誘導される[35]。このことが味覚細胞でも保存されているかどうかを調べるために、SpibKO:Lgr5-EGFPノックイン株またはコントロール(Lgr5-EGFP)株から得られた味覚オルガノイドに注目した。PPや腸管オルガノイドと同様に、コントロールマウス由来のオルガノイドでも、初期M細胞マーカーであるMarcksl1やCcl9のmRNAや対応するタンパク質の発現は1日目から増加し始め、2日目にピークに達した。Spibは徐々に増加して3日目にピークに達し、後期マーカーGp2はよりゆっくりと増加してRANKL投与後4日目にピークとなった(S5A-S5P Fig)。一方、SpibKOマウス由来の味覚オルガノイドは、RANKL投与によりGp2、Ccl9、Marcksl1 mRNAの誘導が劇的に損なわれた(S5M-S5P Fig)。
SpibKOマウスでは粘膜免疫応答が損なわれている
次に、WT マウスと SpibKO マウスの CVP において、粘膜免疫の様々な側面を比較した。RANKL、他のTNFファミリーリガンド、LPSのような病原体関連分子パターンなどの複数の刺激がNF-κB経路を介してシグナル伝達される[39]。SpibKOマウスでは、NF-κBシグナル伝達経路の構成要素やその標的遺伝子の発現に異常が見られるかどうかを調べたところ、qPCR解析により、アダプタータンパク質Myd88、制御タンパク質Tollip、Irak3、Irak4、および転写因子Nfkb1、Nfkb2、Rela、Rel、Irf6の発現が低下していた(S6AおよびS6B Fig)。これらの知見と一致して、NF-κBによって制御されるいくつかの炎症性サイトカイン、すなわちIl1b、Il6、Mcp1、およびTnfの発現はSpibKOマウスで低下しており、抗炎症サイトカインIl10、Il12およびIfnγのそれは変化しなかった(S6C Fig)。LPSはCVPに強い炎症性サイトカインの発現を引き起こすことが知られており、我々はこれがSpibKOマウスで再現されるかどうかを検証した[20]。その結果、LPS投与により、WTマウスに比べ、SpibKOマウスのCVPではサイトカイン遺伝子の発現が増大した(S7 Fig)。次に、SpibKOマウスにおけるベースラインのサイトカイン発現の低下は、CVPへの免疫細胞の採用に影響を与えるかどうかを検討した。広範な免疫細胞を標識するCD11BとCD45、あるいはT細胞マーカーCD3に対する抗体による免疫染色では、SpibKOマウスではCVPをパトロールする免疫細胞が減少していた(Fig 3A-3F)。最後に、味覚細胞が微生物のトランスサイトーシスを行うことができるかどうか、また SpibKO マウスではそれが損なわれているかどうかを検証した。トランスサイトーシスの代用として蛍光標識したマイクロビーズを取り込むと、SpibKOマウスではなくWTマウスのCVPにおいて、KCNQ1発現味覚細胞で明らかになった(図3G-3I)。
拡大表示
図3. Spibノックアウトマウスは免疫反応に障害がある。
(A-F) WTマウスとSpibKOマウスのCVP切片をマウス免疫細胞マーカーCD45 (A, D), CD11B (B, E), CD3 (C, F)に対する抗体で染色した間接免疫蛍光共焦点顕微鏡写真。WTマウスと比較して、SpibKOマウスはCVPの免疫細胞が少なかった。(G-H) WT マウス (G) と SpibKO マウス (H) の CVP から味覚細胞への直径 200 nm の蛍光ビーズの取り込みを共焦点顕微鏡で観察した。味覚細胞は、パネルA-Hで汎味覚細胞マーカーKCNQ1による染色で可視化されている。(I)ビーズの取り込みを画像解析により定量化し、WTマウスの平均取り込みが1.0となるように正規化した(グラフの下にあるデータは、WTマウスの平均取り込みが1.0となるように正規化した。(グラフの基礎となるデータはS6_DataのData Iにある)WTマウスと比較して、SpibKOマウスはより少ないビーズを取り込んでいた。***p < .001. スケールバー、50μm。
doi:10.1371/journal.pbio.3001647.g003
もっと見る "
SpibKOマウスは甘味・うま味の味覚に対する誘引が増強される
SpibはM細胞の再生と機能に関与していることから、Spibを欠損させると味細胞の再生や味覚嗜好に異常が生じるかどうかを検討した。味覚マーカータンパク質 T1R3, TRPM5, GNAT3, CAR4 に対する抗体を用いた免疫染色により、SpibKO マウスの CVP では WT と比較してタイプ II と III の細胞の割合に変化がないことがわかった (S8A-S8I Fig)。これらの結果は、対応するmRNAのqPCR解析によって確認された(S8J Fig)。しかし、短時間の味覚テストでは、SpibKOマウスはWT同腹子と比べて、原型的な甘味およびうま味刺激であるスクロースおよびグルタミン酸一カリウムへの誘引が増加した(図4Aおよび4C)。また、統計学的に有意ではなかったが、スクラロースに対する誘引もSpibKOマウスで高くなったようである(Fig.4B)。一方、安息香酸デナトニウム(苦味)、塩化ナトリウム(塩味)、クエン酸(酸味)に対する、Tas1r3+細胞以外の味細胞型が介在する反応は、2系統間で変化がなかった(図4D-4F)。
拡大表示
図4. SpibKOマウスは甘味とうま味の味覚物質に対する行動的引きつけが増加した。
甘味(スクロース、スクラロース、AおよびB)、うま味(グルタミン酸一カリウム、C)、苦味(デナトニウム、D)、塩味(NaCl、E)および酸味(クエン酸、F)の味刺激に対する行動反応を短時間アクセス試験により測定した。(同腹のWTマウスと比較して、SpibKOマウスは甘味とうま味(ショ糖とMPG)に対するリック反応が増加したが、他の味覚刺激に対する反応は変化しなかった。リック比は、各テストセッションにおける味覚溶液へのリック回数を水へのリック回数で割って算出した。データは二元配置分散分析およびポストホックt検定で解析した平均値±SEMである。N = 12 (WTマウス) と14 (SpibKOマウス)。*p < .05, **p < .01。
doi:10.1371/journal.pbio.3001647.g004
詳細 "
ディスカッション
粘膜は微生物が定着する重要な経路であり、動物は感染に対抗するために自然免疫と適応免疫の両方からなる強力な粘膜免疫系を進化させてきた[40-42]。MALTは、粘膜適応免疫に重要な二次リンパ組織の一種である。腸(PP)と扁桃のMALTが最もよく研究されているが、唾液腺、鼻咽頭、結膜、涙管など他の粘膜にもMALTが存在する[24,43,44]。舌背の粘膜は、頬粘膜よりもさらに口腔内細菌群のコロニー化が進んでいる [9,45]。舌表面の大部分は角化した重層扁平上皮で構成されており、微生物の侵入に対して効果的なバリアとして機能している。しかし、味細胞の微絨毛は、味蕾の味孔を通して舌表面に突出しており、おそらく微生物が侵入しやすい経路であると思われる。味蕾に囲まれたCVPおよびFOPのトレンチは、唾液の洗い流しから大きく遮断されているため、長期的な微生物コロニー形成に理想的な場所である。しかし、口腔内細菌叢が味覚細胞に与える影響については、これまで十分に詳しく研究されていない。味覚細胞におけるToll-like receptor(TLR)、インターフェロン受容体、およびその下流のシグナル伝達経路成分の発現が記録されている[46-48]。TLRに結合するLPSや二本鎖RNAをそれぞれ細菌感染やウイルス感染を模倣して投与すると、味覚細胞のTLRやインターフェロンシグナル経路が活性化され、おそらく炎症性サイトカインの分泌を促すことで味覚細胞の再生や味覚伝達が低下する [20,47,49,50].同様に、マウスでLPSの主要な受容体であるTlr4をノックアウトすると、糖、脂質、うま味に対する味覚応答が低下する[48]。興味深いことに、甘味と苦味の受容体は口腔外のいくつかの組織で微生物の代謝産物と結合し、免疫反応を媒介しますが、味覚乳頭自体でそうなっているかどうかは分かっていません[51,52]。
味覚と腸管上皮の間には、いくつかの機能的および発生的な類似点が存在します。例えば、CVPとFOPの腸上皮細胞と味覚細胞は内胚葉由来でLgr5を発現する幹細胞から発生します [4,53,54] 。味覚受容体および味覚伝達機構の他のメンバーは、栄養を感知する腸内分泌細胞および微生物と寄生虫を感知する腸房細胞にも発現しています [55-60] 。最後に、味覚細胞も腸管上皮細胞もそれぞれの微生物叢に大きく暴露されており、味覚細胞のいくつかのタイプがM細胞の機能的特徴を共有している可能性はもっともである。実際、我々はscRNASeqを用いて味覚細胞におけるM細胞様の遺伝子発現シグネチャーを同定した(図1、2、S1、S2、S1表)。驚くべきことに、RANKL投与により、CVPではM細胞の増殖が、培養味覚オルガノイドではM細胞マーカー遺伝子の発現が、PPおよびPP由来のオルガノイドで観察されたのと同じ時間順序で上昇した(S4およびS5 Figs)。最後に、PPと同様に、CVPと味覚オルガノイドにおけるM細胞マーカー遺伝子の発現は、Spibを必要とする。SpibKOマウスは、M細胞遺伝子発現の基礎レベルが低く、RANKLに反応しない(S4, S5 Figs)。これらの観察と一致して、SpibKOマウスではなくWTマウスの味覚細胞は内腔マイクロビーズを通過させることができる(図3G-3I)。このように、味覚細胞はM細胞様の性質を持つことが、すべての証拠から示されている。しかし、すべての味覚細胞がM細胞様の性質を持つかどうかは明らかではない。基底レベルでは、タイプII細胞、特にTas1r3+集団は、mRNAとタンパク質レベルの両方でSpibとGp2を強く共発現している(図1、図2、図S2)。Ddc+細胞におけるSpibの発現量(細胞あたりの蛍光スポット数で決定)は、タイプII細胞に比べてはるかに低い(図2A-2H)。しかし、RANKL刺激によりM細胞マーカー遺伝子を発現する細胞がすべてII型細胞であるのか、あるいはII型細胞のみがトランスサイトーシス可能なのか、その可能性は低いと思われる。タイプIIIの味覚細胞の中にはTnfrsf11a(RANKL受容体)を発現しているものもあり、RANKL刺激でM細胞マーカー遺伝子を発現する細胞のかなりの割合を占めている可能性がある(図1L、S1、S2表)。同様に、III型味覚細胞もトランスサイトーシスが可能である可能性があるが、サブタイプレベルのトランスサイトーシスアッセイは技術的な困難のために行われなかった。しかしながら、Pou2f3KO動物ではSPIB, GP2, CCL9の基底レベルでの発現が消失しており、II型味覚細胞が免疫監視に重要な役割を果たすことが示された(S3 Fig)。タイプIやIVの細胞は味孔から微絨毛を出さないため、トランスサイトーシスが可能であるとは考えにくい[3]。つまり、タイプII味覚細胞、特にTas1r3+細胞は、M細胞様味覚細胞の大部分を形成していると考えられるが、より少数の他の味覚細胞(おそらくタイプIII細胞)もM細胞の性質を獲得している可能性があるということである。
上記のような共通点がある一方で、味覚細胞と従来のM細胞との間にはいくつかの重要な相違点がある。味覚細胞は、M細胞に見られるようなAPCを収容する基底ポケットをもたない。この点で、味覚細胞は、腸絨毛の先端で腸管細胞から自然に分化する絨毛性M細胞と類似している[61,62]。同様に、絨毛膜のM細胞と味覚乳頭は、その下にある胚中心とは関連していない [63]。絨毛のM細胞が刺激するT細胞やB細胞の成熟は腸管固有層で起こるかもしれないが、味覚乳頭の固有層で起こるかどうかはわからない[27]。しかし、WTマウスの味覚乳頭には多様な免疫細胞の集団が存在し、SpibKOマウスにはその数がはるかに少ないことから、免疫監視における味覚細胞の役割が強く支持されています(図3A〜3F)。注目すべきは、げっ歯類には存在しないが、ヒトをはじめとするほとんどの哺乳類には、CVPとFOPの近くに舌扁桃が存在することである。扁桃腺にはMALTがあり、味覚細胞に刺激されたT細胞やB細胞が成熟することがある。実際、腸間膜リンパ節は、腸粘膜におけるT細胞およびB細胞の成熟の主要な部位であるようだ [64]。
味覚細胞のM細胞様特性は、他にどのような役割を担っているのだろうか。味覚細胞はIL-10やTNFαなどのサイトカインを分泌し、味覚シグナル伝達に影響を与える [49,50,65]。M細胞はPPにおけるサイトカインの分泌を制御することが知られている[66]。SpibKOマウスでは、抗炎症性サイトカインの発現に変化がない一方で、炎症性サイトカインの発現レベルが低く、味覚乳頭の免疫細胞の数が少ない(図3A-3FおよびS6C)。急性期サイトカイン遺伝子発現を制御するNF-κBシグナル伝達経路の構成要素の発現は、SpibKOマウスのCVPにおいて低く、これはこの表現型の背景にあるかもしれない(S6AおよびS6B Fig)。注目すべきは、味覚乳頭への T 細胞の動員は IL-10 ノックアウトマウスで観察され、このマウスも味蕾が小さく、味蕾あたりの味細胞が少なかったことである [65]。SpibKO マウスの CVP における免疫細胞の動員レベルが低いのは、サイトカイン、特にケモカインのレギュレーションが低下しているためと思われる(図 3A-3F、S6C)。しかし、LPS刺激により、SpibKOマウスは炎症性サイトカイン遺伝子の発現を誇張している(S7図)。これらのデータおよびSpibKOマウスの味覚細胞が管腔内粒子を通過できないことから、CVPでは抗原監視がないため、粘膜免疫応答が損なわれていることが示された。Spibは、M細胞や形質細胞様樹状細胞の発生と再生に必要である[35,36,67]。驚くべきことに、SpibKOマウスでは味覚細胞のサブタイプの割合が変化していないことから、味覚細胞での役割は粘膜免疫に関わる遺伝子の発現制御に限定される可能性が高い(S8図)。味覚シグナル伝達そのものを調節する直接的な役割については、まだ未解決のままである。SpibKOマウスで甘味やうま味刺激に対する行動的な魅力が高いのは、炎症性サイトカインの発現が低下しているか、味覚シグナル伝達経路の下流成分の発現が変化しているからかもしれない(図4)。以上のことから、味覚細胞を介した免疫監視は口腔粘膜免疫の重要な側面であり、この経路の制御異常は微生物感染や味覚消失につながる可能性があることが示唆された。
材料と方法
動物実験
すべての動物実験は、National Institutes of Health guidelines for the care and use of animals in researchに従って行われ、Monell Chemical Senses CenterのInstitutional Animal Care and Use Committeeによる審査と承認を受けた(プロトコル:1163および1151はRFMへ)。動物は、12時間の明暗周期で、餌と水に自由にアクセスできる、特定の病原体を含まないビバリウムに収容された。C57BL/6JバックグラウンドのSpibKOマウスは、Lee Ann Garrett-Sinha (State University of New York, Buffalo, USA) [68]から入手した。Lgr5-EGFP-IRES-CreERT2マウス(ストック#008875)は、Jackson Laboratoryから購入した。Tas1r3-GFP、Gad1-GFP、およびGnat3-GFPトランスジェニックマウスは、以前に記載したとおりである[69-71]。Lgr5-EGFP-IRES-CreERT2 マウスを SpibKO マウスと交配し、味覚オルガノイド作製用の Lgr5-EGFP-IRES-CreERT2:SpibKO および Lgr5-EGFP-IRES-CreERT2:Spib+/+ 動物とした。遺伝子型はJackson LaboratoryとSinha labから推奨されたプライマーセットを用いて確認した。
RANKLの調製と注入
組換えマウスRANKLの発現および精製は、いくつかの修正を加えて以前に記載したように行った[31]。切断されたマウスRANKL転写物(マウスRANKLのアミノ酸137〜316をコードする)をPCR増幅し(フォワードプライマー:CACCCCCGGCAGCGCTTCTCAGGAGCT、リバースプライマー:GAGACTCGAGTCAGTCTA TGTCCTGAAC)、そしてSmaIとXhoI部位間のpGEX-5X-2ベクター(GE Healthcare)へクローニングした。インサートはシークエンスにより確認した後、BL21 Escherichia coli株(Stratagene)に形質転換し、発現させた。発現プラスミドを保有する細菌を選択し、100μg/mlアンピシリンを補充したLuria-Bertani(LB)培地中で培養した。培養物を20μMイソプロピル-D-1-チオガラクトピラノシド(IPTG)で25℃で16時間誘導し、GSTrap FFカラム(カタログ番号71-5016-96 AM, GE Healthcare, Chicago, IL)でのアフィニティークロマトグラフィーと、複数回のリン酸緩衝塩(PBS)(pH 7.4)に対する透析によって細菌溶解物からグルタチオンS転移酵素(GST)タグ付きRANKL(GST-RANKL)を精製した。対照として使用したリコンビナントGSTは、空のpGEX-5X-2を用いて同じ方法で調製した。SDS-PAGEによって示されるように少なくとも95%の純度を有するGSTまたはGST-RANKLを、SpibKOおよびその同腹の対照動物に腹腔内注射によって投与した(250μg/日/マウス、3日間)。マウスは4日目に死亡させ、舌上皮または舌の組織を採取した。
マウスのLPS処理
WTおよびSpibKOマウスの半数に5mg/kgのLPS(PBSに溶解)を単回腹腔内注射し、残りの半数にはコントロールとしてビヒクル(PBS緩衝液)の注射を行った。マウスは、味覚組織の抽出のため、LPS処理後6時間目に死亡させた。
舌上皮の単離。
舌上皮は、記載されているように酵素的に剥離された[37]。マウスをCO2窒息で殺し、舌を摘出した。ディスパーゼII(2mg/ml;Roche, Mannheim, Germany;猫番号04942078001)およびコラゲナーゼA(1mg/ml;Roche cat.no.)からなる酵素混合物(0.5ml)を、Ca. 10103578001)をCa2+フリーのチロ-ド液(145 mM NaCl, 5 mM KCl, 10 mM HEPES, 5 mM NaHCO3, 10 mM pyruvate, 10 mM glucose)中で舌上皮下に注入し、37℃で15分間インキュベートした。舌上皮をその下の筋肉組織から静かに剥がし、蛍光活性化セルソーティング(FACS)またはRNA単離に使用した。
蛍光活性化セルソーティング。
Lgr5-EGFP-IRES-CreERT2;SpibKOおよびLgr5-EGFP-IRES-CreERT2;Spib+/+マウスからのGFP蛍光性Lgr5+味覚細胞は、記載されているようにFACSによって分離された[4,72]。簡単に言うと、3匹のマウスからCVPを含む舌上皮の領域を切除してプールし、小片にミンチし、トリプシン(PBS中0.25%)と37℃で10〜25分間インキュベートし、熱引きしたパスツールピペットを用いて機械的に単細胞に解離させた。細胞懸濁液を70μmセルストレーナー(BD Biosciences, Bedford, MA; cat.No.352350)、次いで35μmセルストレーナー(BD Biosciences cat.No.352235) で濾過した。強化型緑色蛍光タンパク質(EGFP)シグナル(励起、488 nm;発光、530 nm)に基づいて、細胞をオルガノイド培養用の培養液にソーティングした。
味覚オルガノイドの3次元培養。
味覚オルガノイドは、記載されているように培養された[4,72]。簡単に言うと、FACSで選別したGFP蛍光細胞を4%チルドマトリゲル(v/v; BD Biosciences, San Jose, CA; cat.No.354234)と混合し、HEPES(10 mM, Thermo Fisher cat.No.15630080), GlutaMAX(2 mM, Thermo Fisher; cat.No.11320-033) で補った DMEM/F12 (Thermo Fisher, Waltham, MA; cat.No.)で保持した。35050061)、Wnt3a調整培地(50%、v/v)、R-スポンジン調整培地(20%、v/v)、Noggin調整培地(10%、v/v)、N2(1%、v/v;Thermo Fisher;猫番号17502-048)、B2(1%、v/v;Thermo Fisher;猫番号17502-048)を添加した。17502-048)、B27(2%、v/v;Thermo Fisher;猫番号12587-010)、Y27632(10μM;Sigma-Aldrich;猫番号Y0503)、および上皮成長因子(50ng/ml;Thermo Fisher)であった。Wnt3a-及びR-スポンディン条件付け培地は、Wnt3a及びR-スポンディン安定細胞株から、記載されているように作製した[73]。ノギン条件付け培地は自家製であった。培地の交換は、まず 5~7 日目に行い、その後 2~3 日おきに行った。14日間の培養後、組換えマウスRANKLを50ng/mlの濃度で5日間連続的に新鮮な培養液に添加した。様々な時点(0日目から5日目)で、味覚オルガノイドを収穫した。
PCRおよびqPCR。
PureLink mini kit (Thermo Fisher; cat.no.12183018A) を用いて、オンカラムDNA消化(PureLink DNase, Thermo Fisher; cat.no.12185010 を使用)を行い、スーパースクリプトVILO kit (Thermo Fisher; cat.no.11755050) でcDNAに変換し、剥離した舌上皮または味覚器官から解剖した味覚乳頭またはNT上皮のトータルRNAを単離した。PCRおよびqPCRは、先に述べたように行った。すべてのqPCRの結果は、Gapdhを基準としてΔΔCt法を用いて正規化した。使用したプライマーをS4表中に示す。
組織の調製。
マウスを頸部脱臼により殺し、舌の味覚乳頭含有部分を迅速に除去し、氷冷PBSで短時間洗浄した。RNAScopeアッセイのために、組織はTissue-Tek O.C.T.マウントメディア(サクラ)中で100%エタノール・ドライアイスバスで新鮮凍結し、解剖後1時間以内に切片を作成した。免疫組織化学のために,組織は4%パラホルムアルデヒド/1×PBSで4℃,1時間固定し,20%スクロース/1×PBSで4℃,一晩凍結保護してからO.C.Tに包埋した. CM3050S cryostat (Leica Microsystems) を用いて切片(8〜10μm厚)を作成し,プレコートした顕微鏡スライド(Superfrost plus; Fisher Scientific)に貼り付けた.RNAScopeに用いた切片は直ちに-80℃で保存し、免疫組織化学に用いた切片は40℃で20分間乾燥させた後、-80℃で保存した。
RNAScope Hiplexアッセイ。
RNAscopeアッセイは、Hiplex12 fluorescent assay kit for mouse (Catalog # 324443, Advanced Cell Diagnostics, Hayward, CA, USA) を用いて、メーカーの説明書に従って行った。陽性および陰性コントロールプローブは、テストプローブと並行して実行し、実験において適切なハイブリダイゼーションおよびイメージング条件が達成されるようにした。共焦点画像は、Nikon A1R-Ti2 共焦点顕微鏡を使用して撮影した。1スタックあたり6枚の画像を持つZシリーズスタックを、1μmのステップサイズでキャプチャした。画像は 512 × 512 ピクセルのフォーマットでスキャンし、スキャンラインは 2 回平均し、フレームは 3 回スキャンした。撮影パラメータ(すなわち、ゲイン、オフセット、光電子増倍管(PMT)設定)は実験中一定に保った。共焦点数カウントはAdvanced Cell Diagnostics社のQuPathソフトウェアで行った。細胞境界はDAPI染色に基づき自動的に検出された。各細胞の境界の忠実性は、手動検査で確認した。細胞ごとの各チャンネル(個々の mRNA 分子に対応する)の蛍光スポットの数を抽出し、共焦点化のカウントに使用した。2匹のマウスから得られた2つ以上の非連続切片のデータをプールした。
免疫染色。
CVP、FOP、またはFFP乳頭を含む切片の免疫染色は、記載されているように行った[37,74]。簡単に言えば、切片をPBSで洗い、0.3%(v/v)Triton X-100および2%ロバ血清を添加したSuperBlockブロッキング緩衝液(Thermo Fisher;カタログ番号 37515)で室温で30分間ブロッキングした。切片を一次抗体とともに4℃で一晩インキュベートした。1×PBSで3×5分間洗浄した後、種特異的二次抗体を用いて特異的味覚細胞マーカーを可視化した。二次抗体染色後の核の可視化には、脱イオン水中の6-Diamidino-2-phenylindole (DAPI; 1:1,000) を使用した。本研究で使用した一次抗体および二次抗体をS5表に示す。
味覚オルガノイドの免疫染色は、以前に記載したように行った[4,72]。簡単に言うと、培養したオルガノイドを遠心分離によって集め、MgCl2 (5 mM), EGTA (10 mM), ショ糖 (4%, wt/v) を添加した1×PBS中の新鮮な4%パラフォルムアルデヒドで15分間固定した。1×PBS で 3×5 分間洗浄した後、オルガノイドを 0.3% (v/v) Triton X-100 および 2% (v/v) ロバ血清を添加した SuperBlock ブロッキング緩衝液 (Thermo Fisher cat. no. 37515) で 45 分間ブロックし、目的の一次抗体とともに 4℃で一晩インキュベートした。1×PBS で5分間3×洗浄し、種特異的二次抗体(1:500)と共に室温で1時間インキュベートした。脱イオン水中の6-Diamidino-2-phenylindole(DAPI,1:1,000)を用いて、二次抗体の後に核を可視化した。すべての画像は、TCS SP2 スペクトル共焦点顕微鏡(Leica Microsystems)で撮影した。Scanware Software(Leica Microsystems)を用いて、0.5μmのステップサイズで取り込んだz-seriesスタックを取得した。画像は 512 × 512 ピクセルのフォーマットでスキャンし、スキャンラインは 2 回平均し、フレームは 3 回スキャンした。取得パラメータ(すなわち、ゲイン、オフセット、PMT設定)は、抗体を用いた実験と抗体を用いないコントロールで一定に保たれた。デジタル画像はPhotoshop CS (Adobe Systems)を用いて切り抜き、配置した。各マウスのCV乳頭または葉状乳頭全体を示す少なくとも2つの切片の画像を用いて、各味覚細胞マーカーの共焦点を計数した(N = 3)。味細胞は、細胞本体と核の全体像が確認できるもののみカウントした。
味覚細胞による蛍光ビーズの取り込みの評価。
ケタミン(4.28 mg/ml)、キシラジン(0.86 mg/ml)、アセプロマジン(0.14 mg/ml)の混合液を腹腔内注射(10 ml/kg)して麻酔したマウスに蛍光ポリスチレンラテックスナノ粒子(フルオルブライトYG、直径200 nm)(Polysciences, Warrington, PA; cat. 09834-10) を投与した。2時間後、舌を単離し、1×PBS中の4%パラホルムアルデヒドを用いて固定した。次に、厚さ10μmの凍結切片を上記のように得て、T1R3に対して特異的な抗体で染色した。共焦点画像は、上記のように撮影した。CVPを含む舌側上皮からの蛍光ビーズ取り込みの定量的解析は、以前に記載したように行った[31]。ImageJを用いた閾値解析により、CVPを含む口腔からのビーズ取り込みの程度を解析した。蛍光ビーズの画像は8bitグレースケール画像として保存し、2値画像に変換した。255 点中 75 点の閾値を超える信号強度を持つ画素の割合を、CVP が占める領域として算出した。別チャンネルで取得した同一フィールドのDAPI染色核の画像は、カットオフポイント70で閾値を設定した。ビーズ取り込みの程度は、WTマウスのCVPの平均値1.0に正規化した後、蛍光ビーズを有する画素とDAPIを有する画素の比として表した。味蕾(トレンチ領域と固有層を除く味蕾の領域)は、各マウスのCVP全体で2〜3切片からカウントした(N = 5)。
ブリーフアクセス味覚試験
ブリーフアクセス試験は、Davis MS-160 mouse gustometer (Dilog Instruments, Tallahassee, FL)を用いて、記載されているように実施した[72,74,75]。以下の味覚化合物を試験した:スクロース(30、100、300、1,000 mM)、スクラロース(1、3、10、30 mM)、グルタミン酸ナトリウム(MSG;30、100、300、600 mM)、ダナトニウム(0.3、1、3、10 mM)、クエン酸(1、3、10、30 mM)及びNaCl(30、100、300、600 mM)。マウスは、食欲性呈味物質(スクロース、スクラロース、MPG)の試験前に23.5時間の水および食物制限(食物1 gと水1.5 mL)を行った。嫌悪性呈味物質(クエン酸、デナトニウム、NaCl)については、試験前に22.5時間の水および食物制限を行った。各試験では、4種類の異なる濃度の味覚物質と水対照をランダムな順序で提示し、最初に舐めてから5秒後にシャッターを開き、7.5秒のインターバルを置いてから試験を行った。試験時間は20分であった。忌避性呈味物質の試験では、各試験の間にさらに1秒間の水による「ウォッシュアウト期間」が設けられた。SpibKOとその同腹のSpib+/+マウスは同時に並行して試験された。各マウスはすべての化合物で試験された。各セッション終了後、マウスは48時間、餌と水に自由にアクセスできる状態で回復させた。マウスの体重は毎日モニターし、初期値の85%以上のマウスを使用した。味覚刺激と水のリックの比率は、味覚化合物のリック数を並行試験セッションで提示された水のリック数で割って算出した。舐める回数が1回以上であれば、その味覚物質に対する選好行動を、1回未満であれば、その味覚物質に対する回避行動を示す。
統計解析
Prism(GraphPad Software)を、細胞数およびqPCRデータの平均値、標準誤差、対応のないt検定の計算を含む統計解析に使用した。味覚行動試験のデータは、Microsoft Excelを使用して集計した。行動反応の統計解析では、Rのtidyverseパッケージとemmeansパッケージを使用して、遺伝子型と濃度間の差を評価するために、二元配置分散分析およびTukeyの補正によるポストホックペアワイズ多重比較を用いた。統計解析に使用したすべてのデータは、Supporting information tableに記載されている。この解析に使用したコードは、Supporting information file S1 Codeに記載されている。
補足情報
S1 データ。本文中の図およびSupporting informationファイルに報告されている基礎データおよび統計解析の結果。
図とそれに対応するエクセルファイルのシートは以下の通り。S1 Fig = S1_Data, S4 Fig = S2_Data, S5 Fig = S3_Data, S6 Fig = S4_Data, S7 Fig = S5_Data, Fig 3 = S6_Data, S8 Fig = S7_Data, Fig 4 = S8_Data.S1 データは、S1データ、S4データ、S5データ、S4データ、S7データ、S8データとする。図中の各パネルのデータには、対応するパネルラベルを付けている。
doi:10.1371/journal.pbio.3001647.s001
(XLSX)
S1コード。gustometerデータの解析用Rコード。
図4のスクロースのガストメーターデータの解析コードを以下に示す。他の呈味物質のコードも、ファイル名と濃度を対応させた以外は同様である。
doi:10.1371/journal.pbio.3001647.s002
(DOCX)
S1 Fig. 味覚細胞におけるSpibおよび他のM細胞マーカー遺伝子の発現。
(A) CVP、非味覚舌上皮(NT)、パイエル板(PP)のcDNAから調製したGapdh(ハウスキーピングコントロール遺伝子)、Gp2、Ccl9、Marcksl1、Anxa5、Sgne1およびSpibのエンドポイントPCR(35サイクル)。Gp2、Ccl9、Sgne1、SpibはCVPとPPで発現しているが、NTでは発現していない。Marcksl1とAnxa5はすべての組織で発現しているが、NTでは低いレベルである。右の線は分子量マーカーの位置を示す。(B) CVPとNTにおける上記遺伝子の発現をqPCRで解析したところ、すべてのM細胞マーカー遺伝子はCVPでは高発現しているが、NTでは低レベルか全く発現していないことが確認された。各マーカー遺伝子の発現は、そのサイクル閾値とGapdhの閾値との比の対数としてプロットした。各cDNAサンプルからの個々のデータポイントは青い点で示した(基礎となるデータはS1_DataのデータBにある)。(C-D) Spib特異的プローブセットを用いたRNAscopeハイブリダイゼーションは、CVPとFFPの味覚細胞のサブセットで強いシグナルを生じた。(E-G)味覚乳頭とPPからの凍結切片をSPIB抗体で染色した間接免疫蛍光共焦点顕微鏡では、CVP、FOP、PPの味覚細胞の亜集団で強い核染色が見られた。(H-I) SpibKOマウスのCVPとPPにSPIBシグナルがないことから、SPIB抗体の特異性が証明された。(J)一次抗体の省略(W/O)により、CVPにおける二次抗体による非特異的バックグラウンドが低いことを示す。核はパネルC-JでDAPIで対比染色した。スケールバー、50μm。**p < .01, ***p < .001。
doi:10.1371/journal.pbio.3001647.s003
(TIF)
S2 図:M細胞およびII型味覚細胞マーカータンパク質の共発現。
M細胞マーカーGP2およびCCL9に対する抗体を用いたCVP切片の二重標識免疫蛍光共焦点顕微鏡観察、II型味覚細胞マーカーTRPM5(A-CおよびG-I)またはIII型味覚受容体マーカーCAR4(D-FおよびJ-L)のCVPにおける発現を示す。マージした画像では、GP2とCCL9はTRPM5と共発現しているが(B、H)、CAR4とは共発現していない(E、K)。核はDAPIで青く対比染色した。スケールバー:50μm
doi:10.1371/journal.pbio.3001647.s004
(TIF)
S3 図:II型味覚細胞を欠損したPou2f3ノックアウトマウスでは、M細胞マーカー遺伝子が発現していない。
SPIB (A), GP2 (B), CCL9 (C)に対する抗体を用いた免疫蛍光画像では、II型味覚細胞をすべて欠損したPou2f3ノックアウトマウスのCVPには染色がない。核はDAPIで青く対比染色した。スケールバー:50μm
doi:10.1371/journal.pbio.3001647.s005
(TIF)
S4 Fig. RANKLは、CVPのSpibを介してM細胞マーカー遺伝子の発現を刺激する。
(A-H) RANKLで処理したWTマウスまたは未処理のCVP切片を、M細胞マーカーGP2、SPIB、CCL9、MARCKSL1に対する抗体で染色した間接免疫蛍光共焦点顕微鏡写真である。その結果、RANKLの投与により、これらのタンパク質を発現する味覚細胞の割合が劇的に増加することがわかった。(I-K) qPCR解析の結果、WTマウスではRANKL投与後、上記マーカー遺伝子とSpibが有意に上昇したが、SpibKOマウスでは上昇しなかった。ND, not done. (M)RANKL処理は、NT舌上皮のM細胞マーカー遺伝子の発現レベルに影響を与えなかった。データは平均値±SEMである。(グラフの基礎となるデータはS2_DataのData I-Mにある) **p < .01, ***p < .001。核はDAPIで青色にカウンターステインされている。スケールバー、50μm。
doi:10.1371/journal.pbio.3001647.s006
(TIF)
S5 図. RANKL処理により、培養した味覚オルガノイドにおいて、M細胞マーカー遺伝子が定型的な時間順序で発現を誘導される。
(A-L) コントロールマウスとSpibKOマウスの味覚オルガノイドの間接免疫蛍光共焦点顕微鏡による、RANKL処理後0-3日のM細胞マーカーMARCKSL1 (A-D), CCL9 (E-H) およびGP2 (I-L) の発現動態の観察。(M-P) RANKL処理後の培養味覚オルガノイドにおけるM細胞マーカーの発現のqPCR解析。RANKL処理後のGP2、CCL9、MARCKSL1の発現動態は、タンパク質(A-L)、mRNA(M-P)レベルともに明瞭であった。SpibKOマウスは、RANKL投与によりすべてのM細胞マーカー遺伝子(M-P)の発現を上昇させることができなかった。(グラフの基礎となるデータは、S3_DataのData M-Pにある。スケールバー、50μm。
doi:10.1371/journal.pbio.3001647.s007
(TIF)
S6 Fig. SpibKOマウスは免疫応答が低下している。
WTおよびSpibKOマウスにおける炎症性サイトカインおよびNF-κBシグナル伝達経路の構成要素のqPCR解析。(A-B) SpibKOマウスでは、NF-κBシグナル経路に属する転写因子Nfkb1, Nfkb2, Rela, Relb, Irf6、および制御因子タンパク質Tollip, Myd88, Irak3, Irak4の発現が著しく低下していることがわかる。(C)WTマウスと比較して、SpibKOマウスは炎症性サイトカインIl1b、Il6、Tnf、Mcpの発現が低下しているが、抗炎症性サイトカインIl10とIl12の発現は変化していない。(グラフの基礎となるデータはS4_DataのData A-Cにある。*p < .05.
doi:10.1371/journal.pbio.3001647.s008
(TIF)
S7 図 LPS誘発炎症性サイトカイン発現のqPCR解析。
WT マウスと比較して、LPS 投与は SpibKO マウスの CVP においてサイトカインの発現を増大させた。(グラフのデータは S5_Data の Data A-F に掲載されている。*p < 0.05, **p < .01, ***p < .001.
doi:10.1371/journal.pbio.3001647.s009
(TIF)
S8 図. SpibKOマウスでは、味覚細胞の種類の割合は変化していない。
(A-H) WTおよびSpibKOマウスのCV切片の間接免疫蛍光共焦点顕微鏡観察により、T1R3 (A, E), TRPM5 (B, F), GNAT3 (C, G) マーカーを用いてII型細胞を、CAR4 (D, H) に対する抗体を用いてIII型味覚細胞を免疫染色した。核はDAPI(青)でカウンターステインされている。(I) WTマウスと比較して、SpibKOマウスの味覚受容体細胞の割合は変化していない。(J) 対応する遺伝子の発現のqPCR解析により、この観察が確認された(S7_DataのData J)。データは平均値±SEMであり、複製からの個々のデータポイントは黒/青ドットで示されている。スケールバー:50μm。
doi:10.1371/journal.pbio.3001647.s010
(TIF)
S1表。味覚細胞におけるM細胞マーカー遺伝子の発現。
T1r3-GFP(Tas1-10)、Gnat3-GFP(Gnat1-10)、Gad1-GFP(Gad1-12)細胞からの正規化sCRNASeqデータが示される。表示されている統計的比較は、DESeq2を用いてT1r3-GFPとGad1-GFP細胞間で行われた。
doi:10.1371/journal.pbio.3001647.s011
(XLSX)
S2 Table. Spib、Gp2、およびTnfrsf11a mRNAと味覚マーカー遺伝子をコードするmRNAの共発現。
RNAscope Hiplex assayは、Spib, Gp2, Tnfrsf11a, Tas1r3, Gnat3, Trpm5, Car4に対するプローブセットを用いてCVPで行い、単一および二重にラベルした細胞を計数した。分子は、遺伝子1と遺伝子2の両方を発現している味覚細胞の数である。分母は、遺伝子1を発現している味覚細胞の数である。括弧内は、遺伝子1と遺伝子2の両方を発現している味覚細胞の、遺伝子1を発現している味覚細胞に対する比率を示す。ND, not determined.
doi:10.1371/journal.pbio.3001647.s012
(DOCX)
S3表。SPIBと味覚マーカー遺伝子の共発現。
CVPとFOPの味覚細胞をSPIBとT1R3, GNAT3, TRPM5, CAR4に対する第二抗体で二重に染色し、一重および二重に標識した細胞を数えた。分子は、遺伝子1と遺伝子2の両方を発現している味覚細胞の数である。分母は、遺伝子1を発現している味覚細胞の数である。括弧内は、遺伝子1と遺伝子2の両方を発現している味覚細胞の、遺伝子1を発現している味覚細胞に対する比率を示す。ND, not determined.
doi:10.1371/journal.pbio.3001647.s013
(DOCX)
S4 表。RT-PCRおよびqPCR実験に使用したプライマーのヌクレオチド配列。
doi:10.1371/journal.pbio.3001647.s014
(DOCX)
S5 表。免疫蛍光実験に使用した一次抗体と二次抗体。
*RRID, Research Resource Identifier.
doi:10.1371/journal.pbio.3001647.s015
(DOCX)
S1 生画像。S1A Fig.に示したRT-PCRデータの解析に使用したアガロースゲルの全ウェルを示すRaw Image。
doi:10.1371/journal.pbio.3001647.s016
(PDF)
謝辞
参考文献
1.Liman ER, Zhang YV, Montell C. Peripheral coding of taste. Neuron. 2014;81(5):984-1000. doi: 10.1016/j.neuron.2014.02.022. pmid:24607224.
2.Chaudhari N, Roper SD. 味覚の細胞生物学。J Cell Biol. 2010;190(3):285-96. doi: 10.1083/jcb.201003144. pmid:20696704.
3.Finger TE, Barlow LA. 3.Finger TE, Barlow LA. Cellular Diversity and Regeneration in Taste Buds. Curr Opin Physio. 2021;20:146-53. doi: 10.1016/j.cophys.2021.01.003. pmid:33615087.
4.Ren W, Lewandowski BC, Watson J, Aihara E, Iwatsuki K, Bachmanov AA, et al. 単一Lgr5-またはLgr6-発現味覚幹/前駆細胞がex vivoで味蕾細胞を生成する。Proc Natl Acad Sci U S A. 2014;111 (46):16401-6. doi: 10.1073/pnas.1409064111. pmid:25368147.
5.Yee KK, Li Y, Redding KM, Iwatsuki K, Margolskee RF, Jiang PH.(イー・ケーケー、リ・イー、レディング・ケーエム、イワツキ・ケー、マーゴルスキーRF、ジアンPH. Lgr5-EGFPは舌後部の味蕾幹細胞/前駆細胞をマークしている。Stem Cells. 2013;31(5):992-1000. doi: 10.1002/stem.1338. pmid:23377989
6.Perea-Martinez I, Nagai T, Chaudhari N. 味蕾の機能的な細胞タイプは、それぞれ異なる寿命を持つ。PLoS ONE. 2013;8 (1):e53399. doi: 10.1371/journal.pone.0053399. pmid:23320081
7.濱道亮、浅野三芳、江森義明. 味蕾には短命な細胞集団と長命な細胞集団が存在する。Neuroscience. 2006;141(4):2129-38. doi: 10.1016/j.neuroscience.2006.05.061. pmid:16843606.
8.Sampaio-Maia B, Caldas IM, Pereira ML, Perez-Mongiovi D, Araujo R. The Oral Microbiome in Health and Its Implication in Oral and Systemic Diseases. Adv Appl Microbiol. 2016;97:171-210. doi: 10.1016/bs.aambs.2016.08.002. pmid:27926431.
9.Wilbert SA, Mark Welch JL, Borisy GG. ヒト舌背部マイクロバイオームの空間生態学。Cell Rep. 2020;30(12):4003-15 e3.
10.Deo PN, Deshmukh R. Oral microbiome: 基本的なことを解明する。J Oral Maxillofac Pathol. 2019;23(1):122-8. doi: 10.4103/jomfp.JOMFP_304_18. pmid:31110428.
11.Nicole B. Arweiler LN. 口腔内の微生物叢。人体の微生物叢. 実験医学と生物学の進歩。スイス: Springer; 2016. p. 45-60.
12.Feng P, Yee KK, Rawson NE, Feldman LM, Feldman RS, Breslin PA. ヒト末梢味覚系の免疫細胞:優性樹状細胞およびCD4 T細胞。Brain Behav Immun. 2009;23(6):760-6. doi: 10.1016/j.bbi.2009.02.016. pmid:19268521
13.Feng P, Wang H, Feldman RS, Pribitkin EA, Breslin PA. 健康なヒト成人の末梢味覚組織における T 細胞:優勢なメモリー T 細胞と Th-1 細胞。Chem Senses. 2010;35(6):501-9. doi: 10.1093/chemse/bjq040. pmid:20457570
14.Baker K BR, Kaetzel CS. 免疫グロブリンの輸送と免疫グロブリンレセプター。Mestecky J SW, Russell MW, et al, editor. Cambridge, MA: Elsevier; 2015.
15.ヘンキンRI、ラーソンAL、パウエルRD. インフルエンザ様感染症に伴う低毛症、味覚障害、低体温症、味覚異常。Ann Otol Rhinol Laryngol. 1975;84(5 Pt 1):672-82. doi: 10.1177/000348947508400519. pmid:1190677
16.Bensadoun RJ, Patton LL, Lalla RV, Epstein JB. 放射線治療を受けた頭頸部がん患者における口腔咽頭カンジダ症:アップデート2011年。サポートケアキャンサー。2011;19(6):737-44. doi: 10.1007/s00520-011-1154-4. pmid:21479787
17.Parma V, Ohla K, Veldhuizen MG, Niv MY, Kelly CE, Bakke AJ, et al. More Than Smell-COVID-19 Is Associated With Severe Impairment of Smell, Taste, and Chemesthesis.化学物質合成の重篤な障害に関連する。Chem Senses. 2020;45 (7):609-22. doi: 10.1093/chemse/bjaa041. pmid:32564071.
18.グラハムCS、グラハムBG、バートレットJA、ヒールドAE、シフマンSS. HIV感染者における味覚・嗅覚の喪失。Physiol Behav. 1995;58(2):287-93. doi: 10.1016/0031-9384(95)00049-o. pmid:7568432
19.Kusnik A, Weiss C, Neubauer M, Huber B, Gerigk M, Miethke T, et al. COVID-19パンデミック時の味覚・嗅覚機能不全の存在について。BMC Infect Dis. 2021;21 (1):612. doi: 10.1186/s12879-021-06294-2. pmid:34174816.
20.Cohn ZJ, Kim A, Huang L, Brand J, Wang H. Lipopolysaccharide-induced inflammation attenuates taste progenitor cell proliferation and shortens the life span of taste bud cells.リポ多糖による炎症は、味覚前駆細胞の増殖を抑制し、味蕾細胞の寿命を縮める。BMC Neurosci. 2010;11:72. doi: 10.1186/1471-2202-11-72. pmid:20537148.
21.Doyle ME, Appleton A, Liu QR, Yao Q, Mazucanti CH, Egan JM.(ドイルME、アップルトンA、リウQR、ヤオQ、マズカンティCH、イーガンJM)。ヒトII型味覚細胞はアンジオテンシン変換酵素2を発現し、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)により感染する。Am J Pathol. 2021;191(9):1511-9. doi: 10.1016/j.ajpath.2021.05.010. pmid:34102107.
22.Dillon A, Lo DD. M Cells: 粘膜免疫監視のインテリジェントエンジニアリング。Front Immunol. 2019;10:1499. doi: 10.3389/fimmu.2019.01499.pmid:31312204をご参照ください。
23.Mabbott NA, Donaldson DS, Ohno H, Williams IR, Mahajan A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium.腸管上皮における免疫監視の重要な役割。Mucosal Immunol. 2013;6(4):666-77. doi: 10.1038/mi.2013.30. pmid:23695511
24.Brandtzaeg P, Kiyono H, Pabst R, Russell MW. 用語集:粘膜関連リンパ組織の命名法。Mucosal Immunol. 2008;1(1):31-7. doi: 10.1038/mi.2007.9. pmid:19079158.
25.Neutra MR, Pringault E, Kraehenbuhl JP. 上皮障壁を越えた抗原のサンプリングと粘膜免疫反応の誘導。Annu Rev Immunol. 1996;14:275-300. doi: 10.1146/annurev.immunol.14.1.275. pmid:8717516
26.大野英男:腸管M細胞.J Biochem. 2016;159 (2):151-60. doi: 10.1093/jb/mvv121. pmid:26634447
27.Wang J, Gusti V, Saraswati A, Lo DD. マウス粘膜上皮におけるM細胞系譜の収束と発散。J Immunol. 2011;187(10):5277-85. doi: 10.4049/jimmunol.1102077. pmid:21984701
28.Hase K, Kawano K, Nochi T, Pontes GS, Fukuda S, Ebisawa M, et al. FimH(+)細菌の糖タンパク質2によるM細胞への取り込みが粘膜免疫反応を開始させる. Nature. 2009;462 (7270):226-30. doi: 10.1038/nature08529. pmid:19907495
29.Iwasaki A, Welker R, Mueller S, Linehan M, Nomoto A, Wimmer E. Immunofluorescence analysis of poliovirus receptor expression in Peyer's patches of humans, primates, and CD155 transgenic mice: implications for poliovirus infection.(ヒトのパイエル板におけるポリオウイルス受容体の免疫蛍光分析およびCD155遺伝子改変マウスの発現:ポリオウイルス感染に関する意義)。J Infect Dis. 2002;186(5):585-92. doi: 10.1086/342682. pmid:12195344
30.Nakato G, Fukuda S, Hase K, Goitsuka R, Cooper MD, Ohno H. 包括的トランスクリプトーム解析によるm細胞特異的分子スクリーニングの新しいアプローチ. DNA Res. 2009;16 (4):227-35. doi: 10.1093/dnares/dsp013. pmid:19675110
31.Knoop KA, Kumar N, Butler BR, Sakthivel SK, Taylor RT, Nochi T, et al. RANKLは腸管上皮における抗原サンプリングM細胞の発生を開始するのに必要かつ十分である。J Immunol. 2009;183(9):5738-47. doi: 10.4049/jimmunol.0901563. pmid:19828638
32.Kanaya T, Sakakibara S, Jinnohara T, Hachisuka M, Tachibana N, Hidano S, et al. 腸管M細胞および濾胞関連上皮の発達はTRAF6を介したNF-kappaBシグナルにより制御される。J Exp Med. 2018;215(2):501-19.
33.Taylor RT, Patel SR, Lin E, Butler BR, Lake JG, Newberry RD, et al. Lymphotoxin-independent expression of TNF-related activation-induced cytokine by stromal cells in cryptopatch, isolated lymphoid follicle, and Peyer's patches.リンパドキシンは、リンパ球の活性化を誘発する。J Immunol. 2007;178(9):5659-67. doi: 10.4049/jimmunol.178.9.5659. pmid:17442949.
34.金谷哲也、大野英男:M細胞分化のメカニズム. Biosci Microbiota Food Health. 2014;33(3):91-7. doi: 10.12938/bmfh.33.91. pmid:25032083.
35.Kanaya T, Hase K, Takahashi D, Fukuda S, Hoshino K, Sasaki I, et al. Ets転写因子Spi-Bは腸管小胞の分化に必須である.Ets転写因子Spi-Bは腸管小胞の分化に不可欠である. Nat Immunol. 2012;13(8):729-36. doi: 10.1038/ni.2352. pmid:22706340
36.de Lau W, Kujala P, Schneeberger K, Middendorp S, Li VS, Barker N, et al. Lgr5(+) 幹細胞由来のパイエル板M細胞はSpiBを必要とし、培養「ミニガット」においてRankLによって誘導される. 2012;32(18):3639-47. doi: 10.1128/MCB.00434-12. pmid:22778137
37.Sukumaran SK, Lewandowski BC, Qin Y, Kotha R, Bachmanov AA, Margolskee RF. 味蕾細胞の全トランスクリプトームプロファイリング。サイ・レップ. 2017;7(1):7595. doi: 10.1038/s41598-017-07746-z. pmid:28790351
38.Matsumoto I, Ohmoto M, Narukawa M, Yoshihara Y, Abe K. Skn-1a (Pou2f3) specifies taste receptor cell lineage.Skn-1aは味覚受容体の細胞系譜を規定する。Nat Neurosci. 2011;14(6):685-7. doi: 10.1038/nn.2820. pmid:21572433
39.Mitchell S, Vargas J, Hoffmann A. Signaling via the NFkappaB system(NFkappaBシステムを介したシグナル伝達). Wiley Interdiscip Rev Syst Biol Med. 2016;8(3):227-41.
40.Clevers HC, Bevins CL. パネス細胞:小腸陰窩のマエストロ。Annu Rev Physiol. 2013;75:289-311. doi: 10.1146/annurev-physiol-030212-183744. pmid:23398152.
41.Lei J, Sun L, Huang S, Zhu C, Li P, He J, et al.抗菌ペプチドとその臨床応用の可能性。Am J Transl Res. 2019;11(7):3919-31. pmid:31396309.
42.Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. Innate Lymphoid Cells: 10 Years On.(イネイト・リンポイド・セル:10年後)。Cell. 2018;174(5):1054-66. doi: 10.1016/j.cell.2018.07.017. pmid:30142344
43.Nair PN, Zimmerli I, Schroeder HE. サルの小唾液腺管関連リンパ組織(DALT)の年齢による変化。J Dent Res. 1987;66(2):407-11. doi: 10.1177/00220345870660020401. pmid:3476564
44.Oya Y, Kimura S, Nakamura Y, Ishihara N, Takano S, Morita R, et al. マウス涙道関連リンパ組織におけるM細胞の特性:眼表面における免疫監視の役割の可能性. Front Immunol. 2021;12:779709. doi: 10.3389/fimmu.2021.779709. pmid:34880872.
45.Radaic A, Kapila YL. オーラルホームとそのディスバイオーシス。口腔内の微生物と宿主の相互作用に関する新たな知見。Comput Struct Biotechnol J. 2021;19:1335-60. doi: 10.1016/j.csbj.2021.02.010. pmid:33777334.
46.Wang H, Zhou M, Brand J, Huang L. Inflammation and taste disorders: mechanisms in taste buds. Ann N Y Acad Sci. 2009;1170:596-603. doi: 10.1111/j.1749-6632.2009.04480.x. pmid:19686199
47.Wang H, Zhou M, Brand J, Huang L. Inflammation activates the interferon signaling pathways in taste bud cells. J Neurosci. 2007;27(40):10703-13. doi: 10.1523/JNEUROSCI.3102-07.2007. pmid:17913904
48.Camandola S, Mattson MP. Toll様受容体4は、脂肪、砂糖、うま味の嗜好と食物摂取および体重調節を媒介する。肥満(シルバースプリング)。2017;25(7):1237-45. doi: 10.1002/oby.21871. pmid:28500692.
49.Feng P, Jyotaki M, Kim A, Chai J, Simon N, Zhou M, et al. Regulation of bitter taste responses by tumor necrosis factor.(腫瘍壊死因子による苦味反応の調節)。Brain Behav Immun. 2015;49:32-42. doi: 10.1016/j.bbi.2015.04.001. pmid:25911043.
50.Feng P, Zhao H, Chai J, Huang L, Wang H. Expression and secretion of TNF-alpha in mouse taste buds: a novel function of a specific subset of type II taste cells.マウスの味蕾におけるTNF-αの発現と分泌:味覚細胞の特定のサブセットの新規機能。PLoS ONE. 2012;7(8):e43140.
51.ウェルカムMO. 泌尿器科感染症の苦味。泌尿器科の苦味受容体の特性、リガンド、味覚と泌尿器科の炎症プロセスを関連付けるメカニズム。Eur J Obstet Gynecol Reprod Biol. 2020;247:101-10. doi: 10.1016/j.ejogrb.2020.02.015. pmid:32088528.
52.Lee RJ, Kofonow JM, Rosen PL, Siebert AP, Chen B, Doghramji L, et al. Bitter and sweet taste receptors regulate human upper respiratory innate immunity.苦味と甘味の味覚受容体は、ヒトの上気道自然免疫を制御している。J Clin Invest. 2014;124 (3):1393-405. doi: 10.1172/JCI72094. pmid:24531552.
53.Barker N, van Es JH, Kuipers J, Kujala P, van den Born M, Cozijnsen M, et al. マーカー遺伝子Lgr5による小腸および大腸の幹細胞の同定。Nature. 2007;449(7165):1003-7. doi: 10.1038/nature06196. pmid:17934449
54.Rothova M, Thompson H, Lickert H, Tucker AS. 口腔発生における内胚葉の系譜追跡。Dev Dyn. 2012;241(7):1183-91. doi: 10.1002/dvdy.23804. pmid:22581563
55.Kokrashvili Z, Mosinger B, Margolskee RF. 腸のT1r3とα-gustducinは、グルカゴン様ペプチド-1の分泌を調節する。Ann N Y Acad Sci. 2009;1170:91-4. doi: 10.1111/j.1749-6632.2009.04485.x. pmid:19686115
56.Margolskee RF, Dyer J, Kokrashvili Z, Salmon KS, Ilegems E, Daly K, et al. 腸内のT1R3およびgustducinは糖を感知してNa+-グルコース共輸送体1の発現を制御している. 2007;104(38):15075-80. doi: 10.1073/pnas.0706678104. pmid:17724332
57.Kok BP, Galmozzi A, Littlejohn NK, Albert V, Godio C, Kim W, et al. 腸の苦味受容体の活性化はホルモン分泌を変化させ、代謝上の利益を与える。Mol Metab. 2018;16:76-87. doi: 10.1016/j.molmet.2018.07.013. pmid:30120064
58.Jang HJ, Kokrashvili Z, Theodorakis MJ, Carlson OD, Kim BJ, Zhou J, et al. Gut-expressed gustducin and taste receptors regulate secretion of glucagon-like peptide - 1.腸に発現するガストゥシンと味覚受容体は、グルカゴン様ペプチド-1の分泌を調節する。2007;104 (38):15069-74. doi: 10.1073/pnas.0706890104. pmid:17724330
59.Howitt MR, Lavoie S, Michaud M, Blum AM, Tran SV, Weinstock JV, et al. Tuft cell, taste-chemosory cells, orchestrate parasite type 2 immunity in the gut.(味覚化学感覚細胞であるタフト細胞は、腸管における寄生虫2型免疫を制御している。Science. 2016;351(6279):1329-33. doi: 10.1126/science.aaf1648. pmid:26847546.
60.Wang H, Matsumoto I, Jiang P. Immune Regulatory Roles of Cells Expressing Taste Signaling Elements in Nongustatory Tissues.(味覚シグナル伝達要素を発現する細胞の非味覚組織における免疫制御的役割). Handb Exp Pharmacol. 2021.
寺原一彦、吉田稔、五十嵐雄、野地俊哉、Pontes GS、長谷和彦、他 パイエル板M細胞、絨毛M様細胞、腸管上皮細胞の包括的遺伝子発現プロファイリング.J Immunol. J Immunol. 2008;180(12):7840-6. doi: 10.4049/jimmunol.180.12.7840. pmid:18523247.
62.佐藤聡、金藤誠一、柴田直樹、高橋陽一、大倉秀樹、結城洋一、他:パイエル板M細胞の発生に関わる転写因子Spi-B依存性および非依存性経路. Mucosal Immunol. 2013;6(4):838-46. doi: 10.1038/mi.2012.122. pmid:23212199
63.Jang MH, Kweon MN, Iwatani K, Yamamoto M, Terahara K, Sasakawa C, et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. 2004;101(16):6110-5. doi: 10.1073/pnas.0400969101. pmid:15071180
64.Spahn TW, Weiner HL, Rennert PD, Lugering N, Fontana A, Domschke W, et al. Mesenteric lymph nodes are critical for the induction of high-dose oral tolerance in the absence of Peyer's patches.(パイエル板がない場合、高用量経口耐性の誘導には腸間膜リンパ節が重要である。Eur J Immunol. 2002;32(4):1109–13. doi: 10.1002/1521-4141(200204)32:4<1109::AID-IMMU1109>3.0.CO;2-K. pmid:11920578
65.Feng P, Chai J, Zhou M, Simon N, Huang L, Wang H. Interleukin-10 is produced by a specific subset of taste receptor cells and critical for maintaining structural integrity of mouse taste buds. J Neurosci. 2014;34(7):2689-701. doi: 10.1523/JNEUROSCI.3074-13.2014. pmid:24523558.
66.Mikulic J, Longet S, Favre L, Benyacoub J, Corthesy B. Secretory IgA in complex with Lactobacillus rhamnosus potentiates mucosal dendritic cell-mediated Treg cell differentiation via TLR regulatory proteins, RALDH2 and secretion of IL-10 and TGF-β.分泌型IgAと乳酸菌の複合体は、粘膜樹状細胞を介したTreg細胞の分化を促進する. Cell Mol Immunol. 2017;14 (6):546-56.
67.Schotte R, Nagasawa M, Weijer K, Spits H, Blom B. The ETS transcription factor Spi-B is required for human plasmacytoid dendritic cell development. J Exp Med. 2004;200(11):1503-9. doi: 10.1084/jem.20041231. pmid:15583020
68.Su GH, Chen HM, Muthusamy N, Garrett-Sinha LA, Baunoch D, Tenen DG, et al. Etsタンパク質欠損マウスにおけるB細胞受容体を介した応答の欠損。Spi-B EMBO J. 1997;16(23):7118-29.
69.Damak S, Mosinger B, Margolskee RF. トランスジェニックマウスのII型味覚細胞のサブセットで発現する小麦胚芽アグルチニンのシナプス移行性。BMC Neurosci. 2008;9:96. doi: 10.1186/1471-2202-9-96. pmid:18831764
70.Chattopadhyaya B, Di Cristo G, Higashiyama H, Knott GW, Kuhlman SJ, Welker E, et al. 生後臨界期における一次視覚野の体周囲GABA神経支配の経験および活動依存的な成熟度。J Neurosci. 2004;24(43):9598-611. doi: 10.1523/JNEUROSCI.1851-04.2004. pmid:15509747
71.Clapp TR, Medler KF, Damak S, Margolskee RF, Kinnamon SC. Gタンパク質共役型味覚受容体を持つマウス味覚細胞は、電位依存性カルシウムチャネルとSNAP-25を欠いている。BMC Biol. 2006;4:7. doi: 10.1186/1741-7007-4-7. pmid:16573824
72.Qin Y, Sukumaran SK, Jyotaki M, Redding K, Jiang P, Margolskee RF. Gli3はTas1r3発現味覚細胞のネガティブレギュレーターである。PLoS Genet. 2018;14(2):e1007058. doi: 10.1371/journal.pgen.1007058. pmid:29415007.
73.Broutier L, Andersson-Rolf A, Hindley CJ, Boj SF, Clevers H, Koo BK, et al. 自己複製ヒトおよびマウス成体肝臓および膵臓3Dオルガノイドの培養および樹立とその遺伝子操作. Nat Protoc. 2016;11(9):1724-43. doi: 10.1038/nprot.2016.097. pmid:27560176.
74.Sukumaran SK, Yee KK, Iwata S, Kotha R, Quezada-Calvillo R, Nichols BL, et al. 味覚細胞発現α-グルコシダーゼ酵素は二糖類に対する味覚反応に寄与している。Proc Natl Acad Sci U S A. 2016;113(21):6035-40.
75.Poole RL, Aleman TR, Ellis HT, Tordoff MG. 8種類のマウス系統におけるマルトデキストリンの受容と嗜好性。Chem Senses. 2016;41(1):45-52. doi: 10.1093/chemse/bjv056. pmid:26464499.
" 記事へ戻る
図1.
味覚細胞のM細胞マーカー遺伝子発現のRNAScope解析。
RNAscope Hiplex蛍光アッセイを用いて、Spib (A-D), Gp2 (E-H), Tnfrsf11a (I-L) とCVPの味細胞マーカーTas1r3, Gnat3, Trpm5, Ddcの共発現を測定した。SpibはTas1r3、Trpm5と強い共発現が見られ、Gnat3、Ddcとはあまり強くない共発現が見られた。Gp2はII型味覚細胞と相関が高い傾向があり、Tnfrsf11aの発現はすべての味覚細胞タイプに均等に分布している。スケールバー=10μm。
詳細 "
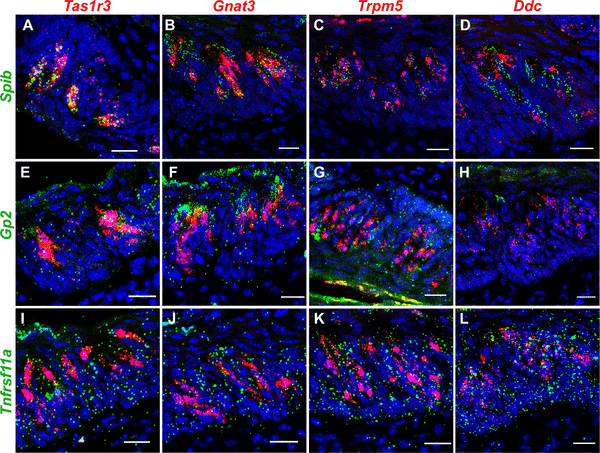
図1拡大
図2.
SPIBはT1R3と共発現している。
CVPおよびFOP切片に、SPIBとII型味覚細胞マーカーTRPM5 (A, F), T1R3 (B, G), GNAT3 (C, H), III型味覚受容体マーカーCAR4に対する抗体を二重標識した免疫蛍光共焦点顕微鏡観察 (D, I)、I型味覚細胞マーカーENTPD2(E、J)は、SPIBとT1R3との共発現が多く、TRPM5とGNAT3との共発現は少なく、CAR4とENTPD2とはごくわずかの共発現であることを示す。核はDAPIで青く対比染色した。スケールバー、50μm。
詳細 "
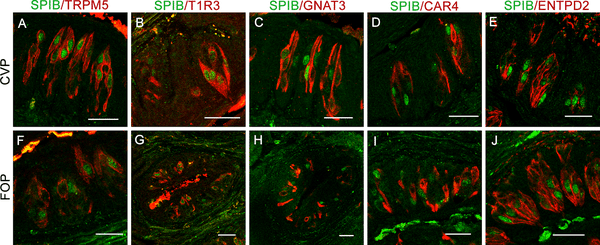
図2拡大
図3.
Spibノックアウトマウスは免疫応答が損なわれている。
(A-F) WTマウスとSpibKOマウスのCVP切片を、マウス免疫細胞マーカーCD45 (A, D), CD11B (B, E), CD3 (C, F) に対する抗体で染色した間接免疫蛍光共焦点顕微鏡写真。WTマウスと比較して、SpibKOマウスはCVPの免疫細胞が少なかった。(G-H) WT マウス (G) と SpibKO マウス (H) の CVP から味覚細胞への直径 200 nm の蛍光ビーズの取り込みを共焦点顕微鏡で観察した。味覚細胞は、パネルA-Hで汎味覚細胞マーカーKCNQ1による染色で可視化されている。(I)ビーズの取り込みを画像解析により定量化し、WTマウスの平均取り込みが1.0となるように正規化した(グラフの下にあるデータは、WTマウスの平均取り込みが1.0となるように正規化した。(グラフの基礎となるデータはS6_DataのData Iにある)WTマウスと比較して、SpibKOマウスはより少ないビーズを取り込んでいた。***p < .001. スケールバー、50μm。
より詳細 "
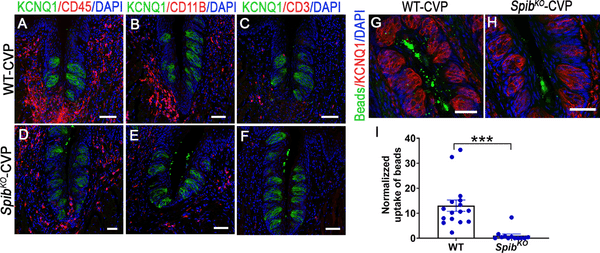
図3拡大
図4.
SpibKOマウスは甘味とうま味の呈味物質に対する行動的引きつけが増加する。
甘味(スクロースとスクラロース、AおよびB)、うま味(グルタミン酸一カリウム[MPG]、C)、苦味(デナトニウム、D)、塩味(NaCl、E)および酸味(クエン酸、F)味覚刺激に対する行動反応を測定するために、短時間アクセス試験が使用された。(同腹のWTマウスと比較して、SpibKOマウスは甘味とうま味(ショ糖とMPG)に対するリック反応が増加したが、他の味覚刺激に対する反応は変化しなかった。リック比は、各テストセッションにおける味覚溶液へのリック回数を水へのリック回数で割って算出した。データは二元配置分散分析およびポストホックt検定で解析した平均値±SEMである。N = 12 (WTマウス) と14 (SpibKOマウス)。*p < .05、**p < .01。
詳細 "
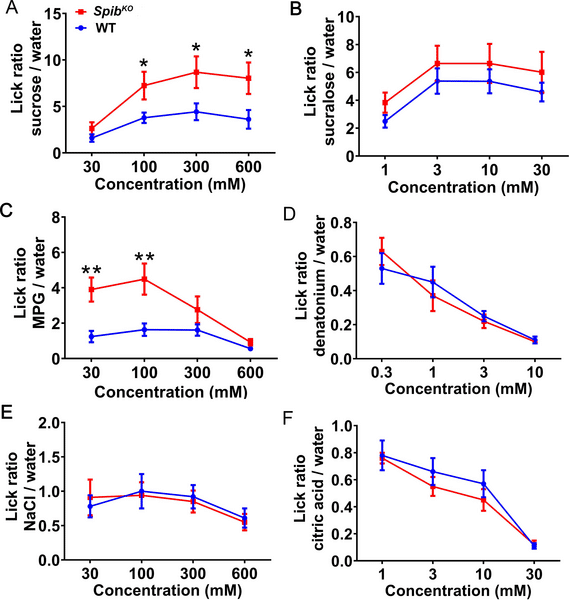
図4拡大
この記事が気に入ったらサポートをしてみませんか?
