ヒト腸内細菌の組成と多様性の形成におけるバクテリオファージの役割
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
409
総閲覧数
13
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
Front. 微生物学, 19 9月 2023
微生物共生
第14巻-2023年|https://doi.org/10.3389/fmicb.2023.1232413
ヒト腸内細菌の組成と多様性の形成におけるバクテリオファージの役割
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1232413/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit




サミア・S・アルカリル
サウジアラビア、リヤド、シャクラ大学応用医学部臨床検査学科
腸内細菌叢は宿主であるヒトとともに進化を続け、栄養素の生産、薬物代謝、免疫系の調節、消化管(GIT)への病原体の侵入に対する拮抗作用など、健康に多大な恩恵をもたらしている。消化管は多様な微生物群の棲息地であり、それらはすべて共存し、互いに、またヒトの免疫系と相互作用していると言われている。ファージは細菌に寄生し、溶菌あるいは溶原性サイクルを介して複製するために宿主の代謝系を必要とする。ファージと細菌の集団は、腸内生態系において最も支配的であると考えられている。そのため、様々な微生物間相互作用の中でも、ファージと細菌の相互作用は、複雑ではあるが、細菌集団による防御と並行して、捕食、溶菌転換、ファージ誘導などの様々なメカニズムを用いて、時間とともに共進化することが実証されている。ファージと細菌の相互作用のモデルとダイナミクスの助けを借りて、腸内生態系におけるファージの生存の背後にある複雑さが解明され、腸内恒常性の維持とヒトの全体的な健康増進におけるファージの役割が解明された。さまざまな消化管感染症の治療において、多剤耐性の原因菌に対する効果が実証されているが、ファージが進化する可能性があるため、研究者の間ではこの手法に対する懸念が依然として根強い。治療目的でのファージの使用に関する知識は乏しいため、細菌とファージの相互作用や、ヒトの腸における免疫学的反応との関連について理解を深めるためには、実験モデルや臨床試験を含むより多くの研究が必要である。
はじめに
ヒトの消化管(GIT)は、口腔から肛門に至る複雑な環境である。GITには数十億の微生物が存在し(Sutton and Hill, 2019; Cao et al., 2022)、腸内細菌叢または腸内細菌叢と総称される様々な微生物群集を構成している(Zuo and Ng, 2018; Sanders et al., 2021)。GITの微生物群集は、それぞれの遺伝子/ゲノムとともに、様々な構成要素(すなわち、直腸、大腸、小腸)および糞便中で異なる(Cao et al.) 最も特徴づけられ、研究されている腸内細菌叢は細菌種であり、その遺伝子の多くが配列決定されている(Cao et al.) 腸内細菌叢は長い時間をかけてヒトの宿主とともに進化してきたもので、宿主に大きな健康上の利益をもたらしていると考えられている(Sandersら、2021)。栄養素(短鎖脂肪酸やビタミンなど)の生産、薬物の代謝、免疫系の調節、GITへの病原体侵入に対する拮抗的役割の発現などは、ほんの一例に過ぎない(Shkoporovら、2019;Jansen and Matthijnssens、2023)。SuttonとHill(2019)とKirschら(2021)は、腸が様々な微生物の生息地として機能していることを報告している。しかし、pH、胆汁酸塩、栄養素と水の利用可能性、酸素含有量の変動はすべて、腸内細菌叢の量と相対的な多様性に影響を及ぼす。さらに、バクテリオファージ(一般にファージウイルスまたはファージと呼ばれる)は、ヒトの腸内の細菌量と分布に大きく影響する(Sutton and Hill, 2019)。
出生直後の乳児の腸には微生物がいないと言われている(Dahlmanら、2021)。しかし、分娩後数時間で、様々な種の微生物による腸の急速なコロニー化が報告されている。したがって、腸は微生物多様性の生息地となる(Dahlmanら、2021;Federiciら、2021;Łobockaら、2021;Gummallaら、2023)。これらの変動は、解剖学的、栄養学的、薬理学的(プロバイオティクス、下剤、プロキネティクス、抗生物質の利用など)、病理学的(全身性感染症や消化管感染症など)、環境的(職場の状況、ライフスタイル、家族構成、気候など)要因の影響を受けている(Scarpellini et al.、2015)。ファージは、産後数日の乳児の便サンプルから分離されているように、出生後の乳児の腸内にコロニーを形成する初期の微生物多様性のひとつである(Dahlman et al.、2021)。ファージの腸内組成は、ヒトの初期成長段階ではウイルス種の入れ替わりがあり、非常にダイナミックであると言われている。これは、各個人のライフスタイルの違いにより、ファージが段階的にヒトの腸内に定着した結果であると考えられている。温帯ファージは、細菌種のバイオマスが低く、ファージの宿主となりうる細菌種が乏しい状況下で主に高発現する(Dahlmanら、2021年)。時間が経つにつれて、腸の様々な構成要素全体に細菌種が拡大し、病原性ファージのコロニー形成が促進される。これに伴い、乳幼児期以降に観察されるcrAss-likeやMicroviridaeなどの強毒ファージファミリーの存在量が増加する(Dahlman et al.) 乳児の腸とは対照的に、成人のビロームはかなり安定している。成人のビロームの安定性は、主にMicroviridaeとcrAss-likeファミリーのファージから構成される、非常に持続的で豊富なファージ群に起因している。前述のファージファミリーは一般に、ヒトの宿主間で高い毒性と特異性を持つと考えられており、個体間で共有されているものはあったとしてもごくわずかである(Dahlman et al.)
ヒトの健康における腸内ファージの重要性と役割は、いくら強調してもしすぎることはない。腸内細菌叢の組成と存在量は、ファージによって制御することができる。さらにファージは、単に細菌病原体を排除するだけでなく、細胞内の炎症性サイトカインと直接相互作用し、活性酸素種(ROS)の過剰産生を抑えることによって、免疫系の抗炎症作用を調節する(Łusiak-Szelachowska et al.) そうすることで、酸化ストレスが抑制される。さらに、ファージと腸に関連するリンパ組織との相互作用により、プロバイオティクスの摂取によって人体にもたらされる健康上の利益と同様の免疫調節保護効果がもたらされる(Łusiak-Szelachowska et al.) ヒトの腸内細菌叢が果たす多くの健康効果と役割のために、腸内細菌叢の相互作用と関係の研究が不可欠となっている。特に、ヒトの腸内における細菌とファージの共存、およびそれらの相互作用がヒトの健康全般に及ぼす直接的・間接的な影響は、まずヒトの腸内におけるバクテリオファージの生活様式と存在量を理解することで理解できる。
1.1. ファージ
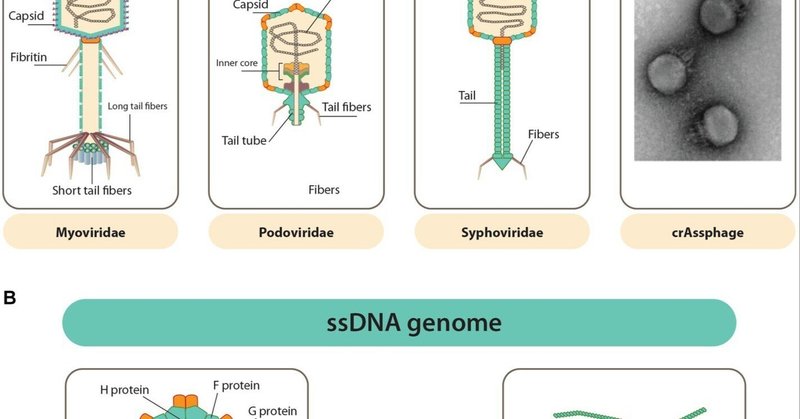
ファージは寄生性であるため、繁殖には宿主(細菌)が必要である(Hannigan et al.) ファージは最も多様で豊富な存在として同定されている。構造的には、ほとんどのファージはカプシド(タンパク質の殻)の中に詰められた核酸のゲノムで構成されている。ファージのカプシドは、形態(すなわち、多形、糸状、多面体)と大きさの点で非常に多様である(図1A,B; Zuppi et al.) タンパク質のキャプシド以外に、いくつかのファージの外層は脂質膜で構成されている(Zuppi et al.) ファージは、保有する核酸の種類、カプシドの形態、尾部の有無、エンベロープの有無に基づいて分類される(Saussetら、2020;Caoら、2022;Zuppiら、2022)。ファージの遺伝物質は、一本鎖(ss)または二本鎖(ds)のRNAまたはDNAで構成されており、ゲノムの大きさは約3.5 kb(大腸菌ファージMS2のssRNAゲノムなど)から約540 kb(プレボテラのLAKファージのようにdsDNAで構成されている)まで様々である(Sausset et al.)
図1
www.frontiersin.org
図1. GITに生息することが知られているファージの多様なキャプシドとゲノム。(A) Caudovirales目のdsDNAファージは、多面体で尾部に付着したキャプシドを持つ(この目に共通する特徴)。右端はcrAssphage(FerAss001)の酢酸ウラニル造影TEM像。(B)正20面体または糸状のキャプシドを持つssDNAファージ(この目ではマイクロウイルス科とイノウイルス科)(Zuppi et al., 2022)。
ファージには非常に多くのバリエーションがあるが、95%はCaudovirales(尾状、非エンベロープ型dsDNAファージ)である。図1A(Zuppi et al., 2022)に示されているように、Caudoviralesはさらに伝統的にPodoviridae、Myoviridae、Siphoviridaeの3科に分類されている。この分類は尾のタイプに基づいていたが、ウイルス系統学との整合性が十分でないため、放棄された。さらに、常に新しいタイプのファージが発見されているため、分類の再編成が進んでおり、分類が非常に困難になっている(Sausset et al.) 他のほとんどのファージは、DNAが封入されていないDNAウイルスとして現れ、ssDNAのミクロウイルス科またはdsDNAのウドウイルス科のいずれかである(Zuppi et al.) イノウイルス科または糸状ssDNAファージは、細菌宿主を死滅させることなく慢性的に感染して繁殖し(図1B)、ヒトの腸内ウイルス群の大部分を占めると言われている。RNAファージはヒトの腸内には存在しないと言われている(Sausset et al.) 健康な被験者のファージオームには、35~2,800種の活性ファージが存在すると推定されており、このうち50%以上は各個人に固有であるといわれている。
1.2. バクテリオファージの構造とライフサイクル
ファージは腸内に存在し、温帯性ファージと溶菌性ファージ(非温帯性ファージとも呼ばれる)に大別される(Sausset et al.) 分類学とは独立した生活様式に基づき、ファージは4つのカテゴリーに分類される。すなわち、(i)溶菌性で非温性、(ii)溶菌性で温性、(iii)慢性で温性、(iv)慢性で非温性である(Kirsch et al.)
温帯性ファージは、染色体外エピソームとして宿主細菌の染色体に組み込まれるか、プロファージとして維持されることで、溶原性ライフサイクルを行う。宿主の染色体に安定的に維持されたプロファージは、垂直伝播によって宿主の子孫に伝えられる。不利な条件下で、あるいは宿主細胞内のストレス因子や刺激に応答して、プロファージは増殖サイクルに入るように誘導され(Sausset et al. しかし、他のファージの中には、安定した溶原体を形成できないため、このような複製様式をとらないものもある。むしろ、ファージは溶菌性複製サイクルをとり、複製後に宿主細胞を溶解させる。図2Bに描かれている溶菌性非温熱性ファージは一般的に寄生性であり、宿主集団間で遺伝子の水平転移も行う。しかしながら、糸状イノウイルスのようなファージは、感染性ビリオンを放出する前に宿主細胞を溶解する必要はない。これらのファージは、図2C,Dに示されるように、細胞からビリオンを直接環境に押し出し続けることによって、慢性的な感染を引き起こすことができる。
図2
www.frontiersin.org
図2. どのような生活様式を始めるにも、すべてのファージは細菌の細胞表面を通して宿主細胞に吸着し、そこでゲノムを導入しなければならない。パネル(B,C)では、新しいビリオンの複製と集合は非温帯性ファージによって行われ、パネル(A,D)に見られるように温帯性ファージは染色体を宿主の染色体に統合し、そこでプロファージまたはエピソームとして維持される。ファージ遺伝子は、ファージゲノムの複製に関与するタンパク質を含む初期に発現する。後期遺伝子発現はファージ構造タンパク質の生産を保証する。最後に、ファージのビリオンは、パネル(A,B)に描かれているように細胞溶解によって、あるいはパネル(C,D)に描かれているように非溶解性の押し出しによって、環境中に放出される前に組み立てられる(Kirsch et al., 2021)。
1.3. 腸内ファージオーム
ヒトのファージオームは、腸内全域に存在するゲノムを含むファージ集団の総体である。ヒトの腸内には、糞便1グラム(1g)中に約35-2,800個の活性ファージが生息していると推定されている(Spencer et al.、2022)。ファージの分類学上のギャップが存在し、未特定のものは「ダークマター」と呼ばれているにもかかわらず、ファージ配列は腸内ビロームで最も顕著であると主張されている(Sinha and Maurice, 2019; Baaziz et al.) それにもかかわらず、ヒト腸内ビロームから単離された多数のファージがDNAコード化されていることが報告されている(Cao et al.) とはいえ、これらのファージの構成は個体によって大きく異なり、溶菌性ファージと温帯性ファージの両方が存在し、配列決定されたウイルス粒子や腸内細菌プロファージに基づくと、前者が優勢である(Baaziz et al.) しかし、腸内ファージの多様性は、腸内ファージオームの構成に大きく影響するいくつかの要因に依存している。
1.4. 腸内ファージの多様性と構成に影響を与える要因
生まれてから成人になるまで、腸内ファージの多様性と組成を形成し、影響を与える要因はさまざまである(Tiamani et al.) これには、年齢、食事、疾患の有無などが含まれる(Sinha and Maurice, 2019; Kirsch et al.)
1.4.1. 年齢
腸内ファージの組成と発生は、それぞれの個体の年齢に起因している(Cao et al.) 出生直後の乳児の体内では、母親の膣の正常細菌叢など、様々な感染源から様々なファージ集団が常にコロニー形成されている(Barr, 2017; Sinha and Maurice, 2019; Kirsch et al.) 乳幼児期には、ファージの存在量が増加すると報告されているが、逆に、ファージの動的性質は思春期には減少し、成人期には最大になると報告している研究もある。これは最終的には年齢とともに減少する(Sandersら、2021;Jansen and Matthijnssens、2023)。乳幼児の腸内ファージ組成は低いが、シホウイルス科とミクロウイルス科では存在量が増加し、ミオウイルス科では時間が経つにつれて減少すると言われている。メコニウム(乳児の最初の便)のウイルス様粒子(VLP)定量では、VLPはほとんど存在しなかった(図3)。しかし、産後1ヵ月を過ぎると、VLPsの数は糞便1gあたり109個まで増加した。分娩形態(帝王切開か経膣分娩か)は、1年以内に乳児の腸内ビロームのβおよびα多様性に有意な影響を与える交絡因子として同定されているが、細菌の多様性には有意な差は観察されなかった(Tiamani et al.) 乳児の腸に最初に定着するファージは、乳児の腸に最初に定着する細菌群(ファーミキューテス、バクテロイデーテス、放線菌、プロテオバクテリアなど)に由来する誘導ファージであり、これらの細菌群も出生時に獲得されるという証拠がある(Tiamani et al. 例えば、乳児の授乳中に感染するビフィズス菌には、ビフィドファージと呼ばれるプロファージが含まれていることが報告されている。これらのビフィズス菌はCaudoviralesに属し、乳児の初期にはcrAssphageの割合がほとんどなく、ファージオームを支配していることが確認されている(Tiamani et al.) 乳児の腸内にバクテロイデス類が定着した後、1ヶ月から3ヶ月の間にcrAssphageが出現し始める。同様に、乳児の腸内にcrAssphagesとともにコロニー形成するビフィズス菌とビフィズス菌は、母親の腸内シーケンスから同定されたcrAssphagesと99%までのゲノム類似性を示している(Tiamani et al.)
図3
www.frontiersin.org
図3. ヒトの生涯における腸内ファージオームの変化。円グラフは、風土病ファージが観察されなかった出生時から成人までの、個別のサンプリング時間で観察された異なるファージ群の比率を表し、こぶ線はファージの多様性と存在量の経時的変化を表し、どちらも出生後数週間でピークに達する(Townsend et al.)
年齢とともに、ファージの多様性と豊富さは細菌群集の多様性と豊富さに反比例して減少することは注目に値する(Tiamaniら、2022)。それでも、乳児の腸内では、バクテリオームとファージオームの多様性は反比例の関係にあり、最初の4日間でバクテリオームが少なくファージオームが多い群集から、2歳になるとバクテリオームが多くファージオームが少ない群集に移行すると言われている(Cao et al.) しかし、幼児期には、腸内ファージオームが支配的であったCaudoviralesは、次第にMicroviridaeファミリーに支配されなくなる(Townsend et al.、2021)。しかし、成人期になると、ヒトの腸内ビロームはcrAssphagesの豊富な存在によって支配されるようになる(Tiamaniら、2022)。例えば、ヒト腸内ビロームの個別メタ解析では、crAssphagesの1集団は、世界的に様々な年齢カテゴリーにわたって解析された全サンプルの12%であったと報告されている(Kirsch et al.) 得られた結果から、crAssphagesの存在量は成人期にピークに達するが、高齢になるにつれて減少することが推測された。また最近の証拠から、crAssphageはBacteroides intestinalis、Bacteroides thetaiotaomicron、Porpyromonas sp.などのバクテロイデーテス属細菌に多く感染することが裏付けられている(Kirsch et al.、2021)。
1.4.2. 食事の種類
ヒトの腸内ビロームを決定または形成する要因の中に、個体が摂取する食事の種類がある(Martinez-Gurynら、2019;Parginら、2023)。しかし、同じような食生活を送る人々の間では、ビロームの収束が観察される(Pargin et al.) 食生活が変わると、個人の腸内ビロームの多様性が変化することがある。この現象は、アルコール、グルテン、脂肪、肉の摂取量を変えてベジタリアンになった人や、食事の頻度や時間を変えた人で観察されている(Martinez-Gurynら、2019;Parginら、2023)。食事の変化は、腸-脳軸を介してそれぞれの個人の健康に影響を及ぼすだけでなく、腸内ビロームの測定可能な変化を引き起こすことが報告されている。しかし、このビロームコミュニティがどのように変化し、食事によってどのような影響を受けるのか、その正確なメカニズムはまだ解明されていない(Pargin et al. 乳児に母乳を与えた場合と粉ミルクを与えた場合の影響を比較した4ヵ月間の研究では、ビロームの量に関して両者で有意な差があることが観察された。
この研究で食事介入を受けた乳児は、食事の変化が腸内ビロームの多様性と豊富性に変化をもたらすことを実証した。さらに、オレガノ、シナモン、コーヒーなど、一般的に使用されている食事成分や経口摂取される薬剤には、プロファージ誘導能があり、その結果、腸内ビロームの組成や動態を変化させる可能性があることが、研究によって明らかにされている(Tiamani et al.、2022年)。食事が腸内ファージオームの構成に与える影響。同じような食事をしている個体でも、腸内ビロームの点で個体間に大きなばらつきがあることが報告された。この知見は否定され、異なる個体に同一の食事を与えることで、マイクロバイオーム組成をより類似したファージオーム組成に形成する可能性はあるが、以前に示唆されたように同一ではないことが判明した(Mukhopadhya et al.) この相反する知見は、腸内ファージオームの研究を制限している現在のギャップを念頭に置いて、研究母集団の大きさのばらつき、多様性、異なる対象材料や方法論における制約に起因している(Mukhopadhya et al.)
JansenとMatthijnssens(2023)は、同じような食生活を送っている個体は、腸内ビロームの組成がより類似している傾向があり、何らかの食事介入があるたびにある程度変化すると報告している。しかし、高脂肪食を摂取した個体では、Caudoviricetesファージの存在が比較的低く、Malgrandaviricetesファージの存在が比較的高いことが観察された。
1.4.3. 疾病の有無
個人の健康状態も、腸内ビロームの多様性に影響を与える要因のひとつと考えられてきた。腸内ビロームには健康な人と不健康な人の間でかなりのばらつきがあり、免疫系に重大な影響を及ぼすことが報告されている(Manohar et al.) 炎症性腸疾患(IBD)、下痢、代謝異常、糖尿病、肥満など、さまざまな疾患によって引き起こされるさまざまなオーダー間の不均衡に関して、数多くの報告がなされている(Łusiak-Szelachowska et al.) 病態の存在が腸内ウイルス叢の多様性の変化を引き起こしているのか、それとも影響しているのかを判断することがいかに難しいかについても報告されている(Łusiak-Szelachowska et al.)
ロベルト・コッホが提唱したコッホの仮説は、微生物と病態の因果関係を特定するために用いられる。メタゲノム版コッホの定石は、健康な個体と病気の個体との間で発見されたメタゲノム形質のばらつきや、病気の個体から健康な個体へのサンプル接種が、サンプルを採取した病気/感染症の発現を誘発するという証拠に大きく貢献している(Łusiak-Szelachowska et al.) しかし、ヒトのファージ研究では、コッホの定理のすべてが支持されているわけではない。例えば、ファージやウイルスのコンティグが健常者と病人では有意に異なるが、ファージ接種ではなく糞便微生物叢移植(FMT)を用いた研究はわずかである(Łusiak-Szelachowska et al.) さらに言えば、温帯ファージはヒトの腸内で最も豊富であることから、腸内ファージオームが世界的に定着している可能性が示唆される。このことは、ヒトの健康状態と、ヒトの腸内細菌叢の機能と構造の維持においてファージが果たす役割との間に相関関係があることを示すことができる。他の腸内細菌叢の維持は、ファージ集団の安定性の機能として可能であることが示唆されている。クローン病(CD)と潰瘍性大腸炎(UC)の患者を対象に、それぞれの腸疾患におけるファージの役割について調査が行われた。興味深いことに、健常人のファージオーム有病率が大きく変化していることが発見された。各サンプル中のファージの豊富さを測定したところ、CDおよびUC患者では多数のファージ種が存在し、それに対応して細菌種の豊富さは減少していた。抑制因子LexAと誘導因子RecAという2つの主要な制御因子によって制御される誘導性DNA修復システム(SOS応答)は、ファージオームの多様性の喪失、病原性細菌の腸内侵入、およびプロファージの誘導に対する制御応答として、炎症を起こした腸と関連していることが観察された。細菌細胞によるSOS応答の引き金には、抗生物質、紫外線、あるいは宿主の免疫反応など、さまざまな環境因子や条件が関係していると考えられている(Gutiérrez and Domingo-Calap, 2020)。
抗生物質の使用は、腸内細菌叢に対して長期にわたって影響を及ぼす可能性があり、個人の幼少期における使用は、炎症性腸疾患(IBD)や喘息を含む様々な健康障害の発症リスクの上昇に関係している。抗生物質は、腸内細菌叢の維持に有益な嫌気性細菌種など、腸内微生物の多様性に大きな影響を与えることが実証されている。抗生物質は重要なプロセスや構造を破壊することで細菌に障害を与え、静菌作用や殺菌作用を引き起こす(Kohanski et al.) 抗生物質の使用によって障害される重要な細菌種には、クロストリジア、バクテロイデス、乳酸桿菌、ビフィズス菌などがある。抗生物質を7日間投与しただけで、微生物の多様性は25%以上減少し、微生物相は当初の29分類群から12分類群に減少し、抗生物質の無差別使用に耐性を持つ細菌種は2.5倍に増加した(Sandersら、2021年)。しかし、どのような微生物群に対しても、抗生物質によるダメージの程度は抗生物質の種類に左右される(Sanders et al.) Duerkop(2018)は、抗生物質の投与による細菌およびファージコミュニティへの大きな影響を報告した。抗生物質の悪影響は、プロファージに存在する溶菌遺伝子の誘導と転写を担う遺伝子の発現を引き起こし、感染した細菌細胞の溶解と最終的な死滅に寄与する可能性が示唆された(Duerkop, 2018)。
消化管微生物叢のバクテリオファージ-細菌相互作用
腸内生態系におけるファージとその宿主細菌との相互作用は非常に複雑であると言われている(Zuppi et al.) まず、ファージは宿主特異的であり、特定の菌株と相互作用するという事実を強調することが重要である。腸内には数百万種の微生物が生息しているため、数百から数千の細菌とファージの相互作用が同時に起こる可能性もある(Guinane and Cotter, 2013; Sausset et al.) 第二に、ヒトの腸内環境と条件は、ファージ感染に遺伝的に感受性がある細菌種の一部を保護または遮蔽するような生息環境を作り出す(Sausset et al.) 第三に、ファージと細菌細胞の間には相互作用と拮抗作用の両方が存在する可能性がある(Feichtmayerら、2017;Batinovicら、2019;Saussetら、2020)。典型的な例は捕食で、細菌細胞は溶菌サイクルの後にファージ寄生体によって殺される(図4)。反対に、細菌は溶菌性ファージや糸状ファージと相互作用することができ、両者が何らかの形で利益を得る(Van Belleghem et al.)
図4
www.frontiersin.org
図4. ファージと細菌および哺乳類宿主との相互作用のメカニズム(A)病原性ファージによる細菌の感染は、細胞の溶解と子孫ファージの放出につながる。(B)温和なファージが宿主細菌に感染すると、溶菌性ライフサイクル、またはプロファージとして細菌の染色体にゲノムが組み込まれ、溶菌性ライフサイクルに至る。(C)ファージはキャプシドとの相互作用を通じて粘膜に付着することができる。 D)ファージはトランスサイトーシスを通じて腸管上皮を通過するか、(E)細菌細胞内で通過することができる(Baaziz et al.
2.1. 捕食
ファージは多くの場合、細菌表面膜上のいくつかの特異的レセプターを認識することにより、細菌の餌を標的とする。ファージが溶ける前に、細菌細胞はまずその構造タンパク質を用いて感受性の高い宿主に吸着する(付着する)(Xu et al.) このファージの作用は、主に細菌表面の結合部位となる分子構造とファージ尾部の相補性に依存する。ファージの尾部には、溶菌酵素を使って細菌のペプチドグリカン細胞壁を加水分解する能力があり、溶菌サイクルの終わりに生成されるファージ子孫を放出する役割を担っている。細菌細胞壁のペプチドグリカンは、単一のタンパク質を介したペプチドグリカンの合成をもたらす過程や経路の阻害、あるいはリジンやその他の付属系を利用したペプチドグリカンの酵素分解を介して、溶菌酵素によって破壊され、溶解される(Xu et al.、2022)。
細菌のバイオフィルムを破壊する酵素には2種類ある。(i)初期段階で細菌細胞へのゲノム侵入を促進する外解酵素と、(ii)終期段階で細菌宿主を分解し、ファージの子孫を身近な環境に放出できるようにする内解酵素である。このユニークな捕食プロセスによって腸内細菌を死滅させると、腸内ファージは犠牲者のゲノム上に特定のCRISPRスペーサーの配列を残す可能性がある。この塩基配列の同定を通じて、動物でもヒトでも、ファージによる自然捕食の結果としての細菌死は、どこにでも存在し、腸内細菌叢の安定化に重要な機能を果たすことが発見された。前述したように、ファージとバクテリアの捕食関係は非常に特異的である。例えば、Faecalibacterium prausnitziiのファージは、宿主であるF. prausnitziiに選択的に感染し、他の腸内細菌細胞は無視する(Xuら、2022年)。しかし、CRISPRスペーサーのマクロゲノム解析を詳細に行ったところ、ヒトの腸内に存在するファージの中には、より幅広い細菌を宿主とするものがあることが明らかになった(Xu et al.) 例えば、F. prausnitziiに感染することが知られているファージが、F. prausnitziiとは距離的に近縁であるBlautia hanseniiに感染し、溶菌を引き起こすことが発見された(Sausset et al.)
ファージと細菌間の捕食的相互作用は、被食者(細菌)による耐性機構の発達と捕食者(ファージ)による対抗効果の間の共進化を促すことが報告されている(Koskella and Brockhurst, 2014; Braga et al.) 耐性につながるような細菌の遺伝子構造の変化が、その表現型にばらつきがあるために起こらない場合もある(Baazizら、2022年)。その他の例では、細菌がファージの攻撃に対して完全に感受性を維持することもある。しかし、細菌種は腸の粘膜の奥深くに存在することが多く、通常の状況ではファージが到達できないことがほとんどである。ファージウイルスによる細菌細胞の感染性は、GITが可能にするいくつかの環境条件によって低下することが報告されている(Saussetら、2020年)。表現型耐性を含む他の耐性手段がない場合、腸管内の環境は一部の感受性細菌種の保菌に適している可能性が報告されている(Corona and Martinez, 2013; Larsson and Flach, 2022)。例えば、試験管内の胆汁酸塩環境では、大腸菌のファージ感染が阻害されることが実証されている。この障害の理由は、相変化する細胞表面タンパク質の抑制に起因している(Kirschら、2021年)。さらに、酸素やpH、短鎖脂肪酸、胆汁酸、ムチンなどの分子を含む生物学的因子の勾配を介して誘導される細菌の不均一な空間的集団により、ファージによる様々な耐性が生じる可能性がある(Sausset et al.、2020;Kirsch et al.、2021)。細菌の生理機能は前述の勾配によって変化し、ファージの捕食がうまくいかなくなる可能性がある。さらに、ファージの拡散は、他の腸内細菌叢を含む様々な非適合細菌種によるGITの混雑によって阻害される可能性がある(Sausset et al.)
2.2. 溶菌変換
細菌とファージの相互作用は、捕食だけでなく、溶菌性ファージが細菌宿主にもたらす潜在的な利益のために拡大してきた。溶原性ファージは細菌宿主の中で不活性/休眠状態を保つことができるため、その複製と生存の成功は、ファージが溶原性である間の宿主に依存する。そのため、相互主義と呼ばれるような関係において、ファージが細菌宿主に進化的な利点を与えることができる(Koskella and Brockhurst, 2014; Braga et al.) この種の相互主義は、ウイルスのライフサイクルには何の役割も影響も持たないが、細菌宿主にフィットネス上の利益を与えることができる遺伝子をビリオンが持つ場合に例示できる。これらの遺伝子はモロンと呼ばれ、モロンが細菌宿主に適合性を与えるプロセスは溶原性変換として知られている(Zuppi et al.) 温帯ファージは、新たに獲得した表現型の発現により、細菌宿主が環境に存在する不利な条件に適応するのを助ける(Davies et al., 2016; Lin et al., 2017; Rogovski et al., 2021; Xu et al.) これらの獲得された表現型には、他のファージ超感染に対する細菌免疫、抗生物質や他のファージに対する耐性、病原性、様々なストレスに対する耐性、その他の可能性のある利点に関与する形質が含まれている可能性がある(Saussetら、2020;Kirschら、2021)。細菌宿主に侵入すると、溶原性ファージは多くの場合、そのゲノムを細菌の染色体と統合する。そうすることで、ファージは宿主のマクロファージに認識されず、排除されるのを避けることができる。ファージは、腸内細菌群集の代謝、存在量、多様性を制御するだけでなく、ある細菌種から別の細菌種へ遺伝子を水平移動させる重要な手段としての役割も果たしている。
2.3. プロファージの誘導
プロファージは宿主内で安定であるが、環境からのストレス要因によってこの安定性が損なわれることがあり、確率的変動がファージの誘導を引き起こし、それによってファージが溶菌サイクルを再開し、結果として前述のように宿主細菌が溶菌されることがある(Fortier and Sekulovic, 2013; Sausset et al.) 一般に、プロファージの誘導は、溶菌のマスターレギュレーターやリプレッサータンパク質の不安定化を通じてDNA分子に加えられた損傷から発せられる細胞シグナルによって引き起こされる(Fortier and Sekulovic, 2013; Sausset et al.) GITにおいて、DNAの二本鎖の切断を引き起こすプロファージ誘導物質としては、キノロン系抗生物質がよく知られている(Sausset et al.) フルオロキノロン系抗生物質とマイトマイシンCは一般的なプロファージ誘導剤であり、この場合、細菌のRecAタンパク質はプロファージ応答センサーとして働く(Henrot and Petit, 2022)。同様に、予防的抗生物質であるカルバドックスは、志賀エキソトキシンをコードする遺伝子を担うプロファージの誘導を引き起こすことが報告されており、このプロファージは牛の大腸菌株間で移行する(Boling et al.) キノロン系抗菌薬は大腸菌のStxプロファージを不安定化させるため、ヒトの志賀毒素原性大腸菌感染症の治療は臨床的に悲惨な結果をもたらす(Sausset et al.)
世界中の様々な研究から、試験管内で行われた古典的な増殖培養と比較して、ネズミの消化管内ではファージ誘導率が高くなると言われており、これは損傷DNAの修復に機能するSOS応答の活性化が増加するためであることが示唆されている。しかしながら、ラクトバチルス・ロイテリについては、SOS応答の活性化はGITで使用される特定の代謝経路を活性化する結果であることが示唆された(Sausset et al.) Saussetら(2020)はまた、胆汁酸塩や一酸化窒素などの腸内代謝産物によって、大腸菌Stxプロファージの誘導率が低下または上昇する可能性を報告している。同様に、胆汁酸塩によるサルモネラのプロファージの誘導もある。しかし、腸の炎症はサルモネラ菌プロファージの誘導率を高めることがマウスモデルで証明されている。興味深いことに、ファージの誘導率は、特にビブリオコレラエとエンテロコッカス・フェカリスのファージにおいて、クォーラムセンシングとして知られる新たに発見されたシグナル伝達経路において、感受性の高い宿主細菌群の濃度に応じてファージによって制御されることが報告されている(Sausset et al.) これらの知見を組み合わせると、プロファージの誘導は、腸内細菌叢の組成を変化させる大きな可能性を持つ細菌宿主に、大きな負担を強いる可能性があることが示唆される。一般的に、このことはマウスモデルを用いて実証されている。高率のプロファージ誘導は、溶原菌を不利にすることによって、既存の菌株間の均衡を変化させることが観察された(Sausset et al.、2020)。
GITでは、デオキシリボ核酸(DNA)がファージによって積極的に導入され、水平遺伝子転移によって他の種や菌株に移されていることは特筆に値する(Boling et al.、2020;Kirsch et al.、2021)。GITはこうした事象の多くを可能にするため、プロファージの動的誘導を裏付ける証拠が現れ始めている。例えば、大腸菌によるプロファージ保有にかかるコストについて、axenicマウスが評価された。実験終了時の結果から、プロファージ誘導率が高いことが明らかになった(de Sordi et al.) 生体内では、プロファージ誘導はE. faecalisでも記録され、そこでは他の競合菌が死滅することが観察された(de Sordi et al.) また、E. faecalisの研究により、欠陥のあるプロファージの一部は、周囲の環境への拡散に必要なビリオンを形成できるように、無傷のプロファージに存在する構造タンパク質を乗っ取ることが観察されたことから、同一細胞内でプロファージの様々な要素が複雑に作用していることも明らかになった(de Sordi et al.)
ファージと細菌の相互作用の生態学的モデルとダイナミクス
ファージが近い将来、重要な治療・診断ツールとなるためには、ファージとその宿主細菌との相互作用を理解することが最も重要である。その結果、生物学的システム(すなわちヒトの腸)の文脈におけるファージとその宿主細菌との相互作用を解明するために、いくつかの生態学的モデルが提唱され、利用されてきた(Sutton and Hill, 2019)。しかし、Zuppiら(2022)は、これらのモデルを独自の特徴に基づいて2つの大きなグループに分類することができた。
3.1. グループ1モデル
このグループのモデルは、細菌とファージ集団の両方の多様性と変動性が低いことが特徴である[すなわち、Piggyback-the-WinnerとArms-Race Dynamic (ARD)](Zuppi et al., 2022)。
3.1.1. アームス・レース・ダイナミック
微生物が任意の生態系で成功するためには、コロニー形成と生存が必要である。そのため、微生物は生息環境に存在する必需品をめぐって競争しなければならない。この相互作用は、微生物がストレス要因にうまく適応するために、競合者に遺伝子型と表現型の両方の変化を引き起こす(Fortuna et al.) 細菌(餌)はファージの捕食に対する防御機構を持ち、ファージ(捕食者)は餌の防御を回避する手段を持つ(Fortuna et al.) 前述したように、このダイナミックスは共進化的である。この防御と反抗は、ファージとバクテリアの間の軍拡競争につながり、この障壁に耐える能力のないそれぞれの種は絶滅し、能力のある種が繁栄することになるかもしれない(Scanlan, 2017; Zuppi et al.) ARDモデルでは、競争相手(細菌とファージ)の両方が、ゲノムにさまざまな数の変異遺伝子を蓄積し、ファージによる感染に対抗するために細菌による抵抗性の進化を高め、その過程で捕食者と被食者のサイクルを生み出し続ける(de Sordi et al.) ARDでは、宿主の防御に対する寄生虫の対抗防御がますます発達するように選択される(Fortuna et al.) ARDモデルの変異は細菌に対するファージの感染性を回復させることができ、その結果、細菌とファージが腸内マイクロバイオームから根絶されないように絶えず進化する捕食者-被食者サイクルが生じる(Sutton and Hill, 2019; Dahlman et al.) これまでのところ、限られたエビデンスのため、GIT内でのARDの拡大について結論づけるのはまだ早い。それにもかかわらず、ファージ耐性が報告されている(Gilpin and Feldman, 2017; Sausset et al.) さらに、ある宿主から別の宿主への移行を助ける微生物の多様性が報告されており、溶菌性コリファージは乳児の腸内で生存しているという仮説もある。しかし、成人の安定した腸内では、このプロセスの適用性はまだ確認されていない。むしろ、最近の研究から、腸内の空間的不均一性(すなわち、粘膜表面と内腔表面)の存在が、ファージと宿主との共存の潜在的な原動力であることが示唆されている(Dahlman et al.)
3.1.2. ピギーバック・ザ・ウィナー・ダイナミック
相互作用はこのモデルの主な原動力であり、主に溶原性ファージのライフサイクルで起こる。実際の意味において、このモデルは、他のファージによる再感染から宿主細菌を保護することで、宿主細菌の生存にプロファージが貢献することを表現している。ライソゲンによってもたらされる付加的な利点により、細菌宿主は競争的な環境でも持続できるような形質を与えられている。そうすることで、ファージとその宿主の双方が、相互関係の構築により腸内生態系を長続きさせることができる。最も重要なことは、提案されているピギーバック・ザ・ウィナー・ダイナミック(PtW)モデルが、細菌とファージの間の集団動態モデルで唯一、溶菌サイクルと直接結びついていることである(Voigtら、2021;Zuppiら、2022)。溶菌サイクルから溶原性複製モードへの切り替えを可能にするPtWのようなモデルもまた、ファージ-宿主相互作用のダイナミクスをサポートし、哺乳類のGIT内で適用可能であるという新たな実験的証拠が得られている(Sutton and Hill, 2019)。温帯ファージが溶原性に入ると、細菌対ファージ集団の比率が低下することが最もよく説明できる。ほとんどの腸内細菌は、最低1つの温帯ファージによって溶菌されると報告されている(Kirschら、2021)。GITの粘膜表面は、ファージと宿主間のPtWモデル相互作用をサポートすることが実証されている。粘膜表面は細菌集団によるコロニー形成が盛んであることが示唆されている。そのため、ウイルスと微生物の比率(VMR)が高くなり、PtWのダイナミクスが生じる。しかし、粘膜の深層はKill-the-Winner(KtW)として知られるモデルを支持することが報告されている(Sutton and Hill, 2019)。
3.2. グループ2モデル
このグループには、細菌とファージの高い多様性と変動性(kill-the-winnerダイナミクスと変動する選択ダイナミクス)を特徴とするモデルが含まれる(Zuppi et al.、2022)。これらのモデルの原動力は負の頻度に依存する選択であり、遺伝子型の適合度がその頻度に反比例する自然な形の選択である(Koskella and Brockhurst, 2014; Scanlan, 2017; Braga et al., 2018; Brisson, 2018; Zuppi et al., 2022)。
3.2.1. 変動する選択ダイナミック
このモデルはレッドクイーンダイナミクス(Fortuna et al.) このモデルは細菌とファージの相互作用を説明するもので、ファージが細菌を攻撃し、その見返りとして餌となる細菌から抵抗力を受けるという寄生的な関係が提案されている(Kirsch et al.) 遺伝子の進化は速いが、遺伝的多様性は一般的に低いレベルである武器競争モデルとは異なり、レッドクイーン動態は長い合体期間を持つバランスのとれた多型をもたらす(Koskella and Brockhurst, 2014)。揺らぎ選択動態(FSD)のモデルは、細菌がファージによる攻撃に対して耐性を持つことを可能にする変異に関する関連した多型性を考慮する;そのようなものとして、ファージはファージの進化に依存しない(de Sordi et al.) FSDモデルでは、ファージは耐性形質を持つ宿主に感染し、同時に環境中に存在するファージビリオンの数を減少させる(Sutton and Hill, 2019)。耐性を持つ餌生物の数が減ることで、感受性株の細菌餌生物の増殖と拡大が可能になる。その結果、豊富な感受性餌生物は耐性宿主に対して競争優位に立ち、その結果、スペースと栄養を奪われ、最終的には絶滅してしまう(de Sordi et al.) ファージ-細菌群集のこのような一過性の感染性と抵抗性は、しばしば細菌数の短期的な変動をもたらし、両者は長期間持続する(Sutton and Hill, 2019)。FSDモデルは、細菌がファージの攻撃に抵抗するメカニズムを発達させるために必要な適性コストの結果であり、特に(腸のような)様々な種が資源をめぐって同時に競合する環境において、これを達成するのはかなり困難である(Zuppi et al.、2022)。ファージの感染力に抵抗する効果的なメカニズムにより、感染力のあるファージの数は減少すると考えられている。ファージに耐性を持つ細菌の集団は、捕食率が低下したときに数が少なければ競争に負ける可能性がある。その結果、ファージ感染に耐性のない細菌が細菌群集の大部分を占めるようになる。新たに発生した寛容な環境でファージの捕食が増加すると、環境は再びファージに耐性を持つ細菌の進化を助長するようになり、それによって耐性ファージの全体数が増加する。その結果、サイクルは新たに始まり、プロセスは繰り返される(Colavecchio et al.) FSDモデルの下では、最も一般的な遺伝子型に局所的に適応したファージの攻撃から逃れることができる場合に限り、一般的でない宿主の遺伝子型が自然選択によって好まれる。同時に、ファージ-宿主関係の特異性により、最も一般的な宿主を攻撃できるファージが有利となる選択過程が続く(Fortuna et al.) FSDモデルは、バクテリアとファージのペアだけでなく、畳み込みによって発展した混合集団にも適用される(de Sordi et al.)
3.2.2. キル・ザ・ウィナー・ダイナミック
バクテリアとファージ間の相互作用は、kill-the-winner(KtW)ダイナミクスを用いて説明されることもある(Kirsch et al.、2021)。このモデルはLotka-Volterra方程式(Bacaër, 2011)に類似していると言われ、捕食者とその獲物の相互作用を記述する(Kirsch et al.) 細菌集団の密度は、非温帯性溶菌ファージのKtWモデルにおける重要な決定因子である(Kirsch et al.) 優勢で増殖の速い常在菌は、増殖の遅い餌生物よりも先にファージによって最初に標的とされ死滅する。このように、KtWモデルは、ファージが感染性と複製のために細菌宿主との日和見的な接触を待っている間に、対象となる細菌集団がファージの集団内で一時的に高くなることに依存している(Mukhopadhya et al.)
宿主とファージの相互作用が低いと言われるのは、細菌の増殖が低く、それによって感染率が低い場合である。しかし、宿主細菌の集団が拡大すると、ファージが宿主と接触する確率も高くなる(Kirsch et al.) ファージと細菌の感染率が高くなると、細菌集団の拡大が妨げられる。このため、ファージはKtWモデルにおいて、細菌群集の組成を安定化させるスタビライザーとして機能し、増殖の速い細菌種が細菌群集の個体数をオーバーランするのを偏った形で防ぐことができる(Zuppi et al.、2022)。複数の競合するファージは、ファージの宿主特異性により、複数の細菌系統に同時に感染しないことがある(Myersら、2023)。KtWモデルを病原性ファージに感染した細菌宿主に適用すると、微生物群集の突然の崩壊が観察される。高度に不均一な細菌群集では、それぞれの種が周期的な個体群動態を観察し、それによって拡大した個体群が突然崩壊した。しかし、細菌群集が細菌群集の構成に比して高い速度で成長する限り、集団の多様性は常に維持される。例えば、KtWモデルは、乳児の腸内における細菌-ファージ相互作用を顕著な例外として、ヒトの腸内微生物群集に適用可能である(Kirsch et al.、2021)。そのため、KtWモデルは、ヒトの腸内におけるこのモデルの発生に関するデータが乏しい群集で優勢な微生物種に対してのみ検討される。コリファージによる感染と並行して大腸菌の単一株を積み重ねた作為的なモデルでさえ、この現象の適用性を明らかにすることはできなかった。腸内環境の生理的性質や物理的構造がファージとの接触から細菌を守っている可能性が、ヒトの腸内におけるこのモデルの適用性を制限している障害であることが示唆されている(Mukhopadhya et al.)
健康と疾患に関連するGITにおけるバクテリオファージ活性
シークエンシングに使用されるハイスループットテクノロジーの進歩により、GITビロームはヒト腸内細菌叢の重要な構成要素であると考えられるようになり、そこではビローム全体が細菌の集団を凌駕し、拮抗していると考えられている(Zuo, 2018)。ハイスループットシークエンシングによって腸内ビロームが明らかになるにつれ、ヒトの健康に影響を及ぼすビロームの生態学的役割や機能に関するデータは乏しくなっている。ヒトの腸内に存在する病原性ウイルスが有害な影響を及ぼすことは、もはやニュースではなくなっている(Zhang et al.) しかし興味深いことに、さまざまなメカニズムや相互作用を介して腸内細菌種に有益な形質や効果をもたらす例も数多くあり、宿主の適応免疫系や自然免疫系を調節することもできる(Zuo, 2018)。このため、ウイルス(特にファージ)は診断や治療の目的で利用されてきた(Brives and Pourraz, 2020)。
4.1. バクテリオファージの治療可能性
現在、世界の医療システムは抗生物質耐性の微生物によって脅かされており、そのため世界中の研究者は新しい改良型抗生物質の探索に取り組んでいる(Loganathan et al.) しかし、新しい抗生物質を探索するのは大変な作業であり、その達成には何年もかかる可能性がある。消化管感染症を引き起こす病原性細菌(サルモネラ菌、赤痢菌、カンピロバクター・ジェジュニ、大腸菌、クロストリジウム・ディフィシル、コレラ菌など)は、慢性あるいは急性の感染性腸炎を引き起こす能力を持ち、新しく開発された抗生物質に対して一貫して耐性を示してきた(Xuら、2022年)。ファージは溶菌サイクルによって病原性細菌細胞を溶解する能力を持つため、ファージ療法として知られるプロセスにおいて、抗生物質耐性の世界的大流行と闘う重要な治療薬となることが提案されている(Sulakvelidze et al.) ファージ療法とは、細菌に起因する疾患の治療にバクテリオファージを使用することであり(Brives and Pourraz, 2020; Baron, 2022)、複数の薬剤に耐性を持つ感染症の治療において、臨床医の関心が高まっている新規治療法である(Baron, 2022)。ファージ療法はまた、慢性バイオフィルム感染症の治療における重要な補助療法と考えられている(Doub, 2021)。しかし、どのような疾患に対してもファージ療法を開始するには、いくつかの条件や基準を満たす必要がある。
4.2. ファージ療法に考慮される基準
治療薬として使用されるファージには、毒素タンパク質や病原性因子をコードする遺伝子がないことが適切である(Manohar et al.) 溶原性ファージ(すなわち、宿主染色体に統合するファージ)は、病原性細菌を溶解するために別の特定の病原性ファージを必要とするような形質(毒素産生や、より多くのクラスの抗生物質に対する耐性など)を付与することによって病原体の病原性を高める可能性があるため、使用前に批判的に検討すべきである。このように、溶菌性ファージは標的とする病原性細菌細胞を直接溶解させるため、使用することがより推奨される(Manohar et al.) ファージ療法がどれほど効果的なものになるかは、ファージが上皮によってもたらされるバリアを乗り越え、免疫系が適切に反応するように誘導する能力に強く依存している(Sinha and Maurice, 2019)。しかし、ヒトの免疫系による炎症性(炎症を促進する)反応や抗体産生の可能性から、ファージ療法の安全性や有効性に疑問が投げかけられている。そのため、いかなる形の抗炎症反応や炎症促進反応を防ぐためにも、治療を検討する特定のファージ分類群について深い理解と知識を持つことが適切である(Sinha and Maurice, 2019)。したがって、適切なファージを入手することは、どのような疾患状態においても、どのような形態のファージ療法を開始するにも必要条件である。これは、in vivoとin vitroの両方で前臨床試験を実施し、ファージが治療目的に使用する基準を満たすかどうかを確認することで達成できる(Manohar et al.)
4.3. ファージとヒトの免疫反応
経口経路または血液中への注射によるファージ曝露による人体の免疫学的応答は、ファージ療法の重要な側面である(Manohar et al.) ヒトの免疫系は、異物(ウイルス粒子を含む)が体内に侵入するたびに反応する複雑なネットワークである。前述したように、ファージは健康なヒトのビロビオータ/マイクロバイオータの重要な構成要素であり、腸内マイクロバイオームにおいてファージが果たす役割を確認するために数多くの研究が行われている(Manohar et al.) しかし、ファージは免疫系によって有害であると認識されることはあまりないため、ファージの存在は人体に有害ではない可能性がある(Loc-Carrillo and Abedon, 2011)。他の微生物ウイルスの排除を含め、ファージに対する免疫系による誘発反応に関する明確な証拠はまだ示されていない。大きさを比較すると、真核生物ウイルスはファージよりもはるかに小さいが、ファージがどのように相互作用し、免疫系を誘導するかに関する知識は乏しい(Manohar et al.) 例えば、ファージで動物やヒトを免疫すると、ファージに対する抗血清(すなわち、ファージの増殖に対して作用する抗体)が産生され、免疫していない動物やヒトは非常に低濃度でしか抗血清を持たないことが報告されている(Manohar et al.) ヒトの腸内細菌叢にT様ファージが普通に存在することから、T様ファージに対する天然抗体の存在も示唆されている。しかし循環系では、ファージの存在はヒトの免疫系には歓迎されない。例えば、実験モデルの循環系に変異型ラムダファージを接種したところ、自然免疫系がファージを排除し、血液中の循環時間が減少した。
体内の免疫系が、接種されたファージに対して作用するようになったのである。ファージに対する細胞反応のメカニズムを解明する研究は少ない。さらに、ファージが抗原提示細胞からT細胞にどのように提示されるのか(抗体の産生と将来の記憶反応を開始させるため)については、現在論争が続いている。研究は行われているが、ファージとヒトの免疫系との相互作用の正確なメカニズムを確立するには、まだかなりの研究が必要である。ヒトはファージと免疫系の相互作用について数多くの研究を行っているが、このテーマに関するヒトの知識と理解はまだ完全には理解されていない(Manohar et al.)
ファージが免疫反応に影響を与える可能性は、ファージのもう一つの興味深い特徴である。この総説では、ファージが侵入細菌を積極的に捕捉・寄生し、炎症反応やその他の免疫反応を抑え、安定した腸内細菌叢を維持することが強調されている(Xu et al.) ファージを介した溶菌は、病原体関連分子パターン(PAMPs)だけでなく、腸の透過性が高まるたびに、免疫応答の移動と活性化にも関与することが報告されている。病原体関連分子パターン(PAMPs)は、微生物が産生する高度に保存された構造モチーフを持つ分子であり、免疫応答を開始するための異物として病原体認識受容体(PRR)によって検出される(Silva-Gomesら、2014;Asiamahら、2019)。ファージによるマクロファージの誘導を通じて、細菌はオプソニン化(免疫プロセスであり、食細胞に飲み込まれるのに十分な大きさの抗体でコーティングされた抗原を処分する手段または分子機構)によって貪食され、免疫系への容易な侵入を促し、そこで破壊される。ファージと宿主細菌との間の重要な決定要因は腸粘膜であることに注意することが重要である(Łusiak-Szelachowska et al.)
ファージコミュニティは時に粘膜バリアと接触し、免疫反応を引き起こす。このようにして、常在微生物は粘膜の上層に存在する限り自然免疫によって保護され、一方、獲得免疫は粘液の最深層に侵入した病原体を溶菌によって死滅させる(Xuら、2022)。抗菌剤の役割を効果的に果たすためには、粘膜に付着したファージが細菌の定着を防ぐ必要がある。ファージの中には、ドメイン型免疫グロブリンやC型レクチンの免疫フォールドを示すタンパク質を発現し、大腸のムチンによるO-グリコシル化MUC2の発現を妨害するものもある。逆に、自然免疫による反応を混乱させる病原体は、獲得免疫アクセサリーによって処理されることになる(Xu et al.、2022)。ファージを制限する腸内の要因は、免疫グロブリンA(IgA)の産生であると考えられてきた。
胃でのファージ活性を制限する重要な因子は、ファージ特異的分泌性IgAであるようだ。注目すべきことに、食餌からファージを除去した後、分泌性IgAのレベルは時間とともに低下した。抗ファージIgM抗体の実質的な上昇は見られず、血液中にファージ特異的IgA抗体は発見されなかった(Majewska et al.) Xuら(2022)によると、IgAレベルが低いときには糞便中にファージが発見されるが、IgAレベルが高いときには糞便中に活性ファージは確認されず、このことも腸内ファージの相対的存在量とIgA関連免疫との関連を直接説明する可能性がある。このことは、IgAがヒトの腸内に存在するファージに大きな影響を与えていることを強く示唆している(Xuら、2022年)。
ファージと哺乳類/免疫細胞との相互作用は、ファージの免疫調節や免疫原性を含めて幅広く研究されている。世界中の様々な研究者によるワクチン開発において、ファージは十分な送達を達成するためのビヒクルとして採用されてきた。樹状細胞による応答を刺激するFDファージの使用に関する報告がなされており、ウイルス粒子が病原体として認識されるため、適応免疫系と自然免疫系の両方が活性化される(Manohar et al.) fdファージは糸状ウイルスであり、その構造は、CpGモチーフが豊富な一本鎖DNAゲノムを含む、約7×890nmの円筒形の柔軟なタンパク質足場によって形成されている(Prisco and De Berardinis, 2012)。抗体応答の障害によって引き起こされる免疫不全に苦しむ人々は、免疫化の際にファージを使用することで緩和されると言われている(Manohar et al.) ファージは免疫系に悪影響を及ぼすこともある。例えば、大腸菌Stxプロファージは志賀毒素をコードする遺伝子を持つことが判明しており、PI3K/Akt/NFBシグナル伝達経路を阻害することにより、ヒト腸細胞の自然免疫応答を改変することができる。その結果、インターロイキン8とケモカインCCL20のレベルが低下する(Davies et al.)
4.4. ファージ療法の戦略
理論的には、すべての細菌は少なくとも1つ以上のファージによって溶解される。そのため、ファージは複数の抗生物質に耐性を持つ細菌株との闘いにおいて重要な武器と考えられてきた。治療中、ファージの種類数によってファージ療法をモノファージまたはポリファージに分類し、前者は1種類のファージのみを使用し、後者は2種類以上のファージを使用する。実際には、治療において複数のファージを組み合わせて使用することを「ファージ・カクテル」と呼ぶ(Chan et al.) モノファージ療法の使用は、特にコンセプトを証明したり、モデルを開発したりするための実験的試験で採用されることが多い。例えば、幅広い宿主に感染可能なファージが利用できるシナリオや、特定のファージ単離株と病原体の正確なマッチングが必要な臨床環境などである(Chan et al.) 広域スペクトル抗生物質は存在するが、すべての菌株を殺すことはできない。さらに、広域スペクトル抗生物質の使用は、人体の正常な微生物叢に悪影響を及ぼす可能性があるため、推奨されていない。ファージは宿主特異的であるため、広域スペクトル抗生物質が引き起こす問題のひとつを解消することができる(Principi et al.)
4.5. 消化器疾患の治療におけるファージ療法
消化管によくみられる細菌感染症には、それぞれC. difficile、赤痢菌、大腸菌、コレラ菌、サルモネラ・エンテリティディスによる下痢、赤痢、胃腸炎、コレラ、サルモネラ症などがある。ファージ療法は腸内細菌叢のバランスを回復させることが報告されている。ファージのカクテル療法が単剤よりも効果的とされる理由は、相乗効果にあると提唱されている。ShuwenとKefeng(2022)は、治療中に複数の抗生物質に耐性を示したアシネトバクター・バウマンニ(Acinetobacter baumannii)の感染とともに壊死性膵炎に罹患した68歳の患者を対象とした臨床治療を報告した。抗生物質による治療は無駄だったので、研究者たちはA. baumanniiを分離することにし、ファージ・カクテルに対する感受性をスクリーニングした。最終的に、抗生物質耐性菌を溶解させることができるファージのカクテルが患者に静脈注射された。その後、治療後に患者の急速な改善が観察された(Shuwen and Kefeng, 2022)。腸管病原性大腸菌(EPEC)感染マウスモデルを用いて、シプロフロキサシンとファージの効果を調べ、どちらの治療薬が治療薬としてより効率的で成功するかを決定した。また、ファージ療法はin vivoでEPECの数を減少させるのに有効であるだけでなく、マウスの正常な成長を引き起こすのに十分であることが観察された。同様に、ファージカクテルの有効性を確認するために、コレラ菌に感染したウサギのモデルを用いた調査が行われた(Xuら、2022年)。ファージカクテルで6時間処理した後、使用したウサギモデルではコレラの増殖が有意に減少したことが観察された。したがって、この結果はファージカクテルの投与時間と相関していた(Xuら、2022年)。
4.6. ファージ治療の利点
治療目的でのファージの使用は、その特性や臨床医に提供する選択肢により、従来の抗生物質の使用よりもいくつかの利点がある(Loc-Carrillo and Abedon, 2011)。細菌種の密度にもよるが、ファージは細菌宿主の溶菌中に、特に細菌宿主が存在する場所で大量に増殖する能力を持っており、この現象は「自動投与」として知られている。ファージは感染する宿主の種類に特異性があるとの報告もあるが、それにもかかわらず、ファージが感染する宿主の種類に特異性があるとの報告もある。とはいえ、ファージが近縁の他の細菌種にも感染できたという報告もある(Loc-Carrillo and Abedon, 2011)。これは従来の抗生物質とは対照的で、ファージはより幅広い抗菌活性を持つため、カンジダ・アルビカンスによる酵母感染症やC.ディフィシルによる大腸炎などの超感染症を促進することが報告されている。ファージが比較的狭い範囲の宿主を持つという事実が、ファージ耐性機構を開発するための選択を特定のファージ種に限定している(Loc-Carrillo and Abedon, 2011; Loganathan et al.) 例えば、下痢を引き起こす大腸菌に感染したマウスモデルをT4様ファージで処理した場合、他の細菌群では副次的な被害は記録されなかった(Principi et al.)
バイオフィルムを形成する細菌は、抗生物質の作用に抵抗するという点でさらに有利になる傾向がある。一方、ファージは、デポリメラーゼやエキソポリマー分解酵素を用いて、細菌のバイオフィルムに侵入したり(すなわち、溶解によって一度に1つの細菌細胞層に侵入する)、除去したりする能力を有することが実証されている(Loganathanら、2021年)。抗生物質と同様、ファージは多用途であり、開発中にさまざまな形態(固形物に含浸させたり、クリームに加えたり、あるいは液体に製剤化したり)に製剤化することができる。また、他の治療薬(抗生物質など)と併用することもできる。ファージはまた、さまざまな経路(経口、吸入、静脈内など)で使用できるように製剤化することもできる(Loc-Carrillo and Abedon, 2011)。さらに、溶菌性ファージは短時間で大きな効果を発揮することが確認されている(Loganathanら、2021年)。
4.7. ファージ療法の限界
ファージはどこにでもあるが、すべてが治療目的に使用できるわけではない。治療に用いられる最も一般的なファージは溶菌性ファージである。治療におけるファージの応用可能性については多くの疑問が投げかけられており、特に純度や安全性に関する問題が多い。ファージの調製において、注意を払わなければ、調製されたファージが細菌宿主から獲得した内毒性タンパク質を持っている可能性がある(Shuwen and Kefeng, 2022)。さらに、宿主細菌の溶解によって、ヒトの腸内に内毒素が放出される可能性があり、これは有害である。具体的には、最後に特定の問題を解決する一方で、別の問題が生じるのである(Shuwen and Kefeng, 2022)。ポリファージ療法が非常に効果的であることは前述したが、それにもかかわらず、治療中にFMTを使用すると、腸内細菌叢から他の重要な正常細菌叢が除去される可能性がある。これはまた、望ましい有害細菌種のみを除去することが全体的な望みであるため、懸念も生じる(Caoら、2022年)。ファージは重要な遺伝子編集ツールであり、ヒトの免疫系と相互作用すると容易に進化し、有害な影響を引き起こす可能性があることが実証されている(Shuwen and Kefeng, 2022)。
さらに、溶菌サイクルを利用するファージは、細菌宿主の染色体にゲノムを組み込む能力を持つことが確認されている。ファージが抗生物質耐性遺伝子を持つシナリオでは、抗生物質耐性菌種を排除する緊急の必要性が生じるため、ファージは治療中の患者にさらなる害をもたらすだけである(Loganathan et al.) ファージは宿主を持つため、標的細菌に感染して溶菌させるファージが準備されたファージカクテルに含まれていない場合、その治療法は効果を発揮しないことになる(Gutiérrez and Domingo-Calap, 2020)。
結論と今後の研究
ファージは腸内細菌叢の重要なグループであり、ヒトの免疫反応の誘導や制御におけるその役割はまだ明らかになっていない。とはいえ、ファージは、特に腸疾患の治療において、効果的な治療手段として使用できる有望な可能性を示している。今後の研究によって、バクテリオファージがヒトの腸内細菌の種類や構成にどのような影響を与えるのか、また、病気の治療にどのように利用できるのかについての理解が深まることが期待される。研究が進展するにつれて、バクテリオファージが腸内細菌叢をどのように変化させ、ヒトの健康や病気に影響を及ぼすかについての知識が深まることが期待される。バクテリオファージと腸内細菌生態系における細菌との相互作用は、開発技術や計算手法の進歩により、より徹底的に特徴付けられるようになると予想される。その結果、従来の抗生物質に取って代わる可能性のある、カスタマイズされたファージ治療法が生み出され、善玉菌を守りながら多剤耐性菌を選択的に駆除できるようになるかもしれない。さらに、遺伝、栄養、ライフスタイルなどの変数を考慮することで、腸内細菌叢の個人差に対応する個別化されたファージベースの治療法が開発されるかもしれない。
ファージは、その可能性が十分に発揮されれば、より正確で成功する腸内細菌叢治療法となり、世界中の人々の健康状態の改善につながるかもしれない。このような治療法が広く使われるようになるには、その安全性と有効性を確認するための徹底的な研究と臨床試験が必要である。このように、細菌とファージの相互作用とヒト腸管における免疫学的反応との関連について理解を深めるためには、実験モデルや臨床試験を含むより多くの研究が必要である。
著者貢献
SSAが原稿を執筆し、図表を作成し、提出された原稿を承認した。
利益相反
著者は、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
Asiamah, E. K., Ekwemalor, K., Adjei-Fremah, S., Osei, B., Newman, R., and Worku, M. (2019). Natural and synthetic pathogen associated molecular patterns modulate galectin expression in cow blood. J. Anim. Sci. Technol. 61, 245-253. doi: 10.5187/jast.2019.61.5.245
クロスレフフルテキスト|Google Scholar
Baaziz, H., Baker, Z. R., Franklin, H. C., and Hsu, B. B. (2022). iScience(アイサイエンス)25:104146。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Bacaër, N. (2011). 数学的集団力学の短い歴史。London: Springer-Verlag, 55-58.
Google Scholar
Baron, M. (2022). ファージ療法: 過去、現在、そして未来。https://asm.org/Articles/2022/August/Phage-Therapy-Past,-Present-and-Future#
Google Scholar
Barr, J. J. (2017). 人体を巡るバクテリオファージの旅。Immunol. Rev. 279, 106-122.
クロスレフ・フルテキスト|Google Scholar
Batinovic, S., Wassef, F., Knowler, S. A., Rice, D. T. F., Stanton, C. R., Rose, J., et al. 自然環境および人工環境におけるバクテリオファージ。Doi: 10.3390/pathogens8030100.
クロスレフ・フルテキスト|Google Scholar
Boling, L., Cuevas, D. A., Grasis, J. A., Kang, H. S., Knowles, B., Levi, K., et al. 食事性プロファージ誘導剤と抗菌剤:ヒト腸内細菌叢のランドスケープに向けて。Gut Microbes 11, 721-734. doi: 10.1080/19490976.2019.1701353.
クロスレフ・フルテキスト|Google Scholar
Braga, L. P. P., Soucy, S. M., Amgarten, D. E., da Silva, A. M., and Setubal, J. C. (2018). ファージとの相互作用から見た細菌の多様化:遺伝的共生生物と生態学的種分化におけるその役割。Front. Ecol. doi: 10.3389/fevo.2018.00006
CrossRef フルテキスト|Google Scholar
Brisson, D. (2018). 負の頻度依存選択はしばしば交絡する。Front. Ecol. doi: 10.3389/fevo.2018.00010.
CrossRef フルテキスト|Google Scholar
Brives, C., and Pourraz, J. (2020). AMRとの闘いにおける潜在的解決策としてのファージ療法:障害と可能な未来。Palgrave Commun. 6:100. doi: 10.1057/s41599-020-0478-4
CrossRef 全文|Google Scholar
Cao, Z., Sugimura, N., Burgermeister, E., Ebert, M. P., Zuo, T., and Lan, P. (2022). 腸内ビローム:健康と疾患における新たなマイクロバイオーム構成要素。doi: 10.1016/j.ebiom.2022.104113.
クロスレフ・フルテキスト|Google Scholar
Chan, B. K., Abedon, S. T., and Loc-Carrillo, C. (2013). ファージカクテルとファージ療法の未来。Future Microbiol. 8, 769-783.
クロスレフ・フルテキスト|Google Scholar
Colavecchio, A., Cadieux, B., Lo, A., and Goodridge, L. D. (2017). バクテリオファージは、腸内細菌科の食品由来病原体における抗生物質耐性遺伝子の拡散に寄与している - 総説。Front. Microbiol. 8:1108. doi: 10.3389/fmicb.2017.01108.
クロスレフ・フルテキスト|Google Scholar
Corona, F., and Martinez, J. L. (2013). 抗生物質に対する表現型耐性。doi: 10.3390/antibiotics2020237.
CrossRef 全文|Google Scholar
Dahlman, S., Avellaneda-Franco, L., and Barr, J. J. (2021). ファージが腸内細菌叢を形成する?Curr. Opin. Biotechnol. doi: 10.1016/j.copbio.2020.09.016
クロスレフ・フルテキスト|Google Scholar
Davies, E. V., Winstanley, C., Fothergill, J. L., and James, C. E. (2016). 細菌感染における温帯バクテリオファージの役割。FEMS Microbiol. Lett. 363:fnw015. doi: 10.1093/femsle/fnw015
クロスレフ・フルテキスト|Google Scholar
de Sordi, L., Lourenço, M., and Debarbieux, L. (2019). 内なる戦い:消化管におけるバクテリオファージと細菌の相互作用。Cell Host Microbe 25, 210-218. doi: 10.1016/j.chom.2019.01.018.
PubMed Abstract|全文|Google Scholar
Doub, J. B. (2021). バクテリオファージ治療薬が遺伝物質を伝達し、エンドトキシン以外の汚染物質を含むリスクと臨床的に適切な緩和戦略。Infect. Drug Resist. 14, 5629-5637. doi: 10.2147/IDR.S341265.
クロスレフ・フルテキスト|Google Scholar
Duerkop, B. A. (2018). バクテリオファージが哺乳類微生物叢の焦点をずらす。PLoS Pathog. 14:e1007310. doi: 10.1371/journal.ppat.1007310.
クロスレフ・フルテキスト|Google Scholar
Federici, S., Nobs, S. P., and Elinav, E. (2021). ファージとそのマイクロバイオームおよび免疫制御の可能性。Cell. Mol. Immunol. 18, 889-904. doi: 10.1038/s41423-020-00532-4
クロスレフ・フルテキスト|Google Scholar
Feichtmayer, J., Deng, L., and Griebler, C. (2017). Antagonistic microbial interactions: Contributions and potential applications for controlling pathogen in the aquatic systems. Front. Microbiol. 8:2192. doi: 10.3389/fmicb.2017.02192.
クロスレフ・フルテキスト|Google Scholar
Fortier, L. C., and Sekulovic, O. (2013). 細菌病原体の進化と病原性に対するプロファージの重要性。doi: 10.4161/viru.24498.
CrossRef 全文|Google Scholar
Fortuna, M. A., Barbour, M. A., Zaman, L., Hall, A. L., Buckling, A., and Bascompte, J. (2019). 共進化ダイナミクスが細菌-ファージ感染ネットワークの構造を形成する。Evolution 73, 1001-1011. doi: 10.1111/evo.13731.
クロスレフ・フルテキスト|Google Scholar
Gilpin, W., and Feldman, M. W. (2017). Gilpin, W. and Feldman, M. W. (2017). A phase transition induces chaos in a predator-prey ecosystem with a dynamic fitness landscape. PLoS Comput. doi: 10.1371/journal.pcbi.1005644.
クロスリファレンス全文|Google Scholar
Guinane, C. M., and Cotter, P. D. (2013). 健康と慢性消化管疾患における腸内細菌叢の役割:隠れた代謝器官を理解する。Ther. Adv. Gastroenterol. 6, 295-308. doi: 10.1177/1756283X13482996
クロスレフ・フルテキスト|Google Scholar
Gummalla, V. S., Zhang, Y., Liao, Y. T., and Wu, V. C. H. (2023). 細菌病原性における温帯ファージの役割。doi: 10.3390/microorganisms11030541.
CrossRef 全文|Google Scholar
Gutiérrez, B., and Domingo-Calap, P. (2020). 消化器疾患におけるファージ療法。doi: 10.3390/microorganisms8091420.
クロスレフ・フルテキスト|Google Scholar
Hannigan, G. D., Duhaime, M. B., Koutra, D., and Schloss, P. D. (2018). Biogeography and environmental conditions shape bacteriophage-bacteria networks across the human microbiome. PLoS Comput. doi: 10.1371/journal.pcbi.1006099.
クロスレフ・フルテキスト|Google Scholar
Henrot, C., and Petit, M. A. (2022). 腸内細菌叢におけるプロファージ誘導を引き起こすシグナル。Mol. Microbiol. 118, 494-502. doi: 10.1111/mmi.14983.
CrossRef 全文|Google Scholar
Jansen, D., and Matthijnssens, J. (2023). 健康と炎症性腸疾患における腸内ウイルス群の新たな役割:課題、共変量体、ウイルスの不均衡。Doi: 10.3390/v15010173.
クロスレフ・フルテキスト|Google Scholar
Kirsch, J. M., Brzozowski, R. S., Faith, D., Round, J. L., Secor, P. R., and Duerkop, B. A. (2021). 腸内におけるバクテリオファージと細菌の相互作用:無脊椎動物から哺乳類まで。Ann. Rev. Virol. 8, 95-113. doi: 10.1146/annurev-virology-091919-101238
クロスレフ・フルテキスト|Google Scholar
Kohanski, M. A., Dwyer, D. J., and Collins, J. J. (2010). 抗生物質はどのように細菌を殺すのか:標的からネットワークへ。Nat. Rev. Microbiol. 8, 423-435.
CrossRef 全文|Google Scholar
Koskella, B., and Brockhurst, M. A. (2014). Bacteria-phage coevolution as a driver of ecological and evolutionary processes in microbial communities. FEMS Microbiol. 38, 916-931. doi: 10.1111/1574-6976.12072.
CrossRef 全文|Google Scholar
Larsson, D. G. J., and Flach, C. F. (2022). 環境における抗生物質耐性。Nat. Rev. Microbiol. 20, 257-269. doi: 10.1038/s41579-021-00649-x
CrossRef 全文|Google Scholar
Lecuit, M., and Eloit, M. (2017). 腸内細菌叢のウイルス。Microbiota Gastrointest. B, 179-183. doi: 10.1016/B978-0-12-804024-9.00021-5.
クロスレフ・フルテキスト|Google Scholar
Lin, D. M., Koskella, B., and Lin, H. C. (2017). Phage therapy: an alternative to antibiotics in the age of multi-drug resistance. World J. Gastrointest. Pharmacol. Ther. 8, 162-173. doi: 10.4292/wjgpt.v8.i3.162.
クロスレフ・フルテキスト|Google Scholar
Łobocka, M., Dąbrowska, K., and Górski, A. (2021). 工学的バクテリオファージ治療薬:理論的根拠、課題、将来。バイオ医薬品 35, 255-280.
クロスレフ・フルテキスト|Google Scholar
Loc-Carrillo, C., and Abedon, S. T. (2011). ファージ療法の長所と短所。バクテリオファージ 1, 111-114.
クロスレフ・フルテキスト|Google Scholar
Loganathan, A., Manohar, P., Kandasamy, E., VinodKumar, C. S., Leptihn, S., and Nachimuthu, R. (2021). グラム陽性菌感染症に対する画期的な治療法としてのファージ療法。Doi: 10.1186/s43088-021-00141-8.
クロスレフ・フルテキスト|Google Scholar
Łusiak-Szelachowska, M., Weber-Dąbrowska, B., Jończyk-Matysiak, E., Wojciechowska, R., and Górski, A. (2017). 消化管におけるバクテリオファージとその意義。Gut Pathogens 9:44. doi: 10.1186/s13099-017-0196-7
クロスレフ・フルテキスト|Google Scholar
Łusiak-Szelachowska, M., Weber-Dąbrowska, B., Zaczek, M., Borysowski, J., and Górski, A. (2020). 人体におけるバクテリオファージの存在:善か、悪か、それとも中立か?Microorganisms 8:2012.
CrossRef 全文|Google Scholar
Majewska, J., Kaźmierczak, Z., Lahutta, K., Lecion, D., Szymczak, A., Miernikiewicz, P., et al. 2種類の治療用ブドウ球菌バクテリオファージの経口投与によるファージ特異的抗体の誘導。Front. Immunol. 10:2607. doi: 10.3389/fimmu.2019.02607.
クロスレフ・フルテキスト|Google Scholar
Manohar, P., Tamhankar, A. J., Leptihn, S., and Ramesh, N. (2019). ファージ療法の薬理学的および免疫学的側面。Infect. Microbes Dis. 1:2. doi: 10.1097/IM9.000000000013
CrossRef 全文|Google Scholar
Marchi, J., Zborowsky, S., Debarbieux, L., and Weitz, J. S. (2023). iScience 26:106004. doi: 10.1016/j.isci.2023.106004.
クロスレフ・フルテキスト|Google Scholar
Martinez-Guryn, K., Leone, V., and Chang, E. B. (2019). 消化管マイクロバイオームの地域的多様性。doi: 10.1016/j.chom.2019.08.011.
クロスレフ・フルテキスト|Google Scholar
Mukhopadhya, I., Segal, J. P., Carding, S. R., Hart, A. L., and Hold, G. L. (2019). 腸内ビローム:腸内細菌と宿主免疫の間の「ミッシングリンク」?Ther. Adv. Gastroenterol. 12, 1-17. doi: 10.1177/1756284819836620
クロスレフ・フルテキスト|Google Scholar
Myers, J., Davis, J. II, Lollo, M., Hudec, G., and Hyman, P. (2023). 複数の宿主は、より広い宿主範囲のファージを選択しない。ウイルス 15:518.
クロスレフ・フルテキスト|Google Scholar
Nair, R. R., Vasse, M., Wielgoss, S., Sun, L., Yu, Y.-T. N., and Velicer, G. J. (2019). 細菌の捕食者と被食者の共進化はゲノム進化を加速し、病原性に関連する被食者の防御を選択する。Nat. Commun. 10:4301. doi: 10.1038/s41467-019-12140-6
パブコメ抄録|全文|Google Scholar
Naureen, Z., Dautaj, A., Anpilogov, K., Camilleri, G., Dhuli, K., Tanzi, B., et al. 自然界におけるバクテリオファージの存在と、細菌集団の自然淘汰におけるその役割。Doi: 10.23750/abm.v91i13-S.10819.
クロスレフ・フルテキスト|Google Scholar
Oechslin, F. (2018). バクテリオファージ治療中に起こるバクテリオファージに対する耐性発現。Doi: 10.3390/v10070351.
クロスレフ・フルテキスト|Google Scholar
Pargin, E., Roach, M. J., Skye, A., Papudeshi, B., Inglis, L. K., Mallawaarachchi, V., et al. ヒト腸内ビローム:組成、コロニー形成、相互作用、ヒトの健康への影響。Front. Microbiol. 14:963173. doi: 10.3389/fmicb.2023.963173.
クロスレフ・フルテキスト|Google Scholar
Principi, N., Silvestri, E., and Esposito, S. (2019). 細菌感染症の治療におけるバクテリオファージの利点と限界。Front. Pharmacol. 10:513. doi: 10.3389/fphar.2019.00513.
クロスレフ・フルテキスト|Google Scholar
Prisco, A., and De Berardinis, P. (2012). Filamentous bacteriophage fd as an antigen delivery system in vaccination. Int. J. Mol. Sci. 13, 5179-5194. doi: 10.3390/ijms13045179.
クロスレフ・フルテキスト|Google Scholar
Rogovski, P., Cadamuro, R. D., da Silva, R., de Souza, E. B., Bonatto, C., Viancelli, A., et al. 細菌制御ツールおよび環境安全性指標としてのバクテリオファージの利用。Front. Microbiol. 12:793135. doi: 10.3389/fmicb.2021.793135.
クロスレフ・フルテキスト|Google Scholar
Sanders, D. J., Inniss, S., Sebepos-Rogers, G., Rahman, F. Z., and Smith, A. M. (2021). 胃腸炎症におけるマイクロバイオームの役割。Biosci. doi: 10.1042/BSR20203850
クロスリファレンス全文|Google Scholar
Sausset, R., Petit, M. A., Gaboriau-Routhiau, V., and De Paepe, M. (2020). 腸内ファージに関する新たな知見。Mucosal Immunol. 13, 205-215.
クロスレフ・フルテキスト|Google Scholar
Scanlan, P. D. (2017). Bacteria-bacteriophage coevolution in the human gut: implications for microbial diversity and functionality. Trends Microbiol. 25:12. doi: 10.1016/j.tim.2017.02.012.
クロスレフ・フルテキスト|Google Scholar
Scanlan, P. D. (2020). 抵抗は無駄かもしれない:腸の空間的不均一性が細菌とファージの共存を支えている。細胞宿主微生物 28, 356-358.
CrossRef 全文|Google Scholar
Scarpellini, E., Laniro, G., Attili, F., Bassanelli, C., De Santis, A., and Gasbarrini, A. (2015). ヒト腸内細菌叢とビローム:潜在的な治療的意味合い。Dig. Liver Dis. 47, 1007-1012. doi: 10.1016/j.dld.2015.07.008.
クロスレフ・フルテキスト|Google Scholar
Shkoporov, A. N., Clooney, A. G., Sutton, T. D. S., Ryan, F. J., Daly, K. M., Nolan, J. A., et al. ヒト腸内ウイルソームは高度に多様で安定であり、個体特異的である。Cell Host Microbe 26, 527-541.
クロスレフ・フルテキスト|Google Scholar
Shuwen, H., and Kefeng, D. (2022). 腸内ファージは細菌と相互作用し、ヒトの疾患に関与する。Gut Microbes 14:2113717.
クロスレフ・フルテキスト|Google Scholar
Silva-Gomes, S., Decout, A., and Nigou, J. (2014). 「病原体関連分子パターン(PAMPs)」炎症性疾患百科事典 M. Parnham編(バーゼル:Birkhäuser.)
Google Scholar
Sinha, A., and Maurice, C. F. (2019). バクテリオファージ:免疫系の未解明で動的な制御因子。Mediat. doi: 10.1155/2019/3730519.
クロスレフ・フルテキスト|Google Scholar
Spencer, L., Olawuni, B., and Singh, P. (2022). 腸内ウイルス:健康と消化器疾患における役割と分布。Front. Cell. Infect. Microbiol. 12:836706.
クロスレフ・フルテキスト|Google Scholar
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. Jr. (2001). バクテリオファージ療法。Antimicrob. Agents Chemother. 45, 649-659. doi: 10.1128/AAC.45.3.649-659.2001.
クロスレフ・フルテキスト|Google Scholar
Sutton, T. D. S., and Hill, C. (2019). 腸内バクテリオファージ:現在の理解と課題。Front. Endocrinol. 10:784. doi: 10.3389/fendo.2019.00784.
クロスレフ・フルテキスト|Google Scholar
Tiamani, K., Luo, S., Schulz, S., Xue, J., Costa, R., Mirzaei, M. K., et al. 消化管とそれ以外におけるビロームの役割。FEMS Microbiol. 46, 1-12. doi: 10.1093/femsre/fuac027
CrossRef 全文|Google Scholar
Townsend, E. M., Kelly, L., Muscatt, G., Box, J. D., Hargraves, N., Lilley, D., et al. ヒト腸内ファージオーム:ヒト腸内細菌叢における起源と役割。Front. Cell. Infect. Microbiol. 11:643214. doi: 10.3389/fcimb.2021.643214
クロスレフ・フルテキスト|Google Scholar
Van Belleghem, J. D., Dąbrowska, K., Vaneechoutte, M., Barr, J. J., and Bollyky, P. L. (2018). バクテリオファージ、細菌、哺乳類免疫系間の相互作用。ウイルス 11:10.
CrossRef 全文|Google Scholar
Voigt, E., Rall, B. C., Chatzinotas, A., Brose, U., and Rosenbaum, B. (2021). ファージ戦略は環境変動下での細菌の共存を促進する。doi: 10.7717/peerj.12194.
クロスレフ・フルテキスト|Google Scholar
Xu, H.-M., Xu, W.-M., and Zhang, L. (2022). 感染症に対するファージ療法の現状と感染症以外への応用の可能性。Int. J. Clin. doi: 10.1155/2022/4913146.
クロスレフ・フルテキスト|Google Scholar
Zhang, Y. J., Li, S., Gan, R. Y., Zhou, T., Xu, D. P., and Li, H. B. (2015). 腸内細菌がヒトの健康と病気に及ぼす影響。Int. J. Mol. Sci. 16, 7493-7519. doi: 10.3390/ijms16047493.
CrossRef フルテキスト|Google Scholar
Zuo, T. (2018). ヒトの健康と疾患における腸内ビロームの解明。Int. J. Clin. Virol. 2018, 1-3. doi: 10.29328/journal.ijcv.1001002
クロス・リーフ・フルテキスト|Google Scholar
Zuo, T., and Ng, S. C. (2018). 炎症性腸疾患の病因と治療における腸内細菌叢。Front. Microbiol. 9:2247. doi: 10.3389/fmicb.2018.02247.
CrossRef フルテキスト|Google Scholar
Zuppi, M., Hendrickson, H. L., O'Sullivan, J. M., and Vatanen, T. (2022). 腸内生態系におけるファージ。Front. Cell. Infect. Microbiol. 11:822562.
クロスリファレンス全文|Google Scholar
キーワード:ファージ、消化管、腸内細菌叢、相互作用、多様性、溶菌、溶原性
引用 ヒト腸内細菌の組成と多様性の形成におけるバクテリオファージの役割。Front. Microbiol. 14:1232413.
受理された: 2023年6月1日;受理された: 2023年8月17日;
発行:2023年9月19日
編集者
マイケル・トラビサーノ(ミネソタ大学ツインシティーズ校、米国
査読者
Ewansiha Uyi, モディボ・アダマ工科大学, ナイジェリア
ナガ・ラジュ・マデラ(マナビ工科大学、エクアドル
アリユ・イブラヒム・ダバイ(クイーンズ大学ベルファスト、イギリス
著作権 © 2023 Alkhalil. 本記事は、クリエイティブ・コモンズ 表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められた慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Samia S. Alkhalil, salkhalil@su.edu.sa
免責事項:本論文で表明されたすべての主張は、あくまでも著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または支持されるものではありません。
こんな人も見ています
トリパノソーマ・コンゴレンセ感染、貧血発症、トランスシアリダーゼ(TconTS1)遺伝子発現に対するβ-シトステロール治療の有効性
Suleiman Aminu, Gloria Chechet, Samia S. Alkhalil, Mansour Sobeh, Rachid Daoud, Mthokozisi BC Simelane, Elewechi Onyike, Mohammed Auwal Ibrahim
Myxococcus属とPyxidicoccus属の比較ゲノム解析: Myxococcus guangdongensis sp. nov., Myxococcus qinghaiensis sp. nov., Myxococcus dinghuensis sp. nov., Pyxidicoccus xibeiensis sp. nov.
王春凌、呂英瑛、周連、張玉聯、姚青、朱宏輝
消化管内微生物バイオフィルムと慢性粘膜疾患とのクロストーク
王玉盟、徐世熙、何秋栄、孫坤、王暁完、張暁瑞、李玉清、曾菊梅
食道疾患における食道細菌叢
銭鄒、馮麗娟、蔡迅超、銭雲、徐龍
プラトーピカ糞便微生物叢移植は大腸炎モデルマウスにおける炎症性腸疾患の症状を改善する
楊雅媛、崔白強、呂彦安、沈文祥、馮敏、丁雪芝、董鵬成、王玉
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
