糞便微生物叢移植は2型糖尿病のインスリン抵抗性を逆転させる: ランダム化比較前向き研究
本文へスキップ
トップバーナビゲーション
細胞・感染微生物学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
5,396
総閲覧数
2,411
ダウンロード
9
引用
記事のインパクトを見る
記事のaltmetricスコアは7
オリジナル研究論文
Front. Cell. Infect. 微生物学、2023年01月04日
Sec.腸内マイクロバイオーム
第12巻 - 2022年|https://doi.org/10.3389/fcimb.2022.1089991
この論文は次の研究テーマの一部です
免疫関連疾患における腸内細菌とその代謝産物の役割
全12記事を見る
糞便微生物叢移植は2型糖尿病のインスリン抵抗性を逆転させる: ランダム化比較前向き研究
https://www.frontiersin.org/articles/10.3389/fcimb.2022.1089991/full

Zezhen Wu1,2,3† Bangzhou Zhang2,4† Fengwu Chen1,2† Rongmu Xia5† Dan Zhu2 Baolong Chen2 Aiqiang Lin2 Chuyan Zheng2 Ducheng Hou2 Xiaoyu Li2 Shuo Zhang1,2,3 Yongsong Chen1*‡ Kaijian Hou1,2,6*‡ 1内分泌科
1中国、汕頭市、汕頭大学医学院第一付属病院内分泌代謝疾患科
2中国汕頭市龍湖病院内分泌代謝疾患科
3汕頭大学医学院(中国広東省汕頭市
4福建中医薬大学薬学院(中国・福州市
5福建中医薬大学第二附属病院臨床研究センター(中国福州市
6中国、汕頭市、汕頭大学公衆衛生学院
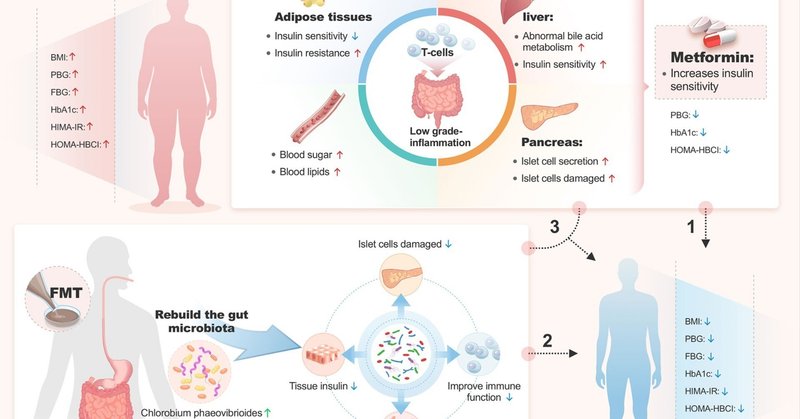
目的 最近の研究で、糞便微生物叢移植(FMT)が2型糖尿病(T2DM)患者の代謝プロファイルを改善することが示されているが、T2DM患者のインスリン抵抗性を回復させ、メトホルミン感受性を高める効果は報告されていない。本研究では、FMT単独およびFMT+メトホルミンによるT2DM患者とその腸内細菌叢の改善について評価した。
方法 新規にT2DMと診断された計31名の患者を、メトホルミンによる介入、FMT、FMT+メトホルミンに無作為に割り付けた。患者はベースライン時と治療後4週目に追跡された。血液サンプルと便サンプルを採取し、それぞれ臨床パラメータとメタゲノムシークエンシングによる微生物群集の解析の対象とした。
結果 FMT単独およびFMT+メトホルミンは、T2DMの臨床指標であるHOMA-IRとBMIを有意に改善し、さらに空腹時血糖、食後血糖、ヘモグロビンA1cもメトホルミンによってコントロールされた。ドナーの微生物叢はT2DMに効果的にコロニー形成され、4週間以内にFMT+メトホルミンよりもFMTの方がコロニー形成率がわずかに高く、その結果、治療後に微生物の多様性とコミュニティがベースラインから変化した。FMTおよびFMT+メトホルミン投与後に、それぞれ227種および441種が有意に注意喚起された。FMTは臨床パラメータと有意に関連していた。その中で、Chlorobium phaeovibrioides、Bifidibacterium adolescentis、Synechococcus sp.WH8103は、HOMA-IRと有意に負の相関を示したことから、その可能性が考えられた。
結論 メトホルミンを併用したFMTは、ドナー由来の微生物叢のコロニー形成により、T2DM患者のインスリン抵抗性、肥満度および腸内細菌群集を有意に改善した。
1 はじめに
2型糖尿病(T2DM)は、膵β細胞量と機能の低下を特徴とする代謝疾患であり、インスリン抵抗性の恒常性モデル評価(HOMA-IR)状態の高いインスリン需要を補うことができないことを表している(Aguayo-Mazzucatoら、2019)。HOMA-IRの発生は、T2DM発症の重要な予測因子である(Wallace et al.) T2DMの世界的有病率は驚くほど高く、推定人口は3億7000万人で、2030年までに倍増すると予測されている(Wildら、2004年)。このようなT2DMの激増は、公衆衛生上の危機であり、医学的課題でもある。最近の研究では、腸内細菌異常症が代謝性内毒素血症およびT2DM発症の重要な因子であることが示された(Zhaoら、2018;Thingholmら、2019;Wuら、2022)。
ヒトの腸には、腸内細菌(Skellyら、2019)、ウイルス(Ingleら、2019)、真菌(Liら、2019)、原生生物(Chudnovskiyら、2016)の複雑なコミュニティが存在する。最近のデータでは、腸内細菌の異常がメタボリックシンドローム、特にT2DMの発症と関連していることが確認されている(Karlssonら、2013;Queら、2021;Houら、2022)。糖尿病患者における腸内細菌叢の組成と量は、健常者とは異なることが判明している(Marchesiら、2016;Chenら、2019)。現在の研究では、腸内細菌叢がさまざまなメカニズムを介して糖尿病における肥満やインスリン抵抗性の発症に関与していること、多くの血糖降下薬が腸内細菌叢の変化をもたらすことが示されている(Suら、2015;Liら、2017)。メトホルミンは現在、T2DM治療に広く使用されており、最近のエビデンスでは、腸内細菌叢がメトホルミンの作用部位として機能することが示唆されている(Pollak, 2017; Rodriguez et al.) Sunらは、メトホルミンがB. fragilis-グリコールソデオキシコール酸(GUDCA)-腸内ファルネソイド-X受容体(FXR)軸を介して部分的に作用し、代謝機能不全を改善することを示した(Sunら、2018)。糖尿病における糞便微生物叢移植(FMT)の治療可能性は、多くの論文で議論されている(Wangら、2019;Aron-Wisnewskyら、2019;Ngら、2022;Houら、2022)。例えば、Grootらは、FMTが内因性インスリン産生の低下を食い止めることができ、特徴的な腸内細菌叢が1型糖尿病(T1DM)患者のβ細胞機能の残存と関連していることを明らかにした(de Grootら、2021)。Siewらは、T2DMの肥満患者においてFMTを繰り返すと、微生物叢の生着レベルと生着期間が向上すると報告している(Ngら、2022)。しかし、T2DM治療におけるメトホルミンの有効性を補助するためのFMTの応用を報告した研究はない。そこで、われわれの研究の目的は、中国南東部のT2DM患者集団において、メトホルミンとFMTの併用療法を評価することであった。
我々は、FMTがT2DM患者の微生物生態系を変化させ、その後、血糖値とインスリン感受性を改善することを提案した。T2DM患者にメトホルミン、FMT単独、FMT+メトホルミンを介入させるFMT臨床試験を開始した。主要アウトカムは、ベースライン時と介入4週後におけるインスリン感受性(HOMA-IRおよびHOMA-HBCI)、食後血糖(PBG)、空腹時血糖(FBG)、ヘモグロビンA1c(HbA1c)、BMIの変化の評価であった。副次的アウトカムは、4週目にFMT後にドナーからの微生物叢を少なくとも20%獲得した被験者の割合であった。
2 材料と方法
2.1 研究対象者
2019年の米国糖尿病学会(ADA)のT2DMの診断基準に従い、29名の成人T2DM患者を募集した。スクリーニング前に全患者から書面によるインフォームドコンセントを得た。すべての患者は試験への参加を志願し、良好なコンプライアンスを示し、試験サイクルにおいて糖尿病薬を置き換えることはなかった。他の診断を受けている患者は除外した: 1)急性および慢性感染症、胃腸疾患、重篤な心機能不全、重篤な肝機能不全、腎機能不全、および/またはその他の疾患または合併症、2)薬物吸収に影響を及ぼす可能性のあるその他の胃腸疾患、3)妊娠中および授乳中の女性、4)アレルギーのある人、5)過去3ヵ月以内に他のホルモン療法を使用したことのある患者、6)白血球減少症または顆粒球異常; 7)過去3ヵ月以内に初めて発症した心血管疾患および脳血管疾患、8)同期間に他の臨床試験に参加した者、9)検査室スクリーニング後のヒト免疫不全ウイルス(HIV)血清陽性歴、10)検査室スクリーニング後のB型肝炎ウイルス表面抗原(HBsAg)陽性歴またはC型肝炎ウイルス抗体(HCV-Ab)陽性歴。この期間中、研究チームは参加者全員に対し、総カロリー、種類、食文化など、介入前後で元の食習慣を維持し、軽度から中等度の身体活動(強度は同じ)を維持し、激しい身体活動を避けるよう指導した。本研究は、中国汕頭市の汕頭大学医学院第一付属病院龍湖病院倫理委員会(倫理番号:LHLL2019001)により承認され、Chinses Clinical Trial Registry(登録番号:ChiCTR1900024636)に登録された(http://www.chictr.org.cn/showprojen.aspx?proj=41166)。
2.2 研究計画と結果
本研究では、メトホルミンのみ、FMTのみ、FMTとメトホルミンの併用によるT2DM患者の治療効果を比較するために、補助的な方法としてFMTを用いた。8名のT2DM患者がFMT+メトホルミン治療を受け、9名の患者がFMT単独治療を受け、12名の患者がメトホルミン単独治療を受けた。第一の研究目的は、T2DM成人患者におけるメトホルミン治療の補助としてのFMTの有効性を、血糖コントロールとインスリン抵抗性の側面から評価することであった。副次的研究目的は、ベースライン検査および介入4週目におけるドナー微生物叢からの細菌生着に対するFMTの影響を観察することであった。我々は、レシピエントで同定された微生物叢種を4つのタイプに分類し、主に、以前に定義されたドナー関連種に注目した(Ngら、2022)。
2.3 介入手順
試験ドナーのスクリーニングは、過去の報告(Wuら、2020;Heら、2021)に基づいた。適格ドナー10名の腸内細菌叢は、糞便微生物叢抽出器TG-01(Treat-gut社、広州、中国)を用いて自動的に分離した。手順は、便と生理食塩水を混合し、孔径の異なる複数回の濾過を行い、厦門のTreat-gut Biotechnology Co. 経鼻空腸栄養チューブによるFMTが、介入前と介入4週間後の臨床表現型と腸内細菌叢に及ぼす影響を検討した。介入は、メトホルミン、FMT単独、FMT+メトホルミンから構成された。FMTでは、移植前に胃が4時間以上空であることを確認した後、50gの細菌スラッジを含むFMT溶液200mLを経鼻腸管から前空腸に注入した。位置はX線検査で確認した。FMTの2時間後、参加者に少量の流動食を摂取させた。ベースライン時(0週目)と介入後4週目に全参加者の血液と便を採取し、生化学的評価と微生物相評価を行った。
2.4 メタゲノム配列決定による糞便微生物叢解析
ドナーとT2DM患者の糞便サンプルは健康診断当日に採取し、直ちに-80℃で凍結した。QIAamp Fast DNA Stool Mini Kit(Qiagen, CA, USA)を用いて糞便ゲノムDNAを抽出した。DNAサンプルは、次世代シーケンスライブラリー調製のテンプレートとして使用する前に-20℃で保存した。サンプルは平均400 bpのインサートサイズに断片化し、PE 150試薬を用いてIllumina Nova seqでシーケンスした。リードはKneadDataを用いてデフォルトパラメータでトリミングし、シーケンスアダプター、低品質リード、ヒトゲノムをフィルターした。分類学的構成はkraken2 (Erem et al., 2014)を用い、デフォルトパラメーターで処理した。
2.5 統計解析
微生物群のα多様性ShannonおよびChao1は、Rプログラムパッケージ「vegan」(バージョン2.5.6)を用いて算出した。β多様性指標はrdaとadonis関数を用いたPERMANOVAで求めた。主成分分析(PCA)はパッケージveganを用いて行った。異なるグループにおいて存在量が異なる分類群を同定するために、異なる分析を行った(Krentz and Bailey, 2005)。corr.test関数を用いて、微生物分類群と臨床指標との相関を分析した。統計的有意性はp値<0.05とした。
3 結果
3.1 研究集団の特徴
合計36名のT2DM患者が適格性を評価され、そのうち31名が採用され、2019年7月から2021年10月にかけてFMT+メトホルミン、FMT単独、メトホルミンのいずれかに無作為に割り付けられた。FMT+メトホルミン群、FMT単独群ともに1人がFMT注入後に離脱している。最終的に、FMT+メトホルミン群(n=8)、FMT単独群(n=9)、メトホルミン群(n=12)に割り付けられた29人の患者が、ベースライン時と4週目の両方で追跡評価を完了した(図1)。3群の患者の人口統計学的特徴は同等であった。男性は患者の48.3%(n=14)を占め、FMT+メトホルミン群、FMT単独群、メトホルミン群のBMI中央値はそれぞれ27.46、27.29、27.01kg/m2であった。10名の健常ドナー(90%男性、BMI中央値:21.56kg/m2)がFMT溶液用の便を提供した。
図1
www.frontiersin.org
図1 試験の流れのコンソート図。FMT、糞便微生物叢移植。
3.2 介入後の血糖値、インスリン抵抗性、BMIの改善
3つの治療群の参加者は、介入後4週目に空腹時血糖値(FBG)、食後血糖値(PBG)、ヘモグロビンA1c(HbA1c)、HOMA-HBCIがベースラインと比較して有意に(P<0.05)改善した(表1)。さらに重要なことは、FMT単独群とFMT+メトホルミン群では、FMT介入後4週目のHOMA-IR(p<0.05)とBMI(p<0.05)が有意に低下したが、メトホルミン群では差は認められなかったことである(表1)。FMT+メトホルミン群では、UA、TG、グロブリンが有意に低下した(図2)。
表1
www.frontiersin.org
表1 本研究に含まれる臨床データ。
図2
www.frontiersin.org
図2 FMTがインスリン抵抗性を改善する一般的なメカニズム。
さらに、3群間の変化の大きさを評価した。PBG、FBG、HOMA-IR、BMI、AST/ALTおよびALPの改善率は、FMT単独群およびFMT+メトホルミン群でメトホルミン群よりも有意に高かった(p<0.05)(図3)。HOMA-HBCI、HbA1c、AST、TBAおよびTPの改善は、メトホルミン群よりもFMT単独群で有意に高く観察された。さらに、FBGとHbA1cはFMT単独群よりもFMT+メトホルミン群でより低下した。PBG、PINS、HOMA-IR、HOMR-HBCI、AST/ALT、ALP、TBA、TPおよびBMIの変化には、2つのFMT関連治療間で有意差は認められなかった(p>0.05)(図3)。
図3
www.frontiersin.org
図3 異なる介入を受けたT2DM患者における、4週目を0週目とした臨床指標の倍数変化。群間の一対比較はWilcox検定を用いて行った。メトホルミン、n=12人;FMT、n=9人;FMT+メトホルミン、n=8人。p<0.05を統計的に有意と定義した。
3.3 FMT介入に伴う微生物叢の変化
微生物の豊富さ(観察された分類群およびChao1)およびシャノン多様性は、FMT後4週目にベースラインと比較して明らかに(P<0.05)改善したが、その有意性はわずかであった。さらに、均等性はFMT単独群ではFMTにより4週目に有意に(P<0.05)増加した(図4A)。メトホルミン投与群では、多様性指標に明らかな変化は認められなかった。予想されたように、ドナー単独またはサンプル全体では、バクテロイデーテス(Bacteroidetes)、ファーミキューテス(Firmicutes)、プロテオバクテリア(Proteobacteria)が支配的な分類群であった(図4B)。FMT単独群とFMT+メトホルミン群の両方で、介入後にBacteroidetesの相対存在量が減少し、Firmicutesが増加した。メトホルミン投与後4週目には、プロテオバクテリア(Proteobacteria)の割合が驚くほど高く、バクテロイデーテス(Bacteroidetes)がほとんど見られないという、珍しい微生物組成が観察された。
図4
www.frontiersin.org
図4 介入後のT2DM患者における0週目と4週目の腸内細菌叢の変化。(A)α多様性指数、微生物の豊かさ(Observed指数とChao1指数)、シャノン多様性、均等性の違い。(2型糖尿病患者における腸内細菌叢の変化とドナー由来微生物叢のコロニー形成。(C)メトホルミン、FMT、FMT+メトホルミンによる介入後のベースライン(W0)と4週目(W4)のβ多様性の違いをPCAで可視化した。(D、F)FMT単独群とFMT+メトホルミン群におけるドナー由来微生物叢のコロニー形成。(E)W0とW4の間のユークリッド距離の変化。(G)W4とドナー間のユークリッド距離の変化。
3.4 βダイバーシティと微生物コロニー形成
ユークリッド距離に基づくβ-多様性の結果から、3つの処理で腸内細菌叢が0週目と比較して4週目に変化していることが示された。FMT+メトホルミン群の腸内微生物群集は、4週目と0週目で有意差(PERMANOVA、p<0.05)を示したが、FMT単独群とメトホルミン群では有意差はなかった(図4C)。3群の中で、4週後のβ多様性の変化はメトホルミン群が最も小さく、次いでFMT群、FMT+メトホルミン群が最も大きかったが、3群間で有意差が認められた(図4E)。同様に、3群それぞれの4週目とドナーとのユークリッド距離を算出した。その結果、メトホルミン投与群とドナーとの距離が最も大きく、FMT+メトホルミン投与群が最も小さかったことから、FMT+メトホルミン投与群の腸内細菌叢は治療後のドナーの腸内細菌叢と類似していることが示された(図4G、図5)。
図5
www.frontiersin.org
図5 ドナーとレシピエントの腸内細菌叢相関率。有効な生着が認められた被験者: ドナー関連微生物叢が20%以上の被験者の割合。
FMT単独群とFMT+メトホルミン群の全レシピエントのFMT後サンプルにおいて、ドナー由来微生物種のコロニー形成を解析・検出したところ、その割合は3.1%~73.7%であった。その結果、FMT群では6例(66.7%)、FMT+メトホルミン群では5例(62.5%)がドナー由来微生物種20%以上を達成し、有効コロニー形成と考えられた。しかし、両群間でコロニー形成率に有意差は認められなかった(p>0.05)(図4D、F)。
3.5 臨床的改善と有意に関連する分類群
臨床効果の改善に関連する分類群を調べるため、FMT単独群とFMT+メトホルミン群のベースライン時と介入後4週目の差をWilcoxon-rank和検定で解析した。その結果、FMT単独群では介入後7門、57科、133属で有意差(p<0.05)が認められたのに対し、FMT+メトホルミン群では10門、63科、206属であった(表S1)。相対存在量を0.001%より大きくカットオフすると、FMT単独群とFMT+メトホルミン群でベースライン時と4週目との間に有意な差が認められたのは、それぞれ227種と441種であった。そのうち89種はこれら2群で共通していた(図6)。投与4週目に相対量が増加した菌種は主にPrevotella属とBifidobacterium属に属し、Prevotella jejuni、Prevotella Fusca、Bifidobacterium animalis、Bifidobacterium adolescentisが含まれた。これら2つのグループの検体に基づく相関分析によると、プロベテラはALPおよびTPと正の相関を示し、ビフィズス菌はCHE、FBG、PBG、TCおよびPINSと負の相関を示した(図7A)。さらに、Collinella aerofaciensはFBGと強い負の相関を示し、PGBはClostridium bolteaeと強い正の相関を示し、HOMA-IRはDysosomobacter Wekbionisと強い正の相関を示した(p < 0.05)。
図6
www.frontiersin.org
図6 FMT単独群とFMT+メトホルミン群の間で共通して有意に異なる菌種。
図7
www.frontiersin.org
図7 介入後に有意に変化した微生物種と臨床指標との相関。(A)FMTまたはFMT+メトホルミン後に有意に変化した上位30種と、これら2群のW0およびW4の検体に基づく臨床指標との相関。(B)メトホルミン投与群、FMT単独投与群、FMT+メトホルミン投与群のT2DM患者のW0とW4の全サンプルに基づく、HOMA-IRと相対存在量が0.001%より大きい有意に変化した生物種との間の有意な補正。(C)HOMA-IRと有意に関連する4つの腸内微生物。「はP値が0.05未満であることを意味する。
HOMA-IRの改善はT2D治療において急務であるため、我々はさらに、ベースライン時と介入後4週目のT2DM患者からのサンプルに基づいて、HOMAR-IRとFMT後またはFMT+メトホルミン後のいずれかに有意差のある菌種との相関解析を行い、菌種を探索した。その結果、有意に関連した菌種の多くは、Lactobacillus ruminis、D. welbioisおよびXylanimicrobium sp.FW10M-9を含むHOMA-IRと正の相関を示した(図7B)。一方、Chlorobium phaeovibrioides、B. adolescentisおよびSynechococcus sp.WH8103はHOMA-IRと強い負の相関を示し、これらはFMTまたはFMT+メトホルミンによる介入後4週目に増加した(図7C)。
4 考察
本研究は、メトホルミンと比較して、FMT単独およびFMT+メトホルミンによるT2DM患者とその腸内細菌叢の改善を評価することを目的とした。その結果、FMT単独およびFMT+メトホルミンは、介入後4週間以内にインスリン抵抗性(HOMA-IR)、HOMA-HBCI、BMI、FBG、PBGを有意に改善し、ドナー由来の微生物叢のコロニー形成により腸内細菌叢を変化させた。相関解析の結果、B. adolescents、C. phaeovibrioides、S. sp.WH8103は、T2DM治療の緊急指標であるHOMA-IRと有意な負の相関を示した。つまり、本研究は、FMT単独およびFMT+メトホルミンが、ドナー由来の微生物をコロニー形成し、腸内細菌叢の多様性および特定種を改変することにより、T2DM患者のインスリン抵抗性および他の指標を改善できることを支持するものである。
メトホルミンは、低血糖および/または体重増加のリスクを伴わずに血糖プロファイルを改善し、心血管死亡率を低下させることから、現在、臨床ガイドラインで推奨されているように、T2DM患者の治療の第一選択薬として広く使用されている(Buseら、2016;Foretzら、2019)。以前の研究では、メトホルミンは最初の4ヵ月の試験期間中にBMI、HbA1c、FBGを低下させたことが示されている(Shinら、2014年)。別の52週間の研究では、血糖介入にメトホルミンを使用した新規診断T2DM患者は、MET群でベースラインと比較して治療後にBMI、FPG、PPG、HbA1cが有意に低下した(DeFronzoら、2016年)。本研究でも、メトホルミン介入後にT2DMのHbA1cとFBGが改善することが観察されたが、BMIやHOMA-IRを含む他の指標は改善せず、FMT単独とFMT+メトホルミンで改善した。これは、FMTが末梢のインスリン感受性および血糖コントロールを改善する他のメカニズムと関連している可能性がある一方、METは主に肝グルコース産生を低下させることにより肝臓で役割を果たす(Wuら、2017)。メトホルミンの役割の過程には、腸内細菌叢と一定の関係があることを示す研究が増えている。メトホルミンの静脈内投与は血糖値を改善しない(de la Cuesta-Zuluaga et al.、2017)。しかし、腸内のメトホルミン濃度は血清中の100~300倍であり、腸はヒトにとってジメチルレンジアミンの主な貯蔵庫となっている(Carvalho and Saad, 2013; Duparc et al., 2017; Depommier et al.) さらに、メトホルミンは、ムチンによって分解されるSCFA(短鎖脂肪酸)の産生を刺激する微生物叢であるAkkermansiamuciniphilaを増加させることによって、腸内細菌叢の組成を変化させることもできる(Maら、2019)。SCFAの産生と調節は、健康結果を促進するプロバイオティクスのメカニズムの1つと考えられている(Hartstraら、2015)。我々の実験では、FMT単独群のFBGとHbA1cは、FMT+メトホルミン群のそれよりも減少しており、これはメトホルミンによって促進された微生物集団構造の改善に関連している可能性がある。
我々のコホートに組み入れられた患者はT2DMと診断され、以前に定期的な薬物治療や食事介入を受けていなかった。これらのT2DM患者は、血糖コントロール不良または重篤なインスリン抵抗性を有し、他の疾患の治療のために他の薬剤を受けていなかった。観察期間中、登録された患者は日常生活活動以外の運動は行わず、一般的に一貫した食事調節を受けた。このデザインにより、腸内細菌叢に影響を与えることが知られている主要な交絡因子の影響を減少させることができた。臨床的には、すべてのT2DM患者がメトホルミンの使用から利益を得たり、メトホルミンにすぐに反応したりするわけではない。例えば、メトホルミン治療にもかかわらず、強いインスリン抵抗性と弱いインスリン分泌機能を示す患者もいる。そこで、このような患者のメトホルミン治療を補助し、メトホルミンに対する感受性を速やかに改善するためにFMTが用いられた。
本研究では、メトホルミンは血糖を改善することができるが、FMTを加えることでさらに改善が促進されることが示された。腸内細菌叢がグルコース代謝(Mussoら、2011年)、インスリン抵抗性(Leeら、2019年)、インスリン分泌(Kootteら、2017年)と密接に関連していることは、多くの研究で示されている。T2DMにおける腸内細菌叢の原因的役割に関する証拠が積み重なったことで、微生物組成を変化させることを目的とした標的治療アプローチが開発されるに至った(Vriezeら、2012;Rinottら、2021)。糞便微生物叢移植(FMT)は、腸内細菌叢を再構築することで疾患を治療する方法である(Wuら、2011)。FMTは一貫して、腸内細菌叢に対する深い持続的な効果によって腸内細菌叢異常を克服する能力を示しており、T2DMを治療する新たな方法となる可能性がある(Belenguerら、2006年)。メタボリックシンドロームの治療にFMTを用いた以前の実験では、メタボリックシンドローム患者において、FMTがインスリン感受性を改善し、腸内微生物の多様性を高め、酪酸産生菌を有意に増加させることが示された(Tolhurstら、2012;Yadavら、2013)。我々の結果は、メタボリックシンドローム患者における一過性の除脂肪ドナー-9腸内細菌叢に関する以前の知見と一致しており、6週間後に末梢インスリン感受性の有意な改善を示した(Belenguerら、2006年)。FMT後4週間で相対存在量が増加した菌種は主にruminisに属し、D. welbioisおよびXylanimicrobium sp.FW10M-9はHOMA-IRと有意な負の相関を示したが、Chlorobium phaeovibrioides、B. adolescentisおよびSynechococcus sp.WH8103はHOMA-IRと強い負の相関を示した。これまでの研究で、脂肪分の多い食事の長期摂取はバクテロイデスの増加に関係し、ベジタリアンはプロクター桿菌の増殖を助長することが示されている。また、プロブレラは食物繊維によって誘導される耐糖能の改善と関連していることが判明している(Suら、2022年)。一方、ビフィズス菌は炭水化物発酵中に酢酸と乳酸を産生し、それらは他の腸内細菌叢によって酪酸に変換される(Li et al.、2016)。中でも酪酸は、インスリン分泌の調節に重要な役割を果たしている(Turnbaughら、2009;Giongoら、2011)。我々の結果は、プラスモバクテリウムとビフィズス菌がT2DM改善に関連する重要な生物である可能性を再び示しており、これは他の研究者(Aggarwalaら、2021年)の先行研究と一致している。
FMTの実施中に、レシピエントにおいてドナー関連微生物叢が適切に生着することは、FMTの有効性を保証する前提条件の一つである。一般に、腸内細菌叢の多様性は腸の健康と密接な関係があると考えられており、レシピエントにおけるドナー細菌叢のコロニー形成率は移植の成功率を評価する重要な指標である。本研究では、FMT群とFMT+メトホルミン群の約2/3がドナー由来微生物種20%以上の目標値に達しており、他の先行研究(Herfarth et al., 2019)と比較して23と有意に増加していた。これは効果的なコロニー形成と考えられ、移植前の厳格なドナー選択と密接に関係している。これまでの研究で、糖尿病患者のファーミキューテス菌数は非糖尿病患者よりも少ないことが示されている(Mocanuら、2021)。糖尿病の進行は、ファーミキューテス類とバクテロイデーテス類の減少に関連している(Mayo and Sinderen, 2010)。ファーミキューテスは通常、栄養素の輸送に関与し、難消化性炭水化物のSCFAの吸収と発酵を促進する(Pinzone et al.) 我々の臨床実験では、FMT後4週目に、微生物の豊富さ(観察された分類群およびChao1)とシャノン多様性がベースラインと比較して有意に改善した。FMT群およびFMT+8メトホルミン群では、バクテロイデーテス属の相対量が減少し、ファーミキューテス属が増加したことから、FMT後に受容体腸内微小生態系の健全性が改善したことが間接的に証明された。Aggarwalaらは、クロストリジウム・ディフィシル感染症(CDI)レシピエントにおける細菌株生着が、初回および反復FMT後の臨床転帰(再発または成功)を独立して説明する(精度100%、再現率95%)ことを観察した(Pinzone et al.) ドナーFMTの生着率が低いため、抗生物質依存性袋炎(ADP)患者におけるFMTの臨床効果は低かった(Bordalo Tonucciら、2017年)。Siewらは、予定された間隔でFMTを繰り返すことで、T2DMを有する肥満レシピエントにおける除脂肪ドナーからの微生物叢の移植が増加し、少なくとも6ヶ月間持続することを示した(Ngら、2022年)。Mocanuらはまた、6週間後のFMT+低発酵性食物繊維群における特定の分類群の生着は、ドナーを介するものであり、FMTは食物繊維分解因子、短鎖脂肪酸(SCFA)産生因子および腫瘍増殖抑制因子として機能することを見出した(Vindigni and Surawicz, 2017)。私たちのFMT法は4週間以内に迅速な臨床反応をもたらし、FMT治療患者においてビフィズス菌がうまく再構成されていることがわかった。ビフィズス菌は、腸内細菌叢のホメオスタシスの調節、局所および全身の免疫応答の調節、腸粘膜に定着または感染する病原体や有害細菌の抑制(Al-Salamiら、2008年)、腸粘膜バリアの改善、腸内リポ多糖レベルの低下(Renら、2017年)など、ヒトの健康において重要な役割を果たしている。また、ビフィズス菌は粘膜バリア機能を改善し、T2DM患者が乳酸菌La5とビフィズス菌Bb12を含むプロバイオティクスヨーグルトを6週間摂取することで、FBGとHbA1cが改善した(Heら、2021年)。
FMTの副作用には、軽度かつ自己限定的な腹部不快感、けいれん、腹部膨満感、下痢または便秘があり、スクリーニング検査に合格できない疾患はほとんどない(Lu and Salzberg, 2020)。我々の研究では、T2DM患者はFMT後に副作用を示さず、FMT治療後に低血糖や脂質異常症を引き起こすことなく、空腹時および食後血糖、HbA1c、インスリン抵抗性が有意に低下した。メタボリック研究に関しては、これまでの研究ではFMTをメタボリックシンドロームへの介入に用いる傾向があったが、T2DMへの介入に用いた研究はほとんどなかった。我々の研究は革新的である。以前の動物実験では、糖尿病ラットにプロバイオティクスを摂取させると、グリクラジド(経口スルホニルウレア系抗糖尿病薬)のバイオアベイラビリティが上昇することが明らかにされている(Segata et al.) われわれの研究は、FMTとメトホルミンの併用が、メトホルミン単独よりも血糖コントロールとインスリン抵抗性の改善を達成するのに優れていることを発見し、T2DMに介入するFMTとT2DMに介入する血糖降下薬と併用するFMTの新たな方向性を提供した。
われわれの研究にはいくつかの限界がある。第1に、サンプル数が比較的少なかったため、FMT療法の有無によるメトホルミン治療との微妙な違いやメカニズムを評価するには十分ではなかった。第2に、研究期間が4週間と限られていたため、長期的な臨床効果とドナー関連微生物叢の生着との関係についての理解が制限された。第三に、ドナーが不足していたため、レシピエントに移植される微生物の多様性を高めるために、異なるFMT時間でマルチドナーFMTを行った。しかし、患者に対するドナーとレシピエントのマッチングに基づいた固定ドナーの選択は、交絡因子の排除に役立つであろう。
5 結論
結論として、本研究では、FMTが4週間でT2DM患者のBMI、PBG、HbA1c、FBG、HOMA-HBCI、HOMA-IRを改善し、また参加者のドナー関連微生物叢の生着を促進することが示された。本試験の結果は、T2DM患者におけるFMTの長期的介入、および安全で効果的かつ手頃な価格の細菌製剤によるT2DMとの闘いを目指した新規バイオ治療戦略のさらなる開発の基礎となるであろう。
データの利用可能性
本研究で提示されたデータセットは、オンラインリポジトリにある。リポジトリ名およびアクセッション番号は、論文/補足資料に記載されている。
倫理声明
ヒトを対象とした本研究は、中国汕頭市の汕頭大学医学院第一付属病院龍湖病院倫理委員会(倫理番号:LHLL2019001)の審査・承認を受け、Chinses Clinical Trial Registryに登録された(登録番号:ChiCTR19001)。(登録番号:ChiCTR1900024636)(http://www.chictr.org.cn/showprojen.aspx?proj=41166)に登録され、すべての患者から書面によるインフォームドコンセントを得た。本研究への参加については、参加者の法定後見人/近親者から書面によるインフォームド・コンセントを得た。
著者貢献
ZWとBZ、構想、調査、方法論、原案執筆。RXとFC、概念化、調査、方法論、執筆-レビューと編集。DZとBC、概念化、調査、執筆-レビューと編集。ALとCZ、構想、監修、執筆-校閲-編集。DH、XL、SZ、構想、調査、執筆-校閲-編集。KHとYCは、概念化、形式的分析、調査、視覚化、監督、執筆-校閲-編集、プロジェクト管理、資金獲得。すべての著者が論文に貢献し、提出されたバージョンを承認した。
資金提供
本研究は、中華人民共和国国家衛生保健委員会-NHC健康経済政策研究重点実験室(No.NHC-HEPR2019003)、汕頭科学技術計画医療健康部門プロジェクト(No.190923115260372および180905124014368)、広東省科学技術特別基金(No.210629086900260)および広東省科学技術特別基金(No.2021-88)の助成を受けた。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fcimb.2022.1089991/full#supplementary-material に掲載されている。
補足表1|参加者の基本情報と臨床データ。
参考文献
Aggarwala、V.、Mogno、I.、Li、Z.、Yang、C.、Britton、G. J.、Chen-Liaw、A.、他(2021年)。糞便微生物叢移植後の細菌株の正確な定量化により、長期生着が明らかになり、転帰が説明できる。Nat. Microbiol. 6 (10), 1309-1318. doi: 10.1038/s41564-021-00966-0
PubMed Abstract|全文|Google Scholar
Aguayo-Mazzucato, C., Andle, J., Lee, T. B., Jr., Midha, A., Talemal, L., Chipashvili, V., et al. β細胞の老化の促進が糖尿病を決定し、老化分解が疾患の転帰を改善する。Cell Metab. 30 (1), 129-42.e4. doi: 10.1016/j.cmet.2019.05.006
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Al-Salami, H., Butt, G., Fawcett, J. P., Tucker, I. G., Golocorbin-Kon, S., Mikov, M. (2008). プロバイオティクス投与は糖尿病ラットの血糖値を低下させ、グリクラジドの全身吸収を増加させる。Eur. J. Drug Metab. Pharmacokinet. 33 (2), 101-106.
PubMedアブストラクト|クロス全文|Google Scholar
Aron-Wisnewsky, J., Clement, K., Nieuwdorp, M. (2019). 糞便微生物叢移植:肥満/糖尿病に対する将来の治療選択肢?Curr. Diabetes Rep. 19 (8), 51. doi: 10.1007/s11892-019-1180-z
クロスレフ・フルテキスト|Google Scholar
Belenguer, A., Duncan, S. H., Calder, A. G., Holtrop, G., Louis, P., Lobley, G. E., et al. ビフィドバクテリウム・アドレッセンティスとヒト腸内酪酸産生嫌気性菌との代謝的相互摂食の2つの経路。Appl. Environ. Microbiol. (5)、3593-3599. doi: 10.1128/AEM.72.5.3593-3599.2006
パブコメ抄録|クロスリファレンス全文|Google Scholar
Bordalo Tonucci, L., Dos Santos, K. M., De Luces Fortes Ferreira, C. L., Ribeiro, S. M., De Oliveira, L. L., Martino, H. S. (2017). 腸内細菌叢とプロバイオティクス: 糖尿病を中心に。Crit. 57 (11), 2296-2309. doi: 10.1080/10408398.2014.934438.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Buse, J. B., DeFronzo, R. A., Rosenstock, J., Kim, T., Burns, C., Skare, S., et al. メトホルミンの主要なグルコース低下作用は、循環ではなく腸に存在する: 短期薬物動態試験および12週間用量設定試験の結果。糖尿病ケア 39 (2), 198-205.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Carvalho, B. M., Saad, M. J. (2013). 不顕性炎症とインスリン抵抗性に対する腸内細菌叢の影響。Mediators Inflamm 2013, 986734.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, P. C., Chien, Y. W., Yang, S. C. (2019). 新たに2型糖尿病と診断された患者における腸内細菌叢の変化。Nutr. (Burbank Los Angeles County Calif) 63-64, 51-56. doi: 10.1016/j.nut.2018.11.019.
クロスレフフルテキスト|Google Scholar
Chudnovskiy, A., Mortha, A., Kana, V., Kennard, A., Ramirez, J. D., Rahman, A., et al. 宿主と原虫の相互作用は、インフラマソームの活性化を通じて粘膜感染を防御する。Cell 167 (2), 444-456.e14. doi: 10.1016/j.cell.2016.08.076.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
DeFronzo, R. A., Buse, J. B., Kim, T., Burns, C., Skare, S., Baron, A., et al. 1日1回遅放性メトホルミンは血漿グルコースを低下させ、空腹時および食後のGLP-1およびPYYを増強する:2つの無作為化試験の結果。Diabetologia 59 (8), 1645-1654.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
de Groot, P., Nikolic, T., Pellegrini, S., Sordi, V., Imangaliyev, S., Rampanelli, E., et al. ランダム化比較試験において、糞便微生物叢移植はヒト新規発症1型糖尿病の進行を阻止する。Gut 70 (1), 92-105. doi: 10.1136/gutjnl-2020-322630.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
de la Cuesta-Zuluaga、J.、Mueller、N. T.、Corrales-Agudelo、V.、Velasquez-Mejia、E. P.、Carmona、J. A.、Abad、J. M.、他(2017)。メトホルミンは、腸内のムチンを分解するakkermansia muciniphilaおよびいくつかの短鎖脂肪酸産生微生物叢の相対存在量の増加と関連している。糖尿病ケア 40 (1), 54-62.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Depommier, C., Van Hul, M., Everard, A., Delzenne, N. M., De Vos, W. M., Cani, P. D. (2020). 低温殺菌したアカマンシア・ムチニフィラは、食事誘発性肥満マウスの全身エネルギー消費と糞便エネルギー排泄を増加させる。腸内細菌 11 (5), 1231-1245. doi: 10.1080/19490976.2020.1737307
PubMedアブストラクト|全文|Google Scholar
Duparc, T., Plovier, H., Marrachelli, V. G., Van Hul, M., Essaghir, A., Stahlman, M., et al. 肝細胞MyD88は、胆汁酸、腸内細菌叢、メタボロームに影響を与え、グルコースと脂質の代謝を制御する。Gut 66 (4), 620-632. doi: 10.1136/gutjnl-2015-310904.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Erem, C., Ozbas, H. M., Nuhoglu, I., Deger, O., Civan, N., Ersoz, H. O. (2014). 新たにコントロール不能と診断された2型糖尿病患者における血糖コントロールと心血管リスク因子に対するグリクラジド、メトホルミン、ピオグリタゾン単剤療法の効果の比較。Exp. Clin. Endocrinol. 糖尿病 122 (5), 295-302.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Foretz, M., Guigas, B., Viollet, B. (2019). 2型糖尿病におけるメトホルミンの糖調節機構の理解。Nat. Rev. Endocrinol. 15 (10), 569-589. doi: 10.1038/s41574-019-0242-2
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Giongo, A., Gano, K. A., Crabb, D. B., Mukherjee, N., Novelo, L. L., Casella, G., et al. 1型糖尿病の自己免疫マイクロバイオームの定義に向けて。ISME J. 5 (1), 82-91. doi: 10.1038/ismej.2010.92.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hartstra, A. V., Bouter, K. E., Backhed, F., Nieuwdorp, M. (2015). 肥満と2型糖尿病におけるマイクロバイオームの役割についての洞察。Diabetes Care 38 (1), 159-165.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
He,J.、He,X.、Ma,Y.、Yang,L.、Fang,H.、Shang,S.、他(2021年)。中国における糞便微生物叢移植のための便ドナースクリーニングの包括的アプローチ。Microb. Cell Fact. 20 (1), 216. doi: 10.1186/s12934-021-01705-0
パブコメ抄録|全文|Google Scholar
Herfarth, H., Barnes, E. L., Long, M. D., Isaacs, K. L., Leith, T., Silverstein, M., et al. 抗生物質依存性袋炎患者における内視鏡的および経口的糞便微生物叢移植の併用: 低いドナー微生物生着による低い臨床効果。Inflamm. Gut. Dis. 4 (1), 1-6. doi: 10.1159/000497042
CrossRef 全文|Google Scholar
Hou, K., Wu, Z. X., Chen, X. Y., Wang, J. Q., Zhang, D., Xiao, C., et al. 健康と疾患における微生物叢。Signal Transduct. Target. Ther. 7 (1), 135. doi: 10.1038/s41392-022-00974-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hou, K., Zhang, S., Wu, Z., Zhu, D., Chen, F., Lei, Z. N., et al. 糞便微生物叢移植による2型糖尿病の腸内微小生態系の再構築: なぜ、どのように。Bosnian J. Basic Med. Doi: 10.17305/bjbms.2021.6323.
クロスレフ・フルテキスト|Google Scholar
Ingle, H., Lee, S., Ai, T., Orvedahl, A., Rodgers, R., Zhao, G., et al. Viral complementation of immunodeficiency confers protection against enteric pathogens via interferon-lambda. Nat. Microbiol. 4 (7), 1120-1128. doi: 10.1038/s41564-019-0416-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Karlsson, F. H., Tremaroli, V., Nookaew, I., Bergstrom, G., Behre, C. J., Fagerberg, B., et al. グルコースコントロールが正常、障害、糖尿病のヨーロッパ人女性における腸内メタゲノム。Nature 498 (7452), 99-103.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Kootte, R. S., Levin, E., Salojarvi, J., Smits, L. P., Hartstra, A. V., Udayappan, S. D., et al. メタボリックシンドロームにおけるリーンドナー糞便後のインスリン感受性の改善は、ベースラインの腸内細菌叢組成によって駆動される。Cell Metab. 26 (4), 611-9.e6. doi: 10.1016/j.cmet.2017.09.008.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Krentz, A. J., Bailey, C. J. (2005). 経口抗糖尿病薬:2型糖尿病における現在の役割。Drugs 65 (3), 385-411. doi: 10.2165/00003495-200565030-00005.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lee, P., Yacyshyn, B. R., Yacyshyn, M. B. (2019). 腸内細菌叢と肥満: 糞便微生物叢移植(FMT)を通して肥満を変化させる機会。糖尿病Obes。Metab. 21 (3), 479-490. doi: 10.1111/dom.13561
パブコメ抄録|クロスリファレンス全文|Google Scholar
Li, X. V., Leonardi, I., Iliev, I. D. (2019). 免疫と炎症性疾患における腸内真菌叢。免疫 50 (6), 1365-1379. doi: 10.1016/j.immuni.2019.05.023.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li, X., Watanabe, K., Kimura, I. (2017). 腸内細菌叢異常は糖尿病および関連代謝疾患の新規治療戦略を駆動し、示唆する。Front. Immunol. 8, 1882. doi: 10.3389/fimmu.2017.01882
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li, S. S., Zhu, A., Benes, V., Costea, P. I., Hercog, R., Hildebrand, F., et al. 糞便微生物叢移植後のドナー株とレシピエント株の持続的共存。Sci. (New York NY) 352 (6285), 586-589. doi: 10.1126/science.aad8852.
クロスレフ・フルテキスト|Google Scholar
Lu, J., Salzberg, S. L. (2020). kraken 2を用いた超高速・高精度の16S rRNA微生物群集解析。doi: 10.1186/s40168-020-00900-2.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ma, Q., Li, Y., Li, P., Wang, M., Wang, J., Tang, Z., et al. 2型糖尿病と腸内細菌叢の関係における研究の進展。Biomed. pharmacother. = Biomed. pharmacother. 117, 109138. doi: 10.1016/j.biopha.2019.109138.
クロスレフ・フルテキスト|Google Scholar
Marchesi, J. R., Adams, D. H., Fava, F., Hermes, G. D., Hirschfield, G. M., Hold, G., et al. 腸内細菌叢と宿主の健康:新たな臨床フロンティア。Gut 65 (2), 330-339. doi: 10.1136/gutjnl-2015-309990
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mayo, B., Sinderen, D. V. (2010). ビフィズス菌のゲノムと分子的側面。
Google Scholar
Mocanu, V., Zhang, Z., Deehan, E. C., Kao, D. H., Hotte, N., Karmali, S., et al. 重度の肥満とメタボリックシンドローム患者における糞便微生物移植と食物繊維補給:無作為化二重盲検プラセボ対照第2相試験。Nat. Med. 27 (7), 1272-1279.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Musso, G., Gambino, R., Cassader, M. (2011). 肥満と糖尿病の素因となる腸内細菌叢と宿主代謝の相互作用。Annu. Rev. Med. 62, 361-380. doi: 10.1146/annurev-med-012510-175505
パブコメ抄録|全文|Google Scholar
Ng,S.C.,Xu,Z.,Mak,J.W.Y.,Yang,K.,Liu,Q.,Zuo,T.,他(2022年)。2型糖尿病の肥満被験者における糞便微生物叢移植後の微生物叢生着:24週間二重盲検無作為化対照試験。Gut 71 (4), 716-723. doi: 10.1136/gutjnl-2020-323617
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pinzone, M. R., Celesia, B. M., Di Rosa, M., Cacopardo, B., Nunnari, G. (2012). 慢性肝疾患における微生物トランスロケーション。Int. J. Microbiol. 2012, 694629.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pollak, M. (2017). 研究のフロンティアとしての腸内細菌叢と免疫系に対するメトホルミンの効果。Diabetologia 60 (9), 1662-1667. doi: 10.1007/s00125-017-4352-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Que,Y.、Cao,M.、He,J.、Zhang,Q.、Chen,Q.、Yan,C.、他(2021年)。2型糖尿病患者の腸内細菌特性とその応用可能性。Front. Immunol. 12, 722206.
PubMedアブストラクト|全文|Google Scholar
Ren, Y. D., Ye, Z. S., Yang, L. Z., Jin, L. X., Wei, W. J., Deng, Y. Y., et al. 長期抗ウイルス療法後のHBe抗原陽性患者において、糞便微生物叢移植はb型肝炎ウイルスe抗原(HBe抗原)のクリアランスを誘導する。Hepatol. (Baltimore Md) 65 (5), 1765-1768.
クロスレフ・フルテキスト|Google Scholar
Rinott、E.、Youngster、I.、Yaskolka Meir、A.、Tsaban、G.、Zelicha、H.、Kaplan、A.、他(2021)。食事で調整した自家糞便微生物叢移植が体重増加に及ぼす影響。Gastroenterology 160 (1), 158-73.e10. doi: 10.1053/j.gastro.2020.08.041.
PubMedアブストラクト|クロス全文|Google Scholar
Rodriguez, J., Hiel, S., Delzenne, N. M. (2018). メトホルミン:古い友人、新しい作用方法-腸内細菌叢の示唆?Curr. Opin. Clin. Nutr. Metab. ケア 21 (4), 294-301.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Segata, N., Izard, J., Waldron, L., Gevers, D., Miropolsky, L., Garrett, W. S., et al. メタゲノム解析によるバイオマーカーの発見と説明。ゲノム生物学 12 (6), R60.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shin, N. R., Lee, J. C., Lee, H. Y., Kim, M. S., Whon, T. W., Lee, M. S., et al. メトホルミン投与により誘導されるアッケシソウ個体群の増加は、食事誘発性肥満マウスのグルコースホメオスタシスを改善する。Gut 63 (5), 727-735. doi: 10.1136/gutjnl-2012-303839.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Skelly, A. N., Sato, Y., Kearney, S., Honda, K. (2019). Mining the microbiota for microbial and metabolite-based immunotherapies. Nat. Rev. Immunol. 19 (5), 305-323. doi: 10.1038/s41577-019-0144-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Su,L.、Hong,Z.、Zhou,T.、Jian,Y.、Xu,M.、Zhang,X.、他(2022年)。食事療法および食事療法+糞便微生物叢移植による2型糖尿病患者の健康改善。論文タイトル:Sci.Rep. 12 (1), 1152.
パブコメ抄録|Ref 全文|Google Scholar
Su,B.、Liu,H.、Li,J.、Sunli,Y.、Liu,B.、Liu,D.、他(2015)。Acarbose treatment affects serum levels of inflammatory cytokines and the gut content of bifidobacteria in Chinese patients with type 2 diabetes mellitus. 糖尿病学会誌 7 (5), 729-739.
パブコメ要旨|全文|Google Scholar
Sun,L.、Xie,C.、Wang,G.、Wu,Y.、Wu,Q.、Wang,X.、他(2018)。腸内細菌叢と腸FXRはメトホルミンの臨床的利益を媒介する。Nat. Med. 24 (12), 1919-1929. doi: 10.1038/s41591-018-0222-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Thingholm, L. B., Ruhlemann, M. C., Koch, M., Fuqua, B., Laucke, G., Boehm, R., et al. 2型糖尿病を有する肥満者と有さない肥満者は、異なる腸内微生物の機能的能力と組成を示す。Cell Host Microbe 26 (2), 252-64.e10. doi: 10.1016/j.chom.2019.07.004.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tolhurst, G., Heffron, H., Lam, Y. S., Parker, H. E., Habib, A. M., Diakogiannaki, E., et al. 短鎖脂肪酸は、Gタンパク質共役型受容体FFAR2を介してグルカゴン様ペプチド-1の分泌を刺激する。糖尿病 61 (2), 364-371.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Turnbaugh, P. J., Hamady, M., Yatsunenko, T., Cantarel, B. L., Duncan, A., Ley, R. E., et al. 肥満と痩身の双生児におけるコア腸内細菌叢。ネイチャー457(7228), 480-484.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vindigni, S. M., Surawicz, C. M. (2017). 糞便微生物叢移植。Gastroenterol. Clinics North Am 46 (1), 171-185. doi: 10.1016/j.gtc.2016.09.012.
CrossRef フルテキスト|Google Scholar
Vrieze, A., Van Nood, E., Holleman, F., Salojarvi, J., Kootte, R. S., Bartelsman, J. F., et al. 除脂肪ドナーからの腸内細菌叢の移入は、メタボリックシンドローム患者におけるインスリン感受性を高める。胃腸病学143(4)、913-6.e7。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wallace, H. J., Holmes, L., Ennis, C. N., Cardwell, C. R., Woodside, J. V., Young, I. S., et al. 糖尿病前症におけるインスリン抵抗性とβ細胞機能に対するビタミンD3補給の効果:二重盲検無作為化プラセボ対照試験。Am. J. Clin. Nutr. 110 (5), 1138-1147. doi: 10.1093/ajcn/nqz171
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, H., Lu, Y., Yan, Y., Tian, S., Zheng, D., Leng, D., et al. 2型糖尿病の有望な治療法: 糞便微生物叢移植はインスリン抵抗性と障害膵島を逆転させる。Front. Cell. infect. Microbiol. 9, 455. doi: 10.3389/fcimb.2019.00455
PubMedアブストラクト|クロス全文|Google Scholar
Wild, S., Roglic, G., Green, A., Sicree, R., King, H. (2004). 糖尿病の世界的有病率:2000年の推定値と2030年の予測値。糖尿病ケア 27 (5), 1047-1053.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wu, G. D., Chen, J., Hoffmann, C., Bittinger, K., Chen, Y. Y., Keilbaugh, S. A., et al. 長期的な食事パターンと腸内細菌の腸型との関連性。Sci.(ニューヨークNY)334(6052)、105-108。
クロスレフ・フルテキスト|Google Scholar
Wu, Z., Chen, Y., Zhu, D., Zheng, Y., Ali, K. B., Hou, K. (2022). 腸内細菌叢の調節における漢方薬の進歩: 疾患管理におけるメカニズムに基づく役割。抗がん創薬に関する最新特許17 (2), 136-144.
クロステキスト|Google Scholar
Wu, H., Esteve, E., Tremaroli, V., Khan, M. T., Caesar, R., Manneras-Holm, L., et al. メトホルミンは未治療の2型糖尿病患者の腸内細菌叢を変化させ、この薬剤の治療効果に寄与する。Nat. Med. 23 (7), 850-858. doi: 10.1038/nm.4345
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wu, H., Tremaroli, V., Schmidt, C., Lundqvist, A., Olsson, L. M., Kramer, M., et al. 糖尿病前症および糖尿病における腸内細菌叢: 集団ベースの横断研究。Cell Metab. 32 (3), 379-90.e3. doi: 10.1016/j.cmet.2020.06.011
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yadav, H., Lee, J. H., Lloyd, J., Walter, P., Rane, S. G. (2013). 酪酸誘導性GLP-1ホルモン分泌を介したプロバイオティクスの有益な代謝効果。J. Biol. Chem. 288 (35), 25088-25097. doi: 10.1074/jbc.M113.452516
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zhao, L., Zhang, F., Ding, X., Wu, G., Lam, Y. Y., Wang, X., et al. 食物繊維によって選択的に促進される腸内細菌は、2型糖尿病を緩和する。Sci. (New York NY) 359 (6380), 1151-1156. doi: 10.1126/science.aao5774.
クロスリファレンス全文|Google Scholar
キーワード:糞便微生物叢移植、2型糖尿病、メトホルミン、メタゲノミクス、微生物叢コロニー形成
引用 Wu Z, Zhang B, Chen F, Xia R, Zhu D, Chen B, Lin A, Zheng C, Hou D, Li X, Zhang S, Chen Y and Hou K (2023) 糞便微生物叢移植は2型糖尿病のインスリン抵抗性を逆転させる: 無作為化対照前向き研究。Front. Cell. Infect. Microbiol. 12:1089991. doi: 10.3389/fcimb.2022.1089991.
受理:2022年11月04日 04 November 2022; Accepted: 2022年12月12日;
発行:2023年01月04日
編集者
呉慶龍(ベイラー医科大学、米国
査読者
Bo Zhu、テキサス大学MDアンダーソンがんセンター、米国
Ravi Verma、ベイラー医科大学病理学・免疫学教室、米国
Copyright © 2023 Wu, Zhang, Chen, Xia, Zhu, Chen, Lin, Zheng, Hou, Li, Zhang, Chen and Hou. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Kaijian Hou, kaijianhou@126.com; Yongsong Chen, yongsongchen@126.com.
これらの著者は本研究に等しく貢献している。
‡ORCID: Yongsong Chen, orcid.org/0000-0002-8208-4951
Kaijian Hou, orcid.org/0000-0003-1733-0068
免責事項:本論文で表明されたすべての主張は、あくまで著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
自己免疫介在性1型糖尿病の糞便微生物叢移植治療: システマティックレビュー
張碩、鄧飛英、陳景賢、陳鳳武、呉澤鎮、李麗平、侯凱健
肺炎桿菌分離株の臨床的およびゲノム解析: 新たな高粘液粘性関連遺伝子の同定
金美齢、賈天悦、劉雄、楊美涛、張娜、陳家利、楊暁静、秦詩宇、劉方尼、唐悦、王永、郭金鵬、陳永、李博安、王長軍
自己免疫介在性1型糖尿病に対する糞便微生物叢移植療法
何莉奈、陳栄平、張邦州、張碩、Barkat Ali Khan、朱丹、呉澤振、蕭傳星、陳宝龍、陳鳳武、侯凱健
高脂肪食による非アルコール性脂肪性肝疾患マウスの腸内細菌叢に対する沢瀉煎じ薬の効果
畢超蘭、孫嘉通、杜健、朱立元、李怡静、賈暁宇、劉元、張文平、李玉春、劉燕静
2型糖尿病患者における糞便微生物叢移植療法に対する臨床効果の宿主微生物による決定因子を明らかにした前向き研究
Dafa Ding、Huijuan Yong、Na You、Wei Lu、Xu Yang、Xiaolong Ye、Yayun Wang、Tingting Cai、Xiaoling Zheng、Hui Chen、Bota Cui、Faming Zhang、Xingyin Liu、Jian-Hua Mao、Yibing Lu、Hang Chang
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
