母親の高脂肪食摂取は、M1ムスカリン受容体を介して、その子孫の炎症反応を調節する。
本文へスキップ
トップバーナビゲーション
免疫学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
67
総閲覧数
記事のインパクトを見る
記事のaltmetricスコアは1
オリジナル研究論文
Front. 免疫学、2023年12月18日
栄養免疫学
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1273556
母親の高脂肪食摂取は、M1ムスカリン受容体を介して、その子孫の炎症反応を調節する。
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1273556/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit


Suleyma Oliveira Costa1 Wenicios Ferreira Chaves1 Priscilla Karla Fernandes Lopes1 Iracema M. Silva1 Beatriz Burguer2 Leticia M. Ignácio-Souza1,3 Adriana Souza Torsoni1,3 Marciane Milanski1,3 Hosana Gomes Rodrigues2 Mina Desai4 Michael Glenn Ross4 Marcio Alberto Torsoni1,3*。
1ブラジル、リメイラ、カンピーナス大学応用科学部代謝疾患研究室
2ブラジル、リメイラ、カンピーナス大学応用科学部、栄養素・組織修復研究室
3ブラジル、カンピーナス、カンピーナス大学、肥満と合併症研究センター
4米国カリフォルニア州トーランス、カリフォルニア大学ロサンゼルス校ハーバーUCLA校デビッド・ゲフェン医学部産科婦人科学科
はじめに 高脂肪食(HFD)の摂取は様々な代謝障害や疾患と関連している。妊娠前と母親の肥満はともに、子孫の健康に長期的な影響を及ぼす可能性がある。さらに、成人期に高脂肪食を摂取すると、肥満や代謝異常のリスクが著しく高まる。しかし、肥満パラドックスとして知られる興味深い現象は、肥満が敗血症の死亡転帰に保護効果を与える可能性を示唆している。敗血症では、コリン作動性抗炎症経路(CAP)の活性化が全身の炎症を緩和するのに役立つ。我々は代謝プログラミングモデルを用いて、母親のHFD摂取と敗血症に対する子孫の反応との関係を調べた。
方法 妊娠前、妊娠中、授乳期に雌マウスに標準食(SC)またはHFDを与えた。その後、28日齢の雄の子孫を評価した。
結果 注目すべきことに、HFDを与えたダムを産んだ子(HFD-O)は、SCを与えたダムを産んだ子(SC-O)に比べて高い生存率を示した。重要なことは、視床下部においてCAPに関与するm1ムスカリン性アセチルコリン受容体(m1mAChR)を阻害すると、この保護作用が消失したことである。視床下部におけるm1mAChRの発現は、異なる年齢においてHFD-Oで高く、28日目にピークに達した。m1mAChRアゴニストによる治療は、末梢組織における炎症反応を調節することができた。特に、CAP活性化はアゴニスト処理後のHFD-Oの肝臓で大きかった。興味深いことに、リポ多糖(LPS)負荷は、SC-Oとは対照的に、HFD-Oではより炎症状態を誘導することができず、アゴニスト処理にはそれ以上の効果はなかった。脾臓免疫細胞の分析から、HFD-OではCD8+リンパ球よりもむしろCD4+リンパ球のレベルが高いという特徴的な表現型が明らかになった。さらに、HFD-Oでは基礎のIl17メッセンジャーRNA(mRNA)レベルが低く、Il22 mRNAレベルは高かったが、LPSチャレンジ後も同じパターンが観察された。
考察: 骨髄から単離し、分化させた骨髄細胞をさらに調べたところ、HFD-Oのマクロファージは抗炎症表現型を示した。さらに、m1mAChRアゴニストによる治療は、両群の炎症マーカーレベルの低下に寄与した。まとめると、我々の知見は、HFD-OがLPS誘発敗血症から保護され、この保護は中枢のm1mAChRによって媒介されることを示している。さらに、肝臓、脾臓、骨髄分化マクロファージにおける炎症反応は減少している。しかし、m1mAChRが敗血症時の免疫反応を調節する具体的なメカニズムを解明するためには、より広範な解析が必要である。
1 はじめに
肥満は、痩せた患者と比較して、敗血症における死亡率の改善と逆説的な関連を示す(1, 2)。この現象は肥満パラドックスとして知られ、以前にも議論されたことがある(3, 4)。しかし、敗血症における肥満の予防効果については、依然として議論の的となっていることに注意することが重要である(5)。一部の研究では、肥満が敗血症の転帰に有益な影響を及ぼすことが示されている(6、7)。逆に、併存疾患を調整した後では、敗血症の転帰に対する肥満の影響は統計的に重要でなくなることが他の研究で明らかにされている(8-10)。さらに、敗血症における過体重や肥満の防御機能の根底にある正確な機序はまだ十分に解明されていないが、脂肪組織におけるエネルギー貯蔵や肥満者における炎症反応の差が重要な役割を果たしている可能性を提唱する研究もある(3, 11, 12)。
中枢神経系は免疫系との連絡において重要な役割を果たしており、迷走神経は特に重要である(13)。迷走神経を介した炎症反応の制御は、コリン作動性受容体であるα7ニコチン性アセチルコリン受容体(α7nAChR)とm1ムスカリン性アセチルコリン受容体(m1mAChR)が関与するコリン作動性抗炎症経路(CAP)と呼ばれる(14-16)。
CAPを刺激すると、敗血症における炎症反応を抑制することができる(17)。JAK2/STAT3経路は、α7nAChRの活性化に伴う抗炎症作用に重要な役割を果たしており(18、19)、DNAへのNF-κB結合をダウンレギュレートし、その結果サイトカインの発現を低下させる(20)。我々の研究グループの以前の研究で、C57/BL6マウスにリポ多糖(LPS)または糞便結紮穿刺(CLP)を行ったところ、高脂肪食(HFD)を3日間摂取すると、視床下部のα7nAChRの発現が低下し、死亡率が上昇した。さらに、HFDの摂取は、LPS注射後の炎症マーカーを低下させるPNU(α7nAChRの特異的アゴニスト)の能力を低下させ、敗血症で死亡する確率を高める一因となった(21)。
世界的な肥満の増加は、妊娠前および母体の肥満の増加に寄与しており、これは母親とその子孫の健康に長期的な影響を及ぼす(22-24)。げっ歯類や非ヒト霊長類のモデルを用いた動物実験では、食事介入によって誘発された母親の肥満が、肥満、糖尿病、高血圧、脂肪肝、行動変化など、子孫の様々な健康問題につながることが実証されている(25-29)。しかし、母親の肥満が子孫の炎症反応に及ぼす影響に関する研究はほとんどない。げっ歯類モデルとヒトの両方で行われた研究により、母親の肥満は免疫反応、微生物叢、免疫系の発達に大きな変化を引き起こすことが明らかになっている(30-33)。
したがって、我々の目的は、母親のHFD摂取が子孫の全身炎症反応と敗血症感受性に及ぼす影響を調べることであった。
2 材料と方法
2.1 動物
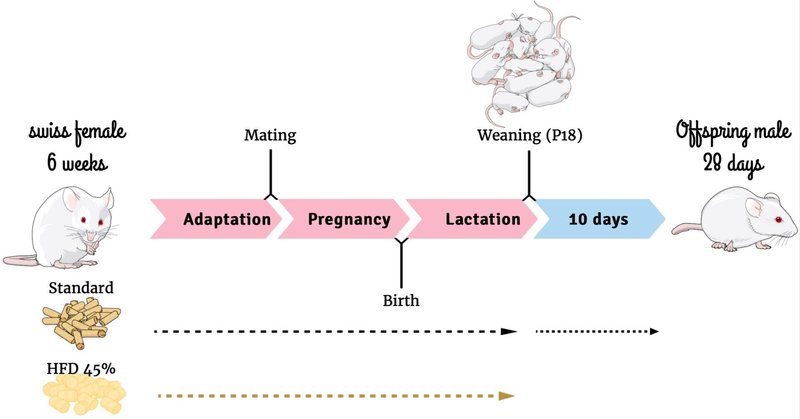
5週齢の雌性スイスマウスをカンピナス大学(ブラジル、カンピナス)の学際的生物学研究センターから入手した。マウスは12時間の光周 期で温度管理された環境で飼育された。実験は、実験動物の使用に関する倫理指針および規則に従って行われた。本論文で紹介する敗血症発症と死亡率解析のデザインを含むこの研究の倫理承認は、カンピナス州立大学倫理委員会から得た(プロトコル5733-1)。重要なことは、研究期間中、動物にいかなる苦痛も与えなかったことである。雌マウスを無作為に2群(各群25匹)に分け、交配前にHFDまたは標準飼料(SC)(NUVILAB® Cr-1, Nuvital, PR, Brazil)を4週間自由摂取させた(表1)。ダムは妊娠中および授乳期もこの飼料を与え続けた。出産後、1子あたり8匹に淘汰した。雄の子供は生後18日目(P18)に離乳させ、P28まで標準的な餌を与えた(図1)。手術や生存試験などの各実験プロトコールは、各ダムから1匹の仔マウスを用いて実施し、それぞれのグループを構成した。受容体発現実験には、特に出生時(P0)、P56、P82の異なる年齢の仔を利用した。HFDは当研究室でAIN-93Gに従って調製したが、高脂肪含量(45%)に変更したのは前述の通りである(34)。
表1
www.frontiersin.org
表1 定量ポリメラーゼ連鎖反応のプライマー配列。
図1
www.frontiersin.org
図1 実験デザイン。図1の作成にはMind the Graphウェブサイトを使用した。
2.2 麻酔と組織抽出
マウスはケタミン(139.2 mg kg-1 体重[bw])、ジアゼパム(4 mg kg-1 bw)、キシラジン(18.4 mg kg-1 bw)を含む混合物で麻酔し、その後、組織採取のために断頭により安楽死させた。組織サンプルは液体窒素で凍結し、処理まで-80℃で保存した。イソフルランは吸入麻酔薬で、定位手術中の全身麻酔の導入と維持に用いられた。麻酔導入には3%~4%を使用し、手術中は2%に減量した。
2.3 炎症反応
炎症反応を評価するため、以下に述べる方法で子マウスを分離した。
デザイン1
LPS誘発敗血症モデルマウスを用いた。マウスに致死量のLPSを滅菌生理食塩水で希釈し、30 mg kg-1 bwで腹腔内(IP)投与した。生存試験では、マウスは餌と水を自由に摂取できた。得られた結果を検証するため、実験は2回繰り返した。
別の研究では、マウスをLPSチャレンジの20分前にベンズトロピン(メシル酸塩)で脳室内投与(ICV)した。m1mAChRアンタゴニストであるベンズトロピンまたはリン酸緩衝生理食塩水(PBS)を40μg kg-1 bw注射した。LPS投与10時間後にマウスを犠牲にし、血清は分析用に採取した。時間は生存率に基づいて定義した。
デザイン2
中枢性m1mAChRを介した抗炎症作用の基礎となるメカニズムを探るため、m1mAChRアゴニストであるMcN-A-343を5 ng kg-1 bwでICV投与した。マウスは注射の2時間後に安楽死させた。別の研究では、LPSチャレンジ(1 mg kg-1 bw IP)の20分前にアゴニスト(ICV)をマウスに投与した。マウスはLPSチャレンジの2時間後に安楽死させた。
2.4 免疫蛍光分析
P28で、両群(SC-OおよびHFD-O)の子孫を4%パラホルムアルデヒド(PFA)で灌流した。その後、脳を取り出し、4%PFAで固定した。その後、脳をTissue-Tek(Sakura, Torrance, CA, USA)に包埋して凍結し、Charles WatsonとGeorge PaxinosのThe Rat Brain in Stereotaxic Coordinatesに従って厚さ15μmの冠状切片に切り出した。スライドをブロッキング液(3%ウシアルブミン;Sigma-Aldrich, St. 使用した一次抗体は、1:500に希釈した抗Chrm1(sc-365966, Santa Cruz Biotechnology, Inc, California)および1:500に希釈した抗F480(ab6640, Abcam, Inc, Boston)である。スライドを洗浄し、適切な二次抗体で120分間インキュベートした。使用した二次抗体は、Alexa 488に結合したロバ抗ウサギを1:500に希釈したもの(A-21206, Thermo Fisher Scientific, Inc, Waltham, MA)と、Cy3に結合したヤギ抗ラットを1:1000に希釈したもの(ab6953, Abcam)である。核標識にはTO-PRO-3 Iodideを用いた(1:1000; Life Technologies Inc, Carlsbad, CA)。スライドを可視化し、TCS SP5II Leica共焦点顕微鏡(Leica Microsystems, Wetzlar, Germany)を用いて画像を撮影した。
2.5 血清測定
一晩絶食させた後、P28 に断頭して子どもを犠牲にし、血液を採取した。サンプルは室温で 15 分間、1300 rpm で遠心分離した。血清を採取し、処理するまで-80℃で保存した。サイトカインレベルは、DuoSet酵素結合免疫吸着測定キット、DY410-05 mouse TNF; DY401-05 mouse IL1-β/IL1-F2; およびDY417-05 mouse IL-10 (R&D Systems, Minneapolis, MN, USA)を用いて測定した。CD14レベルは、Mouse CD14 Quantikine ELISA Kit, #MC140 (R&D Systems, Minneapolis, MN, USA.を用いて測定した。C反応性タンパク質(CRP- K059-8.1)およびアルブミンレベル(K040-1)は、BIOCLIN(Quimica Basica LTDA, Belo Horizonte, Brazil)が提供する生化学分析から得た。
2.6 定位手術
コントロールおよび HFD ダムの子どもは 3%-4% イソフルラン吸入麻酔を受け、脳定位固定装置 (Stoelting Co. Wood Dale, Illinois) に入れられた。カニューレ留置の手術中はイソフルランを2%に減らした。その後、カニューレには26Gの針を用い、頭蓋切開から側脳室に挿入した。側脳室へのアクセスには、頭蓋を基準とした以下の座標が用いられた:前後軸、頭蓋から後方へ0.34mm;外側、正中線から1mm;背腹側、頭蓋表面から2.2mm。カニューレを固定するために歯科用アクリル接着剤を加え、正しい位置で固定した。手術後、動物は暖かいパッドの上で麻酔から回復させた。鎮痛薬であるカルプロフェンを術後痛のために投与した(5mg kg-1 bw, IP)。術後6日目に、アンジオテンシンII注射(1×10-6M溶液2μL、ICV)(Sigma-Aldrich Inc, MERK, St Louis, MO)に対する潜血反応を測定することにより、カニューレ留置を試験した。McN-A-343(アゴニスト)およびベンズトロピン(アンタゴニスト)処置の時間および用量は、時間経過および用量反応実験から標準化した(データは示さず)。
2.7 骨髄細胞の単離
骨髄細胞は、以前(21)に記述したように単離した。子孫から長骨(大腿骨と脛骨)を取り出し、0.5 mL の穴あきチューブに入れ、1.5 mL チューブの中に入れた。細胞ペレットを、10%ウシ胎児血清(FBS;Invitrogen)および1%ペニシリン(100U/mL)/ストレプトマイシン(100μg/mL)(Invitrogen)を添加したRoswell Park Memorial Institute(RPMI)1640培地(Invitrogen, Carlsbad, CA, USA)に再懸濁した。細胞をノイバウアーチェンバーでカウントし、60 mmの培養皿に置いた。細胞は、5%CO2、95%湿度を含む雰囲気中、37℃で7日間培養した。この期間後、培養の写真を撮り、細胞をトリプシン処理し、ウェスタンブロッティング、RT-PCR、フローサイトメトリー解析のために回収した。
2.8 ウェスタンブロッティング分析
組織を新しく調製した氷冷バッファー(1% v/v Triton X-100、0.1 M Tris、pH 7.4、0.1 M ピロリン酸ナトリウム、0.1 M フッ化ナトリウム、0.01 M EDTA、0.01 M バナジン酸ナトリウム、0.002 M PMSF(フッ化フェニルメチルスフォニル)、0.01 mg mL-1 アプロチニン)中でホモジナイズした。サンプルを12,000rpm、4℃で30分間遠心した。上清を除去し、Bradford dye-bleeding法を用いてタンパク質濃度を測定した。サンプルをLaemmliサンプルバッファーに再懸濁し、5分間沸騰させた後、小型スラブゲル装置(Bio-Rad, Richmond, CA, USA)を用いてSDS-PAGEで分離した。分離されたタンパク質は、メタノールとSDSを含む転写バッファー中で30分間、ゲルからニトロセルロース膜に電気泳動された。α7nAChR(bs-1049R、Bioss Antibodies Inc、Woburn、MA)、リン酸化JNK(#9255、Cell Signaling Technology Inc、Danvers、MA)、リン酸化STAT3(#9145、Cell Signaling)、GAPDH(sc-32233、Santa Cruz Biotechnology, Inc、 California)、およびリン酸化NF-κB(#30335, Cell Signaling Technology Inc, Danvers, MA)を用いた。次に、Tris緩衝生理食塩水(TBS)-Tween 20(TTBS; 10 mM Tris, 150 mM NaCl, 0.5% Tween 20)で洗浄した後、ニトロセルロース膜をペルオキシダーゼ標識二次抗体(KPL, Gaithersburg, MD, USA)で室温で90分間プローブした。タンパク質は化学発光キット(SuperSignal West Pico Chemiluminescent Substrate, Thermo Fisher Scientific Inc)で検出し、バンドはScion Imageソフトウェア(ScionCorp, MD, USA)を用いたデンシトメトリーで評価した。バンドの強度は、ローディングコントロール(GAPDH)に対して正規化した。
2.9 RT-PCR 分析
凍結組織をTRIzol試薬(Life Technologies社製)でホモジナイズし、RNA抽出を行った。室温で5分間インキュベートして完全に解離させた後、ホモジネートにクロロホルムを加えた。遠心後、RNA相をイソプロピルアルコールで沈殿させ、ペレットを75%および100%エタノールで洗浄した。乾燥後、ペレットを超純水に懸濁し、-80℃で保存した。RNAはNanodrop ND-2000(Thermo Fisher Scientific)で定量した。逆転写は、High-Capacity cDNA Reverse Transcription kit(Life Technologies)を用いて、3μgの全RNAを用いて行った。相対発現は、TaqMan Gene Expression Assays(Thermo Fisher Scientific)および SYBR Green Master Mix(Bio-Rad)を用いて決定した。以下のTaqMan Gene Expression Assaysを使用した: Chrna7(Mm01312230_m1)、Il6(Mm01312230_m1)、Tnf(Mm004443258_m1)、Il1b(Mm00434228_m1)、Socs3(Mm00545913_s1)、およびIl10(Mm01288386_m1)。Gapdh (4351309; Applied Biosystems, USA)を内因性コントロールとして用いた。
定量的PCRはSYBR Green Master Mix(Bio-Rad)を用いて行った。使用したプライマーを表1に示す。リアルタイムPCRはAB/Prism 7500 fast platformで行った。データはSequence Detection System 2.0.5ソフトウェアを用いて解析した。
2.10 フローサイトメトリー解析
脾臓および骨髄から単離した細胞をフローサイトメトリー分析に供した。脾臓と骨髄の細胞はマクロファージパネルで評価し、CD45+、F480+、CD11c+、CD206+の細胞数を測定した。脾臓細胞はリンパ球パネルでも評価され、CD3+、CD4+、CD8+、Ly6 G+細胞の数が決定された。
脾臓を採取し、針で静かに解離させ、PBSですすいだ。単細胞懸濁液(1×106)をDMEM/FBSに懸濁した。) 細胞をFITC(CD45;CD206)、PECy7(CD45)、APC(F480;CD4)、PE(CD11c;Ly6G;CD8)、Alexa 488(CD3)に結合した特異抗体で処理した。インキュベーションは遮光して室温で15分間行った。解析はBD-FACS Accuri Cytometry (Becton Dickinson, MD, USA)で行い、10,000イベントを取得した。データはFlowJo 7.6ソフトウェアを用いて解析した。
骨髄細胞は自然分化7日後に回収した。細胞はFITC(CD206)、PECy7(CD45)、APC(F480)、PE(CD11c)に結合した特異抗体で処理した。インキュベーションは4℃で15分間遮光した。解析はBD-FACS Accuri Cytometry(Becton Dickinson)で行い、10,000イベントを取得した。データはFlowJo 7.6ソフトウェアを用いて解析した。
2.11 データの表示と統計解析
結果は平均値±標準誤差で示した。データが正規分布しているかどうかを判定するため、コルモゴロフ・スミルノフ検定で評価した。正規分布を確認した後、無対標本に対するStudentのt検定または分散分析(ANOVA)を用いた。ANOVAに続いて、2群以上の差を決定するためにBonferroni post hoc検定を行った。生存率の解析にはlog-rank検定を用いた。すべての解析の統計的有意性はp<0.05とした。すべての統計的比較は、GraphPad Prism 9.5.3(GraphPad Software, San Diego, CA, USA)を用いて行った。
3 結果
3.1 母親のHFD摂取はHFD-Oを敗血症死亡から守る
本試験では、SC-OとHFD-Oに致死量のLPSを投与して敗血症を誘発し、生存率を記録した。まず、LPSチャレンジが両群で敗血症を誘発するのに有効であったかどうかを評価した。LPSチャレンジの10時間後に、敗血症のバイオマーカーと炎症反応を測定した。
CRP値はLPS投与後に高くなったが、SC-OとHFD-Oの間に有意差はなかった。アルブミン値は群間で有意差を示さなかった。CD14値はLPSで処理したすべての子で上昇し、標準曲線の最高点を超えた(表2)。TNF、IL1-βおよびIL-10は、LPSでチャレンジされなかったSC-OおよびHFD-Oでは検出されなかった。LPS注射後のTNFおよびIL-10レベルは、SC-Oに比べてHFD-Oでは低かった。しかし、この減少はm1mAChRアンタゴニストで処理することにより阻止された。IL1-βはLPS注射後のSC-Oとm1mAChRアンタゴニストで処理したHFD-Oでのみ検出された(表2)。脾臓重量も評価した。LPSはSC-Oにおいて、LPSを投与しなかったSC-Oと比較して脾臓重量を有意に増加させた(表2)。しかし、LPSを投与したHFD-Oでは脾臓重量に差は見られなかった。
表2
www.frontiersin.org
表2 子供における敗血症の血清バイオマーカー。
LPSが炎症反応を活性化するのに十分であることを考慮し、SC-OとHFD-Oの生存曲線を評価した。死亡率はHFD-Oと比較してSC-Oで有意に高かった(図2)。しかし、m1mAChRの薬理学的アンタゴニストであるベンズトロピン(メシル酸塩)を事前にICV投与すると、HFD-Oの死亡率はSC-Oと同程度まで上昇した(図2)。この所見は、中枢のm1mAChRがHFD-Oを敗血症から守ることに関与していることを示唆している。
図2
www.frontiersin.org
図2 子の生存解析。生後28日目にコントロールの子(SC-O、n = 10)と高脂肪食の子(HFD-O、n = 10)に致死量のリポ多糖(LPS;30 mg LPS kg-1体重、腹腔内)を投与して敗血症を誘発した。一部のHFD-Oにはm1mAChR拮抗薬benztropine(脳室内投与)を20分間前投与した(HFD-O + Benztropine、n = 10)。マウスを72時間観察し、生存率を1時間ごとに記録した。データは平均値±平均値の標準誤差を表す。*p < 0.05 HFD-O対SC-OおよびHFD-O + Benztropine対HFD-O(log-rank検定)。
3.2 HFD-Oでは母親のHFD摂取により中枢のm1mAChR発現が高くなる
視床下部におけるコリン作動性受容体(α7nAChRとm1mAChR)の分布と発現を評価した(図3)。まず、P0、P28、P56、P82における両受容体のmRNAレベルを評価した。m1mAChRのmRNA発現量はSC-Oと比較してHFD-OではP0、P28、P82で高かったが(図3A)、α7nAChRのmRNA発現量はSC-Oと比較してHFD-OではP0で減少し、P82で増加した(図3B)。さらに、P28、P56およびP82において、ウェスタンブロットによりm1mAChRタンパク質の発現を評価した。その結果、HFD-OではSC-Oに比べてP28とP56で視床下部のm1mAChRタンパク質発現が増加していた(図3C、D)。視床下部のm1mAChR発現が高いことを考慮して、P28の免疫蛍光法でm1mAChR発現の分布を評価した(図3E)。SC-Oと比較して、HFD-Oの正中隆起にはより多くのm1mAChR+細胞が存在した(図3E)。それにもかかわらず、m1mAChRの発現はSC-Oの正中突起と比較して弧状核で高いようである(図3E)。
図3
www.frontiersin.org
図3 子馬の視床下部におけるコリン作動性抗炎症経路受容体の発現。視床下部のm1mAChRおよびα7nAChRのメッセンジャーRNA(mRNA)(A、B)およびタンパク質(C、D)レベルは、それぞれコントロールおよび高脂肪食の子孫(それぞれSC-OおよびHFD-O)において、RT-PCRおよびウェスタンブロットにより評価した。mRNAおよびタンパク質レベルは出生時(新生児)および生後28日目、56日目、82日目に評価した。タンパク質の分子量:m1mAChR - 52KDa、α7nAChR - 55KDa、GAPDH - 35KDa。コントロール(GAPDH)の発現パーセントを示す(平均値±平均値の標準誤差、各群n = 5仔)。アスタリスクはスチューデントのt検定による有意差を示す(*p < 0.05および**p < 0.01)。28日齢の仔マウス(E)の冠状脳切片(厚さ15μm)におけるm1mAChR+細胞(緑)とTO-PRO-3による核標識(青)を示す共焦点画像。画像のスケールは50μm。SD-OおよびHFD-O(各群n = 3)の中央隆起(ME)におけるm1mAChR+細胞の数(E)。V3:第三脳室。
3.3 m1mAChRはHFD-Oの肝臓における炎症経路の活性化を抑制する
中枢性m1mAChRの活性化がP28における子孫の肝臓シグナル伝達経路およびα7nAChR発現に及ぼす影響を評価するために、m1mAChRの薬理学的アゴニストであるMcN-A-343(ICV)を投与した(図4A)。図4B、Cは、m1mAChRの視床下部活性化が、SC-OおよびHFD-Oの肝臓におけるα7nAChRおよびリン酸化STAT3(pSTAT3)タンパク質発現を増加させたことを示している。特に、pSTAT3の発現はSC-OよりもHFD-Oの肝臓で高かった。さらに、m1mAChRの活性化は肝臓におけるリン酸化JNK(pJNK)発現の減少を伴っていた(図4B、C)。
図4
www.frontiersin.org
図4 胎児の肝臓における炎症マーカー。m1mAChRアゴニストMcN-A-343(脳室内[ICV]投与)による薬理学的治療の実験デザイン(A)。肝pSTAT3、α7nAChR、pJNKタンパク質発現(B、C)およびTnf、Il1b、Il10、Il6、Socs3メッセンジャーRNA(mRNA)発現(D)は、28日齢の標準および高脂肪食子孫(それぞれSC-OおよびHFD-O)において、それぞれウェスタンブロットおよびRT-PCRにより評価した。マウスにm1mAChRアゴニストMcN-A-343(5 ng kg-1、ICV)を投与した。リポ多糖(LPS;1 mg kg-1、腹腔内)とm1mAChRアゴニスト(ICV)を同時投与した実験デザイン(E)。肝pSTAT3、pNF-κB、pJNKタンパク質発現(F、G)およびTnf、Il1b、Il10、Il6、Socs3 mRNA発現(H)は、28日齢のSC-OおよびHFD-OにおいてウェスタンブロットおよびRT-PCRにより評価した。タンパク質の分子量:pSTAT3-90KDa;α7nAChR-55KDa;pJNK-55KDa;pNFkB-65KDa;およびGAPDH-35KDa。データは平均値±平均値の標準誤差を表す(各群n = 5)。データは分散分析で解析した。*ベースとアゴニストまたはLPS処理で有意差(p < 0.05)。#HFD-OとSC-O間の有意差(p < 0.05)。図4A、Eの作成にはMind the Graphウェブサイトを使用した。
肝臓のサイトカインmRNAレベルも評価した。Il1bの発現は群間で差がなく、このサイトカインのレベルが同程度であることを示した。興味深いことに、HFD-O肝臓のTnf発現はSC-O肝臓に比べて低かった。しかし、m1mAChRアゴニスト(McN-A-343)をICV投与すると、SC-O肝臓ではTnf mRNAの発現が減少したが、HFD-O肝臓では追加的な効果は認められなかった(図4D)。IL10 mRNA発現は、SC-O肝臓と比較してHFD-O肝臓で増加したが、McN-A-343のICV投与は、HFD-O肝臓と比較してSC-O肝臓でIl10 mRNA発現を有意に増加させた。さらに、ICV投与で送達されたMcN-A-343は、SC-Oと比較してHFD-Oの肝臓のIl6 mRNA発現に対してより大きな阻害効果を示した。同様に、炎症における重要な制御分子であるSocs3のmRNAレベルは、HFD-O肝臓で高かった(図4D)。このことは、母親のHFD摂取がHFD-Oの肝臓でSOCS3の発現を増加させ、炎症反応の制御に影響を与える可能性があることを示している。
図4Eに示すように、LPS処理後のSC-OおよびHFD-Oにおける肝炎反応を調べた。SC-OおよびHFD-OのLPS(1mg kg-1、IP)とm1mAChRアゴニストを同時に投与した。抗炎症経路の構成要素である肝臓のpSTAT3は、すべてのLPSチャレンジマウスで増加した。このことは、LPS投与後、SC-OおよびHFD-Oの両方で抗炎症反応が活性化されたことを示唆している。さらに、リン酸化NF-κB(pNF-κB)とpJNKの発現は、LPS処理SC-Oと比較して、LPS処理HFD-Oの肝臓で減少した。このことは、母親のHFD摂取が子孫の肝炎反応を調節し、その結果、これらの炎症性シグナル伝達経路の活性化が抑制された可能性を示している。興味深いことに、LPSで処理したHFD-Oにm1mAChRアゴニストを投与すると、肝臓におけるpNF-κBとpJNKの発現がさらに減少した(図4F、G)。このことは、図4Hに描かれているように、LPSチャレンジ後のHFD-Oの肝臓において、m1mAChRの活性化が抗炎症反応を増強し、炎症性シグナル伝達経路の活性化を抑制することを示唆している。これらの知見は、母親のHFD摂取とm1mAChR活性化が子孫の肝炎反応に影響を及ぼし、LPS処理後のHFD-Oにおいて、より顕著な抗炎症状態と炎症性シグナル伝達経路の活性化を抑制する可能性があることを示している。
3.4 m1mAChRはHFD-Oの脾臓におけるリンパ球反応を活性化する
病原体に対する炎症反応と免疫反応は脾臓に依存している。m1mAChRアゴニストによるICV処理後、SC-OおよびHFD-Oの脾臓における炎症性サイトカインのレベルを調べた。しかし、炎症マーカーに群間で有意差は見られなかった(データは示さず)。
次に、脾臓の炎症反応を評価するために、マクロファージパネルとリンパ球パネルを用いてフローサイトメトリーを行った。マクロファージパネルでは、SC-Oに比べてHFD-OではCD45+CD11c+細胞の減少がみられ、HFD-OではCD45+CD206+細胞の増加がみられた(図5A)。これらの所見は、脾臓におけるマクロファージマーカーの発現の差によって支持された。同様に、Nos2 mRNA発現はSC-Oと比較してHFD-Oで減少した(図5C)が、Arg1 mRNA発現はHFD-Oで増加したようであった(図5C)。さらに、m1mAChRアゴニストで処理すると、LPSチャレンジ後、SC-OでのみNos2 mRNA発現が減少し、Arg1発現が増加した(図5D)。これらのことから、脾臓に存在するマクロファージは抗炎症性プロフィールを示すことが確認された。
図5
www.frontiersin.org
図5 子脾臓における免疫応答マーカー。脾臓のCD45+F480+細胞、CD45+CD11c+細胞、CD45+CD206+細胞、CD45+Ly6G+細胞をマクロファージパネルで評価し(A)、CD3+CD4+細胞およびCD3+CD8+細胞をリンパ球パネルで評価した(B)。データはコントロールの子孫(SC-O)に対する高脂肪食の子孫(HFD-O)の発現を表す。脾臓Il17、Il22、Tgfb、Ifng、Nos2およびArg1メッセンジャーRNA(mRNA)発現(C)は、28日齢のSC-OおよびHFD-OにおいてRT-PCRにより評価した。脾臓のIL17、IL22、Tgfb、Ifng、Nos2、およびArg1のmRNA発現(D)は、リポ多糖(LPS)チャレンジ(1 mg kg-1、腹腔内)およびm1mAChRアゴニストMcN-A-343(5 ng kg-1、脳室内)投与後の子孫で評価した。データは平均値±平均値の標準誤差を表す。データは分散分析で解析した。*基礎投与とアゴニストまたはLPS投与との間に有意差(p < 0.05)。#HFD-OとSC-O間の有意差(p < 0.05)。
リンパ球パネルから、HFD-Oの脾臓ではSC-Oに比べてCD3+CD4+細胞が増加し、HFD-OではCD3+CD8+細胞が減少していることが明らかになった(図5B)。これらの所見は、SC-Oと比較してHFD-Oの脾臓におけるIl17およびTgfb mRNA発現の減少を伴っていた(図5C)。T-ヘルパーリンパ球の増加を調べるため、LPSチャレンジおよびm1mAChRアゴニスト処理後のHFD-Oの脾臓に存在するT-ヘルパーリンパ球の特異的タイプを決定した。興味深いことに、LPS存在下でIl17 mRNA発現の減少が観察され(図5D)、一方、HFD-OではIl22 mRNA発現が増加しているように見えた(図5C)。これらの観察結果は、HFD-Oにおける明確なリンパ球プロファイルの存在を強調している。さらに、Ifng mRNA発現はLPSチャレンジ後のHFD-Oで減少し、m1mAChRアゴニストはLPS処理SC-OのIfng mRNA発現を減少させた(図5D)。全体として、これらの所見は、HFD-Oでは、基礎状態およびLPSチャレンジ後において、Th17プロファイルへのリンパ球の分化が減少していることを示唆している。
3.5 m1mAchRはHFD-Oにおける抗炎症性マクロファージプロファイルの骨髄細胞分化を活性化する
中枢性ムスカリン受容体とマクロファージ活性化の関係を調べるため、我々は子孫から骨髄細胞を単離した。これらの細胞を培養し、7日間分化させた後、さらなる分析に供した。分離直後にノイバウアーチャンバーを用いて細胞数を数えた(図6A)。HFD-Oから単離された細胞はSC-Oに比べて少なかった(図6B)。さらに、代表的な画像から、分化の7日後、HFD-OではSC-Oに比べてマクロファージの数が減少しているように見えることがわかる(図6C)。しかし、マクロファージパネルをフローサイトメトリーで評価すると、炎症性マーカーまたは抗炎症性マーカーの陽性細胞数に関して、群間に有意差は認められなかった(図6D)。
図6
www.frontiersin.org
図6 分化後の骨髄細胞のプロフィール。28日齢の対照および高脂肪食の子孫(それぞれSC-OおよびHFD-O)の長骨から骨髄細胞を分離した(A)。培養前に細胞を数えた(B)。7日間の自然分化後、細胞がマクロファージに分化したことを確認するために培養の写真を撮った(C)。CD45+F480+、CD45+CD11c+、CD45+CD206+細胞をフローサイトメトリーでマクロファージパネルを用いて評価した(D)。データは平均値±平均値の標準誤差を表す。*スチューデントのt検定に基づく有意差(p < 0.05)。図6Aの作成にはMind the Graphウェブサイトを使用した。
次に、McN-A-343による中枢性m1mAChR活性化が、単離された骨髄細胞のマクロファージ・プロファイルに及ぼす影響を評価した(図7)。m1mAChRアゴニストによる処理後、両群とも培養液中のIL1-βタンパク質発現の減少が認められた(図7A)。また、Tnf、Il1b、Il10、Il6、Nos2、およびArg1のmRNA発現も評価した(図7B)。特に、Il1b、Il6、およびNos2 mRNA発現は、アゴニストMcN-A-343の投与により有意に減少した。逆に、McN-A-343の投与は、Il10 mRNA発現を増加させた。興味深いことに、Il10 mRNA発現は、アゴニスト投与により両群で増加した。さらに、HFD-OではSC-Oに比べてTnfとIl6のmRNAが減少した。炎症性プロファイルを示すNos2 mRNA発現はHFD-Oで減少し、アゴニスト処理により両群でNos2 mRNA発現はさらに減少した。逆に、抗炎症性プロファイルのマーカーであるArg1 mRNA発現はHFD-Oで増加した(図7B)。注目すべきことに、コリン作動性抗炎症経路の下流にあるタンパク質であるSTAT3のリン酸化は、m1mAChRアゴニスト投与後、両群で増加した(図7C、D)。
図7
www.frontiersin.org
図7 分化後の骨髄細胞における炎症マーカー。TNFおよびIL-1βタンパク質の発現は、自然分化7日後の培養液中で酵素結合免疫吸着アッセイを用いて評価した(A)。Tnf、IL1b、IL10、IL6、Nos2およびArg1メッセンジャーRNA(mRNA)発現(B)およびpSTAT3およびpNF-κBタンパク質発現(C、D)は、それぞれコントロールおよび高脂肪食子孫(それぞれSC-OおよびHFD-O)の骨髄から分化させたマクロファージにおいて、RT-PCRおよびウェスタンブロットにより評価した。マウスはm1mAChRアゴニストMcN-A-343(5 ng kg-1、脳室内)で処理した。ブロット上部のバーは各群を表す。データは平均値±平均値の標準誤差を表す。タンパク質の分子量:pSTAT3 - 90KDa、pNFkB - 65KDa、GAPDH - 35KDa。データは分散分析で解析した。*ベースとアゴニストまたはLPS処理間の有意差(p < 0.05)。#HFD-OとSC-O間の有意差(p < 0.05)。
4 考察
肥満は多くの合併症と関連していることが広く認められている(35-37)。意外なことに、肥満は敗血症に対してある程度の予防効果をもたらすようである。疫学的データによると、肥満の人は臨床的全身性炎症反応時に生存する可能性が高いことが示されている(1, 2)。この興味深い現象は、一般に「肥満パラドックス」と呼ばれている(3, 4, 6, 38)が、敗血症における実際の防御機構については、依然として議論の対象となっている(5)。この分析において考慮すべき重要な要素は、DOHaD(Developmental Origins of Health and Disease:健康と疾病の発達的起源)の概念にあるように、子宮内および授乳期のプログラミング過程である。しかし、母親の肥満が敗血症時の子供の炎症反応に及ぼす正確な影響については、未解決のままである。敗血症における炎症反応の形成において、母親の肥満はどのような役割を果たすのだろうか?
いくつかの研究で、肥満したダムを持つ子どもは、炎症チャレンジ後に代謝障害を示すことが示されている(39-41)。敗血症は複雑な疾患であり、死亡率の高い主要な原因として広く認識されている(42-44)。最初の全身性炎症反応症候群(SIRS)とそれに続く対調節性抗炎症反応症候群(CARS)が特徴である(45, 46)。敗血症の予後は、炎症促進反応と抗炎症反応のバランスと密接に関係している。
我々は、LPS誘発敗血症において、HFD-Oが死に対する抵抗性を高めることを見出した。また、LPS投与後、視床下部m1mAChRの発現が増加し、血清中の炎症マーカーのレベルが低下した。注目すべきは、中枢性m1mAChRを阻害すると、HFD-Oにおける敗血症死亡に対する保護効果が完全に消失することである。HFD-OとSC-Oはともに、LPS投与後に敗血症の発症を示す。しかし、HFD-OではSC-Oに比べて回復が早く、これはより効果的な抗炎症制御反応を示している。中枢性m1mAChRは、HFD-Oでは敗血症に対して保護的な役割を果たしているようであり、これは、内毒素血症の予防におけるこの受容体の役割を研究した先行研究(21, 47)によって示唆されたように、敗血症誘発性の免疫および代謝異常の軽減と潜在的に関連している。対照的に、m1mAChRを欠損したノックアウトマウスでは、副腎を摘出する侵襲的な手術後の周術期死亡率が高いことが以前の研究で証明されている(48)。
コリン作動性受容体の発現は、転写後の機序によって制御されているようである。Zaghloulら(49)は、CLP誘発敗血症マウスの中枢神経系におけるm1mAChR発現の減少を示した。さらに、我々のグループによる以前の研究では、CLP手術によって誘発された敗血症モデルにおいて、短期間のHFD摂取が視床下部のα7nAChR発現を低下させ、死亡率を増加させることが明らかにされた(21)。興味深いことに、HFD-Oでは視床下部のα7nAChR発現に変化は見られなかったが、m1mAChR発現は有意に増加した。これらの研究から、コリン作動性受容体の発現調節は、炎症状態によって影響を受けうる動的なプロセスであることが示唆される。
妊娠や授乳期などの発育段階におけるエピジェネティックな機序は、敗血症の予後改善に関連している(50)。エピジェネティクスは、病原体と宿主の相互作用、免疫抑制、炎症反応など、敗血症のさまざまな段階で重要な役割を果たしている(51, 52)。敗血症の後期には、抗炎症性サイトカインが産生され、宿主の免疫寛容に寄与する。免疫学的記憶と呼ばれるこの現象は、将来の感染に対する防御と関連している可能性がある(50, 53)。
肝臓は炎症性免疫反応と自然免疫反応の両方において重要な役割を果たしている(54, 55)。さらに、敗血症の病期に対する反応において肝臓が重要な役割を果たしていることが、研究によって証明されている(56, 57)。肝臓は、IL-6レベルとSTAT3の活性化によって制御される急性期タンパク質(APP)の分泌を担っている(54, 58, 59)。Sanderら(55)は、CXCL1レベルの上昇とともに、アミロイドAのようなAPPの活性化が、肝臓における骨髄細胞の動員、蓄積、生存を促進することを示した。興味深いことに、我々の研究では、HFD-Oにおいて視床下部m1mAChRを薬理学的に活性化すると、SC-Oと比較して肝臓のSTAT3のリン酸化とα7nAChRの発現が増加することが明らかになった。さらに、HFD-OではSC-Oと比較して、LPSに反応して肝臓のIL-6発現が高い。De JongeとUlloa(60)によって実証されたように、JAK2/STAT3経路はα7nAChRの下流で作動し、NF-κBとTNFαの発現を阻害することによって炎症反応を抑えることができることは注目に値する。その結果、HFD-Oでは炎症性サイトカインの発現が抑制され、APP分泌が促進されるため、抗炎症反応が増強される。この効果は、IL-6シグナルを介したSTAT3だけでなく、肝臓α7nAChRの活性化によっても達成される。
敗血症の急性期には、脾臓や胸腺などのリンパ組織に存在するマクロファージ、Tリンパ球、Bリンパ球、好中球などの免疫細胞が活性化を受ける。しかし、敗血症の後期になると、これらの細胞はかなりのアポトーシスを経験する(61, 62)。我々は、HFD-OではSC-Oに比べてCD4+ Tリンパ球が増加し、CD8+細胞が減少していることを発見した。同様に、CLPによって誘発された敗血症を検討した研究でも、CD4+ Tリンパ球の活性低下が報告されている。しかし、CAPの活性化は、CD4+ Tリンパ球の免疫抑制状態を有意に逆転させる(63)。敗血症が進行すると免疫細胞はアポトーシスを起こすことから、敗血症感染前に脾臓のリンパ球レベルが上昇していれば、敗血症の発症を予防できる可能性がある。
CD4+リンパ球は、Th1、Th2、Th17、Th22を含む様々な表現型に分化する能力を持つ。Th17の分化は、TGF-β、IL6、IL1βの分泌によって開始され、Th17分化に関連する転写因子であるRORγtの活性化を誘導する(64)。リンパ球CD4+ Th17細胞は病原性を示し、炎症反応を誘導することができる(64-66)。一方、リンパ球CD4+ Th22細胞の分化は、Th17細胞とIL-17およびIL-22のレベルによって制御される。IL-6のレベルが上昇すると、ナイーブCD4+ T細胞からTh22細胞への分化が促進されるという研究結果もある(67, 68)。今回の所見から、HFD-Oの脾臓ではTGF-βとIL-17レベルが低下し、IL-22とIL-6レベルが上昇していることが示された。その結果、脾臓のリンパ球はTh17表現型よりもむしろTh22表現型に分化するようである。Th22細胞は抗炎症反応に関連し、感染に対する自然免疫防御を促進する役割を担っている(69, 70)。さらに、HFD-Oの脾臓マクロファージと骨髄由来マクロファージは、LPSのような炎症性チャレンジに直面しても、抗炎症性表現型を示すようである。Boomerら(71)は、敗血症時の抗炎症反応における脾臓マクロファージの重要な役割を強調した。これらのマクロファージは、敗血症患者のIFNγ、TNF、IL-6、IL-10などのサイトカインレベルを低下させる役割を担っている。さらに、敗血症生存者では、骨髄前駆細胞が増加し、訓練された免疫によってナイーブな骨髄単球が再プログラミングされる(72, 73)。
結論として、われわれのデータはHFD-OがLPS誘発敗血症に対して部分的な防御効果を示すという証拠を示している。この保護効果は、中枢性m1mAChRのアップレギュレーションを介しているようである。我々はこの中枢性ムスカリン受容体をCAPの主要な活性化因子として同定したが、Renら(63)が示唆したように、この過程における中枢性α7nAChRの役割については調査しなかった。しかし、HFD-OではSC-Oと比較して中枢性α7nAChR発現の増加は観察されなかった。m1mAChR発現の調節の根底にある機序と、敗血症死亡率から子孫を保護する役割を完全に理解するためには、さらなる研究が必要である。
本研究で示された結果は、母親の肥満が抗炎症反応という点で子孫に利点をもたらすことを示唆しているが、この情報を同化することには慎重であるべきである。他の生理学的プロセスが母親の肥満によって影響を受けることは広く知られている。したがって、これらの子孫の発育と免疫系のこの特性の維持をモニターすることが不可欠である。抗炎症療法の使用は、このような症例では有望ではあるが、敗血症の進展の適切な段階で使用する必要がある。
研究の限界として、我々は推奨されるCLP手術の代わりにLPSモデルを用いて敗血症を誘発した。この決断は、28日齢の子マウスの年齢に影響された。私たちは、この非常に衝撃的な手術を実施するためのマウスの大きさを懸念していた。さらに、我々はqPCRを用いてIL17とIL22レベルを評価したが、脾臓のリンパ球のサイトメトリー分析を行えば、より包括的な知見が得られたかもしれない。我々の研究では、生後28日目の子供の免疫反応の変化を評価した。この年齢では、示された結果に対する母乳の寄与を否定することはできない。成体マウスを用いた研究によって、炎症反応におけるこれらの変化の持続性に関する情報を得ることができるだろう。
さらに、免疫系の発達に作用すると思われる栄養成分および/または炎症因子を同定するために、新たな研究を行う必要がある。さらに、我々の研究では、炎症反応のプログラミングが妊娠期間中や授乳期間中に起こったかどうかは調査していない。しかしながら、本研究は、炎症反応が、感染因子にさらされる状況において個体により大きな防御を提供するようにプログラムされうること、そして多くの種にとって進化的適応の重要なメカニズムであった可能性を示している。
データの利用可能性に関する声明
本研究で発表された原著論文は、論文/補足資料に含まれている。その他のお問い合わせは、対応する著者にお願いします。
倫理声明
動物実験はカンピーナス州立大学倫理委員会(プロトコル5733-1)の承認を得た。本研究は、現地の法律および施設要件に従って実施された。
著者貢献
SC:概念化、形式分析、調査、方法論、検証、執筆(原案)。WC:形式分析、調査、方法論、検証、執筆 - 原案。PL: 形式分析、調査、方法論、検証、執筆 - 原案。IS: 形式分析、調査、方法論、検証、執筆 - 原案。BB:形式分析、調査、方法論、執筆 - 原案。LI-S: データキュレーション、形式分析、リソース、監修、執筆 - レビューと編集。AT: 資金獲得、方法論、資源、監督、執筆-校閲・編集。MM:方法論、リソース、執筆-校閲・編集。HR: 正式分析、調査、方法論、リソース、執筆-校閲・編集。MD:資金獲得、リソース、執筆-校閲・編集。MR:資金獲得、リソース、執筆-校閲・編集。MT:概念化、資金獲得、プロジェクト管理、資源、監督、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または発表のために金銭的支援を受けたことを表明する。本研究は、Coordenação de Aperfeiçoamento de Pessoal de Nivel Superior - Brasil(CAPES、財務コード001)、National Council for Scientific and Technological Development(CNPq)、São Paulo Research Foundation - FAPESP(助成金番号16/23484-1、#13/07607-8、#19/07615-7、#21/11772-0)、National Institutes of Health(助成金番号1R01HD099813-01)からの助成金により行われた。資金提供者は、研究デザイン、データ収集・解析、発表の決定、原稿の作成には関与していない。
謝辞
Mind the Graphは図の作成とデザインに使用したプラットフォームである。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない中で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
略語
APP, 急性期タンパク質; Benztropine, m1mAChRの選択的拮抗薬; CAP, Cholinergic Anti-Inflammatory Pathway; CARS, Counter-regulatory Anti-inflammatory Response Syndrome; Chrm1, m1mAChRの遺伝子名; Chrna7, α7nAChRの遺伝子名; CLP, caecal ligation and puncture; CRP, C-Reactive Protein; HFD, 高脂肪食; HFD-O、HFDダムの子孫;ICV、脳室内注射;IP、腹腔内注射;LPS、リポ多糖;m1mAChR、m1ムスカリン性アセチルコリン受容体; McN-A-343、m1mAChRの選択的アゴニスト、SC-標準チャウ食、SC-O、SCダムの子孫、SIRS、全身性炎症反応症候群、α7nAChR、α7ニコチン性アセチルコリン受容体。
参考文献
Alsiö Å, Nasic S, Ljungström L, Jacobsson G. Impact of obesity on outcome of severe bacterial infections. PloS One (2021) 16:e0251887. doi: 10.1371/journal.pone.0251887.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yeo HJ, Kim TH, Jang JH, Jeon K, Oh DK, Park MH, et al. 敗血症における肥満のパラドックスと機能的転帰: 多施設前向き研究。Crit Care Med (2023) 51(6):1-11。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Cichon I, Ortmann W, Kolaczkowska E. 肥満と全身性炎症では、好中球細胞外トラップ(NET)の形成に関与する代謝経路が異なる。肥満と全身性炎症では、自然発症とリポ多糖誘導性の好中球細胞外トラップ(NET)の形成に関与する代謝経路が異なる。
PubMed Abstract|クロスリファレンス全文|Google Scholar
小児敗血症性ショックの予後におけるトランスクリプトームマーカー: 遺伝子発現プロファイルの統合的解析。doi: 10.1590/1414-431X202010152.
クロスレフ・フルテキスト|Google Scholar
Kalani C, Venigalla T, Bailey J, Udeani G, Surani S. 肥満を伴う重症治療室の敗血症患者:肥満は保護的か?Cureus (2020) 12. doi: 10.7759/cureus.6929.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ダニンガーT、レザールR、ママンディプールB、ダンクルD、コーケーファーA、ユングC、他。過体重ではなく低体重は、敗血症ICU患者の過剰死亡率と関連している。Wien Klin Wochenschr (2022) 134:139-47. doi: 10.1007/s00508-021-01912-0
PubMed Abstract|クロスリファレンス全文|Google Scholar
肥満は敗血症による死亡を予防するか?成人患者55,038人のレトロスペクティブ・コホート研究*。Crit Care Med (2019) 47:643-50. doi: 10.1097/CCM.000000003692.
PubMed Abstract|RefRef Full Text|Google Scholar
肥満の敗血症性ショック患者における臨床的特徴、敗血症介入および転帰:国際的な多施設コホート研究(Arabi YM, Dara SI, Tamim HM, Rishu AH, Bouchama A, Khedr MK, et al. Crit Care (2013) 17:1-13.
CrossRef 全文|Google Scholar
Kuperman EF, Showalter JW, Lehman EB, Leib AE, Kraschnewski JL. 肥満が敗血症死亡率に及ぼす影響: レトロスペクティブレビュー。BMC Infect Dis (2013) 13. doi: 10.1186/1471-2334-13-377.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
一般集団における血流感染リスクおよび死亡率と肥満および生活習慣との関連: HUNT研究における64027人の15年間の追跡調査。Int J Epidemiol (2017) 46:1573-81. doi: 10.1093/ije/dyx091.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Harris K, Zhou J, Liu X, Hassan E, Badawi O. The obesity paradox is not observed in critically III patients on early enteral nutrition. Crit Care Med (2017) 45:828-34. doi: 10.1097/CCM.000000002326.
PubMed Abstract|RefRef Full Text|Google Scholar
Robinson MK、Mogensen KM、Casey JD、McKane CK、Moromizato T、Rawn JD、et al.重症患者における肥満、栄養状態、死亡率の関係*。Crit Care Med(2015)43:87-100。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Chang EH, Chavan SS, Pavlov VA. 肥満関連疾患における炎症、代謝機能障害、認知機能障害のコリン作動性制御: Mechanisms and novel therapeutic opportunities. Front Neurosci (2019) 13:263. doi: 10.3389/fnins.2019.00263.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Alen NV. ヒトにおけるコリン作動性抗炎症経路: ヒトにおけるコリン作動性抗炎症経路:最先端のレビューと今後の方向性。神経生物学(2022)136.
PubMedアブストラクト|全文|Google Scholar
パブロフVA、トレーシーKJ。迷走神経と炎症反射-免疫と代謝の関連性。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zila I, Mokra D, Kopi a J, Kolomaznik M, Javorka M, Calkovska A. Vagal-immune interactions involved in cholinergic anti-inflammatory pathway. Physiol Res (2017) 66:S139-45. doi: 10.33549/physiolres.933671.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kim TH, Kim SJ, Lee SM. このような疾患は、喘息や喘息性心疾患(喘息性心筋梗塞、喘息性心筋梗塞、喘息性心筋梗塞、喘息性心筋梗塞、喘息性心筋梗塞、喘息性心筋梗塞、喘息性心筋梗塞)の発症に関与している。J Infect Dis (2014) 209:1668-77. doi: 10.1093/infdis/jit669.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
JAK2/STAT3経路は、雄マウスにおけるPOMCおよびAGRP神経ペプチドのα7nAChR依存的発現に必要である。Cell Physiol Biochem. (2019) 3:701-12. doi: 10.33594/000000166.
CrossRef Full Text|Google Scholar
de Jonge WJ, van der Zanden EP, The FO, Bijlsma MF, van Westerloo DJ, Bennink RJ, et al. 迷走神経の刺激は、Jak2-STAT3シグナル伝達経路を活性化することにより、マクロファージの活性化を抑制する。Nat免疫学(2005)6:844-51. doi: 10.1038/ni1229
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Pavlov VA, Tracey KJ. 免疫の神経制御: 分子メカニズムと臨床への応用。Nat Neurosci (2017) 20:156-66.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Souza ACP, Souza CM, Amaral CL, Lemes SF, Santucci LF, Milanski M, et al. 短期間の高脂肪食摂取は、ニコチン性アセチルコリン受容体α7サブユニット(α7nAChR)の視床下部発現を低下させ、敗血症モデルマウスにおける抗炎症反応に影響を及ぼす。Front Immunol (2019) 10:565.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ドレイクAJ、レイノルズRM。母親の肥満が子孫の肥満と心代謝性疾患リスクに及ぼす影響。リプロダクション(2010)140:387-98。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
パテルN、Pasupathy D、ポストンL.子孫の健康に対する母親の肥満の結果を決定する。Exp Physiol(2015)100:1421-8.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Poston L, Caleyachetty R, Cnattingius S, Corvalán C, Uauy R, Herring S, et al. Preconceptional and maternal obesity: epidemiology and health consequences. Lancet Diabetes Endocrinol (2016) 4:1025-36. doi: 10.1016/S2213-8587(16)30217-0
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
コスタSO、ソウザCM、ランザPG、サルトーリJO、イグナシオ-ソウザLM、カンドレーバT、ら。母親の高脂肪食摂取は、肝臓のα7ニコチン性コリン作動性受容体の発現を低下させ、子孫のインスリンシグナル伝達を障害する。論文タイトル:Sci Rep (2020) 10:1-10.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Dunn GA, Mitchell AJ, Selby M, Fair DA, Gustafsson HC, Sullivan EL. ヒト以外の霊長類の幼若期において、母親の食事と肥満が子孫の中枢および末梢の炎症性転帰を形成する。脳行動免疫(2022)102:224-36. doi: 10.1016/j.bbi.2022.02.024
パブコメ抄録|クロスリファレンス全文|Google Scholar
母親の肥満が子孫の長期的な健康に及ぼす影響。Lancet Diabetes Endocrinol (2017) 5:53-64. doi: 10.1016/S2213-8587(16)30107-3
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kulhanek D, Abrahante Llorens JE, Buckley L, Tkac I, Rao R, Paulsen ME. 母親の肥満誘発食に暴露された雌雄のC57BL/6Jの子どもは、成人期に視床下部のエネルギー代謝が変化する。このような背景のもとで、本論文では、C57BL/6Jにおいて、母体の肥満原性食に暴露された雌雄のC57BL/6J子孫が、成人期に視床下部のエネルギー代謝に変化をきたすことを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
高脂肪食への子宮内曝露は、雄マウスにおいて肝高メチル化および遺伝子調節異常を引き起こし、メタボリックシンドロームを発症させる。内分泌学(2017)158:2860-72.
PubMed Abstract|クロスリファレンス全文|Google Scholar
e-Lacerda RR, CJ T, Bordin S, Antunes E, Anhê GF. マウスにおける母親の肥満は、雄の子孫の気道におけるアレルギー性炎症反応を悪化させる。Nutrients (2019) 11:2902. doi: 10.3390/nu11122902
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Myles IA, Fontecilla NM, Janelsins BM, Vithayathil PJ, Segre JA, Datta SK. 親からの食事脂肪摂取は、子孫のマイクロバイオームと免疫を変化させる。J Immunol (2013) 191:3200-9. doi: 10.4049/jimmunol.1301057.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
胎児期の高脂肪食環境が出生後の代謝・免疫機能に及ぼす影響。肥満(2010)18:1688-94.
PubMed Abstract|クロスリファレンス全文|Google Scholar
母親の肥満は臍帯血サンプルにおける免疫細胞の頻度と反応を変化させる。小児アレルギー免疫学(2015)26:344-51。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Melo AM, Benatti RO, Ignacio-Souza LM, Okino C, Torsoni AS, Milanski M, et al. 妊娠中および授乳期に高脂肪食を与えたマウスの子孫における視床下部小胞体ストレスとインスリン抵抗性。メタボリズム(2014)63:682-92. doi: 10.1016/j.metabol.2014.02.002
PubMed Abstract|クロスリファレンス全文|Google Scholar
Dobson R, Burgess MI, Sprung VS, Irwin A, Hamer M, Jones J, et al. 代謝的に健康な肥満と不健康な肥満: 肥満ではなく、メタボリックシンドロームによる心筋機能への影響の違い。Int J Obes (2016) 40:153-61. doi: 10.1038/ijo.2015.151
クロス・リーフ・フルテキスト|Google Scholar
グレゴリーJW. 小児の肥満とメタボリックシンドロームの予防。フロントEndocrinol(ローザンヌ)(2019)10:669.DOI:10.3389/FENDO.2019.00669
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
BMIの長期的な軌跡と累積メタボリックシンドローム発症: コホート研究。この論文では、BMIとメタボリックシンドロームの長期的な軌跡について検討した。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
敗血症における肥満のパラドックス」の精査メカニズム:肥満は好中球-血小板相互作用の制限による好中球細胞外トラップ(NET)の形成低下を伴う。細胞 (2021) 10:384. doi: 10.3390/cells10020384
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
妊娠中の肥満は胎盤におけるマクロファージの蓄積と炎症を刺激する。プラセンタ (2008) 29:274-81.
PubMed Abstract|クロスリファレンス全文|Google Scholar
父親よりも母親の肥満が乳児および幼児期の肥満度に強く影響する: フェルス縦断研究。小児肥満(2013)8:159-69。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
親の肥満と幼児期の発達。小児科(2017)139:e20161459。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
エグゼクティブサマリー:Surviving sepsis campaign: international guidelines for the management of sepsis and septic shock 2021. Crit Care Med (2021) 49:1974-82. doi: 10.1097/CCM.000000005357.
PubMed Abstract|クロスリファレンス全文|Google Scholar
ハウエルMD、デイビスAM。敗血症と敗血症性ショックの管理。JAMA J Am Med Assoc (2017) 317:847-8. doi: 10.1001/jama.2017.0131.
CrossRef フルテキスト|Google Scholar
Singer M, Deutschman CS, Seymour C, Shankar-Hari M, Annane D, Bauer M, et al. 敗血症と敗血症性ショックの第3次国際コンセンサス定義(sepsis-3)。JAMA J Am Med Assoc (2016) 315:801-10. doi: 10.1001/jama.2016.0287.
CrossRef Full Text|Google Scholar
Lonsdale DO, Shah RV, Lipman J. Infection, sepsis and the inflammatory response: mechanisms and therapy. 2020年)7:588863. doi: 10.3389/fmed.2020.588863.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zetoune FS, Ward PA. 敗血症における補体とヒストンの役割。本論文では、敗血症における補体とヒストンの役割について解説している。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
オメガ3サプリメントは、α7ニコチン性コリン作動性受容体の発現と炎症反応に対する短期高脂肪食の影響を防ぐ。メディエーター炎症(2021)2021。
クロスレフ・フルテキスト|Google Scholar
Pierce H, Zhang D, Magnon C, Lucas D, Christin JR, Huggins M, et al. CNSからのコリン作動性シグナルは、グルココルチコイドシグナル伝達リレーを介して、G-CSFを介した骨髄からの造血幹細胞動員を制御する。細胞幹細胞(2017)20:648-658.e4. doi: 10.1016/j.stem.2017.01.002
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zaghloul N, Addorisio ME, Silverman HA, Patel HL, Valdés-Ferrer SI, Ayasolla KR, et al. マウス敗血症生存者における前脳コリン作動性機能障害と全身および脳の炎症。論文タイトル:Front Immunol (2017) 8:1673.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Córneo E da S, Michels M, Dal-Pizzol F. Sepsis, immunosuppression and the role of epigenetic mechanisms. 専門家Rev Clin Immunol (2021) 17:169-76. doi: 10.1080/1744666X.2021.1875820
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
自然免疫記憶と感染に対する宿主応答。免疫学(2022)208:785-92. doi: 10.4049/jimmunol.2101058.
PubMedアブストラクト|全文|Google Scholar
Vachharajani V, McCall CE. 敗血症における自然免疫のエピジェネティックおよび代謝プログラミング。Innate Immun (2019) 25:267-79. doi: 10.1177/1753425919842320.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Carson WF IV, Cavassani KA, Dou Y, Kunkel SL. 敗血症後の免疫抑制における免疫細胞機能のエピジェネティック制御。Epigenetics (2011) 6:273-83. doi: 10.4161/epi.6.3.14017.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bode JG, Albrecht U, Häussinger D, Heinrich PC, Schaper F. 肝急性期タンパク質-STAT3が関与するIL-6およびIL-1型サイトカインによる制御とNF-κB依存性シグナルとのクロストーク。Eur J Cell Biol (2012) 91:496-505. doi: 10.1016/j.ejcb.2011.09.008.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sander LE, Sackett SD, Dierssen U, Beraza N, Linke RP, Müller M, et al. 肝急性期タンパク質は、骨髄由来サプレッサー細胞の機能を促進することにより、感染時の自然免疫応答を制御する。この論文では、肝臓の急性期タンパク質が感染時の自然免疫応答を制御し、骨髄由来サプレッサー細胞の機能を促進することを明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
肥満がマウスにおける敗血症誘発性肝炎および肝障害を増強する。肥満 (2016) 24:1480-8. doi: 10.1002/oby.21504.
PubMed Abstract|クロスリファレンス全文|Google Scholar
肝STAT3阻害は、敗血症時の肥満マウスの炎症反応を増幅する。Am J Physiol Endocrinol Metab (2019) 316:E286-92. doi: 10.1152/ajpendo.00341.2018.
PubMed Abstract|RefRef Full Text|Google Scholar
Cray C. 動物の急性期タンパク質。In: 分子生物学とトランスレーショナルサイエンスの進歩。2012年). p. 113-50. doi: 10.1016/B978-0-12-394596-9.00005-6
CrossRef 全文|Google Scholar
インターロイキン6曝露によるヒト肝細胞内分泌型急性期応答タンパク質の変化。細胞内分泌型急性期応答タンパク質の変化.
パブコメ抄録|クロスリファレンス全文|Google Scholar
炎症の薬理学的標的としてのα7ニコチン性アセチルコリン受容体。論文概要|日本薬学会誌(2007年)151:915-29.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
病原性T H 17細胞の誘導と分子シグネチャー。Nat Immunol (2012) 13:991-9. doi: 10.1038/ni.2416.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rendon JL, Choudhry MA. Th17細胞:熱傷および敗血症に対する宿主応答の重要なメディエーター。2012年)92:1-10. doi: 10.1189/jlb.0212083.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
中枢性α7ニコチン性アセチルコリン受容体の活性化は、Tリンパ球の抑制された免疫機能を逆転させ、敗血症致死から保護する。Int J Biol Sci (2018) 14:748-59. doi: 10.7150/ijbs.24576.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mills KHG. IL-17とIL-17産生細胞による防御と病理。Nat Rev Immunol (2023) 23:38-54. doi: 10.1038/s41577-022-00746-9
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ムニャカP、ラビMF、パブロフVA、トレーシーKJ、カフィプールE、ギアJE。中枢性ムスカリン性コリン作動性活性化は、実験的大腸炎における脾樹状細胞とCD4+CD25- T細胞間の相互作用を変化させる。doi: 10.1371/journal.pone.0109272.
CrossRef フルテキスト|Google Scholar
敗血症後天性免疫不全における骨髄細胞。Ann N Y Acad Sci (2021) 1499:3-17. doi: 10.1111/nyas.14333.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒト皮膚ホーミングメモリーT細胞のサブセットによるインターロイキン17ではなくインターロイキン22の産生。この論文では、ヒトの皮膚ホーミング記憶T細胞のサブセットによるインターロイキン22の産生とインターロイキン17の産生を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
潰瘍性大腸炎における好中球の動員を制御するインターロイキン22は、ウステキヌマブ療法に対する抵抗性と関連している。Nat Commun (2022) 13:5820. doi: 10.1038/s41467-022-33331-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ouyang W, O'Garra A. IL-10ファミリーサイトカインIL-10とIL-22:基礎科学から臨床応用まで。Immunity (2019) 50:871-91. doi: 10.1016/j.immuni.2019.03.020.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
IL-22依存性腸管移植片対宿主病(Song Q, Wang X, Wu X, Kang TH, Qin H, Zhao D, et al. Nat Commun (2021) 12:805. doi: 10.1038/s41467-021-21133-3
PubMedアブストラクト|クロスリファレンス|Google Scholar
敗血症および多臓器不全で死亡した患者における免疫抑制。JAMA(2011)306:2594-605。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bomans K, Schenz J, Sztwiertnia I, Schaack D, Weigand MA, Uhle F. Sepsis induces a long-lasting state of trained immunity in bone marrow monocytes. 論文タイトル:Front Immunol (2018) 9:2685.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
骨髄由来抑制細胞は敗血症発症時に進化し、全身性の炎症反応を増強または減弱させる。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:高脂肪食(HFD)、コリン作動性、視床下部、肥満、ムスカリン1アセチルコリン受容体、DOHaD(健康と病気の発生起源)、母親のプログラミング
引用 コスタSO、シャーベスWF、ロペスPKF、シルバIM、Burguer B、Ignácio-Souza LM、トルソーニAS、Milanski M、ロドリゲスHG、Desai M、ロスMGとトルソーニMA(2023)高脂肪食の母親の消費は、M1ムスカリン受容体を介し、その子孫の炎症反応を調節する。Front. Immunol. 14:1273556.
受理された: 2023年08月06日;受理:2023年11月27日;
発行:2023年12月18日
編集者
ロバート・J・リー(米国ペンシルバニア大学
査読者
Mourad Aribi, アブー・ベクル・ベルカイド大学, アルジェリア
Xue Jiang(長春科学技術大学、中国
Copyright © 2023 Costa, Chaves, Lopes, Silva, Burguer, Ignácio-Souza, Torsoni, Milanski, Rodrigues, Desai, Ross and Torsoni. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責:マルシオ・アルベルト・トルソーニ マルシオ・アルベルト・トルソーニ marcio.torsoni@fca.unicamp.br
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
胸腺および末梢Foxp3+制御性T細胞発生の選択的切除
Acelya Yilmazer、Dimitra Maria Zevla、Rikke Malmkvist、Carlos Alejandro Bello Rodríguez、Pablo Undurraga、Emre Kirgin、Marie Boernert、David Voehringer、Olivia Kershaw、Susan Schlenner、Karsten Kretschmer
フーリエ変換赤外分光法とディープラーニングアルゴリズムを用いた自己免疫疾患の迅速スクリーニング
Xue Wu, Wei Shuai, Chen Chen, Xiaomei Chen, Cainan Luo, Yi Chen, Yamei Shi, Zhengfang Li, Xiaoyi Lv, Cheng Chen, Xinyan Meng, Xin Lei and Lijun Wu
肺疾患における腸-肺軸を介した肺胞マクロファージの調節
Zijian Chen、Yangqi Liu、Weizhe Huang
イヌリンとその腸内代謝産物の免疫調節作用
ウェイ・シェン、グァン・ジー、リー・チャン
サイトカインの循環レベルと炎症性腸疾患のリスク:遺伝子データからの証拠
ビン・リュー、ユー・チエン、ヤナン・リー、シェン・シャンティン、ディン・イェ、マオ・インイン、スン・シャオホイ
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
