リンの話
皆さまお久しぶりです。私は大学院で化学系の研究をしている者です。名前は二ヒコテとでも呼んでいただけると嬉しいです。国語は苦手なので文章作成にはあまり自信がないですが優しい目で気楽に読んでいただければ幸いです。
今回は原子番号15番のリン(P)について特集していこうと思います。受験生はリンに関する知識があまりにも抜けがちでしかも入試にはよく出題されるテーマなのです。
なぜ抜けがちになってしまうのか?それはリンは15族元素なのですが、高校の無機化学における15族の大半は窒素に関する学習ですのでリンはスッカスカとなってしまうのです。
その証拠にまずリンには幾つか同素体があります。白リンと赤リンくらいは同素体として存在することは知っているとは思います。本当は黒リンと紫リンもありますが、後で触れます。ここで問題です。白リンと赤リンの化学式を正しくお答え下さい。
当然ですがどちらもPではありません。Pなのは赤リンだけです。白リンはP₄です。化学に少し詳しい方なら正解できたでしょう。ではなぜ白リンはP₄で赤リンはPなのか理由も説明できますか?
白リンは4分子からなる正四面体構造を最も取りやすいからです。P₄というのは分子式となります。一方赤リンはPという組成式で表すことが普通です。組成式は切れ目のない結晶を表すときに用いる化学式の一種です(これも意外と知らない人多いです)。赤リンは切れ目のない立体網目構造の結晶であり、扱いとしては高分子化合物に近いという認識でよいでしょう。
ここでこんな疑問を抱いた方もいるでしょう。白リンって何だよ。黄リンちゃうんかい。一緒なら後ろに()を付けるはずです。もちろん違いはあります。
黄リンは嘗ては同素体扱いでしたが、現在は同素体として認められていません。白リン=黄リンは今は誤った認識です。では正しい黄リンとは何か?黄リンは白リンの中に赤リンなど不純物を含んだ粗製の白リンの事です(電解精錬時の粗銅板・純銅板に例えると、黄リンが粗銅版、白リンが純銅板です)。受験化学ではそこまで気にする必要はありませんが、その常識が通用するのは高校までです。
今からは白リンをピックアップしていきます。赤リンはマッチの側薬に使われていて白リンよりは毒性が少なく安定(もちろん白リンと比べての話ですので相対的に安定なだけです)、で十分です。白リンは赤リンの逆で、超猛毒で不安定です。不安定だから水に保存する。空気中では自然発火する・・・。暗記で覚えているのはこれくらいでしょうか?
まず白リンが不安定なのはイメージできるでしょうか?先程も述べましたが、白リンは正四面体構造を最も取りやすいと書きました。その正四面体構造が不安定なのです(変なの)。物質は基本的に安定した構造を目指して反応し、やがて安定した形となるのですが、白リンは少し例外です。正四面体構造が安定した構造を模索した結果まだマシだっただけです。
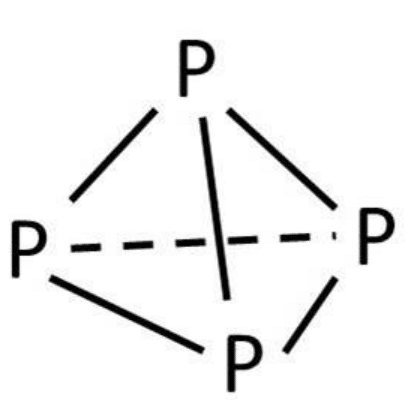
遅くなりましたが、これが白リンの正四面体構造です。PーP同士の結合は実際はこんな直線ではなく、外にぐいっと曲がります。PーP同士の結合は歪んでしまうので何とか正四面体構造として何とかいられるギリギリを保っているのです。それ故PーP結合は不安的で切れやすいのです。しかも結合角は60°と小さすぎます。白リンが安定する術は他の物質と結合すること、これに尽きます。すなわち白リンが白リンとして、単体として安定することはできません。何とかしてでも正四面体構造を保とうとするその姿勢、美しい。
しかし事件は起こるのだ。限界というものがあるのは世の常です。PーP結合だって例外ではありません。やがてその不安定な構造に耐えることができなくなります。そうすることで、PーP結合は切れてしまいます。このとき、2個のP原子は電子(不対電子)を1個だけもつこととなります(専門用語でこの状態をラジカルと言います)。ラジカルはオクテット則に従わない、ものすごく不安定で反応性が高い状態の事です。白リンはラジカルの状態を極度に嫌います。何が何でも不安定な状態を解消したい。そんな時に出会ったのが空気中の酸素なのです。
これが空気中で自然発火する理由となります。白リンはラジカルの状態を解消すべく、空気中の酸素と激しく反応します。空気中の酸素も同様にラジカルになることがあります。この酸素のことを活性酸素(略称ROS)と言い、2個の酸素原子が1個ずつ不対電子を持ちます。白リンと活性酸素同士の不対電子が反応することで安定した化合物となることができるのです。ラジカルは反応性が高いことは先述の通りで、反応する物質がラジカル同士ですので反応が激しくなることは容易に想像できるはずです。自然発火したって何も不思議ではありませんね。ちなみに、反応後は十酸化四リン(P₄O₁₀)という酸性の乾燥剤などに利用される安定した物質となります(化学反応式はP₄+5O₂→P₄O₁₀です)。
次に白リンを水に保存する理由です。当然酸素があろうものなら発火しますので発火しないような溶媒を選ばねばなりません。それが水です。水は極性溶媒で白リンは無極性溶媒です。極性溶媒は極性分子に溶けやすく、無極性溶媒は無極性分子に溶けやすいわけですから、白リンは水との相性が悪く溶けません。水の酸素原子とは反応しません(水の酸素原子は水酸化物イオンとして安定するのでその心配はありません)。大事なのは空気中の酸素を遮断する事です。酸素は水にほとんど溶けないので白リンの保存に適します。逆にベンゼンやエーテルや灯油と言った無極性溶媒には容易に溶けます。高校無機化学ではアルカリ金属は灯油中に保存すると習ったと思います。もし白リンを灯油に入れてしまえば・・・\(^o^)/オタワ★
最後に少し他の同素体について少し話します。黒リンはwikiによると、
黒リンは比重が2.69の固体である。黄リンを約12,000気圧で加圧し、約200℃で加熱すると得られる。リンの同素体中でもっとも安定である。半導体であり鉄灰色の金属光沢を持ち、β金属リンとも呼ばれる。空気中ではなかなか発火しない。
とあります。黄リンを約12000気圧で加圧ととんでもないことが書かれています。これはソルボサーマル合成法という方法の一種です。こんな同素体、人工的につくることしかできません。半導体として利用できることや金属光沢をもつのはおもしろいですね。黒リンは大阪市立大学の研究室が太陽光を利用して水から水素を生成する際の触媒に用いることで高収率でかつ安全に合成することに成功したとの趣旨の論文を発表したことでも注目を集めました。
次に紫リンです。
紫リンは比重が2.36の固体である。褐色を帯びた暗紫色で金属光沢を持ち、α金属リンとも呼ばれる。密閉し、黄リンに鉛を加え加熱することで得られる。電気伝導性は小さい。真の同素体ではなく、赤リンと黒リンの混合物と考えられている。
紫リンは諸説ありなのでこれが一概に正しいとは限りません。完全なる同素体とは言いにくいですが、一応は同素体扱いでいいかと思います。
おっとまだまだ単体しか書いていない、これはいけない。しかし既に大半は飽きているだろうし今回はここまでです。
皆さまとの出会いに感謝、略してC₁₀H₂₂です!
この記事が気に入ったらサポートをしてみませんか?
