
提案! AIに任せっきりじゃない構造ベース創薬
今、創薬のスタンダードとなりつつある構造ベース創薬。英名のStructure-based Drug Designを略してSBDDとしても知られるこの創薬メソッドに、AIを導入する例はいくつかあります。
そんな中、「AIに従うのではなく、AIと協調する」アプローチを提唱するのが阿部一啓さん(細胞生理学研究センター/大学院創薬科学研究科 准教授)。胃の中で胃酸がどのように作られるか、そのしくみの解明に長年取り組んできた、構造生物学の研究者です。

30年以上もグループの研究を支えてきた電子顕微鏡のHELENと。最新鋭の機能はありませんが、研究の大切なパートナーです。
まるでAIを共同研究者かのように語る阿部さんに、他のどこにもない最新メソッドについて聞きました。
【10/13更新】ポッドキャストも公開しました↓
なぜ構造ベース創薬?
── 構造ベース創薬は、従来の創薬とどう違うのですか?
薬が作用するしくみは、よくカギとカギ穴に例えられます。カギ(薬の分子)が、カギ穴(薬のターゲットになるタンパク質)にピッタリはまると薬が「効く」んですね。90%以上の薬は、いろんなカギを用意して、片っ端から差し込んでみる、そんなやり方で見つかってきています。良さそうな「カギ」があれば、それに手を加えて「薬」にしていくんですね。

カギ穴は見えないから、一つずつ差し込むしかありません…
これに対し構造ベース創薬は、まずカギ穴の構造を観て、理解して、それにピッタリあうカギをつくっていこうという考え方です。インフルエンザ治療薬のタミフルや、パキロビッドというCOVID-19治療薬はこの考え方をもとにデザインされた薬なんですよ。
── 合理的ですね。
でも構造ベース創薬の実例は、まだそれほど多くないんですよ。成功率が上がれば、もっといろんな薬をつくるきっかけになると思うんです。
「カギ穴」を観る
── 阿部さんは胃酸抑制剤(胃酸の出過ぎを抑える薬)をつくろうとしているんですよね。その場合のカギ穴は?
胃の内側表面にある「胃プロトンポンプ」というタンパク質です。胃プロトンポンプが胃酸を胃の中へと輸送しているんです。
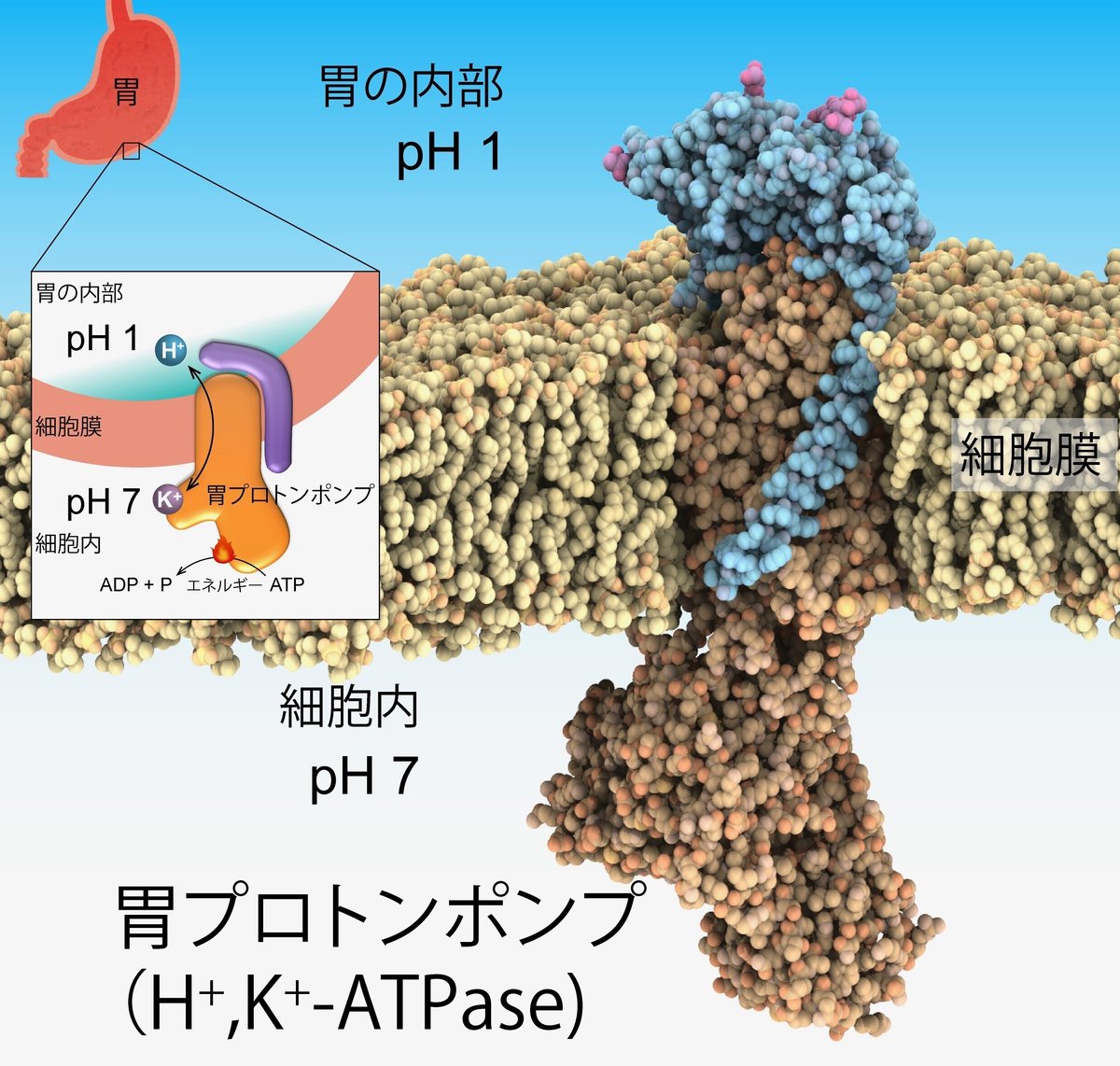
胃プロトンポンプから胃酸が出るのをブロックするのが胃酸抑制剤です。胃酸抑制剤って既にいくつも種類があって、それぞれがどんな風に胃酸をブロックするか調べてみたんです。つまり、カギ(胃酸抑制剤)がカギ穴(胃プロトンポンプ)に差し込まれた状態を、クライオ電子顕微鏡という高精度な電子顕微鏡で観たんですね。

「SPring-8 NEWS 111号」にわかりやすい詳報あります!
「SPring-8とクライオ電子顕微鏡で解き明かした最強のイオンポンプの仕組み 胃酸ができる仕組みを理解し、創薬に応用」
すると、胃酸抑制剤の種類によって、胃酸をブロックしている場所が違うことがわかったんです。じゃあいいとこ取りして、全部をブロックしてしまう薬をつくろうと考えました。
AI創薬プラットフォーム「Deep Quartet」との出会い
でもなかなかうまくいかなくて悩んでいたときに、有機天然物化学が専門の創薬科学研究科の横島聡さんの主催するセミナーで、人工知能を使って薬をデザインする「Deep Quartet」を開発した吉森篤史さんに出会いました。セミナーのお話に可能性を感じ、三人での共同研究がスタートしました。

── 「いいとこ取り化合物」のリクエストに対し、Deep Quartetはどんな解決策を提示してくれたのですか?
全部で百数十の化合物候補を提案してくれました。その中から人の目で厳選して、まず最初に10個くらいから合成しました。それらが本当に胃酸をブロックするのか、一つずつ検証すると、なんと6個目で良さそうなものにヒットしたんです。創薬ってもっともっと多くのカギを試すじゃないですか。さすがAIやな〜!って思いました。
── ということは、薬の候補をスピーディに見つけたことがこの研究の新規ポイントなのですね。
いえ、新しいのはこの後のプロセスです。実は、Deep Quartetが6個目に提案した化合物を合成して、胃プロトンポンプに結合させました。その状態の構造をクライオ電子顕微鏡で観たんです。すると、まだ若干改変の余地があったんですね。そこは人間が手を加えて、カギ穴にぴったりはまる化合物をつくりました。このように、AIがデザインした化合物を実際に構造解析して、そこからさらに改良したというのは、私の知る限り前例がありません

目指せ、タケキャブ代替薬…!?
── 新しい方法論を発表し、胃酸抑制剤の新薬も誕生!ということですか?
といいたいのですが、そのまま薬として使えるとは思っていません。というのも、今回合成した化合物は化学骨格がシンプルすぎて、副作用とか、ひょっとすると肝臓ですぐに分解されてしまうんじゃないかと思うんです。だから骨格をより複雑にして、代謝回避などの工夫をしていく必要がありますね。ただ、そのプロトタイプを作ったということは大きな意義があります。
── 胃酸抑制剤はもう既にいくつもあるんですよね。それでも新薬のニーズがあるのですか?
胃酸抑制剤の市場規模は2兆円といわれています。中でも、2016年に承認された「タケキャブ」はエース的存在です。すぐに効いて、効果が長持ちする、本当にいい薬です。でも、いい薬だからこそ要望も増えているんですよ。例えば、他の薬との飲み合わせが悪く、タケキャブを飲めない場合。タケキャブと同じくらい効く代替薬を提供できるといいですよね。オルタナティブがあるということは、それだけ治療の幅が広がることだと思っています。

「創薬科学の研究棟は、有機合成、構造生物学、生化学などのエキスパートが集まっていて、
とても研究しやすいんですよ!」
── 胃酸抑制剤以外にも応用できそうですか?
そうですね、胃プロトンポンプと似た構造のタンパク質なら比較的簡単に応用できると思います。例えば「ナトリウムポンプ」は胃プロトンポンプの親戚のようなものです。この作用をブロックする化合物は、心不全の薬として使われているんですね。今回発表した方法で、心不全の新薬創出に貢献できるかもしれません。
Deep Quartetとの出会いで研究は大きく前進しましたが、「AIとは主従関係ではなく、協力しながらいい薬をつくりたい」と語る阿部さん。次なる成果が楽しみです!
インタビュー・文:丸山恵

◯関連リンク
プレスリリース(2023/9/29)「AIを活用したde novoドラッグデザイン
~AI、化学、クライオ電顕による新規胃酸抑制剤開発へ~」論文(2023/9/19 オンライン科学雑誌「Communications Biology」 に掲載)
Deep Quartet(株式会社インテージヘルスケア)
この記事が気に入ったらサポートをしてみませんか?
