2023年度 大学入学共通テスト 問題解説「化学基礎」
注釈者コメント
第1問
いずれも基本的な問題ですが,問8は金属のイオン化傾向を覚えてないと解けないのがつらいです.
第2問
食品などの塩分濃度を定量する方法として有名なモール法に関する問題です.実際にはクロム酸銀の赤褐色沈澱の生成がわかりずらいので,滴定終点を見極めるのが難しい実験です.特にしょうゆはもともと褐色なのでさらにわかりずらいです.また,クロムや銀は廃液処理が面倒なので,塩分測定には電気伝導度を応用した塩分計を使うのがいいと思います.しょうゆの製品ごとの塩分濃度の比較には塩分計で十分です.
問1から問3までは平易な問題です.ただし,問3の選択肢(2)は通常ありえない実験操作なので意味を深く考えすぎずに消去法で切り抜けるのがいいかもしれません.問4は選択肢として見慣れない挙動のグラフが出てくるので困りますが.問題リード文の囲み部分(文献の記述)をよく読んで,実験の各段階で起きている化学変化を整理すればよいです.問5は基本的な問題ですが,操作Iの 5.00 mL と操作IIの 5.00 mL を混同しやすいので注意が必要です(私も自分で解いているときに間違えました).これは作問者が意図的に同じ体積(5.00 mL)を用いたと考えられますので,引っかからないように気をつけましょう.
想定される解答時間が30分のわりに問題数が多めの印象です.第2問は教科書などにあまり記載されていない題材なので,本当はじっくり考える時間を確保してあげたいところですね.例えば,第2問の問1は滴定実験の流れとは関係ないので問題から削除したほうがスッキリすると思いますがいかがでしょうか.
第 1 問
次の問い(問1 ~9)に答えよ。
問1
ナトリウム原子 Na に含まれる中性子の数を、次の1~4のうちからーつ選べ。
Naの質量数は23,原子番号(陽子の数)は11.
中性子の数 = 質量数 – 陽子の数 = 23 – 11 = 12
答:12
問2
無極性分子として最も適当なものを,次の1~4のうちから一つ選べ。
1.アンモニア NH3
2.硫化水素 H2S
3.酸素 O2
4.エタノール C2H5OH
本来は,共有結合している原子の電気陰性度を比較して差が0.5以上あれば極性共有結合,0.5未満であれば非極性共有結合であるから,原子ごとの電気陰性度の値を知らないと答えにくい.化学基礎の教科書では,分子内に極性があったとしても,分子の形状の対称性により極性が打ち消し合う場合があり,そのときには分子全体として無極性と判断することになっている.それでも局所的には極性は存在するのだが...同じ原子が結合した二原子分子である O2 はふたつの原子の電気陰性度の差はゼロなので,O2はあきらかに無極性分子と判断できる.
答:O2
問3
ハロゲンに関する記述として最も適当なものを、次の1~4のうちから一つ
選べ。
1.原子番号が大きいほど,原子の価電子の数は多い。
ハロゲンは17族であり,原子の価電子の数はすべて7で同じである.誤
2.原子番号が大きいほど、原子のイオン化エネルギーは大きい。
イオン化エネルギーとは,原子から最外殻電子を1個奪い取って1価の陽イオンにするためのエネルギーのことである.同じ族では,原子番号が大きいほど最外殻電子と原子核の距離が遠いので電子と原子核の引力が弱くなる.したがって,イオン化エネルギーは小さくなる.誤
3.塩化水素分子 HCI では、共有電子対は水素原子の方に偏っている。
HCl分子では電気陰性度はHよりもClのほうが大きいので共有電子対はClのほうに偏っている.誤
4.ヨウ素 I2 と硫化水素 H2S が反応するとき,I2 は酸化剤としてはたらく。
反応式は I2 + H2S → 2 HI + S である.ヨウ素は硫黄から水素を奪うかたちになっている.硫黄はヨウ素によって水素を失っているので,I2 は酸化剤である.正
問4
分子からなる純物質Xの固体を大気圧のもとで加熱して,液体状態を経てすべて気体に変化させた。そのときの温度変化を模式的に図1に示す 。A~E
におけるXの状態や現象に関する記述ア~オにおいて,正しいものはどれ か。正しい組合せとして最も適当なものを、後の1~0のうちから 一つ選べ。

ア Aでは、分子は熱運動していない。
分子が熱運動しないのは絶対零度(0 K)のときだけなので,Aでは分子は熱運動している.誤
イ Bでは、液体と固体が共存している。
Bでは固体と液体が共存しているので 正
ウ Cでは,分子は規則正しい配列を維持している。
Cは液体の状態である.液体では分子は動き回っているので 誤
エ Dでは、液体の表面だけでなく内部からも気体が発生している。
Dでは液体が沸騰して内部からも気体が発生しているので 正
オ Eでは,分子間の平均距離はCのときと変わらない。
Eは気体の状態である.気体は液体よりも分子間の距離が大きいので 誤
問5
二酸化炭素 CO2 とメタン CH4 に関する記述として誤りを含むものはどれ
か。最も適当なものを、次の1~4のうちから一つ選べ。
1.二酸化炭素分子では3個の原子が直線状に結合している。
正
2.メタン分子は正四面体形の構造をとる。
正
3 .二酸化炭素分子もメタン分子も共有結合からなる。
正
4 .常温・常圧での密度は、二酸化炭素の方がメタンより小さい。
密度とは単位体積あたりの質量のことである.常温・常圧では,同じ体積の気体は同じ物質量の分子を含むので,分子量の大きい分子のほうが密度は高くなる.二酸化炭素の分子量は44,メタンの分子量は16なので,常温・常圧での密度は,二酸化炭素の方がメタンより大きい.誤
問6
ヘリウム He と窒素 N2 からなる混合気体 1.00 mol の質量が 10.0 g であっ た。この混合気体に含まれる He の物質量の割合は何%か。最も適当な数値
を、次の1~5のうちから一つ選べ。
Heの物質量を x (mol),N2の物質量を y (mol)とすると,
x + y = 1.00 (mol)
また,Heの分子量は4.0,N2の分子量は28である.この気体の質量は 10.0 g であるから,
4.0 x + 28 y = 10.0 (g)
この連立方程式を解くと,x = 0.75 (mol),y = 0.25 (mol) が得られる.
Heの物質量の割合を%であらわすと,(0.75 / 1.00) x 100 = 75 (%)
答:75%
問7
アルミニウム Al に関する記述として誤りを含むものはどれか。最も適当なも のを、次の1~4のうちから一つ選べ。
1.AI の合金であるジュラルミンは、飛行機の機体に使われている。
正
2.アルミニウム缶を製造する場合、原料の AI は鉱石から製錬するよりも、回収したアルミニウム缶から再生利用(リサイクル)する方が、必要とするエネルギーが小さい。
正
3.アルミナ(酸化アルミニウム)Al2O3 では、アルミニウム原子の酸化数は+2である。
酸素の酸化数は–2である.Al2O3全体の酸化数の和は0であるから,Alの酸化数は(–2)x3 / 2 = +3である.誤
4.金属 Al は、濃硝酸に触れると表面に緻密な酸化物の枝膜が形成される。
濃硝酸は非常に酸化力の強い酸であり,金属アルミニウムの表面に酸化アルミニウムの皮膜を形成する作用がある.正
問8
金属イオンを含む塩の水溶液に金属片を浸して、その表面に金属が析出する
かどうかを調べた。金属イオンを含む塩と金属片の組合せのうち金属が析出しないものはどれか。最も適当なものを、次の1~4のうちから一つ選べ。

金属が析出する=イオン化傾向が小さい(陽イオンになりやすい=イオン化傾向が大きい)である.上の表の金属をイオン化傾向が大きい順に並べると,亜鉛(Zn)>スズ(Sn)>鉛(Pb)>銅(Cu)>銀(Ag)である.したがって,実験結果は以下のとおりになる.
1.亜鉛がイオン化してスズが析出する
2.亜鉛がイオン化して銅が析出する
3.鉛はイオンのままで銅は析出しない
4.銅がイオン化して銀が析出する
答:3
問9
2価の強酸の水溶液Aがある。このうち 5 mL をホールピペットではかり取り,コニカルビーカーにいれた。 これに水 30 mL とフェノールフタレイン溶液一滴を加えて,モル濃度 x (mol/L) の水酸化ナトリウム水溶液で中和滴定したところ、中和点に達するのに y (mL) を要した 。水溶液A中の強酸のモル濃度は何 mol/L か。モル濃度を求める式として正しいものを、次の1~8のうちから一つ選べ。
滴定中和点とはH+とOH–の物質量が等しくなったときのことを指す.水 30 mL は酸を希釈しただけでH+の物質量に影響しないので惑わされないように.

答:xy/10 (mol/L)
第2問
次の文章を読み、後の問い(問1~5)に答えよ。
ある生徒は,「血圧が高めの人は,塩分の取りすぎに注意しなくてはいけない」という話を聞き、しょうゆに含まれる塩化ナトリウム NaCl の量を分析したいと考え、文献を調べた。
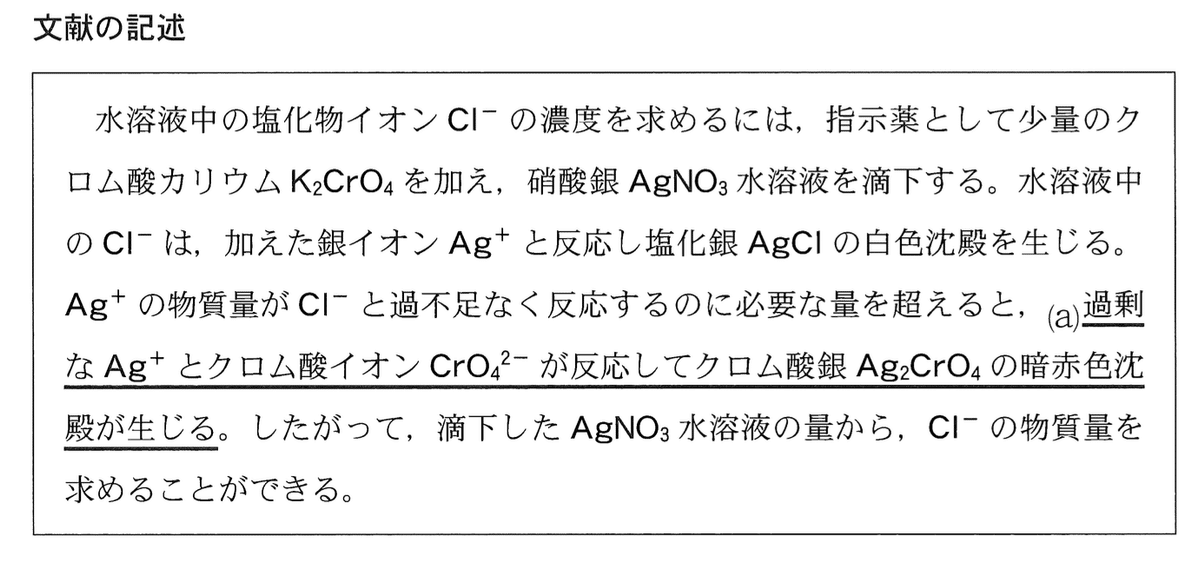
そこでこの生徒は、3種類の市販のしょうゆA~Cに含まれるCI の濃度を分析 するため、 それぞれに次の操作I~Vを行い,表 1 に示す実験結果を得た。た だし、しょうゆには CI– 以外に Ag+ と反応する成分は含まれていないものとする。
操作I ホールピペットを用いて,250 mL のメスフラスコに 5.00 mL のしょうゆをはかり取り、標線まで水を加えて、しょうゆの希釈溶液を得た。
操作II ホールピペットを用いて、操作Iで得られた希釈溶液から一定量をコニカルビーカーにはかり取り、水を加えて全量を 50 mL にした。
操作III 操作IIのコニカルビーカーに少量の K2CrO4 を加え、得られた水溶液を試料とした。
操作IV 操作IIIの試料に 0.0200 mol/L の AgNO3 水溶液を滴下し、よく混ぜた。
操作V 試料が暗赤色に着色して,よく混ぜてもその色が消えなくなるまでに要した滴下量を記録した。

問1
下線部(a)に示した CrO4(2–) に関する次の記述を読み,後の間い(a・b)に答えよ。
この実験は水溶液が弱い酸性から中性の範囲で行う必要がある。強い酸性の 水溶液中では、次の式(1)に従って、CrO4(2–) からニクロム酸イオン Cr2O7(2–) が生じる。

したがって、試料が強い酸性の水溶液である場合、CrO4(2–) は Cr2O7(2–) に変化してしまい指示薬としてはたらかない。式(1)の反応では、クロム原子の酸化数は反応の前後で(エ)。
a 式(1)の係数(ア)〜(ウ)に当てはまる数字を、後の1~9のうちから一つずつ選べ。
両辺で原子の個数が一致するように係数を選べばよいので,
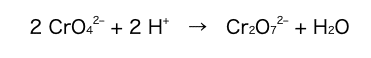
答:(ア)2,(イ)2,(ウ)1
b 空欄(エ)に当てはまる記述として最も適当なものを、後の1~4のうちから一つ選べ。
酸素原子の酸化数は –2 である.
CrO4(2–)では全体の酸化数が –2 なので,+6 – 8 = –2 となって,クロム原子の酸化数は +6 である.
Cr2O7(2–)では全体の酸化数が –2 なので,+12 – 14 = –2 となって,クロム原子の酸化数は +6 である.
答:変化せず、どちらも +6 である
問2
操作IVで,AgNO3 水溶液を満下する際に用いる実験器具の図として最も適 当なものを、次の1~4のうちから一つ選べ。

1.ホールピペット(決まった量の液体をはかり取るための器具)
2.ビュレット(滴定用の器具)
3.駒込ピペット(液体を別の容器に迅速に移動するための器具)
4.分液ろうと(互いに混じり合わない液体同士を分離するための器具)
答:2
問3
操作I~Vおよび表1の実験結果に関する記述として誤りを含むものを、次の1~5のうちから二つ選べ。
1.操作Iで用いるメスフラスコは、純水での洗浄後にぬれているものを乾燥 させずに用いてもよい。
しょうゆをメスフラスコに入れたあと,水で希釈するので,メスフラスコは濡れたまま使用してもよい.正
2.操作IIIの K2CrO4 および操作IVの AgNO3 の代わりに、それぞれ Ag2CrO4 と硝酸カリウム KNO3 を用いても,操作I~Vによって CI– のモル濃度を正しく求めることができる。
操作IIIの K2CrO4 は呈色指示薬であり,試料溶液に加える量は正確である必要はない(数滴加えればよい).K2CrO4の代わりにAg2CrO4を用いた場合,その Ag+ の物質量が不正確であるから,Ag+ と結合する Cl– およびNO3–(操作IVで滴下する) の物質量も不正確になってしまう.そのため,試料に含まれる Cl– の濃度を正しく求めることができない.誤
3.しょうゆの成分として塩化カリウム KCI が含まれているとき、しょうゆ
に含まれる NaCl のモル濃度を,操作I ~Vにより求めたCI のモル濃度と等しいとして計算すると、正しいモル濃度よりも高くなる。
この実験では,試料に含まれる Cl– の濃度を決定できるが,[Na+] = [Cl–] として計算すると,実際には [Na+] + [K+] = [Cl–] なので,NaCl の正しいモル濃度よりも高い値を示す.正
4.しょうゆCに含まれる CI– のモル濃度は、しょうゆBに含まれる CI– のモル濃度の半分以下である。
操作IIで,しょうゆCはしょうゆBの2倍量の 10.00 mL をはかり取っているので,これを半量(しょうゆBと同量)の 5.00 mL にして同じ操作をおこなうと,AgNO3の滴下量も半分の 6.85 mL になるはずである.この量はしょうゆBの滴下量(15.95 mL)の半分以下なので,しょうゆCに含まれる Cl– のモル濃度はしょうゆBに含まれる CI– のモル濃度の半分以下になる。正
5.しょうゆA~Cのうち,CI– のモル濃度が最も高いものは、しょうゆAである。
AgNO3 の滴下量が多いほど Cl– のモル濃度が高いので,CI– のモル濃度が最も高いものは、しょうゆBである。誤
問4
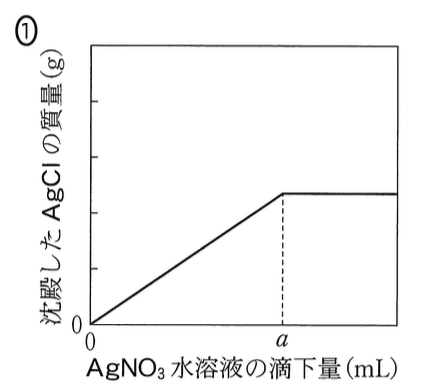
操作IVを続けたときの、AgNO3 水溶液の滴下量と、試料に溶けている Ag+ の物質量の関係は図1で表される。ここで,操作Vで記録した AgNO3 水溶液 の滴下量は a (mL) である。このとき,AgNO3 水溶液の滴下量と,沈殿した
AgCI の質量の関係を示したグラフとして最も適当なものを、後の1~6のう ちから一つ選べ。ただし、CrO4(2–)と反応する Ag+ の量は無視できるものと する。
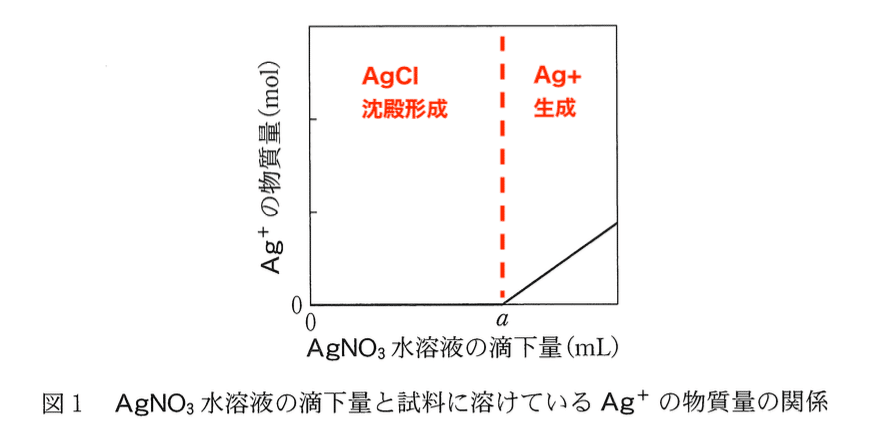
図1より,Ag+ の滴下量が a (mL)までは AgCl の沈殿が増加していく.また,溶液中の Cl– が消費されてすべて AgCl の沈殿になったあとは,それ以上 Ag+ を滴下しても AgCl の沈殿は増加しない.したがって,答は以下のグラフである.
問5
a しょうゆAに含まれる CI- のモル濃度は何 mol/L か。
表1より,クロム酸銀(Ag2CrO4)の沈殿が形成されはじめた時点での AgNO3 溶液の滴下量は 14.25 mL であり,また,その濃度は 0.0200 mol/L であるから,滴下した Ag の物質量(mol)は
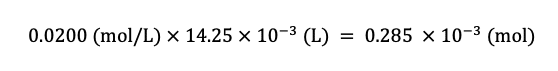
この Ag の物質量は,操作IIにおいてコニカルビーカー に存在する Cl– の物質量と等しい.さらに,操作IにおいてしょうゆAは50倍に希釈されている(5.00 mL のしょうゆAを水で希釈して 250 mL にした)ので, Cl– のモル濃度は
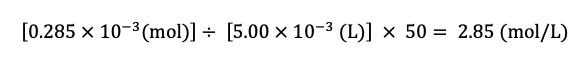
答:2.85 (mol/L)
b 15 mL ( 大さじ一杯相当) のしょうゆAに含まれる NaCl の質量は何g か。ただし、しょうゆA に含まれるすべての CI は NaCI から生じたものとし、NaCl の式量を 58.5 とする。

答:2.5 (g)
