
厚労省コロナワクチン副作用データを紹介します

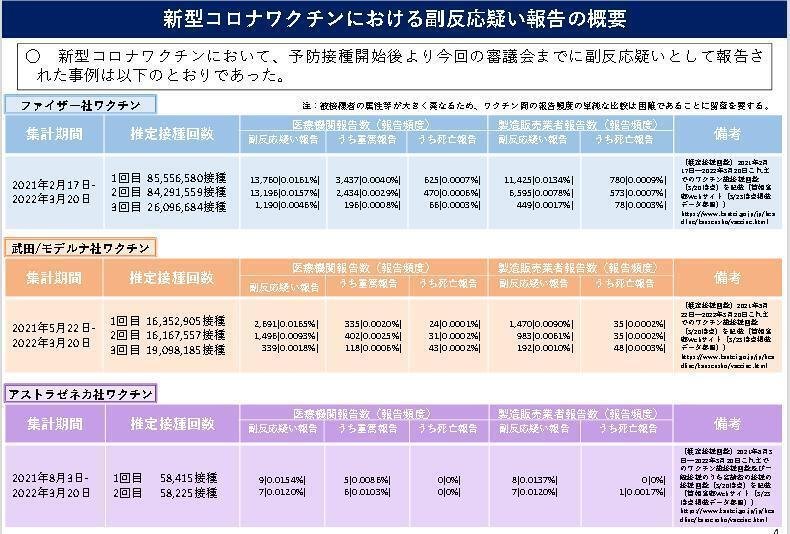
下記は2021年12月5日時点でのデータです

インフルエンザワクチンとコロナワクチンでは報告基準に違いがあります。
■下記は新型インフルエンザワクチンの報告基準です
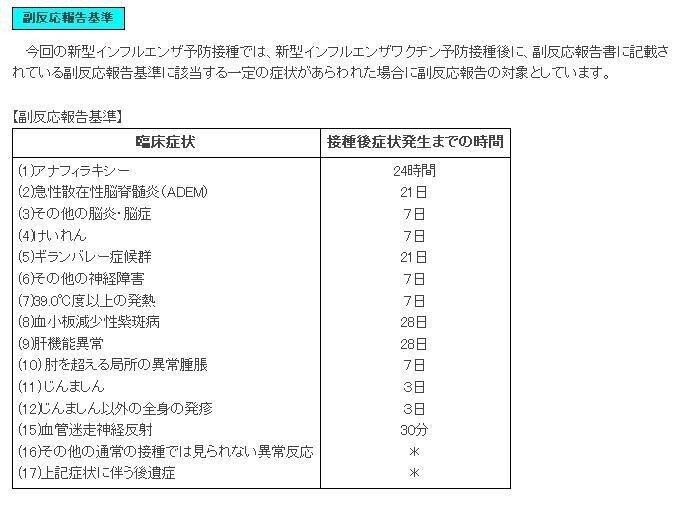
■令和元年シーズンのインフルエンザワクチンの報告基準

https://www.mhlw.go.jp/content/11120000/000681710.pdf
コロナワクチンの有害事象報告基準

上記のようにアナフィラキシーは4時間まで、それ以外に関しては医師が関連性が高いと認める症状でありかつ入院、治療が必要なもの、死亡、身体の障害に至るケース、死亡若しくは身体の機能の障害に至るおそれのあるケースとかなり限定されています。なお下記の症状については積極的に報告されるよう指導されていますが…インフルエンザワクチンと報告基準が大分変わっていることにお気づきでしょうか?
ワクチン接種との因果関係が示されていない症状も含め、幅広く評価を行うため、当面の間、以下の症状について、報告を積極的にご検討ください。
けいれん、ギラン・バレ症候群、急性散在性脳脊髄炎(ADEM)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳炎・脳症、関節炎、脊髄炎、心筋炎、顔面神経麻痺、血管迷走神経反射(失神を伴うもの)
新型コロナワクチンの
副反応疑い報告基準の設定について
https://www.mhlw.go.jp/content/10601000/000739053.pdf

実際に報告されない死亡例が多数出ています。例えば摂取翌日に亡くなった71歳男性のケースでは突然死と診断されました。遺族は報告してほしいという意向を伝えましたが医師から報告するケースには当たらないと断られたとされています…
厚労省が公開 コロナワクチン有害事象報告

■副反応疑い報告の状況について
https://www.mhlw.go.jp/content/10601000/000928874.pdf
ファイザー社ワクチン副反応疑い報告 28146人 うち重篤報告 6067人
モデルナ社ワクチン副反応疑い報告 4526人 うち重篤報告 855人
アストラゼネカ社ワクチン副反応疑い報告 16人 うち重篤報告 11人
有害有害事象登録数累計 32688件 重篤 6933件
■新型コロナワクチン接種後の死亡として報告された事例の概要
(コミナティ筋注、ファイザー株式会社)
https://www.mhlw.go.jp/content/10601000/000928692.pdf
1514人+21人 累計1535人
■新型コロナワクチン接種後の死亡として報告された事例の概要
(モデルナ筋注、武田薬品工業株式会社)131件の死亡例
https://www.mhlw.go.jp/content/10601000/000928694.pdf
ファイザー+モデルナ 累計死亡者数 1667件
■新型コロナワクチン接種後の死亡として報告された事例の概要
(バキスゼブリア筋注、アストラゼネカ株式会社) 1件
https://www.mhlw.go.jp/content/10601000/000928695.pdf
■予防接種法に基づく医療機関からの副反応疑い報告状況について(コミナティ筋注・報告症例一覧)
https://www.mhlw.go.jp/content/10601000/000928663.pdf
■予防接種法に基づく医療機関からの副反応疑い報告状況について(COVID-19ワクチンモデルナ筋注・報告症例一覧)
https://www.mhlw.go.jp/content/10601000/000928667.pdf
■予防接種法に基づく医療機関からの副反応疑い報告状況について(バキスゼブリア筋注・報告症例一覧)
https://www.mhlw.go.jp/content/10601000/000928668.pdf
■新型コロナワクチン接種後のアナフィラキシー疑いとして
製造販売業者から報告された事例の概要
(コミナティ筋注、ファイザー株式会社)
https://www.mhlw.go.jp/content/10601000/000928696.pdf
■新型コロナワクチン接種後のアナフィラキシー疑いとして
製造販売業者から報告された事例の概要
(COVID-19 ワクチンモデルナ筋注、武田薬品工業株式会社)
https://www.mhlw.go.jp/content/10601000/000928697.pdf
■新型コロナワクチン接種後のアナフィラキシー疑いとして報告された事例の概要(バキスゼブリア筋注)
https://www.mhlw.go.jp/content/10601000/000928698.pdf
累計アナフィラキシー 3754件
■薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・報告症例一覧)
https://www.mhlw.go.jp/content/10601000/000928673.pdf
■薬機法に基づく製造販売業者からの副反応疑い報告状況について(COVID-19ワクチンモデルナ筋注・報告症例一覧
https://www.mhlw.go.jp/content/10601000/000928675.pdf
■薬機法に基づく製造販売業者からの副反応疑い報告状況について(バキスゼブリア筋注・報告症例一覧
https://www.mhlw.go.jp/content/10601000/000928676.pdf
■薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・基礎疾患等及び症例経過)
https://www.mhlw.go.jp/content/10601000/000928682.pdf
■薬機法に基づく製造販売業者からの副反応疑い報告状況について(COVID-19ワクチンモデルナ筋注・基礎疾患等及び症例経過)
https://www.mhlw.go.jp/content/10601000/000928683.pdf
■薬機法に基づく製造販売業者からの副反応疑い報告状況について(バキスゼブリア筋注・基礎疾患等及び症例経過)
https://www.mhlw.go.jp/content/10601000/000928684.pdf
■薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注5~11歳用・集計対象期間における基礎疾患等及び症例経過)
https://www.mhlw.go.jp/content/10601000/000928690.pdf
■副反応疑い報告の状況について(症状別報告件数(10代)、医療機関からの報告)
https://www.mhlw.go.jp/content/10601000/000861777.pdf
ファイザー+モデルナ+アストラゼネカ 各社添付文書
■新型コロナワクチン「コミナティ筋注」(ファイザー株式会社)添付文書https://www.mhlw.go.jp/content/10601000/000861778.pdf
改正版ファイザー添付文書
https://www.mhlw.go.jp/content/10601000/000928173.pdf
■新型コロナワクチン「コミナティ筋注5~11歳用」(ファイザー株式会社)添付文書
https://www.mhlw.go.jp/content/10601000/000928182.pdf


■新型コロナワクチン「COVID-19ワクチンモデルナ筋注」(武田薬品工業株式会社)添付文書
https://www.mhlw.go.jp/content/10601000/000861779.pdf
こちらも劇薬であり特例承認医薬品であるということをご理解ください。本剤は特例承認されたものであることはきちんと明記されています。またモデルナではファイザーよりも心筋炎、心膜炎等の報告事例が多い傾向にあります


■新型コロナワクチン「バキスゼブリア筋注」(アストラゼネカ株式会社)添付文書
https://www.mhlw.go.jp/content/10601000/000861780.pdf
最新版はこちら
https://www.mhlw.go.jp/content/10601000/000928181.pdf
同様に劇薬であり特例承認医薬品であると記載されております。下記のように注意時効が記載されていますのできちんとリスクを把握しておく必要があります。果たしてこれを超える恩恵を受けることができますか?
■接種後に注射による心因性反応を含む血管迷走神経反射として失神があらわれることがある
■アナフィラキシーがあらわれることがある
■接種後に、非常にまれに脱髄疾患が報告されている
■本剤接種後に重篤な、血小板減少症を伴う血栓症(一部には出血
が伴う)が認められている。この中には、脳静脈洞血栓症や内臓静
脈血栓症等の、非常にまれな静脈血栓症や動脈血栓症が含まれて
いる。多くは本剤接種後28日以内に発現しており、致死的転帰の
症例も報告されている
■本剤接種のの4~28日後は重度もしくは持続的な頭痛、霧
視、錯乱、痙攣発作、息切れ、胸痛、下肢腫脹、下肢痛、持続的な腹痛、
あるいは接種部位以外の皮膚の内出血もしくは点状出血等の症状に注意し、これらの症状が認められた場合には直ちに医師の診察を受けるように指導すること
■本剤接種後に、非常にまれに毛細血管漏出症候群が報告されている。被接種者に対しては、毛細血管漏出症候群が疑われる症状(手足の浮腫、低血圧等)が認められた場合には直ちに医師等に相談するよう、あらかじめ説明すること。
■本剤との関連性は確立されていないが、本剤接種後に、非常に
まれにギラン・バレー症候群が報告されている。被接種者に対し
ては、ギラン・バレー症候群が疑われる症状(四肢遠位から始まる
弛緩性麻痺、伳反射の減弱ないし消失等)が認められた場合には直
ちに医師等に相談するよう、あらかじめ説明すること



特例承認医薬品であるという事実を注視しなくてはなりません
コロナワクチンはいずれも特例承認医薬品であるためその適応には前提条件が必要になります。緊急の使用が必要であり、かつそれ以外に有効な治療法がないという前提を元に承認されるため他の医薬品のように充分な臨床試験が完了しているわけではありません。
もちろん全くされていないわけではありませんが開発⇒承認までの期間が通常の医薬品と比べて短期間であるためその有効性と安全性に懸念があります。ここで注意しなくてはならないのが他に有効な治療法がないという前提です。つまり本当に有効な治療法があると特例承認された医薬品は使えないため…有効なものほどなかなか承認されづらくなります
例えば安価で副作用の少ない医薬品で治療できてしまったらワクチンは当然いらなくなりますがそうなると困る人たちがワクチン利権に関わる人です。さてこの超巨大利権に関わりのない人とは?関わりのある人とはいったい誰のことでしょうか?当然利権側であればワクチンを推進してきますが…

新薬にはまだ充分な臨床結果が当然ながら得られていないうえに特例承認の医薬品は国内での実証実験は、圧倒的に少ないので当然安全性の懸念はつきません
mRNAワクチンに使われているポリエチレングリコールも注射で接種されてしまうとその場に留まり続けてしまい。アナフィラキシーの原因になると言われております
インフルエンザワクチンとの比較でわかる圧倒的な有害事象報告数

■平成28年インフルエンザワクチン有害事象
■平成29年インフルエンザワクチン有害事象
■平成30年インフルエンザワクチン有害事象
■令和元年インフルエンザワクチン有害事象
コロナワクチンの有害事象については2022年4月1日までの集計であり日々増え続けております。この圧倒的な有害事象の違いを見れば今までのワクチンとコロナワクチンは全く違うものであるということはご理解いただけるのではないでしょうか?
定期的にチェックしていただきたい厚労省の副作用データが公開されるWEBページ
上記のページは約2週間おきに有害事象報告が更新されますので是非定期的にチェックしてください。テレビやその他のメディアではこのような不都合な事実については全く報道されませんので知らない方が本当に多いのです。当記事でも随意更新していきますので手間な方はコチラのページよりご確認ください
お住まいの市役所のホームページにコロナワクチンの副反応のデータは紹介されていますか?
今回のコロナワクチンは全く新しいテクノロジーが使われている、安全性が未知数のワクチンですが副反応に関する記載が多くの市役所のホームページで確認できておりません。例えば下記は広島市の公式のWEBページですがこちらではきちんと厚労省の有害事象が更新されるリンクに案内されております。
もしもお住まいの市役所のホームページに上記のように厚労省の副反応が公開されているページへのリンクがないという方は是非、市役所へ掲載して市民に周知してほしいと依頼しましょう。誰もが正しい判断をするためにはこのようなデータは欠かせません。不都合な事実を知らないと正しい判断は決してできないのでまずはお住まいの役所のホームページをご確認ください
この記事が気に入ったらサポートをしてみませんか?
