多発性血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)フランス血管炎研究グループコホート登録患者383名の臨床的特徴および長期追跡調査
PMID: 23044708
https://onlinelibrary.wiley.com/doi/10.1002/art.37721
概要
目的
多発血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)(EGPA)の先行研究では、患者数や追跡期間が限られており、抗好中球細胞質抗体(ANCA)の状態によって、診断時の臨床症状が異なることが示されたが、予後は異なることが示された。本研究は、より大規模な患者コホートの主な特徴と長期転帰を説明するために実施された。
研究方法
American College of Rheumatologyの基準および/またはChapel Hillの定義を満たすFrench Vasculitis Study Groupのコホート内のEGPA患者を対象としたレトロスペクティブな研究が行われました。患者の特徴および転帰は、ANCAの状態および診断年によって比較された。
結果
1957年から2009年6月までに診断され、平均±SDで66.8±62.5ヵ月間追跡された383人の患者(128人[33.4%]は1997年以前)を同定した。診断時の平均±SD年齢は50.3±15.7歳で,91.1%が喘息であった(期間9.3±10.8年)。主な症状は、末梢神経障害(51.4%)、耳鼻咽喉科症状(48.0%)、皮膚病変(39.7%)、肺浸潤(38.6%)、心筋症(16.4%)であった。診断時にANCAを検査した348人のうち、ANCA陽性患者108人(31.0%)は、ANCA陰性患者に比べ、耳鼻科症状、末梢神経障害、腎障害の頻度が有意に高く、心臓症状の頻度は少なかった。血管炎の再発は,ANCA 陽性患者の 35.2% 対 ANCA 陰性患者の 22.5% で発生し(P = 0.01),死亡はそれぞれ 5.6% 対 12.5% であった(P < 0.05).5 年間の無再発生存率は,ANCA 陽性患者で 58.1%(95% 信頼区間 [95% CI] 45.6-68.6),ANCA 陰性患者で 67.8%(95% CI 59.8-74.5)だった(P = 0.35).多変量解析では、心筋症、高齢、および1996年中またはそれ以前の診断が死亡の独立した危険因子であり、診断時の好酸球数の低さが再発の予測因子であることが確認された。
結論
EGPA患者の特徴および長期転帰は、ANCAステータスの違いによって異なっている。EGPAの再発は依然として頻繁であるが、死亡率は少なくとも1996年以降低下している。
多発性血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)(EGPA)は、小血管を主に侵す、まれではあるが生命を脅かす可能性のある全身性壊死性血管炎の一つである(1-3)。1951年に初めて報告されて以来(4)、いくつかの報告シリーズが発表されているが、いずれも患者数は120人未満で、追跡調査も限定的であった(5-15)。EGPAの病態はまだ部分的にしか解明されていないが、罹患者の30~40%が抗好中球細胞質抗体(ANCA)を有することが一貫して判明しており、主に免疫蛍光法(IF)で核周囲の標識パターンを持つANCA、酵素結合免疫吸着法(ELISA)で通常ミエロペルオキシダーゼ(MPO)に対して指向性を示すANCAが認められる(13、16、17)。我々のグループが報告した112人の患者を含む最新の2つのシリーズでは、ANCA陽性患者はANCA陰性患者と異なり、心病変の頻度は低いが腎臓病および末梢神経病変の頻度は高いことが同時に示された(16, 17)。しかし、1996年以降、EGPA関連心筋症は予後不良であり(6、18、19)、消化器、中枢神経系、腎臓の病変も認められるにもかかわらず、ANCA有無による予後の相違は認められなかった。その理由の一つは、これらの研究の平均追跡期間が比較的短く、3年を超えていなかったことである(French Vasculitis Study Group [FVSG]の分析では平均±SD 34±23ヶ月)[17])。
そこで、1983年の開始以来FVSGのコホートデータベースに登録されている全EGPA患者(既報112例(6、17、19)を含む)について新たに調査を行い、その特徴をさらに分析し、ANCA状態および診断年によって長期転帰が異なるかどうかを判断することにした。また、再発の定義を厳格にし、非特異的および孤立的な喘息またはアレルギー性鼻炎の再燃を別々に分析することにより、血管炎再発の潜在的な予測因子の特定も試みた。
患者および方法
患者
2009年7月以前にFVSGデータベースにデータが登録された、米国リウマチ学会(ACR)1990年基準(20)および/またはチャペルヒル定義(1)によるEGPA患者を対象に、系統的なレトロスペクティブ研究を実施した。(FVSGのメンバーについては付録Aを参照)FVSGデータベースは、1983年にCommission Nationale Informatique et Libertésに申告されて以来、すべての患者データが収集されている。前向き治療試験に参加した患者については、登録時にデータの前向き収集とさらなる分析について書面によるインフォームド・コンセントが得られた。その他の患者には、データの削除を求める無制限の権利を証明する口頭および書面での情報提供を行った。EGPAの診断は、研究者(CC、CP、LG)が追跡期間全体を考慮して再評価し、最終的に他の全身性好酸球性疾患と診断された患者を除外した(21)。また、データ不足の患者(1回しか受診していない、あるいは臨床的詳細が不明)、ヒト免疫不全ウイルスやC型肝炎ウイルス感染の合併、クリオグロブリン血症、その他の全身性疾患を持つ患者も除外された。
ベースライン測定。
臨床試験に参加した患者については、1983 年から FVSG の臨床試験で使用されている標準的な記録用紙からデータを抽出した。その他の患者については、カルテを検索し、人口統計学的特徴および臨床的、生物学的、放射線学的、組織学的所見について検討した。記録され分析された臨床症状のうち、以下の定義が適用された。発熱は38.5℃以上の体温、体重減少は診断前3カ月間の3kg以上の減少、外科的腹部は介入または少なくとも外科医への診察を必要とする重度の消化器症状として定義した。心筋症を含む心臓の症状は、臨床所見と超音波検査および心電図検査の結果に基づいて診断された(これにより、Five-Factors Score [FFS] の定義に対応)(19)。生物学的パラメータとしては、蛋白尿(0.4gm/24時間以上)、血清クレアチニン値、診断時のC反応性蛋白(CRP)値、ANCA状態(診断時または経過中に血清中のANCAが最初は陰性であっても、IFやELISAで検出された場合は陽性とみなす)などが検討された。ANCA検査が普及する前にEGPAと診断された患者については、これらの検査は診断時に採取され、可能であれば凍結された血清検体を用いて実施された。生検所見も、正常または血管炎、肉芽腫、好酸球浸潤(または腎生検標本では壊死性糸球体腎炎)の証拠を示すものとして記録された。
疾患活動性とスコア。
疾患活動性は、オリジナルの1994年版バーミンガム血管炎活動性スコア(BVAS)(22)を用いて診断時に評価し、データベースに記録した。1996年に考案された5項目(重篤な血管炎関連胃腸病変、中枢神経系病変、心筋症、血清クレアチニン値140μモル/リットル以上、蛋白尿1gm/24時間以上)に基づく予後FFSを記録した(19)。は,EGPA(血管炎に関連した重度の胃腸病変および/または心病変,血清クレアチニン値>150μモル/リットル,65歳以上,耳鼻咽喉(ENT)症状がない)の改訂FFSと同様であった(23).すべてのスコアは、FVSG データベースから取得するか、スコアリングシステムが作成される前に診断された患者について遡及的に計算されたものである。
治療手順
臨床試験に参加した患者は、予定された治療レジメンに従って治療された(24-29)。その他の患者は、診断された時点で標準治療と考えられていた方法で治療された。寛解を得るために使用された薬剤、維持または再発のためにその後投与された薬剤(該当する場合)、および最終評価時のプレドニゾン量(入手可能な場合)が記録された。
アウトカム
再発、副腎皮質ステロイド治療の終了、死亡とその原因、追跡調査中に発生した癌などの転帰が調査された。再発は、1)3ヵ月以上の寛解期間後に臨床的EGPA症状が再発または悪化した場合、または2)免疫抑制剤の追加または変更の必要性、および/またはプレドニゾンの再投与、もしくはプレドニゾンの投与量が前回の2倍以上に増加し、合計投与量が30mg/日超となった場合のいずれかとあらかじめ定義された。他の臨床的EGPA症状を伴わない好酸球数の増加、または好酸球数の増加を伴うかどうかにかかわらず、患者の紹介医師が治療上の調整を正当化するために臨床的に重要であると考えた場合には、孤立性の喘息、副鼻腔炎、鼻炎の増悪を記録したが、それ自体は失敗、EGPA症状の再発、または再燃とはみなされず、別々に解析された。寛解は、EGPA血管炎症状(肺実質病変、末梢神経病変、または皮膚、心臓、CNS、腎臓、および/または胃腸の徴候)に起因する疾患活動性が連続3カ月以上なく、BVAS 0に相当するものと定義しました。 この寛解の定義によると、患者は孤立した喘息または鼻炎に対して所定のプレドニン投与量を依然として受けることが可能です。
統計解析
患者の特性は、カテゴリー変数については数と割合で、連続変数については平均±SDで報告されている。患者のサブセットは、ANCAステータス、性別、または診断年に基づいて設定された。これらのサブセットについて、定量変数はスチューデントのt検定で、カテゴリー変数はカイ二乗検定またはフィッシャーの正確検定で、それぞれ比較した。患者の生存率は生命表とKaplan-Meier法(30)を用いて分析し、対数順位検定(31)を用いて比較した。生存率は、EGPAの診断時から死亡または最終フォローアップ受診時までを計算した。無再発生存率は、EGPAの診断時から再発、死亡、またはフォローアップ終了までの期間を算出した。
主な患者属性(性別,診断時年齢,1996年以前/1996年中または1996年以降,すなわちFFSが考案された後の診断年,治療試験への参加歴),一変量解析で P ≦ 0.20 となった臨床,生物,治療パラメーター(最初の治療レジメンまたはフォローアップ中の免疫抑制剤1種類以上)は,死亡または再燃の独立予測因子として多変量Cox比例ハザードモデルで扱った.FFSと改訂版FFSは、複合項目がすでに個別に解析されていたため、多変量モデルには含めなかった。最終モデルのパラメータを決定するために、バックワードステップワイズ法を用いた(32)。結果は、ハザード比(HR)および95%信頼区間(95%CI)で表した。追跡期間中に観察されたがんの標準化発生率(SIR)は、フランスの一般集団における予想がん発生率と比較するために、対応する性および年齢で計算した(1975年から2005年の予想がん発生率は http://www.invs.sante.fr/surveillance/cancers/estimations_cancers/default.htm から取得し、1975年より前の期間と2005年より後の期間の発生率はそれぞれ使用した)。統計解析はすべてStataソフトウェアバージョン10(StataCorp)を用いて行ったが、SIRの算出はPamcompソフトウェアバージョン1.41(33)で計算した。P 値が 0.05 未満の場合は有意であるとみなした。
結果
患者の特定と特徴
感染症や全身疾患を併発し、かつ記録データが不十分な60人を除外した後、FVSGデータベースから、対象基準を満たし、1957年3月から2009年7月までにEGPAと診断された383人の患者を特定した。追跡調査中に他の全身性好酸球性疾患と診断が変更されたために除外された患者はいなかった。これらの患者さんのうち、210人(54.8%)が前向き治療試験(24-29)に参加しており、128人(33.4%)が1996年以前に診断された患者さんであった。これらの患者の人口統計学的特徴および診断時の主な臨床症状を表1に示す。
表1. EGPA患者383人の診断時の主な臨床的特徴(ANCA状態による)*
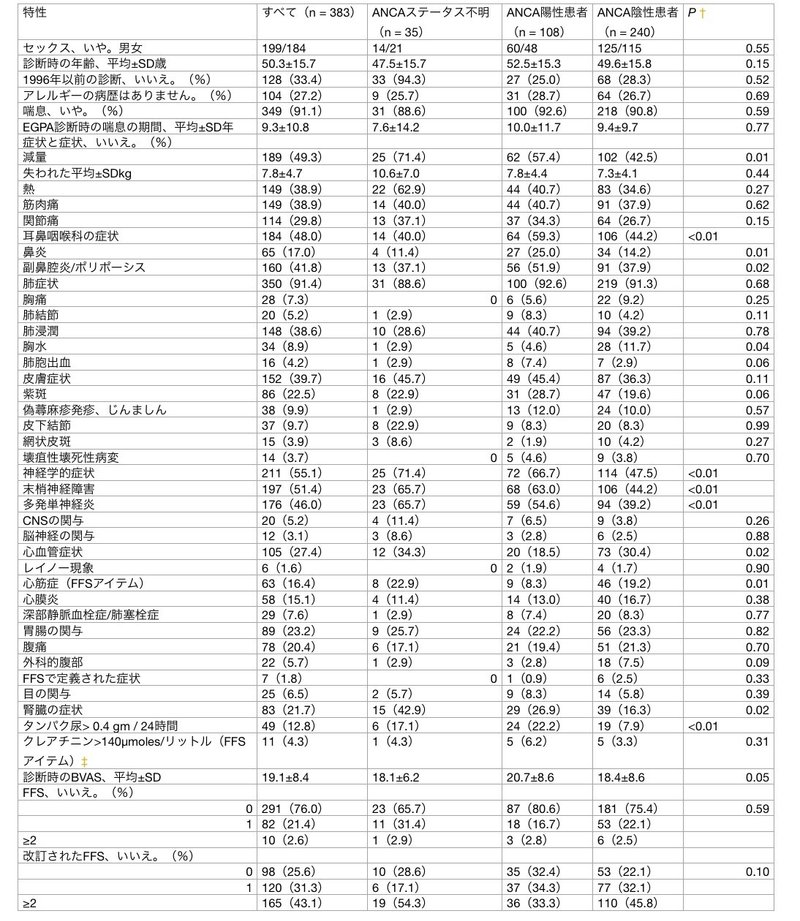
* EGPA = 多発性血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)、ENT = 耳、鼻、喉、CNS = 中枢神経系、FFS = 5因子スコア、BVAS = Birmingham Vasculitis Activity Score(バーミンガム血管炎活動性スコア)。抗好中球細胞質抗体(ANCA)陽性患者と ANCA 陰性患者との比較のため。‡診断時の血清クレアチニン値は、254人の患者(ANCA状態不明の患者23人、ANCA陽性の患者81人、ANCA陰性の患者150人)について入手可能でした。
診断時の平均±SD年齢は50.3±15.7歳で、男女比は1.08と、どちらの性別も優勢ではなかった。383人の患者のうち、376人(98.2%)が白人、4人(1%)がアフリカ系またはカリブ海系、3人(0.8%)がアジア系であった。EGPA診断時に349名(91.1%)が喘息を有しており,喘息歴は平均±SDで9.3年±10.8年,EGPA診断前に6カ月以内に顕在化したのは13名(3.4%)であった.残りの34人はEGPA診断後6カ月以内に耳鼻咽喉科的徴候および/または喘息を発症した(n = 6)。診断時に最も多く見られたEGPA症状は,体重減少(49.3%),多発性単神経炎(46.0%),非びらん性副鼻腔炎/ポリポーシス(41.8%),皮膚病変(39.7%)および肺浸潤(38.6%)であった.胸水は34例(8.9%)に認められ,そのうち14例(3.7%)は心筋症も合併していた.肺胞出血は16名(4.2%)に認められ、そのうち6名は肺胞出血(1名のみ大量)と腎臓症状の両方を有していた。心臓,消化管,腎臓の病変はそれぞれ27.4%,23.2%,21.7%に認められたが,FFSの重症例定義に合致したのは16.4%(心筋症),1.8%(手術合併症),4.3%(クレアチニン値140μmoles/リットル以上)だけであった.中枢神経系症状は20名(5.2%)に認められ,内訳は虚血性脳卒中8名(2.1%),出血性脳卒中2名(0.5%)であった.
表2に示すように、診断時には50%以上の患者が炎症性症候群を有し、平均±SDの血中好酸球数は7,569±6,428/mm3、最大値は34,110/mm3であった。基礎疾患である喘息のためにプレドニンを内服していた患者10名(2.6%)だけが、診断時に血中好酸球数が500/mm3未満であった。35人の患者(そのうち33人は1996年以前に診断された)は、ANCA検査ができなかった。残りの348人のうち108人(31.0%)がANCA陽性で,そのうち72人はIFで核周囲の標識パターンを示し,68人はELISAでMPO特異性を示した.ANCA陽性患者108人のうち18人は細胞質標識パターンがあり、4人はELISAでプロテイナーゼ3(PR3)特異性を示した。ANCA陽性者108名のうち3名はIFで核周囲と細胞質の両方の標識パターンを示し、1名はMPO陽性でELISAでPR3陽性の両方であった。残りの15人のANCA陽性患者は、非典型的なIF標識パターンを有していた。最初にANCAが陰性であった患者のうち、その後陽性となった者はいなかった。
表2. EGPA患者383人の診断時の主な生物学的特性(ANCA状態による)*
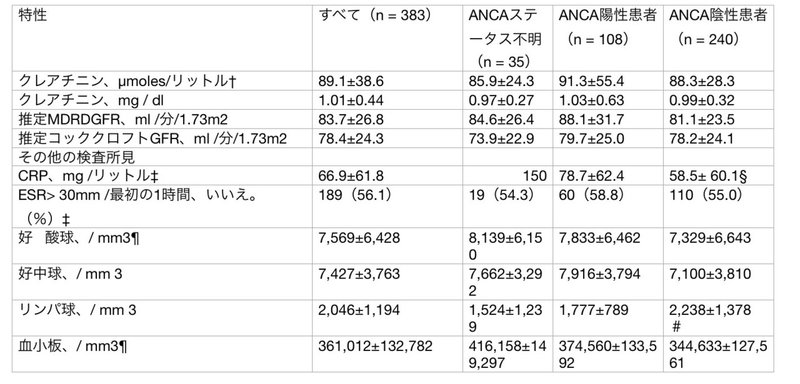
* 特に記載のない限り、数値は平均値±SDです。EGPA = 多発性血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)、MDRD GFR = Modification of Diet in Renal Disease糸球体濾過速度。診断時の血清クレアチニン値は、254人(抗好中球細胞質抗体[ANCA]の状態が不明な患者23人、ANCA陽性患者81人、ANCA陰性患者150人)から入手できました。また、赤血球沈降速度(ESR)については、337人(ANCA状態不明35人、ANCA陽性102人、ANCA陰性200人)の患者についてデータが得られています。§ P = 0.04 対 ANCA 陽性患者。254人の患者(ANCA状態不明の患者21人、ANCA陽性の患者87人、ANCA陰性の患者146人)について、完全な白血球数および血小板数が得られている。# P = 0.03 対 ANCA 陽性患者。
1生検を受けた180名のうち、145名がEGPAの診断を裏付ける組織学的所見を有していた(血管炎61.0%、好酸球浸潤61.3%、肉芽腫33.3%)。これら145名のうち、130名についてANCA結果が得られ、52名(40%)がANCA陽性であった(これらの患者の詳細については、Arthritis & Rheumatismウェブサイト http://onlinelibrary.wiley.com/journal/10.1002/(ISSN)1529-0131 で公開されている補足表1を参照されたい)。より正確には、74名が神経生検、40名が筋生検を受け、それぞれ45名、20名(生検感度61%、50%)でEGPAの診断が支持された。心筋生検9例(感度89%)、開胸肺生検13例(感度77%)、経気管支生検21例(感度52%)、鼻・副鼻腔粘膜生検23例(感度35%)、皮膚生検85例であった。皮膚生検の感度は88%に達したが,後者の主な所見は,好酸球性浸潤と肉芽腫を伴う非特異的な白血球破砕性血管炎で,皮膚生検陽性者のそれぞれ36%と10%にすぎなかった.腎生検は14例で,そのうち12例はpauci-immune型壊死性糸球体腎炎,2例は分節性糸球体腎炎と巣状糸球体腎炎であった.
診断時の患者特性(ANCA状態、診断年、性別による)。
表1に示すように、ANCA陽性患者はANCA陰性患者に比べ、耳鼻咽喉科症状、末梢神経障害、腎臓疾患の頻度が有意に高く、腎臓疾患は比較的まれであった。逆に、ANCA陰性患者では心筋症の頻度が有意に高かった。BVASとCRPの平均値はANCA陽性患者で有意に高かったが、ANCAの状態による他の大きな生物学的差異は認められなかった(表2)。生検でEGPAの診断が支持された患者では、組織学的に血管炎の特徴がANCA陽性患者でより頻繁に認められ(77.4%対ANCA陰性患者48.8%、P = 0.01)、顆粒球および好酸球の浸潤はANCA陽性患者のそれぞれ42.1%と63.2%に対してANCA陰性患者の29.0%と69.7%に認められた(それぞれP = 0.32 と P = 0.63)...(2)...
1996年以前に診断された患者は、1996年以降に診断された患者と比較して、診断時に若く(平均±SD 48.0 ± 15.7 歳 vs 51.8 ± 15.5 歳;P = 0.04 )、より頻繁に体質症状、喘息(96.0 ± 15.5 歳)を有していた。 1%対88.6%;P = 0.02)、多発性単神経炎(68.0%対35.0%;P < 0.01)、心筋症(22.7%対13.3%;P = 0.02)、腎臓病(31.3%対16.9%;P < 0.01) がより多く見られた。2つの期間に診断された患者は、EGPA診断前の喘息期間、FFS分布、平均BVAS、およびANCAステータスが入手可能な患者におけるANCA陽性頻度(28.4%対32.8%、P = 0.51)が同等であった(補足表2および3、Arthritis & Rheumatismウェブサイト http://onlinelibrary.wiley.com/journal/10.1002/(ISSN)1529-0131 で公開を参照されたい)。
EGPAの女性患者は、男性患者と比較して、診断時に有意に若く、EGPA診断前の喘息期間が長く、腎臓異常の頻度が少なかったが、生検証明された糸球体腎炎の頻度は男女とも同等であった。
治療法
寛解導入治療では、全例に副腎皮質ステロイドを投与し、214例(55.9%)に副腎皮質ステロイドと免疫抑制剤の併用投与を行いました。その内訳は、シクロホスファミドが217例(56.7%)、アザチオプリンが98例(25.6%)、メトトレキサートが26例(6.8%)、リツキシマブが3例(0.8%)であった。ANCA陽性患者のうち54名(50%)が導入療法として免疫抑制剤を投与され、76名(70.8%)が導入療法として免疫抑制剤を投与されました。 これは、ANCA陰性群における免疫抑制剤の使用頻度(導入療法時56.3%、追跡調査時70.4%、それぞれP = 0.28およびP = 0.99)と同程度であった。)
疾病の転帰。
平均±SDの追跡期間は66.8±62.5ヵ月(中央値50.5ヵ月)で、ANCA陽性患者とANCA陰性患者で同等であった(それぞれ64.6±56.2ヵ月、65.7±62.2ヵ月、P = 0.88)。追跡期間は,早期に死亡した患者を除いて,すべての患者で診断から 1 年を超えていた.45人の患者(11.7%)が死亡し、その内訳はANCA陽性患者6人、ANCA陰性患者30人、ANCA状態不明患者9人だった(粗死亡率 5.6% 対 12.5% [P < 0.05] 、25.7% 対 12.5%)。死亡したのは、平均±SDで50.4±60.1カ月(中央値21. 4ヵ月)であり、その原因は、14人の患者(ANCA陰性患者10人)の心イベント(心筋梗塞、心不全、不整脈)、5人の患者それぞれの感染症または癌であった。血管炎、呼吸器系イベント(重症喘息発作および末期慢性閉塞性肺疾患)が各4例、残り13例は雑原因(抗凝固療法中の出血2例、食物アレルギーによるアナフィラキシーショック1例など)であった。14件の致死的心疾患のうち、8件はEGPA関連心筋症が判明している患者で、診断から中央値14カ月(範囲3.5~136カ月)に発生し、診断から6カ月以内に発生したのは5件のみであった。
血管炎の再発は、ANCA陽性患者38人、ANCA陰性患者54人、ANCAステータス不明患者5人を含む97人(25.3%)に発生し(再発率はそれぞれ35.2%対22.5% [P = 0.01] と14.3%)、さらに72人(18.3%)が再発しました。 8%)が喘息の再燃、副鼻腔炎、および/または好酸球の増加を経験し、治療の調整が必要となった(ANCA 陽性患者 22 例、ANCA 陰性患者 46 例[それぞれ 20.4% 対 19.2%; P = 0.79])。最終診察時のプレドニゾン使用に関するデータが得られた患者280人のうち、44人(15.7%)がプレドニゾンを服用しておらず(平均±SDの副腎皮質ホルモン使用期間65.8±44.5ヵ月)、ANCA状態の違いによる差はなかった。残りの236人については,プレドニゾンを継続しなければならず(77.1±102.2カ月前に開始),最終診察時の1日平均用量は12.9±12.5 mg(≦5 mg/日:62人,≦7.5 mg/日:94人,≧15 mg/日:62人),ANCA陽性およびANCA陰性のサブグループで同等であった.
5年生存率(図1A)は、全患者で88.9%(95%CI 84.3-92.2)、ANCA陽性患者で94.9%(95%CI 86.9-98.1)、ANCA陰性患者で87.7%(95%CI 81.2-92.1)だった(P=0.09)。10 年後の生存率は,全患者で 78.6%(95% CI 70.3-84.8),ANCA 陽性患者で 88.8%(95% CI 67.9-96.4),ANCA 陰性患者で 76.0%(95% CI 64.3-84.3) であった(P = 0.02).5 年後の血管炎無再発生存率(図 1B)は,全患者で 64.8%(95% CI 58.6-70.4),ANCA 陽性患者で 58.1%(95% CI 45.6-68.6),ANCA 陰性患者で 67.8%(95% CI 59.8-74.5) であった(P = 0.35).10 年後の無再発生存率は,全患者で 54.4%(95% CI 45.8-61.6)であり,ANCA サブグループ間に有意差はなかった(P = 0.43).

Figure 1
多発血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)患者383名の診断時の抗好中球細胞質抗体(ANCA)状態によるKaplan-Meier生存曲線(A)と無再発生存曲線(B)
再発と死亡の予測因子
単変量解析および多変量解析の詳細な結果を表3に示す。推定Modification of Diet in Renal Disease糸球体濾過量または血清クレアチニン値のいずれかをモデルに入力した場合、ステップワイズ多変量解析で保持された唯一の死亡の独立予測因子は、診断時の特異的心筋症(HR 4.5)であった。 11 [95% CI 1.96-8.60])、診断時の高齢(年齢が1歳増えるごとにHR 1.06 [95% CI 1.03-1.09]; 年齢65歳以上でHR 4.12 [95% CI 1.96-8.67] )、および1996年に診断されたかそれ以前のEGPA(HR 3.20 [95% CI 1.53-6.70] )であった.心筋症患者の5年生存率(図2AおよびB)は、心筋症でない患者の91.6%(95%CI 86.7-94.8)に対し78.2%(95%CI 64.3-87.3)(P<0.01) 、1996年に診断されたかそれ以前の患者の82.9%(95%CI 74.4-88.8) に対する、それ以降の患者の93.4%(95% CI 87.9-96.4 )(P<0.01) と、差があった。単変量解析では、元のFFSと改訂版のFFSの両方が死亡を予測した(FFSが1以上の場合と0の場合で、それぞれHR 3.84 [95% CI 2.10-7.03]と3.16 [95% CI 1.40-7.14]; どちらもP < 0.01).
表3. EGPA*患者における死亡または再発のリスクに関する一変量および多変量生存解析の結果

* EGPA = 多発性血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)、ENT = 耳、鼻、喉、CNS = 中枢神経系、FFS = 5因子スコア、MDRD GFR = Modification of Diet in Renal Disease糸球体ろ過率、CRP = C反応性蛋白質。単変量解析でP値が≦0.20のパラメータはすべて多変量解析に含めた。‡診断年(1996年中またはそれ以前 vs 1996年以降)をモデルから除外した場合、死亡を予測する最終パラメータは、診断時年齢(ハザード比[HR] 1.06 [95% 信頼区間(95%CI) 1.03-1.09],P<0.01) および心筋症(HR 3.85 [95% CI 2.00-7.41],P<0.01 )であった。¶ 好酸球数をモデルから除外した場合、再発を予測する最終パラメータは、抗好中球細胞質抗体(ANCA)陽性(HR 1.60 [95% CI 1.03-2.48], P = 0.04) および皮膚症状(HR 1.67 [95% CI 1.07-2.60], P = 0.02 )となった。

Figure 2
AおよびBは,多発血管炎を伴う好酸球性肉芽腫症(Churg-Strauss)(EGPA)患者383人について,診断時の心筋症の有無(A)と診断年(1996年12月31日以前または以降)(B)に応じたカプラン-マイヤー生存曲線である.C、EGPA患者の無再発生存曲線、診断時の好酸球数に応じて。7,569/mm3の閾値は、データが入手できた全254人の患者の診断時の好酸球数の平均に相当する。
血管炎再発の唯一の有意かつ独立した予測因子は、診断時の好酸球数の低さであった(254人の患者について入手可能)。診断時の平均±SD好酸球数は,追跡調査中に血管炎が再発した患者では 5,980 ± 5,244/mm3 であったのに対し,再発しなかった患者では 8,150 ± 6,729/mm3 であった(P = 0.02).好酸球数 7,569/mm3 未満(全患者の平均)の HR は 1.83(95% CI 1.10~3.04)であった.診断時の好酸球数が7,569/mm3以上または7,569/mm3未満の患者の5年無再発生存率は、それぞれ72.8%(95%CI 62.1~80.0)および58.1%(95%CI 48.3~66.7)であった(図2C)。好酸球数をモデルに入力しない場合、ANCA陽性(HR 1.60 [95% CI 1.03-2.48]; P = 0.04)および皮膚徴候(HR 1.67 [95% CI 1.07-2.60]; P = 0.02)が、再発の唯一の有意な独立予測因子であった。ANCA状態が不明な35人の患者を除外しても、再発または死亡の同じ有意な独立した予測因子が保持された。
癌。
追跡調査中に、13人の患者(ANCA陽性2人、ANCA陰性9人、およびANCA状態不明2人;P = 0.48)において14の悪性腫瘍が診断され、そのうちの5人が死亡した。がんの発生率は、一般集団で予想されるものと有意な差はなかった(SIR 1.15 [95% CI 0.63-1.94])。固形癌は11例(結腸癌1例、基底細胞皮膚癌2例、膀胱癌1例、乳癌1例、および致死的癌5例[結腸癌1例、卵巣癌1例、肺癌1例、胃癌1例、前立腺癌もあった男性における膠芽腫1例])、血液腫瘍3例(B細胞リンパ腫1例、真皮多血症1例、骨髄異形成1例)であった。これらの患者のうち9人はシクロホスファミドの投与を受け、2人はシクロホスファミド以外の免疫抑制剤を服用し、2人は副腎皮質ステロイドのみの治療を受けていた。
考察
5年以上経過したEGPA患者の大規模コホートの解析は、以前に報告されたANCA状態による臨床症状の違いを確認し(16、17)、治療上の意味を持つ可能性のある転帰および再発予測因子に関する新しい情報を提供している。ANCA陽性患者は、ANCA陰性患者と比較して、末梢神経障害や腎臓病変などの臨床的な血管炎症状を示すことが多かったが、心筋症は少なかった。死亡率は低かったが、再発のリスクはわずかに高かったようである。心筋症は、多変量解析においても、EGPA患者の死亡の主な独立した予測因子であることに変わりはなかった。
本調査の対象となった患者は、ACR分類基準(20)および/またはChapel Hill命名法定義(1)を満たしていた。EGPAの確立された診断基準は現在のところなく、血管炎の臨床的または組織学的証拠がない場合、EGPAと他の全身性好酸球性疾患との鑑別が困難な場合があります(34、21)。ANCA陰性患者の中には、ある種のEGPAと非分類型全身性好酸球性疾患との重複を完全に排除できない患者もいます(35、36)。しかし、実際には、EGPAの方が原発性全身性好酸球性疾患に比べ、治療に対する反応が良好かつ迅速に得られるのが普通である。また、その後の患者の経過は、初期診断の確認、あるいは逆に修正にさらに役立つことがある。
EGPAにおいてANCAの病原的な役割は証明されておらず、実際にANCA陽性となるのはEGPA患者のごく少数に過ぎない。したがって、EGPAがANCA状態に基づく2つの表現型サブセットを含むのか、あるいはANCA陽性がよりびまん性の血管炎による障害の代理マーカーに過ぎないのかは、まだ解明されていません(35、36)。我々は、先行研究者(16、17)と同様に、ANCAステータスに基づく臨床像の違いを見出した。これらの臨床的差異にもかかわらず、これらの先行研究(13、16、17)ではANCA状態による転帰に差はなかったが、それらの追跡期間とサンプルサイズは限られていた。さらに、これまでのEGPA研究の限界は、疾患フレアの定義が不明確であるか、少なくとも一貫性がないことである。紫斑病や糸球体腎炎のような本物の血管炎の再燃は、喘息や耳鼻咽喉科の症状、好酸球数の増加などの単純な悪化とは別に分析する必要があります。さらに、喘息や鼻炎の増悪は、医師がそれを重要視するかしないかによって、過少報告されることがあります。より多くの患者、より長い追跡調査、より厳格な再発の定義に基づく我々の結果は、ANCA陽性は再発のリスクが高いが、死亡率は低いことを示唆している(単変量解析において)。38人の患者を対象としたイタリアのシリーズで得られた最近の結果も同様で、再発の46.7%はANCA陽性患者で発生したのに対し、ANCA陰性患者では8.7%であった(37)。
診断時の好酸球数は ANCA の状態によって差がありませんでしたが、予想に反して好酸球数の低下が再発の主な予測因子として同定されました。好酸球の変動は大きく、コルチコステロイドに感受性があり、診断時の喘息やアレルギー性鼻炎・副鼻腔炎に対する吸入または全身性コルチコステロイドの使用は系統的に記録されていないため、この知見は他のコホートでさらに分析する必要がある。好酸球数を再発のモデルから除外した場合、診断時のANCA陽性と皮膚徴候がその後の再発の最も強い予測因子であった。
ANCA の状態も死亡と関連しており、単変量解析では ANCA 陽性患者の死亡率が低かった。しかし、多変量解析では、過去数十年にわたって繰り返し報告され、1996年のFFSにも含まれているように、心筋症が依然として主要な予後不良因子であった(19)。その他の独立した予後不良因子としては、診断時年齢が高いこと(これは改訂版FFSに含まれている)(23)、1996年以前、すなわちFFSが考案され、より重症のEGPA患者における治療の最適化とシクロホスファミドの必要性を示すために用いられる以前の診断があった(19、28、29、38、39)。1996年以降に診断された患者の転帰が良好であることの代替または追加仮説として、過去10年間に心不全の管理が進歩したこと、診断時の主要臓器病変の頻度が少ないことが挙げられるが、FFSおよびBVASはそれ以前に診断された患者のものと差はない。本研究では、致命的な心臓疾患の多くはEGPAの診断から中央値で14ヵ月後に発生しており、心臓障害の晩期的な影響の可能性と、徹底した連続した心血管評価の重要性が強調された。
Sinicoらによるイタリアの研究(16)では、主にANCA陽性の患者の52%が、最初の治療レジメンの一部として免疫抑制剤を投与されていた。しかし、本研究では、治療レジメンにANCAの状態による顕著な差は認められなかった。半数の患者は診断時に副腎皮質ステロイドと免疫抑制剤の両方を受けており、2/3の患者は経過中に副腎皮質ステロイドと免疫抑制剤の両方を受けていました。重要なことは、ほとんどの患者が長期間の経口コルチコステロイドを必要とし、1日平均プレドニゾン量が約12mgであったことである。一方、全身性血管炎の研究に対する欧州抗リウマチ連盟の勧告では、7.5mg/日以上が寛解を定義する上限である(40)。しかし、患者の大半は、血管炎の症状に関して臨床的に寛解しており、喘息、鼻炎、または特異性の低い関節痛をコントロールするためにのみプレドニゾンを必要としていた。
この研究は、サンプル数、長い追跡期間、EGPA再発の厳格な定義によりEGPA再発を喘息増悪と区別できたことなど、いくつかの長所がある一方で、いくつかの短所もある。この研究は、多施設共同による部分的な後ろ向き研究であり、血管炎の経過中のある時点で治療試験に参加した患者を含んでいます。各治療の影響を個別に詳しく分析しなかったのは、患者が参加した試験について報告されたものと同じ結論になるからである(28, 29, 38)。
ANCA検査方法の感度が異なる可能性があり、我々の患者全員が中央で検査されたわけではない。さらに、本研究では観察されなかったが、ANCA検査が診断時には陰性で、後になって再燃時に初めて陽性となることが報告されている(13)。しかし、本研究で観察されたANCA頻度およびANCA状態による診断時の臨床的差異は、他の独立したコホートに基づいて以前に報告されたものと一致している(16、17、37、41)。喘息期間は両ANCAステータス群で同様であったが、診断までの時間が長いことが、診断がより困難なANCA陰性患者の生存に影響を与えた可能性も排除できない。1996年以前に診断された患者は、その後に診断された患者よりも喘息や主要臓器病変の頻度が高いということは、特にANCA検査が日常的に使用される以前は、医師がそれほど明白なEGPA症状を持たない患者を研究に登録する傾向がなかったことも示唆しているかもしれない。
最後に、心筋症の定義は、FFSと同様、容易に検出可能な臨床パラメータに基づいている(19)。心エコー、MRI、自律神経系の異常は、EGPA患者に頻繁に見られるが、予後予測としての価値はまだ不明である(42-48)。
以上のように、長期間の追跡調査により定義された大規模なEGPA患者群の解析から、世界的な生存率は過去数十年の間に改善されており、診断時のいくつかの臨床差に加え、ANCA状態によって転帰も異なることが明らかになった。ANCA陽性患者は死亡率が低いものの、再発のリスクは高いようです。他の独立した患者コホートで確認された場合、これらの所見は、ANCAの状態に応じて治療を適応させる必要があることを示唆する可能性がある。しかし、ANCA陽性のEGPA患者数は比較的少ないままであり、他の予後パラメータ(特に心筋症)がより重要であるように思われる。EGPAでは、副腎皮質ステロイドや従来の細胞障害性薬剤の使用を制限または回避できるような、より効果的な治療法の特定など、いくつかの課題が残されている。
この記事が気に入ったらサポートをしてみませんか?
