2021年 米国リウマチ学会/血管炎財団 抗好中球細胞質抗体関連血管炎の管理に関するガイドライン 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Antineutrophil Cytoplasmic Antibody-Associated Vasculitis
PMID: 34235894
https://onlinelibrary.wiley.com/doi/10.1002/art.41773
概要
目的
多発血管炎性肉芽腫症(GPA),顕微鏡的多発血管炎(MPA),好酸球性多発血管炎性肉芽腫症(EGPA)などの抗好中球細胞質抗体関連血管炎(AAV)の管理について,エビデンスに基づく推奨と専門家のガイダンスを提供することである.
研究方法
AAVの治療と管理に関するクリニカルクエスチョンをPICO(population, intervention, comparator, and outcome)形式で作成した(GPA/MPAは47問、EGPAは34問)。各PICOの質問に対して、系統的な文献レビューを行った。エビデンスの質を評価し、推奨を策定するために、Grading of Recommendations Assessment, Development and Evaluation(推奨の評価、開発、評価)の方法が用いられた。各勧告は、投票委員会の70%以上のコンセンサスを必要とした。
結果
GPA/MPAについては26の勧告と5つの未評定ポジションステートメントを、EGPAについては15の勧告と5つの未評定ポジションステートメントを提示した。本ガイドラインは、GPA、MPA、EGPAにおける寛解導入・維持療法および補助的治療戦略に関する推奨事項を示している。これらの推奨には、重症GPAおよびMPAにおける寛解導入・維持療法へのリツキシマブの使用、および非重症EGPAにおけるメポリズマブの使用が含まれる。すべての推奨は、複数のランダム化比較試験および/または推奨を支持する低品質の証拠がないこともあり、条件付きである。
結論
本ガイドラインは、AAVの管理について米国リウマチ学会と血管炎財団が承認した最初の勧告を示し、これらの疾患の治療方法について医療専門家にガイダンスを提供するものである。
米国リウマチ学会(ACR)が開発、承認したガイドラインや勧告は、特定の診療パターンの指針を示すことを意図しており、特定の患者の診療を指示するものではない。ACR は、本ガイドライン内の推奨事項の遵守は任意であり、その適用に関する最終的な判断は、各患者の個別状況に照らし合わせて医師が行うべきであると考えている。ガイドラインと勧告は、有益で望ましい結果を促進することを意図しているが、特定の結果を保証するもので はない。ACR が開発し承認したガイドラインと勧告は、医学的知識、技術、診療の進化に伴い、定期的に改訂されることがある。ACRの勧告は、支払いや保険の決定を指示することを意図しておらず、ACRガイドラインを引用する医薬品フォーミュラや他の第三者による分析には、このことを明記する必要があります。これらの勧告は、患者ケアの不確実性や微妙な違いをすべて適切に伝えることはできない。
American College of Rheumatologyは、独立した専門的、医学的、科学的な学会であり、いかなる商用製品またはサービスも保証、保証、または推奨するものではありません。
はじめに
抗好中球細胞質抗体(ANCA)関連血管炎(AAV)は、多発血管炎性肉芽腫症(GPA)、顕微鏡的多発血管炎(MPA)および好酸球性肉芽腫症(EGPA)から構成されています。これらの疾患は、中小血管を侵し、多臓器に及ぶ病変を有することが特徴です。
GPAは、組織学的に血管炎に加え、壊死性肉芽腫性炎症が特徴です。一般的な臨床症状としては、破壊的な副鼻腔病変、肺結節、および非免疫性糸球体腎炎があります。GPAは、細胞質ANCAおよびプロテイナーゼ3(PR3)に対する抗体と最もよく関連しています。欧州の集団では、有病率は100万人あたり24〜157例で、スウェーデンと英国で最も高い有病率が報告されています(1)。
MPAは、組織学的に、肉芽腫性炎症を伴わない血管炎を特徴とします。一般的な臨床症状として、急速に進行するpauci-immune型糸球体腎炎や肺胞出血があります。MPAは、核周囲のANCAおよびミエロペルオキシダーゼに対する抗体を最も一般的に伴います。MPAの有病率は、欧州諸国では0〜66例/100万人、日本では86例/100万人となっています(1、2)。
EGPAは、組織学的に血管炎に加え好酸球性組織浸潤を特徴とします。一般的な臨床症状としては、喘息、末梢好酸球増多、末梢神経障害などがあります。検出可能なANCAを産生する患者は40%に過ぎません。欧州の人口におけるEGPAの全有病率は、100万人当たり2~38人と推定されています(1、3)。
アルキル化剤が使用される以前は、これらの疾患の生存率は極めて低いものでした(例えば、GPA患者の生存期間中央値は約5ヵ月)(4)。現在の治療レジメンはこの悪い予後を逆転させましたが、治療にはまだ毒性が伴います。最近の臨床試験では、AAVの治療に対する生物学的および非生物学的免疫抑制剤の有効性と毒性が検討されている。また、観察研究により、これらの疾患の管理戦略に関するさらなる知見が得られている。そこで、本ガイドラインは、GPA、MPAおよびEGPAの治療および管理について、エビデンスに基づく推奨を提供するために作成された。本ガイドラインは、国際的な読者に情報を提供するものであるが、米国における治療および診断の選択肢の経験および利用可能性を考慮して、これらの推奨事項を作成した。
方法
本ガイドラインは、米国リウマチ学会(ACR)のガイドライン作成プロセス(https://www.rheumatology.org/Practice-Quality/Clinical-Support/Clinical-Practice-Guidelines)に従い、GRADE(Grading of Recommendations Assessment, Development and Evaluation)の手法を用いてエビデンスの質を評価し、推奨事項を策定した(5、6)。ACRの方針は、利益相反と情報開示の管理を指導するものであった(https://www.rheumatology.org/Practice-Quality/Clinical-Support/Clinical-Practice-Guidelines/Vasculitis)。補足資料1(Arthritis & Rheumatologyのウェブサイトhttp://onlinelibrary.wiley.com/doi/10.1002/art.41773/abstract)には、方法の詳細な説明が記載されている。簡単に説明すると、文献レビューチームは、特定の臨床集団、介入、比較対象、および結果(PICO)に対処する所定の質問に対して系統的な文献レビューを実施しました。異なるタイプの血管炎患者11名(GPA患者4名、MPA患者1名、EGPA患者2名)からなる対面式の患者パネルが、文献レビューチームのメンバー(ABD)によって司会進行されました。この患者パネルは、エビデンスレポートを(モデレーターによる要約と解釈とともに)検討し、患者さんの視点と好みを提供しました。投票パネルは、成人のリウマチ専門医9名、小児リウマチ専門医5名、患者2名で構成され、文献調査チームのエビデンスサマリーを検討し、患者パネルの検討を踏まえて、推奨事項を策定し投票しました。
投票パネルは、ACRと血管炎財団が7つの全身性血管炎(巨細胞性動脈炎、高安動脈炎、結節性多発動脈炎、川崎症候群、本報告書で紹介する3つのAAV)に対する勧告を策定するために集められた広範な活動であった。このパネルの医師は、これらすべての疾患について見識を深めることができるリウマチ専門医を含み、この取り組みで取り上げた他の多くの血管炎に経験のない他のサブスペシャリスト(例えば、大・中サイズの血管炎に経験のない肺専門医)は含まれていない。文献調査チームの委員長は、腎臓内科医であった。投票パネルの患者は、さまざまなタイプの血管炎患者からなる患者パネルの意見を発表した。推奨には、投票パネルの70%以上のコンセンサスが必要であった。
勧告の解釈の仕方
強い推奨は、通常、中程度から高品質のエビデンス(複数のランダム化比較試験など)によって裏付けられている。強い推奨の場合、推奨される行動方針は、すべての患者またはほとんどすべての患者に適用される。その勧告に従いたくないと思う臨床家/患者はごく一部である。まれに、強い推奨が非常に低確実性から低確実性のエビデンスに基づく場合がある。例えば、ある介入が、良性で、低コストで、害がなく、その介入を行わなかった場合の結果が壊滅的であると考えられる場合、強く推奨されることがある。また、介入が比較対象よりも害をもたらす確実性が高く、その有益性についての確実性が非常に低いか低い場合には、介入を行わないよう強く推奨されることがある(7)。
条件付勧告は、通常、低質なエビデンス、または望ましい結果と望ましくない結果のバランスがとれていることで支持される。条件付勧告の場合、推奨される行動方針は患者の大多数に適用されるが、代替案は妥当な検討事項である。条件付きの推奨は、常に共有の意思決定アプローチを保証する。我々は、代替案を検討するための条件をいくつか定めている。
委員会は、特定のPICOの質問に対するエビデンスが、段階的な推奨を支持しない、あるいは一方の介入を他方よりも支持しないことを発見した場合がある。しかし、投票委員会は、そのPICOの質問は一般的に遭遇する臨床上の疑問を扱っていると考え、この質問に対する指針を提供することが正当であると考えた。このような場合、投票委員会の一般的な見解を反映した「無評価の見解」を提示する。
このエビデンスに基づくガイドラインでは、入手可能な最良のエビデンスを明示的に使用し、臨床医と読者のためにそれを提示する(8)。場合によっては、検討中の介入を直接比較した無作為化試験も含まれる。GRADEシステムでは、投票パネルと患者パネルのメンバーの集合的な経験のみから得られたエビデンスを「非常に質の低い」エビデンスとして評価している(6)。
各勧告について、PICOの質問とGRADEのエビデンス表に関する詳細は、補足資料2(http://onlinelibrary.wiley.com/doi/10.1002/art.41773/abstract)に記載されている。
表1. GPA、MPA、EGPA*の勧告および未評定ポジション・ステートメントで使用される特定の用語の定義

* GPA=多発性血管炎を伴う肉芽腫症、MPA=顕微鏡的多発性血管炎、EGPA=多発性血管炎を伴う好酸球性肉芽腫症、IV=静注、GC=グルココルチコイド、SC=皮下注。
表2. GPAとMPA*の管理に関する推奨事項/ステートメント

* 多発性血管炎性肉芽腫症(GPA)および顕微鏡的多発性血管炎(MPA)について作成された、推奨度評価、開発および評価の 方法論で使用される集団、介入、比較対象および結果(PICO)の質問については、補足資料2(Arthritis & Rheumatology ウェブサイト http://onlinelibrary.wiley.com/doi/10.1002/art.41773/abstract から入手可能)を参照してください。IV = 静注、GC = グルココルチコイド、ANCA = 抗好中球細胞質抗体、IVIG = IV免疫グロブリン

図1
多発性血管炎を伴う肉芽腫症および顕微鏡的多発性血管炎の治療に関する主要な推奨事項。
活動的で重症な疾患に対する寛解導入
推奨 活動性の高い重症のGPA/MPA患者には、寛解導入のためにシクロフォスファミドよりもリツキシマブを用いた治療を条件付きで推奨する。
リツキシマブとシクロホスファミドの両方が、グルココルチコイドとの併用で、GPAとMPAの寛解導入に使用されています。リツキシマブは、無作為化比較試験において、寛解導入にシクロホスファミドと同様の効果をもたらすことが示されています(9)。現在使用されているシクロホスファミドの累積投与量は以前のレジメンより少なく、治療コースあたりの毒性は低くなりますが、リツキシマブはシクロホスファミドより毒性が低いと考えられているため、依然としてリツキシマブが好まれています。シクロホスファミドの単回投与は、好中球減少、膀胱損傷、小さいながらも不妊の可能性など、若い患者にとって破壊的なリスクを伴う可能性があります。シクロホスファミドを繰り返し使用すると、悪性腫瘍や不妊症のリスクが高まります。リツキシマブは、一般的に忍容性の高い治療法として、患者委員会でも好まれています。レトロスペクティブ研究によると、成人で使用されているリツキシマブの2つの寛解導入レジメン(375mg/m2を毎週4週間投与[米国食品医薬品局(FDA)が承認した投与スケジュール]と1日目と15日目に1000mg投与)は同等の有効性があることが示唆されています。これらのレジメンのどちらを選択するかは、患者の好みや価値観によって決められるべきである。
シクロホスファミド(表1の投与量)は、リツキシマブの使用を避ける必要がある場合、またはリツキシマブ治療を受けているにもかかわらず患者が疾患活動性を示す場合に使用することができる。急性腎不全(例:血清クレアチニン>4.0mg/dl)などのある種の重症疾患に対してシクロホスファミドを優先すべきかどうかは、まだ議論の余地がある。シクロホスファミドは、静脈内パルス投与と連日経口投与のいずれでも使用可能である(10、11)。成人の場合、これら2つの選択肢のどちらを選ぶかは、患者と医師の希望に基づいて決定されるべきである。小児では、コンプライアンスと毒性の抑制のために、シクロホスファミドの静脈内投与が好まれる場合がある。寛解導入のためのシクロホスファミドとリツキシマブの併用療法の効果に関するデータはまだ限られており(12)、この併用療法の潜在的な毒性が依然として懸念されている。リツキシマブとシクロホスファミドの併用療法は米国ではあまり普及しておらず、リツキシマブまたはシクロホスファミドの単剤療法と比較した有効性は確立されていません。この併用療法は、現時点ではまだ試験中です(ClinicalTrials.gov識別子:NCT03942887)。
推奨する:活動性糸球体腎炎を伴う GPA/MPA 患者において、寛解導入療法に血漿交換をルーチンに追加することは、条件付きで推奨しない。
活動性糸球体腎炎のすべての患者に血漿交換を開始すべきではないが、感染リスクの上昇の可能性を受け入れる末期腎不全(ESRD)への進行リスクが高い患者には検討できる。
この推奨は、AAVにおける糸球体腎炎の治療に対する血漿交換の2つの大規模試験のデータによって裏付けられている。最初の試験は、血清クレアチニン値が5.8mg/dl以上でなければ参加できず、血漿交換によりESRDのリスクは減少したが、死亡率は減少しなかった(13、14)。より最近のAAVにおける血漿交換の無作為化試験では、従来の寛解導入療法に血漿交換を追加しても、ESRDまたは死亡の複合転帰は改善しなかった;ESRDのリスクの減少が認められたが、結果は統計的に有意ではなかった(ハザード比 0.81 [95% 信頼区間 (95% CI) 0.57-1.13] ;)。(15).
しかし、これら2つの試験のデータを総合すると、血漿交換を受けた糸球体腎炎患者では、受けなかった患者と比較して、おそらくESRDのリスクが減少していることがわかります(ハザード比 0.72 [95% CI 0.53-0.98]、確実性中)(補足資料2、http://onlinelibrary.wiley.com/doi/10.1002/art.41773/abstract)。この効果は、ESRDのリスクが最も高い患者において最も顕著であったが(活動性糸球体腎炎1,000例当たりのESRD症例数が118例少ない[95%CI 217~7例少ない])、死亡率には差が示されなかった(リスク比 1.15[95%CI 0.78~1.70]、確実性:中等度)。AAVにおける血漿交換の4つの試験で、血漿交換でより高い重症感染症のリスクが観察された(リスク比1.19[95%CI 0.99-1.42]、中程度の確実性)。
これらの知見は、ESRDへの進行リスクが低い患者では、血漿交換のリスクが利益を上回る可能性があることを示唆している;しかし、ESRDへの進行リスクが高い患者では、リスクの減少が血漿交換による重症感染症のリスク上昇を上回ると思われる。したがって、投票パネルは活動性糸球体腎炎のすべての患者に血漿交換を推奨しないが、ESRDへの進行リスクが高い患者にはこの治療法を検討することを推奨する。血漿交換を開始するかどうかに影響する要因としては、来院時の患者の腎機能、腎機能低下の速度、寛解導入療法に対する反応、重症感染症に対する患者の耐容性などがある。
抗糸球体基底膜疾患を併発しているGPAまたはMPA患者には、依然として血漿交換が推奨される。
推奨する:肺胞出血を伴う活動的で重症の GPA/MPA 患者において、寛解導入療法に血漿交換を追加しないことを条件付きで推奨する。
肺胞出血を呈した患者に対する血漿交換の使用を評価した2つの試験で、死亡率および寛解率に差は認められなかった。したがって、血漿交換は肺胞出血の患者に対する有益性が確立されておらず、重篤な感染症のリスク上昇と関連している(上記の勧告を参照)。血漿交換は、活動性の糸球体腎炎の特定の患者、または重症で推奨される寛解導入療法に反応しない患者(すなわち、「救済」または「救助」療法としての血漿交換)に検討される場合があります。
抗糸球体基底膜疾患を併発しているGPAまたはMPAの患者には、依然として血漿交換が推奨されます。
未評定 ポジションステートメント 活動性の高い重症GPA/MPA患者には、初期治療としてパルスグルココルチコイド静注用または高用量経口グルココルチコイドが処方されることがあります。
パルスグルココルチコイド静注用と高用量経口グルココルチコイドの有効性を比較した臨床試験はない。高用量のグルココルチコイド(パルスグルココルチコイドなど)は、一般に臓器または生命を脅かす疾患症状を有する患者に投与されるが、感染症のリスク上昇に関連する可能性がある(16)。
推奨する:活動性の重症GPA/MPA患者に対しては、寛解導入のために、標準量のグルココルチコイドレジメンよりも減量したグルココルチコイドレジメンを条件付きで推奨する。
最近の研究では、ESRDまたは死亡の複合転帰に対して、低用量グルココルチコイドレジメンは標準用量レジメンと比較して同様の利益をもたらし、感染リスクの低下と関連していることが証明されました(15)。グルココルチコイドの長期使用に伴う毒性が知られているため、グルココルチコイドへの曝露を最小限に抑えることは、転帰を改善するために重要である。グルココルチコイドの投与は、患者ごとに個別化することが可能である。注目すべきは、減量レジメンでは、メチルプレドニゾロンのパルス投与(1日3回、最大総量3gm)と1週間の高用量経口グルココルチコイドから開始している点である。本試験で使用した投与レジメンは、補足資料3(http://onlinelibrary.wiley.com/doi/10.1002/art.41773/abstract)に記載されている。
活動性の高い非重症疾患に対する寛解導入療法
推奨する:活動性で非重症のGPA患者には、シクロホスファミドやリツキシマブよりもメトトレキサートによる治療を開始することを条件付きで推奨します。
非重症GPAは、生命または臓器を脅かす症状を伴わないGPAと定義される(表1)。メトトレキサート、リツキシマブ、シクロホスファミドは、この患者群に寛解をもたらすのに有効です(11)。しかし、重症GPAと同様に、非重症GPAも慢性疾患であり、複数の治療コースが必要となる。そのため、投票委員会は、毒性の高い治療法を使用する前に、毒性の低い治療法を使用することを推奨しました。従って、シクロホスファミドの毒性が強いため、メトトレキサートが好まれます。メトトレキサートは、この患者群に対するメトトレキサート治療のエビデンスと臨床経験が豊富なため、現時点ではリツキシマブよりも推奨される;両者の有効性を比較する臨床試験が必要である。肝機能障害や腎機能障害を有する患者、メトトレキサート投与中に再発した患者、コンプライアンスに関する懸念など、特定の臨床状況においてはリツキシマブが推奨される場合がある。
推奨 :活動性で非重症のGPA患者に対しては、メトトレキサートとグルココルチコイドによる治療を、グルココルチコイド単独よりも条件付きで開始することを推奨する。
メトトレキサートとグルココルチコイドの併用は、グルココルチコイドの曝露と毒性を最小限に抑えるために推奨される。全体として、グルココルチコイド単剤での治療が考慮される臨床状況は少なく(例えば、関節炎や他の寛解維持療法に耐えられない場合)、この治療戦略を用いる場合は綿密なモニタリングが必要である。
推奨する:活動性で非重症のGPA患者に対しては、アザチオプリンとグルココルチコイドまたはミコフェノール酸モフェチルとグルココルチコイドよりもメトトレキサートとグルココルチコイドによる治療の開始を条件付きで推奨します。
この患者群における寛解導入のためのメトトレキサート使用は、他の治療法よりも多くの利用可能なデータによって裏付けられていますが(11)、アザチオプリンとミコフェノール酸モフェチルを考慮することも可能です。活動性の非重症GPAにおける寛解導入のためのメトトレキサート、アザチオプリン、ミコフェノール酸モフェチルの有効性を評価する比較効果試験が必要である。臨床的な要因が選択する薬剤に影響を与える可能性があります。例えば、メトトレキサートは、中等度から重度の腎不全のある患者さんでは、慎重に使用するか、使用を避けるべきです。妊娠中の患者、またはメトトレキサートやミコフェノール酸モフェチルに耐えられない患者にはアザチオプリンが、チオプリンSメチルトランスフェラーゼ全欠損またはハイリスクのTPMTやNUDT15遺伝子型を持つ患者にはメトトレキサートやミコフェノール酸モフェチルが適応となります。
推奨する:活動性の非重症GPA患者には、トリメトプリム/スルファメトキサゾールとグルココルチコイドよりもメトトレキサートとグルココルチコイドによる治療の開始を条件付きで推奨する。
メトトレキサートは、これまでの知見から、寛解導入にトリメトプリム/スルファメトキサゾールよりも有効であると考えられています(17)。ニューモシスチス・ジロベシ肺炎を予防するために、低用量のトリメトプリム/スルファメトキサゾールを免疫抑制剤と同時投与してもよい(このテーマに関するGPA/MPAの勧告を参照)。
リミッション維持
推奨 :シクロホスファミドまたはリツキシマブによる治療後に寛解に移行した重症GPA/MPA患者には、寛解維持のためにメトトレキサートまたはアザチオプリンよりもリツキシマブを用いた治療を条件付きで推奨する。
リツキシマブは、シクロホスファミドによる寛解導入後の寛解維持に使用した場合、アザチオプリンよりも再発率が低いことが知られています(18)。メトトレキサートとアザチオプリンは寛解維持に同程度の有効率を示します(19)。したがって、リツキシマブはメトトレキサートやアザチオプリンよりも有利である。しかし、メトトレキサートとアザチオプリンにはより多くの長期安全性データがあり、コストやその他の要因によりリツキシマブの使用が制限される可能性があります。
寛解維持には、500mgを6ヵ月ごとに静注(18)(FDA承認)、1000mgを4ヵ月ごとに静注(20)、1000mgを6ヵ月ごとに静注(21)など、異なる用量のリツキシマブが使用されています。比較試験は実施されていない。したがって、寛解維持のためのリツキシマブの至適投与量は依然として不明である。
寛解維持療法としてメトトレキサートまたはアザチオプリンによる治療を検討する場合、両者の有効性が同等であることから、患者の臨床状況、好み、価値観によって両者を選択する必要があります。
推奨する:寛解維持のためにリツキシマブを投与されているGPA/MPA患者には、ANCA力価やCD19 + B細胞数を用いた再投与の指針よりも、予定した再投与を条件付きで推奨する。
ある無作為化試験では、CD19+B細胞数および/またはANCA力価の変化に基づいて寛解維持のためにリツキシマブを投与された患者の再発率は、リツキシマブを予定量投与された患者と同等であった。しかし、この研究はサンプル数が少ないという制約があり、効果量に対する信頼区間も広かった(22)。この推奨は、患者が CD19+ B 細胞の減少を経験した場合や ANCA の検査結果が陰性の場合に、再燃が起こりうることを認識した投票委員会の 経験と専門知識に一部基づいている。従って、CD19+ B 細胞数や ANCA 力価は、患者の疾患が再燃する可能性を正確に示していない可能性がある。
推奨事項 シクロホスファミドまたはリツキシマブによる治療後に寛解に移行した重症GPA/MPA患者には、寛解維持のためにミコフェノール酸モフェチルよりもメトトレキサートまたはアザチオプリンによる治療を条件付きで推奨する。
メトトレキサートとアザチオプリンは寛解維持に同等の効果があります(19)。寛解維持療法では、ミコフェノール酸モフェチルの方がアザチオプリンより再発率が高いため、アザチオプリンが有利です(23)。メトトレキサート、アザチオプリン、リツキシマブに耐えられない患者や禁忌の患者には、ミコフェノール酸モフェチルを検討することがあります。
推奨 シクロホスファミドまたはリツキシマブによる治療後に寛解に移行した重症GPA/MPA患者には、寛解維持のためにレフルノミドよりメトトレキサートまたはアザチオプリンによる治療を条件付きで推奨する。
メトトレキサートまたはアザチオプリンによる治療は、メトトレキサートおよびアザチオプリンによる寛解維持を支持するデータおよび臨床経験により、レフルノミドよりも推奨されます。レフルノマイドのデータと臨床経験はより限られています。レフルノミドとメトトレキサート治療を比較したある臨床試験では、レフルノミド治療により再発率は低下しましたが、休薬率は高くなりました(24)。この試験では、レフルノミドを30mg/dayの用量で投与しており、これが毒性に寄与している可能性があります。
推奨する:寛解期に入った GPA 患者には、寛解維持のためにトリメトプリム/スルファメトキサゾールよりもメトトレキサートまたはアザチオプリンによる治療を条件付きで推奨する。
投票パネルは、トリメトプリム/スルファメトキサゾールよりもメトトレキサートまたはアザチオプリンの使用を強く支持したが、この2つの治療を比較する十分な高品質のエビデンスがないため、この推奨は条件付きである。
推奨する:寛解期に入ったGPA患者において、寛解維持の目的でトリメトプリム/スルファメトキサゾールを他の治療法(例:リツキシマブ、アザチオプリン、メトトレキサートなど)に追加しないよう条件付きで推奨する。
トリメトプリム/スルファメトキサゾールは副鼻腔病変を有する患者に有益な場合がありますが(25)、その使用により毒性(例:重度の過敏反応)および薬物負担が増加する可能性があります。
トリメトプリム/スルファメトキサゾールは、P jirovecii肺炎の予防に依然として適応されるかもしれない(このテーマに関するGPA/MPA勧告を参照)。
メトトレキサートとトリメトプリム/スルファメトキサゾールの間には、トリメトプリム/スルファメトキサゾールを800mg/160mgで1日2回投与した場合、薬物相互作用の可能性があります。
ニューモシスチスの予防に使用されるトリメトプリム/スルファメトキサゾールの用量は一般的に許容されますが、メトトレキサートと併用する場合は、その使用を監視する必要があります。
推奨します:リツキシマブによる寛解維持療法を受けているGPA/MPA患者で、低ガンマグロブリン血症(例:IgG<3gm/リットル)および重度の感染症を再発する患者には、免疫グロブリン補充を条件付きで推奨している。
低ガンマグロブリン血症で感染症が再発する場合は、補充量(例:400~800mg/kg/月)の免疫グロブリン補給を検討する必要があります。また、低ガンマグロブリン血症で感染症を繰り返さないが、ワクチン反応が低下している患者には、免疫グロブリンの補充を検討することができます(26)。これらの検討は、アレルギー・免疫専門医の協力のもとで行う必要があります。
未評定 ポジションステートメント GPA/MPA における非グルココルチコイド寛解維持療法の実施期間は、患者の臨床状態、好み、価値観によって決定されるべきです。
寛解維持療法に最適な期間は十分に確立されていない。臨床試験では通常、寛解維持療法は18カ月以上実施されていますが、患者は寛解維持療法をより長い期間継続することで利益を得られる可能性があります(27)。患者委員会は、寛解維持療法を18ヶ月以上、患者固有の要因によってはそれ以上の期間行うことを支持しました。考慮すべき要因としては、過去の再発歴、臓器浸潤の程度、ANCA の状態などの疾患特性(PR3-ANCA 陽性患者は疾患再発を経験する可能性が高い [28])が挙げられます。
未評価の見解 GPA/MPA に対するグルココルチコイド療法の期間は、患者の臨床状態、好み、価値観によって決定される べきである。
GPA/MPA に対するグルココルチコイド療法の最適な期間は、十分に確立されていない。疾患コントロールに寄与するグルココルチコイドの免疫抑制効果は、その使用に伴う毒性とのバランスをとる必要があります。全体として、患者はグルココルチコイドの投与量をできるだけ少なくすることを希望していますが、一部の患者は疾患の静止状態を維持するために低用量のグルココルチコイドを長期間必要とすることを認識しています。グルココルチコイド使用による毒性に対するスクリーニング(例:骨粗鬆症のための骨密度検査)を実施する必要がある。
疾患再発の治療
推奨 重度の疾患症状を伴う再発を経験し、寛解維持のためにリツキシマブを投与されていないGPA/MPA患者に対し、寛解再導入のためにシクロフォスファミドよりもリツキシマブを用いた治療を条件付きで推奨する。
無作為化比較試験のサブグループ解析によると、リツキシマブは、以前にシクロホスファミドの投与を受け、その後再発した患者の寛解再導入に対して、シクロホスファミドの内服よりも有効です(9)。さらに、シクロホスファミドの累積毒性は、この薬剤の反復使用を懸念させるものです。
推奨 寛解維持のためのリツキシマブ投与中に重篤な疾患症状を伴う再発を経験したGPA/MPA患者に対しては、寛解再導入のためのリツキシマブ追加投与よりも、リツキシマブからシクロホスファミドへの切り替えを条件付きで推奨する。
リツキシマブとシクロホスファミドのどちらの治療(静注または経口)を行うかは、リツキシマブ最終投与からの時間やシクロホスファミドの累積投与量などの複数の要因に影響される可能性があります。リツキシマブを最近投与した場合はシクロホスファミドが推奨され、リツキシマブを最後に投与してから長期間経過している場合は、リツキシマブの寛解導入投与が有効である場合があります。寛解導入の標準的な方法として、これらの薬剤はグルココルチコイドと併用して使用されるべきです。
難治性疾患に対する治療法
推奨事項 リツキシマブまたはシクロホスファミドによる寛解導入療法に抵抗性の重症GPA/MPA患者には、2つの療法を併用するよりも、もう一方の療法に治療を切り替えることを条件付きで推奨する。
寛解導入療法に不応な疾患はまれであり、治療推奨の指針となるデータは限られています。医師は、感染症などの他の疾患が血管炎を模倣していないかどうかを評価する必要があります。しかし、もし患者さんの疾患が1つの寛解導入療法に不応性であれば、寛解導入戦略を変更することが重要です。併用療法を行う前に、もう一方の寛解導入剤に切り替えることをお勧めします。
推奨します:寛解導入療法に抵抗性のGPA/MPA患者には、現在の治療に免疫グロブリン(IVIG)を追加することを条件付きで推奨する。
IVIGはGPA/MPAの治療にルーチンに使用すべきではないが、寛解導入療法(リツキシマブやシクロホスファミドなど)が効果を発揮するのを待つ間、短期間のコントロールのための補助療法として一定の治療量(例えば2gm/kg)で検討できる(上記の推奨を参照)(29)。
副鼻腔、気道、腫瘤病変の治療
未評価の見解。GPA の副鼻腔病変を有する患者には、鼻腔洗浄および鼻腔外用療法(抗生物質、潤滑剤、グルココルチコイド)が有効な場合がある。
GPA の治療に精通した耳鼻科医と協力し、これらの介入を行うべきかどうかを判断することを推奨する。
推奨する:鼻中隔欠損および/または鼻梁崩壊を有する寛解期のGPA患者に対して、患者が希望する場合は、条件付きで再建手術を推奨する。
手術結果を最適化するために、再建手術は、持続的な寛解期間の後に、GPAの治療に精通した耳鼻咽喉科医が行うべきである(30、31)。
推奨します:GPA 患者で、狭窄を伴う声門下および/または気管支内組織の炎症が活発な患者には、グルココルチコイドの局所注射のみによる外科的拡張術よりも免疫抑制療法による治療を条件付きで推奨します。
声門下狭窄や気管支内狭窄は、それぞれ耳鼻咽喉科医や呼吸器科医が、これらの病変の管理に精通した上で管理すべきです。免疫抑制療法は活動性の炎症性狭窄の初期治療に推奨され、通常グルココルチコイドやその他の薬剤で構成される(32); 免疫抑制療法の程度は他の疾患症状の重症度に基づいて決定されることがある。グルココルチコイドの局所注射を伴う外科的拡張術は、長期にわたる線維化した狭窄や、免疫抑制に反応しない狭窄に対してより適切である(32-34)。また、早急な治療が必要な狭窄(例:重大な狭窄)に対しては、内科的治療と同時にグルココルチコイドの局所注射による外科的拡張術が初期治療として考慮されることがある。
推奨する:GPAと腫瘤性病変(例:眼窩偽腫瘍、耳下腺、脳、肺の腫瘤)を有する患者に対しては、腫瘤性病変の外科的除去よりも免疫抑制療法による治療を条件付きで推奨する。
腫瘤性病変に対する初期治療として、免疫抑制療法(寛解導入と寛解維持を伴う)がほぼ常に選択される(35、36)。これらの病変は主にグルココルチコイドに反応する傾向があるが、グルココルチコイドを節約する効果を期待して、他の薬剤も通常使用される。視神経圧迫による急性視力低下や、生命や臓器を脅かす圧迫など、緊急に減圧が必要な場合は、デバルキング手術が検討されることがある。
その他の検討事項
推奨します:GPA/MPA 患者においては、ANCA 力価の結果のみに基づいて免疫抑制療法を行うことは、条件付きで推奨しない。
ANCA抗体価の上昇は、疾患活動性の指標としてわずかな情報しかなく(37)、個々の患者の疾患再燃の予測因子としては信頼できない。ANCA抗体価の変化のみに基づいて免疫抑制療法を強化することは、不必要な免疫抑制を招き、有害事象を引き起こす可能性がある。ANCA陽性の持続は、必ずしも免疫抑制療法継続の必要性を示すものではない。むしろ、患者の臨床症状と診断学的検査(検査所見、画像所見、生検所見など)に基づき、治療法を決定すべきである。
推奨する:リツキシマブまたはシクロホスファミドの投与を受けているGPA/MPA患者には、P jirovecii肺炎を予防するための予防薬を条件付きで推奨します。
P jirovecii肺炎を予防するための予防策は、シクロホスファミド治療でルーチンに使用されています(38)。リツキシマブの処方情報では、GPAまたはMPAの患者に対して、リツキシマブの最終投与後6カ月以上、P jirovecii肺炎の予防を推奨しています。投票パネルの多くは、シクロホスファミドまたはリツキシマブの投与を受けているGPA/MPA患者がP jirovecii肺炎の予防投与を受けるべきだと強く感じていますが、この疑問に直接対処する中質または高品質のエビデンスがないことと、予防投与に使用する薬剤の毒性の可能性を考慮して、この推奨は条件付きとなっています。中用量のグルココルチコイド(例:20mg/日以上)とメトトレキサート、アザチオプリン、またはミコフェノール酸モフェチルを併用している患者に対しても、P jirovecii肺炎に対する予防を検討すべきである(38)。リツキシマブを投与されている低年齢の小児では、予防投与はあまり行われませんが、検討すべきです。
推奨する:寛解期の GPA/MPA とステージ 5 の慢性腎臓病の患者には、条件付きで腎臓移植の評価を推奨する。
AAV患者における腎移植の成績は、他の理由で移植を受けた患者と同様であり、移植腎での疾患再発はまれである(39, 40)。寛解期のGPAおよびMPAは、腎移植の禁忌とみなされるべきではないが、これらの患者は移植後の疾患再発を監視する必要がある。
推奨する:他の免疫調節療法を受けることができない活動性GPA/MPA患者には、条件付きでIVIGの投与を推奨する。
IVIGはGPA/MPAの治療にルーチンに使用すべきではない(上記の推奨を参照)。しかし、活動性疾患の患者が従来の免疫抑制療法を受けられない可能性がある稀な例(例:敗血症や妊娠)では、従来の寛解導入療法が使用できるまでの短期介入としてIVIGを使用することができます(29)。
未評定 ポジションステートメント 静脈血栓事象を経験した GPA/MPA 患者に対する最適な抗凝固療法の期間は不明である。
AAVは、深部静脈血栓症および肺塞栓を含む静脈血栓性イベントのリスク上昇と関連しています(41、42)。疾患が活発で他の危険因子がない患者に起こる静脈血栓塞栓事象は、一過性の危険因子による誘発事象と考えることができる(その後の疾患のコントロールを前提としている)。したがって、生涯にわたる抗凝固療法ではなく、短期間の抗凝固療法を検討することができる。
EGPAに関する勧告と未評定ポジションステートメント
EGPAは、喘息・アレルギー性鼻炎、末梢・組織好酸球増多、血管炎など、多様な特徴を有しています。
これらの臨床的特徴は、治療に対する反応が異なる可能性があるため、管理方法は通常、患者の疾患の特徴および重症度に基づいて行われます。
ここで紹介する推奨事項は、主にEGPAの血管炎症状を治療するための免疫抑制剤の使用に焦点を当てたものです。
しかし、喘息およびアレルギー症状はEGPAの重要な構成要素であり、吸入療法やアレルゲン回避を含むこれらの対策は、管理上重要な役割を担っています。
リウマチ専門医、喘息・アレルギー専門医、および他の医療分野の専門医が協力することで、EGPA患者さんの治療がより充実したものになります。
GPA/MPAとは対照的に、EGPAではこれまでほとんど無作為化比較試験は行われていない。したがって,これらの勧告や未評定は,専門家の意見を含む質の低い(すなわち,間接的な)エビデンスへの依存を反映している。
表1は、重症・非重症の定義や寛解導入・維持に用いる薬剤の投与レジメンなど、勧告や未評定声明で用いられている特定の用語の定義を示したものである。表3は、勧告と段階的意見陳述に、その根拠となるPICO質問とエビデンスレベルを示したものである。図 2 は、EGPA の治療に関する主要な推奨事項を示している。
表3. EGPA*の管理に関する推奨事項/ステートメント

* 多発性血管炎を伴う好酸球性肉芽腫症(EGPA)に関して作成された、推奨度評価、開発、評価の方法論に使用される集団、介入、比較対象、結果(PICO)の質問については、補足資料2(Arthritis & Rheumatologyウェブサイト http://onlinelibrary.wiley.com/doi/10.1002/art.41773/abstract にて公開)を参照してください。IV = intravenous; GC = glucocorticoids
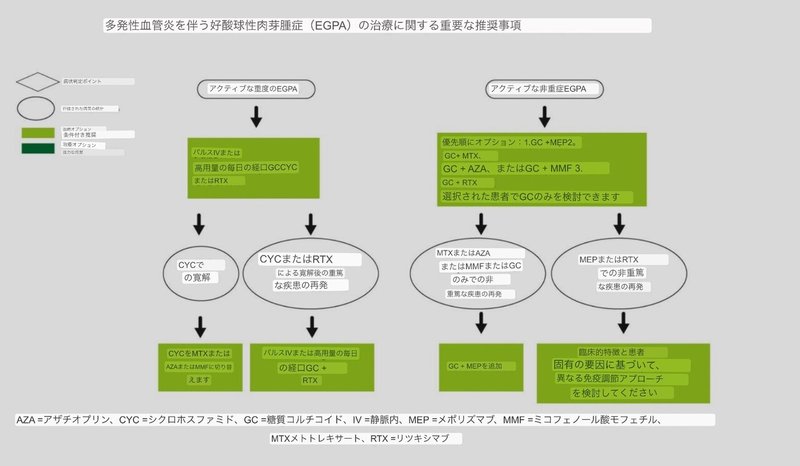
図2
多発性血管炎を伴う好酸球性肉芽腫症の治療に関する主要な推奨事項
活動的で重症な疾患に対する寛解導入
未評定 ポジションステートメント :活動性の重症EGPA患者には、初期治療としてパルスグルココルチコイド静注用または高用量経口グルココルチコイドのいずれかを処方することができる。
活動性の重症EGPAにおいて、パルスグルコルチコイドの静注と経口グルココルチコイドの大量投与のどちらを優先するかを支持するデータは存在しない。治療法の選択は、個々の患者の要因に影響されるべきである。
いずれの場合も、グルココルチコイドは、シクロホスファミドやリツキシマブなどの非グルココルチコイド系免疫抑制剤と併用すべきである(以下の未評定ポジションステートメントを参照)。
未評定ポジションステートメント :活動性の重症EGPA患者には、寛解導入のためにシクロホスファミドまたはリツキシマブのいずれかを処方することができる。
シクロホスファミドは、他の血管炎におけるシクロホスファミドの使用経験から、活動性の重症EGPA患者の寛解導入に、より一般的に使用されています(43)。
GPA/MPAにおけるリツキシマブの使用経験が増えたことにより、EGPA患者にもリツキシマブによる治療が行われるようになり、リツキシマブは活動性の重症疾患にも有効であることがケースシリーズで示唆されています(44)。
EGPAに対するシクロホスファミドとリツキシマブの比較有効性が不明であることから、議決権行使委員会は、活動性かつ重症のEGPAにおける寛解導入にはシクロホスファミドとリツキシマブの両方を検討することができると考えている。
心筋症はEGPAの主な独立した死亡予測因子であることが判明しているため(25、26)、シクロホスファミドの使用経験が多いことから、活動性の心病変を有する患者にはシクロホスファミドが望ましいと思われる。
シクロホスファミドは、ANCA 陰性で重度の神経症状または消化器症状を有する患者に対しても検討することができる。
リツキシマブは、ANCA陽性、活動性糸球体腎炎、サイクロホスファミドの前治療、またはサイクロホスファミドによる性腺毒性のリスクがある患者に対して検討される場合があります。
推奨:活動性で重症のEGPA患者に対しては、寛解導入のためにメポリズマブよりもシクロホスファミドまたはリツキシマブを用いた治療を条件付きで推奨する。
重症EGPAに対するメポリズマブの有効性は、活動性重症患者を無作為化試験から除外したため、確立されていない(45)。このような状況では、メポリズマブよりもリツキシマブまたはシクロホスファミドが推奨されます。
活動性の高い非重症疾患に対する寛解導入療法
推奨します:活動性で非重症のEGPA患者に対しては、メトトレキサート、アザチオプリン、ミコフェノール酸モフェチル、グルココルチコイドよりもメポリズマブとグルココルチコイドによる治療の開始を条件付きで推奨している。
活動性の非重症EGPAの治療には、さまざまな免疫抑制剤が検討されますが、これらはすべてグルココルチコイドと併用されます。非重症EGPAの臨床プロファイルは、主に喘息、副鼻腔疾患、および非重症血管炎を含んでいます。
メトトレキサート、アザチオプリン、ミコフェノール酸モフェチルには重要な臨床経験があるが、その有効性に関するデータは限られており、これらの治療法は無作為化臨床試験で評価されていない。
ガイドラインの作成過程で使用されるGRADE手法は、観察研究よりも臨床試験に重きを置いている。
そのため、メポリズマブは無作為化試験で非重症EGPAに有効であることが判明しているため、第一選択薬として推奨されています(45)。
本試験では、全例が再発性または難治性であり、55%が登録時に非グルココルチコイド系免疫抑制剤を追加投与されていました。本試験では、多くの患者さんが喘息や好酸球の症状を呈していましたが、これらの症状は、EPA以外の疾患においてもメポリズマブの有効性が認められています。
本試験では、非重症血管炎症状を有する患者さんが参加されましたが、非重症血管炎のすべての側面に対するメポリズマブの有効性については疑問が残ります。
病状を含む個々の要因がメポリズマブ使用の決定に影響を与える可能性があり、その場合、メトトレキサート、アザチオプリン、ミコフェノール酸モフェチルを代わりに使用することができます。
これらの薬剤(メトトレキサート、アザチオプリン、ミコフェノール酸モフェチル)のうち、どれかひとつを優先して使用するというデータは不十分であるため、その選択は個々の患者の要因に影響されるべきです。
推奨する:活動性で非重症のEGPA患者に対しては、メトトレキサート、アザチオプリン、またはミコフェノール酸モフェチルとグルココルチコイドによる治療の開始を、グルココルチコイド単独よりも条件付きで推奨する。
グルココルチコイドの毒性を最小限に抑えるために、患者はグルココルチコイド単独ではなく、メトトレキサート、アザチオプリン、またはミコフェノール酸モフェチルを補助的に投与する必要があります。
予後不良因子のないEGPA、MPA、結節性多発動脈炎患者を対象としたある無作為化試験では、アザチオプリンの追加ではグルココルチコイド単独投与以上の効果は得られないことが示された(46)。
特に喘息患者においては、メトトレキサート、アザチオプリン、ミコフェノール酸モフェチルをグルココルチコイドと同時に使用する判断に影響を与え、メポリズマブの検討のきっかけとなる可能性があります。
グルココルチコイド単剤療法は、軽度の喘息、アレルギー症状、妊娠中の使用、その他個々の患者の状況に応じて適切な場合があります。
推奨する:活動性で非重症のEGPA患者に対しては、メトトレキサート、アザチオプリン、またはミコフェノール酸モフェティルとグルココルチコイドによる治療の開始を、シクロホスファミドまたはリツキシマブとグルココルチコイドよりも条件付きで推奨している。
メトトレキサート、アザチオプリン、ミコフェノール酸モフェチル、およびリツキシマブの有効性の比較は十分に確立されていませんが、EGPAにおけるこれらの薬剤の使用経験がリツキシマブと比較して多いことから、メトトレキサート、アザチオプリン、ミコフェノール酸モフェチルの使用が推奨されています。
しかし、他の薬剤が活動性の非重症疾患の制御に有効でない場合、または患者が非重症血管炎(一部のシリーズでは多発性単神経炎を含む)を有し、ANCAが陽性の場合は、リツキシマブを考慮することができる。
シクロホスファミドは、その毒性のため、活動性の非重症疾患の治療では避けるべきであり、この環境では最も好ましくない選択肢である。
寛解の維持
推奨する:シクロホスファミド療法で寛解に至った重症EGPA患者には、寛解維持のためにリツキシマブよりもメトトレキサート、アザチオプリン、ミコフェノール酸モフェチルによる治療を条件付きで推奨する。
通常、重症のEGPAでは、毒性および疾患再発のリスクを軽減するために、寛解導入後に維持療法薬を使用することになるが(47)、単相性疾患が発生することもある(48)。
アザチオプリンは、発表されたEGPAシリーズでよく使用されているが(46)、EGPAにおけるメトトレキサート、アザチオプリン、およびミコフェノール酸モフェチルの比較証拠がないため、ある薬剤を他の薬剤より推奨することは不可能である。
EGPAにおける寛解維持のためのリツキシマブの使用経験が少ないため、メトトレキサート、アザチオプリン、ミコフェノール酸モフェチルの使用がリツキシマブよりも推奨される。
リツキシマブで寛解が得られた場合、または他の選択肢に禁忌がある場合は、リツキシマブを検討することができる。
推奨する:寛解期に入った重症EGPA患者に対しては、寛解維持のためにメポリズマブよりもメトトレキサート、アザチオプリン、ミコフェノール酸モフェチルによる治療を条件付きで推奨する。
EGPAにおける寛解維持療法の使用に関するデータは限られていますが、寛解導入療法(例:シクロホスファミド)は、毒性の可能性を考慮すると、無期限に継続すべきではありません。
したがって、GPA/MPAにおける経験、専門家の意見、小規模試験の結果に基づいて、メトトレキサート、アザチオプリン、またはミコフェノール酸モフェチルを寛解維持療法に考慮することができる(49)。
メポリズマブの主な使用経験は難治性の非重症疾患であり、重症疾患に対する寛解維持療法としての有効性を外挿することは困難である。
未評定 ポジションステートメント:EGPAにおけるグルココルチコイド治療の期間は、患者の臨床状態、価値観、嗜好によって導かれるべきである。
特定のグルココルチコイド治療期間を支持する発表された証拠は不十分であるため、グルココルチコイド治療の期間は、各患者の臨床状況に基づいて決定されるべきです。
EGPA患者の多くは、喘息およびアレルギー症状のコントロールを維持するために、一般に低用量のグルココルチコイドによる何らかの治療を必要とします。
グルココルチコイドの毒性を最小限に抑えるため、最小限の有効量を処方する必要があります。
疾患再発の治療
推奨する:シクロホスファミドによる寛解導入に成功した後、重度の疾患症状を伴う再発を経験したEGPA患者には、寛解再導入のためにシクロホスファミドよりもリツキシマブを用いた治療を条件付きで推奨します。
リツキシマブは、可能であればシクロホスファミドによる再治療を避けたいという一般的な希望と、再発または難治性のEGPAにおけるリツキシマブの観察研究の結果に基づいて推奨されます(50)。
心臓病変は死亡の独立した予測因子であり、ANCA 陰性疾患と関連しているため、シクロホスファミドは再発した場合に考慮される可能性があります(活動性重症疾患における寛解導入に関する未評定見解で議論されています)。
推奨する:リツキシマブによる寛解導入に成功した後、重症の疾患症状を伴う再発を経験したEGPA患者に対しては、寛解再導入のためにシクロホスファミドに切り替えるよりもリツキシマブによる治療を条件付きで推奨します。
リツキシマブによる寛解導入は、毒性を最小限に抑えるために、シクロホスファミドによる治療よりも推奨されます。
しかし、再発前の寛解期間を検討する必要があります。
リツキシマブ治療後すぐに重度の再発が起こった場合、または心臓病変が存在する場合は、シクロホスファミドを検討すべきである(このテーマに関する未評定ポジションステートメントおよび勧告を参照)。
推奨事項:メトトレキサート、アザチオプリン、またはミコフェノール酸モフェチル投与中に、非重症疾患症状(喘息および/または副鼻腔疾患)を伴う再発を経験したEGPA患者には、他の薬剤への切り替えよりもメポリズマブの追加を条件付きで推奨する。
活動性喘息を有するEGPA患者に対しては、全身性免疫抑制療法を増やす前に、吸入療法を最大化する必要があります。
直接的な比較データはないが、メポリズマブは、この勧告で特に述べられている患者、すなわち免疫抑制療法を受けている再発性非重症EGPA患者を対象とした無作為化試験で有効であることが判明している(45)。
また、好酸球性喘息にも有効であることが独立して証明されている(51)。
このエビデンスに基づき、メポリズマブは、メトトレキサート、アザチオプリン、またはミコフェノール酸モフェチルの投与を受けている患者の非重症再発性疾患の治療に、そのグループの代替薬に切り替えるのではなく、推奨されています。
推奨する:低用量グルココルチコイドを投与され、他の治療を受けずに非重症の疾患症状(喘息及び/又は副鼻腔疾患)を伴う再発を経験したEGPA患者に対しては、メトトレキサート、アザチオプリン、又はミコフェノール酸モフェティルの追加よりもメポリズマブの追加を条件付きで推奨する。
上記の推奨に関する議論と同様に、喘息および/または副鼻腔疾患の疾患再発を経験している患者においては、吸入薬の使用を最適化する必要があります。
グルココルチコイド単剤療法を受けている非重症再発性EGPA患者に対しては、無作為化試験でこの集団に対する有効性が証明されていることから、メトトレキサート、アザチオプリン、ミコフェノール酸モフェチルの追加よりもメポリズマブの開始が望ましいと考えられる(45)。
推奨します:メトトレキサート、アザチオプリン、ミコフェノール酸モフェチル投与中に非重症疾患症状(喘息および/または副鼻腔疾患)を伴う再発を経験したEGPAおよび血清IgE高値患者に対しては、オマリズマブ追加よりもメポリズマブ追加を条件付で推奨する。
抗IgE抗体であるオマリズマブについて、EGPAにおける発表されたエビデンスは限られています。
したがって、血清IgE値が高い患者であっても、ランダム化比較試験(45)のエビデンスに基づき、メポリズマブを選択することが望ましいと考えられます。
その他の検討事項
推奨する:ロイコトリエン阻害剤を投与されている新規診断のEGPA患者には、条件付きでロイコトリエン阻害剤を中止するよりも継続することを推奨します。
ロイコトリエン阻害剤の導入後、EGPAの発症との関連性が懸念されました。
その後の後方視的研究において、ロイコトリエン阻害剤とEGPAの間に因果関係があるとは結論付けられていません(52)。
したがって、新たにEGPAと診断された患者さんは、喘息や副鼻腔疾患の管理に有益であれば、ロイコトリエン阻害剤を継続する選択肢を持つべきであると考えられます。
未評価の見解です:ロイコトリエン阻害剤の使用は、活動性の喘息および/または副鼻腔疾患を有するEGPA患者に禁忌とされない。
ロイコトリエン阻害剤は、喘息およびアレルギー性鼻炎に治療適応があります。
EGPAとの明確な因果関係は証明されていないため、喘息や副鼻腔疾患の管理のためにロイコトリエン阻害剤を追加することは可能です。
しかし、ロイコトリエン阻害剤は多くの選択肢の1つであり、この設定において唯一の選択肢ではありません。
ロイコトリエン阻害剤は、喘息や副鼻腔疾患以外の症状の治療に用いるべきではない。
推奨します:EGPA患者には、診断時に心エコー図を取得することを条件付きで推奨する。
心筋梗塞はEGPAの疾患関連死亡の主な原因である(48)。
心エコー検査はリスクが少なく、心病変を特定することができ、それが存在すれば治療法の決定に影響を与えることができる。
心病変を特定できない場合、患者の転帰に悪影響を及ぼす可能性がある。
したがって、心臓の症状がない場合でも、新たにEGPAと診断されたすべての患者に対して、心エコー図を受けることを推奨する。
推奨する:EGPA患者には、治療の指針として5因子スコアを使用することを条件付きで推奨する。
1996年に発表された5因子スコア(FFS)は、当時定義されていた結節性多発動脈炎またはEGPAの患者342人のコホートに基づくものである(53)。
この5つの因子とは、1gm/日を超える蛋白尿、1.58mg/dlを超える血清クレアチニンによる腎機能不全、消化管病変、心筋症、中枢神経系病変のことである。
FFS は、主に予後予測ツールであり、スコアが高いほど予後が悪いとされている(53)。
治療の指針として用いられてきたが(43)、新しい治療法への適用性は不明である。
2011年にGPA、MPA、EGPA、PANの患者1,108名を対象にFFSの再検討が行われた(54)。
2011年版では、耳、鼻、喉のパラメータと65歳以上の年齢が追加された。
1996年版FFSは、現在もより一般的に使用されており、重症化に関連する臓器特異的パラメーターの特定や治療の指針として有用であると考えられる。
本ガイドラインで用いた重症・非重症EGPAの定義はFFSに基づくものではないが、このツールは臨床医が治療を決定する際に有用であることが分かった。
FFSの構成要素は、より積極的な治療を必要とする重症の指標となり得る。
未評価の見解:EGPAの副鼻腔病変を有する患者では、鼻腔洗浄剤および局所療法(例:抗生物質、潤滑剤、グルココルチコイド)による治療を考慮することができる。
アレルギー性鼻炎および副鼻腔疾患は、EGPAの頻度の高い臨床的特徴です。
EGPAにおける鼻腔洗浄剤および外用療法の有効性は十分に確立されていませんが、一部の患者には効果がある可能性があります。
可能であれば、AAVの治療に精通した耳鼻咽喉科医に相談し、これらの薬剤の使用および選択を指導してもらう必要があります。
これらの介入は、症状が改善または消失した場合でも、引き続き有益である可能性がある。
推奨 シクロホスファミドまたはリツキシマブの投与を受けているEGPA患者には、P jirovecii(ニューモシスチス肺炎)肺炎を予防するための薬剤を処方することを条件付きで推奨します。
P jirovecii肺炎を予防するための予防薬については、GPA/MPAの推奨事項の中で前述しています。
GPA/MPA患者におけるこの疾患を予防するための予防薬に関する考察は、EGPA患者にも同じように適用されます。
解説(討論)
本ガイドラインでは、GPA、MPA、EGPAの管理について、ACR/血管炎財団が初めて推奨する内容を提示する。
これらの推奨は、疾患管理の一般的なガイドを提供するが、患者の臨床状態、好み、および価値観が治療に影響を及ぼすべきである。
全体として、これらの推奨は、生物学的製剤の新たな役割やグルココルチコイドの毒性を最小限に抑えるための積極的な戦略など、これらの疾患の進化した管理を反映しています。
GPAとMPAに対する推奨は、現在EGPAで利用可能なものよりも多くの無作為化試験により裏付けられている。
これらの3疾患に対する推奨はすべて条件付きである。これは、エビデンスが強くない、または代替療法が妥当な検討対象であることを示すものである。これらの勧告は、いかなる機関によっても、治療へのアクセスを制限したり、特定の治療法を他の治療法より優先して利用することを要求するために利用されるべきではない。
この勧告は米国のリウマチ専門医のために作成されたため、投票委員会の医師は主にリウマチ専門医であった。
AAVは多臓器疾患であるため、AAV患者は他の専門医(例えば、腎臓内科医、呼吸器科医、耳鼻科医)から治療を受けている場合が多い。本ガイドラインの推奨は発表されたデータに基づくものであるが、他の専門医は異なる管理戦略を支持するかもしれない。我々は、リウマチ専門医が治療計画について議論し、必要に応じて他の専門医とケアを調整することを推奨する。
最近、GPAとMPAの患者を対象としたアバコパンの臨床試験が発表された(55)。
本ガイドラインでは、最終文献検索時にFDAから適応を問わず使用が承認されている治療法を対象としているため、アバコパンの検討は行わなかった。それ以降にFDAから承認された治療法については、本ガイドラインの将来の更新時に含めることを検討する予定である。
本ガイドラインは、AAVの治療に関する我々の知見とのギャップを浮き彫りにするものである。
最も顕著なのは、疾患活動性を正確に評価し、転帰を予測できるバイオマーカー評価や毒性の少ない他の非侵襲的な診断検査がないことである。
さらに、無作為化臨床試験から、初期寛解導入と維持療法に関する推奨を支持する証拠が得られていますが、最適な治療期間など、重要な疑問が未解決のまま残っています。
このような知識のギャップは、これらの疾患における継続的な研究の必要性を補強しています。
具体的に調査すべき分野は以下の通りです。
1) 治療法の決定に役立つ、より具体的で信頼できる疾患活動性の指標を同定するためのバイオマーカー研究、
2) 現在使用されている薬剤の最適な使用方法(例えば、投与量、期間、有効な組み合わせ、どの集団にどの薬剤を使用するかなど)を明らかにする試験、
3) 毒性が少なく新規、標的、グルココルチコイド代替薬を特定する試験、および
4) 経過と現在の治療法の安全性を把握する長期研究、などが挙げられます。
これらの分野で大きな進展があり、将来の推奨事項が、これらの患者の疾病管理、治療毒性の最小化、臓器障害の予防のために、より適したアプローチを提供できるようになることを期待しています。
この記事が気に入ったらサポートをしてみませんか?
