
2021年 共通テスト「化学基礎」過去問解説①第1問(解説動画付き):令和3年度 大学入学共通テスト 本試
第2問、およびプレテスト「化学基礎」の解説は、こちらのページにまとめております。
問題は、大学入試センターの方で公開されております。
そちらからどうぞ。
印刷して、要点などまとめながら進めると、勉強しやすいです。
それでは、「化学基礎」の解説をはじめます。
解説動画も貼っておきますが、あくまで解説記事の方がメインです。
動画は補助として、必要なところだけご覧ください。
第1問 問1 純物質と混合物/単体と化合物
物質は、1種類の物質からなる純物質と、2種類以上の物質が混ざった混合物に分類されます。
さらに純物質は、1種類の元素からなる単体と、2種類以上の元素からなる化合物に分類されます。
まず、この階層構造を理解しましょう。
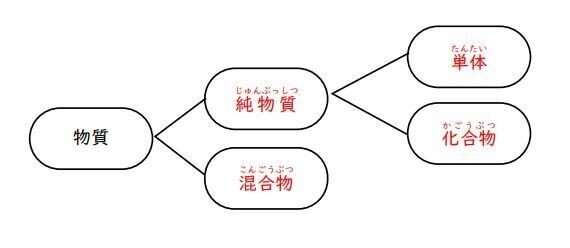
問題では、単体、化合物、および混合物の分類が問われています。
これらのみきわめには、「化学式」を頼りにするといいでしょう。
まず、「空気」のような混合物は、基本的には化学式で表せません。
空気も、窒素や酸素、二酸化炭素などさまざまな気体からできています。
化学式で表しようがないですね。
単体か化合物か?も、化学式をみればわかります。
メタンの化学式は、「化学」を履修していない人には覚えづらいかもしれませんが、炭素原子(C)は手が4本、水素原子(H)は手が1本ということから、分子は次のような形になっています。
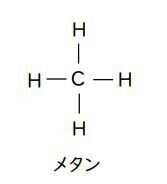
こういう形だから、CH₄ なのだということを知っておけば、覚えやすいでしょう。メタンは、CとHという2種類の元素からできているので、化合物です。
オゾンは、酸素(O₂)の同素体で、酸素原子(O)が3つ無理に結びついた形で化学式は「O₃」です。
オゾンは、1種類の元素でできているので、単体です。
正解:⑥
第1問 問2 化合物中の「原子」の物質量
(物質量〔mol数〕についての基本的な考え方は、こちらの解説記事にまとめています。大切なテーマですので、ここらへんが危うい人は、こちらの記事もどうぞ)
酸素「原子」の物質量なので、注意です。
1つずつ、化学式を確認していく必要があります。
物質量(mol数)を比較する問題ですが、本質的には酸素原子の個数を比較する問題と、とらえましょう。
原子はひじょうに小さいので、私たちが目にする物質は、とても数えきれないほどの原子から構成されています。
そこで、molという非常に大きな単位(6×10²³個の粒子の集まりが1mol)を使って、分子や原子の個数を比較します。
それでは、選択肢を1つずつみていきましょう。
①:「0℃、1.013×10⁵Pa」というのは、標準状態のことです。
標準状態では、どんな気体でも1molの体積が22.4Lを占めます。
今、体積が22.4Lということなので、この酸素の物質量は1molです。
ただし、ここで注意が必要で、ここでいう酸素とは、酸素分子(O₂)のことです。
O₂ なので、酸素分子1個の中に、酸素原子は2個あります。
同様に、酸素分子(O₂)1molの中には、酸素原子(O)は2mol存在します。
選択肢①に含まれる酸素原子の物質量は、2molです。
②:水の化学式は「H₂O」
分子量は、問題の最初に与えられている原子量から・・・
H:1、O:16を使い、Hが2個なので、1×2より「2」、Oが1個で「16」
・・・合わせて「18」です。
分子量が「18」ですが、これは1molあたりの質量を意味します。(分子量に〔g〕をつければ、その分子の1molあたりの質量になります。)
水は、1molで18gの質量だということです。
選択肢②は、水18gについて考えているので、この水の物質量は1molです。
水の化学式H₂O をみると、水分子1個の中に酸素原子は1個だけあることがわかります。
水分子(H₂O)の物質量が、そのまま酸素原子(O)の物質量となり、選択肢②に含まれる酸素原子の物質量は、1molです。
③:過酸化水素は、その名前のとおり、水分子(H₂O)に酸素原子(O)がもう1つ、無理やりくっついた形で、化学式は「H₂O₂」です。
過酸化水素(H₂O₂)1つ(1mol)あたり、酸素原子(O)は2つ(2mol)存在します。
選択肢③に含まれる酸素原子の物質量は、2molです。
④:黒鉛の化学式は「C」、式量(原子量)は冒頭の表より「12」です。
今、「黒鉛12g」とあるので、これは「黒鉛1mol」という意味になります。
黒鉛の燃焼の「化学反応式」を立てる必要があります。
黒鉛(C)が空気中の酸素(O₂)と結びつき、二酸化炭素(CO₂)が発生します。
C + O₂ → CO₂
化学反応式の各物質についている係数は、反応する、また反応で生じた各物質の物質量の比を表しています。
上の反応式では省略されていますが、係数はみな「1」です。
黒鉛(C)1molが酸素(O₂)1molと結びつき、二酸化炭素(CO₂)1molが発生するということです。
今、黒鉛1molを完全燃焼させました。発生する二酸化炭素は1molです。
また二酸化炭素(CO₂)1molの中に、酸素原子(O)は2mol含まれています。
選択肢④に含まれる酸素原子の物質量は、2molです。
以上みてきたように、②だけ1molで、あとはみな2molでした。
②が正解です。
正解:②
第1問 問3a 原子番号と周期表
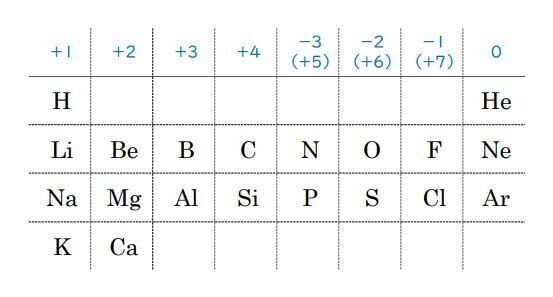
化学のテストでは、周期表は必ず使うので、関連の問題が出たら、すぐに周期表を書き出しておきましょう。
原子番号20のCa(カルシウム)まででいいです。
それ以上は、必要ありません。
この問題の図1でも、原子番号19まであつかっています。
後でも使うかもしれませんので、テスト用紙の十分に空白があるところを利用して書いておきましょう。
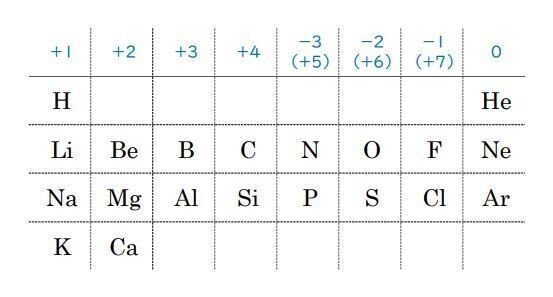
問題では、「陽子・中性子・価電子の数」が問われています。
わかりやすいところからみていったほうがよいので、「陽子」の数からみていきましょう。
「陽子の数=原子番号」です。
これは、覚える覚えないの問題ではありません。
もともと、陽子の数が1つのものを原子番号1、陽子の数が2つのものを原子番号2、として並べていったものが周期表です。
元素の種類は、陽子の数で決まります。
これは、理解しておかないといけないことです。
図1では、イの△が原子番号と同じになるように1から順に増えています。
これが、「陽子の数」です。
次に、特徴的なので●:ウを確認していきましょう。
原子番号、2、10、18で「0」で、その後は、1つずつ増えています。
これは、「価電子の数」ですね。
周期表で確認しておきましょう。
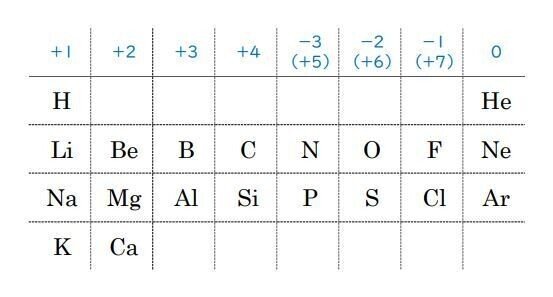
原子核の周りにある電子のうち、最も外側の電子核に入っている電子の数が、さまざまな化学的性質に重要に関わってきます。
そのため、この最外殻にある電子は、価電子ともよばれます。
周期表の縦の列に、似た性質をもつ元素がならぶのは、価電子の数が同じだからです。
周期表の縦の列の一番左から順に、「価電子が1個のグループ」、「価電子が2個のグループ」・・・となっています。
図1とも、照らし合わせて確認しておきましょう。
なお右端の、原子番号2:He、原子番号10:Ne、原子番号18:Ar、などのグループは、希ガスとよばれ、他の元素とほとんど化合物をつくらない(反応性が低い)グループです。
反応性が低いので、希ガスの最外殻電子の数は8個ですが、価電子の数は0個として扱います。
残った■:アが「中性子の数」です。
中性子の数は、だいたい陽子の数と同じくらいですが、元素によってばらつきがあり、図1のようになります。
正解:③
第1問 問3b 質量数/電子核
質量数が最も大きい原子の質量数:
原子を構成する粒子は、陽子、中性子、電子の3種類です。
このうち、陽子と中性子の質量はほとんど同じで、電子の質量はそれらにくらべ、はるかに小さいです。
そこで、陽子の数と中性子の数の和が、質量数とよばれ扱われるようになりました。
陽子の数+中性子の数=質量数
図1の中から、質量数が最も大きいものを選びます。
縦軸のめもりで陽子や中性子の数は、わかります。
ふつうに考えれば、原子番号が最も大きい原子番号19(K)でしょうが、原子番号18(Ar)も、特徴的に中性子の数が多く、こちらが答えかもしれません。両方調べてみましょう。
原子番号18(Ar):陽子の数が18、中性子の数が22、合わせて40
・・・質量数は「40」です。
原子番号19(K):陽子の数が19、中性子の数が20、合わせて39
・・・質量数は「39」です。
原子番号18(Ar)の方が、質量数が大きいと確認できました。
この質量数を答えればよいので、答えは「40」です。
正解:④⓪
M殻に電子がなく原子番号が最も大きい原子の原子番号:
電子核は内側から順に、K殻、L殻、M殻、・・・と、アルファベット順に名前がついています。
これも、周期表をみて答える問題で、今度は横の列に着目します。
(横の並びは「周期」といいます。)
電子の数は、原子番号すなわち陽子の数と同じで、電子は内側の殻から順に埋まっていきます。
第1周期(H~He)は、K殻に電子が入り、
第2周期(Li~Ne)では、L殻に電子が入っていきます。
第3周期(Na~Ar)になって、M殻に電子が入っていきます。
問題の指定では「M殻に電子がなく」ということなので、第2周期の中で原子番号が最も大きなものを選べばよいです。
Ne(ネオン)になります。原子番号を答えるので、答えは「10」です。
(Neは、周期表の10番目にありますね。)
正解:①⓪
なお、問3の内容は「化学」の基礎となる部分です。
この部分を、もっとしっかりかためておきたい方には、こちらの教材を紹介します。
第1問 問4 結晶の電気伝導性
結晶の種類としては、「イオン結晶」、「分子結晶」、「共有結合の結晶」、「金属結晶」の4種類がありますが、この設問ではイオン結晶はなく、3種類からの選択になります。
「金属結晶」は、ふつうに金属を思い浮かべればよいです。
「分子結晶」は、分子どうしが分子間力によってまとまっているだけなので、もろい・・・というイメージでとらえればよいでしょう。
ドライアイスCO₂ などが、これにあたります。
「共有結合による結晶」は、それぞれの原子が共有結合によって結び付いているので、ひじょうに強い結合と考えていいです。
ダイヤモンドなどが好例です。
ただし、黒鉛のようにもろいものもあります。
(ダイヤモンド、黒鉛、ともに化学式は「C」です。)
問題に入りましょう。
アは自由電子をもち電気をよく通すので、金属結晶。
自由電子について、仮に知識がなかったとしても、電気をよく通すということから、金属結晶を選べるはずです。
イはナフタレン分子が集まってできただけの結晶なので、分子結晶。
ウは、共有結合の結晶。代表例のダイヤモンドと特殊な例の黒鉛から判断できます。黒鉛が電気を通すということは、小学校のとき、鉛筆の芯の部分が電気を通す実験で確認しましたね。
正解:⑤
(「結晶」についての解説動画を貼っておきます。何かをつかみかけた方は、こういう機会にかためておくといいですよ。)
第1問 問5 金属のイオン化傾向
「金属のイオン化傾向」は、周期表と同じくらい大切です。
金属のイオン化傾向で、さまざまな化学現象を解釈することができます。
ですので、早めに頭に入れておきましょう。
K Ca Na | Mg Al Zn Fe | Ni Sn Pb (H₂) Cu Hg Ag Pt Au
(↑重要な境目には、仕切り棒(|)を入れておきました)
左のものほど反応性に富みます。
K、 Ca、 Naまでは、「常温で水と反応し水素を発生」・・・とされますが、 実際には空気中の酸素や水分とも反応してしまい、単体のままでいられることはないです。
次のMg~Feまでのグループが、「熱水や高温の水蒸気と反応して水素を発生」するグループです。
設問で問われているアルミニウムAlとマグネシウムMgは、このグループに含まれています。これが答えになります。
なお、白金Ptはイオン化傾向列の右側の方に位置しているので、安定な(反応性の低い)金属です。水と反応することなどありません。
イオン化傾向列の中にある(H₂)は、それより右にある金属は塩酸や硫酸とも反応しない・・・ということを意味しています。
正解:④
第1問 問6 酸化還元反応
まず、下線が付された各物質の酸化数を調べる必要があります。
酸化数の決め方は、優先順位の順に・・・
ⅰ.単体は(0)
ⅱ.水素原子Hは(+1)
ⅲ.酸素原子Oは(-2)
ⅳ.周期表に従う
ⅴ.化合物中のその他のものは、化合物全体の電気(酸化数の総和)が「0」になるように調整
・・・これらは対等ではなく、完全に上から優先順位の順です。
そこに気をつけて、決めていけばいいです。
さて、酸化剤としてはたらいているものを選ぶ問題です。
酸化剤とは、他の物質を酸化させる物質のことです。
でも、他の物質が酸化されているかを調べるのは、手間です。
他の物質を酸化させるということは、酸化剤自身は還元されているということです。ということで、下線が付された物質の中で還元されている物質を探しましょう。
(・・・これが、酸化剤や還元剤に関する問題の基本の解法です。他の物質が酸化されているかを調べるより、その物質が還元されているか調べる方が、はるかに簡単です。還元されている物質をみつけてから、他の物質を酸化していることを確認しましょう。)
酸化と還元で、どちらが酸化数が上がって、どちらが下がるのか?
・・・ごっちゃになっている人も、いると思います。
そういう人は、「例えば…」で考えてみるといいでしょう。
例えば、酸化のよい例として、銅(Cu)は空気中の酸素と化合して、酸化銅(CuO)に変化します。これは典型的な「酸化」ですよね。
酸化数を調べてみると…
銅(Cu)の酸化数は単体なので(0)
酸化銅(CuO)は、『酸素原子Oは(-2)』が優先されるので、銅原子(Cu)は全体の電気(酸化数の和)を「0」になるように酸化数は(+2)
銅原子(Cu)の酸化数は「(0)→(+2)」と増加しています。
よって、「酸化数が増加すると酸化、酸化数が減少すると還元」・・・ということが、確認できます。
今、還元された物質を探そうとしています。
「酸化数が減少するもの」・・・を選べばよいですね。
それでは、選択肢をみていきます。
選択肢①:(左辺)の「CO」に下線が付されています。
『酸素原子Oは(-2)』が優先されるので、炭素原子Cの酸化数は、全体を「0」にするため(+2)です。
この炭素原子Cは反応により、(右辺)の「CO₂」に含まれます。
酸化数を調べると、同じく『酸素原子Oは(-2)』が優先されるので、O₂と酸素原子は2個あるので「(-2)×2=-4」・・・炭素原子Cの酸化数は、全体を「0」にするため(+4)です。
反応の前後で、炭素原子の酸化数は「(+2)→(+4)」と増加しました。
「一酸化炭素CO」は、酸化されて「二酸化炭素CO₂」になったということです。(よくみてみれば、酸素原子が1個増えているので、あたりまえに酸化されていますね。)
この反応で一酸化炭素COは、自身が酸化されているので、還元剤としてはたらいたということです。
還元剤としてはたらいたことも、確認しておきましょう。
(左辺)の「Fe₂O₃」
・・・『酸素原子Oは(-2)』が優先で「(-2)×3=-6」
全体として電気的に「0」とならないといけず、鉄原子Feは2個あるので1個あたり(+3)の酸化数をもてば2個で+6となり、ちょうどプラスマイナスゼロになります。
Fe₂O₃の酸化数は(+3)です。
(なお、Fe₂O₃は、このように鉄原子Feが+3の酸化数をもっている(三価ともいいます)ので、「酸化鉄(Ⅲ)」と表記されます。
次に(右辺)をみてみましょう。鉄Feは、単体となっています。
単体なので、酸化数は(0)です。
反応の前後で、鉄原子の酸化数は「(+3)→(0)」と減少しました。
「酸化鉄(Ⅲ)Fe₂O₃」は、還元されて「鉄Fe」になったということです。(これもよくみてみれば、酸化物から酸素原子をとりのぞく反応が還元の基本なので、あたりまえに還元されたと言えますね。)
選択肢②:(左辺)塩化アンモニウムNH₄Cl
「水素原子Hは(+1)」が優先で、それが4個あるので「(+1)×4=+4」
・・・後は、周期表からです。
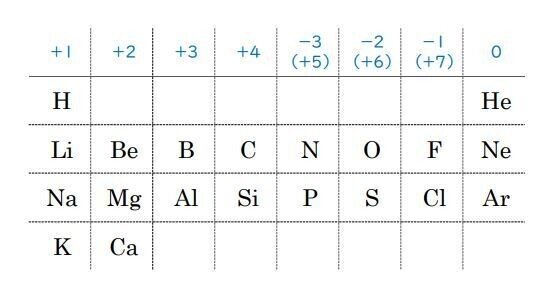
原子番号20番までの周期表で、左の列から順に+1、+2、+3、…
一番右の列は0で、その隣から順に-1、-2、-3、…・・・の酸化数をとりやすいです。
まず、表より塩素原子Clの酸化数が(-1)です。
ここまで、水素原子4個分の(+4)とあわせて(+3)です。
表の窒素原子Nの上には「-3(+5)」と入っていますが、これは状況により、-3と+5のうち、つごうがいい方を選べばよいということです。
ここでは、(-3)を選べば、ちょうどピッタリ全体の電気(酸化数の和)が0になります。
なお、選択肢②は酸化還元反応ではなく、どの原子にも酸化数の変化はみられません。周期表と照らし合わせて、両辺の各化合物の電気(酸化数の和)が0になっていることを、各自、確認しておきましょう。
選択肢③:これも酸化還元反応ではなく、酸化数の変化はみられません。
各化合物の電気(酸化数の和)が0になることは、各自確認しておきましょう。
一点、補足説明しておきます。
(左辺)と(右辺)で、「CO₃」の部分は変わっていませんよね。
これは、「炭酸イオンCO₃²⁻」は、この形のまま変化が進んでいるということです。
こういう場合は、「CO₃」を1かたまりとして酸化数を考えると便利です。
酸素原子Oの酸化数は(-2)・・・それが3つで(-6)
炭素原子Cの酸化数は周期表から(+4)
・・・あわせて、(-2)の電気(酸化数)をもちます。(だから、炭酸イオンCO₃²⁻は、2価の陰イオンです。)
化合物中の各原子の酸化数の確認も、「CO₃」を1かたまりで酸化数(-2)として確認すればよいです。
選択肢④:(左辺)臭素Br₂・・・単体なので酸化数は(0)
これが反応して(右辺)の臭化カリウムKBrに変化しています。
臭化カリウムKBrの中の臭素原子Brの酸化数は、・・・
周期表からKの酸化数が(+1)ということから(-1)と導けますが、これは覚えておいてもいいでしょう。
原子番号20番までの周期表では切れてしまていますが、周期表の右から2番目の列・・・フッ素F、塩素Cl…などのグループは、ハロゲンといい1価の陰イオンになりやすい(-1の酸化数をとりやすい)グループです。
フッ素F、塩素Clの下には、臭素Br、ヨウ素Iと続きます。(上の周期表にかき込んでおいてもいいでしょう。)
反応の前後で、臭素原子の酸化数は「(0)→(-1)」と減少しました。
「臭素Br₂」は、還元されて「臭化カリウムKBr」になったといえます。
自身が還元されたので、臭素は酸化剤としてはたらいています。
(左辺)のヨウ化カリウムKI(ヨウ素原子の酸化数は(-1))が酸化されて、(右辺)のヨウ素I₂(酸化数(0))に変化しました。
正解:④
酸化数や酸化還元反応について、もっとかためたい人はこちらの記事をどうぞ。一通り解説動画付きで説明しています。
第1問 問7 物質量の導出

どこから考えたらいいか?・・・が、わからないような問題でしたら、目標を明確にすることで、すっきりと考えが進むことがよくあります。
この問題で、最終的に求めたいのは溶質の「物質量(mol数)」です。
また、モル質量がM〔g/mol〕と与えられています。
モル質量とは「1molあたりの質量〔g〕」のことです。
よって、溶質の質量〔g〕さえわかれば、それをモル質量Mでわって、目標である物質量(mol数)が求められます。
・・・ということで、最初の目標は溶質の質量〔g〕を求めることとなります。これを求めるために、与えられた「質量パーセント濃度」や「密度」を使います。
今、溶液が100mLあります。
この中に含まれる溶質の質量〔g〕を求めていきましょう。
まず、溶液全体の質量を密度d〔g/㎤〕を使って表します。
1mL=1㎤なので、100mL=100㎤です。
密度d〔g/㎤〕というのは、1㎤あたりの質量がd〔g〕ということなので、100㎤で「100d〔g〕」です。
(以下、計算式が多いので一部画像に切り替えます。スマホでご覧の方は、サイズにご注意ください。)

正解:①
第1問 問8 燃料電池の放電反応
まず、全体の反応を確認するために、(正極)の反応と(負極)の反応を1つの式にまとめましょう。
1つの式にまとめるときには、電子(e⁻)の数を合わせるようにします。
(正極)の反応式には4つ、(負極)の反応式には2つの電子(e⁻)が含まれているので、(負極)の反応式の方を両辺2倍してから、(正極)の反応式と辺々たします。
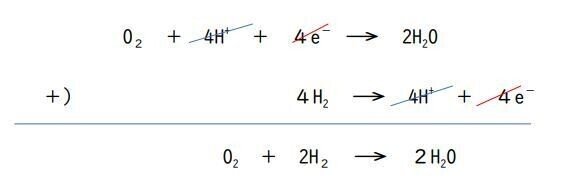
両辺に同じものがあると、それぞれ消せます。
「4e⁻」と「4H⁺」が消せて、「2H₂+O₂→2H₂O」という、基本的な水素H₂の燃焼を表す反応式ができました。
「4e⁻」は消しましたが、これが重要な情報です。
電子(e⁻)4molが流れると、この「2H₂+O₂→2H₂O」という反応が起こるということです。
化学反応式の係数は、反応する、あるいは反応で生じた各物質の物質量に比例しますので、電子(e⁻)4molが流れると、水が2mol生成され、水素が2mol消費されるということです。
この問題では、電子(e⁻)4molの半分の2molが流れるときを考えているので、生成される水や消費される水素もそれぞれ半分で、水が1mol生成され、水素が1mol消費されるということです。
冒頭に与えられた原子量より、水H₂Oの分子量は18、水素H₂の分子量は2です。水1molの質量は18gですし、水素1molの質量は2gで、これが答えになります。
正解:⑤
以上です。ありがとうございました。
コメントなどいただけると、とてもうれしいです。
「こういう教材があったらいいな」のようなご意見でも、助かります。
執筆:井出進学塾(富士宮教材開発) 代表 井出真歩
2021年度、共通テスト「化学」の解説は、こちらのページにまとめております。
井出進学塾のホームページはこちらです。
無料体験授業、受付中!
富士宮教材開発のホームページはこちらです。
各種教材を、準備しております。
この記事が気に入ったらサポートをしてみませんか?
