
分光器で計測したスペクトル
花火が赤や緑に光るのは、炎色反応です。
赤色を出すにはストロンチウム化合物が入っているためです。また、バリウム化合物を入れると緑色に光ります。
炎色反応はなぜ起こるのでしょう?難しい話ですが説明します。
まず光とは何か?
「光は粒子でもあり波でもある。粒子と波の両方の性質を併せ持つ、量子というものである」と言われています。
波という以上、波長という特徴的な数字を持っています。人間が見ることができる光を可視光といいます。可視光の波長はだいたい400nmから800nmです。nmは長さの単位でナノメートルといい、1mの10億分の1という短さです。
虹の七色は赤橙黄緑青藍紫(せきとうおうりょくせいらんし)といわれますが、これが可視光の領域となります。虹は太陽光が水滴により分光された結果であり、波長により屈折率が変わるため赤から紫まで並んで見えるのです。赤色の光より波長が長い光を赤外光といい、紫よりも短い光を赤外光といいます。光とは赤外光、紫外光および可視光からなります。

では、炎色はなぜ、起こるのでしょうか?
ナトリウムは黄色、ストロンチウムは紅色に光ります。これはそういう波長の光を発しているためであり、この現象を化学発光(ケミルミネセンス)といいます。
以下に花火の化学発光の原理を示します。
燃えている花火の炎の中では高温のため、原子あるいは分子の中の電子が励起されます。すなわち、普段、電子が回っている通り道(基底状態)から、上の通り道(電子励起状態)に軌道を変えます。
励起された電子はいつまでも励起状態にいるわけではなく、すぐに基底状態に戻ります。その時に軌道間のエネルギー差(E2-E1)に相当する光を出します。図1のようにエネルギー差(励起エネルギー)が1.55eV(エレクトロンボルト、エネルギーの単位)より小さければ赤外光となり、目に見えない光となります。逆に3.1eVより大きい場合、紫外光となります。その間の1.55~3.1eVに励起された電子は人の目で認識できる可視光を発します。

花火からどのような光が出ているのでしょう?
分光器という装置を使うと容易に調べることができます。波長を横軸にして、どんな色の光が出ているかを示したグラフをスペクトルといいます。ここでは、弊社で販売している「花火の原理がわかる手持ち花火Ⅰ色火剤」を実際に分光器で測った例を紹介します。
分光器とは、光を分ける装置であり、中に回折格子と光センサが入っています。
図3では光ファイバーで光を分光器に取り入れ、分光した信号をUSBでノートPCに取り入れる様子がわかります。
使った分光器は(株)日本レーザーが取り扱っているファイバー・マルチチャンネル分光器BIM-6002です。

No.1 基本 および No.3 橙
「No.1 基本」と書かれた手持ち花火は炎色を発する色火剤を入れていません。しかし、発光スペクトルは氷晶石を加えた「No.3 橙」と同様のピークが見られます。
一つはNa原子のものであり、もう一つはK原子のものです。
Naは自然界に必ず微量存在し、除去することは困難です。なので、この後に紹介するすべてのスペクトルに必ず見られます。
K分は酸化剤として過塩素酸カリウム(KClO4)を使っているので、大きなピークとなります。
Na原子もK原子もアルカリ金属です。


「周期表からわかる花火の原理」のところで説明しましたが、アルカリ金属は原子が発光します。なので、アルカリ土類金属と違い、電子励起だけの自由度しかありません。
アルカリ金属のスペクトルは輝線スペクトルと呼ばれます。
図6に書いているように熱せられるとNa原子の電子は3s軌道から3p軌道に通り道が変わります。3p軌道から3s軌道に戻るときに橙色の光を発します。この光の波長は量子化されているので変わることはありません。だから、発光スペクトルを調べることで発光種を知ることができるのです。
なお、1本だと思われるNa原子の橙色の光は、より分解能が高い分光器で調べると2本(589.0nmと589.6nm)であることがわかっています。
この事実を理解するために電子はスピン(回転)しており、向きが違う2つの状態があると考えるようになりました。実際には電子が回転しているところを見た人はいません。しかし、そう考えるとこれまでの事実と矛盾しないのです。量子科学の多くはこのような論理展開で成り立っています。

No.2 赤
ストロンチウムを含む花火は原子ではなく、塩素1つと結合したSrCl分子ラジカルが光ります。また、SrOHという分子ラジカルも光ります。これは最外殻の電子配置に電子が一つ入った状態となり、電子が励起されやすいからです。
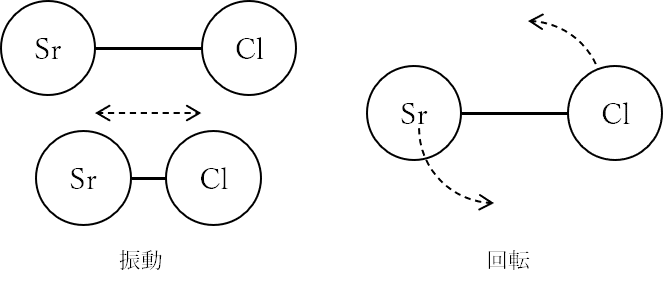
原子の場合の電子励起と異なり、分子が光る場合、運動の自由度として振動、回転することができるため、これに対応したスペクトルとなります。それは図7でわかるようにいろいろな光が出ることがわかります。ナトリウムの例と比べて幅のある光です。これは電子励起に加えて振動励起も起こるからです。このような分子の発光スペクトルを帯(バンド)スペクトルといいます。

図中の記号について説明します。Xという状態は基底状態、つまり、もっとも安定な状態です。エネルギー順位が一つ上の状態をAと書きます。それ以降はアルファベット順に記載されます。
SrCl分子ラジカルの場合、A状態の電子励起とB状態への電子励起の2つによる光が見えます。各電子励起状態で分子は振動と回転ができるので、それによるスペクトルのピークが見られます。↓は振動によるピーク位置を示します。
同じ電子励起でも違う波長の光がでます。その1本を高分解能の分光器で調べると回転構造を見ることができます。回転によるエネルギー順位差はわずかです。回転構造を調べることでSr-Clの結合距離も見積もることができます。

No.4 緑
バリウムを含む花火も原子ではなく、塩素1つと結合したBaCl分子ラジカルが光ります。また、BaOHという分子ラジカルも光ります。
特徴的なのは緑に光る電子励起は3番目にエネルギーが高い状態(C)です。1番目(A)と2番目(B)の電子励起からも光を発しているのですが、可視光ではなく赤外光なので人の目には認識できません。

No.5 青
銅を含む花火も原子ではなく、塩素1つと結合したCuCl分子ラジカルが光ります。また、CuOHという分子ラジカルも光ります。
CuClのスペクトルは少なくとも5番目にエネルギーが高い(E)状態までが確認できます。これはCuが遷移金属であるため軌道の種類が多く、CuClのエネルギー順位がAからEまで近い位置にあることを意味します。これでは緑に近い色から紫に近い光まで出てしまいます。
特定のエネルギー順位だけ電子励起させることはできません。花火師の方は昔から「きれいな青は出しにくい」と経験的に感じていましたが、これは化学的に説明できるのです。

No.6 紫 および No.7 ピンク
ナトリウム(橙)、バリウム(緑)、銅(青)、ストロンチウム(赤)以外の色は、この4色の合色で作ります。No.6の紫はSr化合物とCu化合物を両方、入れたものです。また、No.7のピンクはSr化合物と少量のCu化合物を両方、入れたものです。Sr化合物とCu化合物の量を変えることで、中間色の調整をすることができます。


関連図書
元素や分子がどんな光を発するかはほぼ解明されています。
その集大成の一つとして、元素については「Flame Spectroscopy(炎スペクトル)」に、分子の発光スペクトルについては「The Identification of Molecular Spectra」にまとめられています。
残念ながら、今後、新しい発光種が見つかる可能性はなく、花火として新しい炎色が開発されることもありません。
グリーン・パイロラント社長 工学博士
松永猛裕
この記事が気に入ったらサポートをしてみませんか?
