
バイオプロセス論文解読シリーズ001-01
皆さま、こんばんは。現代の医薬品市場の主役は抗体医薬になっています。特に抗がん剤や自己免疫疾患に有効な抗体医薬品が多く開発されています。いつか市場についてもnoteにまとめてみたいと思っていますが、今日は製造にフォーカスを当ててみたいと思います。
抗体医薬品を製造するには、細胞を培養する必要があります。特にCHO細胞と呼ばれるハムスター由来の細胞が使われています。この細胞を培養する方法もいくつかあるのですが、現在の主流はFed Batch培養と呼ばれるものです。これはCHO細胞をバイオリアクターに培地と一緒に入れて37度付近で酸素を供給しつつ撹拌しながら培養するのですが、CHO細胞が培地中の栄養素を時間とともに吸収するので、そのまま放っておくと栄養素が足りなくなって抗体を十分に産生する前に細胞が死滅してしまいます。そうならないように、途中でFeed培地と呼ばれる濃いめの培地を添加していき、2週間ほどCHO細胞を生き延びさせて、その間に産生される抗体を回収するという方法です。この方法はほぼ完成された方法ですが、弱点としては非常に大きなバイオリアクターが必要になるという点です。例えば、2,000リットルの培地にFeed培地を毎日10リットルずつ加えていく、というようなイメージです。1万リットルくらいの大きなバイオリアクターが用いられることもあります。
もっとコンパクトなバイオリアクターで培養する方法として連続培養と呼ばれる方法があります。Perfuion培養とも呼ばれます。この方法では常に連続的に古い培地を取り除き、代わりに新しい培地を供給するという方法です。細胞はフィルターを使ってトラップして、再びバイオリアクターに戻して再び抗体を産生してもらいます。一方で取り除かれた培養液中に含まれた抗体は回収されます。この方法では、培地を絶えず循環させるので、培地の消費量は多くなりますが、バイオリタクターの大きさはコンパクトですみます。例えば500Lとかのイメージです。このPerfusion培養を抗体医薬品の製造に利用しようという動きが今日は活発になっています。
このPerfusion培養でCHO細胞を培養し、いかに効率的に抗体を産生させるかというのは現代の課題です。今日、紹介する論文はまさにこのことをテーマとした論文です。
論文のタイトルは
Biomass specific perfusion rate as a control lever for the continuous manufacturing of biosimilar monoclonal antibodies from CHO cell cultures
出典は Biotechnol. J. 2024;19:2400092
リンクは https://doi.org/10.1002/biot.202400092
です。
論文は画像として掲載しておきます。
それでは、解読していきます。
まず、タイトルですが、ぎこちない訳ですが以下となります。
「CHO細胞培養からのモノクローナル抗体(バイオシミラー)の連続製造における制御手段としてのバイオマス特異的Perfusion Rate」
モノクローナル抗体というのは抗体医薬品を科学的・物質的に表現した単語です。
バイオシミラーはジェネリックの抗体医薬品版のような意味合いです。
この研究でバイオシミラーを使う理由やタイトルにバイオシミラーを含める理由については、後ほど触れることができるかも知れません。
ただ、今の段階で、このタイトルから読み取るべき情報は、「Perfusion培養でCHO細胞を培養して抗体医薬品を産生する。その時の制御パラメーターとして、バイオマス特異的Perfusion Rateがタイトルの中で強調されている」、ということです。
ここでPerfusion Rateとは何か?ですが、Perfusion培養では連続的に古い培養液を除いて新しい培地を供給すると先ほど述べました。この時、取り除く培養液の速度と供給する培地の速度は同じなので、バイオリアクター中の培養液の体積は一定になりますが、この培養液を取り除いたり、培地を供給する速度を定量的に表す量がPerfusion Rateです。
この論文の本文にも出てきますが、Perfusion Rateを定量的に表す方法は主に3通りあります。一つ目がVessel Volume per Day (VVD)です。1日にバイオリアクターの体積の何倍の培養液を循環させるのかでPerfusion Rateを表します。二つ目がCell Specific Perfusion Rate(CSPR)です。これは生きている細胞(生細胞)一つあたりに1日に供給される培地量で表されます。単位はnL/cell/dayとなります。そして三つ目がこの論文の主役になるBiomass Specific Perfusion Rate (BSPR)です。この方法では、生細胞の大きさも勘案した単位
バイオマス(生細胞数✖️細胞の大きさ)あたりに供給される培地量でPerfusion Rateが表されます。単位はmL/cm3/dayになります。
次にタイトルの次に重要なAbstractを読んでいきます。
Continuous manufacturing enables high volumetric productivities of biologics such as monoclonal antibodies. However, it is challenging to maintain both high viable cell densities and productivities at the same time for long culture durations. One of the key controls in a perfusion process is the perfusion rate which determines the nutrient availability and potentially controls the cell metabolism. Cell Specific Perfusion Rate (CSPR) is a feed rate proportional to the viable cell density while Biomass Specific Perfusion Rate (BSPR) is a feed rate proportional to the biomass (cell volume multiply by cell density). In this study, perfusion cultures were run at three BSPRs in the production phase. Low BSPR favored a growth arresting state that led to gradual increase in cell volume, which in turn led to an increase in net perfusion rate proportional to the increase in cell volume. Consequently, at low BSPR, while the cell viability and cell density decreased, high specific productivity of 55 pg per cell per day was achieved. In contrast, the specific productivity was lower in bioreactors operating at a high BSPR. The ability to modulate the cell metabolism by using BSPR was confirmed when the specific productivity increased after lowering the BSPR in one of the bioreactors that was initially operating at a high BSPR. This study demonstrated that BSPR significantly influenced cell growth, metabolism, and productivity in cultures with variable cell volumes.
連続製造により、モノクローナル抗体などの生物製剤の単位培養体積あたりの高生産が可能になります。しかし、高い生細胞密度と生産性の両方を長い培養期間で両立させることは困難です。Perfusionプロセスにおける重要な制御の 1 つはPerfusion Rateです。Perfusion Rateは栄養素の供給を決定し、細胞代謝を制御します。Cell Specific Perfusion Rate (CSPR) は生細胞密度に比例する供給速度であり、Biomass Specific Perfuion Rate (BSPR) はバイオマス (細胞体積 × 細胞密度) に比例する供給速度です。この研究では、生産段階で 3 つの BSPR でPerfusion培養を実行しました。BSPR が低いと細胞増殖が停止状態になり、細胞体積が徐々に増加し、その結果、細胞体積の増加に比例して実質的なPerfusion Rateが増加しました。その結果、BSPR が低い場合、細胞生存率と細胞密度は低下しましたが、1 日あたり 55 pg という高い比生産性が達成されました。対照的に、高い BSPR で稼働しているバイオリアクターでは、比生産性は低かった。BSPR を使用して細胞代謝を調節する能力は、最初は高い BSPR で稼働していたバイオリアクターの 1 つで BSPR を下げた後に比生産性が増加したことにより確認された。この研究では、BSPR が細胞体積が変化する培養において細胞の増殖、代謝、生産性に大きく影響することが実証された。
このAbstractでの肝は、低いBSPRで培養すると、細胞の増殖が止まる代わりに細胞は大きくなって、そして抗体をたくさん産生するといくこと。そして、BSPRという尺度でPerfusion Rateを変えて培養すると、細胞の増殖、代謝、生産性の違いが明確に見えてくる、ということだと思います。
次にConclusionを読んでみます。
Perfusion rates can be controlled by different parameters: BSPR, CSPR, and VVD. This study explored the effect of BSPR on a high cell density perfusion culture in mini bioreactors running in parallel. At high BSPR, cells experienced an abundance of nutrients that led to higher production of lactate and lower productivity. In contrast, at low BSPR, growth arrest was achieved and led to increasing cell diameters and higher productivity. In contrast to CSPR and VVD, BSPR considers the increase in cell volume that was observed during the production phase of the culture. Therefore, an advantage of BSPR is that the nutrient availability could be modulated based on the amount of living biomass within the bioreactor. As cells progressively became bigger in size, the volume of media perfusing the bioreactor increased proportionally to the increase in cell volume. An intermediate level of BSPR maintained high cell viability (>85%) and high productivity (31 pg cell−1 per day). This study demonstrates the benefit of using BSPR to deliver sufficient nutrients that sustain cell viability and cell productivity.
Perfusion Rateは、BSPR、CSPR、および VVD という異なるパラメータによって制御できます。この研究では、並行して稼働しているミニバイオリアクターでの高細胞密度Perfusion培養に対する BSPR の効果を調査しました。BSPR が高い場合、細胞は栄養素が豊富になり、乳酸の生成が増加し、生産性が低下しました。対照的に、BSPR が低い場合、細胞の増殖が停止し、細胞径が増加し、生産性が高まりました。CSPR および VVD とは対照的に、BSPR は培養の生産段階で観察された細胞体積の増加を考慮します。したがって、BSPR の利点は、バイオリアクター内の生体バイオマスの量に基づいて栄養素の供給を調整できることです。細胞のサイズが次第に大きくなるにつれて、バイオリアクターを灌流する培地の量は、細胞体積に比例して増加しました。中程度の BSPR では、高い細胞生存率 (> 85%) と高い生産性 (31 pg cell−1 / 日) が維持されました。この研究は、BSPRを使用すると細胞生存率と細胞生産性を両立するのに十分な栄養素を供給できるという利点を示しています。
さてさて、このConclusionに出てくる重要なセンテンスは「BSPR が低い場合、細胞の増殖が停止し、細胞径が増加し、生産性が高まりました。」だと思います。これを裏付けるデータが得られているのでしょうか?
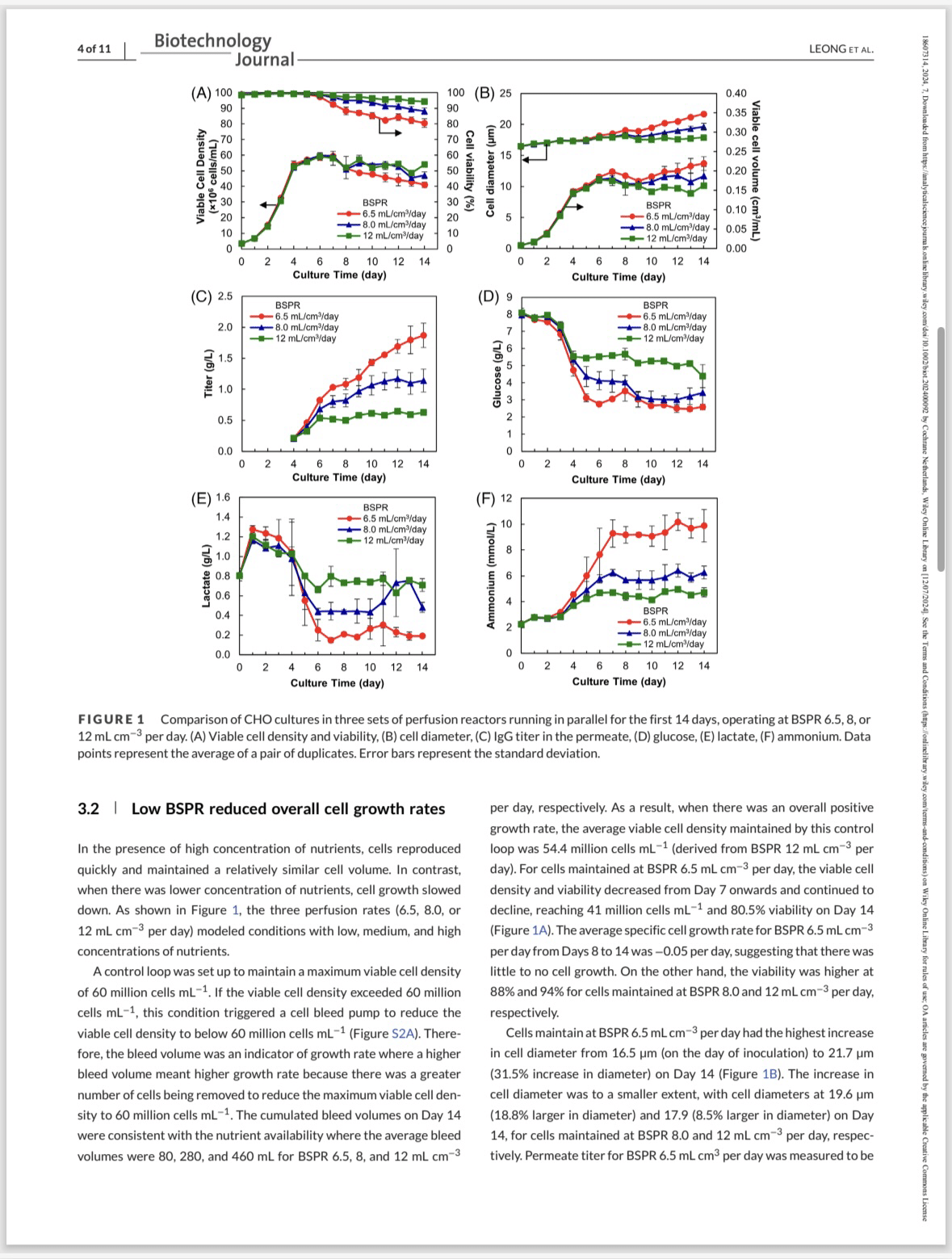
Figure1のBを見ると、BSPRが低い(6.5)の場合、Day5あるいは6あたりから細胞の大きさが増大していることが分かります。またFigure1のCを見ると、BSPRが低い(6.5)と、TiterがDay 5あたりから増大しているのが分かります。ここでResultの3.1を見ると、細胞数が50 x 10^6 cells/mLに到達したとき、培養温度を37℃から34℃にして、これが抗体を産生するPhaseであり、日数としてはDay4と書かれています。このタイミングは細胞が大きくなり始め、Titerが増大し始めるタイミングとも一致して、データも問題ないと思われます。
ちなみに細胞が大きくなるとなぜ、抗体の産生が高まるのかですが、Disucussionの4.2を読むと、論文が引用されており、転写や翻訳、そして抗体の細胞外への分泌が高まることと細胞が大きくなることが関連しているようです。
以上で、この論文の解読は終わりにしたいと思います。
もし、感想などありましたらコメントを頂けますと嬉しいです。









この記事が気に入ったらサポートをしてみませんか?
