低血糖
低血糖とは、血糖値が70mg/dL以下で、自律神経症状と中枢神経症状 neuroglycopenic symptomが合併した状態を指します。
代表的な特徴として、「Whippleの3徴」があり
意識が悪くて、血糖が低く、糖を入れると改善する
(大元はインスリノーマの特徴として言われています)
自律神経症状と中枢神経症状とは具体的には以下のように書かれています。
症状は、人によって様々で、血糖値によっても様々です。治療するかどうかを決める際には、症状と血糖値に注意することが重要です

<中枢神経症状> 混乱、脱力、眠気、呂律障害、協調運動障害、奇妙な行動
最終的にけいれん、昏睡、死に至る症状であるため、低血糖状態が長く続くと、低酸素血症や虚血エピソードの後に見られるような脳損傷を引き起こす可能性があります。
意識障害の鑑別 AIUEOTIPSの中でも、「一過性」があるものとすると
鑑別は絞られて、低血糖、てんかん、精神障害(解離性障害など)くらいになるかと思います
ただ低血糖の症状として「けいれん」があるので、注意が必要です
<原因・リスクファクター>
まずは既往に糖尿病があり、治療をしているのかになると思います。
糖尿病患者で、低血糖を引き起こすリスクファクター
高齢者・慢性腎臓病・慢性心不全・心血管疾患・社会経済的地位が低い・高いA1c・ベータブロッカーの使用・インスリンまたは分泌促進薬の使用・黒人またはヒスパニック系

非糖尿病患者も低血糖を起こすリスクがあり、
最も一般的な原因は、敗血症、肝不全、腎不全、悪性腫瘍、副腎不全や甲状腺機能低下症などの内分泌障害です。

文献より
・アルコールは糖新生を阻害する一方で、グリコーゲン分解は継続させるため、アルコール関連低血糖は通常、肝グリコーゲン貯蔵量が枯渇した状態での食事摂取制限を伴う暴飲暴食の後に起こる。
・栄養不良などの飢餓状態や神経性食欲不振症などの精神疾患も肝グリコーゲン貯蔵量を枯渇させるため、血糖値を補うための食物摂取が制限され、低血糖が起こりうる。
・神経内分泌腫瘍であるインスリノーマも、再発性低血糖症の原因となりうるが、その発生率は低く、年間100万人当たり4例未満である。
・β-ヒドロキシ酪酸値が高値であれば、ケトン体産生はインスリンによって抑制されるため、患者の低血糖の病因はインスリン関連ではない可能性が高い。高値の場合は飢餓、アルコール性ケトアシドーシス、敗血症などの病因を考慮する。
ほか
胃切除後であれば、ダンピング症候群(食後低血糖も参考)
原因不明の高アンモニア血症もあれば、カルニシン欠乏症も鑑別
稀に、NICTH(IGF-II産成腫瘍)による低血糖も、腫瘍性病変のある患者では鑑別に上がります。
薬剤については、インスリンや経口血糖降下薬以外にも
キノロン系、抗不整脈薬(シベンゾリン)、NSAIDsが有名です

J Clin Endocrinol Metab. 2009 Mar;94(3):741-5.
PMID: 19088166.
わかりやすくは
①血糖を下げる薬剤を使用しているかどうか
②敗血症の可能性があるか
③副腎不全と甲状腺機能低下症の評価(治療可能なものなので)
④基礎疾患(がん患者、肝疾患、腎疾患、胃切除後)との関連はどうか
⑤それ以外
になるのかなと思います。
意識障害・意識変容で、ER外来を受診した際に、神経所見と頭部画像をオーダーし待っている間に
採血をし、採取した直後に、数滴をデキスターなど迅速血糖測定器で、血糖を測ることがコツです。
すでに救急隊が血糖値を測って、糖補正をして下さっているかもしれません。
インスリンユーザーの患者さんが、低血糖で来院された際
病歴からほぼほぼインスリンのせいだと思いましたが、入院後血液培養でGNRが検出されたケースもあります。
血液培養は、採血ついでに取ってもよいでしょうが、全例となると大変ですね...
元々の全身状態や意識レベルがわかっていない状況で、個人的には血糖が正常に戻っていても、なんかぼーっとしているような方には取っておくべきだと思います。
<治療>
ブドウ糖の補給と、原因の検索除去になると思います。
ただ文献的には
・経口摂取可能ならば、食物;特に炭水化物・脂肪・タンパク質を複合的に提供すべき。バランスのとれたスナックを提供することで、患者が再び低血糖に陥った場合に、糖新生によって貯蔵している糖分を自分で補給できるようにするための補助的な材料となる。食後に分泌されるインクレチンにより、経口炭水化物ではインスリン反応が亢進し、グルコースに対するβ細胞の感受性が高まるため、一般的に使用されるオレンジジュースなどは最後の手段として使用すべきである。
とあります。
経口摂取できない患者では、ブドウ糖の非経口投与が第1選択療法です。
ブドウ糖の濃度は5%から50%まで様々であるが、症候性の低血糖であれば、ブドウ糖50%(D50)がゴールドスタンダードです。
しかし、D50は比較的短時間で高いグルコース負荷を与えるため、糖新生および糖新生分解を抑制し、インスリン分泌をより大量に刺激するため、リバウンド性低血糖を引き起こす可能性があります。さらに、D50は2500mOsm/Lと高浸透圧であるため、点滴漏れを起こすと皮膚刺激、血栓性静脈炎、組織損傷、硬化を引き起こす可能性があります。D50を2~5分かけて投与すれば、この危険性の一部を軽減することができます。
ブドウ糖投与後、患者の血糖値は遅くとも1時間後、あるいは症状が残っていたり、症状が再発した場合はもっと早くチェックすべきです。血糖値が低ければ、1~2時間おきに血糖チェックを行います。
2回目のブドウ糖投与が必要な場合は、ブドウ糖5%または10%を維持速度で点滴することを考慮します。

D50投与後の血糖値は150~250mg/dLである。
逆に、ブドウ糖10%(D10)ボーラス投与後の平均血糖値は98mg/dLであり、これはグルコースの変動が少ないことを示している。D10はまた、全体的にグルコース負荷が低いため、反跳性低血糖の発生が少ない。D10は浸透圧が500mOSm/Lであるため、滲出しても重篤な組織損傷を引き起こす可能性は低い。
しかし、D50の50mLはD10の250mLに相当するため体積が大きく、体積過剰のリスクがある患者には注意が必要である。
スルホニル尿素SU薬の過剰摂取の場合、オクトレオチドを追加することも選択肢である。
スルホニル尿素は、膵臓のインスリン分泌を刺激するインスリン分泌促進薬で、オクトレオチドは、膵臓のインスリン分泌をブロックするソマトスタチン類似体です。
グルカゴンの使用は、経口摂取ができない低血糖患者への選択肢である。効果が現れるまでに約10~15 分かかるが、これは急性低血糖患者にとって非常に重要な時間である。嘔吐を促すことが多く、患者がすでに低血糖で意識が朦朧としている場合には、さらに気道が損なわれる可能性が高くなる。グルカゴンは肝臓のグリコーゲン貯蔵に依存しているため、栄養失調、肝硬変、または長期にわたる低血糖の患者には効果がない可能性がある。
Approach to the Hypoglycemic Patient
Emerg Med Clin North Am. 2023 Nov;41(4):729-741.
PMID: 37758420.
糖尿病救急は救急外来で頻繁に起こる。多くの場合、糖尿病患者を評価する際に高血糖緊急事態である糖尿病性ケトアシドーシスと高血糖高浸透圧状態を考慮するが、
しばしば見落とされ、不適切に管理される可能性のあるもう一つの緊急事態は「低血糖」である。
糖尿病患者、特にインスリンまたはインスリン分泌促進薬を使用している患者は、低血糖を起こすリスクが高い。しかし、非糖尿病患者もまた、感染症、薬物、または疾患の進行により危険にさらされる。低血糖症は、非糖尿病患者においては認識が不十分であり、その管理はさらに不十分である。
残念なことに、無数の臨床症状があり、診断が困難である。さらに、低血糖症は他の診断と併発する可能性があり、低血糖症よりも他の診断の管理が優先されることがある。低血糖を未治療のままにしておくと、永続的な神経障害や死亡を含む壊滅的な転帰をたどる可能性がある。したがって、有害な転帰を避けるためには、低血糖を早期に発見し、適切に管理することが責務である。
疫学
2018年、CDCは糖尿病患者の低血糖症による242,000件の救急部(ED)受診を報告した。そのうち70.1%が治療を受けて退院したのに対し、23.1%が入院した。3,300万人のメディケア患者を対象とした別の研究では、糖尿病患者では高血糖症よりも低血糖症の方が入院に至るケースが多いことが判明している。
ある研究によると、2008年の低血糖症によるED受診の平均費用は1387ドル、インフレ調整後で約1958ドルであった。別の研究では、米国における低血糖症の年間総費用は2009年に18.4億ドル(インフレ調整後)、2022年には25.3億ドルになると推定されている。これらの数字には、欠勤の増加、労働生産性の低下、罹患率の増加、早期死亡など、低血糖症が患者に及ぼす幅広い経済的影響は考慮されていない。
救急部における低血糖の認識と管理は比較的容易であるにもかかわらず、誤管理率は驚くほど高い。ある研究によると、血糖値が50mg/dL未満で救急部を受診した患者の場合、何らかのブドウ糖負荷の投与に平均12分かかり、12%の患者は低血糖症の治療を受けなかった。さらに、その後のポイントオブケアでのブドウ糖の再測定は、頻度が高くなるにつれて時間がかかり、低血糖症が認められた場合に介入するまでの時間も長くなった。
死亡率は4%から10%と報告されている。ある研究では、入院した高血糖患者を評価し、重症の高血糖患者では、定期的にインスリンを投与しているか否かにかかわらず、全死因死亡率が高いことを明らかにした。
最後に、インスリノーマを診断したときのアプローチですが、
低血糖で入院した患者さんは、
入院後、早朝甲状腺機能異常なし・早朝副腎機能異常なし、迅速ACTH負荷試験でも異常なしでした。
10%ブドウ糖を持続投与していても、朝には低血糖を起こしました。
しかし低血糖を起こしている時も、インスリンとC-ペプチドは高値を認めていたため、インスリンが出続ける病態を考えました。
Uptodate
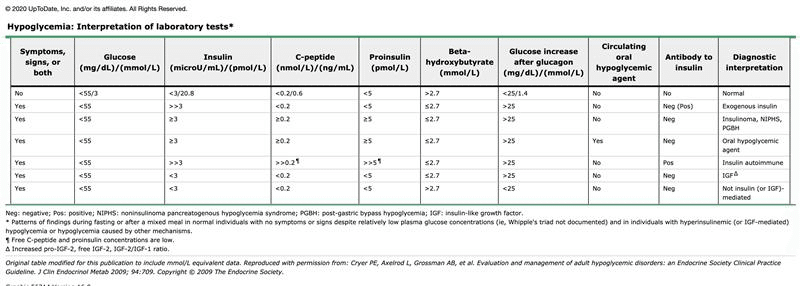
インスリン値が有意に上昇する(3μL/mL以上)C-ペプチドは内因性産生の患者では上昇し(0.2 nM以上)、インスリノーマを示唆する。
追加検査でのインスリン抗体は陰性で、インスリン自己免疫症候群は否定的でしたということでやはり、インスリノーマが疑われました。
膵臓の造影MRIにて膵頭部に腫瘍が見つかり、かつ専門病院にて、選択的動脈カルシウム負荷試験を施行したところ、同部位でインスリンの上昇がみられたことからインスリノーマの診断になりました。

この記事が気に入ったらサポートをしてみませんか?
