
コロナ mRNAワクチンの製造法@全文無料
ここから、始まります
第1. 今回説明したいこと
コロナmRNAワクチンで下のような事態が起きています。

医学部はどうしても製薬の製造過程まで吟味しない傾向がありますが、今回のコロナmRNAワクチンで実際に、無視できない人数の”ワクチン接種後死亡”の事例があります。
はじめの年の被害が激甚でした。厚生労働省に報告された事例で死亡が100万人に6人を超えたロットがあります。
*ワクチン接種後死亡の記録集の記事はこちら
現在もまだ、1年以上も症状が日々増悪し苦しんでいる人たちがいます。公的な支援につながるのも難しく特別なケアもされずに放置されているので、全く関係ない一般の人が副作用で苦しむ人に寄り添い励まし続けています。早く救ってあげたい。

但し書き
この記事は工場が当局の基準を守って完璧に動作していることに疑問を呈していません。工場がいいかげんなことをしていると主張しているわけではありません。日本には古くから稼働しているファイザー社の工場もあります。この記事はいかなる会社の営業妨害も目的としていません。
この記事は収集した情報からワクチンの製造工程を考える試みです。
工場はまじめに生産し、製品であるmRNAワクチンも検品 (QCチェック) され仕様書通りの数値で合格となっている、この点を疑っているわけではありません。
第1-1. 2023年2月、ワクチン製造プロセスへの疑惑が提示された
2023年2月、ミレニアムまでアメリカのゲノムプロジェクトを牽引し、次世代シークエンサー (NGS) を開発したケビン・マッカーナン氏は入手したファイザーとモデルナのコロナワクチンの主成分であるmodRNAの塩基配列を確認しようとした。
NGSの結果は予想と異なりベクターDNAの塩基配列が読めてしまった。マッカーナン氏は聞いていた説明と違ったのでとても動揺した。いったい彼はmRNAワクチンをどのようなものと思っていたのだろうか?
読者の皆様はコロナmRNAワクチンが承認される前後の2020年に、ワクチン製造工程を説明した報道や総説を覚えていますか?オンエアされたmRNAワクチン製造工場はクリーンで完璧、複数の論文で説明される製造過程も分子生物学のモデル図を用いて詳細でクリアでした。
第1-2. 承認前の治験成績の発表
重要なファイザー/BioNTech BNT162b2 (Comirnaty) 臨床試験のプロトコルに対する 2020 年 10 月の修正 (C4591001) では、試験で使用されたほぼすべてのワクチン用量が、いわゆる「プロセス 1」を使用して製造された「臨床バッチ」から得られたことが示されています←この文章はこちらの論文 (和訳ブログ) に記載されています
上記の論文が根拠として引用している書類(英語です。コピー等できません。リンク)↓ 該当すると思われる日本語資料は下です (リンク)↓
そして2020年12月に、緊急承認のために当局へ提出された治験の成績の『有効性95%』がNew Engl J Med に論文として掲載されました。
論文リンク 和訳リンク

https://www.nejm.org/doi/full/10.1056/NEJMoa2034577
これは合計43,548人の参加者を無作為化した治験で、被験者にはProcess 1 (工程1) で生成したmRNAワクチンを投与して実施されました。
しかし、私たちのコロナワクチン接種に用いられているのはProcess 2 (工程2) で製造された市販用ワクチンです。2020年4月付けファイザー社のプロトコルC4591001にある治験の内容には、Process 2 (工程2) で製造された市販用ワクチンに関しては250人の参加者で治験を行う (will be administered) と記載されています
* 2020年4月付けファイザー社のプロトコルC4591001 はNew Engl J Med の org にリンクがあります。
https://www.nejm.org/doi/suppl/10.1056/NEJMoa2034577/suppl_file/nejmoa2034577_protocol.pdf

治験は工程1の製品で実施され、工程2の市販用ワクチンは250人で治験をする予定であるとプロトコルC4591001 の54ページに記載してあります。

スクショの訳
BNT162b2 の製造規模を拡大し、将来の供給をサポートします。増産に対応した製造工程(以下、「工程2」)で製造されたBNT162b2は、本試験において16~55歳の被験者約250名(1ロットあたり)に投与される予定です。既存の製造工程「工程1」を用いて作製された材料で接種された16~55歳の個人、および増産をサポートする製造工程「工程2」を用いて作製されたロットの材料で接種された16~55歳の個人における予防的BNT162b2の安全性および免疫原性について説明する。

新型コロナウイルス感染症に対するmRNAワクチンも、医薬品行政の基準値 (cGMP基準) に従っています。
GMP基準のリンク
FDA: Current Good Manufacturing Practice (CGMP) Regulations
WHO good manufacturing practices for biological products, Annex 2, TRS No 999
GOOD MANUFACTURING PRACTICE GUIDE FOR ACTIVE PHARMACEUTICAL INGREDIENTS Q7
第1-3-1. 医薬品医療機器等法 昭和35年法律第145号第14条の3第1項の規定に基づく審議結果 令和3年2月12日 対象:[販 売 名] コミナティ筋注 ファイザー
令和3年2月12日の医薬品第二部会における審議結果です。結果として、条件付きで特例承認可となりました。



第1-3-2. 医薬品医療機器等法 昭和35年法律第145号第14条の3第1項の規定による特例承認の可否につ いて審議結果 令和3年5月20日 対象:[販売名] COVID-19 ワクチンモデルナ筋注



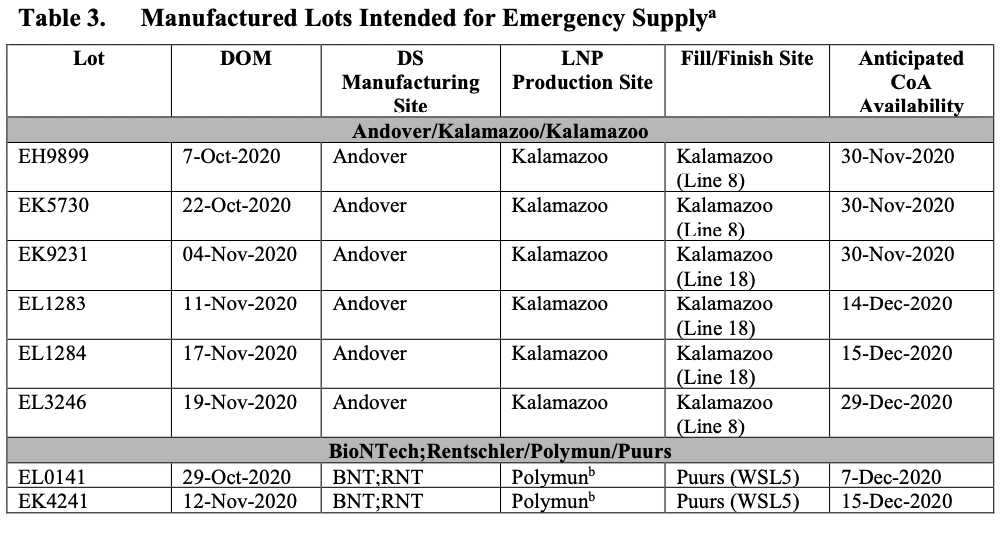
第1-4. 米国市場向けの緊急供給品を生産するための施設と製造ノードの特定 [マニア向け]
修正第 119 号 (2020 年 10 月 21 日に提出) で提供された表の簡略版を表 1 に示します。これには、米国市場向けの緊急供給品を生産するための施設と製造ノードが含まれています。リンク

第1-5. EUA の時点でレビューのために提出される GMP 商用スケール DP ロット [マニア向け]
6 つのロットが IND に提供された。

製造されたが緊急使用のために IND への提出が保留されているロットを表 3 に示します。


第1-6. COVID-19 mRNAワクチンによる被害 [一般_大切]
COVID-19 mRNAワクチンを接種後にどうも死亡する人数が多いようだという現象は医療従事者への先行接種で既にあらわれていました。厚生労働省は、2021年6月9日にコロナワクチンを先行接種した医療従事者のうち196人が死亡したと公表しました。痛ましいことに20代の医療従事者が何人も死亡しました。
その後、一般の方へワクチン接種が普及していくにつれ、いわゆるワクチン接種後の変死を実社会で目にするようになりました。例えば東京都監察医は2021年4月1日から2021年12月31日までに死亡前7日以内にCOVID-19ワクチン接種を受けた変死者 54人を調査し論文報告しました。54人のうちワクチンとの因果関係が明らかであったとされたのは8人です。心筋炎と血栓症は認知された副反応死ですが、入浴中の溺死などは疑わしいが法医学的に断定できず因果関係不明となりました。ワクチン接種後変死者は常に病因として新型コロナウイルス感染症 (COVID-19) による死亡との区別が論争になっています。
*こちらの記事の無料部分に「ワクチン接種後死亡」の詳細を書いてあります。
第1-7. COVID-19 mRNAワクチン の副作用はバッチ依存性である [一般_詳しい_大切] _バッチの説明は第1-8.へ
コロナmRNAワクチンのロットによって死亡者数がとても違うことが取り沙汰されています。厚生労働省のデータとして事実のようです。
ロットごとの違いが大きいことは副作用がスパイク蛋白のみによらない可能性を示唆している可能性があります。製造工程のバラツキと考えるのが筋では?
バッチとは?
COVID-19 mRNAワクチンは全てのバッチごとに独立した品質評価が行われている。日本についてわかりませんが、オーストラリアのTherapeutic Goods Administration (TGA) によるCOVID-19 ワクチンのバッチリリース評価はネットで閲覧できます。
この件に関するブログ記事

バッチ依存性副作用リスクの代表的な結果
各バッチの副作用頻度を調べたところデンマークではリスク高、中、低の3タイプあった。リスク高のバッチの総接種人数が少ないことから当局が途中で市場から回収したものと考えられた。該当するnote記事
またリスク低のバッチがほとんど品質チェックを受けていないことから生理食塩水ではないかという疑惑が出たが、ジェシカさんが詳細に検討した結果では頻度が少ないけれど重い副作用も出現していたため生理食塩水ではない可能性がある。
尚、日本は河野太郎担当大臣(当時)が日本ではプラセボがないとご発言されている。


Eur J Clin Invest. Max Schmeling, 2023 link

それでは、現在使用中の”新型コロナウイルス感染症に対するmRNAワクチン”の製造工程を確認していきましょう
第1-8. S.2.2.2. 生産バッチの定義 – BNT162b2 原薬
商用スケールの原薬バッチは、in vitro 転写 (IVT) の開始容量 37.6 L のスケールで実行されます。 生成されたすべての材料は、単一の 2 段階の限外濾過/ダイアフィルトレーション (UFDF) によって精製され、原薬が生成されます。
第1-9. アセスメントリポート
Assessment report on extension of marketing authorisation 25 November 2021 EMA/719541/2021 COMIRNATY リンク
第2. COVID-19 mRNA 1価ワクチンのmodRNAの構造
ファイザー社のmRNAワクチンBNT162b2の有効成分トジナメランは、SARS-CoV-2(Wuhan-Hu-1 株由来)の S タンパク質 S1 及び S2 をコードする modRNA で、2 アミノ酸が置換(K986P 及び V987P) されるよう設計されています。
2 アミノ酸置換の理由はS タンパク質の最適な融合前構造を保つためです。
成分のmodRNAは、5’末端にキャップ構造、翻訳の効率化のための配列(未公開)、小胞 体輸送のためのシグナル配列(未公開)、RNA の安定化のための配列(未公開)及びポリ A 鎖を含み、 mRNA に対する免疫原性の抑制及び翻訳の促進のため、すべての UTP が m1ΨTP に置換されています。
用語 modRNA: 修飾されたmRNA
令和3年2月12日の 医薬・生活衛生局医薬品審査管理課の審議結果報告書の該当部分です

第3. 鋳型DNA用プラスミドの調整
modRNAのDNA 鋳型の作製には、セルバンク を用います。DNA鋳型配列を組み込んだプラスミド DNA を大腸菌(未公開株)に導入 (transformation)し、 クローニングした後に、マザーセルバンク (MCB)を調製し、MCBから 継代してWCBを調製します。
米Chesterfield 工場は、Pfizer 社の Covid-19 ワクチン用プラスミドの唯一の供給源である。しかし、ワクチンを完成させるには、他の 2 つの工場で、さらにいくつかのステップが必要となる。



プラスミドは環状2本鎖DNAです。
プラスミドの中にスパイク蛋白をコードするdsDNAが組み込まれています。
スパイク蛋白をコードするDNAは環状プラスミドの内部に組み込まれています。環状プラスミドを大腸菌の中に入れ、大腸菌ごと培養して増やします。

環状プラスミドDNAの構造はワトソンとクリックの発見した2本鎖DNAが環状になっている。普通の2本鎖DNAが環状になっている。実験に使用するプラスミドの塩基配列は明らかです。
[復習したい人は、DNA複製の美しいアニメーション動画をどうぞ]

大腸菌を一晩増殖させ、次に、最大 300 リットルの栄養液を含む大きな発酵槽に移す。大腸菌 は発酵槽で 4 日間培養し、20 分ごと分裂・増殖するので、何兆もの DNA プラスミドのコピー ができる。
令和3年2月12日の 医薬・生活衛生局医薬品審査管理課の審議結果報告書から該当部分です

第4. プラスミドDNAの収集と精製
培養が終了すると、化学物質を追加して大腸菌細胞壁を破壊し、中にあるプラスミドを放出させる。次に大腸菌の成分を除去してプラスミドのみ集める。



第5. プラスミドに含まれるスパイク蛋白をコードする DNAの塩基配列を確認する
第6. 鋳型DNAの調整


プラスミドが品質検査に合格すると、制限酵素を添加する。酵素は環状プラスミドを切断し、コロナウイルス遺伝子を線状断片として分離する。この線状化プロセスは、約 2 日を要する。
はじめのニューヨークタイムスの記事ではプラスミドDNAからスパイク蛋白をコードする DNA領域を切り出して鋳型DNAとすると説明されました。
環状プラスミドDNAの2ヶ所を制限酵素処理します。ベクター部分からスパイク蛋白質コード領域を含む鋳型DNAを切り出して、アンドーバー (マサチューセッツ州) にあるファイザーの工場とドイツ・マインツにあるBioNTechの施設へ送付する。

最初に説明された鋳型DNAの構造は右端
2023年2月に、米国のケビン・マッカーナン氏が市販のCOVID-19 mRNA 2価ワクチンを次世代シーケンシング(NGS)解析した結果を公開しました。
解析にはIllumina を使用した。
マッカーナン氏によると、これまで気にされることのなかったベクター部分(上図の青色のDNA部分)が残存していた。
ベクター部分のdsDNAがワクチンバイアルに残存する方法は大きく2つあります
切り出した鋳型プラスミド (上図の赤い部分)の精製が不十分で、ベクター部分が残っている。(環状プラスミド遺残の有無により、さらに場合訳けできる)
ベクター部分も鋳型DNAとして使用した。言い換えると、In vitro translation のステップにベクター全長を投入した。
この件に関してはファイザー社の説明を発見する必要があります。
マッカーナン氏は最終的にファイザー社とモデルナ社の2価ワクチンに使用されているプラスミドDNAの全長塩基配列を決定しました。
そして、FDAの部会で報告した。
以上の塩基配列はGenbankに登録された
ファイザー OR134577.1 (7810bp), モデルナ OR134578.1
次世代シーケンシング(NGS)解析のシークエンスはこちらからダウンロードできます
荒川先生の努力 NGS再解析、qPCR定量
荒川央先生が一人で、これらのNGSデータを再解析し、間違いないことを確認しました。荒川央先生は、qPCR法による定量をマッカーナン氏と新田氏双方のプライマーを用いて確認しました。
Sin Hang Lee先生による混入ベクターDNAのサンガー法による塩基配列部分決定
さらに、遺伝子診断の米Milford Molecular Diagnostics社のSin Hang Lee先生がファイザーのBNT162b2バイアルから、 マッカーナン氏の公表したプラスミドDNAの Ori 領域およびスパイク蛋白遺伝子コード領域のシークエンスプライマーを作成し、サンガー法で塩基配列を決定した。
Sin Hang Lee先生のサンガー法によるシークエンスデータをご紹介します。
下図はスパイク蛋白をコードしている領域になります。マッカーナン氏の公開している塩基配列と同じシークエンスが読まれました。

Sin Hang Lee先生のデータを説明するマッカーナン氏のブログ (6月24日)
NIHの Blastを使って遺伝子のホモロジー検索をしたことのない人が体験できるおまけを書きました。この記事の末尾にあります。
マッカーナン氏の努力
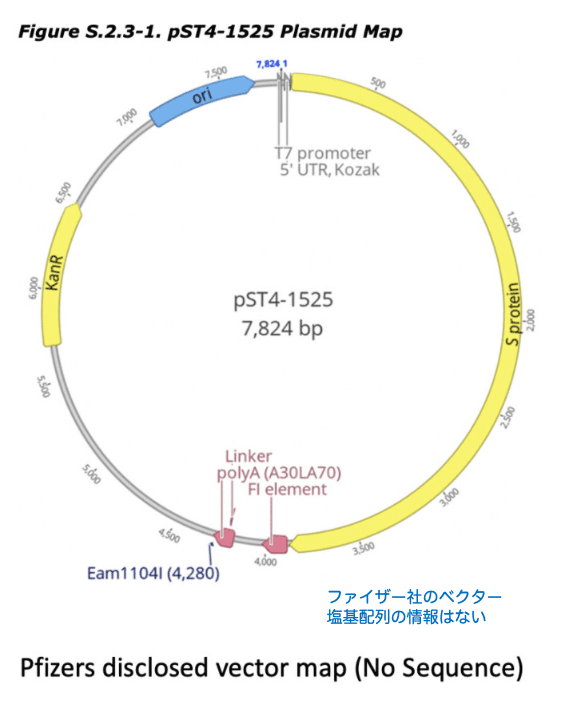
マッカーナン氏はベクターの塩基配列を最終決定する前に実験条件を試行錯誤し、シークエンサーによる解析を複数回試みて複数のベクターの塩基配列を得ています。
以下の4つはマッカーナン氏がブログで公開しているるファイザーのベクターマップです。このうちGenbankに登録したのは7810bpのベクター配列です
注意:記事はベクターマップの後にも続いています。






ファイザー社のベクターの中にSV40プロモーター領域が含まれている件
以上のファイザー社のベクターの中にSV40プロモーター領域が含まれているため安全性に問題があると指摘されています。
安全性とは別に、なぜSV40プロモーターをベクターに組み込んだのか考察しました。
私の意見は、SV40のpoly(A)signal を利用するためではないか?
ご注意ください。結果として癌患者が増えるかどうかとは別の視点です。
私の個人的な意見は、この劇薬は少なくとも全く乳幼児および小児には不適切です。
*全年齢に不適切では?という説明はより複雑になるので現時点で不適切と考えていますが記載を省略します。
ファイザー社が欧州医薬品庁に提出したベクターマップです
SV40関連の遺伝子は記載されていません。塩基配列は公開されていません。
個人の意見ですが、この製剤は途中で監督当局から、有効成分のmodRNAにpoly(A) tail がついてないものや、poly(A) tailが 短すぎるものが多すぎるとチェックされました。そのため、後からSV40 のpoly(A)tail 付加システムを付け加えたのではないか?
鋳型DNAの調整としてニューヨークタイムズを介して公開された方法のうち予測される工程2と異なる部分に線を引きます。
プラスミドDNAを制限酵素2ヶ所で切断し、スパイク蛋白をコードする領域のプラスミドDNAを切り出して、アンドーバー (マサチューセッツ州) にあるファイザーの工場とドイツ・マインツにあるBioNTechの施設へ送付する。

市販用ワクチンのIn Vitro translation の鋳型DNA はスパイク蛋白部分だけではなくベクター部分も含むと推測された
第7. 制限酵素処理後のプラスミドDNAの精製
次に、酵素処理をして切り出したプラスミドDNAまたは直鎖状プラスミドDNAを精製します。
残留している大腸菌やプラスミド断片は全てろ過・除去され、1L ボトルの精製 DNA が得られる。DNA 配列は再度検査され、次の段階のプロセスの mRNA の鋳型として機能する。DNA の各ボトルは約 150 万回分のワクチンを生産する。
少なくともmRNAワクチンの発売時の宣伝に、”ベクターdsDNA残存が周知の事実”とか、"シークエンスできるdsDNAがワクチンバイアルに含まれているのが当たり前である"、という意見に相当する表現は含まれていません。
このステップにおけるワクチン中間産物の精製をしているニューヨークタイムズ掲載写真ではフィルターを用いているようです。写真でDNAの精製を手作業で行っているため、治験用 Process 1 工程1と推測されます。


実験室で酵素処理をして切り出したDNAを回収する方法に、アガロースゲルやキャピラリー電気泳動を用いて、目的とするサイズのDNAを分取する方法もありますが、工程では使用されていないようです。
Process 2 (工程2) の鋳型プラスミドDNAの精製方法を発見する必要があります。

第8. 鋳型DNAからの インビトロ転写
In vitro translation (IVT)
鋳型DNAが届いたアンドーバー工場では、DNAが入った容器を1日かけて解凍し、mRNAへの転写に必要な酵素やmRNAの構成要素と混合し、数時間にわたって転写処理を行います。
mRNA ワクチン製造のためのこのin vitro転写反応は、すべての反応成分をバイオリアクターに添加してスタートします。

IVT 反応槽 バイオリアクター
新たに入手したメーカー文書からIVTの項目を追加します。
S.2.2.4. インビトロ転写 (IVT)
IVT ステップの主な目的は、原薬生産のための RNA を合成することです。
IVT ステップを開始するには、個々の成分を解凍し、ATP 溶液 (100 mM アデノシン 5'-三リン酸)、CTP 溶液 (100 mM シチジン 5'-三リン酸)、m1ΨTP 溶液 (100 mM N1-メチルシュードウリジン 5'-三リン酸) 、GTP 溶液 (100 mM グアノシン 5'-三リン酸)、5'-キャップ ソリューション (100 mM 5'-キャップ)、および注射用水の初期量 (WFI)を含む反応容器に加えます。線形 DNA テンプレート、10X 転写バッファー (400 mM HEPES、400 mM 酢酸マグネシウム、100 mM DTT、20 mM スペルミジン、pH 8.3)、および RNase 阻害剤を、残りの量の WFI と共に反応容器に加えます。 試薬の添加中、プレ酵素攪拌と温度制御が目標範囲で開始されます。 最後に、ピロホスファターゼと T7 ポリメラーゼを反応容器に加え、攪拌を酵素攪拌速度まで上げます。 上記の量の追加は、合計 37.6 L の IVT 開始目標量になります。これらの酵素の追加後、GTP/m1ΨTP ボーラス供給中のインキュベーション時間が始まります。 パラメータの範囲は、表 S.2.2-1 で確認できます。
この潜伏期間中、m1ΨTP と GTP の等量混合物が 11 回のボーラス フィードとして供給されます。 すべてのフィードが完了すると、最後の IVT インキュベーション時間が開始されます。 最後の IVT インキュベーション時間が完了すると、プロセスはすぐに DNase I 消化操作に進みます。
IVT ステップは、表 S.2.2-1 に示すプロセス パラメータを使用して制御されます。

反応成分のすべて
◉ヌクレオチド(アデノシン-5'-三リン酸(ATP)、1-メチルプソイドウリジン-5'-三リン酸(mod-UTP)、シチジン-5'-三リン酸(CTP)、グアノシン-5'-三リン酸(GTP))
◉直鎖状鋳型 DNA (鋳型DNAはテンプレートDNAと同じです)
◉T7 RNA ポリメラーゼ酵素 (大腸菌で生成) および RNase 酵素阻害剤
◉5' キャップ類似体
◉スペルミジン、ジチオスレイトール (DTT)、塩化マグネシウム、必要に応じてピロホスファターゼ酵素(ピロリン酸副産物を分解し、その結果としてMg補因子濃度を維持するため)、ヌクレアーゼフリーの精製水、およびpHを維持するための緩衝液

インビトロ転写の鋳型DNAはプラスミドDNAを制限酵素2ヶ所で切断し、スパイク蛋白をコードする領域のプラスミドDNAを切り出したものと最初に説明されていました (下図B)。

制限酵素2ヶ所で切断し切り出した鋳型DNAからのIVT
(ニューヨークタイムズ報道のファイザー社の製法)
しかし、マッカーナン氏によるシークエンスの結果が示すことは、全長プラスミドDNAを一か所切断した直鎖状プラスミドDNAが鋳型として使われている可能性です(実験データからの推測)(下図A)。

上図AとBは異なるIVT反応ですが、IVT反応終了時のバイオリアクター (反応槽) に存在する核酸種に関する情報はありません。


第9. 鋳型DNAのDNase Iによる分解
転写反応 [mod-UTP を含む 5' キャップ付き mRNA の合成] に続いて、DNA を分解する酵素であるデオキシリボヌクレアーゼ I (DNase I) 酵素をバイオリアクターに加える。DNase I の活性に必要な塩化カルシウムもバイオリアクターに加えます。
工場では鋳型DNAの分解にDNase I を使用しています。基本的なDNase Iの作用はDNAを消化してモノあるいはオチゴヌクレオチドにします。
DNase Iを実験に用いる時に、反応性を制御して特定レンジ長のDNA鎖に切断することも可能です。今回、ネット上でmRNA製造工場におけるDNA除去工程で、DNase Iの効かせかたは次世代シークエンサーで塩基配列が読める程度である、と主張する人間がいます。実際にDNase I処理後にでどこまで長いDNA断片を残しているか数値を知ることは重要です。
工場で行われている工程の詳細を一般人が知らなくても問題ないでしょう?
実際にどこまで長いdsDNAを残しているのかわからないですね、という話をしています。
ただし私の目的はワクチン副作用被害者の救済にあります。特定の企業に対して敵対や非難する目的はありません。
詳しく DNase (ディーエヌエース) I 酵素について
DNase I は酵素です。基本的な働きは、一本鎖DNAおよび二本鎖DNAを分解し5’リン酸基を含むモノヌクレオチドあるいはオリゴヌクレオチドを生じる反応を触媒します。
反応部位はデオキシリボースの5’位の炭素と3’位の炭素の間をリン酸基がつないでいるリン酸ジエステル結合(ホスホジエステル結合)です。ただし長いDNA鎖の全てのリン酸ジエステル結合を同等には切断しません。
Structure of recombinant human DNase I (rhDNaseI) in complex with Magnesium and Phosphate.
PDB 4AWN DOI: https://doi.org/10.1021/bi300873f



Asn7 と Asp168、Glu39、および Mg2+ イオンの配位球 (マゼンタ) からの水原子 (赤) との水素結合 (Å 単位の長さ) が示されている。
リン酸イオンは、一プロトン化 (HPO4-2) 状態または二プロトン化 (H2PO4-) 状態のいずれか。
Biochemistry 2012, 51, 51, 10250–10258
審議結果報告書で公開されている製造方法

医薬・生活衛生局医薬品審査管理課の令和3年2月12日の審議結果報告書
新たに入手したメーカー文書からDNase I 消化の項目を追加します。
S.2.2.5. DNase I 消化
DNase I 消化ステップの主な目的は、直鎖 DNA テンプレートのサイズを小さくし、その後の限外ろ過/ダイアフィルトレーション ステップでの除去を可能にすることです。
塩化カルシウム溶液 (50 mM 塩化カルシウム) と DNase I 溶液は、最後の IVT インキュベーションの最後に追加されます。 このステップの間、温度(温度 1)と攪拌速度を維持します。 DNase I インキュベーション時間の完了時に、EDTA (500
mM EDTA) が追加されると、温度設定値が更新されます (温度 2)。 EDTA 添加後、プロセスはプロテイナーゼ K 消化に進みます。
DNase I 消化ステップは、表 S.2.2-2 に示すプロセスパラメーターを使用して制御されます。

EMAから「DNaseI消化の頑健性が確認されていない」と指摘 ↓ スクショ とレポート全体のダウンロード

https://twitter.com/koronanoukyuus1/status/1692748506208076213
DNaseIを分解する過程があるのですか?
— 御茶ノ水博打🚲 (@koronanoukyuus1) August 19, 2023
分解したDNA断片を除去する濾過操作で、DNaseIも一緒に除けるサイズだと思ってました。
DNaseIを分解したら、分解するためのプロテアーゼもまた除かないといけなくなりますし。
DNase処理の後にプロテイナーゼK処理が行われていますが、プロテイナーゼK処理は酵素不純物を減らすためと書かれていました。 その酵素不純物とは、T7ポリメラーゼとDNaseIのようです。 その後の濾過をしやすくするためでしょうか。 でも、プロテイナーゼKは残ってしまいますね
第10. プロテイネースK処理
下記メーカー文書よりプロテイネースK処理工程を追加します。
S.2.2.3. 製造工程の概要
RNA はまず in vitro 転写 (IVT) によって合成され、続いて DNase I さらにプロテイナーゼ K 消化ステップが行われ、さらに精製に進みます。 粗 RNA を 2 段階の限外濾過/ダイアフィルトレーション (UFDF) で精製します。 最後に、RNA は分配されて凍結保存される前に最終ろ過を受けます。
原薬プロセスのフロー図を図 S.2.2-1 に示す。 各プロセスステップについて、このフローダイアグラムは、プロセス入力 (追加される材料) とプロセス管理 (プロセスパラメータ、材料属性、プロセス性能属性 (PPA)、管理のための工程内試験 (IPT-C) および工程内試験) 、モニタリング用 (IPT-M))をリストします。。
IPT-C は、指定された範囲内で QA/CQA を制御して、目的の DS/DP 品質を満たすために使用されるインプロセス テストです。 IPT-C には、関連する承認基準があります。 これらの IPT-C は、関連する承認基準とともにこのセクションで表にされ、セクション S.2.4 重要なステップと中間体の管理 [BNT Mainz and Rentschler] でも説明されています。
IPT-Cに加えて、モニタリングのための工程内試験(IPT-M)がプロセス全体で実施され、製造プロセスの一貫性が確保されています。 IPT-M は、QA/CQA を監視して以前のプロセス履歴との一貫性を確保するため、または前方処理のために使用されるインプロセス テストです。 監視テストにはアクションの制限がある場合があります。 これらの IPT-M は、セクション S.2.4 重要なステップと中間体の管理 [BNT Mainz and Rentschler] で説明されています。
すべてのプロセスパラメータは、適用可能な範囲内で定義および制御され、バッチ記録と標準操作手順に詳述されています。
特に明記しない限り、すべてのユニット操作は周囲温度 (15 ~ 25 °C) で実行されます。

S.2.2.6. プロテイナーゼ K 消化
プロテイナーゼ K 消化ステップの主な目的は、その後の限外濾過/ダイアフィルトレーション ステップでの除去のために、反応混合物中のタンパク質のサイズを小さくすることです。
プロテイナーゼK溶液を反応容器に添加し、所定の時間インキュベートする。 このステップの間、温度と攪拌速度を維持します。 プロテイナーゼ K インキュベーション時間の完了時に、プールを周囲温度に冷却し、5 つの 10L Flexsafe バッグに充填します。 IVT 溶液は、限外濾過/ダイアフィルトレーションに移行する前に、周囲温度で 24 時間未満維持するか、最大 96 時間 2 ~ 8 °C で維持することができます。
プロテイナーゼ K 消化ステップは、表 S.2.2-3 に示すプロセスパラメーターを使用して制御されます。

プロティナーゼ K プールは、限外濾過/ダイアフィルトレーションに移行する前に、周囲温度で 24 時間未満維持するか、最大 96 時間 2 ~ 8 °C で維持することができます。 その間、プールはラウプハイムのレンシュラーに運ばれ、2 ~ 8 °C でさらに処理されます。
DNase処理の後にプロテイナーゼK処理が行われていますが、プロテイナーゼK処理は酵素不純物を減らすためと書かれていました。 その酵素不純物とは、T7ポリメラーゼとDNaseIのようです。 その後の濾過をしやすくするためでしょうか。 でも、プロテイナーゼKは残ってしまいますね


やっと、討論相手の登場 (2023年8月19日)。2月か3月の時点で契約外物質の混入について、ワクチン接種停止を唱える人たちが一致して訴えを起こせなかったのはなぜか? (私は実名で働きかけをしています)
さて、"濾過で除かれる" の根拠はどこに?
気になって調べました。
— 新田 剛 Takeshi Nitta (@takenitta) August 19, 2023
プロテイナーゼKの分子量 28.9kDa
DNaseIの分子量 30kDa(製品によって多少異なる)
どちらも、50塩基の二本鎖DNA断片と同じくらいのサイズですね。
濾過で除かれますが、ゼロにはできないと思います。
S.2.2.7. トランスポーテーション
IVT 溶液を含む 5 つの 10L バッグは、輸送用に認定されたシェルに梱包され、2 ~ 8 °C に冷却されます。 BNT Manufacturing から Rentschler Biopharma SE への出荷は、断熱された荷送人を使用して 2 ~ 8 °C で行われます。
S.2.2-4.
輸送ステップは、表 S.2.2-4 に示すプロセスパラメータを使用して制御されます。

第11. 精製
転写が完了したmodRNAは、不要なDNA・酵素・不純物などを除去した後、ワクチンとして加工するために、マイナス20度を保った状態でミシガン州・カラマズーの施設へと送られる。また、塩基配列の確認のためにチェスターフィールドの施設へもサンプルが送られる。
新たに確認されたメーカー文書より
粗 RNA を 2 段階の限外濾過/ダイアフィルトレーション (UFDF) で精製します。
S.2.2.8. 限外濾過/透析濾過 (UFDF)
UFDF ステップでは、小さなプロセス関連の不純物を減らし、RNA を濃縮して最終的な DS 製剤 (10 mM HEPES、0.1 mM EDTA、pH 7.0) にバッファー交換します。
UFDF ステップの準備をするために、消毒した UFDF 膜をダイアフィルトレーション 1 バッファー (200 mM 硫酸アンモニウム、10 mM HEPES、0.1 mM EDTA、pH 7.0) で平衡化します。 平衡化された膜の pH と導電率が検証されます。
UFDF の前に、ポスト プロテイナーゼ K プールを硫酸アンモニウム希釈バッファー (400 mM 硫酸アンモニウム、10 mM HEPES、0.1 mM EDTA、pH 7.0) で 2 倍に希釈します。 希釈されたプロテイナーゼ K プールは、2 段階のダイアフィルトレーションを受けます。 最初に最小限のダイアフィルトレーション 1 バッファーを使用して 5 ダイアボリューム (DV)、続いて製剤バッファー (10 mM HEPES、0.1 mM EDTA、pH 7.0) を使用して最低 10 ダイアボリューム。
ダイアフィルトレーション 2 の後に決定された保持液 RNA 濃度に基づいて、必要に応じてダイアフィルター処理された保持液を濃縮し、フレキシブル コンテナー内の 0.45/0.2 μm 二重層フィルターを通して回収します。 調合バッファーは、およそ2.25 mg/mLターゲットに追加される可能性があります
次に、コントロールの工程内試験 (IPT-C) が確立された許容基準とともに、RNA 濃度について実行されます (セクション S.2.4 重要な工程および中間体の管理 [BNT Mainz and Rentschler] に記載)。 次に、最終的なプールは、2 番目の 0.45/0.2 μm 2 層フィルターでろ過され、フレキシブル コンテナー (UFDF プール) に入れられます。
使用後、UFDF 膜を1N水酸化ナトリウム溶液で洗浄し、0.1N水酸化ナトリウム溶液中で保存する。
UFDF は、次のプロセス パラメータを使用して制御されます

鋳型 DNA のDNase Iによる酵素消化後、分子量で最大の成分は分子量 2.5 MDa の mRNA 生成物で、次が酵素で分子量が一桁小さい (たとえば、T7 RNA ポリメラーゼは約 0.1 MDa 、または≈100 kDa、一方、DNase Iは≈0.03 MDa、または≈30 kDa)。さらに小さな工程由来成分が存在します。
これまで接種されてきたCOVID-19 mRNAワクチンに間に合いませんでしたが、その後、工程由来の有害副産物であるdsRNA を除去する方法が開発されました。しかし、現在は有害なdsRNAを含むワクチンを接種しています。ワクチン接種を推奨する関係者には最初から周知の事実だったと思われるのですが…..

審議結果報告書に記載されている製造工程由来不純物

鋳型DNAの残存量はqPCR法によって製薬会社が定量し、規制当局へ報告することになっています。製薬会社はqPCRのプライマーを公開していません。
医薬品インタビューフォームに記載されている製造工程由来不純物
鋳型DNAの残存は製薬会社による製品の日本のインタビューフォームにも記載されています。

EMAやFDA当局に製薬会社が提出した残存DNA量の確認は、鋳型DNA部分をqPCR法によって定量されています。
工場ではどの段階でどのような精製が実施されているのか不明
LNPで包む前に、主成分のmodRNAよりも分子量の小さな夾雑物を除去する精製が行われます。
In Vitro 転写 (IVT) 以降の工程のフロー (サンプル) → 第9章
下の図はIn vitro translation 以降の工程です。DNAを切断する酵素 (DNse I) で処理した後に、完成するまで精製のステップが6つあると記載されています。 タイトル:Resources, Production Scales and Time Required for Producing RNA Vaccines for the Global Pandemic Demand. Vaccines (Basel). 2020 Dec 23;9(1):3. リンク
DNase I 処理後の最初の精製は、タンジェンシャルフロー濾過・ダイアフィルトレーションとあります。

タンジェンシャルフローろ過 (TFF) は、流れと垂直方向の膜孔から回収する目的物質よりも分子量の小さな混合物を時除去する方法です。分子量が小さいほど除去されます。[タンジェンシャルフローろ過 (TFF)の概説]
TFFは、主にタンパク質や核酸といった生体分子やウイルス、微生物、球状粒子を迅速で効果的に分離精製する方法です。
ラボスケールのTFF で50 mL程から数十リットル容積のサンプル溶液の濃縮と脱塩が可能です。

https://www.cytivalifesciences.co.jp/products/pall/laboratory/tangential-flow-filtration/index.html
TFFは、小さな 0-200 nmの直径のエクソソームの分離精製にも使用されています。Int J Mol Sci. 2021;22:2889.
Kis らの論文では1回目のTFFの後にクロマトグラフィーを実施し、さらに2回目のTFF (無菌) を実施することになっています。
アセトニトリルは有害なので、クロマトグラフィーで精製したと想定するのは難しいのではないか

6月29日ニュース 今年の秋冬シーズンはファイザー製ワクチンへ一本化か?
今年の秋冬シーズンに向けて政府が購入する新型コロナウイルス予防用mRNAワクチンを巡り、厚生労働省がファイザー製ワクチンへの一本化を検討していることが分かった。モデルナ製ワクチンの購入量をゼロにするのか、減らすのかといった詳細は不明。背景には、モデルナ製の廃棄が多いことや、予算の効率化などがあるようだ。厚労省は自民党への説明を始めているが、医療系議員からは一本化に慎重論も出ている。厚労省は審議会の議論を踏まえつつ、秋冬シーズンの納入契約を結びたい考えだ。古川俊治参院議員は日刊薬業に対し、複数の調達先を確保するのが望ましいと語った。厚生科学審議会予防接種・ワクチン分科会は16日の会合で、両社のワクチンの特性を比較し、モデルナ製ワクチンの方に優位性を示すデータが含まれていた。具体的には▽免疫不全患者ではモデルナ製の方が予防効果が高い▽感染予防効果はモデルナ製の方が長く維持される―などだ。リンク
この記事はmRNAワクチンによる副作用全体像について考察していません。
第12. LNP包含
第12-1. 米国式
前工程で精製されたものがカラマズー工場に届きます。ここでは、届いたものを解凍してそのまま水と混合した後、人間の細胞に入りやすくするために脂質と混合して、脂質ナノ粒子を生成します (ニューヨークタイムズ記載)。脂質ナノ粒子の生成にはマイクロ流体力学を用いた特殊な機器が必要とされます。
カラマズーの施設では、mRNAを解凍して水と混合した後、人間の細胞に入りやすくするために脂質と混合して、脂質ナノ粒子を生成する。脂質ナノ粒子の生成にはマイクロ流体力学を用いた特殊な機器が必要とされている。

脂質ナノ粒子の完成後、不純物を除去して滅菌した後に、ワクチンをバイアルへ封入します。カラマズーの施設では毎分最大575個のバイアルにワクチンが封入されている。
バイアルへの封入完了後、ワクチンをマイナス70度にまで冷却し、チェスターフィールドとアンドーバーの施設で品質テストを行う。
以上の説明に出てくるニューヨークタイムズの記事↓
第12-2 ドイツ式
独マールブルグのビオンテック製造現場内部の状況は↓

この工場ではmodRNAをLNPで包含するために純粋な加圧エタノールを使います。加圧エタノールは爆発性が高いので作業のために静電気防止用の服装をします↓

バイオンテックではLNPで包含したmodRNAはこの後2回のフィルター処理で精製する。

マールブルグ工場ではmodRNAも製造しており、全雇用は400人です。
第13章 品質管理
第13-1. mRNAの完全性
ファイザー/BioNTech BNT162b2 (Comirnaty) 合成の「プロセス2」は「プロセス 1」と、RNA の転写に使用される DNA テンプレートと精製段階、および脂質ナノ粒子の製造プロセスに変更があります。これによると推定されますが、「プロセス 2」バッチでは mRNA の完全性が大幅に低いことが示されました。
臨床バッチと提案されている商用バッチの間で「RNA 完全性/切断種の % に大きな差がある」(約 78% から 55%)。原因は不明。
mRNAの完全性がどの程度の割合であれば新型コロナウイルス感染症(covid-19)に対するワクチンとして許容できるか?この件についての解答に明確なものはない
この件に関する英国の医薬品・医療製品規制庁は、「規格限界の受け入れ基準は商業上の機密である」と電子メールで述べた
米国FDAは、この件についてFDA審査覚書で扱われていない情報であると答えた
カナダ保健省は、許容基準に関連する特定の情報は機密であると述べた
EMAは、ワクチンの有効性が適切な量の無傷のmRNAの存在に依存することを認めた。またカナダ保健省は、3つの機関がその後「RNAの完全性やその他の製品仕様に懸念はなかった」と判断したと述べた
FDA、カナダ保健省、EMA が mRNA 完全性パーセンテージの臨床的に認定された仕様に基づいて調整していたことが示唆している。 カナダ保健省はBMJに対し、規制当局が「これらの要件を調整するために協力してきた」ことを確認したが、すべての当局は、そのような情報が商業的に機密であるという理由でBMJに詳細を共有することを拒否した。
ファイザーは、mRNAの完全性がどのくらいの割合を目指しているかについてコメントを拒否し、特定のバッチでmRNAの完全性の割合が予想外に低い原因についても言及せず、同じことが再発する可能性があるかどうかという問題は未解決のままとした。 ファイザーは次のように強調した。「ワクチンの各バッチは、最終製品の発売前に、公式の医薬品管理研究所であるドイツのパウル・エールリッヒ研究所によって検査されます。 その結果、欧州で市場に出されるすべてのワクチンの品質は、規制当局と合意された仕様に準拠していることを確認するために二重テストされています。」
モデルナ社の最高経営責任者であるレイ・ジョーダン氏は、BMJの質問への回答を拒否し、「現時点では、モデルナ社はこれらのトピックについて追加のコメントを提供する予定はない」と述べた。
出典1. European Medicines Agency. European public assessment report (EPAR) 2020. リンク
第13-2. LNP の組織局在化
終わり
この記事は7月14日に書き上げてupしました
当記事は副作用被害者の病因病態を考える材料として調査したものを皆様に公開しました。足りないとこ路がありましたら教えていただければ幸いです。
おまけ1. プラスミドDNAの増幅はこんなかんじ
スパイクタンパク質DNAを含む環状プラスミドを導入した大腸菌を4日間培養する
小規模な大腸菌の液体培養の例です。滅菌したフラスコに抗生物質入りの液体培地を入れます。そこに1ml程度に培養した大腸菌培養液を入れ、恒温 (37℃) で振とうさせながらO/N (一晩) 培養します。
大腸菌からプラスミドを取り出します。まず培養液を遠心用のチューブに移します。(画像にあるのは50mlチューブ)

遠心機にかけ大腸菌を沈澱させます。50mlチューブの場合は4℃、12000rpm、5分遠心する。

古典的なアルカリ融解法の全工程は下の動画でどうぞ
多くの場合、DNAが吸着する性質のあるカラムやメンブレンを利用したプラスミドDNAの精製法を用います
ニューヨークタイムズによると、ファイザー社の次の工程はスパイク蛋白質をコードするDNA領域を、制限酵素処理によって切り出し、ろ過して、-20℃に保存する。
DNAの制限酵素処理をしている動画です↓ [動画はかなりつまらない]
プラスミドDNAを2ヶ所で制限酵素処理すると、スパイク蛋白をコードするDNAを切り出せる (下図)

おまけ2. Genbank Blast を使ってみよう
一度も遺伝子を扱ったことのない人へ
相同性のある塩基配列をBlastを使って探してみましょう。
下のNucleotide Blast をクリックしてください

クリックすると下図のページが現れます。Enter Query Sequence に赤字でここに塩基配列を入力する と記載してあります。ここでは、Sin Hang Lee先生がシークエンスした配列↓をコピーしてペーストしてください
AGATGGCCTACCGGTTCAACGGCATCGGAGTGACCCAGAATGTGCTGTACGAGAACCAGAAGCTGATCGCCAACCAGTTCAACAGCGCCATCGGCAAGATCCAGGACAGCCTGA

塩基配列を入力するとEnter Query Sequence が黄色に変化する。小さな赤矢印4箇所を確認してから太い赤矢印のBlastをクリックします

少し待つと下図のページが出現します。Descriptionsの上から2つめ赤矢印にマッカーナン氏が登録したファイザーのプラスミドDNAの塩基配列が出ているので、ここをクリックしてください

Genbank と繋がってる感じを楽しんでいただけましたか?
それではまたね
番外編:アストラゼネカ ChAdOx1 の場合
アデノウイルスベクターに加えて、相当量のヒトウイルスタンパク質と非構造ウイルスタンパク質の両方が含まれている。ヒトタンパク質の中でも、ヒートショックタンパク質と細胞骨格タンパク質が特に豊富である。
ワクチン接種後 1 ~ 2 日後に観察されることが多い強い臨床反応は、検出されたタンパク質不純物と関連している可能性があります。



https://livedoor.blogcms.jp/blog/fujita2011/article/edit?id=51860963
https://livedoor.blogcms.jp/blog/fujita2011/article/edit?id=51860964
https://livedoor.blogcms.jp/blog/fujita2011/article/edit?id=51860966
https://assets.researchsquare.com/files/rs-477964/v1_stamped.pdf
Process- and product-related impurities in the ChAdOx1 nCov-19 vaccine
https://livedoor.blogcms.jp/blog/fujita2011/article/edit?id=51860971
https://livedoor.blogcms.jp/blog/fujita2011/article/edit?id=51860972
https://livedoor.blogcms.jp/blog/fujita2011/article/edit?id=51860974
有料部分はジャンクです。かつて冒頭にあったものです。討論会が終了していますので公開を停止しました。
ここから先は
¥ 500
この記事が気に入ったらチップで応援してみませんか?
