枯渇したT細胞が癌免疫サイクルを乗っ取る:資産と負債
Exhausted T cells hijacking the cancer-immunity cycle: Assets and liabilities
枯渇したT細胞が癌免疫サイクルを乗っ取る:資産と負債
T cell exhaustion is an alternative differentiation path of T cells, sometimes described as a dysfunction.
T 細胞の枯渇は、T 細胞の代替分化経路であり、機能不全として説明されることもあります。
During the last decade, insights of T cell exhaustion acting as a bottle neck in the field of cancer immunotherapy have undoubtedly provoked attention.
過去 10 年間、がん免疫療法の分野でボトルネックとして機能する T 細胞枯渇の洞察は、間違いなく注目を集めてきました。
One of the main drivers of T cell exhaustion is prolonged antigen presentation, a prerequisite in the cancer-immunity cycle.
T 細胞枯渇の主な原因の 1 つは、がん免疫サイクルの前提条件である長期にわたる抗原提示です。
The umbrella term “T cell exhaustion” comprises various stages of T cell functionalities, describing the dynamic, one-way exhaustion process.
「T 細胞枯渇」という包括的な用語は、T 細胞機能のさまざまな段階を含み、動的な一方向の枯渇プロセスを表します。
Together these qualities of T cells at the exhaustion continuum can enable tumor clearance, but if the exhaustion acquired timeframe is exceeded, tumor cells have increased possibilities of escaping immune system surveillance.
消耗の連続体におけるT細胞のこれらの性質が一緒になって、腫瘍の除去を可能にすることができます。しかし、疲労獲得時間枠を超えると、腫瘍細胞は免疫系の監視から逃れる可能性が高くなります。
This could be considered a tipping point where exhausted T cells switch from an asset to a liability.
これは、枯渇した T 細胞が資産から負債に切り替わる転換点と見なすことができます。
In this review, the contrary role of exhausted T cells is discussed.
このレビューでは、枯渇した T 細胞の反対の役割について説明します。

1 Introduction
1.1 T cell exhaustion
T cell exhaustion can be defined as a physiological state of T cells displaying phenotypical and functional changes, such as eventual loss of proliferation capacity and effector functions, changes in cell metabolism and transcription, decreased production of cytokines and elevated expression of inhibitory receptors (IRs).
T細胞枯渇は、表現型および機能の変化を示すT細胞の生理学的状態として定義できます。たとえば、増殖能力とエフェクター機能の最終的な喪失、細胞の代謝と転写の変化、サイトカインの産生の減少、抑制性受容体(IR)の発現の上昇などです。
Exhausted T cells are epigenetically altered, having approximately 6000 different accessible chromatin regions compared to effector and memory T cells, indicating that exhausted T cells may be considered a distinct cell type.
枯渇した T 細胞はエピジェネティックに変化し、エフェクター T 細胞やメモリー T 細胞と比較して、約 6000 の異なるアクセス可能なクロマチン領域を持っています。使い果たされた T 細胞が異なる細胞型と見なされる可能性があることを示しています。
The main drivers of T cell exhaustion such as prolonged T cell receptor (TCR) stimulation by antigens, exposure to suppressive cytokines and tumor mediated immunosuppressive metabolic byproducts, were previously thought to be located mainly in the tumor microenvironment (TME).
抗原による長時間の T 細胞受容体 (TCR) 刺激、抑制性サイトカインへの曝露、腫瘍媒介性免疫抑制性代謝副産物などの T 細胞枯渇の主な要因は、主に腫瘍微小環境 (TME) にあると以前は考えられていました。
More recent studies provide evidence that the exhaustion journey of T cells is initiated already in the lymph nodes (LNs) through interaction between antigen presenting cell (APC)-presented tumor antigens and T cells.
最近の研究では、抗原提示細胞 (APC) に提示された腫瘍抗原と T 細胞との相互作用を介して、リンパ節 (LN) で T 細胞の枯渇の旅がすでに開始されているという証拠が示されています。
T cell exhaustion is an umbrella term describing various functional states of T cells.
T 細胞枯渇は、T 細胞のさまざまな機能状態を表す包括的な用語です。
Exhausted T cells can be divided into subpopulations based on functionality and phenotype, ranging from stem-like exhausted T cells to terminally exhausted T cells.
枯渇した T 細胞は、機能と表現型に基づいて亜集団に分けることができます。幹のような枯渇した T 細胞から末期の枯渇した T 細胞まで、さまざまです。
However, there are no universal, clearly defined lines between the exhaustion subpopulations, and hence T cell exhaustion resembles a continuum; T cells shifting from precursor to terminal exhaustion.
ただし、枯渇亜集団の間には普遍的で明確に定義された線はないため、T 細胞の枯渇は連続体に似ています;前駆細胞から終末枯渇へと移行する T 細胞。
Some of the main markers used for categorizing populations of exhausted T cells include programmed death receptor 1 (PD-1) and transcription factor 1 (TCF-1).
枯渇した T 細胞の集団を分類するために使用される主なマーカーには、プログラム死受容体 1 (PD-1) や転写因子 1 (TCF-1) などがあります。
TCF-1 is a transcription factor essential for T cell development, and the maintenance of TCF-1 expression in exhausted cells is limited to approximately three rounds of divisions, where after its expression is epigenetically silenced.
TCF-1 は T 細胞の発達に不可欠な転写因子であり、消耗した細胞での TCF-1 発現の維持は、約 3 ラウンドの分裂に限定され、その後、その発現はエピジェネティックにサイレンシングされます。
PD-1+TCF-1+ precursor exhausted T cells have stem cell-like properties as they have the capacity to proliferate, self-renew and further produce progeny populations of exhausted T cells, including terminally exhausted less proliferative PD-1+TCF-1–T cells (Figure 1) .
PD-1+TCF-1+ 前駆体枯渇 T 細胞は、増殖し、自己再生し、さらに枯渇 T 細胞の子孫集団を生成する能力があるため、幹細胞のような特性を持っています。 末期に枯渇した増殖性の低い PD-1+TCF-1-T 細胞を含みます (図 1) 。

Studies have shown that the epigenetic state of exhausted T cells is irreversible, indicating that exhaustion of T cells is a one-way process.
研究により、枯渇した T 細胞のエピジェネティックな状態は不可逆的であることが示されており、T 細胞の枯渇が一方通行のプロセスであることを示しています。
However, recent studies suggests that the epigenetic state of exhaustion may be modifiable with the right treatments.
しかし、最近の研究は、疲労のエピジェネティックな状態は適切な治療で修正できる可能性があることを示唆しています。
Most studies investigating T cell exhaustion focus on CD8+ cytotoxic T cells, while exhaustion in CD4+ helper T cells has received less attention.
T 細胞枯渇を調査するほとんどの研究は、CD8+ 細胞傷害性 T 細胞に焦点を当てていますが、CD4+ ヘルパー T 細胞の枯渇はあまり注目されていません。
The main role of CD4+ T cells is to support immune responses by activating and recruiting immune cells through cytokine production.
CD4+ T 細胞の主な役割は、サイトカインの産生を通じて免疫細胞を活性化および動員することにより、免疫応答をサポートすることです。
However, similarly to CD8+ T cells, CD4+ T cells in cancerous conditions show elevated expression of IRs related to exhaustion, such as PD-1 and TIM-3.
ただし、CD8+ T 細胞と同様に、がん状態の CD4+ T 細胞は、PD-1 や TIM-3 などの消耗に関連する IR の発現上昇を示します。
CD4+ T cells do not typically exert cytotoxic functions, but rather promote inflammation and tumor reactivity by cytokine mediated activation of CD8+ T cells.
CD4+ T 細胞は通常、細胞傷害機能を発揮しませんが、サイトカインを介した CD8+ T 細胞の活性化によって炎症と腫瘍反応性を促進します。
In advanced melanoma murine models, development of a tumor reactive CD4+ T cell population with cytotoxic activity have been identified, indicating that CD4+ cells can obtain cytotoxic functions.
進行性メラノーマ マウス モデルでは、細胞傷害活性を持つ腫瘍反応性 CD4+ T 細胞集団の発生が確認されており、CD4+ 細胞が細胞傷害機能を獲得できることが示されています。
The potential cytotoxicity of CD4+ T cells has been highlighted by Cachot et al., demonstrating a CD4+ tumor-specific cytotoxic T cell population in cancer patients by mining single-cell RNA-sequencing datasets.
CD4+ T 細胞の潜在的な細胞傷害性は Cachot らによって強調されており、単一細胞 RNA シーケンス データセットをマイニングすることにより、がん患者における CD4+ 腫瘍特異的細胞傷害性 T 細胞集団を示しています。
The mechanisms behind CD4+ T cell adaptation to cancerous conditions and a possible correlation between cytotoxic CD4+ T cells and T cell exhaustion remains unclear.
CD4+ T 細胞のがん状態への適応の背後にあるメカニズムと、細胞傷害性 CD4+ T 細胞と T 細胞の枯渇との間の相関の可能性は不明のままです。
Likewise, exhaustion in unconventional γδ T cell lineages have been reported but is less investigated than in CD8+ T cells.
同様に、型破りな γδ T 細胞系統の枯渇が報告されていますが、CD8+ T 細胞ほど研究されていません。
The predominant T cell type in the body is αβ T cells (here referred to simply as T cells), and these express αβ TCRs consisting of an α- and a β subunit, while γδ T cells express TCRs consisting of a γ- and a δ subunit.
体内で優勢な T 細胞型は αβ T 細胞 (ここでは単に T 細胞と呼ぶ) であり、これらは α- および β サブユニットからなる αβ TCR を発現します。一方、γδ T 細胞は、γ サブユニットとδサブユニットからなる TCR を発現します。
Studies provides insights in the acquirement of an exhaustion signature by γδ T cell, which has been extensively reviewed by Chen et al.
研究は、Chen らによって広範にレビューされた γδ T 細胞による枯渇サインの獲得に関する洞察を提供します。
Furthermore, it has been reported that γδ T cells can have immunosuppressive functions, imposing immune exhaustion of antitumor αβ T cells through PD-1/PD-L1 signaling.
さらに、γδ T 細胞が免疫抑制機能を持ち、PD-1/PD-L1 シグナル伝達を介して抗腫瘍性 αβ T 細胞の免疫枯渇を引き起こす可能性があることが報告されています。
1.2 The cancer-immunity cycle
To portray the interactions between oncology and immunology, the cancer-immunity cycle has been introduced.
腫瘍学と免疫学の間の相互作用を描写するために、癌免疫サイクルが導入されました。
Cancer cells are defined by genetic and cellular alterations, enabling the immune system to generate T cell responses for recognition and elimination of cancer cells.
がん細胞は、遺伝的および細胞の変化によって定義されます。 免疫系ががん細胞の認識と排除のための T 細胞応答を生成できるようにします。
The cancer-immunity cycle term is used to describe the various necessary steps of T cell-cancer cell interactions, starting from the release of cancer cell antigens.
がん免疫サイクルという用語は、がん細胞抗原の放出から始まる、T 細胞とがん細胞の相互作用に必要なさまざまな段階を表すために使用されます。
The first step of generating an immune response is tumor antigen release from tumor cells.
免疫応答を生成する最初のステップは、腫瘍細胞からの腫瘍抗原の放出です。
Tumor antigens are originally self-antigens, which makes their recognition by the immune system more challenging compared to foreign antigens such as those originating from pathogens.
腫瘍抗原はもともと自己抗原であるため、病原体に由来するものなどの外来抗原と比較して、免疫系による認識がより困難になります。
However, tumor antigens can be recognized by the immune system by distinguishing mutations.
しかし、腫瘍抗原は、変異を区別することによって免疫系によって認識されます。
The higher the mutational burden, the higher the chance of successful recognition by the immune surveillance system.
変異負荷が高いほど、免疫監視システムによる認識が成功する可能性が高くなります。
Antigens released from the tumor site are then trafficked to the blood stream and captured by APCs, which process and present antigens to T cells.
腫瘍部位から放出された抗原は血流に運ばれ、APC によって捕捉されます。抗原を処理して T 細胞に提示します。
Next step involves priming and activation of naïve T cells in LNs.
次のステップでは、LN 内のナイーブ T 細胞のプライミングと活性化が行われます。
APCs present processed tumor antigens to naïve T cells via major histocompatibility complex (MHC) molecules.
APC は、処理された腫瘍抗原を主要組織適合性複合体 (MHC) 分子を介してナイーブ T 細胞に提示します。
Each T cell expresses TCRs, typically consisting of a α and β chain.
各 T 細胞は通常、α 鎖と β 鎖からなる TCR を発現します。
Stochastic V(D)J gene recombination during T cell maturation results in a broad variety of TCRs, estimated to contain 107-108 unique signatures.
T 細胞の成熟中の確率論的 V(D)J 遺伝子組換えにより、107 ~ 108 個の固有のシグネチャが含まれると推定されるさまざまな TCR が生成されます。
Different TCRs recognize different epitopes presented by MHCs on the cell surface of surrounding cells.
異なる TCR は、周囲の細胞の細胞表面上の MHC によって提示される異なるエピトープを認識します。
Binding of specific TCRs to MHC-antigen complexes, leads to activation and proliferation of T cells.
特定の TCR が MHC 抗原複合体に結合すると、T 細胞の活性化と増殖が起こります。
Activated T cells are trafficked to the tumor site via the blood stream guided by chemokine signaling.
活性化された T 細胞は、ケモカイン シグナル伝達によって誘導される血流を介して腫瘍部位に輸送されます。
Chemokines are a subcategory of cytokines providing chemical signals trafficking immune cells to specific destinations.
ケモカインは、免疫細胞を特定の目的地に輸送する化学シグナルを提供するサイトカインのサブカテゴリです。
Infiltration of T cells to tumors is desired, since high levels of cytotoxic T cells in the TME correlates with a positive antitumor response in cancer patients.
TME における高レベルの細胞傷害性 T 細胞は、がん患者における正の抗腫瘍反応と相関するため、T 細胞の腫瘍への浸潤が望まれます。
Via TCR specificity, T cells recognize antigens earlier activated against by APCs in LNs.
TCR 特異性を介して、T 細胞は、LN 内の APC によって以前に活性化された抗原を認識します。
Once TCRs of T cells bind antigens on cancer cells, T cells can kill cancer cells by releasing perforin and granzyme B.
T 細胞の TCR ががん細胞の抗原に結合すると、T 細胞はパーフォリンとグランザイム B を放出してがん細胞を殺すことができます。
Killing of cancer cells triggers release of more antigens, leading to further immune responses, and so the cancer-immunity cycle continues.
がん細胞を殺すと、より多くの抗原が放出され、さらなる免疫応答が引き起こされるため、がん免疫サイクルが継続します。
2 Exhausted T cells in the cancer-immunity cycle
2.1 Priming of tumor-specific T cell activation and exhaustion in lymph nodes
2.1 リンパ節における腫瘍特異的 T 細胞の活性化と枯渇のプライミング
The draining lymph node is the first site of APC-T cell interaction.
所属リンパ節は、APC-T 細胞相互作用の最初の部位です。
Antitumor T cell response-efficacy is dependent on the quality of antigen presentation and possible immunosuppressive conditions of the microenvironment.
抗腫瘍 T 細胞応答の有効性は、抗原提示の質と微小環境の免疫抑制条件に依存します。
Tissue-derived soluble antigens in lymphatic fluid flow into LNs via afferent lymphatic vessels.
リンパ液中の組織由来の可溶性抗原は、輸入リンパ管を介してLNに流れ込みます。
Antigens are captured by LN resident and migratory dendritic cells (DCs) and transported to the LN cortex and paracortex for antigen presentation to T cells.
抗原は、LN常駐および移動性樹状細胞 (DC) によって捕捉され、T 細胞への抗原提示のために LN 皮質および副皮質に輸送されます。
Cross-presentation of DC internalized tumor antigens to CD8+ T cells is a key step for priming antitumor immunity.
DC 内在化腫瘍抗原の CD8+ T 細胞への交差提示は、抗腫瘍免疫をプライミングするための重要なステップです。
Presence of antigens is necessary for adaptive immune responses, and the continuous stimulation by tumor-derived antigens can be considered critical giving the ongoing evolution and accumulation of mutations in tumor cells.
抗原の存在は適応免疫応答に必要であり、腫瘍由来抗原による継続的な刺激は、腫瘍細胞における進行中の進化と突然変異の蓄積を与える上で重要であると考えることができます。
However, it has been shown that one of the main factors behind T cell exhaustion is prolonged, consistent antigen stimulation, indicating that the factors making robust immune responses against tumor cells possible are also the ones assumed to be dampening immune responses in form of T cell exhaustion.
しかし、T 細胞枯渇の背後にある主な要因の 1 つは、長期にわたる一貫した抗原刺激であることが示されています。 腫瘍細胞に対する強力な免疫応答を可能にする要因は、T細胞枯渇の形で免疫応答を弱めていると考えられる要因でもあることを示しています。
Antigenic peptides with a low mutational burden deliver weaker TCR signals, and are thus less potent to induce an immune response but might also be less potent drivers of T cell exhaustion.
変異量が少ない抗原ペプチドは、TCR シグナルが弱いため、免疫応答を誘導する能力が低くなりますが、T 細胞枯渇のドライバーとしての能力も低くなる可能性があります。
Weak TCR signaling combined with lack of co-stimulation rather leads to T cell anergy than exhaustion, an extended hyporesponsive state considered a tolerance mechanism.
共刺激の欠如と組み合わされた弱いTCRシグナル伝達は、枯渇よりもむしろT細胞アネルギー(応答欠如)につながります。
Dysfunction in form of anergy is induced rapidly after antigen stimulation, while exhaustion is developed progressively over a period of weeks to months.
アネルギーの形での機能不全は、抗原刺激後に急速に誘発されますが、枯渇は数週間から数ヶ月かけて徐々に進行します。
Studies provide evidence of the maintenance of a stem-like TCF-1+ CD8+ exhausted T cell reservoir in tumor-draining lymph nodes (TDLNs), and these stem-like exhausted T cells are necessary for long-term T cell responses and efficacy of immunotherapy.
研究は、幹様 TCF-1+ CD8+ 枯渇 T 細胞リザーバーが腫瘍流出リンパ節 (TDLN) に維持されていることの証拠を提供します。そして、これらの幹のように枯渇した T 細胞は、長期的な T 細胞応答と免疫療法の有効性に必要です。
Data suggests that T cells differentiate towards a stem-like exhausted state in LNs, becoming prepared for migration towards tumor sites.
データは、T細胞がLNで幹のような枯渇状態に向かって分化し、腫瘍部位への移動の準備を整えることを示唆しています。
Studies propose that activated CD8+ T cells in human TDLNs are precursors to tumor-resident stem-like CD8+ T cells.
研究では、ヒト TDLN の活性化 CD8+ T 細胞は、腫瘍常在幹様 CD8+ T 細胞の前駆体であることが提唱されています。
Prokhnevska et al. used murine tumor models to reveal that tumor-specific CD8+ T cells in TDLNs were activated, but lacked an effector phenotype.
Prokhnevska らは、マウス腫瘍モデルを使用して、TDLN 内の腫瘍特異的 CD8+ T 細胞が活性化されているが、エフェクター表現型を欠いていることを明らかにしました。
When the tumor-specific stem-like CD8+ T cells migrated into the tumor, effector differentiation was driven by additional co-stimulation by APCs in the TME.
腫瘍特異的な幹様 CD8+ T 細胞が腫瘍内に移動すると、TME 内の APC による追加の共刺激によってエフェクターの分化が促進されました。
This tumor-specific CD8+ T cell activation model proposes a two-step activation: initial activation in TDLNs and additional co-stimulation in the tumor, resulting in subsequent effector program acquisition.
この腫瘍特異的 CD8+ T 細胞活性化モデルでは、2 段階の活性化が提案されています。TDLN での最初の活性化と、腫瘍での追加の共刺激であり、その後のエフェクター プログラムの獲得につながります。
Stem-like CD8+ T cells are also referred to as progenitor exhausted T cells (TPEX), and characterized to be TCF-1+, CXCR5+, PD-1int and TIM-3-.
幹様 CD8+ T 細胞は、前駆細胞枯渇 T 細胞 (TPEX) とも呼ばれ、TCF-1+、CXCR5+、PD-1int、および TIM-3- であると特徴付けられます。
Lugli et al. describes T-PEX cells as partially memory, effector, and exhausted T cells.
Lugliらは、TPEX細胞を部分的にメモリー、エフェクター、および枯渇したT細胞と表現しています。
TPEX cells retain memory-like gene expression and preferentially localize in lymphoid tissues, but also display traits ascribed to effector-like T cells.
TPEX 細胞は記憶様遺伝子発現を保持し、リンパ組織に優先的に局在しますが、エフェクター様 T 細胞に起因する形質も示します。
Upon antigen stimulation, TCF-1+ T cells have shown contradictory IFN-γ production capacity.
抗原刺激により、TCF-1+ T 細胞は相反する IFN-γ 産生能力を示しました。
Some studies display increased IFN-γ production by TCF-1+ TPEX cells compared to TCF-1- terminally exhausted T cells, while other studies have shown greater production of IFN-γ by terminally exhausted T cells than TPEX cells after in vitro stimulation.
いくつかの研究は、TCF-1-末端枯渇T細胞と比較して、TCF-1+ TPEX細胞によるIFN-γ産生の増加を示しています。一方、他の研究では、in vitro 刺激後の TPEX 細胞よりも終末期に枯渇した T 細胞による IFN-γ の産生が多いことが示されています。
T cell exhaustion has been well characterized in chronic infections in lymphocytic choriomeningitis virus (LCMV) models.
T 細胞の枯渇は、リンパ球性脈絡膜髄膜炎ウイルス (LCMV) モデルの慢性感染症でよく特徴付けられています。
In a LCMV-model study by Im et al., a distinct CXCR5+ LCMV glycoprotein 33–41 epitope (GP33)-specific CD8+ T cell population was found in the spleens of mice chronically infected with the LCMV clone 13 strain.
Im らによる LCMV モデル研究では、明確な CXCR5+ LCMV 糖タンパク質 33-41 エピトープ (GP33) 特異的 CD8+ T 細胞集団が、LCMV クローン 13 株に慢性的に感染したマウスの脾臓で発見されました。
In contrast, in mice infected with the LCMV Armstrong strain having cleared the infection, GP33-specific memory CD8+ T cells did not express CXCR5.
対照的に、感染が解消されたLCMVアームストロング株に感染したマウスでは、GP33特異的メモリーCD8 + T細胞はCXCR5を発現しませんでした。
The study showed that during early phase chronic infection, both CXCR5+ and CXCR5- CD8+ T were found in the blood, but at later stages on infection (day 30 onwards), only the CXCR5−CD8+ T cells were found in the blood.
この研究では、慢性感染の初期段階では、CXCR5+ と CXCR5- CD8+ T の両方が血液中に検出されましたが、感染の後期段階 (30 日目以降) では、CXCR5-CD8+ T 細胞のみが血中に検出されたことが示されました。
In the same study, the CXCR5+Tim-3− subset displayed to be TCF-1+ whereas the CXCR5−TIM-3+ cells were TCF1−.
同じ研究で、CXCR5+Tim-3- サブセットは TCF-1+ であることが示されましたが、CXCR5-TIM-3+ 細胞は TCF1- でした。
Lymphoid tissue resident T cells were characterized by TCF-1 expression, while mainly TCF-1-negative cells were found in the periphery.
リンパ組織常在 T 細胞は TCF-1 発現によって特徴付けられましたが、主に TCF-1 陰性細胞は末梢に見られました。
Dammeijer et al. used LNs of ovalbumin (OVA)-expressing AE17 mesothelioma tumor mouse models to analyze the frequencies and phenotype of tumor antigen-specific CD8+ T cells.
Dammeijer らは、オボアルブミン (OVA) 発現 AE17 中皮腫腫瘍マウスモデルの LN を使用して、腫瘍抗原特異的 CD8+ T 細胞の頻度と表現型を分析しました。
The study revealed that TDLN-localized tumor-specific PD-1+CD8+ T cells are capable of effectively initiate antitumor immune responses following TDLN-targeted PD-L1-blockade.
この研究では、TDLN に局在する腫瘍特異的な PD-1+CD8+ T 細胞が、TDLN を標的とした PD-L1 遮断後に抗腫瘍免疫応答を効果的に開始できることが明らかになりました。
Following PD-L1-blockade, TDLN-resident T cells induced TPEX cell accumulation at the tumor site, resulting in improved tumor control.
PD-L1 遮断後、TDLN 常駐 T 細胞は腫瘍部位で TPEX 細胞の蓄積を誘導し、腫瘍制御が改善されました。
These findings support the pivotal role of progenitor exhausted T cells in LNs as an extra-tumoral source of antitumor T cell activity.
これらの発見は、抗腫瘍 T 細胞活性の腫瘍外供給源としての LN における前駆細胞枯渇 T 細胞の極めて重要な役割を支持しています。
These data indicate that the exhaustion journey of T cells is initiated already in the lymph nodes, preparing for later terminal stages of exhaustion (Figure 2).
これらのデータは、T 細胞の枯渇の旅がリンパ節ですでに開始されており、後の末期の枯渇に備えていることを示しています (図 2)。
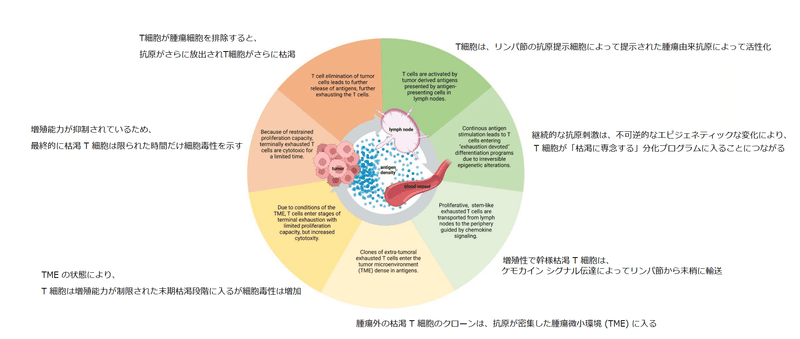
The antigen density in lymph nodes might be enough to initiate exhaustion of T cells, but not enough to promote terminal differentiation of exhausted T cells.
リンパ節の抗原密度は、T 細胞の枯渇を開始するには十分かもしれませんが、枯渇した T 細胞の最終分化を促進するには十分ではありません。
Hence, TCF-1+CD8+ TPEX cells migrating from lymph nodes to tumor sites provide a therapeutic window for maintaining a proliferative T cell population and possibly preventing differentiation of a terminal exhausted state of T cells.
したがって、リンパ節から腫瘍部位に移動する TCF-1+CD8+ TPEX 細胞は、増殖性 T 細胞集団を維持し、おそらく T 細胞の最終枯渇状態の分化を防ぐための治療域を提供します。
2.2 Migration of exhaustion committed T cells from lymph nodes to tumor sites
2.2 リンパ節から腫瘍部位への枯渇型 T 細胞の移動
Activated T cells are trafficked to tumor sites via the blood stream guided by chemokine signaling (Figure 2).
活性化された T 細胞は、ケモカイン シグナル伝達によって誘導される血流を介して腫瘍部位に輸送されます (図 2)。

Chemokines are secreted by various cell types in the TME, including tumor cells and immune cells.
ケモカインは、腫瘍細胞や免疫細胞など、TME 内のさまざまな細胞から分泌されます。
Loss of CCR7, a lymph node homing chemokine receptor, allows effector T cells to migrate to non-lymphoid tissues, and chemokines associated with tumor homing of T cells attract T cells to the TME.
リンパ節ホーミング ケモカイン受容体である CCR7 の喪失により、エフェクター T 細胞が非リンパ組織に移動することが可能になります。T細胞の腫瘍ホーミングに関連するケモカインは、T細胞をTMEに引き寄せます。
CXCL9, CXCL10 and CCL5 are positively associated with immune cell infiltration to tumors, and likewise CX3CL1, CCL3, CCL4, CCL11, and CXCL11 have been associated with T cell infiltration.
CXCL9、CXCL10、および CCL5 は腫瘍への免疫細胞の浸潤と正の関連があり、同様に CX3CL1、CCL3、CCL4、CCL11、および CXCL11 は T 細胞の浸潤と関連しています。
Most chemokine profiles described above are inducible by IFN-γ, which is one of the key proinflammatory molecules secreted by effector T cells.
上記のほとんどのケモカイン プロファイルは、エフェクター T 細胞によって分泌される主要な炎症性分子の 1 つである IFN-γ によって誘導されます。
Presence of activated T cells secreting IFN-γ in the TME cause a positive feedback loop, since IFN-γ leads to production of various chemokines attracting T cells to tumors.
TME に IFN-γ を分泌する活性化 T 細胞が存在すると、IFN-γ が T 細胞を腫瘍に誘引するさまざまなケモカインの産生につながるため、正のフィードバック ループが発生します。
T cells reaching terminal exhaustion and thus produce less IFN-γ, could possibly interfere with the positive feedback loop and reduce T cell attraction to the TME.
T 細胞が終末期に達し、したがって IFN-γ の産生が減少すると、正のフィードバック ループが妨害され、TME への T 細胞の誘引が減少する可能性があります。
T cell trafficking is facilitated by dynamic associations between T cells, endothelial cells, and adhesion molecules.
T 細胞の細胞輸送は、T 細胞、内皮細胞、および接着分子間の動的な関連付けによって促進されます。
Lymphocyte function-associated antigen-1 (LFA-1) is an adhesion molecule expressed by activated T cells.
リンパ球機能関連抗原-1 (LFA-1) は、活性化 T 細胞によって発現される接着分子です。
Binding of LFA-1 to its ligand ICAM-1 expressed by endothelial cells, APCs and tumor cells, facilitates endothelium adhesion, prolonged contact with APCs, and tumor cell binding.
内皮細胞、APC、および腫瘍細胞によって発現されるリガンド ICAM-1 への LFA-1 の結合は、内皮接着、APC との長時間の接触、および腫瘍細胞結合を促進します。
Hence, LFA-1-ICAM-1 interactions can impact the cancer-immunity cycle from beginning to end.
したがって、LFA-1-ICAM-1 相互作用は、がん免疫サイクルの最初から最後まで影響を与える可能性があります。
In lymph nodes, ICAM-1 expression on APCs is essential to guide T cell migration throughout the lymph node, and LFA-1-ICAM-1 engagement is necessary for complete T cell activation and differentiation.
リンパ節では、APC での ICAM-1 の発現は、リンパ節全体の T 細胞の移動を誘導するために不可欠であり、LFA-1-ICAM-1 の関与は、完全な T 細胞の活性化と分化に必要です。
Studies have investigated the effect of PD-1/PD-L1 immune checkpoint blockade (ICB) on adhesion molecule expression and T cell motility.
研究では、PD-1/PD-L1 免疫チェックポイント遮断 (ICB) が接着分子の発現と T 細胞の運動性に及ぼす影響が調査されています。
In chronic infection LCMV models, exhausted T cells had reduced motility capacity, and PD-1 blockade was observed to restore T cell motility leading to increased clearance of viruses.
慢性感染 LCMV モデルでは、枯渇T 細胞は運動能力が低下し、PD-1 遮断により T 細胞の運動性が回復し、ウイルスのクリアランスが増加することが観察されました。
Whether the same applies for PD-1/PD-L1 blockade in tumor models remains to be investigated.
同じことが腫瘍モデルの PD-1/PD-L1 遮断にも当てはまるかどうかはまだ調査されていません。
Several studies provide evidence that anti-PD-1 ICB treatment drives peripheral T cell expansion and recruitment of de novo responses.
いくつかの研究は、抗 PD-1 ICB 治療が末梢 T 細胞の増殖と de novo 応答の動員を促進するという証拠を提供しています。
A study by Nagasaki et al. underlines that clonotypes in exhausted tumor infiltrating lymphocyte (TIL) populations rarely overlap with non-exhausted peripheral blood leukocytes (PBLs), indicating that TDLNs might be the primary source of newly infiltrating exhausted T cells in clusters promoted by PD-1 blockade.
Nagasaki らによる研究は、枯渇した腫瘍浸潤リンパ球 (TIL) 集団のクロノタイプが、枯渇していない末梢血白血球 (PBL) とめったに重複しないことを強調している。 TDLNが、PD-1遮断によって促進されたクラスター内に新たに浸潤する枯渇T細胞の主要な供給源である可能性があることを示しています。
Similar conclusions were made by Yost et al., providing evidence that both pre-existing and new CD8+ T cell clones infiltrate tumors following PD-1 blockade.
Yost らによって同様の結論が下され、既存の CD8+ T 細胞クローンと新しい CD8+ T 細胞クローンの両方が PD-1 遮断後に腫瘍に浸潤するという証拠が得られました。
Beltra et al. have identified two distinct circulating states of exhausted T cells: TCF1+CD69- Texprog2 and TCF1-CD69-T-bethi Texint.
Beltra らは、消耗した T 細胞の 2 つの異なる循環状態を特定しました: TCF1+CD69-Texprog2 および TCF1-CD69-T-bethi Texint。
The Texint population expanded upon PD-1 pathway blockade, but ultimately differentiated into a TCF1-CD69+Eomeshi terminally exhausted subset.
Texint 集団は、PD-1 経路の遮断によって拡大しましたが、最終的には TCF1-CD69+Eomeshi 末期枯渇サブセットに分化しました。
Upon PD-L1 blockade, TCF1+CD69+ Texprog1 and TCF1-CD69+ Texterm cells increased 2.1- and 2.2-fold, while Texprog2 and Texint accumulated heavily and increased 17- and 10-fold.
PD-L1 遮断により、TCF1+CD69+ Texprog1 および TCF1-CD69+ Texterm 細胞は 2.1 倍および 2.2 倍に増加しましたが、Texprog2 および Texint は大量に蓄積し、17 倍および 10 倍に増加しました。
Results of these studies call attention to circulating exhausted T cells as the main source of expanding T cells upon ICB treatment.
これらの研究の結果は、ICB 治療時に T 細胞を増殖させる主な供給源として循環する枯渇 T 細胞に注意を喚起します。
Studies have described a shift from precursor to terminally exhausted T cell as T cells migrate from the lymphoid tissues to the tumor site.
研究では、T 細胞がリンパ組織から腫瘍部位に移動するにつれて、T 細胞の前駆体から最終的に枯渇した T 細胞へのシフトが説明されています。
During this shift a change in transcriptional programs inducing expression alterations of transcription factors BATF, IRF4, NR4A, EOMES, NFATC1 and TOX have been identified.
このシフト中に、転写因子 BATF、IRF4、NR4A、EOMES、NFATC1、および TOX の発現変化を誘発する転写プログラムの変化が特定されています。
Especially TOX have been reported as a critical TF for exhaustion development and differentiation.
特にTOXは、枯渇の発生と分化に重要なTFとして報告されています。
TOX expression correlates with an exhausted transcriptional program of T cells, including co-expression of PD-1, TIM-3, and CD244.
TOX 発現は、PD-1、TIM-3、および CD244 の共発現を含む、T 細胞の枯渇した転写プログラムと相関しています。
Interestingly, deletion of TOX lead to chromatin inaccessible gene regions coding for the IRs Pdcd1, Entpd1, Havcr2, Cd244 and Tigit and thus reduced IR expression.
興味深いことに、TOXの削除は、IRのPdcd1、Entpd1、Havcr2、Cd244、およびTigitをコードするクロマチンにアクセスできない遺伝子領域につながり、したがってIR発現を減少させました。
Even though TOX-deleted T cells showed reduced IR expression, they have been observed to be dysfunctional in terms of effector functions such as cytokine release.
TOX 欠失 T 細胞は IR 発現の低下を示しましたが、サイトカイン放出などのエフェクター機能に関して機能不全であることが観察されています。
2.3 Infiltration of exhausted T cells to the TME and functions of T cells in the TME
2.3 枯渇T細胞のTMEへの浸潤とTMEにおけるT細胞の機能
2.3.1 T cell tumor infiltration and cytotoxicity
2.3.1 T細胞腫瘍の浸潤と細胞毒性
Studies provide evidence of pre-existing TILs having limited reinvigoration potential following ICB treatment, and the majority of ICB responsive cells originating from outside tumors.
研究は、ICB治療後の再活性化の可能性が限られている既存のTIL、および腫瘍の外側に由来するICB応答細胞の大部分の証拠を提供します。
Profiling of T cells in human basal and squamous cell carcinomas prior and post anti-PD-1 treatment displayed a more robust clonal expansion of CD8+ T cell with an exhausted phenotype compared to other TIL populations.
抗 PD-1 治療前後のヒト基底細胞がんおよび扁平上皮がんにおける T 細胞のプロファイリングは、他の TIL 集団と比較して、枯渇表現型 CD8+ T 細胞のより強いクローン増殖を示しました。
Additionally, clonal expansion of T cells in response to immunotherapy was derived from extra-tumoral clones of T cells, and the effect was specific to T cells characterized as exhausted.
さらに、免疫療法に応答した T 細胞のクローン増殖は、T 細胞の腫瘍外クローンに由来し、その効果は枯渇したと特徴付けられる T 細胞に特異的でした。
This study demonstrates a tumor infiltration capacity of particularly exhausted T cells.
この研究は、特に枯渇 T 細胞の腫瘍浸潤能力を示しています。
However, where on the exhaustion continuum such capacity is at its most optimal remains to be investigated.
ただし、枯渇の連続体のどこでそのような能力が最も最適であるかは、まだ調査されていません。
TPEX CD8+ TILs are able to control tumor growth and can respond to anti-PD-1 therapy, while terminally exhausted TILs cannot.
TPEX CD8+ TIL は腫瘍増殖を制御でき、抗 PD-1 療法に反応できますが、末期枯渇TIL は反応しません。
As pre-existing TILs characterized as terminally exhausted have been considered resistant to ICB immunotherapy, recent studies have investigated whether these terminally exhausted T cells are involved in generation of an immunosuppressive TME.
末期枯渇として特徴付けられる既存の TIL は ICB 免疫療法に耐性があると考えられているため、最近の研究では、これらの末期枯渇 T 細胞が免疫抑制 TME の生成に関与しているかどうかが調査されています。
Vignali et al. have identified intratumoral CD8+ terminally exhausted T cells with transcriptional features of CD4+Foxp3+ regulatory T (Treg) cells and show that these cells are capable of directly suppressing T cell proliferation ex vivo.
Vignaliらは、CD4+Foxp3+制御性T(Treg)細胞の転写機能を持つ腫瘍内CD8+終末枯渇T細胞を同定し、これらの細胞がエクスビボでT細胞増殖を直接抑制できることを示しています。
Eradication of tumor cells can be considered the final goal of the cancer-immunity cycle.
腫瘍細胞の根絶は、がん免疫サイクルの最終目標と考えることができます。
Cytotoxic mechanisms of T cells rely on two distinct pathways: the perforin-granzyme-induced apoptosis pathway (granule exocytosis) and Fas/Fas ligand (FasL) pathway (death ligands).
T 細胞の細胞毒性メカニズムは、パーフォリン グランザイム誘導アポトーシス経路 (顆粒エキソサイトーシス) と Fas/Fas リガンド (FasL) 経路 (死リガンド) の 2 つの異なる経路に依存しています。
Out of these two pathways, granule exocytosis is considered the main pathway to eliminate cancer cells.
これら 2 つの経路のうち、顆粒エキソサイトーシスは、がん細胞を排除するための主要な経路と考えられています。
Perforin is a pore-forming protein facilitating the delivery of granzymes into target cells, and granzymes belong to a family of serine proteases known for mediating cytotoxic T cell elimination of infected cells and tumor cells.
パーフォリンは、標的細胞へのグランザイムの送達を促進する細孔形成タンパク質であり、グランザイムは、感染細胞および腫瘍細胞の細胞傷害性 T 細胞除去を媒介することが知られているセリンプロテアーゼのファミリーに属します。
A study by Wu et al. demonstrated defects in CD8+ TIL perforin expression in colorectal cancer (CRC), even though these cells stored the highest levels of granzyme B.
Wu らによる研究は、結腸直腸癌 (CRC) における CD8+ TIL パーフォリン発現の欠陥を示しましたが、これらの細胞は最高レベルのグランザイム B を保存していました。
Furthermore, PD-1 expression correlated with impaired perforin production, and the intact perforin expression was restricted to tumor resident T cells.
さらに、PD-1 発現はパーフォリン産生障害と相関し、無傷のパーフォリン発現は腫瘍内在 T 細胞に限定されていました。
Yan et al. have identified an effector memory phenotype PD-1+CXCR1+ CD8+ T cells population able to withstand chemotherapy and expand after chemo immunotherapy with cytolytic activity, defined by granzyme B and perforin release.
Yanらは、エフェクターメモリー表現型PD-1+CXCR1+CD8+T細胞集団を同定し、化学療法に耐え、化学免疫療法後に増殖し、グランザイムBとパーフォリンの放出によって定義される細胞溶解活性を示しました。
Hurkmans et al. studied granzyme B serum levels in metastatic non-small cell lung cancer (NSCLC) patients post PD-1 blockade by Nivolumab.
Hurkmans らは、ニボルマブによる PD-1 遮断後の転移性非小細胞肺癌 (NSCLC) 患者のグランザイム B 血清レベルを研究しました。
Lower serum levels of granzyme B correlated with worse clinical outcome, and interestingly, serum levels of granzyme B positively correlated with peripheral abundance of T cell populations expressing PD-1 and TIM-3.
グランザイム B の血清レベルの低下は、臨床転帰の悪化と相関し、興味深いことに、グランザイム B の血清レベルは、PD-1 および TIM-3 を発現する T 細胞集団の末梢存在量と正の相関を示しました。
Together these findings show sustained and elevated granzyme B release capacity of exhausted T cells, while perforin production remains questionable.
まとめると、これらの発見は、枯渇した T 細胞のグランザイム B 放出能力が持続的かつ上昇していることを示していますが、パーフォリンの産生には疑問が残ります。
It is widely assumed that both perforin and granzyme B are necessary for efficient cytotoxicity of T cells.
パーフォリンとグランザイム B の両方が T 細胞の効率的な細胞毒性に必要であると広く考えられています。
Interestingly, perforin knockout OT-I T cells have been shown to efficiently kill MC38Ova and B16Ova cells in prolonged presence (>18 hours) of antigens, indicating cytolytic activity of T cells in absence of perforin.
興味深いことに、パーフォリン ノックアウト OT-I T 細胞は、抗原の長時間の存在下 (>18 時間) で MC38Ova および B16Ova 細胞を効率的に殺すことが示されており、パーフォリンの非存在下での T 細胞の細胞溶解活性を示しています。
The Fas/FasL pathway plays an essential role in regulating apoptosis and T cell activation.
Fas/FasL 経路は、アポトーシスと T 細胞活性化の調節に重要な役割を果たします。
The Fas/FasL signaling in exhausted antigen-specific CD8+ T cells during tumor immune response have been studied in C57BL/6 mice inoculated with EG.7.
腫瘍免疫応答中の枯渇した抗原特異的 CD8+ T 細胞における Fas/FasL シグナル伝達は、EG.7 を接種した C57BL/6 マウスで研究されています。
The study showed that the number of activated antigen-specific CD8+ T cells decreased via apoptosis during prolonged tumor immune responses, but the number of T cells in FasL-dysfunctional gld mice were higher than in control mice.
この研究は、活性化された抗原特異的 CD8+ T 細胞の数が、長期の腫瘍免疫応答中にアポトーシスを介して減少することを示しましたが、FasL 機能不全 gld マウスの T 細胞の数は、対照マウスよりも高かったです。
Thus, the Fas/FasL signaling pathway is critical for survival of exhausted CD8+ T cells during tumor immune response.
したがって、Fas/FasL シグナル伝達経路は、腫瘍免疫応答中の枯渇した CD8+ T 細胞の生存に重要です。
In chronic infection LCMV mice models, the FasL mRNA expression is reported to be substantially elevated in exhausted CD8+ T cells compared to naive, effector, and memory CD8+ T cells, and the Fas/FasL pathway is discussed to provide alternate cytolytic mechanisms during chronic infection.
慢性感染 LCMV マウス モデルでは、FasL mRNA 発現は、ナイーブ、エフェクター、およびメモリー CD8+ T 細胞と比較して、枯渇した CD8+ T 細胞で大幅に上昇することが報告されており、Fas/FasL 経路は、慢性感染中に代替の細胞溶解メカニズムを提供することが議論されています。
In CD8+ T cells specific for chronic persistent virus (HIV), PD-1 expression has been observed to be associated with spontaneous and Fas-induced apoptosis.
慢性持続性ウイルス (HIV) に特異的な CD8+ T 細胞では、PD-1 発現が自発的および Fas 誘導性アポトーシスと関連していることが観察されています。
Studies provide insights of an altered Fas/FasL pathway in exhausted T cells, but the precise outcomes of these alterations in cancerous conditions remain to be investigated.
研究により、枯渇した T 細胞における Fas/FasL 経路の変化についての洞察が得られますが、がん状態におけるこれらの変化の正確な結果はまだ調査されていません。
Studies describe various ICAM-expression levels by exhausted T cells, and its impact on tumor eradication remains unclear.
研究では、枯渇 T 細胞によるさまざまな ICAM 発現レベルが説明されており、その腫瘍根絶への影響は不明のままです。
LFA-1-ICAM-1 binding enables T cell-tumor cell binding prior to contact killing by cytotoxic elimination.
LFA-1-ICAM-1 結合は、細胞傷害性除去による接触死滅の前に T 細胞と腫瘍細胞の結合を可能にします。
The importance of proper immune synapse formation prior to target cell elimination has been highlighted in cancer models of hematological malignancies.
標的細胞を排除する前の適切な免疫シナプス形成の重要性は、血液悪性腫瘍の癌モデルで強調されています。
Ramsay et al. show that F-actin polymerization was suppressed upon T cell chronic lymphocytic leukemia (CLL)-B cell encounter, leading to impaired immune synapse formation, and hindered antitumor activity.
Ramsayらは、T細胞慢性リンパ球性白血病(CLL)-B細胞の遭遇時にF-アクチン重合が抑制され、免疫シナプス形成が損なわれ、抗腫瘍活性が妨げられたことを示しています。
Studies show that loss of ICAM-1 expression as a possible consequence of reduced proinflammatory cytokine production, could lead to elevated granzyme B release.
炎症誘発性サイトカイン産生の減少の結果として考えられる ICAM-1 発現の喪失が、グランザイム B 放出の上昇につながる可能性があることを研究が示しています。
Loss of ICAM-1 expression has been observed to result in elevated levels of IFN-γ and granzyme B, as well as enhanced cytotoxicity.
ICAM-1 発現の喪失は、IFN-γ およびグランザイム B のレベルの上昇、ならびに細胞毒性の増強をもたらすことが観察されています。
T cell activation without classical immune synapse formation but via TCR microclusters has been reported, providing evidence of maintained T cell activation and effector functions regardless expression levels of LFA-1 and ICAM-1.
古典的な免疫シナプス形成を伴わない TCR マイクロクラスターを介した T 細胞活性化が報告されており、LFA-1 および ICAM-1 の発現レベルに関係なく、T 細胞活性化およびエフェクター機能が維持されているという証拠を提供しています。
2.3.2 T cell metabolic activity
2.3.2 T 細胞の代謝活性
To adapt to hypoxic conditions in the TME, T cells undergo a metabolic switch upon activation.
TME の低酸素状態に適応するために、T 細胞は活性化時に代謝スイッチを受けます。
Metabolic reprogramming is essential to meet the increasing energy demand necessary for effector T cell functions.
代謝の再プログラミングは、エフェクター T 細胞の機能に必要なエネルギー需要の増加に対応するために不可欠です。
Naïve T cells exhibit lower energy demands than effector T cells and rely on oxidative phosphorylation (OXPHOS) derived ATP as the main source of energy.
ナイーブ T 細胞は、エフェクター T 細胞よりもエネルギー需要が低く、主なエネルギー源として酸化的リン酸化 (OXPHOS) 由来の ATP に依存しています。
Effector T cells utilize aerobic glycolysis as their primary metabolic program, increasing the glucose uptake and oxidative consumption.
エフェクター T 細胞は、主要な代謝プログラムとして好気性解糖を利用し、グルコースの取り込みと酸化的消費を増加させます。
T cells can also use fatty acids as an energy source, and the use of fatty acid β-oxidation (FAO) pathway is linked to memory T cell differentiation.
T 細胞は脂肪酸をエネルギー源として利用することもでき、脂肪酸 β 酸化 (FAO) 経路の利用はメモリー T 細胞の分化に関連しています。
Furthermore, FAO is an important pathway of survival in metabolically stressed cells, and Tregs generally rely upon FAO for their metabolic needs.
さらに、FAO は代謝的にストレスを受けた細胞における重要な生存経路であり、Treg は通常、代謝の必要性を FAO に依存しています。
The metabolic plasticity and regulation of T cell exhaustion has been extensively reviewed by Li et al., focusing on T cell exhaustion in chronic infections.
代謝の可塑性と T 細胞枯渇の調節は、慢性感染症における T 細胞枯渇に焦点を当てて、Li らによって広範にレビューされています。
FAO and OXPHOS are discussed to be the primary energy sources for TPEX, while terminally exhausted T cells rely on glycolytic metabolism, but having reduced glucose uptake and an inability to effectively utilize OXPHOS to provide energy.
FAO と OXPHOS は TPEX の主要なエネルギー源であると考えられていますが、末期に枯渇した T 細胞は解糖代謝に依存していますが、グルコースの取り込みが減少し、OXPHOS を効果的に利用してエネルギーを供給することができません。
The high consumption of glucose by cancer cells creates glucose derivatized, acidic extracellular conditions in the TME, caused by lactate accumulation known to suppress the proliferation and effector functions of cytotoxic T cells.
癌細胞によるグルコースの大量消費は、TME でグルコース誘導体化された酸性の細胞外条件を作り出します。 細胞傷害性 T 細胞の増殖とエフェクター機能を抑制することが知られている乳酸の蓄積によって引き起こされます。
Effector T cells exhibit decreased mitochondrial respiratory activity, and studies show exhausted T cells exhibiting suppressed glycolysis and mitochondrial respiration, causing poor metabolic fitness and exhaustion.
エフェクター T 細胞は、ミトコンドリアの呼吸活動の低下を示し、枯渇 T 細胞は、解糖とミトコンドリアの呼吸が抑制され、代謝能力の低下と疲労を引き起こすことが研究で示されています。
A study by Chang et al. displays the role of aerobic glycolysis as a metabolically regulated signaling mechanism, and activated T cells blocked from aerobic glycolysis have a compromised ability to produce IFN-γ, possible explaining decreased IFN-γ production of terminally exhausted T cells in the TME.
Chang らによる研究は、好気性解糖の役割を代謝的に調節されるシグナル伝達メカニズムとして示しており、好気性解糖からブロックされた活性化 T 細胞は IFN-γ を産生する能力が損なわれています。 TME内の最終的に枯渇したT細胞のIFN-γ産生の減少を説明できる可能性があります。
A study by Scharping et al. point out that progressive loss of mitochondrial function and mass correlates with decreased cytokine production in solid tumor infiltrating T cells.
Scharping らによる研究は、ミトコンドリアの機能と質量の進行性の喪失が、固形腫瘍浸潤 T 細胞におけるサイトカイン産生の減少と相関していることを指摘しています。
Expression of the glucose transporter-1 (Glut1) has been observed to increase in PD-1hi exhausted T cells in hepatitis B virus (HBV) chronic infection, and these cells were dependent on glucose supplies.
グルコース トランスポーター 1 (Glut1) の発現は、B 型肝炎ウイルス (HBV) 慢性感染症の PD-1hi 枯渇 T 細胞で増加することが観察されており、これらの細胞はグルコース供給に依存していました。
In contrast, non-chronic infection cytomegalovirus (CMV)-specific T cells that could utilize OXPHOS in the absence of glucose to optimize their energy supply.
対照的に、非慢性感染サイトメガロ ウイルス (CMV) 特異的 T 細胞は、グルコースの非存在下で OXPHOS を利用してエネルギー供給を最適化できます。
Similar metabolic deficiencies in exhausted T cells have not yet been investigated in tumor models.
枯渇した T 細胞における同様の代謝欠損は、腫瘍モデルではまだ調査されていません。
The metabolism of T cells has been studied in murine melanoma models, and a positive correlation between immune checkpoints expression levels on CD8+ T cells and total cholesterol content in the cells has been observed.
T 細胞の代謝は、マウス黒色腫モデルで研究されており、CD8+ T 細胞の免疫チェックポイント発現レベルと細胞内の総コレステロール含有量との間に正の相関が観察されています。
Lung B16 tumor-infiltrating PD-1+high2B4high CD8 T cells had significantly higher cholesterol content than PD-1med/low2B4 med/lowCD8+ T cells.
肺 B16 腫瘍浸潤 PD-1+high2B4high CD8 T 細胞は、PD-1med/low2B4 med/lowCD8+ T 細胞よりもコレステロール含有量が有意に高かった。
The same pattern was observed in LN and spleen resident T cells, although these cells had significantly lower cholesterol content than the tumor-infiltrating T cells.
同じパターンがLNおよび脾臓常在T細胞で観察されましたが、これらの細胞は腫瘍浸潤T細胞よりもコレステロール含有量が大幅に低かった。
Cholesterol is a tumor metabolic byproduct inducing metabolic stress in T cells, and the study demonstrated that cholesterol in the TME induces CD8+ T cell exhaustion via activation of the endoplasmic reticulum (ER)-stress sensor XBP1.
コレステロールは、T 細胞の代謝ストレスを誘発する腫瘍代謝副産物であり、この研究では、TME のコレステロールが小胞体 (ER) ストレス センサー XBP1 の活性化を介して CD8+ T 細胞の枯渇を誘発することが実証されました。
XBP1 can directly increase PD-1, TIM-3, and LAG-3 expression, thus immunosuppression of T cells.
XBP1 は、PD-1、TIM-3、および LAG-3 の発現を直接増加させることができるため、T 細胞の免疫抑制が可能です。
Patsoukis et al. discovered the incapability of activated T cells to engage in glycolysis upon PD-1 ligation, and their studies show that PD-1 ligation increase the FAO rate.
Patsoukisらは、活性化T細胞がPD-1結紮時に解糖に関与できないことを発見し、彼らの研究は、PD-1結紮がFAO率を増加させることを示しています。
FAO supports T cell persistence, but not necessarily T cell function.
FAO は T 細胞の持続性をサポートしますが、必ずしも T 細胞の機能をサポートするとは限りません。
Altogether these findings support the theory of an altered metabolic program in exhausted T cells, causing altered effector functions, but precise locations and timelines of metabolic switches in exhausted T cells during the cancer-immunity cycle remain to be explored.
全体として、これらの調査結果は、枯渇した T 細胞の代謝プログラムが変化し、エフェクター機能が変化するという理論を支持していますが、癌免疫サイクル中の枯渇した T 細胞の代謝スイッチの正確な位置とタイムラインはまだ調査されていません。
3 T cell exhaustion as a functional adaptation to persistent antigen stimulation
3 持続的な抗原刺激に対する機能的適応としての T 細胞枯渇
T cell exhaustion has been discussed to be an evolutionarily conserved adaptation to chronic antigen stimulation, important for restricting autoreactivity and immunopathology.
T 細胞の枯渇は、慢性的な抗原刺激に対する進化的に保存された適応であり、自己反応性と免疫病理学を制限するために重要であると議論されています。
RNA-sequencing and ATAC-sequencing data generated from circulating T cell subsets from healthy donors show that circulating PD1+ CD39+ T cells had the highest enrichment of tumor exhausted T cell genes, providing transcriptional evidence of recent proliferation and characteristics of intermediate exhausted T cells.
健康なドナーからの循環 T 細胞サブセットから生成された RNA 配列決定および ATAC 配列決定データは、循環 PD1+ CD39+ T 細胞が腫瘍枯渇 T 細胞遺伝子の濃縮度が最も高いことを示しており、中間枯渇 T 細胞の最近の増殖および特性の転写証拠を提供します。
This study provides evidence of circulating exhausted T cell populations present also in healthy donors, suggesting that PD-1+CD39+CD8+ exhausted T cells are not restricted to cancer or chronic infections.
この研究は、健康なドナーにも存在する循環消耗 T 細胞集団の証拠を提供し、PD-1+CD39+CD8+ 消耗 T 細胞が癌や慢性感染症に限定されないことを示唆しています。
Their existence might point towards an alternative fate to deletion for autoreactive T cells, hence enabling a broader diversity of T cell populations, but their precise role in healthy donors remains to be explored.
それらの存在は、自己反応性 T 細胞の欠失とは別の運命を指し示す可能性があり、したがって T 細胞集団のより幅広い多様性を可能にしますが、健康なドナーにおけるそれらの正確な役割はまだ調査されていません。
Galletti et al. have identified two different subsets of human stem-like CD8+ memory T cell progenitors in healthy donors: CCR7+PD-1−TIGIT− stem-like T (TSTEM) cells and CCR7+ PD-1+TIGIT+ T progenitor exhausted T (TPEX) cells.
Gallettiらは、健康なドナーにおけるヒト幹様CD8+メモリーT細胞前駆細胞の2つの異なるサブセットを特定しました:CCR7+PD-1-TIGIT-幹様T(TSTEM)細胞およびCCR7+PD-1+TIGIT+T前駆体枯渇T(TPEX)細胞。
The TPEX population gave rise to a cell linage with reduced functionality compared to TSTEM cells.
TPEX 集団は、TSTEM 細胞と比較して機能が低下した細胞系統を生み出しました。
Interestingly, the TPEX cells had memory-like features, suggesting that exhaustion-like and memory-like characteristics could coexist in healthy individuals.
興味深いことに、TPEX 細胞には記憶のような特徴があり、健康な人には枯渇のような特徴と記憶のような特徴が共存している可能性があることが示唆されました。
This further indicates that T cell exhaustion could be a functional adaption to persistent antigen stimulation aimed at minimizing the risk of immunopathology, and simultaneously maintain a memory-like population.
これはさらに、T細胞の枯渇が、免疫病理のリスクを最小限に抑え、同時に記憶のような集団を維持することを目的とした持続的な抗原刺激に対する機能的適応である可能性があることを示しています。
The role of exhaustion in limiting immunopathology is underlined in a study by McKinney et al., displaying reduced clinical autoimmunity as T cell exhaustion gets more severe.
McKinney らの研究では、免疫病理学を制限する枯渇の役割が強調されており、T 細胞の消耗がより深刻になるにつれて臨床的自己免疫が低下することが示されています。
Expression of members of the transcription factor (TF) family NR4A is regulated downstream of TCR signaling.
転写因子 (TF) ファミリー NR4A のメンバーの発現は、TCR シグナル伝達の下流で調節されます。
Beltra et al. have defined a four-cell-stage developmental framework for exhausted T cells.
Beltra らは、枯渇した T 細胞の 4 細胞段階発生フレームワークを定義しました。
In studies combining motif enrichment analysis with RNA expression, NR4A2 was predicted to be the most enriched TF in terminally exhausted T cells.
モチーフ濃縮分析と RNA 発現を組み合わせた研究では、NR4A2 が末期枯渇 T 細胞で最も濃縮された TF であると予測されました。
TCR stimulation induces expression of the NR4A family, indicating that terminally differentiated exhausted T cells are subjects of heavy TCR signaling.
TCR 刺激は NR4A ファミリーの発現を誘導し、最終的に分化した枯渇 T 細胞が重い TCR シグナル伝達の対象であることを示します。
Nr4a triple knockout (TKO) in CAR T cells have been shown to prolong the survival of tumor-bearing mice, and NR4A inhibition has been pointed out as a promising cancer immunotherapy strategy.
CAR T 細胞における Nr4a トリプル ノックアウト (TKO) は、担癌マウスの生存を延長することが示されており、NR4A 阻害は有望な癌免疫療法戦略として指摘されています。
Expression of mRNAs encoding effector proteins such as granzymes, TNF and IL-2Rα were increased in Nr4a TKO TILs, indicating that dense antigen environments and heavy TCR signaling eventually leads to decreased cytotoxicity of T cells.
グランザイム、TNF、IL-2Rαなどのエフェクタータンパク質をコードするmRNAの発現がNr4a TKO TILで増加したことは、高密度の抗原環境と重いTCRシグナル伝達が最終的にT細胞の細胞毒性の低下につながることを示しています。
Together these findings point out that prolonged antigen-TCR stimulation indeed leads to a terminally exhausted state of T cells and eventual loss of cytotoxicity, limiting the risk of immunopathology but also limiting tumor cell clearance.
まとめると、これらの発見は、長期にわたる抗原-TCR刺激が実際にT細胞の末期疲労状態と最終的な細胞毒性の喪失につながることを指摘しています。免疫病理のリスクを制限するだけでなく、腫瘍細胞のクリアランスも制限します。
These studies draw attention to the importance of eliminating tumor cells within an exhaustion restricted time frame.
これらの研究は、枯渇制限された時間枠内で腫瘍細胞を排除することの重要性に注目を集めています。
Studies suggest that varying tumor types might generate distinct exhaustion patterns in T cells.
研究は、さまざまな腫瘍タイプが T 細胞に異なる枯渇パターンを生成する可能性があることを示唆しています。
Woroniecka et al. performed a study with mouse-implanted SMA-560 malignant glioma, CT2A malignant glioma, E0771 breast medullary adenocarcinoma, B16F10 melanoma, and Lewis Lung Carcinoma (LLC), comparing exhaustion patterns according to cell line.
Woroniecka らは、マウスに移植された SMA-560 悪性神経膠腫、CT2A 悪性神経膠腫、E0771 乳髄腺癌、B16F10 黒色腫、およびルイス肺癌 (LLC) を用いた研究を実施し、細胞株による枯渇パターンを比較しました。
They found distinct functional programs of exhausted T cells depending on tumor type, displaying variations in proinflammatory cytokine production and expression of IRs.
彼らは、腫瘍の種類に応じて枯渇した T 細胞の異なる機能プログラムを発見し、炎症誘発性サイトカインの産生と IR の発現に変化を示しました。
Tumors causing greater functional impairment of T cells showed higher levels of alternative IRs such as TIGIT, CD39 and 2B4, indicating that greater functional impairment indeed provides opportunities for alternative immunotherapy strategies.
T細胞のより大きな機能障害を引き起こす腫瘍は、TIGIT、CD39、2B4などの代替IRのレベルが高いことを示しました。より大きな機能障害が実際に代替免疫療法戦略の機会を提供することを示しています。
Distinct exhaustion programs according to tumor type explains varying response to PD-1 pathway inhibitors, which have shown greatest results in melanoma, NSCLC, RCC, and metastatic bladder cancer.
腫瘍の種類に応じた明確な枯渇プログラムは、黒色腫、NSCLC、RCC、および転移性膀胱癌で最大の結果を示した PD-1 経路阻害剤に対するさまざまな反応を説明しています。
These concluding remarks point out the need to understand not only how T cell exhaustion impacts the cancer-immunity cycle, but the varying T cell exhaustion cycles according to specific tumor types.
これらの結論は、T 細胞枯渇が癌免疫サイクルにどのように影響するかだけでなく、特定の腫瘍タイプに応じてさまざまな T 細胞枯渇サイクルを理解する必要があることを指摘しています。
Distinct exhaustion programs according to tumor type calls attention to the dynamic features of T cell exhaustion, adapting to specific tumor conditions.
腫瘍の種類に応じた明確な枯渇プログラムは、特定の腫瘍状態に適応する T 細胞の枯渇の動的な特徴に注意を喚起します。
As the cancer-immunity cycle points out, the balance between stimulating factors and inhibitors is critical.
がん免疫サイクルが指摘するように、刺激因子と阻害因子のバランスが重要です。
Tumor cells can exploit immune escape mechanisms such as loss of antigenicity, loss of immunogenicity or generation of immunosuppressive microenvironments, to avoid elimination by the immune system.
腫瘍細胞は、抗原性の喪失、免疫原性の喪失、または免疫抑制性微小環境の生成などの免疫逃避メカニズムを利用して、免疫系による排除を回避できます。
In a similar manner, T cell exhaustion could be regarded as an alternative mechanism of the immune system, a tool to control cancer.
同様に、T 細胞の枯渇は、がんを制御するツールである免疫系の代替メカニズムと見なすことができます。
Exhausted T cells aren’t suitable tools for all types of cancer types and conditions, hence having a contrary role, in some circumstances acting as an asset and in some as a liability.
枯渇 T 細胞は、すべての種類のがんの種類と状態に適したツールではないため、状況によっては資産として機能し、一部の状況では負債として機能する、逆の役割を果たします。
4 Potential immunotherapeutic interventions for reinvigoration of exhausted T cells
4 枯渇した T 細胞の再活性化のための潜在的な免疫療法介入
Immune checkpoint blockade (ICB) therapies such as antibodies targeting PD-1, PD-L1, CTLA-4 and LAG-3 aim to activate T cells by interrupting inhibitory signals (Table 1).
PD-1、PD-L1、CTLA-4、LAG-3 をターゲットとする抗体などの免疫チェックポイント遮断 (ICB) 療法は、抑制シグナルを遮断することで T 細胞を活性化することを目的としています (表 1)。
Today, the focus area of controlling T cell exhaustion lies within preventing exhaustion and reactivating already exhausted T cells.
今日、T 細胞の枯渇を制御するための重点領域は、枯渇を防ぎ、すでに枯渇した T 細胞を再活性化することにあります。
Combination with traditional ICBs PD-1, PD-L1 and CTLA-4 and second-generation checkpoint targets such as LAG-3, TIM-3 and TIGIT are being investigated.
従来の ICB PD-1、PD-L1、CTLA-4、および LAG-3、TIM-3、TIGIT などの第 2 世代チェックポイント ターゲットとの組み合わせが検討されています。
Since the first ICB therapy was approved in 2011, the US Food and Drug Administration (FDA) have issued over 65 approvals for 20 types of neoplasms.
最初の ICB 療法が 2011 年に承認されて以来、米国食品医薬品局 (FDA) は 20 種類の新生物に対して 65 以上の承認を発行しています。
Studies from the past decade provide evidence of checkpoint therapies being most efficient when administering in an early state of exhaustion.
過去 10 年間の研究は、チェックポイント療法が枯渇の初期状態で投与する場合に最も効果的であるという証拠を提供しています。
Despite increased knowledge in targeting T cell exhaustion and the large number of FDA approvals, only 20.2% of patients receiving ICBs achieve objective response, and out of these only 13% of patients achieve durable responses for multiple years.
T 細胞枯渇を標的とする知識が増し、多数の FDA 承認が得られたにもかかわらず、ICB を受けた患者の 20.2% だけが客観的な反応を達成し、そのうち 13% の患者だけが複数年にわたって持続的な反応を達成しています。
To improve patient responses, combination therapies with ICBs can be utilized.
患者の反応を改善するために、ICB との併用療法を利用できます。
FDA approved therapies to be combined with ICBs include chemotherapy, radiation, anti-angiogenic agents, cancer vaccines and adoptive cell therapies (ACT).
FDA が承認した ICB との併用療法には、化学療法、放射線、抗血管新生薬、がんワクチン、養子細胞療法 (ACT) などがあります。
Some tumors have been shown particularly challenging to target due to T cell exhaustion.
一部の腫瘍は、T 細胞の枯渇のために標的とするのが特に困難であることが示されています。
Chimeric antigen receptor (CAR) T cells have been proven to be a potent tool for targeting blood cancer, but the dense antigen environment in solid tumor often generates severe exhaustion of these cells, causing restricted efficacy.
キメラ抗原受容体 (CAR) T 細胞は、血液がんを標的とする強力なツールであることが証明されていますが、固形腫瘍の高密度抗原環境は、これらの細胞の深刻な枯渇を引き起こすことが多く、有効性が制限されます。
Studies have shown that combination therapies with ICBs and CAR T cells can improve T cell expansion and tumor reactivity.
研究では、ICB と CAR T 細胞の併用療法が T 細胞の増殖と腫瘍反応性を改善できることが示されています。
To further improve CAR T cell efficacy, studies have targeted the exhaustion inducing transcription factor protein TOX.
CAR T 細胞の有効性をさらに改善するために、研究では枯渇を誘発する転写因子タンパク質 TOX を標的にしています。
TOX is upregulated and co-expressed with PD-1, TIM-3, and CD244 in non-Hodgkin lymphoma, multiple myeloma, and in acute myeloid leukemia patients.
TOX は、非ホジキンリンパ腫、多発性骨髄腫、および急性骨髄性白血病患者においてアップレギュレートされ、PD-1、TIM-3、および CD244 と共発現します。
Depletion of the Tox gene in CAR T cells proved to improve persistence and tumor reactivity in tumor inoculated mice.
CAR T細胞におけるTox遺伝子の喪失は、腫瘍接種マウスにおける持続性と腫瘍反応性を改善することが証明されました。
Recent studies point out the transcription factor MYB as an orchestrator of T cell exhaustion.
最近の研究は、転写因子 MYB が T 細胞枯渇のオーケストレーターであることを指摘しています。
MYB mediates differentiation of a CD62L+ TPEX cell stem-like population.
MYB は、CD62L+ TPEX 細胞幹様集団の分化を媒介します。
Upon PD-1 ICB treatment this population is responsible for the proliferative burst, and thus, MYB could play a central role in therapeutic checkpoint blockade success.
PD-1 ICB 治療により、この集団は増殖性バーストの原因となるため、MYB は治療的チェックポイント遮断の成功において中心的な役割を果たす可能性があります。
Other transcriptions factors found to promote exhaustion are NFAT and NR4A, while BATF attenuates exhaustion.
枯渇を促進することがわかっている他の転写因子は NFAT と NR4A であり、BATF は枯渇を弱めます。
The transcription factor IKZF3 is a repressor of IL-2, and Hay et al. (2022) used an in vitro model to show that exhausted T cells partially can be rescued by treatment with Lenalidomide, an IKZF3 small molecule inhibitor, either as a single treatment or in combination with ICB treatment.
転写因子 IKZF3 は IL-2 のリプレッサーであり、Hay et al (2022) は in vitro モデルを使用して、消耗した T 細胞が IKZF3 小分子阻害剤であるレナリドミドによる治療によって部分的に救出されることを示しました。 単独の治療として、またはICB治療と組み合わせます。
As exhausted T cells display dysregulation in mitochondrial function, strategies for improving mitochondrial biogenesis have raised an interest.
枯渇T 細胞はミトコンドリア機能の調節不全を示すため、ミトコンドリア生合成を改善するための戦略が関心を集めています。
In B16OVA tumor microenvironments, PGC1α overexpressing OT-I T cells, leading to increased mitochondrial mass and OXPHOS, are enriched.
B16OVA 腫瘍微小環境では、ミトコンドリア質量と OXPHOS の増加につながる OT-I T 細胞を過剰発現する PGC1α が濃縮されています。
These cells displayed enhanced tumor efficacy, demonstrating a preservation of T cell function in the TME by reprogramming these cells to favor mitochondrial biogenesis.
これらの細胞は、増強された腫瘍効果を示し、ミトコンドリア生合成を支持するようにこれらの細胞を再プログラミングすることにより、TME における T 細胞機能の保存を示しました。
Metabolic stress, such as hypoxia and glucose deprivation in the TME of solid tumors, have shown to lower tumor immunogenicity.
固形腫瘍の TME における低酸素症やグルコース欠乏などの代謝ストレスは、腫瘍の免疫原性を低下させることが示されています。
To improve responses to ICB, signaling pathways such as the PI3K/AKT pathway, could be targeted to restore tumor cell recognition by T cells.
ICB に対する応答を改善するために、PI3K/AKT 経路などのシグナル伝達経路を標的にして、T 細胞による腫瘍細胞認識を回復させることができます。
Thus, addressing metabolic and signaling pathways hold promising potential to improve immunotherapy responses.
したがって、代謝およびシグナル伝達経路に対処することは、免疫療法の反応を改善する有望な可能性を秘めています。
The posttranscriptional mechanisms regulating exhaustion of T cells remains poorly understood.
T 細胞の枯渇を調節する転写後メカニズムはよくわかっていないままです。
Using Affymetrix miR arrays, the microRNA (miR) expression in isolated LCMV DbGP33–41–specific CD8+ T cells have been examined.
Affymetrix miR アレイを使用して、単離された LCMV DbGP33–41 特異的 CD8+ T 細胞におけるマイクロ RNA (miR) 発現が調べられました。
MiR-29a was identified as an exhaustion attenuating molecule in chronic infection and could also play a role in decreasing exhaustion in cancer.
MiR-29a は、慢性感染症の枯渇軽減分子として同定されており、がんにおける枯渇を軽減する役割も果たしている可能性があります。
Data suggests that miR-29a attenuates TCR signaling pathways involved in driving exhaustion and thus, enhanced expression of miR-29a favor a durable T memory cell-like rather than exhausted T cell-like differentiation in conditions of persistent antigen stimulation.
データは、miR-29a が枯渇の促進に関与する TCR シグナル伝達経路を減衰させ、したがって miR-29a の発現の増強が、持続的な抗原刺激の条件下での枯渇した T 細胞様の分化ではなく、耐久性のある T メモリー細胞様の分化に有利に働くことを示唆しています。
Hence, targeting microRNAs in combination therapies could represent novel solutions for improved immunotherapy efficacy.
したがって、併用療法でマイクロRNAを標的とすることは、免疫療法の有効性を改善するための新しいソリューションとなる可能性があります。
The development and maintenance of exhausted T cells can be controlled by manipulation of molecular pathways, by utilizing methods such as CRISPR gene editing.
枯渇した T 細胞の発生と維持は、CRISPR 遺伝子編集などの方法を利用して分子経路を操作することで制御できます。
Using CRISPR, synthetic DNA sequences can be inserted to generate next-generation autologous T cell therapies, and there is an interest in modifying T cell exhaustion promotors such as Tox for augmented tumor control.
CRISPR を使用すると、合成 DNA 配列を挿入して次世代の自己 T 細胞療法を生成することができ、腫瘍制御を強化するために Tox などの T 細胞枯渇プロモーターを改変することに関心があります。
Other proposed CRISPR targets attracting attention by biotech and pharmaceutical companies are PTPN2, NR4A and c-JUN.
バイオテクノロジー企業や製薬会社の注目を集めている提案されているその他の CRISPR ターゲットは、PTPN2、NR4A、および c-JUN です。
Unlike most molecules and genes of interested currently being targeted to prevent T cell exhaustion, deletion of Ptpn2 has shown to scale up the population of terminally exhausted T cells whilst preserving the population of self-renewable progenitor exhausted T cells.
T細胞の枯渇を防ぐために現在標的にされているほとんどの分子や関心のある遺伝子とは異なり、Ptpn2の削除は、自己再生可能な前駆細胞の枯渇したT細胞の集団を維持しながら、最終的に枯渇したT細胞の集団を拡大することを示しています。
To increase and prolong patient response and survival, bispecific antibodies (BsAbs) have been introduced to the field of immunotherapy.
患者の反応と生存率を高めて延長するために、二重特異性抗体 (BsAbs) が免疫療法の分野に導入されました。
BsAbs can bind two distinct targets on the same cell at the same time, enabling additive effects and novel therapeutic approaches.
BsAb は、同じ細胞上の 2 つの異なる標的に同時に結合できるため、相加効果と新しい治療アプローチが可能になります。
Dual BsAbs targets include immune checkpoints, signaling pathways, tumor associated antigens and cytokines.
デュアル BsAb ターゲットには、免疫チェックポイント、シグナル伝達経路、腫瘍関連抗原、およびサイトカインが含まれます。
OSE Immunotherapeutics have developed a bispecific antibody checkpoint inhibitor BiCKI platform, with the BiCKI-IL-7 program targeting PD-1 and simultaneously releasing IL-7, promoting TCF-1+ stem-like T cell expansion.
OSE Immunotherapeutics は、PD-1 を標的とし、同時に IL-7 を放出して TCF-1+ 幹様 T 細胞の増殖を促進する BiCKI-IL-7 プログラムを備えた、二重特異性抗体チェックポイント阻害剤 BiCKI プラットフォームを開発しました。
In September 2022, Roche announced taking over Good Therapeutics’ PD1-regulated IL-2 receptor agonist program.
2022 年 9 月、Roche は Good Therapeutics の PD1 制御 IL-2 受容体アゴニスト プログラムを引き継ぐことを発表しました。
Similarly to IL-7, IL-2 have potential immunostimulating and antineoplastic functions, but unregulated IL-2 release can cause toxicity.
IL-7 と同様に、IL-2 には潜在的な免疫刺激機能と抗腫瘍機能がありますが、制御されていない IL-2 放出は毒性を引き起こす可能性があります。
Linkage of anti-PD-1 to an alternative form of IL-2 (IL-2v) enables precise IL-2 stimulation, thus minimizing side effects and toxicity.
抗 PD-1 と IL-2 の代替形態 (IL-2v) との結合により、正確な IL-2 刺激が可能になり、副作用と毒性が最小限に抑えられます。
5 Discussion and conclusions
Throughout the cancer-immunity cycle, T cells are subjects of a variety of factors such as prolonged antigen stimulation and altered conditions of the TME, unavoidably shifting the T cells towards an exhausted state.
がん免疫サイクル全体を通して、T 細胞は、長期にわたる抗原刺激や TME の状態の変化などのさまざまな要因の対象となり、T 細胞を枯渇状態に移行させることは避けられません。
Studies discuss the possibility of separate differentiation programs of T cells, one initiating the “classical” effector/memory T cells pathway and the other one initiating an exhaustion program of T cells.
研究では、T 細胞の個別の分化プログラムの可能性が議論されています。1 つは「古典的な」エフェクター/メモリー T 細胞経路を開始し、もう 1 つは T 細胞の枯渇プログラムを開始します。
Insights display the close integration of the cancer-immunity cycle and T cell exhaustion, pointing out the need of a deeper understanding of the T cell exhaustion cycle to enable discovery of novel immunotherapies.
洞察は、がん免疫サイクルと T 細胞枯渇の密接な統合を示しており、新しい免疫療法の発見を可能にするために T 細胞枯渇サイクルをより深く理解する必要があることを指摘しています。
T cell exhaustion has potential benefits, but also consequences.
T細胞の枯渇には潜在的な利点がありますが、帰結もあります。
A stem-like TCF-1+ exhausted T cell state maintain a memory-like population with proliferation capacity.
幹のような TCF-1+ 枯渇した T 細胞の状態は、増殖能力を持つ記憶のような集団を維持します。
Stem-like TCF-1+ T cells giving rise to terminally exhausted cytotoxic T cells could serve as a type of safety mechanism.
幹様 TCF-1+ T 細胞は、最終的に消耗した細胞傷害性 T 細胞を生じさせ、一種の安全メカニズムとして機能する可能性があります。
Excessive antigen density in the TME leading to short-term cytotoxic states restrain cytotoxicity to tumors sites and thus limits immunopathology in healthy tissues.
短期的な細胞傷害状態につながる TME の過剰な抗原密度は、腫瘍部位への細胞傷害を抑制し、健康な組織の免疫病理学を制限します。
Since terminally exhausted T cells have reduced proliferation capacity, the damage caused by this population is limited.
末期に枯渇した T 細胞は増殖能力が低下しているため、この集団によって引き起こされる損傷は限られています。
On the other hand, high cytotoxicity is desired for tumor elimination, and thus short-term cytotoxicity and lacking proliferation capacity simultaneously serves as a liability.
一方で、腫瘍の排除には高い細胞毒性が望まれ、したがって、短期的な細胞毒性と増殖能力の欠如は、同時に責任を負います。
Restricted rounds of proliferation by stem-like exhausted T cells and restricted periods of cytotoxicity creates a time frame of tumor cell clearance.
幹様の枯渇した T 細胞による制限された増殖ラウンドと制限された期間の細胞毒性により、腫瘍細胞クリアランスの時間枠が作成されます。
If events in the exhaustion cycle exceed these time frames, the consequences of T cell exhaustion could result in tumor immune escape, rather than tumor elimination.
枯渇サイクルのイベントがこれらの時間枠を超えると、T 細胞の枯渇の結果として、腫瘍の排除ではなく、腫瘍の免疫逃避が起こる可能性があります。
To fully utilize the potential assets of exhausted T cells in terms of immunotherapies, the master mechanisms and regulators behind T cell exhaustion needs to be further elucidated.
枯渇した T 細胞の潜在的な資産を免疫療法の観点から十分に活用するには、T 細胞の枯渇の背後にある主なメカニズムと調節因子をさらに解明する必要があります。
Nevertheless, it might be useful considering T cell exhaustion as a functional adaptation rather than simply a dysfunction.
それにもかかわらず、T細胞の枯渇を単なる機能不全ではなく機能的適応と考えると、それは有用かもしれません。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
